Zofran Zydis 4 Mg Liofilizado Oral
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
Zofran Zydis 4 mg liofilizado oral Zofran Zydis 8 mg liofilizado oral
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Zofran Zydis 4 mg liofilizado oral:
Cada liofilizado oral contiene 4 mg de ondansetrón.
Excipientes con efecto conocido: cada liofilizado oral contiene 0,625 mg de aspartamo (E951), 0,056 mg de parahidroxibenzoato de metilo, sal de sodio (E219), 0,0069 mg de parahidroxibenzoato de propilo y 0,125 mg de sal de sodio (E217).
Este medicamento contiene 0,1 % de etanol (alcohol), que corresponde con una cantidad de 0,0015 mg de etanol/4 mg de liofilizado oral.
Zofran Zydis 8 mg liofilizado oral:
Cada liofilizado oral contiene 8 mg de ondansetrón.
Excipientes con efecto conocido: cada liofilizado oral contiene 1,25 mg de aspartamo (E951), 0,11 mg de parahidroxibenzoato de metilo, sal de sodio (E219), 0,014 mg de parahidroxibenzoato de propilo y 0,250 mg de sal de sodio (E217).
Este medicamento contiene 0,3 % de etanol (alcohol), que corresponde con una cantidad de 0,003 mg de etanol/8 mg de liofilizado oral.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Liofilizado oral
Zofran Zydis: liofilizado oral, redondo, de color blanco, plano-convexo y de rápida dispersión.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Adultos
Zofran Zydis está indicado en el control de náuseas y vómitos inducidos por quimioterapia y radioterapia citotóxicas, y para la prevención y tratamiento de náuseas y vómitos postoperatorios.
Población pediátrica
Zofran Zydis está indicado en el control de náuseas y vómitos inducidos por quimioterapia en niños a partir de 6 meses.
No se han realizado estudios sobre el uso de ondansetrón administrado por vía oral en la prevención y tratamiento de náuseas y vómitos postoperatorios. Se recomienda utilizar Zofran (ondansetrón) inyectable en el tratamiento de náuseas y vómitos postoperatorios, en niños a partir de 1 mes de edad.
3E
4.2 Posología y forma de administración
4.2.1 Posología
Zofran Zydis liofilizado oral se administra por vía oral.
Náuseas y vómitos inducidos por quimioterapia y radioterapia (CINV y RINV)
El potencial emetógeno del tratamiento del cáncer, varía de acuerdo con las dosis y combinaciones de los regímenes quimioterápicos y radioterápicos usados. La elección de la pauta posológica debe ser determinado por la gravedad de la emesis.
Adultos
Quimioterapia y radioterapia emetógenas
Se recomienda administrar una dosis de 8 mg por vía oral, 1-2 horas antes del tratamiento con quimioterapia o radioterapia, seguida de 8 mg administrados por vía oral cada 12 horas durante un periodo máximo de 5 días.
Cuando se emplea quimioterapia altamente emetógena, se puede emplear una única dosis de 24 mg de ondansetrón administrada por vía oral junto con 12 mg de dexametasona sódica fosfato por vía oral, una o dos horas antes de la quimioterapia.
Después de las primeras 24 horas, se puede continuar administrando Zofran por vía oral, 8 mg dos veces al día, durante 5 días después de un ciclo de tratamiento.
Población pediátrica
Náuseas y vómitos inducidos por quimioterapia en niños > 6 meses y adolescentes
La dosis para las náuseas y vómitos inducidos por quimioterapia puede calcularse en base a la superficie corporal o al peso - ver a continuación. Si la dosis se calcula en base al peso, los resultados en la dosis total diaria son mayores que si se calcula en base a la superficie corporal (ver secciones 4.4 y 5.1).
No hay datos de ensayos clínicos controlados del uso de ondansetrón en la prevención de las náuseas y vómitos retardados o prolongados inducidos por quimioterapia. No hay datos de ensayos clínicos controlados sobre el uso de ondansetrón para náuseas y vómitos inducidos por radioterapia en niños.
Cálculo de dosis por superficie corporal:
Zofran debe administrarse inmediatamente antes de la quimioterapia como una dosis única intravenosa de 5 mg/m2. La dosis intravenosa no debe exceder de 8 mg.
La dosis oral puede comenzar 12 horas más tarde y puede continuarse hasta 5 días (ver a continuación Tabla 1). La dosis diaria total no debe exceder la dosis de adultos de 32 mg.
Tabla 1: Dosis por superficie corporal, para las náuseas y vómitos inducidos por quimioterapia - Niños > 6 meses y adolescentes
|
Superficie corporal |
Día 1(a b) |
Días 2-6(b) |
|
< 0,6 m2 |
5 mg/m2 vía intravenosa más 2 mg vía oral después de 12 horas |
2 mg vía oral cada 12 horas(c) |
|
> 0,6 m2 |
5 mg/m2 vía intravenosa más 4 mg vía oral después de 12 horas |
4 mg vía oral, cada 12 horas(c) |
a. La dosis intravenosa no debe exceder de 8 mg.
b. La dosis diaria total no debe exceder la dosis de adultos de 32 mg.
c. La dosis de 2 mg no puede obtenerse con los comprimidos de 4 mg ya que estos no han sido fabricados para romperse en dos comprimidos iguales.
Cálculo de dosis por peso corporal:
Si la dosis se calcula en base al peso, los resultados en la dosis total diaria son mayores que si se calcula en base a la superficie corporal (ver secciones 4.4 y 5.1).
Zofran debe administrarse inmediatamente antes de la quimioterapia como una dosis intravenosa única de 0,15 mg/kg. La dosis intravenosa no debe exceder de 8 mg.
Deben administrarse dos dosis intravenosas adicionales a intervalos de 4 horas. La dosis diaria total no debe exceder la dosis de adultos de 32 mg.
La dosis oral puede comenzar 12 horas después y puede continuarse hasta 5 días (ver a continuación la Tabla 2).
Tabla 2: Dosis por peso, para las náuseas y vómitos inducidos por quimioterapia (Niños > 6 meses y adolescentes)
|
Peso |
Día 1(a b) |
Días 2-6(b) |
|
< 10 kg |
Hasta 3 dosis de 0,15 mg/kg IV cada 4 horas |
2 mg vía oral cada 12 horas(c) |
|
10 kg |
Hasta 3 dosis de 0,15 mg/kg IV cada 4 horas |
4 mg vía oral cada 12 horas(c) |
a. La dosis intravenosa no debe exceder de 8 mg.
b. La dosis diaria total no debe exceder la dosis de adultos de 32 mg.
c. La dosis de 2 mg no puede obtenerse con los comprimidos de 4 mg ya que estos no han sido fabricados para romperse en dos comprimidos iguales.
Pacientes de edad avanzada
No se requiere realizar modificaciones de la dosis administrada por vía oral ni de la frecuencia de administración.
Pacientes con insuficiencia renal
No se requiere variar la dosis diaria, frecuencia de dosis o vía de administración.
Pacientes con insuficiencia hepática
El aclaramiento de ondansetrón está significativamente reducido y la semivida sérica significativamente prolongada en sujetos con disfunción moderada o grave de la función hepática. En tales pacientes no deberá excederse una dosis diaria total de 8 mg por vía intravenosa u oral.
Pacientes metabolizadores lentos de esparteína/debrisoquina
La semivida de eliminación de ondansetrón no se ve alterada en personas calificadas como metabolizadores lentos de esparteína y debrisoquina. Por consiguiente, los niveles de exposición al fármaco tras administración repetida en estos pacientes no difieren de los alcanzados en la población general. No se requiere, pues, modificar la dosis diaria o la frecuencia de administración.
Náuseas y vómitos postoperatorios (NVPO)
Adultos
Para la prevención de náuseas y vómitos postoperatorios, la dosis oral recomendada es de 16 mg administrados una hora antes de la anestesia.
Para el tratamiento de náuseas y vómitos postoperatorios establecidos se recomienda la administración de ondansetron inyectable (ver ficha técnica de Zofran solución inyectable).
Población pediátrica
Náuseas y vómitos _postoperatorios en niños > 1 mes y adolescentes
No se han realizado estudios sobre el uso de ondansetrón administrado por vía oral para la prevención o el tratamiento de náuseas y vómitos postoperatorios; se recomienda una inyección lenta por vía intravenosa (ver ficha técnica de Zofran solución inyectable).
No hay datos del uso de ondansetrón en el tratamiento de náuseas y vómitos postoperatorios en niños menores de 2 años.
Pacientes de edad avanzada
Hay poca experiencia en el uso de ondansetrón en la prevención y tratamiento de náuseas y vómitos postoperatorios en ancianos; no obstante, ondansetrón ha sido bien tolerado en pacientes de más de 65 años que reciben tratamiento quimioterápico.
Pacientes con insuficiencia renal
No se requiere variar la dosis diaria, frecuencia de dosis o vía de administración.
Pacientes con insuficiencia hepática
El aclaramiento de ondansetrón está significativamente reducido y la semivida sérica significativamente prolongada en sujetos con disfunción moderada o grave de la función hepática. En tales pacientes no deberá excederse una dosis diaria total de 8 mg por vía intravenosa u oral.
Pacientes metabolizadores lentos de esparteína/debrisoquina
La semivida de eliminación de ondansetrón no se ve alterada en personas calificadas como metabolizadores lentos de esparteína y debrisoquina. Por consiguiente, los niveles de exposición al fármaco tras administración repetida en estos pacientes no difieren de los alcanzados en la población general. No se requiere, pues, modificar la dosis diaria o la frecuencia de administración.
4.2.2 Forma de administración
Los liofilizados se colocan sobre la parte superior de la lengua. Para más información ver sección 6.6
4.3 Contraindicaciones
Hipersensibilidad a ondansetrón o a cualquier otro antagonista de los receptores 5HT3 (por ej.: granisetrón, dolasetrón) o a alguno de los excipientes.
En base a las notificaciones de hipotensión profunda y pérdida del conocimiento cuando se administró ondansetrón junto con apomorfina hidrocloruro, el uso concomitante de ondansetrón y apomorfina está contraindicado
4.4 Advertencias y precauciones especiales de empleo
Se han notificado reacciones de hipersensibilidad en pacientes que han presentado hipersensibilidad a otros antagonistas selectivos de los receptores 5TH3.
Los acontecimientos respiratorios deben tratarse sintomáticamente y los médicos deben poner especial atención en los mismos, como precursores de reacciones de hipersensibilidad.
Ondansetrón prolonga el intervalo QT de manera dosis dependiente (ver sección 5.1). Por otro lado, se han notificado casos postcomercialización de Torsade de Pointes en pacientes que tomaron ondansetrón. Se debe evitar la administración de ondansetrón en pacientes con síndrome de QT largo congénito. Ondansetrón debe ser administrado con precaución en pacientes que tienen o pueden desarrollar prolongación del intervalo QTc, incluyendo pacientes con alteraciones electrolíticas, fallo cardiaco congestivo, bradiarritmias o pacientes que estén tomando otros fármacos que provoquen prolongación del intervalo QT o alteraciones electrolíticas.
Se debe corregir la hipocalemia y la hipomagnesemia antes de la administración de ondansetrón.
Se han descrito casos de síndrome serotoninérgico tras la administración concomitante de ondansetrón con otros medicamentos serotoninérgicos (ver sección 4.5). Si el tratamiento concomitante de ondansetrón con medicamentos serotoninérgicos está justificado clínicamente, se recomienda monitorizar a los pacientes.
Como se sabe que ondansetrón aumenta el tiempo de tránsito en el intestino grueso, se vigilará a los pacientes con signos de obstrucción intestinal subaguda después de su administración.
ítp.
m
En pacientes que se han sometido a una adenoamigdalectomía, la prevención de náuseas y vómitos con ondansetrón podría enmascarar una hemorragia oculta. Por ello, dichos pacientes deben ser monitorizados con cuidado tras recibir ondansetrón.
4.4.1 Población pediátrica
Los pacientes pediátricos que reciben ondansetrón junto con quimioterapia hepatotóxica, deben ser vigilados para controlar cualquier alteración de la función hepática.
Vómitos y nauseas inducidas por quimioterapia: Cuando se calcula la dosis en mg/kg de peso corporal y se administran tres dosis a intervalos de 4 horas, la dosis diaria total será más alta que si se administra una dosis única de 5 mg/m2 seguida de una dosis oral. No se ha investigado en ensayos clínicos la eficacia comparativa de estos dos regímenes posológicos. La comparación entre ensayos indica una eficacia similar de ambos regímenes - ver sección 5.1.
Información importante sobre algunos de los excipientes de este medicamento.
La formulación de Zofran Zydis contiene aspartamao. Zofran Zydis puede ser perjudicial para personas con fenilcetonuria porque contiene aspartamo que es una fuente de fenilalanina.
Zofran Zydis puede producir reacciones alérgicas (posiblemente retardadas) porque contiene parahidroxibenzoato de propilo, sal de sodio (E217).
Zofran Zydis puede producir reacciones alérgicas (posiblemente retardadas) y, excepcionalmente broncoespamo porque contiene parahidroxibenzoato de metilo, sal de sodio (E-219).
Este medicamento contiene menos de 1 mmol (23 mg) de sodio por dosis, por lo que se considera esencialmente “exento de sodio”.
4.5 Interacción con otros medicamentos y otras formas de interacción
No hay evidencia alguna de que ondansetrón induzca o inhiba el metabolismo de otros fármacos con los que comúnmente se coadministra. Estudios específicos señalan que no existe interacción cuando ondansetrón es administrado con alcohol, temazepam, furosemida, alfentanilo, tramadol, morfina, lidocaína, tiopental o propofol.
Ondansetrón es metabolizado por múltiples enzimas hepáticos del citocromo P-450: CYP3A4, CYP2D6 y CYP1A2. Debido a la gran cantidad de enzimas metabólicas capaces de metabolizar ondansetrón, la inhibición o actividad reducida de un enzima (por ejemplo, la deficiencia genética de CYP2D6) es normalmente compensada por otras enzimas y debe dar como resultado un cambio pequeño o no significativo en el aclaramiento global de ondansetrón o en los requisitos de dosificación.
Se debe tener precaución cuando se coadministra ondansetrón con fármacos que prolongan el intervalo QT y/o fármacos que causan alteraciones electrolíticas (ver sección 4.4).
Apomorfma
En base a las notificaciones de hipotensión profunda y pérdida del conocimiento cuando se administró ondansetrón junto con apomorfma hidrocloruro, el uso concomitante de ondansetrón y apomorfina está contraindicado.
Fenitoina, carbamazepina y rifampicina
A. i *4
on
En aquellos pacientes tratados con potentes inductores del CYP3A4 (por ejemplo, fenitoina, carbamazepina y rifampicina) el aclaramiento oral de ondansetrón fue incrementado y las concentraciones plasmáticas reducidas.
Medicamentos serotoninérgicos (ISRS, ISRSN)
Se han descrito casos de síndrome serotoninérgico (incluyendo alteración del estado mental, inestabilidad autonómica y anomalías neuromusculares) tras la administración concomitante de ondansetrón con otros medicamentos serotoninérgicos, entre los que se incluyen inhibidores selectivos de la recaptación de serotonina (ISRS) e inhibidores de la recaptación de serotonina y noradrenalina (ISRSN) (ver sección 4.4).
Tramado!
Los datos de pequeños estudios indican que ondansetrón puede reducir el efecto analgésico de tramadol.
El uso de ondansetrón con fármacos que prolongan el intervalo QT puede provocar una prolongación adicional del intervalo QT. El uso concomitante de ondansetrón con fármacos cardiotóxicos (por ej. antraciclinas) puede aumentar el riesgo de arritmias (ver secciones 4.4 y 4.8).
4.6 Fertilidad, embarazo y lactancia
4.6.1 Embarazo
No se ha determinado la seguridad del uso de ondansetrón en el embarazo humano. La evaluación de los estudios experimentales realizados con animales no señala efectos perjudiciales directos o indirectos con respecto al desarrollo del embrión, o para el feto, el ciclo de gestación y el desarrollo peri- y postnatal. No obstante, como los estudios realizados con animales no siempre predicen la respuesta en humanos, no se recomienda la administración de ondansetrón durante el embarazo.
4.6.2 Lactancia
Se ha demostrado que ondansetrón pasa a la leche en animales en periodo de lactancia. Se recomienda, por tanto, que las madres en periodo de lactancia no amamanten a sus niños si están tomando ondansetrón.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
Ondansetrón no afecta las funciones psicomotrices ni causa sedación. No se esperan efectos perjudiciales en estas actividades como consecuencia de la farmacología de ondansetrón.
4.8 Reacciones adversas
Las reacciones adversas descritas a continuación se han clasificado por órgano, sistemas y frecuencias. Las frecuencias se han definido de la siguiente forma: muy frecuentes (>1/10), frecuentes (>1/100 a <1/10), poco frecuentes (>1/1.000 a <1/100), raras (>1/10.000 a <1/1.000), muy raras (<1/10.000), incluyendo notificaciones aisladas.
Se han utilizado datos de ensayos clínicos para determinar la frecuencia de las reacciones adversas clasificadas de muy frecuentes a poco frecuentes. Se tuvo en cuenta la incidencia en pacientes tratados con placebo. Las reacciones adversas clasificadas como raras y muy raras se determinaron generalmente a partir de datos post-comercialización.
Las siguientes frecuencias se determinan a las dosis recomendadas estándar de ondansetrón, de acuerdo con la indicación y formulación.
Trastornos del sistema inmunológico
Raras:
reacciones de hipersensibilidad inmediata, algunas veces graves, incluyendo anafilaxia.
Puede producir sensibilidad cruzada con otros antagonistas selectivos 5-HT3.
Muy frecuentes:
Poco frecuentes:
Raras:
Trastornos oculares
Raras:
Muy raras:
Trastornos cardíacos
Poco frecuentes: Raras:
cefalea.
convulsiones, trastornos del movimiento (incluyendo reacciones extrapiramidales
como reacciones distónicas, crisis oculógiras y discinesia)(1)
vértigo, de manera predominante durante la administración intravenosa rápida
alteraciones visuales transitorias (por ej. visión borrosa) principalmente durante la administración intravenosa.
ceguera transitoria, principalmente durante la administración intravenosa(2).
arritmias, dolor torácico con o sin depresión del segmento ST, bradicardia. prolongación del intervalo QTc (incluyendo Torsade de Pointes).
Frecuentes: sensación de enrojecimiento o calor.
Poco frecuentes: hipotensión.
Trastornos respiratorios, torácicos y mediastínicos
Poco frecuentes: hipo.
Trastornos gastrointestinales
Frecuentes: estreñimiento.
Trastornos hepatobiliares
Poco frecuentes: aumentos asintomáticos en las pruebas de función hepática(3).
Trastornos de la piel y del tejido subcutáneo
Muy raros: erupción cutánea tóxica, incluyendo necrolisis epidérmica tóxica
(1) Observado sin que hubiera evidencia concluyente de secuelas clínicas persistentes.
(2) La mayoría de los casos de los casos de ceguera notificados se resolvieron en 20 minutos. La mayoría de los pacientes habían recibido agentes quimioterápicos, que incluían cisplatino. Algunos de los casos de ceguera transitoria fueron notificados como de origen cortical.
(3) Estas reacciones se observaron frecuentemente en pacientes que reciben quimioterapia con cisplatino.
4.8.1 Población pediátrica
El perfil de acontecimientos adversos en niños y adolescentes fue comparable al observado en adultos. Notificación de sospechas de reacciones adversas
Es importante notificar las sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: www.notificaRAM.es.
4.9 Sobredosis
Síntomas y signos
Poco se sabe actualmente acerca de la sobredosificación con ondansetrón; sin embargo, un número limitado de pacientes han recibido sobredosis. Las manifestaciones de sobredosificación que se han notificado incluyen alteraciones visuales, estreñimiento grave, hipotensión (y desfallecimiento) y un episodio vasovagal con bloqueo auriculoventricular de segundo grado transitorio. En todos los casos, los acontecimientos se resolvieron completamente.
Ondansetrón prolonga el intervalo QT de forma dosis dependiente. En caso de sobredosis, se recomienda realizar un seguimiento del electrocardiograma.
Población pediátrica
Se han notificado casos en niños con síndrome de serotonina tras una sobredosis accidental oral de ondansetrón (ingestión en exceso estimada de 4 mg/kg) en lactantes y niños de 12 meses a 2 años.
Tratamiento
No hay un antídoto específico para ondansetrón, por consiguiente, en caso de sospecha de sobredosificación, se proporcionará el tratamiento sintomático y de soporte que resulte apropiado.
El control adicional debe seguir las recomendaciones clínicas indicadas o las recomendaciones del Instituto Nacional de Toxicología, si estuvieran disponibles.
No se recomienda la administración de ipecacuana para tratar la sobredosis con ondansetrón ya que no es probable que los pacientes respondan, debido a la acción antiemética de Zofran.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Antieméticos y antinauseosos - Antagonistas de receptores de serotonina (5-HT3). Código ATC: A04AA01.
5.1.1 Mecanismo de acción
Zofran (ondansetrón), es un antagonista potente y altamente selectivo de los receptores 5HT3. No se conoce el modo exacto de acción en el control de las náuseas y vómitos.
Los agentes quimioterápicos y la radioterapia pueden causar liberación de 5HT en el intestino delgado, iniciando el reflejo del vómito al activarse los receptores 5HT3 de las vías aferentes vagales. Ondansetrón bloquea el inicio de este reflejo.
La activación de las vías aferentes vagales puede causar también una liberación de 5HT en el área postrema, situada sobre el suelo del cuarto ventrículo, pudiendo esto también promover emesis a través de un mecanismo central. Así, el efecto de ondansetrón en el control de náuseas y vómitos inducidos por radioterapia y quimioterapia citotóxicas se debe probablemente al antagonismo de los receptores 5HT3 sobre las neuronas situadas tanto en el Sistema Nervioso Central como en el Periférico.
No se conocen los mecanismos de acción de ondansetrón en náuseas y vómitos postoperatorios, pero es posible que haya vías comunes con los vómitos y náuseas inducidos por agentes citotóxicos.
5.1.2 Efectos farmacodinámicos
Ondansetrón no altera las concentraciones de prolactina plasmática.
Prolongación del intervalo QT
El efecto de ondansetrón en el intervalo QTc se ha evaluado en un estudio doble ciego, aleatorizado, cruzado y controlado con placebo y control positivo (moxifloxacino) en 58 adultos sanos, hombres y mujeres. Las dosis de ondansetrón incluyeron 8 mg y 32 mg administrados mediante infusión intravenosa durante 15 minutos. Para la dosis más alta estudiada de 32 mg, la diferencia media máxima (límite superior del IC del 90 %) en QTcF respecto a placebo después de la corrección basal fue de 19,6 (21,5) mseg. Para la dosis más baja estudiada de 8 mg, la diferencia media máxima (límite superior del IC del 90 %) en QTcF respecto a placebo después de la corrección basal fue de 5,8 (7,8) mseg. En este estudio no hubo medidas de QTcF mayores de 480 mseg y las prolongaciones de QTcF no fueron superiores a 60 mseg. No se observaron cambios significativos en las medidas electrocardiografías en PR o en los intervalos QRS.
5.1.4 Población pediátrica
Náuseas y vómitos inducidos por quimioterapia
En un ensayo doble ciego, aleatorizado, en 415 pacientes entre 1 y 18 años (S3AB3006) se evaluó la eficacia de ondansetrón en el control de emesis y náuseas inducidos por quimioterapia. En los días de la quimioterapia los pacientes recibieron 5 mg/m2 de ondansetrón por vía intravenosa más 4 mg de ondansetrón por vía oral tras 8-12 horas u 0,45 mg/kg de ondansetrón por vía intravenosa más placebo administrado por vía oral 8-12 horas después. Tras la quimioterapia ambos grupos recibieron 4 mg de ondansetrón por vía oral, dos veces al día durante 3 días. El control completo de la emesis en el peor día de la quimioterapia fue del 49% (5 mg/m2 intravenoso + ondansetrón 4 mg oral) y 41% (0,45 mg/kg intravenoso + placebo oral). Tras la administración de la quimioterapia ambos grupos recibieron 4 mg de ondansetrón por vía oral dos veces al día durante 3 días.
Un ensayo clínico doble-ciego, aleatorizado y controlado por placebo (S3AB4003), en 438 pacientes de entre 1 y 17 años, demostró control completo de la emesis en el peor día de la quimioterapia en:
• 73% de los pacientes que recibieron ondansetrón intravenoso a una dosis de 5 mg/m2, junto con 2
4 mg de dexametasona oral.
10 de 16 MINIST«ODE
SANIDAD, POLITICA SOCIALE IGUALDAD Agencia esparto» de medie amentos y Ofoouctos saltaros
• 71% de los pacientes que recibieron ondansetrón por vía oral a una dosis de 8 mg + 2-4 mg de
dexametasona oral en los días de quimioterapia.
Tras la quimioterapia, ambos grupos recibieron 4 mg de ondansetrón por vía oral dos veces al día durante 2 días. No hubo diferencias en la incidencia o naturaleza de las reacciones adversas entre los dos grupos de tratamiento.
Se evaluó la eficacia de ondansetrón en 75 niños de edades entre 6 y 48 meses en un ensayo abierto, no comparativo, de un solo brazo (S3A40320). Todos los niños recibieron tres dosis intravenosas de 0,15 mg/kg de ondansetrón, administrado 30 minutos antes de comenzar el tratamiento con quimioterapia y a las 4 horas y 8 horas después de la primera dosis. Se alcanzó el control total de la emesis en el 56% de los pacientes.
En otro ensayo clínico abierto, no comparativo, de un solo brazo (S3A239) se evaluó la eficacia de una dosis intravenosa de 0,15 mg/kg de ondansetron seguida de dos dosis orales de 4 mg de ondansetron para niños menores de 12 años y 8 mg para niños > 12 años (número total de niños n=28). El control total de la emesis se alcanzó en el 42% de los pacientes.
Nauseas y vómitos postoperatorios
Se evaluó la eficacia de una dosis única de ondansetrón en la prevención de náuseas y vómitos postoperatorios en un ensayo aleatorizado, doble ciego, controlado por placebo, en 670 niños de edades entre 1 y 24 meses (edad post-fecundación >44 semanas, peso >3 kg). Los pacientes incluidos estaban programados para ser sometidos a cirugía bajo anestesia general y tenían un estado <III según la clasificación ASA (American Society of Anesthesiologists). Se administró una dosis única de 0,1 mg/kg de ondansetrón en los cinco minutos siguientes a la inducción de la anestesia. La proporción de pacientes que experimentó al menos un episodio de vómitos durante el periodo de evaluación de 24 horas (ITT) fue mayor en el grupo de pacientes con placebo que para los pacientes que recibieron ondansetron (28% vs.
11%; p<0,0001).
Se han realizado cuatro estudios doble-ciego, controlados por placebo en 1.469 pacientes, (niños y niñas de 2 a 12 años) sometidos a anestesia general. Los pacientes fueron aleatorizados a una dosis única de ondansetrón por vía intravenosa (0,1 mg/kg en pacientes pediátricos de 40 kg de peso o menos; 4 mg en pacientes pediátricos de más de 40 kg de peso; número de pacientes=735) o a placebo (número de pacientes=734). El fármaco de estudio se administró durante al menos 30 segundos, inmediatamente antes o tras la inducción de la anestesia. Ondansetrón fue significativamente más eficaz en la prevención de náuseas y vómitos que el placebo. Los resultados de estos estudios se resumen en la Tabla 3.
Tabla 3. Prevención y tratamiento de NVPO en pacientes pediátricos -Respuesta al tratamiento a las 24 horas
|
Estudio |
Variable |
Ondansetrón (%) |
Placebo (%) |
Valor de p |
|
S3A380 |
RC |
68 |
39 |
<0,001 |
|
S3GT09 |
RC |
61 |
35 |
<0,001 |
|
S3A381 |
RC |
53 |
17 |
<0,001 |
|
S3GT11 |
no náusea |
64 |
51 |
0,004 |
|
S3GT11 |
no emesis |
60 |
47 |
0,004 |
RC = Respuesta completa (no episodios eméticos, rescate o retirada)
5.2 Propiedades farmacocinéticas
5.2.1 Absorción
Tras la administración por vía oral, ondansetrón se absorbe pasiva y completamente desde el tracto gastrointestinal, sufriendo metabolismo de primer paso. Las concentraciones plasmáticas máximas se alcanzan aproximadamente a las 1,5 horas de la administración de la dosis. Con respecto a dosis superiores a 8 mg, el incremento que se produce en la exposición sistémica del ondansetrón con relación a la dosis supera la proporcionalidad; esto puede reflejar una cierta reducción en el metabolismo de primer paso al administrarse dosis orales más altas.
La biodisponibilidad media en hombres sanos, tras la administración de un comprimido de 8 mg, es aproximadamente del 55% al 60%.
La biodisponibilidad se ve ligeramente potenciada por la presencia de alimentos pero no así por los antiácidos.
5.2.2 Distribución
La disposición de ondansetrón después de ser administrado por vías oral, intramuscular e intravenosa es similar, con una semivida de eliminación de unas 3 horas y un volumen de distribución en equilibrio de unos 140 litros. La exposición sistémica alcanzada tras la administración de ondansetrón por las vías intramuscular e intravenosa es equivalente. Ondansetrón no se une en gran proporción a proteínas plasmáticas (70-76%).
5.2.4 Eliminación
Ondansetrón se elimina de la circulación sistémica predominantemente por metabolismo hepático a través de múltiples rutas enzimáticas. Menos del 5% de la dosis absorbida se excreta en la orina en forma inalterada. La ausencia de la enzima CYP2D6 (polimorfismo de debrisoquina) no tiene efecto alguno sobre la farmacocinética de ondansetrón. Las propiedades farmacocinéticas de ondansetrón no se ven alteradas con la administración repetida.
Niños y adolescentes (de 1 mes a 17 años)
En pacientes pediátricos con edades comprendidas entre 1 y 4 meses (n=19) sometidos a una intervención quirúrgica, el aclaramiento normalizado a su peso fue aproximadamente un 30% más lento que en pacientes entre 5 y 24 meses (n= 22) pero comparable a los pacientes de 3 a 12 años. La semivida que se comunicó en la población de pacientes de 1 a 4 meses fue de una media de 6,7 horas, comparada con 2,9 horas en pacientes de 5 a 24 meses y de 3 a 12 años. Las diferencias en los parámetros farmacocinéticos en la población de pacientes de 1 a 4 meses pueden explicarse en parte por el mayor porcentaje de agua corporal total en neonatos y lactantes y un mayor volumen de distribución para fármacos solubles en agua, como ondansetrón.
En pacientes pediátricos con edades comprendidas entre los 3 y 12 años y sometidos a una intervención quirúrgica electiva con anestesia general, se redujeron los valores absolutos del aclaramiento y del volumen de distribución de ondansetrón, en comparación con los valores de pacientes adultos. Ambos parámetros aumentaron siguiendo una moda lineal con el peso y hasta los 12 años de edad, los valores se fueron aproximando a los de adultos jóvenes. Cuando los valores de aclaramiento y volumen de distribución se normalizaron por peso corporal, los valores de estos parámetros fueron similares entre los diferentes grupos
de edad. El empleo de una dosis en función del peso compensa estos cambios relacionados con la edad y resulta eficaz en la normalización de la exposición sistémica en pacientes pediátricos.
Se realizó un análisis farmacocinético de la población tras la administración intravenosa de ondansetrón en 428 personas (pacientes con cáncer, pacientes sometidos a cirugía y voluntarios sanos) de edades comprendidas entre 1 mes y 44 años. Basándose en este análisis, la exposición sistémica (AUC) de ondansetrón tras la administración oral o intravenosa en niños y adolescentes fue comparable a la de adultos, con la excepción de lactantes de 1 a 4 meses. El volumen de distribución se relacionó con la edad y fue menor en adultos que en lactantes y niños. El aclaramiento se relacionó con el peso pero no con la edad, a excepción de lactantes de 1 a 4 meses. Es difícil concluir si hubo una reducción adicional en el aclaramiento relacionado con la edad en lactantes de 1 a 4 meses o simplemente es inherente a la variabilidad debida al bajo número de personas estudiadas en este grupo de edad. Debido a que los pacientes menores de 6 meses sólo recibirán una dosis única en náuseas y vómitos postoperatorios, no se espera que un aclaramiento disminuido sea clínicamente relevante.
Pacientes de edad avanzada
En estudios Fase I llevados a cabo con voluntarios sanos de edad avanzada, se han observado ligeros descensos en el aclaramiento, y un incremento en la semivida de eliminación de ondansetrón. Sin embargo, a pesar de la amplia variabilidad entre los sujetos, el resultado observado fue un solapamiento considerable de los parámetros farmacocinéticos entre sujetos jóvenes (<65 años) y sujetos de edad avanzada (>65 años), y no hubo diferencias globales en la eficacia y seguridad observada entre pacientes jóvenes y pacientes de edad avanzada con cáncer que fueron incluidos en los ensayos clínicos de CINV, que apoyen la recomendación del uso de diferentes dosis en pacientes de edad avanzada.
En base a datos más recientes sobre las concentraciones plasmáticas de ondansetrón y datos sobre modelos de respuesta a la exposición al fármaco, en pacientes >75 años se espera un mayor efecto sobre el intervalo QTc, en comparación con adultos jóvenes. Existe información específica sobre la pauta posológica de administración intravenosa, en pacientes mayores de 65 años y también para pacientes mayores de 75 años (ver ficha técnica de Zofran solución inyectable, sección 4.2- Náuseas y vómitos inducidos por quimioterapia y radioterapia- pacientes de edad avanzada).
Género
La disposición de ondansetrón varía en función del sexo, de manera que en mujeres es mayor la tasa y velocidad de absorción por vía oral y están reducidos el aclaramiento sistémico y el volumen de distribución (ajustado al peso).
Pacientes con insuficiencia renal
En pacientes con insuficiencia renal moderada (aclaramiento de creatinina 15 - 60 ml/min), tanto el aclaramiento sistémico como el volumen de distribución están reducidos, causando un ligero, aunque clínicamente poco significativo, aumento de la semivida de eliminación (5,4 horas). Un estudio llevado a cabo en pacientes con insuficiencia renal grave sometidos regularmente a hemodiálisis (evaluados en el periodo entre diálisis), mostró que la farmacocinética de ondansetrón era esencialmente la misma tras la administración intravenosa.
Pacientes con insuficiencia hepática
En pacientes con insuficiencia hepática grave, el aclaramiento sistémico de ondansetrón se ve notablemente reducido, con aumento de las semividas de eliminación (15-32 horas) y una biodisponibilidad por vía oral cercana al 100% a causa del reducido metabolismo presistémico.
5.3 Datos preclínicos sobre seguridad
El programa de experimentación toxicológica en rata, conejo y perro anticipó la seguridad de ondansetrón a las dosis utilizadas en los estudios clínicos. Este programa sólo ha encontrado toxicidad significativa en el Sistema Nervioso Central a dosis cercanas a las letales del fármaco, lo cual no se asoció con ningún cambio histopatológico. No se ha identificado ninguna otra toxicidad en órganos diana. Los cambios menores observados en los enzimas plasmáticos no se asociaron con patologías específicas en ningún tejido. Similarmente, ondansetrón no mostró genotoxicidad en un amplio rango de ensayos y tampoco es teratogénico ni oncogénico.
Como sucede con otros muchos fármacos de naturaleza básica, ondansetrón se fija reversiblemente a los tejidos que contienen melanina. Sin embargo, no se asoció este fenómeno con toxicidad en las especies examinadas. Ondansetrón y sus metabolitos cruzan la barrera hematoencefálica sólo en pequeña cantidad. Los estudios de transferencia placentaria en rata y conejo indican que el feto está expuesto a niveles bajos de productos asociados al fármaco durante el embarazo.
No se ha encontrado abuso potencial o riesgo de dependencia en animales.
En un estudio con canales iónicos cardíacos humanos clonados, se ha observado que ondansetrón a concentraciones clínicamente relevantes, puede afectar a la repolarización cardíaca por medio del bloqueo de los canales de potasio HERG. En un estudio sobre el intervalo QT en voluntarios sanos, se observó que ondansetrón prolonga el intervalo QT de manera dosis dependiente (ver sección 5.1 Prolongación del intervalo QT).
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Gelatina Manitol (E421)
Aspartamo (E951)
Parahidroxibenzoato de metilo, sal de sodio (E219)
Parahidroxibenzoato de propilo, sal de sodio (E217)
Sabor fresa IFF 17.C5.6217*.
* el sabor fresa tiene la siguiente composición: sustancias aromatizantes artificiales, sustancias aromatizantes naturales, sustancias aromatizantes idénticas a naturales, propilenglicol (E1520).
6.2 Incompatibilidades
No se han descrito.
6.3 Periodo de validez
]£
6.4 Precauciones especiales de conservación
No debe conservarse a temperaturas superiores a 30°C.
6.5 Naturaleza y contenido del envase
Zofran Zydis va envasado en embalaje alveolar (blíster) doble de aluminio. Se presenta en envases conteniendo 10 unidades de liofilizado oral.
6.6 Precauciones especiales de eliminación <y otras manipulaciones>
SEPARAR la lámina de aluminio de un alvéolo y sacar CUIDADOSAMENTE la unidad liofilizada oral de Zofran Zydis.
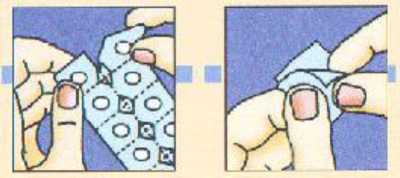
NO intentar sacar las unidades liofilizadas orales de Zofran Zydis rompiendo la lámina de aluminio.
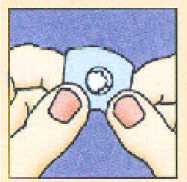
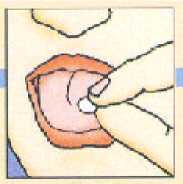
Colocar la unidad liofilizada oral en la parte superior de la lengua donde se dispersará en segundos y después tragar de la forma habitual.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Novartis Farmacéutica, S.A.
Gran Via de les Corts Catalanes, 764 08013 Barcelona
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
¡m
MI MISTERIO DE )E SANIDAD.POLITICA LITIGA SOCIAL E IGUALDAD IALDAD Agencia esparto» de cSacse-medicamentos y ¡y Cfoouctos san-íanos taws
Zofran Zydis 4 mg liofilizado oral - n0reg: 62.944 Zofran Zydis 8 mg liofilizado oral - n°reg: 62.945
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Febrero 2000
10. FECHA DE LA REVISIÓN DEL TEXTO
Febrero 2016
16 de 16