Zavesca 100 Mg, Capsulas Duras
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
1. NOMBRE DEL MEDICAMENTO
Zavesca 100 mg cápsulas duras
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada cápsula contiene 100 mg de miglustat.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Cápsula dura.
Las cápsulas son de color blanco, llevan impreso “OGT 918” en negro en la tapa y “100” en negro en el cuerpo de la cápsula.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Zavesca está indicado en el tratamiento oral de pacientes adultos con la enfermedad de Gaucher tipo 1 leve o moderada. Zavesca se utilizará únicamente en aquellos casos en los que no sea adecuado el tratamiento enzimático sustitutivo (ver secciones 4.4 y 5.1).
Zavesca está indicado para el tratamiento de las manifestaciones neurológicas progresivas en pacientes adultos y pacientes pediátricos con enfermedad de Niemann-Pick C (ver secciones 4.4 y 5.1).
4.2 Posología y forma de administración
El tratamiento debe ser dirigido por un médico con conocimientos sobre el tratamiento de la enfermedad de Gaucher o de la enfermedad de Niemann-Pick C, respectivamente.
Posología
Posología en enfermedad de Gaucher Tipo 1 Adultos
Para el tratamiento de pacientes adultos con la enfermedad de Gaucher tipo 1, se recomienda una dosis inicial de 100 mg administrada tres veces al día.
Temporalmente, puede resultar necesario reducir la dosis a 100 mg una o dos veces al día en caso de producirse diarrea.
Población pediátrica
No se ha establecido la eficacia de Zavesca en niños y adolescentes de 0 a 17 años con enfermedad de Gaucher tipo 1. No se dispone de datos.
Posología en enfermedad de Niemann-Pick C
Adultos
La dosis recomendada para el tratamiento de pacientes adultos con enfermedad de Niemann-Pick C es de 200 mg tres veces al día.
La dosis recomendada para el tratamiento de pacientes adolescentes (12 años o más) con enfermedad de Niemann-Pick C es de 200 mg tres veces al día.
La dosis en pacientes menores de 12 años de edad debería ajustarse en base al área de superficie corporal, como se ilustra a continuación:
|
Area de superficie corporal (m2) |
Dosis recomendada |
|
> 1.25 |
200 mg tres veces al día |
|
> 0.88 - 1.25 |
200 mg dos veces al día |
|
> 0.73 - 0.88 |
100 mg tres veces al día |
|
> 0.47 - 0.73 |
100 mg dos veces al día |
|
< 0.47 |
100 mg una vez al día |
La reducción temporal de la dosis puede ser necesaria en algunos pacientes debido a la diarrea.
El beneficio para el paciente del tratamiento con Zavesca debe ser evaluado regularmente (ver sección 4.4).
Hay experiencia limitada con el uso de Zavesca en pacientes con enfermedad de Niemann-Pick C menores de cuatro años.
Poblaciones especiales
Ancianos
No existe experiencia con el uso de Zavesca en pacientes mayores de 70 años.
Insuficiencia renal
Los datos farmacocinéticos indican un aumento de la exposición sistémica al miglustat en pacientes con insuficiencia renal. En pacientes con aclaramiento de creatinina corregido de 50-70 ml/min/1,73 m2, debe iniciarse la administración de Zavesca con una dosis de 100 mg dos veces al día, en pacientes con enfermedad de Gaucher tipo 1, y a una dosis de 200 mg dos veces al día (ajustado según el área de superficie corporal en pacientes menores de 12 años) en pacientes con enfermedad de Niemann-Pick C.
En pacientes con aclaramiento de creatinina corregido de 30-50 ml/min/1,73 m2, deberá iniciarse la administración de Zavesca con una dosis de una única cápsula de 100 mg al día, en pacientes con enfermedad de Gaucher tipo 1 y una dosis de 100 mg dos veces al día (ajustado según el área de superficie corporal en pacientes menores de 12 años) en pacientes con enfermedad de Niemann-Pick C. No se recomienda el uso de Zavesca en pacientes con insuficiencia renal grave (aclaramiento de creatinina < 30 ml/min/1,73 m2) (ver secciones 4.4 y 5.2).
Insuficiencia hepática
No se ha evaluado Zavesca en pacientes con insuficiencia hepática.
Forma de administración
Zavesca puede tomarse con o sin alimentos.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo Temblor
Aproximadamente el 37% de los pacientes en ensayos clínicos con enfermedad de Gaucher tipo 1, y el 58% de los pacientes en un ensayo clínico en enfermedad de Niemann-Pick C padecen temblor. En la enfermedad de Gaucher tipo 1, este temblor se ha descrito como un temblor fisiológico exagerado de las manos. Normalmente los temblores se presentan durante el primer mes, resolviéndose, en muchos casos durante el tratamiento, al cabo de entre uno y tres meses. La disminución de la dosis puede mejorar el temblor, por lo general en unos días, si bien a veces puede resultar necesario interrumpir el tratamiento.
Trastornos gastrointestinales
Se han comunicado trastornos gastrointestinales, principalmente diarrea, en más del 80% de los pacientes, bien al inicio del tratamiento o de forma intermitente durante el mismo (ver sección 4.8). El mecanismo más probable es la inhibición de disacaridasas intestinales como la sacarasa-isomaltasa en el tracto gastrointestinal, lo que da lugar a una menor absorción de los disacáridos. En la práctica clínica se ha observado que los efectos gastrointestinales inducidos por miglustat responden a modificaciones individualizadas de la dieta (por ejemplo, reducción de la ingesta de sacarosa, lactosa y de otros hidratos de carbono), a la administración de Zavesca entre comidas y/o al tratamiento con productos medicinales antidiarreicos como la loperamida. En algunos pacientes puede ser necesaria la reducción temporal de la dosis. De acuerdo con la práctica clínica, se deben descartar otras etiologías en aquellos pacientes que presenten diarrea crónica u otros trastornos gastrointestinales persistentes que no respondan a estas medidas. No se ha evaluado el uso de Zavesca en pacientes con antecedentes de patología gastrointestinal significativa, incluida la enfermedad inflamatoria intestinal.
Efectos sobre la espermatogénesis
Los pacientes varones deberán mantener una anticoncepción eficaz mientras dure el tratamiento con Zavesca. Los estudios realizados en ratas han demostrado que miglustat tiene un efecto adverso sobre la espermatogénesis y parámetros espermáticos y que disminuye la fertilidad (ver secciones 4.6 y 5.3). Hasta que no se disponga de más información, los pacientes varones deberán suspender el tratamiento con Zavesca antes de realizar intentos de concepción y mantener métodos anticonceptivos fiables durante los tres meses siguientes a la suspensión.
Poblaciones especiales
Teniendo en cuenta la experiencia limitada existente, Zavesca deberá emplearse con cautela en pacientes con insuficiencia renal o hepática. Existe una estrecha relación entre la función renal y el aclaramiento de miglustat, y existe un importante aumento en la exposición al miglustat en pacientes con insuficiencia renal grave (ver sección 5.2). Actualmente no se cuenta con experiencia clínica suficiente en estos pacientes para efectuar recomendaciones de posología. No se recomienda el uso de Zavesca en pacientes con insuficiencia renal grave (aclaramiento de creatinina < 30ml/min/1,73m2).
Enfermedad de Gaucher tipo 1
Aunque no se ha contrastado el tratamiento con Zavesca directamente con la Terapia Enzimática de Sustitución (TES) en pacientes previamente no tratados con enfermedad de Gaucher tipo 1, no existen indicios de que Zavesca tenga una eficacia y seguridad superior con respecto a TES. La TES es el tratamiento estándar para pacientes que precisan terapia para la enfermedad de Gaucher tipo 1 (ver sección 5.1). No se han evaluado específicamente ni la eficacia ni la seguridad de Zavesca en pacientes con enfermedad de Gaucher grave.
Se recomienda un control regular de los niveles de vitamina B12 debido a la alta prevalencia de déficit de vitamina B12 en pacientes con enfermedad de Gaucher tipo 1.
Se han notificado casos de neuropatía periférica en pacientes tratados con Zavesca en presencia y ausencia de patologías concomitantes, como pueden ser el déficit en vitamina B12 y la gammapatía monoclonal. La neuropatía periférica parece ser más común en pacientes con enfermedad de Gaucher tipo I en comparación con la población general. Todos los pacientes deberán someterse a una evaluación neurológica basal y periódica.
Se recomienda la evaluación del recuento de plaquetas en pacientes con enfermedad de Gaucher tipo 1. Se han observado ligeros descensos del recuento de plaquetas no acompañados de sangrado en pacientes con enfermedad de Gaucher tipo 1 a los que se había cambiado la TES por Zavesca.
Enfermedad de Niemann-Pick C
El beneficio del tratamiento con Zavesca para las manifestaciones neurológicas en pacientes con enfermedad de Niemann-Pick C debe evaluarse regularmente, esto es, cada 6 meses; la continuación del tratamiento debe volver a evaluarse después de al menos un año de tratamiento con Zavesca.
En algunos pacientes con enfermedad de Niemann-Pick C tratados con Zavesca se observaron reducciones leves del recuento de plaquetas sin asociarse a hemorragias. En los pacientes incluidos en el ensayo clínico, un 40%-50% de los pacientes tenían recuentos de plaquetas por debajo del límite inferior de normalidad basal. En estos pacientes se recomienda monitorizar el recuento de plaquetas.
Población pediátrica
Se ha informado de una reducción del crecimiento en algunos pacientes pediátricos con enfermedad de Niemann-Pick C en la fase temprana de tratamiento con miglustat, donde el reducido incremento de peso inicial puede acompañarse de un reducido aumento de la estatura. El crecimiento debería monitorizarse en pacientes pediátricos y adolescentes durante el tratamiento con Zavesca; el balance beneficio/riesgo debería ser reevaluado individualmente para la continuación de la terapia.
4.5 Interacción con otros medicamentos y otras formas de interacción
Existen datos limitados que sugieren que la administración simultánea de Zavesca y sustitución enzimática con imiglucerasa en pacientes con enfermedad de Gaucher tipo 1 puede dar lugar a una disminución de la exposición al miglustat (en un pequeño estudio en grupos paralelos se observó una reducción de aproximadamente el 22% en Cmax y una disminución del 14% en el AUC de miglustat). Asimismo, en este estudio se constató un efecto nulo o limitado de Zavesca en la farmacocinética de imiglucerasa.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No existen datos suficientes sobre la utilización de miglustat en mujeres embarazadas. Los estudios en animales han mostrado toxicidad reproductiva, incluida la distocia (ver sección 5.3). Se desconoce el riesgo potencial en seres humanos. Miglustat atraviesa la placenta por lo que no debe emplearse durante el embarazo.
Lactancia
No se sabe si el miglustat se excreta en la leche materna. No se recomienda tomar Zavesca durante la lactancia.
Fertilidad
Estudios en la rata han demostrado que miglustat afecta negativamente los parámetros espermáticos (movilidad y morfología) con la consiguiente reducción de la fertilidad (ver secciones 4.4 y 5.3). Hasta que no se disponga de más información, se recomienda que los pacientes varones que deseen concebir interrumpan Zavesca y mantengan métodos anticonceptivos fiables durante los tres meses siguientes.
Las mujeres en edad fértil deberán utilizar métodos anticonceptivos. Los pacientes varones deberán emplear métodos anticonceptivos fiables mientras estén tomando Zavesca (ver secciones 4.4 y 5.3).
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de Zavesca sobre la capacidad para conducir y utilizar máquinas es insignificante. Se han notificado mareos como reacción adversa frecuente, por lo que los pacientes que experimenten mareos no deberán conducir ni utilizar máquinas.
4.8 Reacciones adversas
Resumen del perfil de seguridad
Las reacciones adversas notificadas con más frecuencia en los estudios clínicos con Zavesca fueron la diarrea, flatulencia, dolor abdominal, pérdida de peso y temblor (ver sección 4.4). La reacción adversa más grave notificada en los estudios clínicos con Zavesca fue la neuropatía periférica (ver sección 4.4).
En 11 ensayos clínicos en diferentes indicaciones 247 pacientes fueron tratados con Zavesca a dosis de 50-200 mg tres veces al día durante una duración media de 2.1 años. De estos, 132 pacientes tenían enfermedad de Gaucher tipo I, y 40 tenían enfermedad de Niemann-Pick C. Las reacciones adversas fueron en general de intensidad leve a moderada y ocurrieron con una frecuencia similar en las diferentes indicaciones y dosis probadas.
Lista tabulada de reacciones adversas
A continuación se incluyen las reacciones adversas procedentes de ensayos clínicos y notificaciones espontáneas que ocurrieron en >1% de los pacientes y se clasifican según el sistema de clasificación de órganos y frecuencia (muy frecuentes: > 1/10, frecuentes: > 1/100 a < 1/10, poco frecuentes:
> 1/1.000 a < 1/100, raras: > 1/10.000 a < 1/1.000, muy raras: < 1/10.000). Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
|
Trastornos de la |
sangre y del sistema linfático |
|
Frecuentes |
T rombocitopenia |
|
Trastornos del metabolismo y de la nutrición | |
|
Muy frecuentes |
Pérdida de peso, disminución del apetito |
|
Trastornos psiquiátricos | |
|
Frecuentes |
Depresión, insomnio, disminución de la libido |
|
Trastornos del sistema nervioso | |
|
Muy frecuentes |
Temblores, |
|
Frecuentes |
Neuropatía periférica, ataxia, amnesia, parestesia, hipoestesia, cefalea, mareo |
|
Trastornos gastrointestinales | |
|
Muy frecuentes |
Diarrea, flatulencia, dolor abdominal, |
|
Frecuentes |
Náuseas, vómitos, distensión/molestia abdominal, estreñimiento, dispepsia |
Trastornos músculoesqueléticos y del tejido conjuntivo Frecuentes Espasmos musculares, debilidad muscular
Trastornos generales y alteraciones en el lugar de administración Frecuentes Fatiga, astenia, escalofríos y sensación de malestar
Exploraciones complementarias
Frecuentes Estudios de conducción nerviosa anormales
Descripción de reacciones adversas seleccionadas
Se ha notificado una pérdida de peso en el 55% de los pacientes. La mayor prevalencia se registró entre los 6 y los 12 meses.
Se ha estudiado Zavesca en indicaciones donde ciertos eventos notificados como reacciones adversas, tales como síntomas/signos neurológicos y neuropsicológicos, disfunción cognitiva y trombocitopenia, podrían ser también debidos a la condición subyacente.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Anexo V.
4.9 Sobredosis
Síntomas
No se han notificado síntomas agudos de sobredosis. En ensayos clínicos en pacientes VIH positivos Zavesca se ha administrado a dosis de hasta 3000 mg/día durante periodos de hasta seis meses. Entre los efectos adversos observados se encuentran granulocitopenia, mareos y parestesia. También se ha observado leucopenia y neutropenia en un grupo similar de pacientes que recibían dosis iguales o superiores a 800 mg/día.
Manejo
En caso de sobredosis se recomiendan cuidados médicos generales.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Otros productos del tracto alimentario y el metabolismo, Código ATC: A16AX06
Enfermedad de Gaucher tipo 1
La enfermedad de Gaucher es un trastorno hereditario del metabolismo debido a un fallo en la degradación de la glucosilceramida, lo que provoca su acumulación en los lisosomas y produce una patología generalizada. Miglustat inhibe la glucosilceramida sintasa, la enzima responsable de la primera fase de la síntesis de la mayoría de los glucolípidos. La glucosilceramida sintetasa in vitro es inhibida por miglustat con una IC50 de 20-37 ^M. Además, se ha demostrado experimentalmente in-vitro la acción inhibidora de una glucosilceramida no lisosomal. La acción inhibidora de la glucosilceramida sintetasa constituye la base para la terapia de reducción de substrato en la enfermedad de Gaucher.
El ensayo fundamental de Zavesca se realizó en pacientes que no podían o no querían recibir TES. Los motivos para no recibir la TES incluían el inconveniente que suponen las infusiones intravenosas así como las dificultades de conseguir adecuado acceso venoso. En este ensayo clínico no comparativo, de
12 meses de duración, se incluyeron veintiocho pacientes con enfermedad de Gaucher tipo 1 leve o moderada, de los cuales 22 completaron el estudio. A los 12 meses se observó una media de reducción del 12,1% en la hepatomegalia y del 19,0% en la esplenomegalia. Se observó una media de incremento en la concentración de hemoglobina de 0,26 g/dl, y de 8,29 x 109/l en el recuento de plaquetas. Dieciocho pacientes optaron por continuar su tratamiento con Zavesca en el contexto de un protocolo de tratamiento a largo plazo. El beneficio clínico se ha evaluado a los 24 y a los 36 meses en
13 pacientes. Tras tratamiento continuado con Zavesca durante 3 años, la reducción media de la hepato- y esplenomegalia fue del 17,5% y 29,6%, respectivamente. Se observó una media de aumento de 22,2 x 109/l en el recuento de plaquetas y de 0,95 g/dl en la concentración de hemoglobina.
En otro estudio abierto controlado, 36 pacientes que habían seguido terapia enzimática de sustitución (TES) durante al menos 2 años fueron asignados aleatoriamente a tres grupos de tratamiento: seguir con el tratamiento con imiglucerasa; añadir Zavesca; o suspender el tratamiento con imiglucerasa y sustituirlo por Zavesca. Este estudio aleatorizado y comparado tuvo una duración de 6 meses seguido de una extensión a 18 meses en que todos los pacientes recibieron monoterapia con Zavesca. En los 6 primeros meses, en pacientes que cambiaron a Zavesca se observó que el volumen de hígado y bazo y los niveles de hemoglobina se mantuvieron invariables. En algunos pacientes se observó un descenso en el recuento de plaquetas así como aumento en la actividad de quitotriosidasa, lo que indica que la monoterapia con Zavesca puede no mantener el mismo control de la actividad de la enfermedad en todos los pacientes. 29 pacientes continuaron en el periodo de extensión. Cuando se compararon con los registros a 6 meses, el control de la enfermedad se mantuvo sin cambios después de 18 y 24 meses de monoterapia con Zavesca (20 y 6 pacientes, respectivamente). Ningún paciente mostró rápido deterioro de la enfermedad de Gaucher tipo I tras el cambio a monoterapia con Zavesca.
En los dos estudios citados anteriormente, se utilizó una dosis total diaria de 300 mg de Zavesca repartida en tres dosis iguales. Se realizó un estudio adicional con monoterapia en 18 pacientes utilizando una dosis diaria total de 150 mg con resultados que indican una menor eficacia frente a la dosis diaria total de 300 mg.
Un estudio abierto, no comparativo, a dos años incluyó 42 pacientes con enfermedad de Gaucher tipo 1 que habían recibido un mínimo de 3 años de TES y que cumplían criterios de enfermedad estable durante al menos 2 años. Los pacientes fueron cambiados a monoterapia con miglustat 100 mg t.i.d. El volumen hepático (variable principal de eficacia) no se modificó entre el periodo basal y el final del tratamiento. En 6 pacientes se discontinuó el tratamiento con miglustat de forma prematura por posible deterioro de la enfermedad, según se había definido en el estudio. Trece pacientes discontinuaron el tratamiento por efecto adverso. Se observó una pequeña reducción en las medias de la hemoglobina [0.95 g/dL (IC 95%: -1.38, -0.53)] y el recuento de plaquetas [-44.1 x 109/L (IC 95%: -57.6, -30.7)] entre el periodo basal y el final del estudio. Veintiún pacientes completaron los 24 meses de tratamiento con miglustat. De estos, 18 pacientes se encontraban en el periodo basal dentro de los objetivos terapéuticos establecidos para volumen hepático y esplénico, niveles de hemoglobina y recuentos de plaquetas, permaneciendo 16 pacientes dentro de estos objetivos terapéuticos el Mes 24.
Las manifestaciones óseas de la enfermedad de Gaucher tipo I fueron evaluadas en 3 ensayos clínicos abiertos en pacientes tratados con miglustat 100 mg t.i.d. durante periodos de hasta 2 años (n = 72). En un análisis combinado de datos no controlados, el índice Z de puntuación de densidad mineral ósea en la columna lumbar y en el cuello femoral aumentó en más de 0.1 unidades respecto al basal en 27 (57%) y 28 (65%) de los pacientes con mediciones de densidad del hueso longitudinal. No hubo eventos de crisis óseas, necrosis avascular o fractura durante el periodo de tratamiento.
Enfermedad de Niemann-Pick C
La enfermedad de Niemann-Pick C es un trastorno neurodegenerativo muy raro, invariablemente progresivo y finalmente fatal, caracterizado por una alteración del transporte intracelular de lípidos.
Las manifestaciones neurológicas se consideran secundarias a la acumulación anormal de glucoesfingolípidos las neuronas y células de la glía.
Los datos que apoyan la seguridad y eficacia de Zavesca en la enfermedad de Niemann-Pick C proceden de un ensayo clínico prospectivo, abierto y de una revisión retrospectiva. El ensayo clínico incluyó 29 pacientes adultos y pediátricos en un periodo de control de 12 meses, seguido de una terapia de extensión con una duración total media de 3,9 años y hasta 5,6 años. Además, 12 pacientes pediátricos fueron incluidos en un subestudio no controlado de una duración global media de 3,1 años y hasta 4,4 años. Entre los 41 pacientes incluidos en el ensayo 14 pacientes fueron tratados con Zavesca durante más de 3 años. La revisión incluyó una serie de casos de 66 pacientes tratados con Zavesca fuera del ensayo clínico durante una media de 1,5 años. Ambos conjuntos de datos incluyeron pacientes pediátricos, adolescentes y adultos con un rango de edad de 1 a 43 años. La dosis habitual de Zavesca en pacientes adultos era de 200 mg t.i.d. y fue ajustada en función del área de superficie corporal en pacientes pediátricos.
En general, los datos muestran que el tratamiento con Zavesca puede reducir la progresión de los síntomas clínicos neurológicos relevantes en pacientes con enfermedad de Niemann-Pick C.
El beneficio del tratamiento con Zavesca para las manifestaciones neurológicas de la enfermedad de Niemann-Pick C debería ser evaluado regularmente, esto es, cada 6 meses; la continuación del tratamiento debe volver a evaluarse después de un año de tratamiento con Zavesca, (ver sección 4.4).
5.2 Propiedades farmacocinéticas
Los parámetros farmacocinéticos de miglustat se evaluaron en individuos sanos, en un grupo reducido de pacientes con enfermedad de Gaucher tipo 1, enfermedad de Fabry, pacientes infectados por el VIH y adultos, adolescentes y niños con la enfermedad de Niemann-Pick C o enfermedad de Gaucher tipo 3.
La cinética de miglustat parece ser lineal con respecto a la dosis e independiente respecto al tiempo.
En individuos sanos, miglustat se absorbe rápidamente. Las concentraciones plasmáticas máximas se alcanzan aproximadamente a las dos horas de la toma del medicamento. No se ha determinado la biodisponibilidad absoluta. La ingesta simultánea de alimentos disminuye la tasa de absorción (disminución de Cmax en un 36% y retraso de 2 horas en alcanzar tmax) sin efecto estadísticamente significativo en el grado de absorción de miglustat (disminución del 14% en AUC).
El volumen aparente de distribución de miglustat es de 83 l. Miglustat no se une a proteínas plasmáticas. Miglustat se elimina principalmente vía renal, con una recuperación urinaria de fármaco no modificado del 70-80% de la dosis. El aclaramiento oral aparente (CL/F) es de 230 ± 39 ml/min.
El promedio de la semivida es de 6-7 horas.
Después de la administración de una sola dosis de 100 mg de miglustat-C14 en voluntarios sanos, se recuperó el 83% de la radiactividad en la orina y el 12% en heces. Diversos metabolitos fueron identificados en heces y orina. El metabolito más abundante en la orina fue el glucurónido de miglustat, que constituía el 5% de la dosis. La semivida terminal de la radiactividad en el plasma fue de 150 h, sugiriendo la presencia de uno o más metabolitos con una semivida larga. El metabolito considerado para esta determinación no ha sido identificado, pero puede acumular y alcanzar concentraciones que excedan las de miglustat en el estado estacionario.
La farmacocinética de miglustat es similar en pacientes con enfermedad de Gaucher tipo 1 del adulto y en pacientes con enfermedad de Niemann-Pick C, comparado con sujetos sanos.
Población pediátrica
Los datos farmacocinéticos fueron obtenidos en pacientes pediátricos con enfermedad de Gaucher tipo 3, con edades comprendidas entre 3 y 15 años así como en pacientes con enfermedad de Niemann-Pick C de 5-16 años. En niños, la dosis de 200 mg t.i.d ajustada a la superficie de área corporal resultó en
unos valores de Cmax y AUCT que fueron aproximadamente el doble de aquellos alcanzados con 100 mg t.i.d. en pacientes con enfermedad de Gaucher tipo 1, consistentes con la farmacocinética dosis-lineal de miglustat. En el estado estacionario, la concentración de miglustat en el fluido cerebroespinal de seis pacientes con enfermedad de Gaucher tipo 3 fue 31,4-67,2% de la plasmática.
Existen datos limitados, en pacientes con enfermedad de Fabry e insuficiencia renal, que demuestran que el CL/F disminuye con el deterioro de la función renal. Si bien había el número de sujetos con insuficiencia renal leve o moderada era muy reducido, los datos sugieren una disminución aproximada del CL/F del 40% y del 60% en la insuficiencia renal leve y moderada, respectivamente (ver sección 4.2). Con respecto a la insuficiencia renal grave, se dispone de datos de dos pacientes con aclaramiento de creatinina en el rango de 18-29 ml/min, no pudiendo extrapolarse los datos a rangos inferiores. Estos datos sugieren que los pacientes con insuficiencia renal grave experimentan una disminución de CL/F de al menos el 70%.
En el rango de datos disponibles, no se han observado relaciones ni tendencias significativas entre los parámetros farmacocinéticos de miglustat y las variables demográficas (edad, IMC, sexo o raza).
No se dispone de datos farmacocinéticos en pacientes con insuficiencia hepática, ni en pacientes de edad avanzada (> 70 años).
5.3 Datos preclínicos sobre seguridad
La pérdida de peso y la diarrea, así como, a dosis superiores, lesiones (erosiones y ulceraciones) en la mucosa gastrointestinal han sido los principales efectos comunes a todas las especies. Además, los efectos observados en animales con dosis que dan lugar a niveles de exposición similares o moderadamente superiores al nivel clínico han incluido: alteraciones en los órganos linfoides en todas las especies estudiadas, alteraciones en los niveles de transaminasas, vacuolización en tiroides y páncreas, cataratas, nefropatía y alteraciones del miocardio en ratas. Se consideró que estas alteraciones están asociadas al debilitamiento.
La administración de miglustat a ratas Sprague Dawley macho y hembra, mediante cánula gástrica durante 2 años a dosis de 30, 60 y 180 mg/kg/día, dio lugar a una mayor incidencia de hiperplasia y adenomas de células intersticiales testiculares (células de Leydig) en ratas macho a todos los niveles de dosis. La exposición sistémica con la mínima dosis fue inferior o comparable a la observada en el ser humano (en base a la AUC0_<») a las dosis recomendadas en el hombre. No se estableció el Nivel Sin Efecto Observado [No Observed Effect Level (NOEL)] y el efecto no fue dosis-dependiente. No se observó un aumento asociado al fármaco en la incidencia de tumores en ningún otro órgano en ratas, ni macho ni hembra. Estudios mecanicistas revelaron un mecanismo específico en la rata que se considera de poca relevancia en el ser humano.
La administración de miglustat a ratones CD1 macho y hembra, mediante cánula gástrica durante 2 años, a dosis de 210, 420 y 840/500 mg/kg/día (con reducción de dosis después de medio año) dio lugar en ambos sexos a un aumento de la incidencia de lesiones inflamatorias e hiperplásicas en el intestino grueso. Basado en los mg/kg/día y corregido por las diferencias en la excreción fecal, las dosis correspondieron a 8, 16 y 33/19 veces la dosis más alta recomendada en el hombre (200 mg t.i.d.). De forma ocasional se encontraron carcinomas en el intestino grueso en todas las dosis, con un aumento estadísticamente significativo en el grupo de mayor dosis. Se desconoce la relevancia de estos hallazgos en el ser humano. No se observó un aumento asociado al fármaco en la incidencia de tumores en ningún otro órgano.
Miglustat no mostró ningún potencial para inducir efectos mutagénicos o clastogénicos en una batería estándar de ensayos de genotoxicidad.
Los estudios de toxicidad con dosis múltiples en ratas han demostrado efectos sobre el epitelio seminífero del testículo. Otros estudios han revelado alteraciones en los parámetros espermáticos (motilidad y morfología) congruentes con una disminución observada en la fertilidad. Estos efectos sobre la fertilidad se produjeron con niveles de exposición similares a los observados en pacientes, si bien fueron reversibles. Miglustat ha afectado la supervivencia embrionaria/fetal en la rata y el conejo; se ha observado distocia; aumento de las pérdidas post-implantación así como una mayor incidencia de anomalías vasculares en el conejo. Estos efectos pueden estar parcialmente relacionados con la toxicidad materna.
En un estudio de 1 año de duración en ratas hembras, se observaron alteraciones en la lactancia. Se desconoce el mecanismo responsable de este efecto.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Contenido de las cápsulas Almidón glicolato sódico,
Povidona (K30),
Estearato magnésico.
Cápsula
Gelatina,
Agua,
Dióxido de titanio (E171).
Tinta de impresión Óxido de hierro negro (E172)
Goma laca.
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
5 años
6.4 Precauciones especiales de conservación
No conservar a temperatura superior a 30°C.
6.5 Naturaleza y contenido del envase
Las cápsulas Zavesca están envasadas en tiras blíster de ACLAR/ALU y se comercializan en una caja con un total de 84 cápsulas repartidas en 4 tiras de blíster, con 21 cápsulas en cada.
6.6 Precauciones especiales de eliminación
Ninguna especial para su eliminación.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Actelion Registration Ltd Chiswick Tower, 13th Floor 389 Chiswick High Road Londres W4 4AL Reino Unido
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/02/238/001
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 20/noviembre/2002 Fecha de la última renovación: 20/noviembre/2012
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
A. FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES RELATIVAS AL USO SEGURO Y EFICAZ DEL MEDICAMENTO
A. FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección del fabricante responsable de la liberación de los lotes
Actelion Manufacturing GmbH Emil-Barell-Strasse 7 79639 Grenzach-Wyhlen Alemania
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica restringida (ver Anexo I: Ficha Técnica o Resumen de las Características del Producto, sección 4.2).
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
El Titular de la Autorización de Comercialización (TAC) presentará los informes periódicos de seguridad para este medicamento de conformidad con las exigencias establecidas en la lista de fechas de referencia de la Unión (lista EURD) prevista en el artículo 107ter, párrafo 7, de la Directiva 2001/83/CE y publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado
en la versión del PGR incluido en el Módulo 1.8.2 de la Autorización de Comercialización y en
cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos.
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
Si coincide la presentación de un IPS con la actualización del PGR, ambos documentos se pueden
presentar conjuntamente.
• Obligación de llevar a cabo medidas post-autorización
El TAC deberá llevar a cabo, dentro del plazo establecido, las siguientes medidas:
|
Descripción |
Fecha límite |
|
El TAC deberá mantener el Registro de NP-C, actualmente en marcha, con el fin de permitir la generación continuada de datos acerca de la seguridad, el curso a largo plazo de la enfermedad y la evolución clínica del tratamiento de pacientes con enfermedad de NP-C. El Registro de NP-C es un estudio observacional de |
Se presentarán informes anuales con el IPS. |
cohortes, multicéntrico, prospectivo, en pacientes diagnosticados de enfermedad de Niemann-Pick C (NP-C)_
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR CARTÓN EXTERIOR
1. NOMBRE DEL MEDICAMENTO
Zavesca 100 mg, cápsulas duras Miglustat
2. PRINCIPIO(S) ACTIVO(S)
Cada cápsula contiene 100 mg de miglustat
3. LISTA DE EXCIPIENTES
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Cápsula dura 84 cápsulas
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento. Vía oral
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera del alcance y de la vista de los niños.
7. OTRAS ADVERTENCIAS ESPECIALES, SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
No conservar a temperatura superior a 30°C.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Actelion Registration Ltd Chiswick Tower, 13th Floor 389 Chiswick High Road Londres W4 4AL Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/02/238/001
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACION EN BRAILLE
Zavesca
INFORMACIÓN MÍNIMA A INCLUIR EN BLÍSTERS O TIRAS BLÍSTERS
|
1. |
NOMBRE DEL MEDICAMENTO |
Zavesca 100 mg, cápsulas duras Miglustat
2. NOMBRE DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Actelion Registration Ltd
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. OTROS
B. PROSPECTO
Zavesca 100 mg cápsulas duras
Miglustat
Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto:
1. Qué es Zavesca y para qué se utiliza.
2. Qué necesita saber antes de empezar a tomar Zavesca.
3. Cómo tomar Zavesca.
4. Posibles efectos adversos.
5. Conservación de Zavesca.
6. Contenido del envase e información adicional.
1. Qué es Zavesca y para qué se utiliza
Zavesca contiene la sustancia activa miglustat que pertenece a un grupo de medicamentos que tienen efecto sobre el metabolismo. Se usa para tratar dos transtornos:
• Zavesca se usa para tratar la enfermedad de Gaucher tipo 1 leve-moderada en adultos.
En la enfermedad de Gaucher tipo 1, su cuerpo no puede eliminar una sustancia denominada glucosilceramida. Debido a ello se acumula en algunas células de su sistema inmunitario. Esto puede dar lugar a que le aumente de tamaño el hígado y al bazo, se produzcan cambios en la sangre y le afecte a los huesos.
El tratamiento habitual para la enfermedad de Gaucher tipo 1 consiste en la terapia enzimática de sustitución (TES). Zavesca sólo se utilizará en aquellos casos en los que se considere que la terapia enzimática de sustitución no es adecuada para el paciente.
• Zavesca también se usa para el tratamiento de los síntomas neurológicos progresivos de la enfermedad de Niemann-Pick C en adultos y en niños.
Si usted tiene la enfermedad de Niemann-Pick C, pueden acumularse en las células de su cerebro lípidos como la glucosilceramida. Esto puede conllevar una alteración de las funciones neurológicas como lentitud de los movimientos oculares, el equilibrio, la deglución, la memoria o las convulsiones.
Zavesca actúa inhibiendo la enzima denominada glucosilceramida sintetasa, responsable del primer paso en la síntesis de la mayoría de glucoesfingolípidos.
2. Qué necesita saber antes de empezar a tomar Zavesca No tome Zavesca
- si es alérgico al miglustat o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
Advertencias y precauciones
Consulte a su médico o farmacéutico antes de empezar a tomar Zavesca
- si padece enfermedad renal
- si padece enfermedad hepática
Su médico realizará las siguientes pruebas antes y durante su tratamiento con Zavesca:
- exploración física de los nervios de los brazos y piernas
- medición de los niveles de vitamina B12
- Monitorización del crecimiento en niños o adolescentes con enfermedad de Niemann-Pick C
- Monitorización del recuento de plaquetas en sangre
Estas pruebas son necesarias debido a que algunos pacientes han comunicado síntomas como hormigueo o entumecimiento en manos y pies, o una reducción del peso corporal durante el tratamiento con Zavesca. Las pruebas ayudarán al médico a determinar si estos efectos se deben a su enfermedad o a condiciones ya existentes o son efectos adversos de Zavesca (ver sección 4 para más detalles).
Si usted padece diarrea, su médico puede solicitarle que modifique su dieta para reducir la ingesta de lactosa e hidratos de carbono tales como la sacarosa (azúcar de caña), o no tomar Zavesca junto con los alimentos, o reducir temporalmente la dosis. En algunos casos el médico puede recetarle medicamentos para tratar la diarrea, como la loperamida. Consulte a su médico si la diarrea no responde a estas medidas o si presenta cualquier otra molestia abdominal. En dicho caso, su médico puede decidir realizar exploraciones adicionales.
Se aconseja a los pacientes varones que empleen métodos anticonceptivos fiables durante el tratamiento con Zavesca y hasta tres meses después de finalizar el mismo.
Niños y adolescentes
No administre este medicamento a niños y adolescentes (menores de 18 años de edad) con enfermedad de Gaucher tipo1 porque se desconoce si funciona en esta enfermedad.
Uso de Zavesca con otros medicamentos
Informe a su médico o farmacéutico si está tomando o ha tomado recientemente o podría tener que tomar cualquier otro medicamento.
Informe a su médico if está tomando medicamentos que contienen imiglucerasa, que a veces se utilizan al mismo tiempo que Zavesca. Pueden disminuir la cantidad de Zavesca en su cuerpo.
Embarazo, lactancia y fertilidad
No tome Zavesca si está embarazada o tiene intención de quedarse embarazada. Para más información, consulte con su médico o farmacéutico. Deberá emplear un método anticonceptivo eficaz mientras esté tomando Zavesca. No debe proseguir con la lactancia mientras tome Zavesca.
Los pacientes varones deberán utilizar un método anticonceptivo fiable durante el tratamiento con Zavesca, y durante los tres meses siguientes tras finalizar el tratamiento.
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento.
Conducción y uso de máquinas
Zavesca puede producirle mareos. No conduzca ni maneje herramientas o máquinas si se siente mareado.
3. Cómo tomar Zavesca
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico. En caso de duda, consulte de nuevo a su médico o farmacéutico.
• Para la enfermedad de Gaucher tipo 1: En adultos, la dosis normal es de una cápsula (100 mg) tres veces al día (mañana, tarde, noche), lo cual supone una dosis máxima diaria de tres cápsulas (300 mg).
• Para la enfermedad de Niemann-Pick C: En adultos y adolescentes (mayores de 12 años), la dosis normal es 2 cápsulas (200 mg) tres veces al día (mañana, tarde y noche). Esto supone un máximo diario de seis cápsulas (600 mg).
Para niños de menos de 12 años, su médico ajustará la dosis para la enfermedad de Niemann-Pick C.
En el caso de problemas de riñón, su médico puede indicarle una dosis inicial inferior. Es posible que su médico reduzca la dosis de Zavesca a una cápsula (100 mg) una o dos veces al día en el caso de que se presente diarrea durante el tratamiento con Zavesca (ver sección 4). Su médico le indicará la duración del tratamiento.
Para extraer la cápsula:
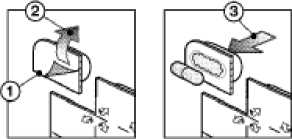
1. Separar por la línea perforada
2. Retirar el papel según indiquen las flechas
3. Extraer la cápsula presionando a través del aluminio
Zavesca puede tomarse con o sin alimentos. Debe tragarse la cápsula entera con un vaso de agua.
Si toma más Zavesca del que debiera
Si usted toma más cápsulas de las que se le indicó, consulte a su médico inmediatamente. En ensayos clínicos se ha empleado Zavesca a dosis diez veces superiores a la dosis recomendada: esto causó una reducción de los leucocitos sanguíneos y otros efectos secundarios similares a los descritos en la sección 4.
Si olvidó tomar Zavesca
Tome la siguiente cápsula cuando corresponda. No tome una dosis doble para compensar las dosis olvidadas.
Si interrumpe el tratamiento con Zavesca
No interrumpa el tratamiento con Zavesca sin consultar con su médico.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Efectos adversos más graves:
Algunos pacientes han presentado hormigueo o entumecimiento de las manos y los pies (se observa con frecuencia). Estos podrían ser signos de neuropatía periférica, debida a efectos secundarios de Zavesca o podrían ser debidos a enfermedades ya existentes. Su médico realizará pruebas antes y durante el tratamiento con Zavesca para evaluar su caso (ver sección 2).
Si presenta alguno de estos efectos, comuníquelo a su médico lo antes posible.
Si usted experimenta un ligero temblor, habitualmente temblor en las manos, informe a su médico lo antes posible. Con frecuencia el temblor se resuelve sin necesidad de interrumpir el tratamiento. En ocasiones su médico necesitará disminuir la dosis e incluso interrumpir el tratamiento con Zavesca para controlar el temblor.
Muy frecuentes - pueden afectar a más de 1 de cada 10 pacientes
Entre los efectos adversos más frecuentes se encuentran diarrea, flatulencia (gases), dolor abdominal (de estómago), pérdida de peso y disminución del apetito.
Si pierde algo de peso al iniciar el tratamiento con Zavesca, no se preocupe, por lo general la gente deja de perder peso con la continuación del tratamiento.
Frecuentes - pueden afectar hasta 1 de cada 10 pacientes
Los efectos adversos frecuentes son dolor de cabeza, mareos, parestesias (hormigueo o entumecimiento), alteraciones de la coordinación, hipoestesias (sensación reducida al tacto), dispepsia (acidez), nauseas (sentirse mareado), estreñimiento y vómitos, hinchazón o molestia del abdomen (estómago) y trombocitopenia (disminución de los niveles sanguíneos de plaquetas). Los síntomas neurológicos y la trombocitopenia pueden deberse a la enfermedad subyacente.
Otros posibles efectos adversos son espasmos musculares o debilidad, fatiga, escalofríos y sensación de malestar, dificultad para dormir, olvidos y disminución de la libido.
La mayoría de los pacientes notan uno o más efectos secundarios de este tipo, normalmente al iniciar el tratamiento o en distintos momentos durante el mismo. La mayoría son leves y se resuelven con bastante rapidez. Si alguno de estos efectos adversos le causa problemas consulte con su médico. Él o ella puede que reduzca la dosis de Zavesca o le recete otros medicamentos para controlar los efectos secundarios.
Comunicación de efectos adversos
Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Anexo V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Zavesca
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en el envase después de “CAD”. La fecha de caducidad es el último día del mes que se indica.
Conservar a temperatura inferior a 30°C.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma ayudará a proteger el medio ambiente
Composición de Zavesca El principio activo es miglustat 100 mg.
Los demás componentes son:
Almidón glicolato sódico,
Povidona (K30)
Estearato magnésico
Gelatina,
Agua,
Dióxido de titanio
Óxido de hierro negro Goma laca
Aspecto del producto y contenido del envase
Zavesca es una capsula blanca de 100 mg con “OGT 918” impreso en negro sobre la tapa y “100” impreso en negro en el cuerpo.
Caja con cuatro tiras blister, conteniendo cada tira 21 cápsulas, siendo el total de 84 cápsulas.
Titular de la autorización de comercialización:
Actelion Registration Ltd Chiswick Tower, 13th Floor 389 Chiswick High Road London W4 4AL United Kingdom
Fabricante:
Actelion Manufacturing GmbH Emil-Barell-Strasse 7 79639 Grenzach-Wyhlen Alemania
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización.
Belgie/Belgique/Belgien
Actelion Pharmaceuticals Belgium N.V. Tél/Tel: +32-(0) 15 284 777
Etarapna
Actelion Pharmaceuticals Ltd Tea.: +420-2 3413 8150
Ceská republika
Actelion Pharmaceuticals CZ, s.r.o.
Tel: +420 2 21 968 006
Danmark
Actelion Pharmaceuticals Sverige AB Tlf: +46-(0)8 544 982 50
Lietuva
UAB ALGOL PHARMA Tel: +370 37 40 86 81
Luxembourg/Luxemburg
Actelion Pharmaceuticals Belgium N.V. Tél/Tel: +32-(0) 15 284 777
Magyarország
Actelion Pharmaceuticals Hungaria Kft. Tel: +36-1-413-3270
Malta
Actelion Pharmaceuticals UK Ltd Tel: +44 208 987 3333
|
Deutschland Actelion Pharmaceuticals Deutschland GmbH Tel: +49-(0)761 45 64 0 |
Nederland Actelion Pharmaceuticals Nederland B.V. Tel: +31 -(0)348 435950 |
|
Eesti Algol Pharma OÜ Tel: +372 605 6014 |
Norge Actelion Pharmaceuticals Sverige AB Tlf: +46-(0)8 544 982 50 |
|
EXláSa Actelion Pharmaceuticals EAAág A.E. Tn^: +30-210 675 25 00 |
Osterreich Actelion Pharmaceuticals Austria GmbH Tel: +43-(0)1 505 4527 |
|
España Actelion Pharmaceuticals España S.L. Tel: +34-93 366 43 99 |
Polska Actelion Pharma Polska Sp. z o.o. Tel: +48 (22) 262 31 00 |
|
France Actelion Pharmaceuticals France SAS Tél: +33-(0) 1 58 62 32 32 |
Portugal Actelion Pharmaceuticals Portugal Lda. Tel: +351-21 358 6120 |
|
Hrvatska Medis Adria d.o.o Tel: +385 (0)1 2303 446 |
Romania Geneva Romfarm International Tel: + 40 (021) 231 3561 |
|
Ireland Actelion Pharmaceuticals UK Ltd Tel: +44 208 987 3333 |
Slovenija Medis d.o.o. Tel: +386-(0)1 589 69 00 |
|
Ísland Actelion Pharmaceuticals Sverige AB Simi : +46-(0)8 544 982 50 |
Slovenská republika Actelion Pharmaceuticals SK, s.r.o. Tel: +420 2 21 968 006 |
|
Italia Actelion Pharmaceuticals Italia S.r.l. Tel: +39-0542 64 87 40 |
Suomi/Finland Actelion Pharmaceuticals Sverige AB Puh/Tel: +46-(0)8 544 982 50 |
|
Kúnpoq Actelion Pharmaceuticals EAAág A.E. Tn^: +30-210 675 25 00 |
Sverige Actelion Pharmaceuticals Sverige AB Tel: +46-(0)8 544 982 50 |
|
Latvija Algol Pharma SIA Tel: +371 6761 9365 |
United Kingdom Actelion Pharmaceuticals UK Ltd Tel: +44 208 987 3333 |
|
Fecha de la última revisión de este prospecto: |
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu. También existen enlaces a otras páginas web sobre enfermedades raras y medicamentos huérfanos.
27