Zarzio 30 Mu/0,5 Ml Sol. Iny. O Para Perfusion En Jeringa Precargada
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
1. NOMBRE DEL MEDICAMENTO
Zarzio 30 MU/0,5 ml solución inyectable o para perfusión en jeringa precargada Zarzio 48 MU/0,5 ml solución inyectable o para perfusión en jeringa precargada
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Zarzio 30 MU/0,5 ml solución inyectable o para perfusión en jeringa precargada
Cada ml de solución contiene 60 millones de unidades (MU) (equivalentes a 600 microgramos [^g])
de filgrastim*.
Cada jeringa precargada contiene 30 MU (equivalentes a 300 ^g) de filgrastim en 0,5 ml.
Zarzio 48 MU/0,5 ml solución inyectable o para perfusión en jeringa precargada
Cada ml de solución contiene 96 millones de unidades (MU) (equivalentes a 960 microgramos [^g])
de filgrastim*.
Cada jeringa precargada contiene 48 MU (equivalentes a 480 ^g) de filgrastim en 0,5 ml.
* Factor estimulante de las colonias de granulocitos (G-CSF) humano recombinante metionilado producido en E coli por tecnología de DNA recombinante.
Excipiente con efecto conocido:
cada ml de solución contiene 50 mg de sorbitol (E420).
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Solución inyectable o para perfusión en jeringa precargada (inyectable o perfusión). Solución transparente, de aspecto incoloro a ligeramente amarillento.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
- Reducción de la duración de la neutropenia y de la incidencia de la neutropenia febril en los pacientes tratados con quimioterapia citotóxica establecida para enfermedades malignas (con la excepción de la leucemia mieloide crónica y los síndromes mielodisplásicos) y reducción de la duración de la neutropenia en los pacientes sometidos a tratamiento mieloablativo seguido de trasplante de médula ósea que se considere que presentan un mayor riesgo de experimentar neutropenia grave prolongada.
La eficacia y la seguridad de filgrastim son similares en los adultos y en los niños tratados con quimioterapia citotóxica.
- Movilización de las células progenitoras de sangre periférica (PBPC).
- En pacientes, tanto niños como adultos, con neutropenia congénita grave, cíclica o idiopática, con un recuento absoluto de neutrófilos (RAN) < 0,5 x 109/l y una historia de infecciones graves o recurrentes, la administración a largo plazo de filgrastim está indicada para aumentar el recuento de neutrófilos y reducir la incidencia y la duración de los acontecimientos relacionados con las infecciones.
- Tratamiento de la neutropenia persistente (RAN < 1,0 x 109/l) en pacientes con infección avanzada por VIH, para reducir el riesgo de desarrollar infecciones bacterianas cuando otras opciones para el tratamiento de la neutropenia no sean adecuadas.
El tratamiento con filgrastim debe administrarse únicamente en colaboración con un centro de oncología que tenga experiencia en el uso de G-CSF y en hematología y que disponga de las instalaciones necesarias para el diagnóstico. Los procedimientos de movilización y aféresis deben realizarse en colaboración con un centro de oncología-hematología con experiencia suficiente en este campo y en el que el seguimiento de las células progenitoras hematopoyéticas pueda realizarse de una forma correcta.
Quimioterapia citotóxica establecida
Posología
La dosis recomendada de filgrastim es de 0,5 MU/Kg/día (5 ^g/Kg/día). La primera dosis de filgrastim debe administrarse al menos 24 horas después de la finalización de la quimioterapia citotóxica. En ensayos clínicos aleatorizados, se utilizó una dosis subcutánea de 230 ^g/m2/día (entre 4,0 y 8,4 ^g/kg/día).
La dosificación diaria se debe mantener hasta que se haya sobrepasado el nadir teórico de neutrófilos y el recuento de estas células retorne a su rango normal. Después de la quimioterapia establecida en tumores sólidos, linfomas y leucemia linfoide, se prevé que la duración del tratamiento necesario para alcanzar estos criterios sea de hasta 14 días. Tras el tratamiento de inducción y consolidación en la leucemia mieloide aguda, la duración del tratamiento puede ser bastante mayor (hasta 38 días) dependiendo del tipo, la posología y las pautas de administración de la quimioterapia citotóxica.
Los pacientes sometidos a quimioterapia citotóxica experimentan un aumento transitorio del recuento de neutrófilos que ocurre típicamente 1 - 2 días después de iniciar la administración de filgrastim. Sin embargo, para conseguir una respuesta terapéutica sostenida no se debe suspender el tratamiento con filgrastim hasta que se haya sobrepasado el nadir teórico de neutrófilos y el recuento de estas células retorne a su rango normal. No se recomienda, por tanto, la interrupción prematura del tratamiento con filgrastim antes de alcanzar el nadir teórico de neutrófilos.
Forma de administración
Filgrastim se puede administrar diariamente en inyección subcutánea o en perfusión intravenosa diluido en solución de glucosa al 5% y administrado a lo largo de 30 minutos (ver sección 6.6). Es preferible la vía subcutánea en la mayoría de los casos. Hay alguna evidencia procedente de un estudio de administración en dosis única de que la administración intravenosa puede acortar la duración del efecto. La relevancia clínica de este hallazgo con respecto a la administración de múltiples dosis no está clara. La elección de la vía de administración depende de las circunstancias clínicas individuales.
En pacientes tratados con terapia mieloablativa seguida de trasplante de médula ósea
Posología
La dosis inicial recomendada de filgrastim es de 1,0 MU/Kg/día (10 ^g/Kg/día). La primera dosis de filgrastim se debe administrar al menos 24 horas después de la quimioterapia citotóxica y al menos 24 horas después de la perfusión de la médula ósea.
Una vez sobrepasado el nadir de neutrófilos, la dosis diaria de filgrastim se ajustará en función de la respuesta celular obtenida de la siguiente forma:
|
Recuento de neutrófilos |
Ajuste de la dosis de filgrastim |
|
> 1,0 x 109/l durante 3 días consecutivos |
Reducir a 0,5 MU/Kg/día (5 ^g/Kg/día). |
|
Si el RAN permanece > 1,0 x 109/l durante 3 días consecutivos más |
Suspender filgrastim |
|
Si el RAN desciende a < 1,0 x 109/l durante el periodo de tratamiento, se debe reajustar de nuevo la dosis de filgrastim siguiendo los pasos previamente indicados | |
|
RAN = recuento absoluto de neutrófilos | |
Filgrastim se puede administrar en perfusión intravenosa durante 30 minutos o 24 horas, o en perfusión subcutánea continua durante 24 horas. Filgrastim se debe diluir en 20 ml de solución de glucosa al 5% (ver sección 6.6).
Para la movilización de PBPC en pacientes sometidos a terapia mielosupresora o mieloablativa seguida de trasplante autólogo de PBPC
Posología
La dosis recomendada de filgrastim cuando se administra sólo para la movilización de PBPC es de 1,0 MU/Kg/día (10 gg/Kg/día) durante 5 - 7 días consecutivos. Momento de realización de las leucoféresis: una o dos leucoféresis en los días 5 y 6 suelen ser suficientes. En otras circunstancias, pueden ser necesarias leucoféresis adicionales. La administración de filgrastim debe mantenerse hasta la última leucoféresis.
La dosis recomendada de filgrastim para movilizar las PBPC tras una quimioterapia mielosupresora es de 0,5 MU/Kg/día (5 gg/Kg/día) desde el primer día tras la conclusión de la quimioterapia hasta que se haya sobrepasado el nadir teórico de neutrófilos y el recuento de estas células alcance su rango normal. Se debe realizar la leucoféresis en el periodo en el que el RAN aumente de < 0,5 x 109/l a > 5,0 x 109/l. En aquellos pacientes que no hayan sido sometidos a quimioterapia extensiva, una única leucoféresis suele ser suficiente. En otras circunstancias, se recomiendan leucoféresis adicionales.
Forma de administración
Filgrastim para la movilización de PBPC cuando se usa en monoterapia:
Filgrastim se puede administrar en perfusión subcutánea continua durante 24 horas o en inyección subcutánea. Para la perfusión, filgrastim se debe diluir en 20 ml de solución de glucosa al 5% (ver sección 6.6).
Filgrastim para la movilización de PBPC tras una quimioterapia mielosupresora:
Filgrastim se debe administrar en inyección subcutánea.
Para la movilización de PBPC en donantes sanos antes del trasplante alogénico de PBPC
Posología
Para la movilización de las PBPC en los donantes sanos, filgrastim debe administrarse en dosis de 1,0 MU/Kg/día (10 gg/Kg/día) durante 4 - 5 días consecutivos. Las leucoféresis deben iniciarse el día 5 y, si fuera necesario, continuar hasta el día 6 con objeto de recoger 4 x 106 células CD34/Kg de peso del receptor.
Forma de administración
Filgrastim se debe administrar en inyección subcutánea.
En pacientes con neutropenia crónica grave (NCG)
Posología
Neutropenia congénita:
La dosis inicial recomendada es de 1,2 MU/Kg/día (12 gg/Kg/día), administrada en dosis única o repartida en varias tomas.
Neutropenia idiopática o cíclica:
La dosis inicial recomendada es de 0,5 MU/Kg/día (5 gg/Kg/día), administrada en dosis única o repartida en varias tomas.
Ajuste de la dosis:
Filgrastim se debe administrar diariamente en inyección subcutánea hasta alcanzar y poder mantener el recuento de neutrófilos por encima de 1,5 x 109/l. Una vez conseguida la respuesta, se establecerá la dosis mínima eficaz para mantener este nivel. Para mantener un recuento de neutrófilos adecuado, es necesaria la administración diaria a largo plazo. Al cabo de 1 - 2 semanas de tratamiento, la dosis inicial se puede duplicar o dividir por la mitad, dependiendo de la respuesta del paciente. Posteriormente, la dosis se puede ajustar individualmente en intervalos de 1 - 2 semanas con el fin de mantener un recuento medio de neutrófilos entre 1,5 x 109/l y 10 x 109/l. En pacientes con infecciones graves se puede proceder a un aumento más rápido de la dosis. En los ensayos clínicos, el 97% de los pacientes que respondieron al tratamiento presentaron una respuesta completa a dosis < 24 ^g/Kg/día. En pacientes con neutropenia crónica grave (NCG), no se ha establecido la seguridad a largo plazo de la administración de filgrastim por encima de 24 ^g/Kg/día.
Forma de administración
Neutropenia congénita, idiopática o cíclica: filgrastim se debe administrar en inyección subcutánea.
En pacientes con infección por VIH
Posología
Para la reversión de la neutropenia:
La dosis inicial recomendada de filgrastim es de 0,1 MU/Kg/día (1 ^g/Kg/día), con ajuste de la dosis hasta un máximo de 0,4 MU/Kg/día (4 ^g/Kg/día) hasta que se alcance y pueda mantener un recuento normal de neutrófilos (RAN > 2,0 x 109/l). En los ensayos clínicos, > 90% de los pacientes respondieron a estas dosis y presentaron una reversión de la neutropenia en una mediana de 2 días.
En un pequeño número de pacientes (< 10%) se necesitaron dosis de hasta 1,0 MU/Kg/día (10 ^g/Kg/día) para revertir la neutropenia.
Para mantener el recuento normal de neutrófilos:
Una vez lograda la reversión de la neutropenia, se debe determinar la dosis mínima eficaz necesaria para mantener el recuento normal de los neutrófilos. Se recomienda comenzar el ajuste de dosis con 30 MU/día (300 ^g/día) cada dos días. Dependiendo del RAN del paciente, puede ser necesario continuar con el ajuste de la dosis con objeto de mantener el recuento de neutrófilos > 2,0 x 109/l. En los ensayos clínicos, se requirió la administración de 30 MU/día (300 ^g/día) durante 1 - 7 días a la semana para mantener el RAN > 2,0 x 109/l, con una mediana de la frecuencia de dosis de 3 días a la semana. Puede ser necesaria una administración a largo plazo para mantener el RAN > 2,0 x 109/l.
Forma de administración
Reversión de la neutropenia o mantenimiento del recuento normal de neutrófilos: filgrastim se debe administrar en inyección subcutánea.
Pacientes de edad avanzada
Los ensayos clínicos con filgrastim han incluido un pequeño número de pacientes de edad avanzada. Pero no se ha realizado ningún estudio especial en este grupo y por lo tanto no es posible establecer una recomendación posológica específica.
Insuficiencia renal
Los estudios sobre filgrastim en pacientes con alteración grave de la función renal o hepática demuestran que su perfil farmacodinámico y farmacocinético es similar al observado en individuos normales. No se requiere ajuste de dosis en estas circunstancias.
Uso pediátrico en el contexto de la neutropenia crónica grave (NCG) y el cáncer
El sesenta y cinco por ciento de los pacientes estudiados en el programa del ensayo sobre NCG eran menores de 18 años. La eficacia del tratamiento quedó clara para este grupo de edad, que incluía a la mayoría de los pacientes con neutropenia congénita. No se observó ninguna diferencia en el perfil de seguridad de los pacientes pediátricos tratados de NCG.
Los datos procedentes de estudios clínicos en pacientes pediátricos indican que la seguridad y la eficacia de filgrastim son similares en adultos y niños tratados con quimioterapia citotóxica.
Las dosis recomendadas en pacientes pediátricos tratados con quimioterapia citotóxica mielosupresora son las mismas que en los adultos.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
Precauciones especiales
Filgrastim no se debe utilizar para aumentar la dosis de quimioterapia citotóxica por encima de las pautas de dosificación establecidas (ver más adelante).
Filgrastrim no se debe administrar a pacientes con neutropenia congénita grave que desarrollen leucemia o tengan evidencia de evolución leucémica.
Se ha notificado la aparición de hipersensibilidad, incluyendo reacciones anafilácticas, en el tratamiento inicial o posterior en pacientes tratados con filgrastim. Suspender permanentemente la administración de Zarzio en los pacientes con hipersensibilidad clínicamente significativa. No administrar Zarzio a los pacientes con antecedentes de hipersensibilidad a filgrastim o pegfilgrastim.
Al igual que con todas las proteínas terapéuticas, existe la posibilidad de que aparezca inmunogenicidad. Por lo general, los índices de generación de anticuerpos contra filgrastim son bajos. Si bien se producen anticuerpos de unión según lo esperado con todos los productos biológicos, estos no se han asociado hasta la fecha con actividad neutralizante.
Quimioterapia citotóxica establecida
Crecimiento de células malignas
El G-CSF puede promover el crecimiento in vitro de las células mieloides y se pueden observar efectos similares in vitro en algunas células no mieloides.
La seguridad y la eficacia de la administración de filgrastim en los pacientes con síndrome mielodisplásico o leucemia mieloide crónica no se conocen todavía. Filgrastim no está indicado en estas enfermedades. Debe ponerse especial cuidado en distinguir el diagnóstico de leucemia mieloide crónica en transformación blástica de leucemia mieloide aguda.
Debido a los pocos datos disponibles sobre seguridad y eficacia en los pacientes con leucemia mieloide aguda (LMA) secundaria, filgrastim debe administrarse con precaución.
La seguridad y la eficacia de la administración de filgrastim en pacientes < 55 años con LMA de novo y buena citogenética [t(8;21), t(15;17) e inv(16)] no han sido establecidas.
Precauciones especiales en los pacientes con cáncer
Se han notificado casos poco frecuentes de esplenomegalia y ruptura esplénica tras la administración de filgrastim. Algunos casos de ruptura esplénica fueron mortales. Se debe considerar un diagnóstico de esplenomegalia o ruptura esplénica en pacientes tratados con filgrastim que refieran dolor en la parte superior izquierda del abdomen y/o dolor en el extremo del hombro.
Leucocitosis
Se han observado recuentos leucocitarios de 100 x 109/l o superiores en menos del 5% de los pacientes tratados con filgrastim en dosis superiores a 0,3 MU/Kg/día (3 pg/Kg/día). No se ha notificado ningún efecto adverso directamente atribuible a este grado de leucocitosis. Sin embargo, dada la posibilidad de que aparezcan reacciones asociadas a esta leucocitosis tan intensa, se debe controlar periódicamente el recuento de leucocitos durante el tratamiento con filgrastim. Si el recuento leucocitario supera un nivel de 50 x 109/l después del nadir teórico, se debe suspender inmediatamente el tratamiento con filgrastim. Sin embargo, durante el periodo de administración de filgrastim para la movilización de PBPC, debe suspenderse o disminuirse la dosis si el recuento de leucocitos aumenta hasta > 70 x 109/l.
Riesgos asociados con el aumento de la dosis de quimioterapia
Se debe tener especial cautela con los pacientes tratados con quimioterapia de altas dosis, ya que no se ha demostrado una mejora de los resultados obtenidos sobre el tumor y la intensificación de las dosis de quimioterapia puede conducir a una mayor toxicidad, incluidos efectos cardiacos, pulmonares, neurológicos y dermatológicos (consulte la ficha técnica o resumen de las características del producto de los distintos agentes quimioterapéuticos utilizados).
El tratamiento con filgrastim en monoterapia no evita la trombocitopenia y la anemia secundarias a la quimioterapia mielosupresora. Debido a la posibilidad de recibir dosis más altas de quimioterapia (p. ej., dosis completas de acuerdo con el protocolo prescrito), el paciente puede estar expuesto a un mayor riesgo de trombocitopenia y anemia. Por ello, es recomendable realizar controles periódicos del recuento plaquetario y del valor hematocrito. Deberán tomarse medidas de precaución especiales cuando se administren agentes quimioterápicos, tanto solos como combinados, con capacidad conocida para producir trombocitopenia grave.
Se ha demostrado que el uso de PBPC movilizadas por filgrastim reduce la intensidad y la duración de la trombocitopenia tras la quimioterapia mielosupresora o mieloablativa.
Otras precauciones especiales
No se han estudiado los efectos de filgrastim en los pacientes con una reducción considerable de los progenitores mieloides. Filgrastim actúa fundamentalmente sobre los precursores de los neutrófilos y ejerce su efecto mediante el aumento del recuento de neutrófilos. Por ello, en los pacientes con disminución de las células precursoras, la respuesta de los neutrófilos puede estar disminuida (como aquellos tratados con radioterapia o quimioterapia extensivas o aquellos con infiltración tumoral de la médula ósea).
Se han notificado ocasionalmente trastornos vasculares, incluyendo la enfermedad venooclusiva y alteraciones del volumen de los fluidos corporales, en pacientes sometidos a altas dosis de quimioterapia seguida de trasplante.
Se han notificado casos de enfermedad del injerto contra el huésped (EICH) y de muerte en pacientes tratados con G-CSF tras un trasplante alogénico de médula ósea (ver las secciones 4.8 y 5.1).
El aumento de la actividad hematopoyética de la médula ósea en respuesta a la terapia con factor de crecimiento se ha asociado con resultados positivos transitorios en las pruebas de imagen ósea. Esto se debe tener en cuenta a la hora de interpretar los resultados de dichas pruebas.
Movilización de PBPC
No hay datos comparativos aleatorizados prospectivamente de los dos métodos de movilización recomendados (filgrastim solo o en combinación con quimioterapia mielosupresora) dentro de la misma población de pacientes. El grado de variación entre cada paciente así como entre las pruebas de laboratorio de las células CD34+ indica que es difícil establecer una comparación directa entre los diferentes estudios. Es difícil, por lo tanto, recomendar un método óptimo. La elección del método de movilización se debería considerar en relación con todos los objetivos del tratamiento para cada paciente en particular.
Exposición previa a agentes citotóxicos
Los pacientes que han sido sometidos a una terapia mielosupresora previa muy extensiva pueden no manifestar una movilización suficiente de las PBPC como para alcanzar el rendimiento mínimo recomendado (> 2,0 x 106 células CD34+/Kg) o una aceleración de la recuperación plaquetaria del mismo grado.
Algunos agentes citotóxicos muestran una especial toxicidad sobre el reservorio progenitor hematopoyético y ello puede afectar negativamente a la movilización de las células progenitoras. Agentes como el melfalán, la carmustina (BCNU) y el carboplatino, cuando se administran durante periodos prolongados previos al intento de movilización de las células progenitoras, pueden reducir el rendimiento del mismo. Sin embargo, la administración de melfalán, carboplatino o BCNU junto con filgrastim ha mostrado ser eficaz en la movilización de las células progenitoras. Cuando se contemple la posibilidad de realizar un trasplante de PBPC, se recomienda planificar el procedimiento de movilización de células madre al comienzo del periodo de tratamiento del paciente. En estos pacientes, antes de administrar altas dosis de quimioterapia, debe prestarse especial atención al número de células progenitoras movilizadas. Si los rendimientos no son adecuados, según los criterios citados anteriormente, se deben considerar otras formas alternativas de tratamiento que no requieran apoyo de células progenitoras.
Valoración del rendimiento de células progenitoras
Se recomienda prestar especial atención al método de cuantificación para valorar el número de células progenitoras recolectadas en los pacientes tratados con filgrastim. Los resultados de los análisis de la citometría de flujo del número de células CD34+ varían en función de la metodología utilizada en cada caso y, por lo tanto, deben interpretarse con precaución las recomendaciones numéricas basadas en estudios realizados en otros laboratorios.
Los análisis estadísticos de la relación entre el número de células CD34+ transfundidas y la velocidad de recuperación plaquetaria tras altas dosis de quimioterapia indican que dicha relación es compleja pero continua.
La recomendación de un rendimiento mínimo > 2,0 x 106 células CD34/Kg se basa en las experiencias publicadas que tuvieron como resultado una reconstitución hematológica adecuada. Los rendimientos superiores a este mínimo parecen correlacionarse con una recuperación más rápida y los inferiores con una recuperación más lenta.
Donantes sanos sometidos a movilización de PBPC
La movilización de PBPC no ofrece ningún beneficio clínico directo a los donantes sanos y solamente debe considerarse en el marco de un trasplante alogénico de células madre.
La movilización de PBPC solamente debe considerarse en donantes que cumplan los criterios de elegibilidad clínicos y de laboratorio estándar para la donación de células madre, prestando especial atención a los valores hematológicos y a las infecciones.
No se han realizado evaluaciones de la seguridad y la eficacia de filgrastim en donantes sanos < 16 años o > 60 años.
Se han notificado casos muy frecuentes de trombocitopenia en pacientes que reciben filgrastim. Por lo tanto, el recuento de plaquetas se debe controlar minuciosamente.
Después de la administración de filgrastim y de los procedimientos de leucoféresis, se ha observado trombocitopenia transitoria (plaquetas < 100 x 109/l) en el 35% de los sujetos estudiados. Entre ellos, se notificaron dos casos con plaquetas < 50 x 109/l que se atribuyeron al procedimiento de leucoféresis.
En caso de ser necesaria más de una leucoféresis, se debe prestar especial atención a los donantes que antes de la aféresis tengan plaquetas < 100 x 109/l; en general, no se recomienda efectuar aféresis si el recuento de plaquetas es < 75 x 109/l.
No deben realizarse leucoféresis a donantes tratados con anticoagulantes o con alteraciones conocidas de la hemostasia.
Debe suspenderse la administración de filgrastim o reducirse su dosis si el recuento de leucocitos alcanza niveles > 70 x 109/l.
Los donantes tratados con G-CSF para la movilización de las PBPC deben controlarse hasta que los índices hematológicos vuelvan a los valores normales.
Se han observado anormalidades citogenéticas transitorias en donantes sanos tratados con G-CSF. Se desconoce el significado de dichos cambios. Aun así, no se puede descartar el riesgo de estimulación de algún clon mieloide maligno. Se recomienda que el centro de aféresis lleve un control y un seguimiento sistemático de los donantes de células progenitoras hematopoyéticas durante al menos 10 años para garantizar la vigilancia de la seguridad a largo plazo.
Se han notificado casos frecuentes, pero generalmente asintomáticos, de aumento del tamaño del bazo y casos poco frecuentes de ruptura esplénica en donantes sanos (y en pacientes) después de la administración de G-CSF. Algunos casos de ruptura esplénica fueron mortales. Por lo tanto, debe realizarse una vigilancia estrecha del tamaño del bazo (p. ej., mediante exploración clínica o ecografía). Debe considerarse un diagnóstico de ruptura esplénica en los donantes y/o pacientes que refieran dolor en la parte superior izquierda del abdomen o en el extremo del hombro.
Se ha notificado disnea con frecuencia y se han notificado otros acontecimientos adversos pulmonares (hemoptisis, hemorragia pulmonar, infiltrados pulmonares e hipoxia) con poca frecuencia en los donantes sanos. En caso de sospecha o confirmación de acontecimientos adversos pulmonares, debe plantearse la interrupción del tratamiento con filgrastim y proporcionarse la atención médica adecuada.
Receptores de PBPC alogénicas movilizadas con filgrastim
Los datos disponibles indican que las interacciones inmunológicas entre el injerto alogénico de PBPC y el receptor pueden estar asociadas a un mayor riesgo de enfermedad del injerto contra el huésped (EICH) aguda o crónica que el trasplante de médula ósea.
Neutropenia crónica grave (NCG)
Hemograma
Se han notificado casos frecuentes de trombocitopenia en pacientes tratados con filgrastim. El recuento de plaquetas se debe controlar cuidadosamente, sobre todo durante las primeras semanas de tratamiento con filgrastim. En pacientes que desarrollen trombocitopenia, es decir, aquellos con un recuento de plaquetas persistentemente < 100.000/mm3, debe valorarse la posibilidad de suspender el tratamiento con filgrastim de forma intermitente o de reducir su dosis.
Existen también otros cambios del hemograma, como anemia y aumento transitorio de los progenitores mieloides, que obligan a vigilar cuidadosamente los recuentos celulares.
Transformación hacia leucemia o síndrome mielodisplásico
Conviene poner especial cuidado en el diagnóstico de neutropenia crónica grave para diferenciarlo de otros trastornos hematopoyéticos como la anemia aplásica, la mielodisplasia y la leucemia mieloide. Antes del tratamiento debe realizarse un hemograma completo con fórmula leucocitaria y recuento de plaquetas, así como un estudio de la morfología de la médula ósea y del cariotipo.
Se ha observado una baja frecuencia (aproximadamente el 3%) de síndrome mielodisplásico (SMD) o leucemia en los pacientes con NCG incluidos en ensayos clínicos que recibieron tratamiento con filgrastim. Esta observación sólo se ha hecho en pacientes con neutropenia congénita. El SMD y las leucemias son complicaciones naturales de la enfermedad y su relación con el tratamiento con filgrastim es incierta. Un subgrupo de aproximadamente el 12% de los pacientes cuyas evaluaciones citogenéticas fueron normales en condiciones basales, presentaron posteriormente anomalías, incluida una monosomía 7, en las evaluaciones repetidas sistemáticas. No está claro en la actualidad si el tratamiento a largo plazo de los pacientes con NCG los predispone a sufrir anomalías citogenéticas,
SMD o transformación leucémica. Se recomienda efectuarles exámenes morfológicos y citogenéticos de la médula ósea en intervalos regulares (aproximadamente cada 12 meses).
Otras precauciones especiales
Se deben excluir las causas de neutropenia transitoria, como las infecciones víricas.
Tras la administración de filgrastim se han notificado casos muy frecuentes de esplenomegalia, y casos frecuentes de ruptura esplénica. Se debe considerarun diagnóstico de esplenomegalia o ruptura esplénica en pacientes tratados con filgrastim que refieran dolor en la parte superior izquierda del abdomen y/o dolor en el extremo del hombro.
La esplenomegalia es una consecuencia directa del tratamiento con filgrastim. El 31% de los pacientes participantes en estudios presentaron esplenomegalia detectable por palpación. El aumento del volumen del bazo, medido radiográficamente, se presentó al comienzo del tratamiento con filgrastim y tendió a estabilizarse. La progresión del aumento del tamaño del bazo disminuyó o quedó frenada al reducir la dosis y sólo un 3% de los pacientes requirieron esplenectomía. Debe evaluarse de forma regular el tamaño del bazo. Para detectar un aumento anómalo del volumen esplénico, basta con realizar una palpación abdominal.
Se observó hematuria frecuente y proteinuria en un pequeño número de pacientes, por lo que es necesario efectuar análisis periódicos de la orina para vigilar esta complicación.
La seguridad y la eficacia de filgrastim no están establecidas en los recién nacidos y en los pacientes con neutropenia autoinmune.
Infección por VIH
Se han notificado de manera frecuente casos de esplenomegalia tras la administración de filgrastim. Se debe considerar un diagnóstico de esplenomegalia o ruptura esplénica en individuos tratados con filgrastim que refieran dolor en la parte superior izquierda del abdomen y/o en el extremo del hombro.
Hemograma
El recuento absoluto de neutrófilos (RAN) debe monitorizarse cuidadosamente, en especial durante las primeras semanas de tratamiento con filgrastim. Algunos pacientes responden muy rápidamente a la dosis inicial de filgrastim con un aumento considerable del recuento de neutrófilos. Se recomienda la medición diaria del RAN durante los 2 - 3 primeros días de tratamiento con filgrastim. A partir de entonces, se recomienda medir el RAN al menos dos veces por semana durante las dos primeras semanas y, posteriormente, una vez a la semana o una vez cada dos semanas durante la terapia de mantenimiento. Durante la administración intermitente de 30 MU/día (300 ^g/día) de filgrastim pueden producirse grandes fluctuaciones del RAN a lo largo del tiempo. Con objeto de determinar el nadir o nivel valle del RAN del paciente, se recomienda que se tomen muestras sanguíneas para medir el RAN inmediatamente antes de la administración de cualquier dosis prevista de filgrastim.
Riesgos asociados con dosis más altas de medicamentos mielosupresores El tratamiento solo con filgrastim no evita la trombocitopenia ni la anemia causadas por los tratamientos mielosupresores. Como consecuencia de la posibilidad de recibir dosis más altas o un mayor número de estos medicamentos con el tratamiento con filgrastim, el paciente puede presentar un riesgo mayor de desarrollar trombocitopenia y anemia. Se recomienda vigilar los recuentos sanguíneos de forma regular (ver más arriba).
Infecciones y enfermedades malignas causantes de mielosupresión
La neutropenia puede deberse a la infiltración de la médula ósea por infecciones oportunistas, como el complejo Mycobacterium avium, o a enfermedades malignas como los linfomas. En los pacientes con enfermedades malignas o infecciones que han infiltrado la médula ósea, se debe considerar la administración de un tratamiento adecuado para dichos trastornos, además de la administración de filgrastim para el tratamiento de la neutropenia. No están bien establecidos los efectos de filgrastim sobre la neutropenia causada por infecciones o tumores con infiltración de la médula ósea.
Rasgo de células falciformes y anemia de células falciformes
Se han notificado crisis de células falciformes, en algunos casos con desenlace mortal, en sujetos con rasgo de células falciformes y anemia de células falciformes tratados con filgrastim. Los médicos deben tener precaución cuando prescriban filgrastim a pacientes con rasgo de células falciformes o anemia de células falciformes.
Otras precauciones especiales
Se han notificado efectos adversos pulmonares, en particular enfermedad pulmonar intersticial, tras la administración de G-CSF. Los pacientes con historia reciente de infiltrados pulmonares o neumonía pueden presentar un mayor riesgo. La aparición de síntomas respiratorios como tos, fiebre y disnea, en asociación con signos radiológicos de infiltrados pulmonares y deterioro de la función pulmonar, puede ser un indicio preliminar de un síndrome de distrés respiratorio agudo (SDRA). En estos casos, se debe suspender la administración de filgrastim y administrar el tratamiento apropiado.
La monitorización de la densidad ósea puede estar indicada en los pacientes que presenten una enfermedad osteoporótica de base y reciban tratamiento continuado con filgrastim durante más de 6 meses.
Se ha notificado síndrome de fuga capilar tras la administración de factores estimuladores de colonias de granulocitos, que se caracteriza por hipotensión, hipoalbuminemia, edema y hemoconcentración. Los pacientes que desarrollan síntomas del síndrome de fuga capilar deben ser supervisados estrechamente y recibir tratamiento sintomático estándar, que puede incluir la necesidad de cuidados intensivos (ver sección 4.8).
Se ha notificado glomerulonefritis en pacientes tratados con filgrastim o pegfilgrastim. Por lo general, los episodios de glomerulonefritis se resolvieron tras la reducción de la dosis o la retirada de filgrastim o pegfilgrastim. Se recomienda vigilancia mediante análisis de orina.
Personas con sensibilidad al látex
El capuchón extraíble de la aguja de esta jeringa precargada contiene un derivado del látex natural. No se ha detectado látex natural en el capuchón extraíble de la aguja hasta la fecha. No obstante, no se ha estudiado el uso de Zarzio solución inyectable en jeringa precargada en personas sensibles al látex, por lo que no se puede descartar totalmente el riesgo de aparición de reacciones de hipersensibilidad.
Excipientes
Zarzio contiene sorbitol (E420). Los pacientes con intolerancia hereditaria a la fructosa no deben usar este medicamento.
Con el fin de mejorar la trazabilidad de factores estimulantes de las colonias de granulocitos (G-CSFs), el nombre comercial del producto administrado debe estar claramente registrado en la historia clínica del paciente.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han establecido definitivamente la seguridad y la eficacia de filgrastim cuando éste se administra el mismo día que la quimioterapia citotóxica mielosupresora. No se recomienda el empleo de filgrastim desde 24 horas antes hasta 24 horas después de la quimioterapia, debido a la sensibilidad de las células mieloides en fase de replicación rápida a la quimioterapia citotóxica mielosupresora. Las evidencias preliminares provenientes de un pequeño número de pacientes tratados concomitantemente con filgastrim y 5-fluorouracilo indican que se puede exacerbar la gravedad de la neutropenia.
Todavía no se han investigado en ensayos clínicos las posibles interacciones con otros factores de crecimiento hematopoyético y citocinas.
Debido a que el litio estimula la liberación de neutrófilos, es probable que potencie el efecto de filgrastim. Aunque esta interacción no se ha investigado formalmente, no hay evidencias de que pueda ser nociva.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No hay datos o éstos son limitados relativos al uso de filgrastim en mujeres embarazadas. Los estudios realizados en animales han mostrado toxicidad para la reproducción. Se ha observado una mayor incidencia de pérdidas embrionarias en los conejos con la utilización de múltiplos elevados de la exposición clínica y en presencia de toxicidad para la madre (ver sección 5.3). En la literatura médica hay publicaciones en las que se demuestra que filgrastim atraviesa la barrera placentaria en las mujeres embarazadas.
No se recomienda utilizar Zarzio durante el embarazo.
Lactancia
Se desconoce si filgrastim/metabolitos se excretan en la leche materna. No se puede excluir el riesgo en recién nacidos/niños. Se debe decidir si es necesario interrumpir la lactancia o interrumpir el tratamiento tras considerar el beneficio de la lactancia para el niño y el beneficio del tratamiento para la madre.
Fertilidad
Filgrastim no afectó a la actividad reproductora ni a la fertilidad en ratas machos ni hembras (ver sección 5.3).
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No se han realizado estudios sobre los efectos sobre la capacidad para conducir y utilizar máquinas.
4.8 Reacciones adversas Resumen del perfil de seguridad
En los ensayos clínicos en pacientes con cáncer, la reacción adversa más frecuente fue el dolor musculoesquelético, de intensidad leve a moderada en un 10% de los pacientes y de forma grave en un 3%.
También se ha notificado enfermedad del injerto contra el huésped (EICH; ver más adelante).
En la movilización de PBPC en donantes sanos, la reacción adversa notificada con mayor frecuencia fue el dolor musculoesquelético. En donantes se ha observado leucocitosis y trombocitopenia tras la administración de filgrastim y leucocitaféresis. También se han notificado casos de esplenomegalia y ruptura esplénica. Algunos casos de ruptura esplénica fueron mortales.
En los pacientes con NCG, las reacciones adversas más frecuentemente relacionadas con filgrastim fueron el dolor óseo, dolor musculoesquelético general y esplenomegalia. Se ha desarrollado síndrome mielodisplásico (SMD) o leucemia en pacientes con neutropenia congénita tratados con filgrastim (ver sección 4.4).
Se ha notificado como una reacción poco frecuente (> 1/1.000 a < 1/100) síndrome de fuga capilar, que puede poner en peligro la vida si se retrasa el tratamiento, en pacientes con cáncer sometidos a quimioterapia y en donantes sanos sometidos a movilización de PBPC, tras la administración de factores estimuladores de colonias de granulocitos; ver más adelante y sección 4.4.
En los estudios clínicos en pacientes con VIH, las únicas reacciones adversas que se consideraron en consistente relación con la administración de filgrastim fueron el dolor musculoesquelético, dolor óseo y mialgia.
Tabla de reacciones adversas
Los datos incluidos en las siguientes tablas describen reacciones adversas notificadas durante ensayos clínicos y en la notificación espontánea. Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia. Se presentan los datos separados para los pacientes con cáncer, movilización de PBPC en donantes sanos, pacientes con NCG y pacientes con VIH, reflejando los diferentes perfiles de reacciones adversas en estas poblaciones.
Tabla 1. Pacientes con cáncer
|
Clasificación de órganos del sistema MedDRA |
Reacciones adversas | ||||
|
Muy frecuentes (>1/10) |
Frecuentes (>1/100 a <1/10) |
Poco frecuentes (>1/1.000 a <1/100) |
Raras (>1/10.000 a <1/1.000) |
Muy raras (<1/10.00 0) | |
|
Trastornos de la sangre y del sistema linfático |
Ruptura esplénicaa Esplenomegali a3, e Crisis de células falciformesa | ||||
|
Trastornos del sistema inmunológico |
Hipersensibili dad a los medicamento sa |
Enfermedad del injerto contra el huéspedb | |||
|
Trastornos del metabolismo y de la nutrición |
Elevación del ácido úrico en sangre Elevación de la lactato deshidrogenasa en sangre Reducción del apetitoa |
Pseudogotaa | |||
|
Clasificación de órganos del sistema MedDRA |
Reacciones adversas | ||||
|
Muy frecuentes (>1/10) |
Frecuentes (>1/100 a <1/10) |
Poco frecuentes (>1/1.000 a <1/100) |
Raras (>1/10.000 a <1/1.000) |
Muy raras (<1/10.00 0) | |
|
Trastornos del sistema nervioso |
Cefalea3 | ||||
|
Trastornos vasculares |
Hipotensión |
Enfermedad venooclusivad Alteraciones del volumen de fluidos Síndrome de fuga capilar1 | |||
|
Trastornos respiratorios, torácicos y mediastínicos |
Dolor orofaríngeo3 Tos3 Disnea |
Hemoptisise |
Síndrome de distrés respiratorio del adultoa Insuficiencia respiratoriaa Edema pulmonara Enfermedad pulmonar intersticiala Infiltración pulmonara Hemorragia pulmonar | ||
|
Trastornos gastrointestina-l es |
Diarrea3 Vómitos3 Estremmientoíi Náuseasa | ||||
|
Trastornos hepatobiliares |
Elevación de la gamma glutamiltransfe-ras a Elevación de la fosfatasa alcalina en sangre | ||||
|
Trastornos de la piel y del tejido subcutáneo |
Exantemaa Alopeciaa |
Síndrome de Sweet Vasculitis cutáneaa | |||
|
Trastornos musculoesquelé-ticos y del tejido conjuntivo |
Dolor musculoesquelé-tic oc |
Exacerbación de la artritis reumatoide | |||
|
Trastornos renales y urinarios |
Disuria |
Anomalía urinaria Glomerulone- fritis | |||
Se han notificado casos de EICH y muerte en pacientes tras un trasplante alogénico de médula ósea (ver más adelante).
|
Clasificación de órganos del sistema MedDRA |
Reacciones adversas | ||||
|
Muy frecuentes (>1/10) |
Frecuentes (>1/100 a <1/10) |
Poco frecuentes (>1/1.000 a <1/100) |
Raras (>1/10.000 a <1/1.000) |
Muy raras (<1/10.00 0) | |
|
Trastornos generales y alteraciones en el lugar de administración |
Astenia3 Fatiga3 Inflamación mucosaa Dolora |
Dolor torácicoa | |||
|
a Ver más ade |
ante. | ||||
b
c
Incluye dolor óseo, dolor de espalda, artralgia, mialgia, dolor de las extremidades, dolor musculoesquelético, dolor torácico musculoesquelético, dolor del cuello.
d
e
Se observaron casos en la situación postcomercialización en pacientes sometidos a trasplantes de médula ósea o a movilización de PBPC.
Se observaron casos en los ensayos clínicos.
Tabla 2. Movilización de PBPC en donantes sanos
|
Clasificación de órganos del sistema MedDRA |
Reacciones adversas | ||||
|
Muy frecuentes (>1/10) |
Frecuentes (>1/100 a <1/10) |
Poco frecuentes (>1/1.000 a <1/100) |
Raras (>1/10.000 a <1/1.000) |
Muy raras (<1/10.000 ) | |
|
Trastornos de la sangre y del sistema linfático |
Trombocitopeniaa Leucocitosisa |
Esplenomegali aa |
Ruptura esplénicaa Crisis de células falciformesa | ||
|
Trastornos del sistema inmunológico |
Reacción anafiláctica | ||||
|
Trastornos del metabolismo y de la nutrición |
Elevación de la lactato deshidrogenasa en sangre |
Hiperuricemia (elevación del ácido úrico en sangre) | |||
|
Trastornos del sistema nervioso |
Cefalea | ||||
|
Trastornos vasculares |
Síndrome de fuga capilar1 | ||||
|
Trastornos respiratorios, torácicos y mediastínicos |
Disnea |
Hemorragia pulmonar Hemoptisis Infiltración pulmonar Hipoxia | |||
|
Trastornos hepatobiliares |
Elevación de la fosfatasa alcalina en sangre |
Elevación de la aspartato aminotransferas a | |||
|
Trastornos musculoesquel é- |
Dolor musculoesquelétic ob |
Agravamiento de la artritis reumatoide | |||
|
Clasificación de órganos del sistema MedDRA |
Reacciones adversas | ||||
|
Muy frecuentes (>1/10) |
Frecuentes (>1/100 a <1/10) |
Poco frecuentes (>1/1.000 a <1/100) |
Raras (>1/10.000 a <1/1.000) |
Muy raras (<1/10.000 ) | |
|
ticos y del tejido conjuntivo | |||||
|
Trastornos renales y urinarios |
Glomerulone- fritis | ||||
|
a Ver más ac |
elante. | ||||
Incluye dolor óseo, dolor de espalda, artralgia, mialgia, dolor de las extremidades, dolor musculoesquelético, dolor torácico musculoesquelético, dolor del cuello.
Tabla 3. Pacientes con NCG
|
Clasificación de órganos del sistema MedDRA |
Reacciones adversas | ||||
|
Muy frecuentes (>1/10) |
Frecuentes (>1/100 a <1/10) |
Poco frecuentes (>1/1.000 a <1/100) |
Raras (>1/10.000 a <1/1.000) |
Muy raras (<1/10.00 0) | |
|
Trastornos de la sangre y del sistema linfático |
Esplenomegaliaa Anemia |
Ruptura esplénicaa Trombocitopeni aa |
Crisis de células falciforme sa | ||
|
Trastornos del metabolismo y de la nutrición |
Hiperuricemia Disminución de la glucosa en sangre Elevación de la lactato deshidrogena sa en sangre | ||||
|
Trastornos del sistema nervioso |
Cefalea | ||||
|
Trastornos respiratorios, torácicos y mediastínicos |
Epistaxis | ||||
|
Trastornos gastrointestinales |
Diarrea | ||||
|
Trastornos hepatobiliares |
Hepatomegalia Elevación de la fosfatasa alcalina en sangre | ||||
|
Trastornos de la piel y del tejido subcutáneo |
Exantema |
Vasculitis cutánea Alopecia | |||
|
Trastornos musculoesquelétic os y del tejido conjuntivo |
Dolor musculoesqueléticob Artralgia |
Osteoporosis | |||
|
Trastornos renales y urinarios |
ematuria Glomerulone- fritis |
Proteinuri a | |||
|
Trastornos generales y |
Reacción en el lugar de la | ||||
|
Clasificación de órganos del sistema MedDRA |
Reacciones adversas | ||||
|
Muy frecuentes (>1/10) |
Frecuentes (>1/100 a <1/10) |
Poco frecuentes (>1/1.000 a <1/100) |
Raras (>1/10.000 a <1/1.000) |
Muy raras (<1/10.00 0) | |
|
alteraciones en el lugar de administración |
inyección | ||||
Ver más adelante.
Incluye dolor óseo, dolor de espalda, artralgia, mialgia, dolor de las extremidades, dolor musculoesquelético, dolor torácico musculoesquelético, dolor del cuello.
Tabla 4. Pacientes con VIH
|
Clasificación de órganos del sistema MedDRA |
Reacciones adversas | ||||
|
Muy frecuentes (>1/10) |
Frecuentes (>1/100 a <1/10) |
Poco frecuentes (>1/1.000 a <1/100) |
Raras (>1/10.000 a <1/1.000) |
Muy raras (<1/10.000 ) | |
|
Trastornos de la sangre y del sistema linfático |
Esplenomegali aa |
Crisis de células falciformes a | |||
|
Trastornos musculoesquelétic os y del tejido conjuntivo |
Dolor musculoesquelétic ob | ||||
|
Trastornos renales y urinarios |
Glomeru- lonefritis | ||||
a
b
Ver más adelante.
Incluye dolor óseo, dolor de espalda, artralgia, mialgia, dolor de las extremidades, dolor musculoesquelético, dolor torácico musculoesquelético, dolor del cuello.
Descripción de ciertas reacciones adversas
Se han notificado casos de EICH y de muerte en pacientes que recibieron G-CSF tras un trasplante alogénico de médula ósea (ver secciones 4.4 y 5.1).
Se han notificado casos de síndrome de fuga capilar en la experiencia postcomercialización con el uso de factores estimuladores de colonias de granulocitos. Estos casos ocurrieron generalmente en pacientes con enfermedades neoplásicas malignas avanzadas, sepsis, tratados con múltiples medicamentos quimioterápicos o sometidos a aféresis (ver sección 4.4).
Pacientes con cáncer
En los ensayos clínicos aleatorizados y controlados con placebo, filgrastim no aumentó la incidencia de reacciones adversas asociadas a la quimioterapia citotóxica. En esos ensayos clínicos, en los pacientes tratados con filgrastim/quimioterapia y con placebo/quimioterapia, las siguientes reacciones adversas se notificaron con la misma frecuencia: náuseas y vómitos, alopecia, diarrea, fatiga, anorexia (reducción del apetito), inflamación mucosa, cefalea, tos, exantema, dolor torácico, astenia, dolor faringolaríngeo (dolor orofaríngeo) y estreñimiento.
En la fase de postcomercialización, se han notificado casos de vasculitis cutánea en pacientes tratados con filgrastim. Se desconoce el mecanismo de la vasculitis en los pacientes que reciben filgrastim. La frecuencia se estima como poco frecuente en base a los datos de los ensayos clínicos.
Se han notificado casos de síndrome de Sweet (dermatosis febril aguda) en la fase de postcomercialización. La frecuencia se estima como poco frecuente a partir de los datos de los ensayos clínicos.
En ensayos clínicos y en la fase de postcomercialización se han notificado reacciones adversas pulmonares, entre ellas neumopatía intersticial, edema pulmonar e infiltración pulmonar, que evolucionaron en algunos casos hacia insuficiencia respiratoria o síndrome de distrés respiratorio del adulto (SDRA), que pueden llegar a ser mortales (ver sección 4.4).
Se han notificado casos poco frecuentes de esplenomegalia y ruptura esplénica tras la administración de filgrastim. Algunos casos de ruptura esplénica fueron mortales (ver sección 4.4).
Se han notificado en los ensayos clínicos y en la fase de postcomercialización reacciones de hipersensibilidad, entre ellas anafilaxia, exantema, urticaria, angioedema, disnea e hipotensión, durante el tratamiento inicial o el tratamiento subsiguiente. En general, las notificacionesfueron más frecuentes tras la administración intravenosa. En algunos casos, los síntomas han reaparecido tras reexposición al medicamento, lo que sugiere la existencia de una relación causal. Se debe suspender definitivamente el tratamiento con filgrastim en aquellos pacientes que desarrollen alguna reacción alérgica grave.
En la experiencia postcomercialización se han notificado casos aislados de crisis de células falciformes en pacientes con rasgo de células falciformes o anemia de células falciformes (ver sección 4.4). La frecuencia se estima como poco frecuente en base a los datos de los ensayos clínicos.
Se han notificado casos de pseudogota en pacientes con cáncer tratados con filgrastim. La frecuencia se estima como poco frecuente en base a los datos de los ensayos clínicos.
Movilización de PBPC en donantes sanos
Se han notificado casos frecuentes, pero generalmente asintomáticos, de esplenomegalia y casos poco frecuentes de ruptura esplénica en donantes sanos y en pacientes después de la administración de filgrastim. Algunos casos de ruptura esplénica fueron mortales (ver sección 4.4).
Se han notificado reacciones adversas pulmonares (hemoptisis, hemorragia pulmonar, infiltración pulmonar, disnea e hipoxia) (Ver sección 4.4).
Se ha observado con poca frecuencia exacerbación de los síntomas de artritis.
Se ha observado leucocitosis (recuento leucocitario > 50 x 109/l) en el 41% de los donantes y trombocitopenia transitoria (plaquetas < 100 x 109/l) tras filgrastim y leucoféresis en el 35% de los donantes (ver sección 4.4).
En pacientes con NCG
Entre las reacciones adversas observadas figura la esplenomegalia, que puede ser progresiva en unos pocos casos, ruptura esplénica y trombocitopenia (ver sección 4.4).
Las reacciones adversas posiblemente relacionadas con el tratamiento con filgrastim y que ocurrieron habitualmente en < 2% de los pacientes con NCG fueron reacción en el lugar de la inyección, cefalea, hepatomegalia, artralgia, alopecia, osteoporosis y exantema.
Durante el uso a largo plazo se ha notificado vasculitis cutánea en el 2% de los pacientes con NCG.
En _pacientes con VIH
Se notificó esplenomegalia relacionada con el tratamiento con filgrastim en < 3% de los pacientes. En todos los casos fue leve o moderada en la exploración física y la evolución clínica fue benigna; a ningún paciente se le diagnosticó hiperesplenismo y ninguno tuvo que someterse a una esplenectomía. Como la esplenomegalia es un hallazgo frecuente en los pacientes con infección por VIH y la mayoría de los pacientes con SIDA lo presentan en mayor o menor grado, su relación con el tratamiento con filgrastim no está clara (ver sección 4.4).
Población pediátrica
Los datos procedentes de estudios clínicos en pacientes pediátricos indican que la seguridad y eficacia de filgrastim son similares en adultos y niños que reciben quimioterapia citotóxica, lo que sugiere que no hay diferencias relacionadas con la edad en la farmacocinética de filgrastim. La única reacción adversa notificada constantemente fue el dolor musculoesquelético, que no es diferente de la experiencia en la población adulta.
No hay datos suficientes para la evaluación adicional del uso de filgrastim en pacientes pediátricos. Otras poblaciones especiales
Uso geriátrico
No se observaron diferencias generales de seguridad o eficacia entre los sujetos de más de 65 años en comparación con sujetos adultos más jóvenes (> 18 años) tratados con quimioterapia citotóxica y la experiencia clínica no ha identificado diferencias de respuesta entre pacientes ancianos y adultos más jóvenes. No hay datos suficientes para la evaluación del uso de filgrastim en sujetos geriátricos para otras indicaciones aprobadas de filgrastim.
Pacientes pediátricos con NCG
Se han notificado casos de reducción de la densidad ósea y osteoporosis en pacientes pediátricos con neutropenia crónica grave que recibían tratamiento crónico con filgrastim. La frecuencia se estima como “frecuente” a partir de los datos de los ensayos clínicos.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Apéndice V.
4.9 Sobredosis
No se han establecido los efectos de la sobredosificación con filgrastim. La interrupción del tratamiento con filgrastim suele ocasionar una reducción del 50% de los neutrófilos circulantes en el plazo de 1 a 2 días, con un retorno a los niveles normales en el plazo de 1 a 7 días.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: inmunoestimulantes, factores estimulantes de colonias, código ATC: L03AA02
Zarzio es un medicamento biosimilar. La información detallada sobre este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
El G-CSF humano es una glucoproteína que regula la producción y la liberación de neutrófilos funcionales de la médula ósea. Zarzio contiene r-metHuG-CSF (filgrastim), que aumenta considerablemente el recuento de neutrófilos en sangre periférica en un plazo de 24 horas, con un incremento de escasa magnitud en las cifras de monocitos. En algunos pacientes con neutropenia crónica grave (NCG), filgrastim también puede inducir un leve aumento de los eosinófilos y basófilos circulantes con respecto a los valores iniciales; algunos de estos pacientes pueden presentar eosinofilia o basofilia ya antes del tratamiento. El incremento del recuento de neutrófilos depende de la dosis cuando se aplica conforme a la posología recomendada. Los neutrófilos producidos en respuesta al filgrastim muestran una función normal o superior a la habitual, de acuerdo con las pruebas de función quimiotáctica y fagocitaria. Después de interrumpir el tratamiento con filgrastim, el recuento de neutrófilos circulantes se reduce un 50% al cabo de 1-2 días y se normaliza en un plazo de 1 a 7 días.
El empleo de filgrastim en pacientes sometidos a quimioterapia citotóxica reduce de forma significativa la incidencia, la gravedad y la duración de la neutropenia y de la neutropenia febril. El tratamiento con filgrastim reduce significativamente la duración de la neutropenia febril, el uso de antibióticos y las hospitalizaciones después del tratamiento de inducción con quimioterapia para la leucemia mieloide aguda o la terapia mieloablativa seguida de trasplante de médula ósea. La incidencia de fiebre e infecciones documentadas no se redujo en ninguna de las dos situaciones citadas. La duración de la fiebre en los pacientes sometidos a terapia mieloablativa seguida de trasplante de médula ósea tampoco disminuyó.
La administración de filgrastim, solo o tras la quimioterapia, moviliza las células progenitoras hematopoyéticas hacia la sangre periférica. Estas PBPC autólogas se pueden recolectar y transfundir después de altas dosis de terapia citotóxica, bien junto con trasplante de médula ósea o en lugar de éste. La transfusión de las PBPC acelera la recuperación hematopoyética, con lo que reduce el periodo de riesgo de complicaciones hemorrágicas y la necesidad de transfusiones plaquetarias.
Los receptores de PBPC alogénicas movilizadas con filgrastim experimentaron una recuperación hematológica significativamente más rápida que los tratados con trasplante alogénico de médula ósea, con una disminución significativa del tiempo transcurrido hasta la recuperación de las plaquetas sin apoyo externo.
Un estudio retrospectivo europeo mediante el que se evaluó el uso de G-CSF tras el trasplante alogénico de médula ósea en pacientes con leucemias agudas sugirió un aumento en el riesgo de EICH, de muerte relacionada con el tratamiento (MRT) y de muerte en los pacientes tratados con G-CSF. En otro estudio internacional retrospectivo en pacientes con leucemias mieloides agudas y crónicas, no se observó efecto alguno sobre el riesgo de EICH, MRT y muerte. Un metaanálisis de los estudios sobre trasplantes alogénicos, incluidos los resultados de nueve ensayos prospectivos aleatorizados, ocho estudios retrospectivos y un estudio de casos y controles, no detectó efectos sobre el riesgo de EICH aguda, EICH crónica o muerte precoz relacionada con el tratamiento.
|
Riesgo relativo (IC del 95%) de EICH y MRT Tras tratamiento con G-CSF después de un trasplante de médula ósea | |||||
|
Publicación |
Periodo de estudio |
N |
EICH aguda de grado II - IV |
EICH crónica |
MRT |
|
Metaanálisis (2003) |
1986 - 2001a |
1198 |
1,08 (0,87, 1,33) |
1,02 (0,82, 1,26) |
0,70 (0,38, 1,31) |
|
Estudio retrospectivo europeo (2004) |
1992 - 2002b |
1789 |
1,33 (1,08, 1,64) |
1,29 (1,02, 1,61) |
1,73 (1,30, 2,32) |
|
Estudio retrospectivo internacional (2006) |
1995 - 2000 b |
2110 |
1,11 (0,86, 1,42) |
1,10 (0,86, 1,39) |
1,26 (0,95, 1,67) |
a
b
El análisis incluye estudios relativos al trasplante de médula ósea durante este periodo; en algunos estudios se utilizó GM-CSF
El análisis incluye pacientes que recibieron un trasplante de la médula ósea durante este periodo
Utilización de filgrastim para la movilización de PBPC en donantes sanos antes del trasplante alogénico de PBPC
En donantes sanos, la administración por vía subcutánea de 1 MU/Kg/día (10 ^g/Kg/día) durante 4 - 5 días consecutivos permite obtener > 4 x 106 células CD34+ por kilogramo de peso del receptor en la mayoría de los donantes después de dos leucoféresis.
El uso de filgrastim en pacientes, tanto niños como adultos, con NCG (neutropenia congénita grave, neutropenia cíclica y neutropenia idiopática) induce un aumento mantenido del recuento absoluto de neutrófilos (RAN) en sangre periférica y una reducción del número de infecciones y procesos relacionados.
La administración de filgrastim a pacientes con infección por VIH mantiene el recuento de neutrófilos en los niveles normales, lo que permite la administración programada del tratamiento antiviral y/u otros medicamentos mielosupresores. No hay evidencia de que los pacientes con infección por VIH tratados con filgrastim presenten un aumento de la replicación del VIH.
Tal como sucede con otros factores de crecimiento hematopoyéticos, el G-CSF ha mostrado propiedades estimulantes in vitro sobre las células endoteliales humanas.
5.2 Propiedades farmacocinéticas
Ensayos cruzados, aleatorizados, doble ciego, de dosis únicas y múltiples, en 204 voluntarios sanos mostraron que el perfil farmacocinético de Zarzio es comparable al del producto de referencia tras su administración subcutánea e intravenosa.
Absorción
Una dosis subcutánea única de 0,5 MU/Kg (5 ^g/Kg) dio lugar a concentraciones séricas máximas tras un tmax de 4,5 ± 0,9 horas (media ± DE).
Distribución
El volumen de distribución en sangre es de alrededor de 150 ml/Kg. Tras la administración subcutánea de las dosis recomendadas, las concentraciones séricas se mantuvieron por encima de 10 ng/ml durante 8 - 16 horas. Existe una correlación lineal positiva entre la dosis y la concentración sérica de filgrastim, tanto administrado por vía intravenosa como por vía subcutánea.
Eliminación
La mediana de la semivida de eliminación sérica (t./2) de filgrastim tras dosis únicas administradas por vía subcutánea osciló desde 2,7 horas (1,0 MU/Kg, 10 ^g/Kg) hasta 5,7 horas (0,25 MU/Kg, 2,5 ^g/Kg) y se prolongó tras siete días de administración a 8,5 - 14 horas, respectivamente.
La perfusión continua de filgrastim a lo largo de un periodo de hasta 28 días en pacientes en fase de recuperación de un trasplante autólogo de médula ósea no reveló datos indicativos de acumulación del medicamento y dio lugar a semividas de eliminación comparables.
5.3 Datos preclínicos sobre seguridad
Filgrastim se ha estudiado en ensayos de toxicidad con dosis repetidas de hasta 1 año de duración, que revelaron cambios atribuibles a las acciones farmacológicas esperadas, como aumento de los leucocitos, hiperplasia mieloide en la médula ósea, granulopoyesis extramedular y aumento del tamaño del bazo. Dichos cambios revertieron al suspender el tratamiento.
Los efectos de filgrastim en el desarrollo prenatal se han estudiado en ratas y conejos. La administración (80 ^g/kg/día) intravenosa de filgrastim a conejos durante el periodo de organogénesis resultó tóxica para la madre; además, se observó un aumento de los abortos espontáneos y de las pérdidas tras la implantación y una disminución del tamaño de la camada y del peso fetal medios.
De acuerdo con los datos notificados en relación con un medicamento con filgrastim similar al de referencia, se observaron resultados semejantes y un aumento de las malformaciones con la dosis de 100 ^g/kg/día, una dosis tóxica para la madre equivalente a una exposición sistémica aproximada de entre 50 y 90 veces la observada en los pacientes tratados con la dosis clínica de 5 ^g/kg/día. La concentración sin efectos adversos observados para la toxicidad embriofetal en este estudio fue de 10 ^g/kg/día, equivalente a una exposición sistémica aproximada de entre 3 y 5 veces la observada en los pacientes tratados con la dosis clínica.
No se observó toxicidad materna ni fetal en ratas gestantes con dosis de hasta 575 ^g/kg/día. Las crías de ratas que recibieron filgrastim durante el periodo perinatal y la lactancia mostraron un retraso en la diferenciación extema y un retraso en el crecimiento (> 20 ^g/kg/día) y una ligera disminución de la tasa de supervivencia (100 ^g/kg/día).
Filgrastim no mostró efectos sobre la fertilidad de ratas machos ni hembras.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Acido glutámico Sorbitol (E420)
Polisorbato 80 Agua para inyectables
6.2 Incompatibilidades
Zarzio no debe diluirse con solución de cloruro sódico.
Este medicamento no debe mezclarse con otros, excepto con los mencionados en la sección 6.6.
Filgrastim diluido puede adsorberse al vidrio y a los materiales plásticos, a menos que esté diluido en solución de glucosa de 50 mg/ml (al 5%) (ver sección 6.6).
6.3 Periodo de validez
36 meses.
Tras la dilución: se ha demostrado que, durante el uso, la solución diluida para perfusión permanece fisicoquímicamente estable durante 24 horas a 2 - 8°C. Desde el punto de vista microbiológico, el producto debe utilizarse inmediatamente. Si no se utiliza de forma inmediata, los tiempos de almacenamiento durante el uso y las condiciones previas al mismo son responsabilidad del usuario y normalmente no deberían sobrepasar las 24 horas a 2 - 8°C, a menos que la dilución se haya realizado en condiciones de asepsia validadas y controladas.
6.4 Precauciones especiales de conservación
Conservar en nevera (entre 2°C y 8°C).
Conservar la jeringa precargada en el embalaje exterior para protegerla de la luz.
Dentro de su periodo de validez y para su uso ambulatorio, el paciente puede sacar el medicamento de la nevera y almacenarlo a temperatura ambiente (no más de 25°C) durante un único periodo máximo de 72 horas. Después de este periodo, el producto no debe volver a refrigerarse y debe desecharse.
Para las condiciones de conservación tras la dilución del medicamento, ver sección 6.3.
6.5 Naturaleza y contenido del envase
Jeringa precargada (de vidrio tipo I) con aguja para inyección (de acero inoxidable), con o sin protector de seguridad para la aguja, que contienen 0,5 ml de solución.
Tamaños de envases correspondientes a 1, 3, 5 o 10 jeringas precargadas.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
La solución debe inspeccionarse visualmente antes del uso. Tan sólo se deben utilizar soluciones transparentes sin partículas.
La exposición accidental a temperaturas de congelación no afecta de forma adversa a la estabilidad de filgrastim.
Zarzio no contiene conservantes. En vista del posible riesgo de contaminación microbiológica, las jeringas de Zarzio son para un sólo uso.
La parte interior del capuchón de la aguja de la jeringa puede contener caucho seco (látex). Las personas sensibles al látex deben tener especial cuidado con Zarzio (ver sección 4.4).
Dilución previa a la administración (opcional)
Zarzio se puede diluir, si es necesario, en una solución de glucosa de 50 mg/ml (al 5%).
No se recomienda en ningún caso diluir a concentraciones finales < 0,2 MU/ml (2 ^g/ml).
En los pacientes tratados con filgrastim diluido hasta concentraciones < 1,5 MU/ml (15 ^g/ml), debe añadirse albúmina sérica humana (ASH) hasta una concentración final de 2 mg/ml.
Ejemplo: si el volumen de inyección final es de 20 ml y la dosis total de filgrastim inferior a 30 MU (300 ^g), deben agregarse 0,2 ml de una solución de albúmina sérica humana de 200 mg/ml (al 20%) Ph. Eur.
Diluido en una solución de glucosa de 50 mg/ml (al 5%), filgrastim es compatible con el vidrio y con diversos plásticos, incluidos el cloruro de polivinilo, la poliolefina (un copolímero de polipropileno y polietileno) y el polipropileno.
Uso de la jeringa precargada con protector de seguridad para la aguja
El protector de seguridad para la aguja cubre ésta tras haber realizado la inyección con el fin de prevenir pinchazos accidentales, lo cual no afecta a la forma de utilizar la jeringa. Empujar el émbolo lenta y uniformemente hasta que se haya administrado la totalidad de la dosis y el émbolo no pueda seguir avanzando. Retirar la jeringa manteniendo la presión sobre el émbolo. El protector de seguridad para la aguja cubrirá ésta una vez que se suelte el émbolo.
Uso de la jeringa precargada sin protector de seguridad para la aguja
Administrar la dosis según el protocolo estándar.
Eliminación
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Sandoz GmbH Biochemiestrasse 10 A-6250 Kundl Austria
8. NÚMEROS DE AUTORIZACIÓN DE COMERCIALIZACIÓN
Zarzio 30 MU/0,5 ml solución inyectable o para perfusión en jeringa precargada
EU/1/08/495/001
EU/1/08/495/002
EU/1/08/495/003
EU/1/08/495/004
EU/1/08/495/009
EU/1/08/495/010
EU/1/08/495/011
EU/1/08/495/012
Zarzio 48 MU/0,5 ml solución inyectable o para perfusión en jeringa precargada
EU/1/08/495/005
EU/1/08/495/006
EU/1/08/495/007
EU/1/08/495/008
EU/1/08/495/013
EU/1/08/495/014
EU/1/08/495/015
EU/1/08/495/016
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 06 de febrero de 2009 Fecha de la última renovación: 13 de noviembre de 2013
10. FECHA DE LA REVISIÓN DEL TEXTO
<{MM/AAAA}>
A. FABRICANTE DEL PRINCIPIO ACTIVO BIOLÓGICO Y TITULAR DE LA AUTORIZACIÓN DE FABRICACIÓN RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
A. FABRICANTE DEL PRINCIPIO ACTIVO BIOLÓGICO Y TITULARES DE LA AUTORIZACIÓN DE FABRICACIÓN RESPONSABLES DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección del fabricante del principio activo biológico
Sandoz GmbH Biochemiestrasse 10 6250 Kundl Austria
Nombre y dirección del fabricante responsable de la liberación de los lotes
Sandoz GmbH Biochemiestrasse 10 AT-6250 Kundl Austria
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica restringida (ver Anexo I: Ficha Técnica o Resumen de las Características del Producto, sección 4.2).
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
Los requerimientos para la presentación de los informes periódicos de seguridad para este medicamento se establecen en la lista de fechas de referencia de la Unión (lista EURD) prevista en el artículo 107ter, párrafo 7, de la Directiva 2001/83/CE y publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado
en la versión del PGR incluido en el Módulo 1.8.2 de la Autorización de Comercialización y en
cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos.
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
1. NOMBRE DEL MEDICAMENTO
Zarzio 30 MU/0,5 ml solución inyectable o para perfusión en jeringa precargada Filgrastim
2. PRINCIPIO(S) ACTIVO(S)
Cada jeringa precargada contiene 30 millones de unidades (equivalentes a 300 microgramos) de filgrastim en 0,5 ml (60 MU/ml).
3. LISTA DE EXCIPIENTES
Excipientes: ácido glutámico, polisorbato 80, agua para preparaciones inyectables y sorbitol (E420). Para más información consultar el prospecto.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Solución inyectable o para perfusión en jeringa precargada.
1 jeringa precargada sin protector de seguridad para la aguja 3 jeringas precargadas sin protector de seguridad para la aguja 5 jeringas precargadas sin protector de seguridad para la aguja 10 jeringas precargadas sin protector de seguridad para la aguja
5. FORMA Y VIA(S) DE ADMINISTRACIÓN
Para un sólo uso. Leer el prospecto antes de utilizar este medicamento. Vías subcutánea o intravenosa.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
Conservar en nevera (entre 2°C y 8°C).
Conservar la jeringa precargada en el embalaje exterior para protegerla de la luz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Sandoz GmbH Biochemiestrasse 10 A-6250 Kundl Austria
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/08/495/009
EU/1/08/495/010
EU/1/08/495/011
EU/1/08/495/012
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Zarzio 30 MU/0,5 ml
1. NOMBRE DEL MEDICAMENTO
Zarzio 48 MU/0,5 ml solución inyectable o para perfusión en jeringa precargada Filgrastim
2. PRINCIPIO(S) ACTIVO(S)
Cada jeringa precargada contiene 48 millones de unidades (equivalentes a 480 microgramos) de filgrastim en 0,5 ml (96 MU/ml).
3. LISTA DE EXCIPIENTES
Excipientes: ácido glutámico, polisorbato 80, agua para preparaciones inyectables y sorbitol (E420). Para más información consultar el prospecto.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Solución inyectable o para perfusión en jeringa precargada.
1 jeringa precargada sin protector de seguridad para la aguja 3 jeringas precargadas sin protector de seguridad para la aguja 5 jeringas precargadas sin protector de seguridad para la aguja 10 jeringas precargadas sin protector de seguridad para la aguja
5. FORMA Y VIA(S) DE ADMINISTRACIÓN
Para un sólo uso. Leer el prospecto antes de utilizar este medicamento. Vías subcutánea o intravenosa.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
Conservar en nevera (entre 2°C y 8°C).
Conservar la jeringa precargada en el embalaje exterior para protegerla de la luz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Sandoz GmbH Biochemiestrasse 10 A-6250 Kundl Austria
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/08/495/013
EU/1/08/495/014
EU/1/08/495/015
EU/1/08/495/016
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Zarzio 48 MU/0,5 ml
CAJA EXTERIOR - JERINGA PRECARGADA CON PROTECTOR DE SEGURIDAD PARA LA AGUJA
1. NOMBRE DEL MEDICAMENTO
Zarzio 30 MU/0,5 ml solución inyectable o para perfusión en jeringa precargada Filgrastim
2. PRINCIPIO(S) ACTIVO(S)
Cada jeringa precargada contiene 30 millones de unidades (equivalentes a 300 microgramos) de filgrastim en 0,5 ml (60 MU/ml).
3. LISTA DE EXCIPIENTES
Excipientes: ácido glutámico, polisorbato 80, agua para preparaciones inyectables y sorbitol (E420). Para más información consultar el prospecto.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Solución inyectable o para perfusión en jeringa precargada.
1 jeringa precargada con protector de seguridad para la aguja 3 jeringas precargadas con protector de seguridad para la aguja 5 jeringas precargadas con protector de seguridad para la aguja 10 jeringas precargadas con protector de seguridad para la aguja
5. FORMA Y VIA(S) DE ADMINISTRACIÓN
Para un sólo uso. Leer el prospecto antes de utilizar este medicamento. Vías subcutánea o intravenosa.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
Conservar en nevera (entre 2°C y 8°C).
Conservar la jeringa precargada en el embalaje exterior para protegerla de la luz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Sandoz GmbH Biochemiestrasse 10 A-6250 Kundl Austria
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/08/495/001
EU/1/08/495/002
EU/1/08/495/003
EU/1/08/495/004
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Zarzio 30 MU/0,5 ml
CAJA EXTERIOR - JERINGA PRECARGADA CON PROTECTOR DE SEGURIDAD PARA LA AGUJA
1. NOMBRE DEL MEDICAMENTO
Zarzio 48 MU/0,5 ml solución inyectable o para perfusión en jeringa precargada Filgrastim
2. PRINCIPIO(S) ACTIVO(S)
Cada jeringa precargada contiene 48 millones de unidades (equivalentes a 480 microgramos) de filgrastim en 0,5 ml (96 MU/ml).
3. LISTA DE EXCIPIENTES
Excipientes: ácido glutámico, polisorbato 80, agua para preparaciones inyectables y sorbitol (E420). Para más información consultar el prospecto.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Solución inyectable o para perfusión en jeringa precargada.
1 jeringa precargada con protector de seguridad para la aguja 3 jeringas precargadas con protector de seguridad para la aguja 5 jeringas precargadas con protector de seguridad para la aguja 10 jeringas precargadas con protector de seguridad para la aguja
5. FORMA Y VIA(S) DE ADMINISTRACIÓN
Para un sólo uso. Leer el prospecto antes de utilizar este medicamento. Vías subcutánea o intravenosa.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
Conservar en nevera (entre 2°C y 8°C).
Conservar la jeringa precargada en el embalaje exterior para protegerla de la luz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Sandoz GmbH Biochemiestrasse 10 A-6250 Kundl Austria
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/08/495/005
EU/1/08/495/006
EU/1/08/495/007
EU/1/08/495/008
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Zarzio 48 MU/0,5 ml
JERINGA PRECARGADA / JERINGA PRECARGADA CON PROTECTOR DE SEGURIDAD PARA LA AGUJA
1. NOMBRE DEL MEDICAMENTO Y VIA(S) DE ADMINISTRACIÓN
Zarzio 30 MU/0,5 ml inyectable o perfusión
Filgrastim
SC/IV
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE
Lot
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
6. OTROS
JERINGA PRECARGADA / JERINGA PRECARGADA CON PROTECTOR DE SEGURIDAD PARA LA AGUJA
1. NOMBRE DEL MEDICAMENTO Y VIA(S) DE ADMINISTRACIÓN
Zarzio 48 MU/0,5 ml inyectable o perfusión
Filgrastim
SC/IV
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE
Lot
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
6. OTROS
B. PROSPECTO
Prospecto: información para el usuario
Zarzio 30 MU/0,5 ml solución inyectable o para perfusión en jeringa precargada
Zarzio 48 MU/0,5 ml solución inyectable o para perfusión en jeringa precargada
Filgrastim
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico, farmacéutico o enfermero.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas
aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico, farmacéutico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es Zarzio y para qué se utiliza
2. Qué necesita saber antes de empezar a usar Zarzio
3. Cómo usar Zarzio
4. Posibles efectos adversos
5. Conservación de Zarzio
6. Contenido del envase e información adicional
1. Qué es Zarzio y para qué se utiliza
Zarzio es un factor de crecimiento de los glóbulos blancos (factor estimulante de las colonias de granulocitos) y pertenece a un grupo de medicamentos denominados citocinas. Los factores de crecimiento son proteínas que se producen de manera natural en el organismo pero también se pueden elaborar mediante biotecnología para su uso como medicamentos. Zarzio actúa haciendo que la médula ósea produzca más glóbulos blancos.
Una reducción del número de glóbulos blancos (neutropenia) puede producirse por motivos diversos y hace que su cuerpo tenga menos posibilidades de luchar contra las infecciones. Zarzio estimula la médula ósea para producir rápidamente nuevos glóbulos blancos.
Zarzio se puede utilizar:
• para aumentar el número de glóbulos blancos tras el tratamiento con quimioterapia para ayudar a prevenir infecciones;
• para aumentar el número de glóbulos blancos tras un trasplante de médula ósea para ayudar a prevenir infecciones;
• antes de someterse a quimioterapia de altas dosis para que la médula ósea produzca más células madre que se pueden recoger y que se le pueden devolver al organismo después del tratamiento. Éstas pueden extraerse de usted mismo o de un donante. Las células madre regresarán después a la médula ósea y producirán células sanguíneas;
• para aumentar el número de glóbulos blancos si padece neutropenia crónica grave para ayudarle a prevenir infecciones;
• en pacientes con infección VIH avanzada para ayudar a reducir el riesgo de infecciones.
2. Qué necesita saber antes de empezar a usar Zarzio No use Zarzio
- si es alérgico a filgrastim o a alguno de los demás componentes de este medicamento (incluidos en la sección 6).
Advertencias y precauciones
Consulte a su médico, farmacéutico o enfermero antes de empezar a usar Zarzio.
Tenga especial cuidado con Zarzio si ha tenido alguna vez una reacción alérgica al látex.
Informe a su médico antes de iniciar el tratamiento si tiene:
- osteoporosis (enfermedad de los huesos);
- anemia de células falciformes ya que Zarzio puede provocar crisis de células falciformes. Informe a su médico inmediatamente durante el tratamiento con Zarzio, si:
- siente dolor en la parte superior izquierda del abdomen, dolor en el lado izquierdo inferior de la caja torácica o dolor en el extremo del hombro izquierdo (estos pueden ser síntomas de un aumento de tamaño del bazo [esplenomegalia] o de una posible ruptura del mismo).
- tiene sangrados o hematomas (moratones) inusuales (estos pueden ser síntomas de una disminución de las plaquetas sanguíneas [trombocitopenia], con la consiguiente reducción de la capacidad de la sangre para formar coágulos).
- presenta signos repentinos de alergia, como erupción, picazón o habones urticariales en la piel, hinchazón de la cara, los labios, la lengua u otras partes del cuerpo, respiración difícil, sonido silbante que se produce al respirar (sibilancia) o dificultad para respirar, ya que podrían ser signos de una reacción alérgica grave.
- presenta hinchazón en la cara o en los tobillos, sangre en la orina o si su orina es de color marrón o si advierte que orina menos de lo habitual.
Pérdida de respuesta a filgrastim
Si sufre pérdida de respuesta al tratamiento con filgrastim o esta no se mantiene, su médico estudiará los motivos, por ejemplo, si ha producido anticuerpos que neutralizan la actividad de filgrastim.
Es posible que su médico desee vigilarle atentamente; ver sección 4 del prospecto.
Si es usted un paciente con neutropenia crónica grave, puede tener riesgo de desarrollar un cáncer de la sangre (leucemia, síndrome mielodisplásico [MDS]). Debe consultar con su médico sobre su riesgo de desarrollar cáncer de sangre y qué pruebas deben hacerse. Si desarrolla o es probable que desarrolle cáncer de sangre, no debe usar Zarzio a menos que se lo indique su médico.
Si es donante de células madre, debe usted tener entre 16 y 60 años de edad.
Tenga especial cuidado con otros productos que estimulan los glóbulos blancos.
Zarzio pertenece a un grupo de medicamentos que estimulan la producción de glóbulos blancos. El profesional sanitario que le atienda siempre debe registrar en su historial el producto exacto que está usando.
Uso de Zarzio con otros medicamentos
Informe a su médico o farmacéutico si está tomando, ha tomado recientemente o podría tener que tomar cualquier otro medicamento.
Embarazo, lactancia y fertilidad
Zarzio no se ha probado en mujeres embarazadas o en periodo de lactancia.
Es importante que informe a su médico si:
• está embarazada,
• cree que puede estarlo o
• planea quedarse embarazada.
Si se queda embarazada durante el tratamiento con Zarzio, informe a su médico.
A menos que su médico le indique otra cosa, debe interrumpir la lactancia si usa Zarzio.
Conducción y uso de máquinas
Zarzio no debería afectar a su capacidad para conducir y utilizar máquinas. No obstante, es aconsejable esperar a ver cómo se siente después de usar Zarzio y antes de conducir o manejar maquinaria.
Zarzio contiene sorbitol
Zarzio contiene sorbitol (E420); si su médico le ha indicado que padece una reacción a ciertos azúcares, consulte con él antes de usar este medicamento.
3. Cómo usar Zarzio
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico. En caso de duda, consulte de nuevo a su médico o farmacéutico.
¿Cómo se administra Zarzio y qué cantidad debo usar?
Zarzio se administra habitualmente como una inyección diaria en el tejido situado justo debajo de la piel (es lo que se llama una inyección subcutánea). También se puede administrar como una inyección diaria lenta en la vena (lo que se conoce como infusión intravenosa). La dosis habitual varía en función de su enfermedad y peso. Su médico le indicará la cantidad de Zarzio que debe usar.
Pacientes a los que se realiza un trasplante de médula ósea después de la quimioterapia:
Generalmente recibirá la primera dosis de Zarzio al menos 24 horas después de la quimioterapia y al menos 24 horas después de la realización del trasplante de médula ósea.
Usted, o las personas que lo cuidan, pueden recibir formación sobre cómo administrar inyecciones subcutáneas para que pueda continuar el tratamiento en su domicilio. No obstante, no debe intentarlo hasta que un profesional sanitario le haya enseñado primero correctamente cómo hacerlo.
¿Durante cuánto tiempo deberé usar Zarzio?
Deberá usar Zarzio hasta que su recuento de glóbulos blancos sea normal. Se le harán análisis de sangre periódicos para controlar el número de glóbulos blancos de su cuerpo. Su médico le indicará durante cuánto tiempo necesitará utilizar Zarzio.
Uso en niños
Zarzio se utiliza para tratar a niños que reciben quimioterapia o que tienen un recuento de glóbulos blancos muy bajo (neutropenia). La dosis para niños que reciben quimioterapia es igual que para adultos.
Si usa más Zarzio del que debe
No aumente la dosis que su médico le ha indicado. Si cree que se ha inyectado más del que debe, contacte con su médico lo antes posible.
Si olvidó usar Zarzio
Si olvidó una inyección, o la cantidad inyectada es demasiado pequeña, contacte con su médico lo antes posible. No use una dosis doble para compensar las dosis olvidadas.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico, farmacéutico o enfermero.
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Informe a su médico inmediatamente durante el tratamiento:
• si tiene una reacción alérgica que incluye debilidad, disminución de la presión arterial, dificultad respiratoria, hinchazón de la cara (anafilaxia), erupción cutánea, erupción con picor (urticaria), hinchazón de la cara, los labios, la lengua o la garganta (angioedema) y dificultad para respirar (disnea). La hipersensibilidad es frecuente en pacientes con cáncer.
• si tiene tos, fiebre y dificultades respiratorias (disnea), ya que podrían ser signos de un síndrome de distrés respiratorio agudo (SDRA). El SDRA es poco frecuente en pacientes con cáncer.
• si tiene dolor en la parte superior izquierda del abdomen, dolor en el lado izquierdo inferior de la caja torácica o dolor en el extremo del hombro, ya que podría haber algún problema en el bazo (aumento del tamaño del bazo [esplenomegalia] o ruptura del bazo).
• si está en tratamiento para la neutropenia crónica grave y tiene sangre en la orina (hematuria).
Su médico puede realizarle análisis de orina regularmente en el caso de que presente este efecto adverso o en el caso de tener proteínas en la orina (proteinuria).
• si experimenta alguno o una combinación de los siguientes efectos adversos:
- hinchazón, que puede estar asociado con orinar con una menor frecuencia, dificultad para respirar, hinchazón y sensación de plenitud en abdomen y una sensación general de cansancio. Estos síntomas generalmente se desarrollan muy rápidamente.
Estos pueden ser síntomas de una enfermedad que ocurre poco frecuentemente (que puede afectar hasta 1 de cada 100 personas) llamada “síndrome de fuga capilar” y que puede causar que la sangre se escape de los vasos sanguíneos pequeños hacia otros lugares de su cuerpo y necesite atención médica urgente.
• si experimenta lesión renal (glomerulonefritis). Se ha observado lesión renal en pacientes tratados con filgrastim. Llame inmediatamente a su médico si presenta hinchazón en la cara o en los tobillos, sangre en la orina o si su orina es de color marrón o si advierte que orina menos de lo habitual.
Un efecto adverso muy frecuente de filgrastim es dolor en los músculos o en los huesos (dolor musculoesqueletico), que se puede aliviar tomando analgésicos comunes. Los pacientes que se someten a un trasplante de células madre o de médula ósea, pueden padecer la enfermedad de injerto contra el huésped (EICH) - ésta es una reacción de las células del donante contra el paciente que recibe el trasplante, cuyos signos y síntomas incluyen erupción en las palmas de las manos o plantas de los pies y úlceras y llagas en la boca, intestino, hígado, piel, o en los ojos, pulmones, vagina y articulaciones. En donantes de células madre sanos se observa muy frecuentemente un aumento en los glóbulos blancos de la sangre (leucocitosis) y una disminución de las plaquetas reduciéndose la capacidad de coagulación de la sangre (trombocitopenia), ambos serán vigilados por su médico.
Efectos adversos muy frecuentes (pueden afectar a más de 1 de cada 10 personas que utilizan Zarzio)
En pacientes con cáncer
• cambios en los parámetros bioquímicos de la sangre
• aumento de algunas enzimas de la sangre
• disminución del apetito
• dolor de cabeza
• dolor en la boca y garganta (dolor orofaríngeo)
• tos
• diarrea
• vómitos
• estreñimiento
• náuseas
• erupción cutánea
• debilitamiento o pérdida de cabello inusual (alopecia)
• dolor en los músculos o en los huesos (dolor musculoesquelético)
• debilidad generalizada (astenia)
• cansancio (fatiga)
• irritación e hinchazón de la mucosa digestiva que va de la boca al ano (inflamación de la mucosa)
• dificultad para respirar (disnea)
• dolor
En donantes sanos de células madre
• disminución de las plaquetas reduciéndose la capacidad de coagulación de la sangre (trombocitopenia)
• aumento de los glóbulos blancos (leucocitosis)
• dolor de cabeza
• dolor de músculos o en los huesos (dolor musculoesquelético)
En pacientes con neutropenia crónica grave
• aumento del tamaño del bazo (esplenomegalia)
• recuento bajo de glóbulos rojos (anemia)
• cambios en los parámetros bioquímicos de la sangre
• aumento de algunas enzimas de la sangre
• dolor de cabeza
• hemorragia nasal (epistaxis)
• diarrea
• aumento de tamaño del hígado (hepatomegalia)
• erupción cutánea
• dolor en los músculos o en los huesos (dolor musculoesquelético)
• dolor en las articulaciones (artralgia)
En pacientes con VIH
• dolor en los músculos o en los huesos (dolor musculoesquelético)
Efectos adversos frecuentes (pueden afectar hasta 1 de cada 10 personas que utilizan Zarzio)
En pacientes con cáncer
• reacción alérgica (hipersensibilidad a los medicamentos)
• tensión arterial baja (hipotensión)
• dolor al orinar (disuria)
• dolor en el pecho
• toser sangre (hemoptisis)
En donantes sanos de células madre
• aumento de algunas enzimas en la sangre
• dificultad para respirar (disnea)
• aumento del tamaño del bazo (esplenomegalia)
En pacientes con neutropenia crónica grave
• ruptura del bazo
• disminución de las plaquetas lo que reduce la capacidad de coagulación de la sangre (trombocitopenia)
• cambios en los parámetros bioquímicos de la sangre
• inflamación de los vasos sanguíneos de la piel (vasculitis cutánea)
• debilitamiento o pérdida de cabello inusual (alopecia)
• enfermedad que produce una disminución de la densidad de los huesos, lo que los hace más débiles, más frágiles y más propensos a romperse (osteoporosis)
• sangre en la orina (hematuria)
• dolor en el lugar de la inyección
• lesión de los diminutos filtros existentes en el interior de sus riñones (glomerulonefritis)
En pacientes con VIH
• aumento del tamaño del bazo (esplenomegalia)
Efectos adversos poco frecuentes (pueden afectar hasta 1 de cada 100 personas que utilizan Zarzio)
En pacientes con cáncer
• ruptura del bazo
• aumento del tamaño del bazo (esplenomegalia)
• dolor intenso en los huesos, pecho, intestino o articulaciones (crisis de células falciformes)
• rechazo de la médula ósea trasplantada (enfermedad del injerto contra el huésped)
• dolor e hinchazón de las articulaciones, similar a la gota (pseudogota)
• inflamación grave de los pulmones que causa dificultad para respirar (síndrome de distrés respiratorio del adulto)
• funcionamiento anormal de los pulmones, causando falta de aliento (insuficiencia respiratoria)
• hinchazón o líquido en los pulmones (edema pulmonar)
• inflamación de los pulmones (enfermedad pulmonar intersticial)
• anomalías radiológicas de los pulmones (infiltración pulmonar)
• úlceras dolorosas de color rojo oscuro en las extremidades y, a veces, la cara y el cuello que cursan con fiebre (síndrome de Sweet)
• inflamación de los vasos sanguíneos de la piel (vasculitis cutánea)
• empeoramiento de la artritis reumatoide
• cambio anormal en la orina
• dolor
• lesión hepática causada por la obstrucción de las venas pequeñas del hígado (enfermedad venooclusiva)
• sangrado del pulmón (hemorragia pulmonar)
• un cambio en la forma que el cuerpo regula los fluidos corporales que puede causar hinchazón
• lesión de los diminutos filtros existentes en el interior de sus riñones (glomerulonefritis)
En donantes sanos de células madre
• ruptura del bazo
• dolor intenso en los huesos, el pecho, el intestino o las articulaciones (crisis de células falciformes)
• reacción alérgica repentina que ponga en peligro la vida (reacción anafiláctica)
• cambios en los parámetros bioquímicos de la sangre
• sangrado de los pulmones (hemorragia pulmonar)
• tos con sangre (hemoptisis)
• anomalías radiológicas de los pulmones (infiltración pulmonar)
• falta de absorción de oxígeno en los pulmones (hipoxia)
• aumento de algunas enzimas de la sangre
• empeoramiento de la artritis reumatoide
• lesión de los diminutos filtros existentes en el interior de sus riñones (glomerulonefritis)
En pacientes con neutropenia crónica grave
• dolor intenso en los huesos, el pecho, el intestino o las articulaciones (crisis de células falciformes)
• exceso de proteínas en la orina (proteinuria)
En pacientes con VIH
• dolor intenso en los huesos, el pecho, el intestino o las articulaciones (crisis de células falciformes)
Efectos adversos de frecuencia no conocida (la frecuencia no puede estimarse a partir de los datos disponibles):
• lesión de los diminutos filtros existentes en el interior de sus riñones (glomerulonefritis)
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Zarzio
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la caja y en la etiqueta de la jeringa después de CAD y EXP, respectivamente. La fecha de caducidad es el último día del mes que se indica.
Conservar en nevera (entre 2°C y 8°C).
Conservar la jeringa precargada en el embalaje exterior para protegerla de la luz.
La congelación accidental no provocará daños en Zarzio.
La jeringa puede sacarse de la nevera y dejarse a temperatura ambiente durante un periodo único máximo de 72 horas (pero a una temperatura no superior a 25°C). Después de este periodo, el producto no debe volver a refrigerarse y debe desecharse.
No utilice este medicamento si observa decoloración, turbidez o partículas; debe ser un líquido transparente, entre incoloro y ligeramente amarillento.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de Zarzio
- El principio activo es filgrastim.
Zarzio 30 MU/0,5 ml solución inyectable o para perfusión en jeringa precargada: cada jeringa precargada contiene 30 MU de filgrastim en 0,5 ml, que corresponden a 60 MU/ml.
Zarzio 48 MU/0,5 ml solución inyectable o para perfusión en jeringa precargada: cada jeringa precargada contiene 48 MU de filgrastim en 0,5 ml, que corresponden a 96 MU/ml.
- Los demás componentes son ácido glutámico, sorbitol (E420), polisorbato 80 y agua para preparaciones inyectables.
- El capuchón de la aguja de la jeringa puede contener caucho seco (látex).
Aspecto del producto y contenido del envase
Zarzio es una solución inyectable o para perfusión transparente y de aspecto incoloro a ligeramente amarillento, que se suministra en jeringa precargada.
Zarzio se encuentra disponible en envases de 1, 3, 5 o 10 jeringas precargadas con aguja de inyección y con o sin protector de seguridad para la aguja.
Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización y responsable de la fabricación
Sandoz GmbH Biochemiestrasse 10
A-6250 Kundl Austria
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
|
Belgie/Belgique/Belgien Sandoz nv-sa Tél/Tel: +32 2 722 97 97 |
Lietuva Sandoz Pharmaceuticals d.d filialas Tel: +370 5 2636 037 |
|
Etarapna TtproBCKO npegcTaBHTeacTBO CaHgo3 g.g. Tea.: +359 2 970 47 47 |
Luxembourg/Luxemburg Sandoz GmbH Tel: +43 5338 200 |
|
Ceská republika Sandoz s.r.o. Tel: +420 221 421 611 |
Magyarország Sandoz Hungária Kft. Tel.: +36 1 430 2890 |
|
Danmark/Norge/Ísland/Sverige Sandoz A/S Tlf/Sími /Tel: +45 63 95 10 00 |
Malta Sandoz GmbH Tel: +43 5338 200 |
|
Deutschland Hexal AG Tel: +49 8024 908 0 |
Nederland Sandoz B.V. Tel: +31 36 52 41 600 |
|
Eesti Sandoz d.d. Eesti filiaal Tel: +372 665 2400 |
Osterreich Sandoz GmbH Tel: +43 5338 2000 |
|
EXXáSa Sandoz Pharmaceuticals d.d, Tn^: +30 216 600 5000 n DEMO Avróvu^og Bio^nxaviKq Kai E^nopiKq Eraipsía Tea.: +30 210 816 18 02 |
Polska Sandoz Polska Sp. z o.o. Tel.: +48 22 209 70 00 |
|
España Sandoz Farmacéutica, S.A. Tlf: +34 900 456 856 |
Portugal Sandoz Farmacéutica Lda. Tel: +351 21 924 19 11 |
|
France Sandoz SAS Tél: +33 1 49 64 48 00 |
Romania S.C. Sandoz Pharma Services S.R.L. Tel: +40 21 4075160 |
|
Hrvatska Sandoz d.o.o. Tel: +385 1 23 53 111 |
Slovenija Lek farmacevtska druzba d.d. Tel: +386 1 580 21 11 |
|
Ireland Novartis Ireland Limited Tel: +353 1 260 12 55 |
Slovenská republika Sandoz d.d. - organizacná zlozka Tel: +421 2 48 200 600 |
Italia
Suomi/Finland
Sandoz A/S
Puh/Tel: +358 10 6133 415
United Kingdom
Sandoz Ltd
Tel: +44 1276 69 8020
Sandoz S.p.A.
Tel: +39 02 96541
Kúrcpog
P.T.Hadjigeorgiou co ltd Tel: +357 25372425
Latvija
Sandoz d.d. Párstávnieciba Latvija Tel: +371 67 892 006
Fecha de la última revisión de este prospecto: {MM/AAAA}
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos (EMA): http://www.ema.europa.eu/.
Instrucciones de autoinyección
Esta sección contiene información sobre cómo administrarse usted mismo una inyección de Zarzio. Es importante que no intente administrarse la inyección sin que antes su médico o profesional de enfermería le haya explicado cómo hacerlo. Zarzio puede suministrarse o no con un protector de seguridad para la aguja, que su médico o profesional de enfermería le enseñará a utilizar. Si no está seguro de querer administrarse la inyección a usted mismo o tiene alguna pregunta, consulte a su médico o profesional de enfermería.
1. Lávese las manos.
2. Extraiga una jeringa del paquete y retire la tapa protectora de la aguja para inyección. Las jeringas tienen grabados anillos de graduación para permitir su uso parcial si es necesario. Cada anillo de graduación corresponde a un volumen de 0,1 ml. Si es necesario el uso parcial de una jeringa, retire la solución no deseada antes de la inyección.
3. Limpie la piel en el lugar de la inyección con una compresa con alcohol.
4. Forme un pliegue de la piel pellizcándola entre el pulgar y el índice.
5. Inserte la aguja en el pliegue de la piel con un movimiento rápido y firme. Inyecte la solución de Zarzio como le ha indicado su médico. En caso de duda, debe consultar de nuevo a su médico o farmacéutico.
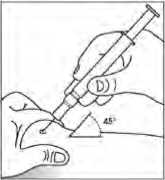
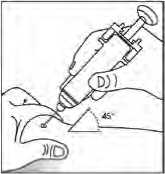
Jeringa precargada sin protector de seguridad para la aguja
6. Manteniendo la piel pellizcada, presione el émbolo lenta y uniformemente.
7. Una vez inyectado el líquido, retire la aguja y suelte la piel.
8. Introduzca la jeringa usada en el recipiente especial de desecho. Use cada jeringa sólo para una inyección.
Jeringa precargada con protector de seguridad para la aguja
6.
7.
8.
Manteniendo la piel pellizcada, presione el émbolo lenta y uniformemente hasta que se haya administrado la totalidad de la dosis y el émbolo no pueda avanzar más. ¡No deje de mantener la presión sobre el émbolo!
Una vez inyectado el líquido, retire la aguja mientras mantiene la presión sobre el émbolo y suelte la piel.
Suelte el émbolo. El protector de seguridad para la aguja se desplazará rápidamente hasta cubrir la aguja.
9. Deseche cualquier producto no utilizado o material de desecho. Use cada jeringa sólo para una inyección.
Esta información está destinada únicamente a profesionales del sector sanitario:
La solución debe inspeccionarse visualmente antes del uso. Tan sólo se deben utilizar soluciones transparentes sin partículas. La exposición accidental a temperaturas de congelación no afecta de forma adversa a la estabilidad de Zarzio.
Zarzio no contiene conservantes: en vista del posible riesgo de contaminación microbiológica, las jeringas de Zarzio son para un solo uso.
El capuchón de la aguja de la jeringa puede contener caucho seco (látex), que no debe ser manipulado por personas con sensibilidad a esta sustancia.
Dilución previa a la administración (opcional)
Zarzio se puede diluir, si es necesario, en una solución glucosa de 50 mg/ml (al 5%). Zarzio no debe diluirse con soluciones de cloruro sódico.
No se recomienda en ningún caso diluir a concentraciones finales < 0,2 MU/ml (2 ^g/ml).
En los pacientes tratados con filgrastim diluido a concentraciones < 1,5 MU/ml (15 ^g/ml), debe añadirse albúmina sérica humana (ASH) hasta una concentración final de 2 mg/ml.
Ejemplo: si el volumen de inyección final es de 20 ml y la dosis total de filgrastim inferior a 30 MU (300 ^g), deben agregarse 0,2 ml de una solución de albúmina sérica humana de 200 mg/ml (al 20%) Ph. Eur.
Diluido en una solución glucosa de 50 mg/ml (al 5%), filgrastim es compatible con el vidrio y con diversos plásticos, incluidos el cloruro de polivinilo, la poliolefina (un copolímero de polipropileno y polietileno) y el polipropileno.
Tras la dilución: se ha demostrado que, durante el uso, la solución diluida para perfusión permanece fisicoquímicamente estable durante 24 horas a 2 - 8°C. Desde el punto de vista microbiológico, el producto debe utilizarse inmediatamente. Si no se utiliza de forma inmediata, los tiempos de almacenamiento durante el uso y las condiciones previas al mismo son responsabilidad del usuario y normalmente no deberían sobrepasar las 24 horas a 2 - 8°C, a menos que la dilución se haya realizado en condiciones de asepsia validadas y controladas.
Uso de la jeringa precargada con protector de seguridad para la aguja
El protector de seguridad para la aguja cubre ésta tras haber realizado la inyección con el fin de prevenir pinchazos accidentales. Ello no afecta a la forma de utilizar la jeringa. Empujar el émbolo lenta y uniformemente hasta que se haya administrado la totalidad de la dosis y el émbolo no pueda seguir avanzando. Retirar la jeringa manteniendo la presión sobre el émbolo. El protector de seguridad para la aguja cubrirá ésta una vez que se suelte el émbolo.
Uso de la jeringa precargada sin protector de seguridad para la aguja
Administrar la dosis según el protocolo estándar.
Eliminación
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
49