Yanimo Respimat 2,5 Microgramos / 2,5 Microgramos Solucion Para Inhalacion
¡m
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
Yanimo Respimat 2,5 microgramos/2,5 microgramos, solución para inhalación
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
La dosis liberada es de 2,5 microgramos de tiotropio (como bromuro monohidrato) y 2,5 microgramos de olodaterol (como hidrocloruro) por pulsación.
La dosis liberada es la dosis disponible para el paciente después de pasar por la boquilla.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Solución para inhalación
Solución para inhalación transparente, incolora
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Yanimo Respimat está indicado como tratamiento broncodilatador de mantenimiento para aliviar los síntomas en pacientes adultos con enfermedad pulmonar obstructiva crónica (EPOC).
4.2 Posología y forma de administración
4.2.1 Posología
Este medicamento es únicamente para uso por vía inhalatoria. El cartucho sólo puede introducirse y utilizarse con el inhalador Respimat.
Una dosis son dos pulsaciones del inhalador Respimat.
Adultos
La dosis recomendada es de 5 microgramos de tiotropio y 5 microgramos de olodaterol administrados en dos pulsaciones mediante el inhalador Respimat una vez al día y a la misma hora.
No debe superarse la dosis recomendada.
Población de edad avanzada
Los pacientes de edad avanzada pueden utilizar Yanimo Respimat a la dosis recomendada.
Insuficiencia hepática e insuficiencia renal
Yanimo Respimat contiene tiotropio que se excreta predominantemente por vía renal y olodaterol que se metaboliza predominantemente en el hígado.
Insuficiencia hepática
Los pacientes con insuficiencia hepática leve o moderada pueden utilizar Yanimo Respimat a la dosis recomendada.
milite:
No se dispone de datos sobre el uso de olodaterol en pacientes con insuficiencia hepática grave.
Insuficiencia renal
Los pacientes con insuficiencia renal pueden utilizar Yanimo Respimat a la dosis recomendada.
En pacientes con insuficiencia moderada a grave (aclaramiento de creatinina < 50 ml/min) ver 4.4 y 5.2.
Yanimo Respimat contiene olodaterol. La experiencia con el uso de olodaterol en pacientes con insuficiencia renal grave es limitada.
Población pediátrica
No existe una recomendación de uso específica para Yanimo Respimat en la población pediátrica (menores de 18 años).
4.2.2 Forma de administración
Para asegurar la correcta administración del medicamento, el paciente debe ser instruido por un médico u otros profesionales sanitarios sobre cómo usar el inhalador.
Instrucciones de Uso Introducción
Yanimo Respimat (bromuro de tiotropio y olodaterol). Lea estas Instrucciones de Uso antes de empezar a usar Yanimo Respimat.
Necesitará usar este inhalador UNA VEZ AL DÍA. Cada vez que lo use, realice DOS PULSACIONES.
CIERRE DE SEGURIDAD
BASE TRANSPARENTE ELEMENTO PERFORADOR
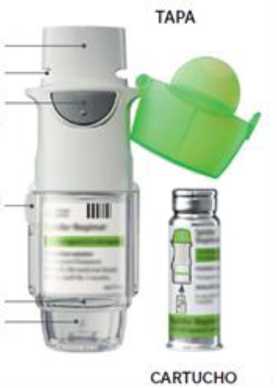
BOQUILLA VÁLVULA DE AIRE
BOTÓN DE LIBERACIÓN DE DOSIS
• Si no ha utilizado Yanimo Respimat durante más de 7 días realice una pulsación hacia el suelo.
• Si no ha utilizado Yanimo Respimat durante más de 21 días, repita los pasos del 4 al 6 descritos en “Preparación para el primer uso” hasta que observe una nube. Entonces repita los pasos del 4 al 6 tres veces más.
• No tocar el elemento perforador de dentro de la base transparente.
¡m
Cómo mantener su Yanimo Respimat
Limpie la boquilla incluyendo la parte metálica que se encuentra dentro de la misma, solo con un trapo húmedo o un pañuelo, al menos una vez a la semana.
Cualquier pequeña decoloración de la boquilla no afecta el funcionamiento de su inhalador Yanimo Respimat.
Si es necesario, limpie la parte exterior de su inhalador Yanimo Respimat con un trapo húmedo.
Cuándo cambiar a un nuevo Yanimo Respimat
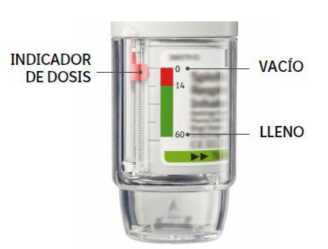
• Su inhalador Yanimo Respimat contiene 60 pulsaciones (30 dosis) si se usa tal como está indicado (2 pulsaciones/una vez al día).
• El indicador de dosis marca, aproximadamente, cuanta medicación queda.
• Cuando el indicador de dosis alcance la zona roja de la escala necesita una nueva receta médica; aproximadamente queda medicación para 7 días (14 pulsaciones).
• Una vez el indicador de dosis ha alcanzado el final de la zona roja, su Yanimo Respimat se bloquea automáticamente - no se pueden liberar más dosis. En este punto, la base transparente ya no puede girarse más.
• Yanimo Respimat debe desecharse tres meses después de haberse preparado para el primer uso aunque no se haya utilizado completamente o no se haya utilizado.
Preparación para el primer uso
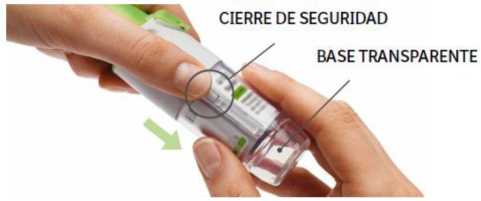
1.
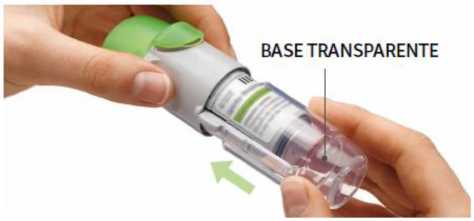
Retirar la base transparente
Mantenga la tapa cerrada. Presione el cierre de seguridad mientras retira firmemente la base transparente con su otra mano.
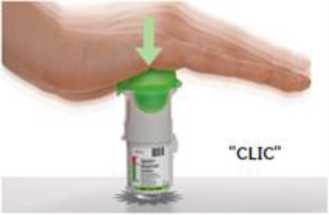
2.
Insertar el cartucho
Inserte el extremo estrecho del cartucho dentro del inhalador. Coloque el inhalador sobre una superficie firme y empuje firmemente hacia abajo hasta que haga clic.
No saque el cartucho una vez se ha insertado en el inhalador.

3. Colocar la base transparente
• Vuelva a colocar la base transparente en su sitio hasta que haga clic.
• No saque la base transparente otra vez.
4. Rotar
• Mantenga la tapa cerrada.
• Rote la base transparente en la dirección de las flechas de la etiqueta hasta que haga clic (media vuelta).
5. Abrir
• Abra la tapa completamente. 1 2
Uso diario

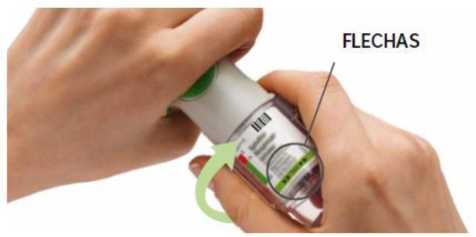


ROTAR
Mantenga la tapa cerrada.
ROTE la base transparente en la dirección de las flechas de la etiqueta hasta que haga clic (media vuelta).
FLECHAS

ABRIR
• ABRA la tapa completamente.
PRESIONAR
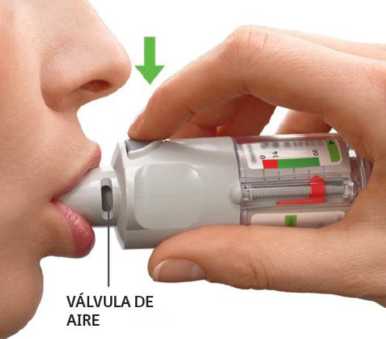
• Espire lenta y profundamente.
• Cierre los labios alrededor de la boquilla sin cubrir las válvulas de aire. Apunte con el inhalador hacia el fondo de su garganta.
• Mientras inspira lenta y profundamente a través de la boca, PRESIONE el botón de liberación de dosis y continúe inspirando lentamente mientras le resulte cómodo.
• Mantenga la respiración durante 10 segundos o hasta que le sea posible.
• Repita los pasos ROTAR, ABRIR Y PRESIONAR para completar el total de 2 pulsaciones.
• Cierre la tapa hasta que vuelva a usar el inhalador.



4.3 Contraindicaciones
Hipersensibilidad a tiotropio u olodaterol o a alguno de los excipientes incluidos en la sección 6.1. Antecedentes de hipersensibilidad a atropina o sus derivados, p. ej. ipratropio u oxitropio.
-25EP.
3QB!
4.4 Advertencias y precauciones especiales de empleo
Asma
Yanimo Respimat no debe ser utilizado para asma. La eficacia y seguridad de Yanimo Respimat en asma no han sido estudiadas.
No para uso agudo
Yanimo Respimat no está indicado en el tratamiento de episodios agudos de broncoespasmo, es decir, como tratamiento de rescate.
Broncoespasmo paradójico
Al igual que con otros fármacos administrados por vía inhalatoria, Yanimo Respimat puede causar broncoespasmos paradójicos que pueden ser potencialmente mortales. En caso de producirse un broncoespasmo paradójico, se debe interrumpir el tratamiento con Yanimo Respimat de inmediato y sustituir por un tratamiento alternativo.
Efectos anticolinérgicos relacionados con tiotropio
Glaucoma de ángulo estrecho, hiperplasia prostática u obstrucción del cuello de la vejiga
Dada la actividad anticolinérgica de tiotropio, Yanimo Respimat debe utilizarse con precaución en pacientes con glaucoma de ángulo estrecho, hiperplasia prostática u obstrucción del cuello de la vejiga.
Síntomas oculares
Debe advertirse a los pacientes que eviten la introducción del spray en los ojos. Se les debe indicar que ello puede provocar o empeorar un glaucoma de ángulo estrecho, dolor o molestia ocular, visión borrosa transitoria, halos visuales o imágenes coloreadas, junto con enrojecimiento ocular por congestión de la conjuntiva y edema de la córnea. Si aparece cualquier combinación de estos síntomas oculares, los pacientes deben interrumpir el uso de Yanimo Respimat y consultar inmediatamente un especialista.
Caries dental
La sequedad de boca, observada con el tratamiento anticolinérgico, a largo plazo puede asociarse con caries dental.
Pacientes con insuficiencia renal
En pacientes con insuficiencia renal de moderada a grave (adaramiento de creatinina < 50 ml/min), Yanimo Respimat sólo debe utilizarse si el beneficio esperado supera el riesgo potencial, ya que la concentración plasmática de tiotropio aumenta cuando la función renal está disminuida. No existe experiencia a largo plazo en pacientes con insuficiencia renal grave (ver 5.2.).
Efectos cardiovasculares
Se excluyeron de los ensayos clínicos los pacientes con historia de infarto de miocardio durante el año anterior, arritmia cardíaca inestable o potencialmente mortal, hospitalizados debido a insuficiencia cardíaca durante al año anterior o con diagnóstico de taquicardia paroxística (> 100 latidos por minuto). Por lo tanto, la experiencia en estos grupos de pacientes es limitada. Yanimo Respimat debe utilizarse con precaución en estos grupos de pacientes.
Como con otros agonistas beta2-adrenérgicos, olodaterol puede producir un efecto cardiovascular clínicamente significativo en algunos pacientes medido por aumentos de la frecuencia del pulso, de la presión arterial y/u otros síntomas. En caso de producirse estos efectos, puede ser necesario interrumpir el
¡m
tratamiento. Además, se ha notificado que los agonistas beta-adrenérgicos producen cambios en el electrocardiograma (ECG), como aplanamiento de la onda T y depresión del segmento ST, aunque se desconoce la relevancia clínica de estas observaciones.
Los agonistas beta2-adrenérgicos de acción prolongada deben administrarse con precaución en pacientes con enfermedades cardiovasculares, particularmente enfermedad coronaria isquémica, descompensación cardíaca grave, arritmias cardíacas, cardiomiopatía hipertrófica obstructiva, hipertensión y aneurisma; en pacientes con trastornos convulsivos o tirotoxicosis; en pacientes con prolongación del intervalo QT o sospecha de prolongación del intervalo QT (p.ej. QT> 0,44 s) y en pacientes especialmente sensibles a los efectos de las aminas simpaticomiméticas.
Hipopotasemia
Los agonistas beta2-adrenérgicos pueden producir hipopotasemia significativa en algunos pacientes, lo cual puede aumentar el riesgo de que se produzcan efectos adversos cardiovasculares. El descenso de los niveles de potasio en sangre suele ser transitorio y no requiere suplementos. En pacientes con EPOC grave, la hipopotasemia se puede ver potenciada por la hipoxia y por el tratamiento concomitante (ver sección 4.5), lo que puede aumentar la susceptibilidad a las arritmias cardíacas.
Hiperglucemia
La inhalación de dosis elevadas de agonistas beta2-adrenérgicos puede producir aumentos de la glucosa en sangre.
Anestesia
Se requiere precaución en el caso de intervención quirúrgica planificada con anestésicos de hidrocarburos halogenados debido al aumento de la susceptibilidad a los efectos cardíacos adversos de los agonistas beta broncodilatadores.
Yanimo Respimat no debe utilizarse en combinación con otras medicaciones que contengan agonistas beta2-adrenérgicos de acción prolongada.
A los pacientes que hayan estado tomando agonistas beta2-adrenérgicos de acción corta por vía inhalatoria de forma regular (p.ej. cuatro veces al día) se les debe indicar que sólo deben usarlos para el alivio de los síntomas respiratorios agudos.
Yanimo Respimat no debe usarse con una frecuencia superior a una vez al día.
Hipersensibilidad
Como con todos los medicamentos, pueden producirse reacciones de hipersensibilidad inmediata después de la administración de Yanimo Respimat.
4.5 Interacción con otros medicamentos y otras formas de interacción
Aunque no se han realizado estudios formales de interacción entre fármacos in vivo con Yanimo Respimat y otros medicamentos, Yanimo Respimat inhalado se ha usado de manera simultánea con otros medicamentos para la EPOC, incluyendo broncodilatadores simpaticomiméticos de acción corta y corticosteroides inhalados sin evidencia clínica de interacciones entre fármacos.
Agentes anticolinérgicos
La administración conjunta de bromuro de tiotropio, un componente de Yanimo Respimat, con otros medicamentos anticolinérgicos no se ha estudiado por lo tanto no se recomienda.
¡m
Agentes adrenérgicos
La administración simultánea de otros agentes adrenérgicos (administrados solos o como parte de una terapia combinada) puede incrementar las reacciones adversas de Yanimo Respimat.
Derivados de la xantina, esteroides o diuréticos
La administración simultánea de derivados de la xantina, esteroides o diuréticos no ahorradores de potasio pueden incrementar los efectos hipopotasémicos de los agonistas adrenérgicos (ver sección 4.4).
Betabloqueantes
Los bloqueantes beta-adrenérgicos pueden atenuar o antagonizar el efecto de olodaterol. Se podría considerar la administración de betabloqueantes cardioselectivos, aunque éstos deben ser administrados con precaución.
Inhibidores de la MAO y antidepresivos tricíclicos, fármacos prolongadores del intervalo QTc Los inhibidores de la monoaminooxidasa o los antidepresivos tricíclicos u otros fármacos que causan una prolongación del intervalo QTc pueden potenciar el efecto de Yanimo Respimat en el sistema cardiovascular.
Interacciones farmacocinéticas entre fármacos
No se ha observado un efecto relevante en la exposición sistémica a olodaterol en los estudios de interacciones entre fármacos con administración conjunta de fluconazol, utilizado como modelo de inhibición del CYP2C9.
La administración conjunta de ketoconazol como inhibidor potente de la gp-P y del CYP3A4 aumentó la exposición sistémica a olodaterol un 70 %, aproximadamente. No es necesario un ajuste de dosis de Yanimo Respimat.
Las investigaciones in vitro han mostrado que olodaterol no inhibe las enzimas CYP o los transportadores de fármacos a las concentraciones plasmáticas alcanzadas en la práctica clínica.
4.6 Fertilidad, embarazo y lactancia
4.6.1 Embarazo
Tiotropio
Hay datos muy limitados relativos al uso de Yanimo Respimat en mujeres embarazadas. Los estudios en animales no sugieren efectos perjudiciales directos ni indirectos en términos de toxicidad para la reproducción a niveles de exposición clínicamente relevante (ver sección 5.3).
Olodaterol
No hay datos clínicos disponibles sobre el uso de olodaterol durante el embarazo. Los datos no clínicos con olodaterol revelaron efectos típicos de otros agonistas beta2-adrenérgicos a dosis mayores a las terapéuticas (ver sección 5.3).
Como medida de precaución, es preferible evitar el uso de Yanimo Respimat durante el embarazo.
Como otros agonistas beta2-adrenérgicos, olodaterol, un componente de Yanimo Respimat, puede inhibir el parto debido a un efecto relajante sobre el músculo liso uterino.
¡m
4.6.2 Lactancia
No hay datos clínicos disponibles de mujeres lactantes expuestas a tiotropio y/o olodaterol.
En estudios en animales con tiotropio y olodaterol, se han detectado las sustancias y/o sus metabolitos en la leche de ratas lactantes pero se desconoce si tiotropio y/o olodaterol se excretan en la leche materna.
Se debe decidir si es necesario interrumpir la lactancia o interrumpir el tratamiento con Yanimo Respimat tras considerar el beneficio de la lactancia para el niño y el beneficio del tratamiento con Yanimo Respimat para la madre.
4.6.3 Fertilidad
No hay datos clínicos disponibles sobre el efecto en la fertilidad de tiotropio y olodaterol o la combinación de ambos componentes. Los estudios preclínicos realizados con los componentes individuales tiotropio y olodaterol no mostraron efectos adversos sobre la fertilidad (ver 5.3).
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No se han realizado estudios de los efectos sobre la capacidad de conducir y utilizar máquinas.
De todos modos, se debe informar a los pacientes de que se han notificado mareos y visión borrosa con el uso de Yanimo Respimat. Por ello, se recomienda tener precaución al conducir un coche o utilizar máquinas. Si los pacientes experimentan dichos síntomas, deben evitar realizar tareas potencialmente peligrosas como conducir o utilizar máquinas.
4.8 Reacciones adversas
a. Resumen del perfil de seguridad
Muchas de las reacciones adversas listadas pueden asignarse a las propiedades anticolinérgicas de bromuro de tiotropio o a las propiedades B2-adrenérgicas de olodaterol, los componentes de Yanimo Respimat.
b. Resumen tabulado de reacciones adversas
Las frecuencias asignadas a las reacciones adversas listadas a continuación se basan en porcentajes de tasas de incidencia bruta de reacciones adversas al fármaco (es decir, acontecimientos atribuidos a Yanimo Respimat) observadas en el grupo de tiotropio 5 microgramos/olodaterol 5 microgramos (1.302 pacientes), recopiladas de 5 ensayos clínicos activos o controlados con placebo, con grupos paralelos, en pacientes con EPOC, con periodos de tratamiento en un rango de 4 a 52 semanas.
Las reacciones adversas notificadas en todos los ensayos clínicos con Yanimo Respimat se muestran a continuación siguiendo la clasificación por órganos y sistemas.
También se incluyen todas las reacciones adversas previamente notificadas con uno de los componentes individuales.
La frecuencia se define según la siguiente convención:
Muy frecuentes (>1/10); frecuentes (>1/100 a <1/10); poco frecuentes (>1/1.000 a <1/100); raras (>1/10.000 a <1/1.000); muy raras (<1/10.000), frecuencia no conocida (no puede estimarse a partir de los datos disponibles)
|
Clasificación por órganos y |
Reacción adversa |
Frecuencia |
|
sistemas |
Clasificación por órganos y
sistemas_
Infecciones e infestaciones
Trastornos del metabolismo y de la nutrición Trastornos del sistema nervioso
Nasofaringitis
Deshidratación
Mareos
Insomnio
Cefalea
rara
no conocida
poco frecuente
poco frecuente poco frecuente
Visión borrosa
rara
Glaucoma
no conocida
Aumento de la presión intraocular Fibrilación auricular
no conocida
Palpitaciones
Taquicardia
Taquicardia supraventricular
Hipertensión
Tos
poco frecuente poco frecuente
poco frecuente
rara
poco frecuente poco frecuente
Disfonía
rara
Epistaxis
Laringitis
Faringitis
Broncoespasmo
Sinusitis
rara
rara
rara
no conocida
no conocida
Sequedad de boca Estreñimiento
frecuente
poco frecuente
Gingivitis
Náuseas
rara
rara
Candidiasis orofaríngea
Obstrucción intestinal, incluyendo íleo paralítico Caries dental
Disfagia
Reflujo gastroesofágico
Glositis
Estomatitis
rara
no conocida
no conocida
no conocida
no conocida
no conocida
no conocida
¡m
|
Clasificación por órganos y |
Reacción adversa |
Frecuencia |
|
sistemas | ||
|
Trastornos de la piel y del tejido subcutáneo, trastornos del sistema inmunológico |
Angioedema |
rara |
|
Urticaria |
rara | |
|
Hipersensibilidad |
rara | |
|
Prurito |
rara | |
|
Reacción anafiláctica |
no conocida | |
|
Erupción |
no conocida | |
|
Piel seca |
no conocida | |
|
Infección de la piel/úlcera en la piel |
no conocida | |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Dolor de espalda1 |
rara |
|
Artralgia |
rara | |
|
Tumefacción en articulación |
no conocida | |
|
Trastornos renales y urinarios |
Retención urinaria |
rara |
|
Disuria |
rara | |
|
Infección del tracto urinario |
no conocida |
reacciones adversas notificadas con Yanimo Respimat pero no con los componentes individuales
c. Descripción de reacciones adversas seleccionadas
Yanimo Respimat combina propiedades anticolinérgicas y B-adrenérgicas debido a sus componentes tiotropio y olodaterol.
Perfil de reacciones adversas anticolinérgicas
En los ensayos clínicos a largo plazo de 52 semanas de duración con Yanimo Respimat, la reacción adversa anticolinérgica observada más frecuentemente fue la sequedad de boca que ocurrió en aproximadamente el 1,7% de los pacientes tratados con Yanimo Respimat y en 2,7% y 1% en los brazos de tiotropio 5 microgramos y olodaterol 5 microgramos, respectivamente. La sequedad de boca provocó el abandono en 1 de 1.029 pacientes tratados con Yanimo Respimat (0,1 %).
Reacciones adversas graves relacionadas con efectos anticolinérgicos incluyen glaucoma, estreñimiento, obstrucción intestinal incluyendo íleo paralítico y retención urinaria.
Perfil de reacciones adversas B-adrenérgicas
En los ensayos clínicos a largo plazo de 52 semanas de duración con Yanimo Respimat, las reacciones adversas B-adrenérgicas observadas más frecuentemente fueron palpitaciones, taquicardia e hipertensión.
Olodaterol, un componente de Yanimo Respimat forma parte del grupo farmacoterapéutico de los agonistas beta2-adrenérgicos de acción prolongada. Por ello, debe considerarse la aparición de otros efectos adversos no listados arriba, relacionados con la familia de los agonistas beta-adrenérgicos tales como arritmia, isquemia miocárdica, angina de pecho, hipotensión, temblores, nerviosismo, espasmos musculares, fatiga, malestar, hipopotasemia, hiperglucemia y acidosis metabólica.
d. Otras poblaciones especiales
Puede ocurrir un aumento en el efecto anticolinérgico con el aumento de la edad.
Notificación de sospechas de reacciones adversas
Es importante notificar las sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: www.notificaRAM.es
4.9 Sobredosis
Hay información limitada sobre la sobredosis con Yanimo Respimat. Yanimo Respimat se ha estudiado a dosis de hasta 5 microgramos/10 microgramos (tiotropio/olodaterol) en pacientes con EPOC y a dosis de hasta 10 microgramos/40 microgramos (tiotropio/olodaterol) en sujetos sanos; no se observaron efectos clínicamente relevantes. Una sobredosis podría provocar efectos antimuscarínicos exagerados de tiotropio y/o efectos p2agonistas exagerados de olodaterol.
Síntomas
Sobredosis de tiotropio anticolinérgico
Dosis elevadas de tiotropio pueden provocar la aparición de signos y síntomas anticolinérgicos.
No obstante, después de la administración de una dosis única inhalada de hasta 340 microgramos de bromuro de tiotropio en voluntarios sanos, no hubo reacciones adversas anticolinérgicas sistémicas. Adicionalmente, no se observaron reacciones adversas relevantes más allá de sequedad de boca/garganta y sequedad de la mucosa nasal, tras la administración durante 14 días de una dosis de hasta 40 microgramos de tiotropio solución para inhalación en voluntarios sanos con la excepción de una reducción pronunciada en el flujo salival a partir del séptimo día.
Sobredosis de olodaterol fí-agonista
Una sobredosis de olodaterol probablemente provoque efectos exagerados típicos de los agonistas beta2-adrenérgicos, p.ej. isquemia miocárdica, hipertensión o hipotensión, taquicardia, arritmias, palpitaciones, mareo, nerviosismo, insomnio, ansiedad, cefalea, temblor, boca seca, espasmos musculares, náuseas, fatiga, malestar, hipopotasemia, hiperglucemia y acidosis metabólica.
Tratamiento en caso de sobredosis
El tratamiento con Yanimo Respimat debe ser interrumpido. Aplicar tratamiento de apoyo y sintomático. En casos graves se requiere hospitalización. Se puede considerar el uso de betabloqueantes cardioselectivos, pero sólo bajo vigilancia extrema ya que el uso de betabloqueantes adrenérgicos puede provocar broncoespasmo.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Fármacos para enfermedades obstructivas de las vías respiratorias; adrenérgicos en combinación con anticolinérgicos, código ATC: R03AL06
5.1.1 Mecanismo de acción
Yanimo Respimat
¡m
Yanimo Respimat es una combinación a dosis fijas de una solución para inhalación que contiene tiotropio, un antagonista del receptor muscarínico de acción prolongada y olodaterol, un agonista beta2-adrenérgico de acción prolongada (LAMA/LABA) que se libera a través del inhalador de nube de vapor suave Yanimo Respimat.
Los dos principios activos proporcionan una broncodilatación añadida debido a sus diferentes mecanismos de acción. Dado que los receptores muscarínicos parecen ser más prominentes en las vías respiratorias centrales y los receptores adrenérgicos beta2 tienen un nivel de expresión mayor en las vías respiratorias periféricas, la combinación de tiotropio y olodaterol proporciona una broncodilatación óptima en todas las regiones de los pulmones.
Tiotropio
El bromuro de tiotropio es un antagonista específico de los receptores muscarínicos de acción prolongada. Tiene una afinidad similar por los diferentes subtipos M1 a M5. En las vías aéreas, el bromuro de tiotropio se une, de forma competitiva y reversible, a los receptores M3 de la musculatura lisa bronquial, antagonizando los efectos colinérgicos (broncoconstrictores) de la acetilcolina, provocando relajación de la musculatura lisa bronquial. El efecto fue dependiente de la dosis y duró más de 24 horas. Como anticolinérgico N-cuaternario, el bromuro de tiotropio es tópicamente (bronco-) selectivo cuando se administra por inhalación, demostrando un rango terapéutico aceptable antes de que aparezcan efectos anticolinérgicos sistémicos.
Olodaterol
Olodaterol tiene una gran afinidad y un alto grado de selectividad por el receptor adrenérgico beta2 humano.
Estudios in vitro han mostrado que olodaterol tiene una actividad agonista 241 veces mayor sobre los receptores adrenérgicos beta2 que sobre los receptores adrenérgicos beta1, y una actividad agonista 2.299 veces mayor en comparación con los receptores adrenérgicos beta3.
Tras la administración tópica por vía inhalatoria, el compuesto ejerce sus efectos farmacológicos por unión a los receptores adrenérgicos beta2 y su activación.
La activación de estos receptores en las vías respiratorias provoca una estimulación de la adinil ciclasa intracelular, una enzima que actúa de intermediaria en la síntesis del adenosín monofosfato cíclico-3’,5’ (AMPc). Los niveles elevados de AMPc estimulan la broncodilatación por relajación de las células del músculo liso bronquial.
Olodaterol tiene el perfil preclínico de un agonista selectivo del receptor adrenérgico beta2 de acción prolongada (LABA), con un inicio de efecto rápido y una duración del efecto de como mínimo 24 horas.
Los receptores beta-adrenérgicos están divididos en tres subtipos: los receptores adrenérgicos beta1, que se expresan predominantemente en el músculo cardíaco, los receptores adrenérgicos beta2 que se expresan predominantemente en el músculo liso respiratorio, y los receptores adrenérgicos beta3, que se expresan predominantemente en el tejido adiposo. Los agonistas beta2 causan broncodilatación. A pesar de que el receptor adrenérgico beta2 es el adrenorreceptor predominante en el músculo liso respiratorio, también está presente en la superficie de algunas otras células, entre ellas las células epiteliales y endoteliales del pulmón y en el corazón. No se conoce la función exacta de los receptores beta2 en el corazón pero el hecho de que estén presentes aumenta la posibilidad de que incluso los agonistas beta2-adrenérgicos más selectivos tengan efectos cardíacos.
Efectos sobre la electrofisiología cardíaca
Tiotropio
¡m
En un estudio específico sobre el intervalo QT en 53 voluntarios sanos, la administración de 18 microgramos de tiotropio polvo para inhalación y 54 microgramos (es decir, tres veces la dosis terapéutica) durante 12 días no prolongó de manera significativa los intervalos QT del ECG.
Olodaterol
El efecto de olodaterol sobre el intervalo QT/QTc del ECG fue investigado en 24 voluntarios sanos, hombres y mujeres, en un estudio doble ciego, aleatorizado, controlado con placebo y con tratamiento activo (moxifloxacino). Olodaterol administrado en dosis únicas de 10, 20, 30 y 50 microgramos, mostró que, en comparación con placebo, la variación media del valor basal en el intervalo QT en un plazo de 20 minutos a 2 horas después de la administración, aumenta, dependiendo de la dosis, entre 1,6 ms (10 microgramos de olodaterol) y 6,5 ms (50 microgramos de olodaterol), con un límite máximo de los intervalos de confianza bilaterales (90%) de menos de 10 ms en todos los niveles de dosis para los QT corregidos individualmente (QTcI).
El efecto de 5 microgramos y 10 microgramos de olodaterol sobre la frecuencia cardíaca y el ritmo cardíaco se evaluó mediante monitorización continua del registro del ECG durante 24 horas (monitorización Holter) en un subgrupo de 772 pacientes incluidos en los estudios en fase III controlados con placebo de 48 semanas. No se observaron tendencias o patrones relacionados con la dosis o el tiempo para las magnitudes de variaciones medias en cuanto a la frecuencia cardíaca o latidos prematuros. Los cambios desde inicio hasta final del tratamiento en los latidos prematuros no mostraron diferencias significativas entre olodaterol 5 microgramos, 10 microgramos y placebo.
Yanimo Respimat
Dos estudios doble ciego, aleatorizados, de 52 semanas de duración con Yanimo Respimat incluyeron 5.162 pacientes con EPOC. En un análisis conjunto, el número de sujetos con cambios en el intervalo QTcF (correcciones Fredericia) respecto al valor basal de >30 mseg 40 minutos después de la administración los días 85, 169 y 365 varió desde 3,1%, 4,7% y 3,6% para el grupo Yanimo Respimat comparado con el 4,1%, 4,4% y 3,6% para el grupo de olodaterol 5 microgramos y 3,4%, 2,3% y 4,6% para el grupo de tiotropio 5 microgramos, respectivamente.
5.1.3 Eficacia clínica y seguridad
El programa de desarrollo clínico en fase III de Yanimo Respimat incluyó tres estudios, aleatorizados, doble ciego:
(i) dos estudios replicados, de 52 semanas de duración, de grupos paralelos comparando Yanimo Respimat con 5 microgramos de tiotropio y 5 microgramos de olodaterol (1.029 pacientes recibieron Yanimo Respimat) [estudios 1 y 2]
(ii) un estudio cruzado, de 6 semanas de duración, comparando Yanimo Respimat con 5 microgramos de tiotropio y 5 microgramos de olodaterol y placebo (139 pacientes recibieron Yanimo Respimat) [estudio 3]
En estos estudios, los comparadores, 5 microgramos de tiotropio y 5 microgramos de olodaterol y placebo se administraron con el inhalador Respimat.
Características de los pacientes
La mayoría de los 5.162 pacientes reclutados en los estudios globales de 52 semanas de duración [estudios 1 y 2] fueron hombres (73 %), de raza blanca (71 %) o de raza asiática (25 %), con una edad media de 64 años. El FEVi post-broncodilatador medio fue de 1,37 l (GOLD 2 [50 %], GOLD 3 [39 %], GOLD 4 [11 %]). La capacidad de respuesta media de los p2-agonistas fue del 16,6 % con respecto al valor basal
(0,171 l). Estaban permitidos como tratamiento concomitante los medicamentos pulmonares incluyendo esteroides inhalados [47 %] y las xantinas [10 %].
El estudio de 6 semanas de duración [estudio 3] fue llevado a cabo en Europa y Norteamérica. La mayoría de los 219 pacientes reclutados fueron hombres (59 %) de raza blanca (99 %), con una edad media de 61,1 años. El FEVi post-broncodilatador medio fue de 1,55 l (GOLD 2 [64 %], GOLD 3 [34 %], GOLD 4 [2 %]). La capacidad de respuesta media de los p2-agonistas fue del 15,9 % con respecto al valor basal (0,193 l). Estaban permitidos como tratamiento concomitante los medicamentos pulmonares incluyendo esteroides inhalados [41 %] y las xantinas [4 %].
Efectos en la _función _pulmonar
En los estudios de 52 semanas de duración, Yanimo Respimat, administrado una vez al día por la mañana, proporcionó una mejora clara en la función pulmonar en los 5 minutos siguientes a la primera dosis en comparación con tiotropio 5 microgramos (aumento medio en FEV1 de 0,137 l para Yanimo Respimat vs 0,058 l para tiotropio 5 microgramos (p < 0,0001) y 0,125 l para olodaterol 5 microgramos [p=0,16]).
En ambos estudios, se observaron mejoras significativas en la respuesta FEV1 AUC0-3 y en el FEV1 valle después de 24 horas (variables principales de la función pulmonar) para Yanimo Respimat en comparación con tiotropio 5 microgramos y olodaterol 5 microgramos (Tabla 1).
Tabla 1 Diferencias en la respuesta FEVi ÁUC0-3h y en el FEVi valle para Yanimo Respimat
comparado con tiotropio 5 microgramos, olodaterol 5 microgramos después de 24 semanas (Estudios 1 y 2)
|
Respuesta FEV1 AUC0-3h |
Respuesta FEV1 valle | |||||||
|
Estudio 1 |
Estudio 2 |
Estudio 1 |
Estudio 2 | |||||
|
n |
Media |
n |
Media |
n |
Media |
n |
Media | |
|
Yanimo Respimat versus |
522 |
-- |
502 |
-- |
521 |
-- |
497 |
-- |
|
Tiotropio 5 microgramos |
526 |
0,117 L |
500 |
0,103 L |
520 |
0,071 L |
498 |
0,050 L |
|
Olodaterol 5 microgramos |
525 |
0,123 L |
507 |
0,132 L |
519 |
0,082 L |
503 |
0,088 L |
|
Valor basal del FEV1 pretratamiento: Ensayo 1 = |
,16 l; Ensayo 2 = 1 |
,15 l | ||||||
p<0,0001 para todas las comparaciones n=número de pacientes
Pacientes con un mayor grado de reversibilidad a nivel basal generalmente mostraron una respuesta broncodilatadora mayor con Yanimo Respimat que pacientes con un menor grado de reversibilidad a nivel basal.
El aumento del efecto broncodilatador de Yanimo Respimat en comparación con tiotropio 5 microgramos y olodaterol 5 microgramos se mantuvo durante las 52 semanas de duración del tratamiento. Yanimo Respimat también mejoró el PEFR (tasa de flujo espiratorio máximo) matinal y nocturno medido en los registros diarios de los pacientes, en comparación con tiotropio 5 microgramos y olodaterol 5 microgramos.
En el estudio de 6 semanas de duración, Yanimo Respimat mostró una capacidad de respuesta del FEV1 significativamente mayor que tiotropio 5 microgramos, olodaterol 5 microgramos y placebo (p < 0,0001) durante todo el intervalo de administración de 24 horas (Tabla 2).
¡m
Tabla 2 Diferencia promedio en FEV1 (l) tras 3 h, 12 h y 24 h y diferencia en el FEV1 valle para Yanimo Respimat comparado con tiotropio 5 microgramos, olodaterol 5 microgramos y placebo tras 6 semanas (Estudio 3)
|
n |
3h promedio |
n |
12 h promedio |
24 h promedio1 |
Valle | |
|
Yanimo Respimat versus |
138 |
138 | ||||
|
Tiotropio 5 microgramos |
137 |
0,109 |
135 |
0,119 |
0.110 |
0,079 |
|
Olodaterol 5 microgramos |
138 |
0,109 |
136 |
0,126 |
0,115 |
0,092 |
|
Placebo |
135 |
0,325 |
132 |
0,319 |
0,280 |
0,207 |
Valor basal del FEVj pretratamiento= 1,30 l 1 variable principal
p<0,0001 para todas las comparaciones n=número de pacientes
Calidad de vida relacionada con la salud
Yanimo Respimat mostró mejoras en la calidad de vida relacionada con la salud tal como indicó la reducción en la puntuación total del St. George Respiratory Questionnaire (SGRQ). Después de 24 semanas, Yanimo Respimat mejoró de forma significativa la puntuación total media del SGRQ en comparación con tiotropio 5 microgramos y olodaterol 5 microgramos (Tabla 3); se observaron mejoras en todos los campos del SGRQ. Un mayor número de pacientes tratados con Yanimo Respimat mostraron una mejora clínicamente significativa en la puntuación total del SGRQ (MCID, definida como una reducción de al menos 4 unidades respecto al valor basal) en comparación con tiotropio 5 microgramos (57,5% vs. 48,7%, p=0,0001) y olodaterol 5 microgramos (57,5% vs. 44,8%, p<0,0001).
Tabla 3: Puntuación total del SGRQ después de 24 semanas de tratamiento
|
n |
Promedio del tratamiento (cambio respecto al valor basal) |
Diferencia con Yanimo Respimat | ||
|
Promedio (valor p) | ||||
|
Puntuación total |
Valor basal |
43,5 | ||
|
Yanimo Respimat |
979 |
36,7 (-6,8) | ||
|
Tiotropio 5 microgramos |
954 |
37,9 (-5,6) |
-1,23 (p=0,025) | |
|
Olodaterol 5 microgramos |
954 |
38,4 (-5,1) |
-1,69 (p=0,002) | |
N=número de pacientes
Disnea
Después de 24 semanas, la puntuación focal media del Índice de Transición de la Disnea (ITD) fue 1,98 unidades para Yanimo Respimat, con una mejora significativa en comparación con tiotropio 5 microgramos (diferencia media 0,36, p=0,008) y olodaterol 5 microgramos (diferencia media 0,42 (p=0,002).
Un mayor número de pacientes tratados con Yanimo Respimat mostraron una mejora clínicamente significativa en la puntuación focal del TDI (MCID, definido como un valor de al menos 1 unidad) comparado con tiotropio 5 microgramos (54,9% vs. 50,6%, p=0,0546) y olodaterol 5 microgramos (54,9% vs. 48,2%, p=0,0026).
¡m
Uso de la medicación de rescate
Los pacientes tratados con Yanimo Respimat utilizaron menos salbutamol de rescate durante el día y la noche en comparación con los pacientes tratados con tiotropio 5 microgramos y olodaterol 5 microgramos (uso medio de medicación de rescate durante el día para Yanimo Respimat de 0,76 ocasiones al día comparado con 0,97 ocasiones al día para tiotropio 5 microgramos y 0,87 ocasiones al día para olodaterol 5 microgramos, p<0,0001; uso medio de medicación de rescate durante la noche para Yanimo Respimat de1,24 ocasiones al día comparado con 1,69 ocasiones al día para tiotropio 5 microgramos y 1,52 ocasiones al día para olodaterol 5 microgramos, p<0,0001).
Evaluación global del _paciente
Los pacientes tratados con Yanimo Respimat percibieron una mejora en su afección respiratoria mayor en comparación con tiotropio 5 microgramos y olodaterol 5 microgramos, tal y como se midió en la escala de Evaluación global del paciente (Patients Global Rating (PGR) scale).
Exacerbaciones
Tiotropio 5 microgramos ha demostrado previamente una reducción estadísticamente significativa en el riesgo de sufrir una exacerbación en la EPOC comparado con placebo. Las exacerbaciones en la EPOC se incluyeron como una variable adicional en los ensayos pivotales de 52 semanas (Ensayos 1 y 2). En el conjunto de datos combinados, la proporción de pacientes que experimentaron por lo menos una exacerbación moderada/grave de la EPOC fue del 27,7% para Yanimo Respimat y 28,8% para tiotropio 5 microgramos (p=0,39). Estos estudios no estaban específicamente diseñados para evaluar el efecto de los tratamientos en las exacerbaciones de la EPOC.
Capacidad inspiratoria, dificultad respiratoria y resistencia al ejercicio
El efecto de Yanimo Respimat en la capacidad inspiratoria, en la dificultad respiratoria y en la resistencia al ejercicio limitada a síntomas se investigó en tres estudios doble ciego, aleatorizados en pacientes con EPOC:
(i) dos estudios replicados cruzados de 6 semanas de duración comparando Yanimo Respimat con tiotropio 5 microgramos, olodaterol 5 microgramos y placebo durante el trabajo de pedaleo a velocidad constante (450 recibieron Yanimo Respimat) [Ensayos 4 y 5]
(ii) un ensayo de 12 semanas de duración, de grupo paralelo comparando Yanimo Respimat con placebo durante el trabajo de pedaleo a velocidad constante (139 recibieron Yanimo Respimat) y caminando a velocidad constante (subgrupo) [Ensayo 6]
Yanimo Respimat mejoró de manera significativa la capacidad inspiratoria en reposo dos horas después de adminisitrar la dosis en comparación con tiotropio 5 microgramos (0,114 l, p<0,0001; Ensayo 4, 0,088 l, p=0,0005; Ensayo 5), olodaterol 5 microgramos (0,119 l, p<0,0001; Ensayo 4, 0,080l, p=0,0015; Ensayo 5) y placebo (0,244 l, p<0,0001; Ensayo 4, 0,265l, p<0,0001; Ensayo 5) después de 6 semanas.
En los Ensayos 4 y 5, Yanimo Respimat mejoró de forma significativa el tiempo de resistencia al ejercicio durante cicloergometría a carga constante en comparación con placebo después de 6 semanas (Ensayo 4: tiempo de resistencia medio geométrico de 454s para Yanimo Respimat en comparación con 375s para placebo (20,9% de mejora, p<0,0001); Ensayo 5: tiempo de resistencia medio geométrico de 466s para Yanimo Respimat en comparación con 411s para placebo (13,4% de mejora, p<0,0001).
En el Ensayo 6, Yanimo Respimat mejoró de forma significativa el tiempo de resistencia al ejercicio durante cicloergometría a carga constante en comparación con placebo después de 12 semanas (tiempo de resistencia geométrico de 528s para Yanimo Respimat en comparación con 464s para placebo (13,8% de mejora, p=0,021).
¡m
5.1.4 Población pediátrica
La Agencia Europea de Medicamentos ha eximido al titular de la obligación de presentar los resultados de los ensayos realizados con Yanimo Respimat en los diferentes grupos de la población pediátrica en la indicación de enfermedad pulmonar obstructiva crónica (EPOC) por una dispensa de clase (ver sección 4.2 para consultar la información sobre el uso en la población pediátrica).
5.2 Propiedades farmacocinéticas
a. Introducción general
Cuando tiotropio y olodaterol se administraron en combinación por vía inhalatoria, los parámetros farmacocinéticos de cada componente fueron similares a los observados cuando cada sustancia activa se administró por separado.
Tiotropio y olodaterol mostraron una farmacocinética lineal en el rango terapéutico. Después de inhalar una vez al día de forma repetida, se alcanzó el estado estacionario de tiotropio tras 7 días. El estado estacionario de olodaterol se alcanzó tras 8 días de inhalar una vez al día, y la acumulación se incrementó 1,8 veces en comparación con la dosis única.
b. Características generales del principio activo después de la administración del medicamento
5.2.1 Absorción
Tiotropio: Después de la inhalación en voluntarios jóvenes sanos, los datos de excreción urinaria sugieren que aproximadamente el 33% de la dosis inhalada a través del inhalador RESPIMAT alcanza la circulación sistémica. La biodisponibilidad absoluta de una solución administrada por vía oral fue del 2-3%. Se observaron concentraciones plasmáticas máximas de tiotropio 5-7 minutos después de la inhalación a través de RESPIMAT.
Olodaterol: La biodisponibilidad absoluta de olodaterol en voluntarios sanos después de la inhalación se estimó aproximadamente en un 30%, mientras que la biodisponibilidad absoluta como solución oral fue de menos del 1%. Las concentraciones plasmáticas máximas de olodaterol se alcanzan generalmente a los 1020 minutos de la inhalación del fármaco a través de RESPIMAT.
5.2.2 Distribución
Tiotropio tiene una unión a proteínas plasmáticas del 72% y muestra un volumen de distribución de 32 l/kg. Los estudios en ratas han mostrado que tiotropio no atraviesa la barrera hematoencefálica en un grado significativo.
Olodaterol tiene una unión a proteínas plasmáticas de aproximadamente el 60 % y muestra un volumen de distribución de 1.110 l. Olodaterol es sustrato de los transportadores gp-P, OAT1, OAT3 y OCT1. Olodaterol no es sustrato de los siguientes transportadores: BCRP, MRP, OATP2, OATP8, OATP-B, OCT2 y OCT3.
Biotransformación
Tiotropio: El grado de metabolismo es pequeño. Ello se hace evidente por una excreción urinaria del 74% de fármaco inalterado, después de una dosis intravenosa. El éster del bromuro de tiotropio se fragmenta de manera no enzimática a su alcohol y ácido (Nmetilescopina y ácido ditienilglicólico, respectivamente), los cuales no se unen a los receptores muscarínicos. Los ensayos in vitro con microsomas hepáticos humanos y hepatocitos humanos sugieren que alguna proporción adicional del fármaco (< 20% de la dosis después de
¡m
administración intravenosa) se metaboliza mediante oxidación dependiente del citocromo P450 (CYP) 2D6 y 3A4 y posterior conjugación con glutatión, a varios metabolitos de Fase II.
Olodaterol se metaboliza principalmente por glucuronidación directa y por O-desmetilación en el radical metoxilo con posterior conjugación. De los seis metabolitos identificados, solo el producto desmetilado no conjugado se une a los receptores beta2. De todos modos, este metabolito no es detectable en el plasma después de la inhalación crónica de la dosis terapéutica recomendada o dosis hasta 4 veces mayores. Las isoenzimas CYP2C9 y CYP2C8 del citocromo P450, con la contribución mínima de CYP3A4, participan en la O-desmetilación de olodaterol, mientras que las isoformas uridindifosfoglucuronato glucuronosiltransferasa UGT2B7, UGT1A1, 1A7 y 1A9 están involucradas en la formación de glucurónidos de olodaterol.
5.2.4 Eliminación
Tiotropio: El aclaramiento total en voluntarios sanos es 880 ml/min. El tiotropio administrado intravenosamente se excreta inalterado principalmente en la orina (74%). Después de la inhalación por pacientes con EPOC hasta el estado estacionario, la excreción urinaria es del 18,6% de la dosis permaneciendo el resto del fármaco sin absorber en el intestino, eliminándose por las heces. El aclaramiento renal de tiotropio excede el grado de filtración glomerular aclaramiento de creatinina, indicando la existencia de una secreción a la orina. La semivida efectiva de tiotropio tras la inhalación de tiotropio en pacientes con EPOC oscila entre 27 y 45 h.
Olodaterol: El aclaramiento total de olodaterol en voluntarios sanos es de 872 ml/min y el aclaramiento renal de 173 ml/min. Después de la administración intravenosa de olodaterol marcado con Carbono14, el 38 % de la dosis radioactiva fue recuperada en la orina y el 53 % en las heces. La cantidad de olodaterol inalterado excretado en la orina después de la administración intravenosa fue del 19 %. Después de la administración oral, únicamente se recuperó el 9 % de la radioactividad a través de la orina (0,7 % de olodaterol inalterado), mientras que la mayor parte fue recuperada en las heces (84 %). Más del 90 % de la dosis fue excretada entre 6 y 5 días después de la administración intravenosa y oral, respectivamente. Después de la inhalación, la excreción de olodaterol inalterado en la orina durante el intervalo de administración en voluntarios sanos en estado estacionario fue del 5-7 % de la dosis. Las concentraciones plasmáticas de olodaterol después de la inhalación disminuyen de forma multifásica con una vida media terminal de aproximadamente 45 horas.
c. Características en pacientes
Tiotropio: Tal como era de esperar para todos los fármacos excretados predominantemente por vía renal, una edad más avanzada se asoció a una reducción del aclaramiento renal de tiotropio de 347 ml/min en pacientes con EPOC < 65 años hasta 275 ml/min en pacientes con EPOC > 65 años. Esto no dio lugar a un correspondiente incremento en los valores AUC 0-6SS o Cmáx,SS.
Olodaterol: Un metaanálisis farmacocinético que utilizó datos de 2 estudios clínicos controlados con 405 pacientes con EPOC y 296 pacientes con asma mostró que no es necesario un ajuste de dosis basándose en la influencia de la edad, del género o peso sobre la exposición sistémica a olodaterol.
Raza
Olodaterol: La comparación de datos farmacocinéticos entre un mismo estudio o varios con olodaterol muestra una tendencia de mayor exposición sistémica en japoneses y otros sujetos de raza asiática que en sujetos caucásicos.
¡m
No se identificaron problemas de seguridad en los estudios clínicos con olodaterol con sujetos caucásicos y asiáticos, usando olodaterol Respimat hasta durante un año a dosis hasta dos veces la dosis terapéutica recomendada.
Insuficiencia renal
Tiotropio: Después de la administración por inhalación una vez al día de tiotropio hasta el estado de equilibrio en pacientes con EPOC, la insuficiencia renal leve (CLcr 50-80 ml/min) resultó en un ligero aumento del AUC0-6,SS (entre 1,8-30% mayor) y valores similares de CmáxSS comparado con pacientes con función renal normal (CLcr > 80 ml/min). En pacientes con insuficiencia renal de moderada a grave (CLcr<50 ml/min) la administración intravenosa de tiotropio resultó en el doble de la exposición total (82% más alto de la AUC0-4h y 52% más alto de Cmáx) comparado con sujetos con función renal normal, lo que fue confirmado por las concentraciones plasmáticas después de la inhalación del polvo seco.
Olodaterol: No hubo aumentos de la exposición sistémica clínicamente relevantes en pacientes con insuficiencia renal.
Insuficiencia hepática
Tiotropio: No se espera que la insuficiencia hepática tenga ninguna influencia importante sobre la farmacocinética de tiotropio. El tiotropio se aclara predominantemente por eliminación renal (un 74% en voluntarios jóvenes sanos) y por una fragmentación simple no enzimática del éster a productos farmacológicamente inactivos.
Olodaterol: No hubo evidencia de diferencias en la eliminación de olodaterol ni hubo diferencias con respecto a la unión de proteínas entre sujetos con insuficiencia hepática leve o moderada y los sujetos sanos control. No se llevó a cabo un estudio con sujetos con insuficiencia hepática grave.
5.3 Datos preclínicos sobre seguridad
Tiotropio + olodaterol
Únicamente se observaron efectos en los estudios preclínicos con la combinación tiotropio/olodaterol con exposiciones consideradas superiores a la máxima humana, lo que indica poca relevancia para su uso clínico.
Tiotropio
Los estudios sobre genotoxicidad y potencial carcinogénico no revelaron ningún peligro en particular para el ser humano.
Los efectos nocivos sobre la gravidez, desarrollo embrional/fetal, parto o desarrollo postnatal únicamente se pudieron demostrar a niveles de dosis tóxicas para las madres. El bromuro de tiotropio no fue teratogénico en ratas ni conejos. Los cambios respiratorios (irritación) y urogenitales (prostatitis) y la toxicidad sobre la reproducción, fueron observados con la exposición local o sistémica a dosis cinco veces superiores a la dosis terapéutica.
Olodaterol
Los estudios sobre genotoxicidad y potencial carcinogénico no revelaron ningún peligro en particular para el ser humano.
Se observó una mayor incidencia de leiomioma mesovariano en ratas y leiomioma de útero y leiomiosarcoma en ratones. Esto se considera un efecto de clase que se ha observado en roedores tras la exposición prolongada a dosis altas de agonistas-p2. Hasta ahora, los agonistas-p2 no se han asociado con cáncer en humanos.
¡m
No ocurrieron efectos teratogénicos en rata después de la inhalación de dosis de hasta 1.054 microgramos/kg/día (> 2.600 veces la exposición humana (AUC(0.24h) a la dosis de 5 mcg). En conejos gestantes NZW la administración de dosis inhaladas de 2.489 microgramos/kg/día (aproximadamente 7.130 veces la exposición humana a 5 microgramos basada en AUC (0-24h)) de olodaterol mostró toxicidad fetal que característicamente resultó de la estimulación del receptor beta-adrenérgico; que incluyó osificaciones parcheadas, huesos cortos/doblados, ojos parcialmente abiertos, paladar hendido, anomalías cardiovasculares. No ocurrieron efectos significativos a la dosis inhalada de 974 migrogramos/kg/día (aproximadamente 1.353 veces la dosis de 5 microgramos basada en AUC (0-24h)).
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Cloruro de benzalconio Edetato disódico Agua purificada
Ácido clorhídrico 1M (para ajustar el pH)
6.2 Incompatibilidades No procede.
6.3 Periodo de validez
3 años
Periodo de validez en uso: 3 meses
6.4 Precauciones especiales de conservación
No congelar.
6.5 Naturaleza y contenido del envase
Tipo de envase y material en contacto con el medicamento:
Solución contenida en un cartucho de polietileno/polipropileno con un tapón de polipropileno con un anillo de sellado de silicona integrado. El cartucho está incluido en un cilindro de aluminio.
Cada cartucho contiene 4 ml de solución para inhalación.
Tamaños de los envases y dispositivos disponibles:
Envase individual: 1 inhalador Respimat y 1 cartucho que proporciona 60 pulsaciones (30 dosis)
Envase doble: 2 envases individuales, cada uno contiene 1 inhalador Respimat y 1 cartucho que proporciona 60 pulsaciones (30 dosis)
Envase triple: 3 envases individuales, cada uno contiene 1 inhalador Respimat y 1 cartucho que proporciona 60 pulsaciones (30 dosis)
Envase de ocho: 8 envases individuales, cada uno contiene 1 inhalador Respimat y 1 cartucho que proporciona 60 pulsaciones (30 dosis)
Puede que solamente estén comercializados algunos tamaños de los envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
La eliminación del medicamento no utilizado y de los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Boehringer Ingelheim International GmbH Binger Strasse 173 D-55216 Ingelheim am Rhein Alemania
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
79.966
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Junio 2015
10. FECHA DE LA REVISIÓN DEL TEXTO
Marzo 2016
23 de 23
6. Presionar
• Dirija el inhalador hacia el suelo
• Presione el botón de liberación de dosis.
• Cierre la tapa.
• Repita los pasos 4 a 6 hasta observar una nube.
Después de observar una nube,
repita los pasos 4 a 6 tres veces más.
Ahora su inhalador está listo para ser utilizado. Estos pasos no afectarán el número de dosis disponibles. Después de la preparación, su inhalador podrá liberar 60 pulsaciones (30 dosis)