Votrient 400 Mg Comprimidos Recubiertos Con Pelicula
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
1. NOMBRE DEL MEDICAMENTO
Votrient 200 mg comprimidos recubiertos con película
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada comprimido recubierto con película contiene 200 mg de pazopanib (como hidrocloruro). Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Comprimido recubierto con película.
Con forma de cápsula, de color rosa y marcado con GS JT en una de las caras.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Carcinoma de Células Renales (CCR)
Votrient está indicado para el tratamiento de primera línea del Carcinoma de Células Renales avanzado (CCR) en adultos y para los pacientes con enfermedad avanzada que han recibido tratamiento previo con citoquinas.
Sarcoma de Tejidos Blandos (STB)
Votrient está indicado para el tratamiento de pacientes adultos con determinados subtipos de Sarcoma de Tejidos Blandos (STB) avanzado que hayan recibido previamente tratamiento con quimioterapia para tratar su enfermedad metastásica o en aquellos pacientes adultos cuya enfermedad ha progresado en los 12 meses siguientes tras recibir tratamiento neo-adyuvante y/o adyuvante.
La eficacia y seguridad solamente se ha establecido para ciertos subtipos histológicos de tumores de STB (ver sección 5.1).
4.2 Posología y forma de administración
El tratamiento con Votrient sólo debe ser iniciado por un médico experimentado en la administración de agentes anticancerígenos.
Posología
Adultos
La dosis recomendada de pazopanib para el tratamiento de CCR y STB es de 800 mg una vez al día.
Las modificaciones de la dosis se deben hacer de forma escalonada en incrementos de 200 mg según la tolerabilidad individual, con el fin de manejar las reacciones adversas. La dosis de pazopanib no debe exceder de 800 mg.
Población pediátrica
Pazopanib no se debe utilizar en niños menores de 2 años debido a motivos de seguridad relacionados con el desarrollo y maduración de órganos (ver secciones 4.4 y 5.3).
No se ha establecido la eficacia y seguridad de pazopanib en niños entre los 2 y los 18 años (ver sección 5.1).
Pacientes de edad avanzada
Los datos sobre el uso de pazopanib en pacientes de 65 años y mayores son limitados. En los estudios de pazopanib en CCR, no se observaron diferencias clínicamente significativas en la seguridad de pazopanib entre individuos de al menos 65 años e individuos más jóvenes. La experiencia clínica no ha identificado diferencias en las respuestas entre los pacientes de edad avanzada y los pacientes más jóvenes, pero no se puede descartar la mayor sensibilidad de algunos individuos de mayor edad.
Insuficiencia renal
Es poco probable que la insuficiencia renal tenga un efecto clínicamente relevante sobre la farmacocinética de pazopanib debido a la baja excreción renal de pazopanib y sus metabolitos (ver sección 5.2). Por lo tanto, no se requiere ajustar la dosis en pacientes con un aclaramiento de creatinina por encima de 30 ml/min. Se recomienda tener precaución en pacientes con un aclaramiento de creatinina por debajo de 30 ml/min, al no tener experiencia con pazopanib en esta población de pacientes.
Insuficiencia hepática
Las recomendaciones posológicas en pacientes con insuficiencia hepática están basadas en los estudios farmacocinéticos de pazopanib en pacientes con diferentes grados de disfunción hepática (ver sección 5.2). Antes de iniciar el tratamiento con pazopanib, y durante el mismo, se deben realizar pruebas de función hepática a todos los pacientes para determinar si presentan insuficiencia hepática.
La administración de pazopanib en pacientes con insuficiencia hepática leve o moderada se debe realizar con precaución y estrecha vigilancia sobre la tolerabilidad. La dosis recomendada es de 800 mg de pazopanib una vez al día en pacientes con alteraciones leves de las pruebas hepáticas en suero (definidas como valores normales de bilirrubina y cualquier grado de elevación de alanina aminotransferasa (ALT) o elevación de los valores de bilirrubina (> 35 % bilirrubina directa) de hasta 1,5 veces el límite superior de la normalidad (LSN) independientemente de los valores de ALT). Se recomienda una dosis reducida de pazopanib de 200 mg una vez al día en pacientes con insuficiencia hepática moderada (definida como elevación de los valores de bilirrubina de > 1,5 a 3 veces el LSN independientemente de los valores de ALT) (ver sección 5.2).
Pazopanib no está recomendado en pacientes con insuficiencia hepática grave (definida como bilirrubina total > 3 x LSN independientemente de los niveles de ALT).
Para más información sobre pacientes con hepatotoxicidad inducida por medicamentos, ver en el apartado monitorización hepática y modificaciones de la dosis en la sección 4.4.
Pazopanib se debe tomar sin alimentos, al menos una hora antes o dos horas después de las comidas (ver sección 5.2). Votrient comprimidos recubiertos con película se deben tomar enteros con agua y no se deben romper o machacar (ver sección 5.2).
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1
4.4 Advertencias y precauciones especiales de empleo
Efectos hepáticos
Se han notificado casos de insuficiencia hepática (incluyendo víctimas mortales) durante el uso de pazopanib. La administración de pazopanib a pacientes con insuficiencia hepática leve o moderada debe realizarse con precaución y bajo una estrecha vigilancia. La dosis recomendada es de 800 mg de pazopanib una vez al día en pacientes con alteraciones leves de las pruebas hepáticas en suero (tanto bilirrubina normal con cualquier grado de elevación de ALT, como bilirrubina elevada hasta
1.5 x LSN independientemente de los niveles de ALT). Se recomienda una dosis reducida de 200 mg de pazopanib una vez al día en pacientes con insuficiencia hepática moderada (elevaciones de bilirrubina > 1,5 a 3 veces el LSN independientemente de los valores de ALT) (ver secciones 4.2 y 5.2). Pazopanib no se recomienda en pacientes con insuficiencia hepática grave (bilirrubina
total > 3 x LSN independientemente de los niveles de ALT) (ver secciones 4.2 y 5.2). En estos pacientes con valores considerados insuficientes para obtener un efecto clínico relevante, la exposición a dosis de 200 mg es considerablemente reducida, aunque altamente variable.
En ensayos clínicos con pazopanib, se observó un incremento de las transaminasas séricas (ALT, aspartato aminotransferasa [AST]) y de la bilirrubina (ver sección 4.8). Se han notificado incrementos aislados de ALT y AST, que en la mayoría de los casos, no presentaron elevaciones concomitantes de fosfatasa alcalina o bilirrubina. Los pacientes mayores de 60 años de edad, pueden presentar mayor riesgo de incremento de la ALT, de moderada (> 3 x LSN) a grave (> 8 x LSN). Los pacientes que son portadores del alelo HLA-B*57:01 también presentan mayor riesgo de incrementos de ALT asociados a pazopanib. Se debe controlar la función hepática en todos los pacientes que reciben pazopanib, independientemente del genotipo o la edad (ver sección 5.1).
Se deben monitorizar las pruebas hepáticas en suero antes de iniciar el tratamiento con pazopanib y en las semanas 3, 5, 7 y 9 de tratamiento. Después de este periodo, se deben monitorizar en el tercer y cuarto mes, y según esté clínicamente indicado. Después del cuarto mes se debe continuar con una monitorización periódica.
En la Tabla 1 se puede consultar cómo llevar a cabo modificaciones de dosis en pacientes con valores basales de bilirrubina total < 1,5 x LSN, y valores de AST y ALT < 2 x LSN:
Tabla 1: Modificaciones de la dosis cuando se produce hepatotoxicidad inducida por el fármaco.
|
Valores en las pruebas hepáticas |
Modificaciones de la dosis |
|
Elevación de transaminasas entre 3 y 8 x LSN |
Continuar el tratamiento con pazopanib con una monitorización semanal de la función hepática hasta que las transaminasas vuelvan al Grado 1 o a la situación inicial. |
|
Elevación de transaminasas > 8 x LSN |
Interrumpir el tratamiento con pazopanib hasta que las transaminasas vuelvan al Grado 1 o a la situación inicial. Si el posible beneficio de reiniciar el tratamiento con pazopanib se considera mayor que el riesgo de hepatotoxicidad, se puede reiniciar el tratamiento con pazopanib a la dosis reducida de 400 mg al día y realizar pruebas hepáticas en suero semanalmente durante 8 semanas. Si tras reiniciar el tratamiento con pazopanib, las elevaciones de transaminasas vuelven a ser > 3 x LSN, se debe interrumpir permanentemente el tratamiento con pazopanib. |
|
Elevación de transaminasas > 3 x LSN junto con elevaciones de bilirrubina > 2 x LSN |
Interrumpir permanentemente el tratamiento con pazopanib. Se debe monitorizar a los pacientes hasta que los valores vuelvan al Grado 1 o a la situación inicial. Pazopanib es un inhibidor de UGT1A1. En pacientes con Síndrome de Gilbert, puede aparecer hiperbilirrubinemia indirecta (no conjugada) leve. En los pacientes con hiperbilirrubinemia indirecta leve, conocida o posible Síndrome de Gilbert, las elevaciones de ALT > 3 x LSN deben ser manejadas siguiendo las recomendaciones indicadas en caso de elevaciones aisladas de ALT. |
El uso concomitante de pazopanib y simvastatina incrementa el riesgo de elevaciones en la ALT (ver sección 4.5) y se debe realizar con precaución y estrecha vigilancia.
Hipertensión
En estudios clínicos con pazopanib, se han producido casos de hipertensión incluyendo episodios sintomáticos de presión arterial elevada recientemente diagnosticados (crisis hipertensiva). La presión sanguínea debe estar bien controlada antes de iniciar el tratamiento con pazopanib. Para asegurar el control de la presión arterial, al poco tiempo de iniciar el tratamiento con pazopanib (no más de una semana después), se debe monitorizar la hipertensión de los pacientes y controlar frecuentemente su presión arterial.
Niveles elevados de presión arterial (presión arterial sistólica > 150 o presión arterial diastólica > 100 mm Hg) se produjeron al principio del curso del tratamiento con pazopanib (aproximadamente el 40 % de los casos se produjeron antes del Día 9 y aproximadamente el 90 % de los casos sucedieron en las primeras 18 semanas). Se debe monitorizar la presión arterial y tratarla inmediatamente utilizando una combinación de terapia antihipertensiva y modificando la dosis de pazopanib (interrupción y reinicio con la dosis reducida siguiendo el criterio clínico) (ver secciones 4.2 y 4.8). Se debe interrumpir el tratamiento con pazopanib si existe evidencia de crisis hipertensiva o si la hipertensión es grave y persistente pese al tratamiento antipertensivo y las reducciones de dosis de pazopanib.
Síndrome de encefalopatía posterior reversible (PRES)/ Síndrome de leucoencelopatía posterior reversible (RPLS)
Se han notificado casos de PRES/RPLS asociados al uso de pazopanib. El PRES/RPLS pueden presentarse en forma de cefalea, hipertensión, convulsiones, letargia, confusión, ceguera y otras alteraciones visuales y neurológicas, pudiendo ser mortales. Los pacientes que desarollen PRES/RPLS deben interrumpir definitivamente el tratamiento con pazopanib.
Enfermedad pulmonar intersticial (EPI)/Neumonitis
Se han notificado casos de EPI, que pueden llegar a ser mortales, asociados al uso de pazopanib (ver sección 4.8). Se debe monitorizar a los pacientes con síntomas pulmonares indicativos de EPI/neumonitis, así como interrumpir el tratamiento con pazopanib en pacientes que desarrollen EPI o neumonitis.
Dis función cardiaca/Fallo cardiaco
Se deben tener en cuenta los riesgos y beneficios de pazopanib antes de iniciar el tratamiento en pacientes con disfunción cardiaca preexistente. No se ha estudiado la seguridad y la farmacocinética de pazopanib en pacientes con fallo cardiaco de moderado a grave o en aquellos con una Fracción de Eyección del Ventrículo Izquierdo (FEVI) por debajo de lo normal.
En ensayos clínicos con pazopanib, se han producido acontecimientos de disfunción cardiaca como insuficiencia cardiaca congestiva y disminución de la FEVI (ver sección 4.8). En los pacientes que participaron en un ensayo randomizado comparativo de pazopanib frente a sunitinib en CCR (VEG108844), se realizaron mediciones iniciales y de seguimiento del FEVI. La disfunción miocárdica se produjo en el 13% (47/362) de los pacientes en el brazo de pazopanib comparado con el 11% (42/369) de los pacientes en el brazo de sunitinib. Se observó insuficiencia cardíaca congestiva en el 0,5% de los sujetos en cada brazo del tratamiento.Se notificó fallo cardiaco congestivo en 3 de los 240 sujetos (1 %) en la fase III del estudio VEG110727 en STB . En sujetos a los que les realizaron mediciones tras iniciar el ensayo clínico y de seguimiento del FEVI, se detectaron disminuciones del FEVI de un 11 % (15/140) en el brazo de pazopanib comparado con el 3 % (1/39) en el brazo del placebo.
Factores de riesgo: trece de los 15 sujetos en el brazo de pazopanib del estudio de fase III en STB presentaron hipertensión simultáneamente, la cual pudo exacerbar la disfunción cardiaca en pacientes con riesgos a través de un incremento de la poscarga cardiaca. El 99 % de los pacientes (243/246) reclutados en el estudio de fase III en STB, incluyendo los 15 sujetos con hipertensión, recibieron antraciclinas. El tratamiento previo con antraciclinas puede ser un factor de riesgo de disfunción cardiaca.
Resultados: cuatro de los 15 sujetos se recuperaron completamente (5 % inicial) y 5 tuvieron una recuperación parcial (dentro del rango normal, pero > 5% por debajo del valor inicial). Un sujeto no se recuperó y no se dispone de los datos de seguimiento de los otros 5 sujetos.
Manejo: el tratamiento de la hipertensión (si está presente, consultar la sección anterior acerca de las precauciones en caso de hipertensión) se debe combinar con interrupciones y/o reducciones de la dosis de pazopanib en pacientes con disminuciones significantes de la FEVI, como indica la práctica clínica. Se debe monitorizar cuidadosamente a los pacientes para detectar signos clínicos o síntomas de fallo cardiaco congestivo. Se recomienda realizar una evaluación inicial y periódica de la FEVI en pacientes con riesgo de disfunción cardiaca.
Prolongación del intervalo QT y Torsade de Pointes
En ensayos clínicos con pazopanib han aparecido casos de prolongación del intervalo QT y Torsade de Pointes (ver sección 4.8). Pazopanib se debe utilizar con precaución en pacientes con un historial de prolongación del intervalo QT, en pacientes que tomen antiarrítmicos u otros medicamentos que puedan prolongar el intervalo QT y en aquellos con una importante enfermedad cardíaca preexistente. Mientras se esté utilizando pazopanib se recomienda la monitorización basal y periódica de los electrocardiogramas y el mantenimiento de los niveles de electrolitos (ej. calcio, magnesio, potasio) dentro de los rangos normales.
Acontecimientos trombóticos arteriales
En ensayos clínicos con pazopanib se observaron casos de infarto de miocardio, accidente cerebrovascular isquémico, y accidente isquémico transitorio (ver sección 4.8). Se han observado acontecimientos mortales. Pazopanib se debe usar con precaución en pacientes que presenten un mayor riesgo de padecer acontecimientos trombóticos o que hayan tenido un historial clínico de acontecimientos trombóticos. Pazopanib no se ha estudiado en pacientes que hayan presentado un acontecimiento de este tipo en los 6 meses previos al inicio del tratamiento con pazopanib. Se debe tomar una decisión en cuanto al tratamiento en base a la evaluación individual del beneficio/riesgo de los pacientes.
Acontecimientos tromboembólicos venosos
En los estudios clínicos con pazopanib se han producido acontecimientos tromboembólicos venosos entre los que se incluyen trombosis venosa y embolia pulmonar mortal. Al observar los estudios en CCR y STB, la incidencia fue mayor en la población con STB (5 %) que en la población con CCR (2 %).
Microangiopatía trombótica
Se han notificado casos de microangiopatía trombótica (MAT) en ensayos clínicos de pazopanib en monoterapia, en combinación con bevacizumab, y en combinación con topotecan (ver sección 4.8). Los pacientes que desarrollen MAT deben interrumpir definitivamente el tratamiento con pazopanib. Tras la interrupción del tratamiento se ha observado que los efectos de la MAT revierten. Pazopanib no está indicado para su uso en combinación con otros medicamentos.
En ensayos clínicos con pazopanib se han notificado acontecimientos hemorrágicos (ver sección 4.8). Se han producido acontecimientos hemorrágicos mortales. No se ha estudiado el uso de pazopanib en pacientes que hayan tenido antecedentes de hemoptisis, hemorragia cerebral o hemorragia gastrointestinal clínicamente significativa en los últimos 6 meses. Pazopanib se debe utilizar con precaución en pacientes con riesgo significativo de hemorragia.
Perforaciones gastrointestinales y fístula
En ensayos clínicos con pazopanib se han producido casos de perforación gastrointestinal o fístula (ver sección 4.8). Se han producido perforaciones gastrointestinales mortales. Pazopanib se debe utilizar con precaución en pacientes con riesgo de perforaciones gastrointestinales o fístula.
Cicatrización de heridas
No se han realizado estudios formales sobre el efecto de pazopanib en la cicatrización de heridas. Debido a que los inhibidores del Factor de Crecimiento del Endotelio Vascular (VEGF) pueden dificultar la cicatrización de heridas, el tratamiento con pazopanib debe interrumpirse durante al menos 7 días antes de una intervención quirúrgica programada. La decisión de reanudar el tratamiento con pazopanib después de la cirugía debe basarse en el juicio clínico de cicatrización adecuada. Se debe interrumpir el tratamiento con pazopanib en pacientes con dehiscencia de la herida.
Hipotiroidismo
En ensayos clínicos con pazopanib se han producido casos de hipotiroidismo (ver sección 4.8). Se recomienda analizar en el laboratorio los valores de referencia de la función tiroidea y los pacientes con hipotiroidismo deben ser tratados según la práctica médica estándar antes de iniciar el tratamiento con pazopanib. Se debe vigilar estrechamente a todos los pacientes para detectar signos y síntomas de disfunción tiroidea durante el tratamiento con pazopanib. Se debe realizar un seguimiento periódico de la función tiroidea y tratarla como una práctica médica estándar.
Proteinuria
En ensayos clínicos con pazopanib se han notificado casos de de proteinuria. Se recomienda analizar los valores iniciales y realizar análisis de orina durante el tratamiento así como vigilar a los pacientes en caso de empeoramiento de la proteinuria. Se debe interrumpir el tratamiento con pazopanib en aquellos pacientes que desarrollen síndrome nefrótico.
Neumotorax
En los estudios clínicos con pazopanib en sarcoma de tejidos blandos avanzado, se han producido acontecimientos de neumotórax (ver sección 4.8). Se debe vigilar muy de cerca a los pacientes que estén siendo tratados con pazopanib para detectar signos y síntomas de neumotórax.
Población pediátrica
Debido a que el mecanismo de acción de pazopanib puede afectar gravemente al desarrollo y la maduración de los órganos de roedores durante el primer desarrollo postnatal (ver sección 5.3), pazopanib no se debe administrar a pacientes pediátricos menores de 2 años.
Se han notificado casos de infecciones graves (con o sin neutropenia), en algunos casos con desenlace mortal.
Combinación con otros tratamientos anti cancerígenos sistémicos
Los ensayos clínicos de pazopanib en combinación con pemetrexed (cáncer de pulmón no microcítico (CPNM)) y lapatinib (cáncer de cérvix) se interrumpieron antes de lo previsto debido al incremento de la toxicidad y/o mortalidad, y todavía no ha sido establecida una combinación de dosis segura y eficaz para estos tratamientos.
Embarazo
En estudios preclínicos en animales se ha observado toxicidad reproductiva (ver sección 5.3). Si se usa pazopanib durante el embarazo, o si la paciente se queda embarazada durante el tratamiento con pazopanib, se debe explicar a la paciente el riesgo potencial para el feto. Se debe aconsejar a las mujeres en edad fértil evitar quedarse embarazadas durante el tratamiento con pazopanib (ver sección 4.6).
Interacciones
Se debe evitar el tratamiento concomitante con inhibidores potentes de CYP3A4, glicoproteína-P (P-gp) o de la proteína resistente al cáncer de mama (BCRP) debido al riesgo de una mayor exposición a pazopanib (ver sección 4.5). Se recomienda hacer una selección alternativa de medicamentos concomitantes que no tengan potencial de inhibir o presenten un potencial mínimo de inhibir CYP34A, P-gp o BCRP.
Se debe evitar el tratamiento concomitante con inductores de CYP34A debido al riesgo de disminuir la exposición a pazopanib (ver sección 4.5).
Se han observado casos de hiperglucemia durante el tratamiento concomitante con ketoconazol.
Se debe tener precaución con la administración concomitante de pazopanib con sustratos de uridín difosfato glucuronosil transferasa 1A1 (UGT1A1) (ej. irinotecan) debido a que pazopanib es un inhibidor de UGT1A1 (ver sección 4.5).
Se debe evitar tomar zumo de pomelo durante el tratamiento con pazopanib (ver sección 4.5).
4.5 Interacción con otros medicamentos y otras formas de interacción
Efectos de otros medicamentos sobre _pazopanib
Los estudios in vitro sugieren que el metabolismo oxidativo de pazopanib en los microsomas hepáticos humanos es mediado principalmente por CYP3A4, con contribuciones menores de CYP1A2 y CYP2C8. Por lo tanto, los inhibidores e inductores de CYP3A4 pueden alterar el metabolismo de pazopanib.
Inhibidores de CYP3A4, P-gp, BCRP:
Pazopanib es un sustrato para CYP3A4, P-gp y BCRP.
La administración concomitante de pazopanib (400 mg una vez al día) con un inhibidor potente de CYP3A4 y P-gp, ketoconazole (400 mg una vez al día) durante 5 días consecutivos, produjo un incremento medio del AUC(0-24) y de la Cmax de pazopanib en un 66 % y un 45 % respectivamente, en comparación con la administración de pazopanib solo (400 mg una vez al día durante 7 días). La comparación de parámetros farmacocinéticos de Cmax (rango de medias de 27,5 a 58,1 pg/ml) y AUC(0-24) (rango de medias 48,7 a 1040 pg*h/ml) tras la administración de 800 mg de pazopanib solo y tras la administración de 400 mg de pazopanib junto con 400 mg de ketoconazol (media de Cmax 59,2 pg/ml, media de AUC(0-24) 1300 pg*h/ml ) indica que en presencia de un inhibidor potente de CYP3A4 y P-gp, la reducción de dosis a 400 mg de pazopanib una vez al día producirá en la mayoría de los pacientes una exposición sistémica similar a la observada tras la administración de 800 mg de solo pazopanib una vez al día. Sin embargo, algunos pacientes puede presentar una exposición sistémica a pazopanib mayor a la observada tras la administración de 800 mg de pazopanib solo.
La administración concomitante de pazopanib con otros inhibidores potentes de la familia CYP3A4 (e.j., itraconazol, claritromicina, atazanavir, indinavir, nefazodona, nelfinavir, ritonavir, saquinavir, telitromicina, voriconazol) pueden aumentar las concentraciones de pazopanib. El zumo de pomelo contiene un inhibidor de CYP3A4 y puede también aumentar las concentraciones plasmáticas de pazopanib.
La administración de 1.500 mg de lapatinib (sustrato e inhibidor débil de CYP3A4 y P-gp y potente inhibidor de BCRP) con 800 mg de pazopanib produjo un incremento de aproximadamente un 50% a un 60% en la media del AUC(0-24) y la Cmax de pazopanib, comparado con la administración de 800 mg de pazopanib solo. Es probable que la inhibición de P-gp y/o BCRP por lapatinib contribuya a un aumento de la exposición de pazopanib.
La administración concomitante de pazopanib con inhibidores de CYP3A4, P-gp y BCRP, como lapatinib, dará lugar a un incremento de las concentraciones plasmáticas de pazopanib. La administración concomitante con inhibidores potentes de P-pg o BCRP puede también alterar la exposición y la distribución de pazopanib, incluso la distribución en el sistema nervioso central (SNC).
Se debe evitar la administración concomitante de pazopanib con un inhibidor potente de CYP3A4 (ver sección 4.4). Si no se dispone de una alternativa médica aceptable diferente de un inhibidor potente de CYP3A4, se debe reducir la dosis de pazopanib a 400 mg al día durante la administración concomitante. En estos casos se debe prestar especial atención a las reacciones adversas relacionadas con el fármaco, y pueden plantearse reducciones de dosis adicionales si se observan posibles reacciones adversas relacionadas con el fármaco.
Por lo tanto, se debe evitar la combinación con inhibidores potentes de P-gp o BCRP, o se recomienda seleccionar una medicación alternativa concomitante que no tenga capacidad para inhibir o presente una mínima capacidad de inhibir P-gp o BCRP.
Inductores de CYP3A4, P-gp, BCRP:
Los inductores CYP3A4 como rifampina pueden disminuir las concentraciones plasmáticas de pazopanib. La administración concomitante de pazopanib con un potente inductor de P-gp o BCRP puede alterar la exposición y la distribución de pazopanib, incluso la distribución en el SNC. Se recomienda seleccionar una medicación alternativa concomitante que no tenga capacidad o que tenga una mínima capacidad de inducción enzimática o transportadora.
Los estudios in vitro con microsomas hepáticos humanos mostraton que pazopanib inhibe las enzimas CYP 1A2, 3A4, 2B6, 2C8, 2C9, 2C19, y 2E1. La capacidad de inducción de CYP3A4 en humanos se demostró en un análisis in vitro de PXR humano. En estudios de farmacología clínica en pacientes con cáncer, en los que utilizaron 800 mg de pazopanib una vez al día, se ha demostrado que pazopanib no tiene un efecto clínicamente relevante sobre la farmacocinética de la cafeína (CYP1A2 sonda de sustrato), warfarina (CYP2C9 sonda de sustrato), o el omeprazol (CYP2C19 sonda de sustrato). Pazopanib provoca un incremento de aproximadamente el 30% en la media del AUC y de la Cmax de midazolam (CYP3A4 sonda de sustrato) e incrementos del 33% al 64% en el cociente de las concentraciones de dextrometorfano a dextrofano en orina después de la administración oral de dextrometorfano (CYP2D6 sonda de sustrato). La administración conjunta de 800 mg de pazopanib una vez al día y paclitaxel 80 mg/m2 (CYP3A4 y CYP2C8 sustrato) una vez a la semana provocó un incremento medio del 25% y el 31% respectivamente en el AUC y la Cmax de paclitaxel.
En base a los valores in vitro de CI50 y los valores in vivo de la Cmax en plasma, los metabolitos de pazopanib GSK1268992 y GSK1268997 pueden contribuir al efecto inhibitorio neto de pazopanib sobre BCRP. Además, no se puede excluir la inhibición de BCRP y P-gp por pazopanib en el tracto gastrointestinal. Se debe tener cuidado cuando se administra conjuntamente pazopanib con otros sustratos orales de BCRP y P-gp.
In vitro, pazopanib inhibe el polipéptido transportador de aniones orgánicos humanos (OATP1B1). No se puede excluir que pazopanib afecte a la farmacocinética de los sustratos de OATP1B1 (por ej.: estatinas, ver a continuación “Efecto del uso concomitante de pazopanib y simvastatina”).
Pazopanib es un inhibidor in vitro de la enzima uridina difosfoglucuronosil-transferasa 1A1 (UGT1A1). El metabolito activo de irinotecan, SN-38, es un sustrato de OATP1B1 y UGT1A1. La coadministración de 400 mg de pazopanib una vez al día con 250 mg/m2 de cetuximab y 150 mg/m2 de irinotecan, produjo un incremento de la exposición sistémica a SN-38 de aproximadamente el 20 %. Pazopanib puede tener un mayor impacto sobre la disposición a SN-38 en sujetos con polimorfismo familiar en UGT1A1*28 que en sujetos con el alelo normal. Sin embargo, el genotipo UGT1A1 no fue siempre predictivo del efecto de pazopanib sobre la disposición a SN-38. Se debe tener precaución cuando se coadministre pazopanib con sustratos de UGT1A1.
Efecto del uso concomitante de _pazopanib ysimvastatina
El uso concomitante de pazopanib y simvastatina incrementa la incidencia de elevaciones de ALT. Los resultados procedentes de un meta análisis donde utilizaron datos agrupados de los estudios clínicos con pazopanib mostraron que elevaciones de ALT > 3 x LSN fueron notificadas en 126 / 895 (14 %) de los pacientes que no tomaron estatinas en comparación con 11 / 41 (27 %) de los pacientes que tomaron simvastatina simultáneamente (p = 0,038). Si un paciente que recibe simultáneamente simvastatina desarrolla elevaciones de ALT, siga las instrucciones posológicas de pazopanib y suspenda el tratamiento con simvastatina (ver sección 4.4). Además, el uso concomitante de pazopanib y otras estatinas se debe realizar con precaución ya que actualmente los datos disponibles son insuficientes para evaluar su impacto en los niveles de ALT. No se puede descartar que pazopanib afecte a la farmacocinética de otras estatinas (por ej.: atorvastatina, fluvastatina, pravastatina, rosuvastatina).
La administración de pazopanib con comidas con alto o bajo contenido en grasas da lugar a un incremento de aproximadamente 2 veces en el AUC y la Cmax. Por lo tanto, pazopanib se debe administrar al menos 1 hora antes o 2 horas después de las comidas.
Medicamentos que aumentan el _pH gástrico
La administración concomitante de pazopanib con esomeprazol disminuye la biodisponibilidad de pazopanib aproximadamente en un 40 % (AUC y Cmax), y se debe evitar la administración conjunta de pazopanib con medicamentos que aumentan el pH gástrico. Si el médico considera necesario emplear de forma concomitante un inhibidor de la bomba de protones (IBP), se recomienda tomar la dosis pazopanib en ausencia de alimentos, una vez al día por la noche junto con el IBP. Si el médico considera necesario emplear de forma concomitante un antagonista de los receptores H2, pazopanib se debe tomar en ausencia de alimentos al menos 2 horas antes o 10 horas después de tomar un antagonista de los receptores H2. Pazopanib debe ser administrado al menos 1 hora antes o 2 horas después de la administración de antiácidos de acción rápida. Las recomendaciones sobre cómo administrar pazopanib junto con IBP y con antagonistas de los receptores H2 se basan en consideraciones fisiológicas.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No existen datos adecuados del uso de pazopanib en mujeres embarazadas. Los estudios en animales han mostrado toxicidad reproductiva (ver sección 5.3). El riesgo potencial en humanos es desconocido.
Pazopanib no se debe utilizar durante el embarazo a menos que el estado clínico de las mujeres requiera el tratamiento con pazopanib. Si se utiliza pazopanib durante el embarazo, o si la paciente se queda embarazada durante el tratamiento con pazopanib, se debe explicar a la paciente el posible riesgo que existe para el feto.
Se debe aconsejar a las mujeres en edad fértil que utilicen un método anticonceptivo adecuado durante el tratamiento y al menos 2 semanas después del tratamiento para evitar quedarse embarazadas durante el tratamiento con pazopanib.
Lactancia
No se ha establecido el uso seguro de pazopanib durante la lactancia. Se desconoce si pazopanib se excreta en la leche materna. No hay datos en animales sobre la excreción de pazopanib en la leche, por tanto el riesgo en el lactante no puede ser excluido. La lactancia debe interrumpirse durante el tratamiento con pazopanib.
Fertilidad
Estudios en animales indican que la fertilidad masculina y femenina puede verse afectada por el tratamiento con pazopanib (ver sección 5.3).
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No se han realizado estudios de los efectos sobre la capacidad para conducir y utilizar máquinas. No se puede predecir que exista un efecto perjudicial en estas actividades a partir de la farmacología de pazopanib. Se debe tener en cuenta el estado clínico del paciente y el perfil de acontecimientos adversos de pazopanib cuando se examina la habilidad del paciente para realizar tareas que requieran juicio, habilidades motoras o cognitivas. Los pacientes deben evitar conducir o utilizar máquinas si sienten mareo, cansancio o debilidad.
4.8 Reacciones adversas
Resumen del_perfil de seguridad
Los datos agrupados procedentes del estudio pivotal en CCR (VEG105192, n=290), el estudio de extensión (VEG107769, n=71), el estudio complementario de Fase II (VEG102616, n=225) y el estudio Fase III de no inferioridad, randomizado, abierto, de grupos paralelos (VEG108844, n=557), fueron analizados en la evaluación global de seguridad y tolerabilidad de pazopanib (total n=1.149) en pacientes con CCR (ver sección 5.1).
Los datos agrupados procedentes del estudio pivotal en STB (VEG110727, n = 369) y el estudio complementario Fase II (VEG20002, n = 142) fueron analizados en la evaluación global de seguridad y tolerabilidad de pazopanib (población total de seguridad n = 382) en sujetos con STB (ver sección 5.1).
La reacciones adversas graves más importantes identificadas en los estudios de CCR y STB fueron: accidente isquémico transitorio, accidente cerebrovascular isquémico, isquemia de miocardio, infarto de miocardio e infarto cerebral, insuficiencia cardiaca, perforación gastrointestinal y fístula, prolongación del intervalo QT y hemorragia pulmonar, gastrointestinal y cerebral. Todas las reacciones adversas fueron notificadas en < 1 % de los pacientes tratados. Entre las otras importantes reacciones adversas graves identificadas en los estudios en STB se incluyen, acontecimientos tromboembólicos venosos, disfunción del ventrículo izquierdo y neumotórax.
Entre los eventos mortales que posiblemente tuvieron relación con pazopanib se incluyeron la hemorrágia gastrointestinal, hemorragia pulmonar/hemoptisis, función hepática anormal, perforación intestinal y accidente cerebrovascular isquémico.
Entre las reacciones adversas más comunes (experimentadas por al menos el 10% de los pacientes) de cualquier grado en los estudios en CCR y STB se incluyeron: diarrea, cambios en el color del pelo, hipopigmentación de la piel, erupción cutánea exfoliativa, hipertensión, náusea, dolor de cabeza, fatiga, anorexia, vómitos, disgeusia, estomatitis, disminución de peso, dolor, elevaciones de alanina aminotransferasa y aspartato aminotransferasa.
Las reacciones adversas relacionadas con el tratamiento, en todos los grados, que fueron notificadas en sujetos con CCR y STB o durante el periodo postcomercialización, se enumeran a continuación por la clasificación de órganos del sistema MedDRA, por frecuencia y por el nivel de gravedad. Se ha empleado el siguiente criterio para la clasificación de la frecuencia:
Muy frecuentes Frecuentes Poco frecuentes Raras Muy raras No conocida
>1/10
>1/100 a <1/10 >1/1.000 a <1/100 >1/10.000 a <1/1.000 <1/10.000
(no puede estimarse a partir de los datos disponibles)
Las categorías han sido asignadas en base a las frecuencias absolutas procedentes de los datos de estudios clínicos. Los datos sobre la seguridad y tolerabilidad postcomercialización también han sido evaluados en todos los ensayos clínicos de pazopanib y en las notificaciones espontáneas. Dentro de cada clasificación de órganos por sistema, las reacciones adversas con la misma frecuencia se enumeran en orden decreciente de gravedad.
Tabla de reacciones adversas
Tabla 2: Reacciones adversas relacionadas con el tratamiento notificadas en los estudios en CCR (n = 1.149) o durante el periodo postcomercialización
|
Sistema de clasificación de órganos |
Frecuencia (todos los grados) |
Reacciones adversas |
Todos los Grados n (%) |
Grado 3 n (%) |
Grado 4 n (%) |
|
Infecciones e infestaciones |
Poco frecuentes |
Infecciones (con o sin neutropenia)f |
desconocida |
desconocida |
desconocida |
|
Poco frecuentes |
Infección gingival |
1 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Peritonitis infecciosa |
1 (< 1 %) |
0 |
0 | |
|
Neoplasias benignas, malignas y no especificadas (incl quistes y pólipos) |
Poco frecuentes |
Dolor tumoral |
1 (< 1 %) |
1 (< 1 %) |
0 |
|
Trastornos de la sangre y del sistema linfático |
Frecuentes |
Trombocitopenia |
80 (7 %) |
10 (< 1 %) |
5 (< 1 %) |
|
Frecuentes |
Neutropenia |
79 (7 %) |
20 (2 %) |
4 (< 1 %) | |
|
Frecuentes |
Leucopenia |
63 (5 %) |
5 (< 1 %) |
0 | |
|
Raras |
Microangiopatía trombótica (incluyendo púrpura trombocitopénica trombótica y síndrome urémico hemolítico)f |
desconocida |
desconocida |
desconocida | |
|
Trastornos endocrinos |
Frecuentes |
Hipotiroidismo |
83 (7 %) |
1 (< 1 %) |
0 |
|
Trastornos del metabolismo y de la nutrición |
Muy frecuentes |
Disminución del apetitoe |
317 (28 %) |
14 (1 %) |
0 |
|
Frecuentes |
Hipofosfatemia |
21 (2 %) |
7 (< 1 %) |
0 | |
|
Frecuentes |
Deshidratación |
16 (1 %) |
5 (< 1 %) |
0 | |
|
Poco frecuentes |
Hipomagnesemia |
10 (< 1 %) |
0 |
0 | |
|
Trastornos psiquiátricos |
Frecuentes |
Insomnio |
30 (3 %) |
0 |
0 |
|
Trastornos del sistema nervioso |
Muy frecuentes |
Disgeusiac |
254 (22 %) |
1 (< 1 %) |
0 |
|
Muy frecuentes |
Cefalea |
122 (11%) |
11 (< 1 %) |
0 | |
|
Frecuentes |
Mareo |
55 (5 %) |
3 (< 1 %) |
1 (< 1 %) | |
|
Frecuentes |
Letargia |
30 (3 %) |
3 (< 1 %) |
0 | |
|
Frecuentes |
Parestesia |
20 (2 %) |
2 (< 1 %) |
0 | |
|
Frecuentes |
Neuropatía sensorial periférica |
17 (1 %) |
0 |
0 | |
|
Poco frecuentes |
Hipoestesia |
8 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Accidente isquémico transitorio |
7 (< 1 %) |
4 (< 1 %) |
0 | |
|
Poco frecuentes |
Somnolencia |
3 (< 1 %) |
1 (< 1 %) |
0 | |
|
Poco frecuentes |
Accidente cerebrovascular |
2 (< 1 %) |
1 (< 1 %) |
1 (< 1 %) | |
|
Poco frecuentes |
Ictus isquémico |
2 (< 1 %) |
0 |
1 (< 1 %) | |
|
Raras |
Encefalopatía posterior reversible/ síndrome de leucoencefalopatía posterior reversible |
desconocida |
desconocida |
desconocida | |
|
Trastornos oculares |
Frecuentes |
Visión borrosa |
19 (2 %) |
1 (< 1 %) |
0 |
|
Poco frecuentes |
Desprendimiento de retinaf |
1 (< 1 %) |
1 (< 1 %) |
0 | |
|
Poco frecuentes |
Desgarro retinianof |
1 (< 1 %) |
1 (< 1 %) |
0 | |
|
Poco frecuentes |
Alteración del color de las pestañas |
4 (< 1 %) |
0 |
0 |
|
Poco frecuentes |
Bradicardia |
6 (< 1 %) |
0 |
0 | |
|
Trastornos |
Poco frecuentes |
Infarto de miocardio |
5 (< 1 %) |
1 (< 1 %) |
4 (< 1 %) |
|
cardiacos |
Poco frecuentes |
Disfunción cardiaca |
4 (< 1 %) |
1 (< 1 %) |
0 |
|
Poco frecuentes |
Isquemia de miocardio |
3 (< 1 %) |
1 (< 1 %) |
0 | |
|
Muy frecuentes |
Hipertensión |
473 (41 %) |
115(10%) |
1 (< 1 %) | |
|
Frecuentes |
Sofoco |
16 (1 %) |
0 |
0 | |
|
Trastornos |
Frecuentes |
Eventos tromboembólicos venosos g |
13 (1 %) |
6 (< 1 %) |
7 (< 1 %) |
|
vasculares |
Frecuentes |
Rubefacción |
12 (1 %) |
0 |
0 |
|
Poco frecuentes |
Crisis hipertensiva |
6 (< 1 %) |
0 |
2 (< 1 %) | |
|
Poco frecuentes |
Hemorragia |
1 (< 1 %) |
0 |
0 |
|
Trastornos respiratorios, torácicos y mediastínicos |
Frecuentes |
Epistaxis |
50 (4 %) |
1 (< 1 %) |
0 |
|
Frecuentes |
Disfonía |
48 (4 %) |
0 |
0 | |
|
Frecuentes |
Disnea |
42 (4 %) |
8 (< 1 %) |
1 (< 1 %) | |
|
Frecuentes |
Hemoptisis |
15 (1 %) |
1 (< 1 %) |
0 | |
|
Poco frecuentes |
Rinorrea |
8 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Hemorragia pulmonar |
2 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Neumotórax |
1 (< 1 %) |
0 |
0 | |
|
Raras |
Enfermedad pulmonar intersticial/neumonitisf |
desconocida |
desconocida |
desconocida |
|
Muy frecuentes |
Diarrea |
614 (53 %) |
65 (6 %) |
2 (< 1 %) | |
|
Muy frecuentes |
Náusea |
386 (34 %) |
14 (1%) |
0 | |
|
Muy frecuentes |
Vómitos |
225 (20 %) |
18 (2 %) |
1 (< 1 %) | |
|
Muy frecuentes |
Dolor abdominal3 |
139 (12 %) |
15 (1 %) |
0 | |
|
Frecuentes |
Estomatitis |
96 (8 %) |
4 (< 1 %) |
0 | |
|
Frecuentes |
Dispepsia |
83 (7 %) |
2 (< 1 %) |
0 | |
|
Frecuentes |
Flatulencia |
43 (4 %) |
0 |
0 | |
|
Frecuentes |
Distensión abdominal |
36 (3 %) |
2 (< 1 %) |
0 | |
|
Frecuentes |
Ulceración de la boca |
28 (2 %) |
3 (< 1 %) |
0 | |
|
Frecuentes |
Sequedad bucal |
27 (2 %) |
0 |
0 | |
|
Poco frecuentes |
Pancreatitis |
8 (< 1 %) |
4 (< 1 %) |
0 | |
|
Poco frecuentes |
Hemorragia rectal |
8 (< 1 %) |
2 (< 1 %) |
0 | |
|
Poco frecuentes |
Hematoquecia |
6 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Hemorragia gastrointestinal |
4 (< 1 %) |
2 (< 1 %) |
0 | |
|
Trastornos gastrointestinales |
Poco frecuentes |
Melenas |
4 (< 1 %) |
1(< 1 %) |
0 |
|
Poco frecuentes |
Movimientos intestinales frecuentes |
3 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Hemorragia anal |
2 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Perforación del intestino grueso |
2 (< 1 %) |
1 (< 1 %) |
0 | |
|
Poco frecuentes |
Hemorragia bucal |
2 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Hemorragia gastrointestinal alta |
2 (< 1 %) |
1 (< 1 %) |
0 | |
|
Poco frecuentes |
Fístula enterocutánea |
1 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Hematemesis |
1 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Hemorragia hemorroidal |
1 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Perforación de íleon |
1 (< 1 %) |
0 |
1 (< 1 %) | |
|
Poco frecuentes |
Hemorragia esofágica |
1 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Hemorragia retroperitoneal |
1 (< 1 %) |
0 |
0 |
|
Frecuentes |
Hiperbilirrubinemia |
38 (3 %) |
2 (< 1 %) |
1 (< 1 %) | |
|
Trastornos |
Frecuentes |
Función hepática anormal |
29 (3 %) |
13 (1 %) |
2 (< 1 %) |
|
hepatobiliares |
Frecuentes |
Hepatotoxicidad |
18 (2 %) |
11 (< 1 %) |
2 (< 1 %) |
|
Poco frecuentes |
Ictericia |
3 (< 1 %) |
1 (< 1 %) |
0 | |
|
Poco frecuentes |
Daño hepático inducido por fármacos |
2 (< 1 %) |
2 (< 1 %) |
0 | |
|
Poco frecuentes |
Fallo hepático |
1 (< 1 %) |
0 |
1 (< 1 %) | |
|
Muy frecuentes |
Cambios de color del pelo |
404 (35 %) |
1 (< 1 %) |
0 | |
|
Muy frecuentes |
Síndrome de eritrodisestesia palmoplantar |
206 (18 %) |
39 (3 %) |
0 | |
|
Muy frecuentes |
Alopecia |
130 (11%) |
0 |
0 | |
|
Muy frecuentes |
Erupción |
129 (11%) |
7 (< 1 %) |
0 | |
|
Frecuentes |
Hipopigmenta-ción de la piel |
52 (5 %) |
0 |
0 | |
|
Frecuentes |
Piel seca |
50 (4 %) |
0 |
0 | |
|
Frecuentes |
Prurito |
29 (3 %) |
0 |
0 | |
|
Frecuentes |
Eritema |
25 (2 %) |
0 |
0 | |
|
Frecuentes |
Despigmentación de la piel |
20 (2 %) |
0 |
0 | |
|
Frecuentes |
Hiperhidrosis |
17 (1 %) |
0 |
0 | |
|
Trastornos de la |
Poco frecuentes |
Trastornos en las uñas |
11 (< 1 %) |
0 |
0 |
|
piel y del tejido subcutáneo |
Poco frecuentes |
Exfoliación de la piel |
10 (< 1 %) |
0 |
0 |
|
Poco frecuentes |
Reacción de fotosensibilidad |
7 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Erupción eritematosa |
6 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Trastornos de la piel |
5 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Erupción macular |
4 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Erupción prurítica |
3 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Erupción vesicular |
3 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Prurito generalizado |
2 (< 1 %) |
1 (< 1 %) |
0 | |
|
Poco frecuentes |
Erupción generalizada |
2 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Erupción papular |
2 (< 1 %) |
0 |
0 |
|
Poco frecuentes |
Eritema plantar |
1 (< 1 %) |
0 |
0 | |
|
Trastornos musculoesquelé-ticos y del tejido conjuntivo |
Frecuentes |
Artralgia |
48 (4 %) |
8 (< 1 %) |
0 |
|
Frecuentes |
Mialgia |
35 (3 %) |
2 (< 1 %) |
0 | |
|
Frecuentes |
Espasmos musculares |
25 (2 %) |
0 |
0 | |
|
Poco frecuentes |
Dolor musculoesquelético |
9 (< 1 %) |
1 (< 1 %) |
0 | |
|
Trastornos renales y urinarios |
Muy Frecuentes |
Proteinuria |
135 (12 %) |
32 (3 %) |
0 |
|
Poco frecuentes |
Hemorragia en el tracto urinario |
1 (< 1 %) |
0 |
0 | |
|
Trastornos del aparato reproductor y de la mama |
Poco frecuentes |
Menorragia |
3 (< 1 %) |
0 |
0 |
|
Poco frecuentes |
Hemorragia vaginal |
3 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Metrorragia |
1 (< 1 %) |
0 |
0 | |
|
Trastornos generales y alteraciones en el lugar de administración |
Muy frecuentes |
Fatiga |
415 (36 %) |
65 (6 %) |
1 (< 1 %) |
|
Frecuentes |
Inflamación de la mucosa |
86 (7 %) |
5 (< 1 %) |
0 | |
|
Frecuentes |
Astenia |
82 (7 %) |
20 (2 %) |
1 (< 1 %) | |
|
Frecuentes |
Edemab |
72 (6 %) |
1 (< 1 %) |
0 | |
|
Frecuentes |
Dolor torácico |
18 (2 %) |
2 (< 1 %) |
0 | |
|
Poco frecuentes |
Escalofríos |
4 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Trastorno en la membrana mucosa |
1 (< 1 %) |
0 |
0 |
|
Muy frecuentes |
Incremento de alanina aminotransferasa |
246 (21 %) |
84 (7 %) |
14 (1 %) | |
|
Muy frecuentes |
Incremento de aspartato aminotransferasa |
211 (18%) |
51 (4 %) |
10 (< 1 %) | |
|
Frecuentes |
Pérdida de peso |
96 (8 %) |
7 (< 1 %) |
0 | |
|
Frecuentes |
Incremento de bilirrubina en sangre |
61 (5 %) |
6 (< 1 %) |
1 (< 1 %) | |
|
Frecuentes |
Incremento de creatinina en sangre |
55 (5 %) |
3 (< 1 %) |
0 | |
|
Frecuentes |
Incremento de lipasa |
51 (4 %) |
21 (2 %) |
7 (< 1 %) | |
|
Frecuentes |
Descenso del recuento de leucocitos en sangred |
51 (4 %) |
3 (< 1 %) |
0 | |
|
Frecuentes |
Incremento de la hormona estimulante de la tiroides en sangre |
36 (3 %) |
0 |
0 | |
|
Frecuentes |
Incremento de amilasa |
35 (3 %) |
7 (< 1 %) |
0 | |
|
Exploraciones complementarias |
Frecuentes |
Incremento de Gamma-glutamiltransferasa |
31 (3 %) |
9 (< 1 %) |
4 (< 1 %) |
|
Frecuentes |
Incremento de la presión arterial |
15 (1 %) |
2 (< 1 %) |
0 | |
|
Frecuentes |
Incremento de urea en sangre |
12 (1 %) |
1 (< 1 %) |
0 | |
|
Frecuentes |
Prueba de función hepática anormal |
12 (1 %) |
6 (< 1 %) |
1 (< 1 %) | |
|
Poco frecuentes |
Incremento de las enzimas hepáticas |
11 (< 1 %) |
4 (< 1 %) |
3 (< 1 %) | |
|
Poco frecuentes |
Descenso de glucosa en sangre |
7 (< 1 %) |
0 |
1 (< 1 %) | |
|
Poco frecuentes |
Prolongación del intervalo QT del electrocardiograma |
7 (< 1 %) |
2 (< 1 %) |
0 | |
|
Poco frecuentes |
Incremento de transaminasas |
7 (< 1 %) |
1 (< 1 %) |
0 | |
|
Poco frecuentes |
Prueba de función tiroidea anormal |
3 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Incremento de la presión arterial diastólica |
2 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Incremento de la presión arterial sistólica |
1 (< 1 %) |
0 |
0 |
f Reacciones adversas relacionadas con el tratamiento y notificadas durante el periodo postcomercialización (notificación espontánea de casos y reacciones adversas graves procedentes de todos los ensayos clínicos con pazopanib).
Los siguientes términos se han combinado:
a Dolor abdominal, dolor en la parte superior e inferior del abdomen b Edema, edema periférico, edema del ojo, edema localizado y edema de cara c Disgeusia, ageusia e hipogeusia
d Descenso en el recuento de glóbulos blancos, neutrófilos y leucocitos e Disminución del apetito y anorexia
f Disfunción cardiaca, disfunción del ventrículo izquierdo, insuficiencia cardiaca y cardiomiopatía restrictiva
g Evento tromboembólico venoso, trombosis venosa profunda, embolismo pulmonar y trombosis
En pacientes con ascendencia del Este Asiático, se observaron con mayor frecuencia casos de neutropenia, trombocitopenia y síndrome de eritrodisestesia palmoplantar.
Tabla 3: Reacciones adversas relacionadas con el tratamiento notificadas en los estudios en STB (n = 382)
|
Sistema de clasificación de órganos |
Frecuencia (todos los grados) |
Reacciones Adversas |
Todos los Grados n (%) |
Grado 3 n (%) |
Grado 4 n (%) |
|
Infecciones e infestaciones |
Frecuentes |
Infección gingival |
4 (1 %) |
0 |
0 |
|
Neoplasias benignas, malignas y no especificadas (incl quistes y pólipos) |
Muy frecuentes |
Dolor tumoral |
121 (32 %) |
32 (8 %) |
0 |
|
Trastornos de la sangre y del sistema linfático f |
Muy frecuentes |
Leucopenia |
106 (44 %) |
3 (1 %) |
0 |
|
Muy frecuentes |
T rombocitopenia |
86 (36 %) |
7 (3 %) |
2 (< 1 %) | |
|
Muy frecuentes |
Neutropenia |
79 (33 %) |
10 (4 %) |
0 | |
|
Poco frecuentes |
Microangiopatía trombótica (incluyendo púrpura trombocitopénica trombótica y síndrome hemolítico urémico) |
1 (< 1 %) |
1 (< 1 %) |
0 | |
|
Trastornos endocrinos |
Frecuentes |
Hipotiroidismo |
18 (5 %) |
0 |
0 |
|
Trastornos del metabolismo y de la nutrición |
Muy frecuentes |
Disminución del apetitoe |
108 (28 %) |
12 (3 %) |
0 |
|
Muy frecuentes |
Hipoalbuminemia |
81 (34 %) |
2 (< 1 %) |
0 | |
|
Frecuentes |
Deshidratación |
4 (1 %) |
2 (1 %) |
0 | |
|
Poco frecuentes |
Hipomagnesemia |
1 (< 1 %) |
0 |
0 | |
|
Trastornos psiquiátricos |
Frecuentes |
Insomnio |
5 (1 %) |
1 (< 1 %) |
0 |
|
Trastornos del sistema nervioso |
Muy frecuentes |
Disgeusiac |
79 (21 %) |
0 |
0 |
|
Muy frecuentes |
Cefalea |
54 (14 %) |
2 (< 1 %) |
0 | |
|
Frecuentes |
Neuropatía sensorial periférica |
30 (8 %) |
1 (< 1 %) |
0 | |
|
Frecuentes |
Mareo |
15 (4 %) |
0 |
0 | |
|
Poco frecuentes |
Somnolencia |
3 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Parestesia |
1 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Infarto cerebral |
1 (< 1 %) |
0 |
1 (< 1 %) | |
|
Trastornos oculares |
Frecuentes |
Visión borrosa |
15 (4 %) |
0 |
0 |
|
Trastornos cardiacos |
Frecuentes |
Disfunción cardiacag |
21 (5 %) |
3 (< 1 %) |
1 (< 1 %) |
|
Frecuentes |
Disfunción del ventrículo izquierdo |
13 (3 %) |
3 (< 1 %) |
0 | |
|
Frecuentes |
Bradicardia |
4 (1 %) |
0 |
0 | |
|
Poco frecuentes |
Infarto de miocardio |
1 (< 1 %) |
0 |
0 | |
|
Trastornos vasculares |
Muy frecuentes |
Hipertensión |
152 (40 %) |
26 (7 %) |
0 |
|
Frecuentes |
Acontecimientos tromboembólicos venososd |
13 (3 %) |
4 (1 %) |
5 (1 %) | |
|
Frecuentes |
Sofoco |
12 (3 %) |
0 |
0 | |
|
Frecuentes |
Rubefacción |
4 (1 %) |
0 |
0 | |
|
Poco frecuentes |
Hemorragia |
2 (< 1 %) |
1 (< 1 %) |
0 | |
|
Trastornos respiratorios, torácicos y mediastínicos |
Frecuentes |
Epistaxis |
22 (6 %) |
0 |
0 |
|
Frecuentes |
Disfonia |
20 (5 %) |
0 |
0 | |
|
Frecuentes |
Disnea |
14 (4 %) |
3 (< 1 %) |
0 | |
|
Frecuentes |
Tos |
12 (3 %) |
0 |
0 | |
|
Frecuentes |
Neumotórax |
7 (2 %) |
2 (< 1 %) |
1 (< 1 %) | |
|
Frecuentes |
Hipo |
4 (1 %) |
0 |
0 | |
|
Frecuentes |
Hemorragia pulmonar |
4 (1 %) |
1 (< 1 %) |
0 | |
|
Poco frecuentes |
Dolor orofaríngeo |
3 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Hemorragia bronquial |
2 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Rinorrea |
1 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Hemoptisis |
1 (< 1 %) |
0 |
0 | |
|
Raras |
Enfermedad pulmonar intersticial/neumonitisf |
desconocida |
desconocida |
desconocida |
|
Muy frecuentes |
Diarrea |
174 (46 %) |
17 (4 %) |
0 | |
|
Muy frecuentes |
Náusea |
167 (44 %) |
8 (2 %) |
0 | |
|
Muy frecuentes |
Vómitos |
96 (25 %) |
7 (2 %) |
0 | |
|
Muy frecuentes |
Dolor abdominal3 |
55 (14 %) |
4 (1 %) |
0 | |
|
Muy frecuentes |
Estomatitis |
41 (11 %) |
1 (< 1 %) |
0 | |
|
Frecuentes |
Distensión abdominal |
16 (4 %) |
2 (1 %) |
0 | |
|
Frecuentes |
Sequedad bucal |
14 (4 %) |
0 |
0 | |
|
Frecuentes |
Dispepsia |
12 (3 %) |
0 |
0 | |
|
Frecuentes |
Hemorragia bucal |
5 (1 %) |
0 |
0 | |
|
Frecuentes |
Flatulencia |
5 (1 %) |
0 |
0 | |
|
Frecuentes |
Hemorragia anal |
4 (1 %) |
0 |
0 | |
|
Trastornos |
Poco frecuentes |
Hemorragia gastrointestinal |
2 (< 1 %) |
0 |
0 |
|
gastrointestinales |
Poco frecuentes |
Hemorragia rectal |
2 (< 1 %) |
0 |
0 |
|
Poco frecuentes |
Fístula enterocutánea |
1 (< 1 %) |
1 (< 1 %) |
0 | |
|
Poco frecuentes |
Hemorragia gástrica |
1 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Melenas |
2 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Hemorragia esofágica |
1 (< 1 %) |
0 |
1 (< 1 %) | |
|
Poco frecuentes |
Peritonitis |
1 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Hemorragia retroperitoneal |
1 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Hemorragia gastrointestinal superior |
1 (< 1 %) |
1 (< 1 %) |
0 | |
|
Poco frecuentes |
Perforación del ileón |
1 (< 1 %) |
0 |
1 (< 1 %) | |
|
Trastornos hepatobiliares |
Poco frecuentes |
Función hepática anormal |
2 (< 1 %) |
0 |
1 (< 1 %) |
|
Trastornos de la piel y del tejido subcutáneo |
Muy frecuentes |
Cambios de color del pelo |
93 (24 %) |
0 |
0 |
|
Muy frecuentes |
Hipopigmentación de la piel |
80 (21 %) |
0 |
0 | |
|
Muy frecuentes |
Erupción exfoliativa |
52 (14 %) |
2 (< 1 %) |
0 | |
|
Frecuentes |
Alopecia |
30 (8 %) |
0 |
0 | |
|
Frecuentes |
Trastornos de la pielc |
26 (7 %) |
4 (1 %) |
0 | |
|
Frecuentes |
Piel seca |
21 (5 %) |
0 |
0 | |
|
Frecuentes |
Hiperhidrosis |
18 (5 %) |
0 |
0 | |
|
Frecuentes |
Trastornos de las uñas |
13 (3 %) |
0 |
0 | |
|
Frecuentes |
Prurito |
11 (3 %) |
0 |
0 | |
|
Frecuentes |
Eritema |
4 (1 %) |
0 |
0 | |
|
Poco frecuentes |
Úlcera de la piel |
3 (< 1 %) |
1 (< 1 %) |
0 | |
|
Poco frecuentes |
Erupción cutánea |
1 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Erupción papular |
1 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Reacción de fotosensibilidad |
1 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Síndrome de eritrodisestesia palmoplantar |
2 (<1 %) |
0 |
0 | |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Frecuentes |
Dolor musculoesquelético |
35 (9 %) |
2 (< 1 %) |
0 |
|
Frecuentes |
Mialgia |
28 (7 %) |
2 (< 1 %) |
0 | |
|
Frecuentes |
Espasmos musculares |
8 (2 %) |
0 |
0 | |
|
Poco frecuentes |
Artralgia |
2 (< 1 %) |
0 |
0 | |
|
Trastornos renales y urinarios |
Poco frecuentes |
Proteinuria |
2 (<1 %) |
0 |
0 |
|
Trastornos del aparato reproductor y de la mama |
Poco frecuentes |
Hemorragia vaginal |
3 (< 1 %) |
0 |
0 |
|
Poco frecuentes |
Menorragia |
1 (< 1 %) |
0 |
0 | |
|
Trastornos generales y alteraciones en el lugar de administración |
Muy frecuentes |
Fatiga |
178 (47 %) |
34 (9 %) |
1 (< 1 %) |
|
Frecuentes |
Edemab |
18 (5 %) |
1 (< 1 %) |
0 | |
|
Frecuentes |
Dolor en el pecho |
12 (3 %) |
4 (1 %) |
0 | |
|
Frecuentes |
Escalofríos |
10 (3 %) |
0 |
0 | |
|
Poco frecuentes |
Inflamación de las e mucosas |
1 (<1 %) |
0 |
0 | |
|
Poco frecuentes |
Astenia |
1 (< 1 %) |
0 |
0 |
|
Exploraciones complementarias |
Muy frecuentes |
Pérdida de peso |
86 (23 %) |
5 (1 %) |
0 |
|
Frecuentes |
Examen anormal de oídos, nariz y gargantae |
29 (8 %) |
4 (1 %) |
0 | |
|
Frecuentes |
Elevación de alanina aminotransferasa |
8 (2 %) |
4 (1 %) |
2 (< 1 %) | |
|
Frecuentes |
Colesterol en sangre anormal |
6 (2 %) |
0 |
0 | |
|
Frecuentes |
Elevación de aspartato aminotransferasa |
5 (1 %) |
2 (< 1 %) |
2 (< 1 %) | |
|
Frecuentes |
Elevación de gamma glutamyltransferasa |
4 (1 %) |
0 |
3 (< 1 %) | |
|
Poco frecuentes |
Incremento de bilirrubina en sangre |
2 (<1 %) |
0 |
0 | |
|
Poco frecuentes |
Aspartato aminotransferasa |
2 (< 1 %) |
0 |
2 (< 1 %) | |
|
Poco frecuentes |
Alanina aminotransferasa |
1 (< 1 %) |
0 |
1 (< 1 %) | |
|
Poco frecuentes |
Disminución del recuento de plaquetas |
1 (< 1 %) |
0 |
1 (< 1 %) | |
|
Poco frecuentes |
Prolongación del intervalo QT del electrocardiograma |
2 (< 1 %) |
1 (< 1 %) |
0 |
f Reacciones adversas relacionadas con el tratamiento y notificadas durante el periodo postcomercialización (notificación espontánea de casos y reacciones adversas graves procedentes de todos los ensayos clínicos con pazopanib).
Los siguientes términos han sido combinados: a Dolor abdominal, dolor abdominal superior y dolor gastrointestinal b Edema, edema periférico y edema palpebral
c La mayoría de los casos fueron síndrome de eritrodisestesia palmoplantar
d Acontecimientos tromboembólicos venosos - incluye trombosis venosa profunda, embolismo pulmonar y términos de trombosis
e La mayoría de estos casos se describieron como mucositis
f La frecuencia está basada en las tablas de valores del laboratorio procedentes de VEG110727 (N = 240). Estos fueron notificados por los investigadores como acontecimientos adversos menos frecuentes que los indicados en las tablas de valores del laboratorio.
g Acontecimientos de disfunción cardiaca - incluye disfunción del ventrículo izquierdo, fallo cardiaco y cardiomiopatía restrictiva
h La frecuencia está basada en los acontecimientos adversos notificados por los investigadores. Las anomalías del laboratorio fueron notificadas por los investigadores como acontecimientos adversos menos frecuentes que los indicados en las tablas de valores del laboratorio.
En pacientes con ascendencia del Este Asiático, se observaron con mayor frecuencia casos de neutropenia, trombocitopenia y síndrome de eritrodisestesia palmoplantar.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Anexo V*.
4.9 Sobredosis
En los estudios clínicos se ha evaluado el empleo de dosis superiores a 2.000 mg de pazopanib. Se ha observado fatiga de Grado 3 (toxicidad limitante de dosis) e hipertensión de Grado 3 en 1 de cada 3 pacientes que recibieron dosis de 2.000 mg y 1.000 mg de pazopanib al día, respectivamente.
No existe un antídoto específico para la sobredosis con pazopanib y el tratamiento de la sobredosis debe consistir en medidas de soporte.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Agentes antineoplásicos, otros agentes antineoplásicos, inhibidores de protein kinasa, código ATC: L01XE11
Mecanismo de acción
Pazopanib administrado por vía oral, es un potente inhibidor de tirosin kinasa (ITK) que inhibe múltiples Receptores del Factor de Crecimiento Endotelial Vascular (VEGFR)-1, -2 y -3, inhibe los receptores del factor de crecimiento derivado de plaquetas (PDGFR)-a y -p, e inhibe el receptor del factor de células madre (c-KIT), con valores CI50, de 10, 30, 47, 71, 84 y 74 nM, respectivamente. En experimentos preclínicos, pazopanib produjo una inhibición dependiente de la dosis, de la autofosforilación inducida por ligando de los receptores VEGFR-2, c-Kit y PDGFR-p en las células. In vivo, pazopanib inhibió la fosforilación de VEGFR-2 inducida por VEGF en los pulmones de ratón, la angiogénesis en varios modelos animales y el crecimiento de múltiples xenotransplantes de tumores humanos en ratones.
Farmacogenómica
En un metanálisis farmacogenético de datos procedentes de 31 ensayos clínicos de pazopanib administrado o bien en monoterapia o bien en combinación con otros agentes, se observó ALT > 5 x LSN (Grado 3 NCI CTC) en un 19% de los portadores del alelo HLA-B*57:01 y en un 10% de los no portadores. En esta base de datos, 133/2235 (6%) de los pacientes eran portadores del alelo HLA-B*57:01 (ver sección 4.4).
Estudios clínicos
Carcinoma de Células Renales (CCR)
Se evaluó la seguridad y la eficacia de pazopanib en CCR en un estudio aleatorizado, doble ciego, multicéntrico, controlado con placebo. Los pacientes (N = 435) con CCR avanzado y/o metastásico fueron aleatorizados para recibir 800 mg de pazopanib una vez al día o placebo. El objetivo primario del estudio fue determinar y comparar en los dos brazos de tratamiento, la supervivencia libre de progresión (SLP) siendo la variable secundaria principal la supervivencia global (SG). Los otros objetivos fueron evaluar la tasa de respuesta global y la duración de la respuesta.
Del total de 435 pacientes en este ensayo, 233 pacientes no habían recibido tratamiento previo y 202 eran pacientes en segunda línea que recibieron un tratamiento previo con IL-2 o INFa. El estado funcional de los pacientes (ECOG) fue similar entre los grupos de pazopanib y placebo (ECOG 0:
42% vs. 41%; ECOG 1: 58% vs. 59%). La mayoría de los pacientes tenían factores de pronóstico MSKCC (Memorial Sloan Kettering Cancer Centre) / Motzer, favorables (39 %) o intermedios (54 %). Todos los pacientes presentaron histología de células claras o predominante histología de células claras. Aproximadamente la mitad de los pacientes tenían 3 o más órganos implicados en su enfermedad y la mayoría de los pacientes presentaban el pulmón (74 %), y/o los ganglios linfáticos (54%) como localización metastásica de la enfermedad en la situación inicial.
Una proporción similar de pacientes en cada brazo no habían recibido tratamiento previo o habían sido pretratados con citoquinas (53 % y 47 % en el brazo de pazopanib; 54 % y 46% en el brazo de placebo). En el grupo pretratado con citoquinas, la mayoría (75%) habían recibido tratamiento basado en interferón.
Proporciones similares de pacientes en cada brazo tuvieron nefrectomía previa (89% y 88% en los brazos de pazopanib y placebo, respectivamente) y/o radioterapia previa (22% y 15% en los brazos de pazopanib y placebo, respectivamente).
El análisis primario de la variable principal SLP está basada en la evaluación de la enfermedad mediante una revisión radiológica independiente en toda la población de estudio (pacientes que no han recibido tratamiento previo y pretratados con citoquinas).
|
Tabla 4: Resultados de eficacia glo |
ml en CCR por una evaluación independiente (VEG105192) | |||
|
Variables/Población de estudio |
Pazopanib |
Placebo |
HR (IC 95 %) |
Valor de P (uno de los lados) |
|
SLP ITT global* Mediana (meses) |
N = 290 9,2 |
N = 145 4,2 |
0,46 (0,34; 0,62) |
< 0,0000001 |
|
Tasa de respuesta % (IC 95 %) |
N = 290 30 (25,1;35,6) |
N = 145 3 (0,5; 6,4) |
< 0,001 | |
HR = Hazard ratio; ITT = intención de tratar; SLP = supervivencia libre de progresión. * - Poblaciones que no han recibido tratamiento previo y pretratadas con citoquinas.
Figura 1 Curva de Kaplan-Meier para la supervivencia libre de progresión según una evaluación independiente para la población global (Poblaciones que no han recibido tratamiento previo y poblaciones pretratadas con citoquinas) (VEG105192).
Pazopanib irJ = 29Cj
f/nd ari Ei.2 montns
f/nd'.an 4.2 monttis
I lazara njitio - 0.48
95% Cl l.D.34, 0.62)
P< 0.0000001
Mnriths
Eje horizontal: Meses; Eje vertical: Porcentaje Libre de Progresión. Pazopanib (N = 290) Mediana de 9,2 meses; Placebo (N = 145) Mediana de 4,2 meses; Harzard ratio = 0,46; IC 95 % (0,34; 0,62), P < 0,0000001
Figura 2: Curva de Kaplan-Meier para la supervivencia libre de progresión según una evaluación independiente para la población que no ha recibido tratamiento previo (VEG105192).
[1.8
9.6-
BaMpanOftJ cbi
r.'ocian 11 l monlhs
nacEbciN = 73
Moa an 2.3 monda
Hazard Sallo - ü.40
P^0 KlDOÜJl
C.0
Mnnthn
Eje horizontal: Meses; Eje vertical: Porcentaje Libre de Progresión. Pazopanib (N = 155) Mediana de 11,1 meses; Placebo (N = 78) Mediana de 2,8 meses; Harzard ratio = 0,40; IC 95 % (0,27; 0,60), P < 0,0000001
Figura 3 Curva de Kaplan-Meier para la supervivencia libre de progresión según una evaluación independiente para la población pretratada con citoquinas (VEG105192).
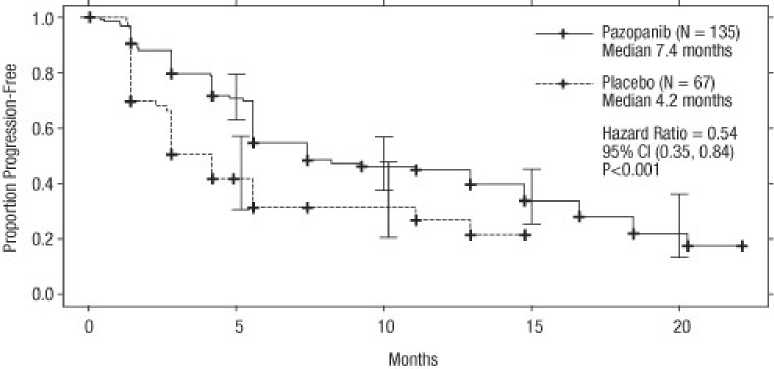
Eje horizontal: Meses; Eje vertical: Porcentaje Libre de Progresión. Pazopanib (N = 135) Mediana de 7,4 meses; Placebo (N = 67) Mediana de 4,2 meses; Harzard ratio = 0,54; IC 95 % (0,35; 0,84), P < 0,001
Para los pacientes que respondieron al tratamiento, la mediana del tiempo hasta la respuesta fue de
11,9 semanas y la mediana de la duración de la respuesta fue de 58,7 semanas según la revisión independiente (VEG105192).
Los datos de la mediana de la supervivencia global (SG) especificados en el protocolo como análisis final de supervivencia fueron 22,9 meses y 20,5 meses [HR = 0,91 (IC 95 %: 0,71 - 1,16; p = 0,224)] para los pacientes aleatorizados en el brazo de pazopanib y placebo respectivamente. Los resultados de SG están sujetos a posibles sesgos ya que el 54 % de los pacientes en el brazo placebo recibieron pazopanib en la parte de extensión del estudio tras progresión de la enfermedad. El sesenta y seis por ciento de los pacientes en el brazo del placebo recibieron tratamiento al finalizar el estudio en comparación con el 30 % de los pacientes en el brazo de pazopanib.
No se observaron diferencias estadísticamente significativas entre los grupos de tratamiento para la Calidad de Vida Global utilizando EORTC QLQ-C30 y EuroQoL EQ-5D.
En un ensayo Fase 2 de 225 pacientes con carcinoma de células renales localmente recurrente o metastásico, la tasa de respuesta objetiva fue del 35 % y la mediana de la duración de la respuesta fue de 68 semanas, según la revisión independiente. La mediana de la SLP fue de 11,9 meses.
Se ha evaluado la seguridad, eficacia y calidad de vida de pazopanib frente a sunitinib en un estudio Fase III de no inferioridad, randomizado, abierto y con grupos paralelos (VEG108844).
En el estudio VEG108844, los pacientes (N=1.110) con CCR localmente avanzado y/o metastásico que no hubiesen recibido tratamiento sistémico previo, fueron randomizados para recibir 800 mg de pazopanib una vez al día de forma continuada ó 50 mg de sunitinib una vez al día en ciclos de 6 semanas consistentes en 4 semanas de tratamiento, seguidas de 2 semanas sin tratamiento.
El objetivo primario de este estudio fue evaluar y comparar la SLP en pacientes tratados con pazopanib frente aquellos tratados con sunitinib. Las características demográficas fueron similares entre los grupos de tratamiento. Las características de la enfermedad en el diagnóstico inicial y en las pruebas de control fueron similares entre los grupos de tratamiento, con una mayoría de pacientes con histología de células claras y enfermedad en estadío IV.
El estudio VEG108844 alcanzó la variable primaria de SLP y demostró la no inferioridad de pazopanib frente a sunitinib, siendo el límite superior del IC al 95 % para el Riesgo Relativo (Hazard Ratio) menor que el margen de no inferioridad de 1,25 especificado en el protocolo. Los resultados globales de eficacia se resumen en la Tabla 5.
Tabla 5: Resultados globales de eficacia (VEG108844)
|
Variables |
Pazopanib N = 557 |
Sunitinib N = 553 |
HR (95 % CI) |
|
SLP Resultados globales Mediana (meses) (IC 95 %) |
8,4 (8,3; 10,9) |
9,5 (8,3; 11,0) |
1,047 (0,898; 1,220) |
|
Supervivencia Global Mediana (meses) (IC 95 %) |
28,3 (26,0; 35,5) |
29,1 (25,4; 33,1) |
0,915a (0,786; 1,065) |
HR = Hazard Ratio; SLP = Supervivencia libre de progresión3 Valor de P = 0,245 (a los 2 lados)
Figura 4: Curva de Kaplan-Meier para la supervivencia libre de progresión realizada por una evaluación independiente para la población total (VEG108844)
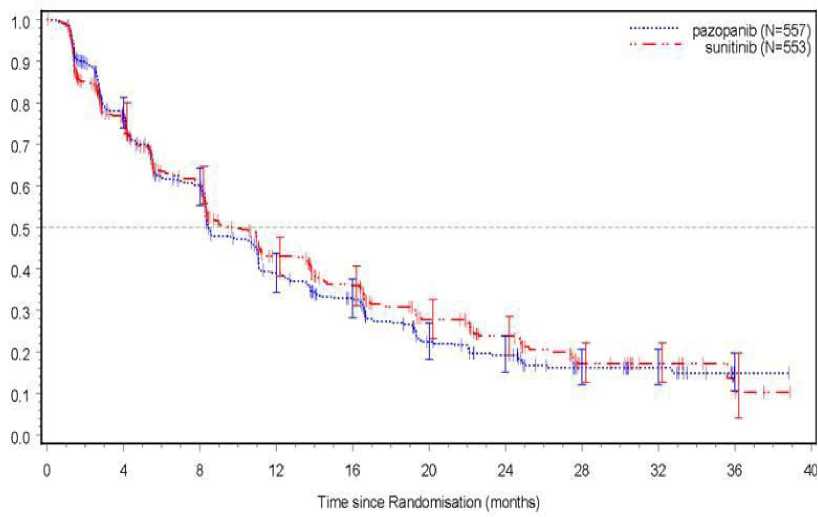
Se realizó un análisis de subgrupos de la SLP incluyendo 20 factores pronósticos y demográficos. El 95 % de los intervalos de confianza para todos los subgrupos incluía un valor estimado de riesgo relativo de 1. De los 20 subgrupos, en los tres más pequeños, el valor estimado de riesgo relativo fue superior a 1,25, por ejemplo, en sujetos sin nefrectomía previa (n=186, HR=1,403 IC 95 % [0,955; 2,061]), LDH basal > 1,5 x LSN (n=68, HR=1,72 IC 95 % [0,943; 3,139], y MSKCC: riesgo bajo (n=119, HR=1,472 IC 95 % [0,937; 2,313].
La eficacia y seguridad de pazopanib en STB fue evaluada en un estudio pivotal de fase III, multicéntrico, randomizado, doble ciego, controlado con placebo (VEG110727). Un total de 369 pacientes con STB avanzado fueron randomizados para recibir 800 mg de pazopanib una vez al día o placebo.
De forma general, solamente se permitió participar en el estudio a aquellos pacientes con determinados subtipos histológicos de STB. Por lo tanto la eficacia y seguridad de pazopanib sólo se puede considerar establecida para esos subtipos de STB y el tratamiento con pazopanib se debe restringir a dichos subtipos de STB.
Los siguientes tipos de tumores fueron incluidos:
Fibroblástico (fibrosarcoma del adulto, mixofibrosarcoma, fibrosarcoma epitelioide esclerosante, tumores fibrosos solitarios malignos), los llamados fibrohistocíticos (histocitioma fibroso maligno pleomórfico [HFM], HFM de células gigantes, HFM inflamatorio), leiomiosarcoma, tumores glomus malignos, músculo esqueléticos (rabdomiosarcoma pleomórfico y alveolar), vascular (hemangioendotelioma epiteliode, angiosarcoma), de diferenciación incierta (sinovial, epitelioide, de parte blanda alveolar, de células claras, desmoplásico de células pequeñas redondas, rabdoide extrarrenal, de mesenquioma maligno, PEComa, sarcoma intimal), tumor maligno de la vaina del nervio periférico, sarcomas de tejidos blandos indiferenciados no especificado (NOS) y otros tipos de sarcoma (no figuran como no elegibles).
Los siguientes tipos de tumores fueron excluidos:
Sarcoma adipocítico (todos los subtipos), todos los rabdomiosarcomas que eran no alveolares o pleomórficos, condrosarcoma, osteosarcoma, tumores Ewing/tumores neuroectodérmicos primitivos (PNET), GIST, sarcoma dermatofibromatosis protuberans, sarcoma miofibroblástico inflamatorio, mesotelioma maligno y tumores mixtos del mesodermo del útero.
Hay que tener en cuenta que los pacientes con sarcoma adipocítico fueron excluidos del estudio pivotal de fase III, debido a que en el estudio preliminar de fase II (VEG20002) la actividad observada con pazopanib en sarcomas adipocíticos (SLP a la semana 12) no alcanzó la tasa de respuesta preestablecida que permitía la realización de posteriores análisis clínicos.
Los otros principales criterios de inclusión del estudio VEG110727 fueron: evidencias histológicas de STB maligno de grado alto o intermedio y enfermedad progresiva durante los 6 meses de tratamiento para la enfermedad metastásica, o recurrente durante 12 meses de tratamiento (neo)-/adyuvante.
El noventa y ocho por ciento (98 %) de los sujetos habían recibido doxorrubicina anteriormente, el 70 % ifosfamida y el 65 % de los sujetos habían recibido al menos tres o más fármacos quimioterápicos antes de incluirse en el estudio.
Los pacientes fueron estratificados por factores de la escala de evaluación del estado funcional de la OMS (WHO PS) (0 o 1) al inicio del estudio y por el número de líneas de tratamiento sistémico previo que recibieron para enfermedad avanzada (0 o 1 vs 2 o más). En cada grupo de tratamiento hubo un porcentaje ligeramente superior de sujetos que recibieron más de 2 líneas de tratamiento sistémico previo para enfermedad avanzada (58 % y 55 % para los brazos de placebo y pazopanib respectivamente) comparado con aquellos que recibieron 0 o 1 línea de tratamiento sistémico previo (42 % y 45 % para los brazos de placebo y pazopanib respectivamente). La mediana de la duración del seguimiento de sujetos (definida desde la fecha de randomización a la fecha de la última visita o la muerte) fue similar en ambos grupos de tratamiento (9,36 meses para placebo [rango de 0,69 a 23,0 meses] y 10,04 meses para pazopanib [rango de 0,2 a 24,3 meses]).
El objetivo primario del estudio clínico fue la supervivencia libre de progresión (SLP evaluada mediante una revisión radiológica independiente); entre las variables secundarias se incluyeron la supervivencia global (SG), la tasa respuesta global y la duración de la respuesta.
Tabla 6: Resultados de eficacia global en STB por una evaluación independiente (VEG110727)
|
Variables primarias /población del estudio |
Pazopanib |
Placebo |
HR (IC 95 %) |
Valor de P (dos lados) |
|
SLP ITT Global Mediana (semanas) |
N = 246 20,0 |
N = 123 7,0 |
0,35 (0,26; 0,48) |
< 0,001 |
|
Leiomiosarcoma Mediana (semanas) |
N = 109 20,1 |
N = 49 8,1 |
0,37 (0,23; 0,60) |
< 0,001 |
|
Sarcoma sinovial subgrupos Mediana (semanas) |
N = 25 17,9 |
N = 13 4,1 |
0,43 (0,19; 0,98) |
0,005 |
|
“Otros subgrupos de STB” Mediana (semanas) |
N = 112 20,1 |
N = 61 4,3 |
0,39 (0,25; 0,60) |
< 0,001 |
|
SG | ||||
|
ITT Global Mediana (meses) |
N = 246 12,6 |
N = 123 10,7 |
0,87 (0,67; 1,12) |
0,256 |
|
Leiomiosarcoma* Mediana (meses) |
N = 109 16,7 |
N = 49 14,1 |
0,84 (0,56; 1,26 |
0,363 |
|
SG | ||||
|
Sarcoma sinovial subgrupos* Mediana (meses) |
N = 25 8,7 |
N = 13 21,6 |
1,62 (0,79; 3,33) |
0,115 |
|
‘Otros subgrupos de STC’* Mediana (meses) |
N = 112 10,3 |
N = 61 9,5 |
0,84 (0,59; 1,21) |
0,325 |
|
Tasas de respuesta (RC+RP) % (IC 95 %) |
4 (2,3; 7,9) |
0 (0,0; 3,0) | ||
|
Duración de la respuesta Mediana (semanas) (IC 95 %) |
38,9 (16,7; 40,0) |
HR = Hazard ratio; ITT = Población por intención de tratar; SLP = Supervivencia libre de progresión; RC = Respuesta completa; RP = Respuesta parcial. SG = Supervivencia global
* La supervivencia global para los respectivos subgrupos histológicos de STB (leiomiosarcoma, sarcoma sinovial y “otros” STB) debe ser interpretada con precaución debido al reducido número de sujetos y los amplios intervalos de confianza.
Según las evaluaciones del investigador, se observó una mejora similar en la SLP en el brazo de pazopanib comparado con placebo (HR en el conjunto de la población por intención de tratar: 0,39; IC 95 % de 0,30 a 0,52; p < 0,001).
Figura 5: Curva de Kaplan-Meier para la supervivencia libre de progresión en STB según una evaluación independiente para la población global total (VEG110727)
El análisis final de SG se realizó después de que se produjeran el 76 % (280/369) de los acontecimientos (HR 0,87, IC 95 % 0,67; 1,12 p = 0,256) y no se observaron diferencias significativas en la SG entre los dos grupos de tratamiento.
Población _ pediátrica
La Agencia Europea del Medicamento ha eximido de la obligación de presentar los resultados de los estudios con Votrient en todos los subgrupos de población pediátrica en el tratamiento del carcinoma de riñón y de pelvis renal (excluyendo nefroblastoma, nefroblastomatosis, sarcoma de células claras, nefroma mesoblastico, carcinoma medular renal y tumor rabdoide del riñon).
La Agencia Europea del Medicamento ha aplazado la obligación de presentar los resultados de los estudios con Votrient en uno o más subgrupos de población pediátrica en el tratamiento de rabdomiosarcoma, sarcoma de tejidos blandos de tipo no-rabdomiosarcoma y la familia de tumores de tipo sarcoma de Ewing. Ver la sección 4.2 para mayor información acerca del uso pediátrico.
5.2 Propiedades farmacocinéticas
Absorción
Tras la administración oral de una dosis única de 800 mg de pazopanib a pacientes con tumores sólidos, se obtuvo la concentración plasmática máxima (Cmax) de aproximadamente 19 ± 13 pg/ml tras una mediana de 3,5 horas (intervalo 1,0-11,9 horas) y se obtuvo un AUC0_<» de aproximadamente 650 ± 500 pg.h/ml. La dosis diaria produjo un aumento de entre 1,23 a 4 veces el AUC0-T. No hubo un aumento constante en el AUC o en la Cmax a dosis de pazopanib mayores de 800 mg.
La exposición sistémica a pazopanib se ve aumentada cuando se administra con alimentos.
La administración de pazopanib con alimentos con alto o bajo contenido en grasas produjo un incremento en el AUC y la Cmax de aproximadamente dos veces. Por lo tanto, se debe administrar pazopanib como mínimo dos horas después de las comidas o una hora antes de las comidas (ver sección 4.2).
La administración de un comprimido machacado de 400 mg de pazopanib aumentó el AUC(0-72) en un 46 % y la Cmax aproximadamente 2 veces y disminuyó la tmax aproximadamente 2 horas en comparación con la administración de un comprimido entero. Estos resultados indican que la biodisponibilidad y la velocidad de absorción oral de pazopanib aumentan tras la administración de comprimidos machacados en relación con la administración de comprimidos enteros (ver sección 4.2).
Distribución
La unión de pazopanib a proteínas plasmáticas humanas in vivo fue mayor del 99 %, independientemente de la concentración, en el intervalo de 10-100 pg/ml. Los estudios in vitro sugieren que pazopanib es sustrato de P-gp y BCRP.
Biotransformación
Los resultados de estudios in vivo demostraron que el metabolismo de pazopanib está mediado principalmente por CYP3A4, con menor contribución de CYP1A2 y CYP2C8. Los cuatro metabolitos principales de pazopanib representaban sólo el 6% de la exposición en plasma. Uno de estos metabolitos inhibe la proliferación de células endoteliales de vena umbilical humana estimulada por VEGF, con una potencia similar a la de pazopanib. El resto de los metabolitos son de 10 a 20 veces menos activos. Por tanto, la actividad de pazopanib depende principalmente de la exposición a la molécula original.
Eliminación
Pazopanib se elimina lentamente, con una semivida media de 30,9 horas tras la administración de la dosis recomendada de 800 mg. La eliminación se produce principalmente a través de las heces; la eliminación renal representa < 4 % de la dosis administrada.
Poblaciones especiales
Insuficiencia renal: los resultados indican que menos del 4 % de la dosis de pazopanib administrada oralmente se excreta en la orina como pazopanib y metabolitos. Los resultados de un modelo farmacocinético poblacional (datos de individuos con valores del aclaramiento de creatinina entre 30,8 ml/min y 150 ml/min) indicaron que es improbable que la insuficiencia renal tenga un efecto clínicamente relevante en la farmacocinética de pazopanib. No se requieren ajustes de la dosis en pacientes con aclaramiento de creatinina superior a 30 ml/min. Se recomienda tener precaución en los pacientes con aclaramiento de creatinina inferior a 30 ml/min debido a que no hay experiencia del uso de pazopanib en esta población de pacientes (ver sección 4.2).
Insuficiencia hepática:
Leve:
La mediana de la Cmax y el AUC(0.24 h) de pazopanib en estado estacionario en los pacientes con alteraciones leves de los parámetros hepáticos (definidas como valores normales de bilirrubina y cualquier grado de elevación de ALT o elevación de los valores de bilirrubina de hasta 1,5 veces el LSN independientemente de los valores de ALT) después de la administración de 800 mg una vez al día es similar a la mediana en los pacientes con función hepática normal (ver Tabla 7). En pacientes con alteraciones leves de las pruebas hepáticas en suero, la dosis recomendada es de 800 mg de pazopanib una vez al día (ver sección 4.2).
Moderada:
En pacientes con insuficiencia hepática moderada (definida como una elevación de bilirrubina > 1,5 a 3 veces el LSN independientemente de los niveles de ALT) la dosis máxima tolerada (DMT) fue de 200 mg de pazopanib una vez al día. Los valores de la mediana de Cmax y AUC(0-24) en estado estacionario tras la administración de 200 mg de pazopanib una vez al día en pacientes con insuficiencia hepática moderada, fueron aproximadamente el 44 % y el 39 % respectivamente de los valores de las medianas correspondientes tras la administración de 800 mg una vez al día en pacientes con función hepática normal (ver Tabla 7).
En base a los datos de seguridad y tolerabilidad, la dosis de pazopanib se debe reducir a 200 mg una vez al día en individuos con insuficiencia hepática moderada (ver sección 4.2).
Grave:
Los valores de la mediana de Cmax y AUC(0-24) en estado estacionario tras la administración de 200 mg de pazopanib una vez al día en pacientes con insuficiencia hepática grave, fueron aproximadamente el 18 % y el 15 % respectivamente de los valores de las medianas tras la administración de 800 mg una vez al día en pacientes con función hepática normal. En base a la disminución de la exposición y la reserva hepática limitada, pazopanib no está recomendado en pacientes con insuficiencia hepática grave (definida como bilirrubina total > 3 x LSN independientemente de los niveles de ALT) (ver sección 4.2).
Tabla 7: Medianas farmacocinéticas de pazopanib calculadas en estado estacionario, en sujetos con insuficiencia hepática.
|
Grupo |
Dosis investigada |
Cmax (^g/ml) |
AUC (0-24) (pg x hr/ml) |
Dosis recomendada |
|
Función hepática normal |
800 mg una vez al día |
52,0 (17,1-85,7) |
888,2 (345,5-1482) |
800 mg una vez al día |
|
Insuficiencia hepática leve |
800 mg una vez al día |
33,5 (11,3-104,2) |
774,2 (214,7-2034,4) |
800 mg una vez al día |
|
Insuficiencia hepática moderada |
200 mg una vez al día |
22,2 (4,2-32,9) |
256,8 (65,7-487,7) |
200 mg una vez al día |
|
Insuficiencia hepática grave |
200 mg una vez al día |
9,4 (2,4-24,3) |
130,6 (46,9-473,2) |
No está recomendado |
5.3 Datos preclínicos sobre seguridad
El perfil de seguridad preclínica de pazopanib fue evaluado en ratones, ratas, conejos y monos. En los estudios a dosis repetidas en roedores, los efectos en una variedad de tejidos (hueso, dientes, lecho de la uña, órganos reproductivos, tejidos hematológicos, riñón y páncreas) parecen estar relacionados con la farmacología de la inhibición de VEGFR y/o la interrupción de las vías de señalización de VEGF y con la mayoría de los efectos que ocurren a niveles de exposición plasmática inferiores a los observados en la clínica. Otros efectos observados incluyeron pérdida de peso corporal, diarrea y/o morbilidad que fueron, o bien secundarios a los efectos gastrointestinales locales causados por la elevada exposición del medicamento en la mucosa local (monos) o bien, efectos farmacológicos (roedores). Se observaron lesiones hepáticas proliferativas (focos de eosinófilos y adenoma) en hembras de ratón a exposiciones 2,5 veces la exposición en humanos basada en el AUC.
En estudios de toxicidad juvenil, cuando se administraron dosis de pazopanib a ratas antes de ser destetadas, desde el día 9 hasta el día 14 después del parto, pazopanib originó muertes y desarrollo/maduración anormal en el riñón, pulmón, hígado y corazón a dosis de aproximadamente 0,1 veces la exposición clínica según el AUC en humanos adultos. Cuando se administraron dosis de pazopanib a ratas después de ser destetadas desde el día 21 hasta el día 62 después del parto, los hallazgos toxicológicos fueron semejantes a los vistos en ratas adultas a exposiciones comparables.
Los pacientes humanos pediátricos presentan mayor riesgo de padecer efectos en los huesos y los dientes al compararlos con pacientes adultos, dado que estos cambios, entre los que se incluyen inhibición del crecimiento (extremidades acortadas), fragilidad en los huesos y remodelación de los dientes, se presentaron en ratas juveniles a dosis > 10 mg/Kg/día (aproximadamente igual a 0,1-0,2 veces la exposición clínica según el AUC en humanos adultos) (ver sección 4.4).
Efectos reproductivos, en la_ fertilidad y teratogénicos
Pazopanib ha mostrado ser embriotóxico y teratogénico cuando se administró en ratas y conejos a exposiciones más de 300 veces inferiores a la exposición en humanos (basada en el AUC). Los efectos incluyeron fertilidad femenina reducida, pérdida pre y post-implantación aumentada, resorciones tempranas, mortalidad embrional, disminución del peso corporal fetal y malformación cardiovascular. En roedores también se observó disminución del cuerpo lúteo, aumento de quistes y atrofia de ovarios. En un estudio de fertilidad en ratas macho no hubo efecto sobre el apareamiento o la fertilidad, pero se observaron disminuciones en el peso del testículo y del epidídimo, con reducciones en las tasas de producción de esperma, movilidad del esperma y concentraciones de esperma testicular, observados a exposiciones 0,3 veces la exposición en humanos en base al AUC.
Genotoxicidad
Pazopanib no causó daño genético cuando se analizó en pruebas de genotoxicidad (test de Ames, test de aberración cromosómica de linfocitos periféricos humanos y micronúcleos de ratas in vivo). Un intermedio sintético utilizado en la fabricación de pazopanib, que también está presente en pequeñas cantidades en el principio activo final, no fue mutagénico en el Test de Ames pero fue genotóxico en el test de linfoma en ratón y en el test de micronúcleos de ratón in vivo.
Carcinogenicidad
En estudios de carcinogenicidad de dos años con pazopanib, se observaron aumentos en el número de adenomas en el hígado detectados en ratones y de adenocarcinomas duodenales detectados en ratas. En base a la patogénesis específica de roedores y el mecanismo ligado a estos hallazgos, no se considera que representen un aumento del riesgo carcinogénico para los pacientes tratados con pazopanib.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Núcleo del comprimido
Estearato de magnesio Celulosa microcristalina Povidona (K30)
Glicolato sódico de almidón (tipo A)
Cubierta _ pelicular Hipromelosa
Óxido de hierro rojo (E172)
Macrogol 400 Polisorbato 80 Dióxido de titanio (E171)
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
2 años.
6.4 Precauciones especiales de conservación
No requiere condiciones especiales de conservación.
6.5 Naturaleza y contenido del envase
Frascos de PEAD con un tapón de polipropileno resistente a los niños que contiene 30 ó 90 comprimidos.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación
Ninguna especial.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Novartis Europharm Limited Frimley Business Park Camberley GU16 7SR Reino Unido
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/10/628/001
EU/1/10/628/002
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 14 de junio de 2010
Fecha de la última renovación de la autorización: 18 de junio de 2013
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu/.
1. NOMBRE DEL MEDICAMENTO
Votrient 400 mg comprimidos recubiertos con película
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada comprimido recubierto con película contiene 400 mg de pazopanib (como hidrocloruro). Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Comprimido recubierto con película.
Con forma de cápsula, de color blanco y marcados con GS UHL en una de las caras.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Carcinoma de Células Renales (CCR)
Votrient está indicado para el tratamiento de primera línea del Carcinoma de Células Renales avanzado (CCR) en adultos y para los pacientes con enfermedad avanzada que han recibido tratamiento previo con citoquinas.
Sarcoma de Tejidos Blandos (STB)
Votrient está indicado para el tratamiento de pacientes adultos con determinados subtipos de Sarcoma de Tejidos Blandos (STB) avanzado que hayan recibido previamente tratamiento con quimioterapia para tratar su enfermedad metastásica o en aquellos pacientes adultos cuya enfermedad ha progresado en los 12 meses siguientes tras recibir tratamiento neo-adyuvante y/o adyuvante.
La eficacia y seguridad solamente se ha establecido para ciertos subtipos histológicos de tumores de STB (ver sección 5.1).
4.2 Posología y forma de administración
El tratamiento con Votrient sólo debe ser iniciado por un médico experimentado en la administración de agentes anticancerígenos.
Posología
Adultos
La dosis recomendada de pazopanib para el tratamiento de CCR y STB es de 800 mg una vez al día.
Las modificaciones de la dosis se deben hacer de forma escalonada en incrementos de 200 mg según la tolerabilidad individual, con el fin de manejar las reacciones adversas. La dosis de pazopanib no debe exceder de 800 mg.
Población pediátrica
Pazopanib no se debe utilizar en niños menores de 2 años debido a motivos de seguridad relacionados con el desarrollo y maduración de órganos (ver secciones 4.4 y 5.3).
No se ha establecido la eficacia y seguridad de pazopanib en niños entre los 2 y los 18 años (ver sección 5.1).
Pacientes de edad avanzada
Los datos sobre el uso de pazopanib en pacientes de 65 años y mayores son limitados. En los estudios de pazopanib en CCR, no se observaron diferencias clínicamente significativas en la seguridad de pazopanib entre individuos de al menos 65 años e individuos más jóvenes. La experiencia clínica no ha identificado diferencias en las respuestas entre los pacientes de edad avanzada y los pacientes más jóvenes, pero no se puede descartar la mayor sensibilidad de algunos individuos de mayor edad.
Insuficiencia renal
Es poco probable que la insuficiencia renal tenga un efecto clínicamente relevante sobre la farmacocinética de pazopanib debido a la baja excreción renal de pazopanib y sus metabolitos (ver sección 5.2). Por lo tanto, no se requiere ajustar la dosis en pacientes con un aclaramiento de creatinina por encima de 30 ml/min. Se recomienda tener precaución en pacientes con un aclaramiento de creatinina por debajo de 30 ml/min, al no tener experiencia con pazopanib en esta población de pacientes.
Insuficiencia hepática
Las recomendaciones posológicas en pacientes con insuficiencia hepática están basadas en los estudios farmacocinéticos de pazopanib en pacientes con diferentes grados de disfunción hepática (ver sección 5.2). Antes de iniciar el tratamiento con pazopanib, y durante el mismo, se deben realizar pruebas de función hepática a todos los pacientes para determinar si presentan insuficiencia hepática.
La administración de pazopanib en pacientes con insuficiencia hepática leve o moderada se debe realizar con precaución y estrecha vigilancia sobre la tolerabilidad. La dosis recomendada es de 800 mg de pazopanib una vez al día en pacientes con alteraciones leves de las pruebas hepáticas en suero (definidas como valores normales de bilirrubina y cualquier grado de elevación de alanina aminotransferasa (ALT) o elevación de los valores de bilirrubina (> 35 % bilirrubina directa) de hasta 1,5 veces el límite superior de la normalidad (LSN) independientemente de los valores de ALT). Se recomienda una dosis reducida de pazopanib de 200 mg una vez al día en pacientes con insuficiencia hepática moderada (definida como elevación de los valores de bilirrubina de > 1,5 a 3 veces el LSN independientemente de los valores de ALT) (ver sección 5.2).
Pazopanib no está recomendado en pacientes con insuficiencia hepática grave (definida como bilirrubina total > 3 x LSN independientemente de los niveles de ALT).
Para más información sobre pacientes con hepatotoxicidad inducida por medicamentos, ver en el apartado monitorización hepática y modificaciones de la dosis en la sección 4.4.
Pazopanib se debe tomar sin alimentos, al menos una hora antes o dos horas después de las comidas (ver sección 5.2). Votrient comprimidos recubiertos con película se deben tomar enteros con agua y no se deben romper o machacar (ver sección 5.2).
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1
4.4 Advertencias y precauciones especiales de empleo
Efectos hepáticos
Se han notificado casos de insuficiencia hepática (incluyendo víctimas mortales) durante el uso de pazopanib. La administración de pazopanib a pacientes con insuficiencia hepática leve o moderada debe realizarse con precaución y bajo una estrecha vigilancia. La dosis recomendada es de 800 mg de pazopanib una vez al día en pacientes con alteraciones leves de las pruebas hepáticas en suero (tanto bilirrubina normal con cualquier grado de elevación de ALT, como bilirrubina elevada hasta
1.5 x LSN independientemente de los niveles de ALT). Se recomienda una dosis reducida de 200 mg de pazopanib una vez al día en pacientes con insuficiencia hepática moderada (elevaciones de bilirrubina > 1,5 a 3 veces el LSN independientemente de los valores de ALT) (ver secciones 4.2 y 5.2).
Pazopanib no se recomienda en pacientes con insuficiencia hepática grave (bilirrubina total > 3 x LSN independientemente de los niveles de ALT) (ver secciones 4.2 y 5.2). En estos pacientes con valores considerados insuficientes para obtener un efecto clínico relevante, la exposición a dosis de 200 mg es considerablemente reducida, aunque altamente variable.
En ensayos clínicos con pazopanib, se observó un incremento de las transaminasas séricas (ALT, aspartato aminotransferasa [AST]) y de la bilirrubina (ver sección 4.8). Se han notificado incrementos aislados de ALT y AST, que en la mayoría de los casos, no presentaron elevaciones concomitantes de fosfatasa alcalina o bilirrubina. Los pacientes mayores de 60 años de edad, pueden presentar mayor riesgo de incremento de la ALT, de moderada (> 3 x LSN) a grave (> 8 x LSN). Los pacientes que son portadores del alelo HLA-B*57:01 también presentan mayor riesgo de incrementos de ALT asociados a pazopanib. Se debe controlar la función hepática en todos los pacientes que reciben pazopanib, independientemente del genotipo o la edad (ver sección 5.1).
Se deben monitorizar las pruebas hepáticas en suero antes de iniciar el tratamiento con pazopanib y en las semanas 3, 5, 7 y 9 de tratamiento. Después de este periodo, se deben monitorizar en el tercer y cuarto mes, y según esté clínicamente indicado. Después del cuarto mes se debe continuar con una monitorización periódica.
En la Tabla 1 se puede consultar cómo llevar a cabo modificaciones de dosis en pacientes con valores basales de bilirrubina total < 1,5 x LSN, y valores de AST y ALT < 2 x LSN:
Tabla 1: Modificaciones de la dosis cuando se produce hepatotoxicidad inducida por el fármaco.
|
Valores en las pruebas hepáticas |
Modificaciones de la dosis |
|
Elevación de transaminasas entre 3 y 8 x LSN |
Continuar el tratamiento con pazopanib con una monitorización semanal de la función hepática hasta que las transaminasas vuelvan al Grado 1 o a la situación inicial. |
|
Elevación de transaminasas > 8 x LSN |
Interrumpir el tratamiento con pazopanib hasta que las transaminasas vuelvan al Grado 1 o a la situación inicial. Si el posible beneficio de reiniciar el tratamiento con pazopanib se considera mayor que el riesgo de hepatotoxicidad, se puede reiniciar el tratamiento con pazopanib a la dosis reducida de 400 mg al día y realizar pruebas hepáticas en suero semanalmente durante 8 semanas. Si tras reiniciar el tratamiento con pazopanib, las elevaciones de transaminasas vuelven a ser > 3 x LSN, se debe interrumpir permanentemente el tratamiento con pazopanib. |
|
Elevación de transaminasas > 3 x LSN junto con elevaciones de bilirrubina > 2 x LSN |
Interrumpir permanentemente el tratamiento con pazopanib. Se debe monitorizar a los pacientes hasta que los valores vuelvan al Grado 1 o a la situación inicial. Pazopanib es un inhibidor de UGT1A1. En pacientes con Síndrome de Gilbert, puede aparecer hiperbilirrubinemia indirecta (no conjugada) leve. En los pacientes con hiperbilirrubinemia indirecta leve, conocida o posible Síndrome de Gilbert, las elevaciones de ALT > 3 x LSN deben ser manejadas siguiendo las recomendaciones indicadas en caso de elevaciones aisladas de ALT. |
El uso concomitante de pazopanib y simvastatina incrementa el riesgo de elevaciones en la ALT (ver sección 4.5) y se debe realizar con precaución y estrecha vigilancia.
Hipertensión
En estudios clínicos con pazopanib, se han producido casos de hipertensión incluyendo episodios sintomáticos de presión arterial elevada recientemente diagnosticados (crisis hipertensiva). La presión sanguínea debe estar bien controlada antes de iniciar el tratamiento con pazopanib. Para asegurar el control de la presión arterial, al poco tiempo de iniciar el tratamiento con pazopanib (no más de una semana después), se debe monitorizar la hipertensión de los pacientes y controlar frecuentemente su presión arterial.
Niveles elevados de presión arterial (presión arterial sistólica > 150 o presión arterial diastólica > 100 mm Hg) se produjeron al principio del curso del tratamiento con pazopanib (aproximadamente el 40 % de los casos se produjeron antes del Día 9 y aproximadamente el 90 % de los casos sucedieron en las primeras 18 semanas). Se debe monitorizar la presión arterial y tratarla inmediatamente utilizando una combinación de terapia antihipertensiva y modificando la dosis de pazopanib (interrupción y reinicio con la dosis reducida siguiendo el criterio clínico) (ver secciones 4.2 y 4.8). Se debe interrumpir el tratamiento con pazopanib si existe evidencia de crisis hipertensiva o si la hipertensión es grave y persistente pese al tratamiento antipertensivo y las reducciones de dosis de pazopanib.
Síndrome de encefalopatía posterior reversible (PRES)/ Síndrome de leucoencelopatía posterior reversible (RPLS)
Se han notificado casos de PRES/RPLS asociados al uso de pazopanib. El PRES/RPLS pueden presentarse en forma de cefalea, hipertensión, convulsiones, letargia, confusión, ceguera y otras alteraciones visuales y neurológicas, pudiendo ser mortales. Los pacientes que desarollen PRES/RPLS deben interrumpir definitivamente el tratamiento con pazopanib.
Enfermedad pulmonar intersticial (EPI)/Neumonitis
Se han notificado casos de EPI, que pueden llegar a ser mortales, asociados al uso de pazopanib (ver sección 4.8). Se debe monitorizar a los pacientes con síntomas pulmonares indicativos de EPI/neumonitis, así como interrumpir el tratamiento con pazopanib en pacientes que desarrollen EPI o neumonitis.
Dis función cardiaca/Fallo cardiaco
Se deben tener en cuenta los riesgos y beneficios de pazopanib antes de iniciar el tratamiento en pacientes con disfunción cardiaca preexistente. No se ha estudiado la seguridad y la farmacocinética de pazopanib en pacientes con fallo cardiaco de moderado a grave o en aquellos con una Fracción de Eyección del Ventrículo Izquierdo (FEVI) por debajo de lo normal.
En ensayos clínicos con pazopanib, se han producido acontecimientos de disfunción cardiaca como insuficiencia cardiaca congestiva y disminución de la FEVI (ver sección 4.8). En los pacientes que participaron en un ensayo randomizado comparativo de pazopanib frente a sunitinib en CCR (VEG108844), se realizaron mediciones iniciales y de seguimiento del FEVI. La disfunción miocárdica se produjo en el 13% (47/362) de los pacientes en el brazo de pazopanib comparado con el 11% (42/369) de los pacientes en el brazo de sunitinib. Se observó insuficiencia cardíaca congestiva en el 0,5% de los sujetos en cada brazo del tratamiento.Se notificó fallo cardiaco congestivo en 3 de los 240 sujetos (1 %) en la fase III del estudio VEG110727 en STB. En sujetos a los que les realizaron mediciones tras iniciar el ensayo clínico y de seguimiento del FEVI, se detectaron disminuciones del FEVI de un 11 % (15/140) en el brazo de pazopanib comparado con el 3 % (1/39) en el brazo del placebo.
Factores de riesgo: trece de los 15 sujetos en el brazo de pazopanib del estudio de fase III en STB presentaron hipertensión simultáneamente, la cual pudo exacerbar la disfunción cardiaca en pacientes con riesgos a través de un incremento de la poscarga cardiaca. El 99 % de los pacientes (243/246) reclutados en el estudio de fase III en STB, incluyendo los 15 sujetos con hipertensión, recibieron antraciclinas. El tratamiento previo con antraciclinas puede ser un factor de riesgo de disfunción cardiaca.
Resultados: cuatro de los 15 sujetos se recuperaron completamente (5 % inicial) y 5 tuvieron una recuperación parcial (dentro del rango normal, pero > 5% por debajo del valor inicial). Un sujeto no se recuperó y no se dispone de los datos de seguimiento de los otros 5 sujetos.
Manejo: el tratamiento de la hipertensión (si está presente, consultar la sección anterior acerca de las precauciones en caso de hipertensión) se debe combinar con interrupciones y/o reducciones de la dosis de pazopanib en pacientes con disminuciones significantes de la FEVI, como indica la práctica clínica. Se debe monitorizar cuidadosamente a los pacientes para detectar signos clínicos o síntomas de fallo cardiaco congestivo. Se recomienda realizar una evaluación inicial y periódica de la FEVI en pacientes con riesgo de disfunción cardiaca.
Prolongación del intervalo QT y Torsade de Pointes
En ensayos clínicos con pazopanib han aparecido casos de prolongación del intervalo QT y Torsade de Pointes (ver sección 4.8). Pazopanib se debe utilizar con precaución en pacientes con un historial de prolongación del intervalo QT, en pacientes que tomen antiarrítmicos u otros medicamentos que puedan prolongar el intervalo QT y en aquellos con una importante enfermedad cardíaca preexistente. Mientras se esté utilizando pazopanib se recomienda la monitorización basal y periódica de los electrocardiogramas y el mantenimiento de los niveles de electrolitos (ej. calcio, magnesio, potasio) dentro de los rangos normales.
Acontecimientos trombóticos arteriales
En ensayos clínicos con pazopanib se observaron casos de infarto de miocardio, accidente cerebrovascular isquémico, y accidente isquémico transitorio (ver sección 4.8). Se han observado acontecimientos mortales. Pazopanib se debe usar con precaución en pacientes que presenten un mayor riesgo de padecer acontecimientos trombóticos o que hayan tenido un historial clínico de acontecimientos trombóticos. Pazopanib no se ha estudiado en pacientes que hayan presentado un acontecimiento de este tipo en los 6 meses previos al inicio del tratamiento con pazopanib. Se debe tomar una decisión en cuanto al tratamiento en base a la evaluación individual del beneficio/riesgo de los pacientes.
Acontecimientos tromboembólicos venosos
En los estudios clínicos con pazopanib se han producido acontecimientos tromboembólicos venosos entre los que se incluyen trombosis venosa y embolia pulmonar mortal. Al observar los estudios en CCR y STB, la incidencia fue mayor en la población con STB (5 %) que en la población con CCR (2 %).
Microangiopatía trombótica
Se han notificado casos de microangiopatía trombótica (MAT) en ensayos clínicos de pazopanib en monoterapia, en combinación con bevacizumab, y en combinación con topotecan (ver sección 4.8). Los pacientes que desarrollen MAT deben interrumpir definitivamente el tratamiento con pazopanib. Tras la interrupción del tratamiento se ha observado que los efectos de la MAT revierten. Pazopanib no está indicado para su uso en combinación con otros medicamentos.
En ensayos clínicos con pazopanib se han notificado acontecimientos hemorrágicos (ver sección 4.8). Se han producido acontecimientos hemorrágicos mortales. No se ha estudiado el uso de pazopanib en pacientes que hayan tenido antecedentes de hemoptisis, hemorragia cerebral o hemorragia gastrointestinal clínicamente significativa en los últimos 6 meses. Pazopanib se debe utilizar con precaución en pacientes con riesgo significativo de hemorragia.
Perforaciones gastrointestinales y _fístula
En ensayos clínicos con pazopanib se han producido casos de perforación gastrointestinal o fístula (ver sección 4.8). Se han producido perforaciones gastrointestinales mortales. Pazopanib se debe utilizar con precaución en pacientes con riesgo de perforaciones gastrointestinales o fístula.
Cicatrización de heridas
No se han realizado estudios formales sobre el efecto de pazopanib en la cicatrización de heridas. Debido a que los inhibidores del Factor de Crecimiento del Endotelio Vascular (VEGF) pueden dificultar la cicatrización de heridas, el tratamiento con pazopanib debe interrumpirse durante al menos 7 días antes de una intervención quirúrgica programada. La decisión de reanudar el tratamiento con pazopanib después de la cirugía debe basarse en el juicio clínico de cicatrización adecuada. Se debe interrumpir el tratamiento con pazopanib en pacientes con dehiscencia de la herida.
Hipotiroidismo
En ensayos clínicos con pazopanib se han producido casos de hipotiroidismo (ver sección 4.8). Se recomienda analizar en el laboratorio los valores de referencia de la función tiroidea y los pacientes con hipotiroidismo deben ser tratados según la práctica médica estándar antes de iniciar el tratamiento con pazopanib. Se debe vigilar estrechamente a todos los pacientes para detectar signos y síntomas de disfunción tiroidea durante el tratamiento con pazopanib. Se debe realizar un seguimiento periódico de la función tiroidea y tratarla como una práctica médica estándar.
Proteinuria
En ensayos clínicos con pazopanib se han notificado casos de de proteinuria. Se recomienda analizar los valores iniciales y realizar análisis de orina durante el tratamiento así como vigilar a los pacientes en caso de empeoramiento de la proteinuria. Se debe interrumpir el tratamiento con pazopanib en aquellos pacientes que desarrollen síndrome nefrótico.
Neumotorax
En los estudios clínicos con pazopanib en sarcoma de tejidos blandos avanzado, se han producido acontecimientos de neumotórax (ver sección 4.8). Se debe vigilar muy de cerca a los pacientes que estén siendo tratados con pazopanib para detectar signos y síntomas de neumotórax.
Población _ pediátrica
Debido a que el mecanismo de acción de pazopanib puede afectar gravemente al desarrollo y la maduración de los órganos de roedores durante el primer desarrollo postnatal (ver sección 5.3), pazopanib no se debe administrar a pacientes pediátricos menores de 2 años.
Se han notificado casos de infecciones graves (con o sin neutropenia), en algunos casos con desenlace mortal.
Combinación con otros tratamientos anti cancerígenos sistémicos
Los ensayos clínicos de pazopanib en combinación con pemetrexed (cáncer de pulmón no microcítico (CPNM)) y lapatinib (cáncer de cérvix) se interrumpieron antes de lo previsto debido al incremento de la toxicidad y/o mortalidad, y todavía no ha sido establecida una combinación de dosis segura y eficaz para estos tratamientos.
Embarazo
En estudios preclínicos en animales se ha observado toxicidad reproductiva (ver sección 5.3). Si se usa pazopanib durante el embarazo, o si la paciente se queda embarazada durante el tratamiento con pazopanib, se debe explicar a la paciente el riesgo potencial para el feto. Se debe aconsejar a las mujeres en edad fértil evitar quedarse embarazadas durante el tratamiento con pazopanib (ver sección 4.6).
Interacciones
Se debe evitar el tratamiento concomitante con inhibidores potentes de CYP3A4, glicoproteína-P (P-gp) o de la proteína resistente al cáncer de mama (BCRP) debido al riesgo de una mayor exposición a pazopanib (ver sección 4.5). Se recomienda hacer una selección alternativa de medicamentos concomitantes que no tengan potencial de inhibir o presenten un potencial mínimo de inhibir CYP34A, P-gp o BCRP.
Se debe evitar el tratamiento concomitante con inductores de CYP34A debido al riesgo de disminuir la exposición a pazopanib (ver sección 4.5).
Se han observado casos de hiperglucemia durante el tratamiento concomitante con ketoconazol.
Se debe tener precaución con la administración concomitante de pazopanib con sustratos de uridín difosfato glucuronosil transferasa 1A1 (UGT1A1) (ej. irinotecan) debido a que pazopanib es un inhibidor de UGT1A1 (ver sección 4.5).
Se debe evitar tomar zumo de pomelo durante el tratamiento con pazopanib (ver sección 4.5).
4.5 Interacción con otros medicamentos y otras formas de interacción
Efectos de otros medicamentos sobre _pazopanib
Los estudios in vitro sugieren que el metabolismo oxidativo de pazopanib en los microsomas hepáticos humanos es mediado principalmente por CYP3A4, con contribuciones menores de CYP1A2 y CYP2C8. Por lo tanto, los inhibidores e inductores de CYP3A4 pueden alterar el metabolismo de pazopanib.
Inhibidores de CYP3A4, P-gp, BCRP:
Pazopanib es un sustrato para CYP3A4, P-gp y BCRP.
La administración concomitante de pazopanib (400 mg una vez al día) con un inhibidor potente de CYP3A4 y P-gp, ketoconazole (400 mg una vez al día) durante 5 días consecutivos, produjo un incremento medio del AUC(0-24) y de la Cmax de pazopanib en un 66 % y un 45 % respectivamente, en comparación con la administración de pazopanib solo (400 mg una vez al día durante 7 días). La comparación de parámetros farmacocinéticos de Cmax (rango de medias de 27,5 a 58,1 pg/ml) y AUC(0-24) (rango de medias 48,7 a 1040 pg*h/ml) tras la administración de 800 mg de pazopanib solo y tras la administración de 400 mg de pazopanib junto con 400 mg de ketoconazol (media de Cmax 59,2 pg/ml, media de AUC(0-24) 1300 pg*h/ml ) indica que en presencia de un inhibidor potente de CYP3A4 y P-gp, la reducción de dosis a 400 mg de pazopanib una vez al día producirá en la mayoría de los pacientes una exposición sistémica similar a la observada tras la administración de 800 mg de solo pazopanib una vez al día. Sin embargo, algunos pacientes puede presentar una exposición sistémica a pazopanib mayor a la observada tras la administración de 800 mg de pazopanib solo.
La administración concomitante de pazopanib con otros inhibidores potentes de la familia CYP3A4 (e.j., itraconazol, claritromicina, atazanavir, indinavir, nefazodona, nelfinavir, ritonavir, saquinavir, telitromicina, voriconazol) pueden aumentar las concentraciones de pazopanib. El zumo de pomelo contiene un inhibidor de CYP3A4 y puede también aumentar las concentraciones plasmáticas de pazopanib.
La administración de 1.500 mg de lapatinib (sustrato e inhibidor débil de CYP3A4 y P-gp y potente inhibidor de BCRP) con 800 mg de pazopanib produjo un incremento de aproximadamente un 50% a un 60% en la media del AUC(0-24) y la Cmax de pazopanib, comparado con la administración de 800 mg de pazopanib solo. Es probable que la inhibición de P-gp y/o BCRP por lapatinib contribuya a un aumento de la exposición de pazopanib.
La administración concomitante de pazopanib con inhibidores de CYP3A4, P-gp y BCRP, como lapatinib, dará lugar a un incremento de las concentraciones plasmáticas de pazopanib. La administración concomitante con inhibidores potentes de P-pg o BCRP puede también alterar la exposición y la distribución de pazopanib, incluso la distribución en el sistema nervioso central (SNC).
Se debe evitar la administración concomitante de pazopanib con un inhibidor potente de CYP3A4 (ver sección 4.4). Si no se dispone de una alternativa médica aceptable diferente de un inhibidor potente de CYP3A4, se debe reducir la dosis de pazopanib a 400 mg al día durante la administración concomitante. En estos casos se debe prestar especial atención a las reacciones adversas relacionadas con el fármaco, y pueden plantearse reducciones de dosis adicionales si se observan posibles reacciones adversas relacionadas con el fármaco.
Por lo tanto, se debe evitar la combinación con inhibidores potentes de P-gp o BCRP, o se recomienda seleccionar una medicación alternativa concomitante que no tenga capacidad para inhibir o presente una mínima capacidad de inhibir P-gp o BCRP.
Inductores de CYP3A4, P-gp, BCRP:
Los inductores CYP3A4 como rifampina pueden disminuir las concentraciones plasmáticas de pazopanib. La administración concomitante de pazopanib con un potente inductor de P-gp o BCRP puede alterar la exposición y la distribución de pazopanib, incluso la distribución en el SNC. Se recomienda seleccionar una medicación alternativa concomitante que no tenga capacidad o que tenga una mínima capacidad de inducción enzimática o transportadora.
Los estudios in vitro con microsomas hepáticos humanos mostraton que pazopanib inhibe las enzimas CYP 1A2, 3A4, 2B6, 2C8, 2C9, 2C19, y 2E1. La capacidad de inducción de CYP3A4 en humanos se demostró en un análisis in vitro de PXR humano. En estudios de farmacología clínica en pacientes con cáncer, en los que utilizaron 800 mg de pazopanib una vez al día, se ha demostrado que pazopanib no tiene un efecto clínicamente relevante sobre la farmacocinética de la cafeína (CYP1A2 sonda de sustrato), warfarina (CYP2C9 sonda de sustrato), o el omeprazol (CYP2C19 sonda de sustrato). Pazopanib provoca un incremento de aproximadamente el 30% en la media del AUC y de la Cmax de midazolam (CYP3A4 sonda de sustrato) e incrementos del 33% al 64% en el cociente de las concentraciones de dextrometorfano a dextrofano en orina después de la administración oral de dextrometorfano (CYP2D6 sonda de sustrato). La administración conjunta de 800 mg de pazopanib una vez al día y paclitaxel 80 mg/m2 (CYP3A4 y CYP2C8 sustrato) una vez a la semana provocó un incremento medio del 25% y el 31% respectivamente en el AUC y la Cmax de paclitaxel.
En base a los valores in vitro de CI50 y los valores in vivo de la Cmax en plasma, los metabolitos de pazopanib GSK1268992 y GSK1268997 pueden contribuir al efecto inhibitorio neto de pazopanib sobre BCRP. Además, no se puede excluir la inhibición de BCRP y P-gp por pazopanib en el tracto gastrointestinal. Se debe tener cuidado cuando se administra conjuntamente pazopanib con otros sustratos orales de BCRP y P-gp.
In vitro, pazopanib inhibe el polipéptido transportador de aniones orgánicos humanos (OATP1B1). No se puede excluir que pazopanib afecte a la farmacocinética de los sustratos de OATP1B1 (por ej.: estatinas, ver a continuación “Efecto del uso concomitante de pazopanib y simvastatina”).
Pazopanib es un inhibidor in vitro de la enzima uridina difosfoglucuronosil-transferasa 1A1 (UGT1A1). El metabolito activo de irinotecan, SN-38, es un sustrato de OATP1B1 y UGT1A1. La coadministración de 400 mg de pazopanib una vez al día con 250 mg/m2 de cetuximab y 150 mg/m2 de irinotecan, produjo un incremento de la exposición sistémica a SN-38 de aproximadamente el 20 %. Pazopanib puede tener un mayor impacto sobre la disposición a SN-38 en sujetos con polimorfismo familiar en UGT1A1*28 que en sujetos con el alelo normal. Sin embargo, el genotipo UGT1A1 no fue siempre predictivo del efecto de pazopanib sobre la disposición a SN-38. Se debe tener precaución cuando se coadministre pazopanib con sustratos de UGT1A1.
Efecto del uso concomitante de _pazopanib ysimvastatina
El uso concomitante de pazopanib y simvastatina incrementa la incidencia de elevaciones de ALT. Los resultados procedentes de un meta análisis donde utilizaron datos agrupados de los estudios clínicos con pazopanib mostraron que elevaciones de ALT > 3 x LSN fueron notificadas en 126 / 895 (14 %) de los pacientes que no tomaron estatinas en comparación con 11 / 41 (27 %) de los pacientes que tomaron simvastatina simultáneamente (p = 0,038). Si un paciente que recibe simultáneamente simvastatina desarrolla elevaciones de ALT, siga las instrucciones posológicas de pazopanib y suspenda el tratamiento con simvastatina (ver sección 4.4). Además, el uso concomitante de pazopanib y otras estatinas se debe realizar con precaución ya que actualmente los datos disponibles son insuficientes para evaluar su impacto en los niveles de ALT. No se puede descartar que pazopanib afecte a la farmacocinética de otras estatinas (por ej.: atorvastatina, fluvastatina, pravastatina, rosuvastatina).
Efecto de los alimentos sobre _pazopanib
La administración de pazopanib con comidas con alto o bajo contenido en grasas da lugar a un incremento de aproximadamente 2 veces en el AUC y la Cmax. Por lo tanto, pazopanib se debe administrar al menos 1 hora antes o 2 horas después de las comidas.
La administración concomitante de pazopanib con esomeprazol disminuye la biodisponibilidad de pazopanib aproximadamente en un 40 % (AUC y Cmax), y se debe evitar la administración conjunta de pazopanib con medicamentos que aumentan el pH gástrico. Si el médico considera necesario emplear de forma concomitante un inhibidor de la bomba de protones (IBP), se recomienda tomar la dosis pazopanib en ausencia de alimentos, una vez al día por la noche junto con el IBP. Si el médico considera necesario emplear de forma concomitante un antagonista de los receptores H2, pazopanib se debe tomar en ausencia de alimentos al menos 2 horas antes o 10 horas después de tomar un antagonista de los receptores H2. Pazopanib debe ser administrado al menos 1 hora antes o 2 horas después de la administración de antiácidos de acción rápida. Las recomendaciones sobre cómo administrar pazopanib junto con IBP y con antagonistas de los receptores H2 se basan en consideraciones fisiológicas.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No existen datos adecuados del uso de pazopanib en mujeres embarazadas. Los estudios en animales han mostrado toxicidad reproductiva (ver sección 5.3). El riesgo potencial en humanos es desconocido.
Pazopanib no se debe utilizar durante el embarazo a menos que el estado clínico de las mujeres requiera el tratamiento con pazopanib. Si se utiliza pazopanib durante el embarazo, o si la paciente se queda embarazada durante el tratamiento con pazopanib, se debe explicar a la paciente el posible riesgo que existe para el feto.
Se debe aconsejar a las mujeres en edad fértil que utilicen un método anticonceptivo adecuado durante el tratamiento y al menos 2 semanas después del tratamiento para evitar quedarse embarazadas durante el tratamiento con pazopanib.
Lactancia
No se ha establecido el uso seguro de pazopanib durante la lactancia. Se desconoce si pazopanib se excreta en la leche materna. No hay datos en animales sobre la excreción de pazopanib en la leche, por tanto el riesgo en el lactante no puede ser excluido. La lactancia debe interrumpirse durante el tratamiento con pazopanib.
Fertilidad
Estudios en animales indican que la fertilidad masculina y femenina puede verse afectada por el tratamiento con pazopanib (ver sección 5.3).
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No se han realizado estudios de los efectos sobre la capacidad para conducir y utilizar máquinas. No se puede predecir que exista un efecto perjudicial en estas actividades a partir de la farmacología de pazopanib. Se debe tener en cuenta el estado clínico del paciente y el perfil de acontecimientos adversos de pazopanib cuando se examina la habilidad del paciente para realizar tareas que requieran juicio, habilidades motoras o cognitivas. Los pacientes deben evitar conducir o utilizar máquinas si sienten mareo, cansancio o debilidad.
Resumen del perfil de seguridad
Los datos agrupados procedentes del estudio pivotal en CCR (VEG105192, n=290), el estudio de extensión (VEG107769, n=71), el estudio complementario de Fase II (VEG102616, n=225) y el estudio Fase III de no inferioridad, randomizado, abierto, de grupos paralelos (VEG108844, n=557), fueron analizados en la evaluación global de seguridad y tolerabilidad de pazopanib (total n=1.149) en pacientes con CCR (ver sección 5.1).
Los datos agrupados procedentes del estudio pivotal en STB (VEG110727, n = 369) y el estudio complementario Fase II (VEG20002, n = 142) fueron analizados en la evaluación global de seguridad y tolerabilidad de pazopanib (población total de seguridad n = 382) en sujetos con STB (ver sección 5.1).
La reacciones adversas graves más importantes identificadas en los estudios de CCR y STB fueron: accidente isquémico transitorio, accidente cerebrovascular isquémico, isquemia de miocardio, infarto de miocardio e infarto cerebral, insuficiencia cardiaca, perforación gastrointestinal y fístula, prolongación del intervalo QT y hemorragia pulmonar, gastrointestinal y cerebral. Todas las reacciones adversas fueron notificadas en < 1 % de los pacientes tratados. Entre las otras importantes reacciones adversas graves identificadas en los estudios en STB se incluyen, acontecimientos tromboembólicos venosos, disfunción del ventrículo izquierdo y neumotórax.
Entre los eventos mortales que posiblemente tuvieron relación con pazopanib se incluyeron la hemorrágia gastrointestinal, hemorragia pulmonar/hemoptisis, función hepática anormal, perforación intestinal y accidente cerebrovascular isquémico.
Entre las reacciones adversas más comunes (experimentadas por al menos el 10% de los pacientes) de cualquier grado en los estudios en CCR y STB se incluyeron: diarrea, cambios en el color del pelo, hipopigmentación de la piel, erupción cutánea exfoliativa, hipertensión, náusea, dolor de cabeza, fatiga, anorexia, vómitos, disgeusia, estomatitis, disminución de peso, dolor, elevaciones de alanina aminotransferasa y aspartato aminotransferasa.
Las reacciones adversas relacionadas con el tratamiento, en todos los grados, que fueron notificadas en sujetos con CCR y STB o durante el periodo postcomercialización, se enumeran a continuación por la clasificación de órganos del sistema MedDRA, por frecuencia y por el nivel de gravedad. Se ha empleado el siguiente criterio para la clasificación de la frecuencia:
Muy frecuentes Frecuentes Poco frecuentes Raras Muy raras No conocida
>1/10
>1/100 a <1/10 >1/1.000 a <1/100 >1/10.000 a <1/1.000 <1/10.000
(no puede estimarse a partir de los datos disponibles)
Las categorias han sido asignadas en base a las frecuencias absolutas procedentes de los datos de estudios clínicos. Los datos sobre la seguridad y tolerabilidad postcomercialización también han sido evaluados en todos los ensayos clínicos de pazopanib y en las notificaciones espontáneas. Dentro de cada clasificación de órganos por sistema, las reacciones adversas con la misma frecuencia se enumeran en orden decreciente de gravedad.
Tabla 2: Reacciones adversas relacionadas con el tratamiento notificadas en los estudios en CCR (n = 1.149) o durante el periodo postcomercialización
|
Sistema de clasificación de órganos |
Frecuencia (todos los grados) |
Reacciones adversas |
Todos los Grados n (%) |
Grado 3 n (%) |
Grado 4 n (%) |
|
Infecciones e infestaciones |
Poco frecuentes |
Infecciones (con o sin neutropenia)f |
desconocida |
desconocida |
desconocida |
|
Poco frecuentes |
Infección gingival |
1 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Peritonitis infecciosa |
1 (< 1 %) |
0 |
0 | |
|
Neoplasias benignas, malignas y no especificadas (incl quistes y pólipos) |
Poco frecuentes |
Dolor tumoral |
1 (< 1 %) |
1 (< 1 %) |
0 |
|
Trastornos de la sangre y del sistema linfático |
Frecuentes |
T rombocitopenia |
80 (7 %) |
10 (< 1 %) |
5 (< 1 %) |
|
Frecuentes |
Neutropenia |
79 (7 %) |
20 (2 %) |
4 (< 1 %) | |
|
Frecuentes |
Leucopenia |
63 (5 %) |
5 (< 1 %) |
0 | |
|
Raras |
Microangiopatía trombótica (incluyendo púrpura trombocitopénica trombótica y síndrome urémico hemolítico)f |
desconocida |
desconocida |
desconocida | |
|
Trastornos endocrinos |
Frecuentes |
Hipotiroidismo |
83 (7 %) |
1 (< 1 %) |
0 |
|
Trastornos del metabolismo y de la nutrición |
Muy frecuentes |
Disminución del apetitoe |
317 (28 %) |
14 (1 %) |
0 |
|
Frecuentes |
Hipofosfatemia |
21 (2 %) |
7 (< 1 %) |
0 | |
|
Frecuentes |
Deshidratación |
16 (1 %) |
5 (< 1 %) |
0 | |
|
Poco frecuentes |
Hipomagnesemia |
10 (< 1 %) |
0 |
0 | |
|
Trastornos psiquiátricos |
Frecuentes |
Insomnio |
30 (3 %) |
0 |
0 |
|
Trastornos del sistema nervioso |
Muy frecuentes |
Disgeusiac |
254 (22 %) |
1 (< 1 %) |
0 |
|
Muy frecuentes |
Cefalea |
122 (11%) |
11 (< 1 %) |
0 | |
|
Frecuentes |
Mareo |
55 (5 %) |
3 (< 1 %) |
1 (< 1 %) | |
|
Frecuentes |
Letargia |
30 (3 %) |
3 (< 1 %) |
0 | |
|
Frecuentes |
Parestesia |
20 (2 %) |
2 (< 1 %) |
0 | |
|
Frecuentes |
Neuropatía sensorial periférica |
17 (1 %) |
0 |
0 | |
|
Poco frecuentes |
Hipoestesia |
8 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Accidente isquémico transitorio |
7 (< 1 %) |
4 (< 1 %) |
0 | |
|
Poco frecuentes |
Somnolencia |
3 (< 1 %) |
1 (< 1 %) |
0 | |
|
Poco frecuentes |
Accidente cerebrovascular |
2 (< 1 %) |
1 (< 1 %) |
1 (< 1 %) | |
|
Poco frecuentes |
Ictus isquémico |
2 (< 1 %) |
0 |
1 (< 1 %) | |
|
Raras |
Encefalopatía posterior reversible/síndrome de leucoencefalopatía posterior reversible |
desconocida |
desconocida |
desconocida | |
|
Trastornos oculares |
Frecuentes |
Visión borrosa |
19 (2 %) |
1 (< 1 %) |
0 |
|
Poco frecuentes |
Desprendimiento de retinaf |
1 (< 1 %) |
1 (< 1 %) |
0 | |
|
Poco frecuentes |
Desgarro retinianof |
1 (< 1 %) |
1 (< 1 %) |
0 | |
|
Poco frecuentes |
Alteración del color de las pestañas |
4 (< 1 %) |
0 |
0 |
|
Trastornos cardiacos |
Poco frecuentes |
Bradicardia |
6 (< 1 %) |
0 |
0 |
|
Poco frecuentes |
Infarto de miocardio |
5 (< 1 %) |
1 (< 1 %) |
4 (< 1 %) | |
|
Poco frecuentes |
Disfunción cardiaca |
4 (< 1 %) |
1 (< 1 %) |
0 | |
|
Poco frecuentes |
Isquemia de miocardio |
3 (< 1 %) |
1 (< 1 %) |
0 | |
|
Trastornos vasculares |
Muy frecuentes |
Hipertensión |
473 (41 %) |
115(10%) |
1 (< 1 %) |
|
Frecuentes |
Sofoco |
16 (1 %) |
0 |
0 | |
|
Frecuentes |
Eventos tromboembólicos venosos g |
13 (1 %) |
6 (< 1 %) |
7 (< 1 %) | |
|
Frecuentes |
Rubefacción |
12 (1 %) |
0 |
0 | |
|
Poco frecuentes |
Crisis hipertensiva |
6 (< 1 %) |
0 |
2 (< 1 %) | |
|
Poco frecuentes |
Hemorragia |
1 (< 1 %) |
0 |
0 | |
|
Trastornos respiratorios, torácicos y mediastínicos |
Frecuentes |
Epistaxis |
50 (4 %) |
1 (< 1 %) |
0 |
|
Frecuentes |
Disfonía |
48 (4 %) |
0 |
0 | |
|
Frecuentes |
Disnea |
42 (4 %) |
8 (< 1 %) |
1 (< 1 %) | |
|
Frecuentes |
Hemoptisis |
15 (1 %) |
1 (< 1 %) |
0 | |
|
Poco frecuentes |
Rinorrea |
8 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Hemorragia pulmonar |
2 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Neumotórax |
1 (< 1 %) |
0 |
0 | |
|
Raras |
Enfermedad pulmonar intersticial/neumonitisf |
desconocida |
desconocida |
desconocida |
|
Muy frecuentes |
Diarrea |
614 (53 %) |
65 (6 %) |
2 (< 1 %) | |
|
Muy frecuentes |
Náusea |
386 (34 %) |
14 (1%) |
0 | |
|
Muy frecuentes |
Vómitos |
225 (20 %) |
18 (2 %) |
1 (< 1 %) | |
|
Muy frecuentes |
Dolor abdominal3 |
139 (12 %) |
15 (1 %) |
0 | |
|
Frecuentes |
Estomatitis |
96 (8 %) |
4 (< 1 %) |
0 | |
|
Frecuentes |
Dispepsia |
83 (7 %) |
2 (< 1 %) |
0 | |
|
Frecuentes |
Flatulencia |
43 (4 %) |
0 |
0 | |
|
Frecuentes |
Distensión abdominal |
36 (3 %) |
2 (< 1 %) |
0 | |
|
Frecuentes |
Ulceración de la boca |
28 (2 %) |
3 (< 1 %) |
0 | |
|
Frecuentes |
Sequedad bucal |
27 (2 %) |
0 |
0 | |
|
Poco frecuentes |
Pancreatitis |
8 (< 1 %) |
4 (< 1 %) |
0 | |
|
Poco frecuentes |
Hemorragia rectal |
8 (< 1 %) |
2 (< 1 %) |
0 | |
|
Poco frecuentes |
Hematoquecia |
6 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Hemorragia gastrointestinal |
4 (< 1 %) |
2 (< 1 %) |
0 | |
|
Trastornos gastrointestinales |
Poco frecuentes |
Melenas |
4 (< 1 %) |
1(< 1 %) |
0 |
|
Poco frecuentes |
Movimientos intestinales frecuentes |
3 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Hemorragia anal |
2 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Perforación del intestino grueso |
2 (< 1 %) |
1 (< 1 %) |
0 | |
|
Poco frecuentes |
Hemorragia bucal |
2 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Hemorragia gastrointestinal alta |
2 (< 1 %) |
1 (< 1 %) |
0 | |
|
Poco frecuentes |
Fístula enterocutánea |
1 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Hematemesis |
1 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Hemorragia hemorroidal |
1 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Perforación de íleon |
1 (< 1 %) |
0 |
1 (< 1 %) | |
|
Poco frecuentes |
Hemorragia esofágica |
1 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Hemorragia retroperitoneal |
1 (< 1 %) |
0 |
0 |
|
Frecuentes |
Hiperbilirrubinemia |
38 (3 %) |
2 (< 1 %) |
1 (< 1 %) | |
|
Frecuentes |
Función hepática anormal |
29 (3 %) |
13 (1 %) |
2 (< 1 %) | |
|
Trastornos hepatobiliares |
Frecuentes |
Hepatotoxicidad |
18 (2 %) |
11 (< 1 %) |
2 (< 1 %) |
|
Poco frecuentes |
Ictericia |
3 (< 1 %) |
1 (< 1 %) |
0 | |
|
Poco frecuentes |
Daño hepático inducido por fármacos |
2 (< 1 %) |
2 (< 1 %) |
0 | |
|
Poco frecuentes |
Fallo hepático |
1 (< 1 %) |
0 |
1 (< 1 %) | |
|
Muy frecuentes |
Cambios de color del pelo |
404 (35 %) |
1 (< 1 %) |
0 | |
|
Muy frecuentes |
Síndrome de eritrodisestesia palmoplantar |
206 (18 %) |
39 (3 %) |
0 | |
|
Muy frecuentes |
Alopecia |
130 (11%) |
0 |
0 | |
|
Muy frecuentes |
Erupción |
129 (11%) |
7 (< 1 %) |
0 | |
|
Frecuentes |
Hipopigmenta-ción de la piel |
52 (5 %) |
0 |
0 | |
|
Frecuentes |
Piel seca |
50 (4 %) |
0 |
0 | |
|
Frecuentes |
Prurito |
29 (3 %) |
0 |
0 | |
|
Frecuentes |
Eritema |
25 (2 %) |
0 |
0 | |
|
Frecuentes |
Despigmentación de la piel |
20 (2 %) |
0 |
0 | |
|
Frecuentes |
Hiperhidrosis |
17 (1 %) |
0 |
0 | |
|
Trastornos de la |
Poco frecuentes |
Trastornos en las uñas |
11 (< 1 %) |
0 |
0 |
|
piel y del tejido subcutáneo |
Poco frecuentes |
Exfoliación de la piel |
10 (< 1 %) |
0 |
0 |
|
Poco frecuentes |
Reacción de fotosensibilidad |
7 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Erupción eritematosa |
6 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Trastornos de la piel |
5 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Erupción macular |
4 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Erupción prurítica |
3 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Erupción vesicular |
3 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Prurito generalizado |
2 (< 1 %) |
1 (< 1 %) |
0 | |
|
Poco frecuentes |
Erupción generalizada |
2 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Erupción papular |
2 (< 1 %) |
0 |
0 |
|
Poco frecuentes |
Eritema plantar |
1 (< 1 %) |
0 |
0 | |
|
Trastornos musculoesquelé-ticos y del tejido conjuntivo |
Frecuentes |
Artralgia |
48 (4 %) |
8 (< 1 %) |
0 |
|
Frecuentes |
Mialgia |
35 (3 %) |
2 (< 1 %) |
0 | |
|
Frecuentes |
Espasmos musculares |
25 (2 %) |
0 |
0 | |
|
Poco frecuentes |
Dolor musculoesquelético |
9 (< 1 %) |
1 (< 1 %) |
0 | |
|
Trastornos renales y urinarios |
Muy Frecuentes |
Proteinuria |
135 (12 %) |
32 (3 %) |
0 |
|
Poco frecuentes |
Hemorragia en el tracto urinario |
1 (< 1 %) |
0 |
0 | |
|
Trastornos del aparato reproductor y de la mama |
Poco frecuentes |
Menorragia |
3 (< 1 %) |
0 |
0 |
|
Poco frecuentes |
Hemorragia vaginal |
3 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Metrorragia |
1 (< 1 %) |
0 |
0 | |
|
Trastornos generales y alteraciones en el lugar de administración |
Muy frecuentes |
Fatiga |
415 (36 %) |
65 (6 %) |
1 (< 1 %) |
|
Frecuentes |
Inflamación de la mucosa |
86 (7 %) |
5 (< 1 %) |
0 | |
|
Frecuentes |
Astenia |
82 (7 %) |
20 (2 %) |
1 (< 1 %) | |
|
Frecuentes |
Edemab |
72 (6 %) |
1 (< 1 %) |
0 | |
|
Frecuentes |
Dolor torácico |
18 (2 %) |
2 (< 1 %) |
0 | |
|
Poco frecuentes |
Escalofríos |
4 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Trastorno en la membrana mucosa |
1 (< 1 %) |
0 |
0 | |
|
Exploraciones complementarias |
Muy frecuentes |
Incremento de alanina aminotransferasa |
246 (21 %) |
84 (7 %) |
14 (1 %) |
|
Muy frecuentes |
Incremento de aspartato aminotransferasa |
211 (18%) |
51 (4 %) |
10 (< 1 %) | |
|
Frecuentes |
Pérdida de peso |
96 (8 %) |
7 (< 1 %) |
0 | |
|
Frecuentes |
Incremento de bilirrubina en sangre |
61 (5 %) |
6 (< 1 %) |
1 (< 1 %) | |
|
Frecuentes |
Incremento de creatinina en sangre |
55 (5 %) |
3 (< 1 %) |
0 | |
|
Frecuentes |
Incremento de lipasa |
51 (4 %) |
21 (2 %) |
7 (< 1 %) | |
|
Frecuentes |
Descenso del recuento de leucocitos en sangred |
51 (4 %) |
3 (< 1 %) |
0 | |
|
Frecuentes |
Incremento de la hormona estimulante de la tiroides en sangre |
36 (3 %) |
0 |
0 | |
|
Frecuentes |
Incremento de amilasa |
35 (3 %) |
7 (< 1 %) |
0 | |
|
Frecuentes |
Incremento de Gamma-glutamiltransferasa |
31 (3 %) |
9 (< 1 %) |
4 (< 1 %) | |
|
Frecuentes |
Incremento de la presión arterial |
15 (1 %) |
2 (< 1 %) |
0 |
|
Frecuentes |
Incremento de urea en sangre |
12 (1 %) |
1 (< 1 %) |
0 | |
|
Frecuentes |
Prueba de función hepática anormal |
12 (1 %) |
6 (< 1 %) |
1 (< 1 %) | |
|
Poco frecuentes |
Incremento de las enzimas hepáticas |
11 (< 1 %) |
4 (< 1 %) |
3 (< 1 %) | |
|
Poco frecuentes |
Descenso de glucosa en sangre |
7 (< 1 %) |
0 |
1 (< 1 %) | |
|
Poco frecuentes |
Prolongación del intervalo QT del electrocardiograma |
7 (< 1 %) |
2 (< 1 %) |
0 | |
|
Poco frecuentes |
Incremento de transaminasas |
7 (< 1 %) |
1 (< 1 %) |
0 | |
|
Poco frecuentes |
Prueba de función tiroidea anormal |
3 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Incremento de la presión arterial diastólica |
2 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Incremento de la presión arterial sistólica |
1 (< 1 %) |
0 |
0 |
f Reacciones adversas relacionadas con el tratamiento y notificadas durante el periodo postcomercialización (notificación espontánea de casos y reacciones adversas graves procedentes de todos los ensayos clínicos con pazopanib).
Los siguientes términos se han combinado:
a Dolor abdominal, dolor en la parte superior e inferior del abdomen b Edema, edema periférico, edema del ojo, edema localizado y edema de cara c Disgeusia, ageusia e hipogeusia
d Descenso en el recuento de glóbulos blancos, neutrófilos y leucocitos e Disminución del apetito y anorexia
f Disfunción cardiaca, disfunción del ventrículo izquierdo, insuficiencia cardiaca y cardiomiopatía restrictiva
g Evento tromboembólico venoso, trombosis venosa profunda, embolismo pulmonar y trombosis
En pacientes con ascendencia del Este Asiático, se observaron con mayor frecuencia casos de neutropenia, trombocitopenia y síndrome de eritrodisestesia palmoplantar.
Tabla 3: Reacciones adversas relacionadas con el tratamiento notificadas en los estudios en STB (n = 382)
|
Sistema de clasificación de órganos |
Frecuencia (todos los grados) |
Reacciones Adversas |
Todos los Grados n (%) |
Grado 3 n (%) |
Grado 4 n (%) |
|
Infecciones e infestaciones |
Frecuentes |
Infección gingival |
4 (1 %) |
0 |
0 |
|
Neoplasias benignas, malignas y no especificadas (incl quistes y pólipos) |
Muy frecuentes |
Dolor tumoral |
121 (32 %) |
32 (8 %) |
0 |
|
Muy frecuentes |
Leucopenia |
106 (44 %) |
3 (1 %) |
0 | |
|
Muy frecuentes |
T rombocitopenia |
86 (36 %) |
7 (3 %) |
2 (< 1 %) | |
|
Trastornos de la sangre y del sistema linfático f |
Muy frecuentes |
Neutropenia |
79 (33 %) |
10 (4 %) |
0 |
|
Poco frecuentes |
Microangiopatía trombótica (incluyendo púrpura trombocitopénica trombótica y síndrome hemolítico urémico) |
1 (< 1 %) |
1 (< 1 %) |
0 | |
|
Trastornos endocrinos |
Frecuentes |
Hipotiroidismo |
18 (5 %) |
0 |
0 |
|
Trastornos del metabolismo y de la nutrición |
Muy frecuentes |
Disminución del apetitoe |
108 (28 %) |
12 (3 %) |
0 |
|
Muy frecuentes |
Hipoalbuminemia |
81 (34 %) |
2 (< 1 %) |
0 | |
|
Frecuentes |
Deshidratación |
4 (1 %) |
2 (1 %) |
0 | |
|
Poco frecuentes |
Hipomagnesemia |
1 (< 1 %) |
0 |
0 | |
|
Trastornos psiquiátricos |
Frecuentes |
Insomnio |
5 (1 %) |
1 (< 1 %) |
0 |
|
Muy frecuentes |
Disgeusiac |
79 (21 %) |
0 |
0 | |
|
Muy frecuentes |
Cefalea |
54 (14 %) |
2 (< 1 %) |
0 | |
|
Trastornos del |
Frecuentes |
Neuropatía sensorial periférica |
30 (8 %) |
1 (< 1 %) |
0 |
|
sistema nervioso |
Frecuentes |
Mareo |
15 (4 %) |
0 |
0 |
|
Poco frecuentes |
Somnolencia |
3 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Parestesia |
1 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Infarto cerebral |
1 (< 1 %) |
0 |
1 (< 1 %) |
|
Trastornos oculares |
Frecuentes |
Visión borrosa |
15 (4 %) |
0 |
0 |
|
Frecuentes |
Disfunción cardiaca8 |
21 (5 %) |
3 (< 1 %) |
1 (< 1 %) | |
|
Trastornos cardiacos |
Frecuentes |
Disfunción del ventrículo izquierdo |
13 (3 %) |
3 (< 1 %) |
0 |
|
Frecuentes |
Bradicardia |
4 (1 %) |
0 |
0 | |
|
Poco frecuentes |
Infarto de miocardio |
1 (< 1 %) |
0 |
0 | |
|
Muy frecuentes |
Hipertensión |
152 (40 %) |
26 (7 %) |
0 | |
|
Trastornos |
Frecuentes |
Acontecimientos tromboembólicos venososd |
13 (3 %) |
4 (1 %) |
5 (1 %) |
|
vasculares |
Frecuentes |
Sofoco |
12 (3 %) |
0 |
0 |
|
Frecuentes |
Rubefacción |
4 (1 %) |
0 |
0 | |
|
Poco frecuentes |
Hemorragia |
2 (< 1 %) |
1 (< 1 %) |
0 | |
|
Frecuentes |
Epistaxis |
22 (6 %) |
0 |
0 | |
|
Frecuentes |
Disfonia |
20 (5 %) |
0 |
0 | |
|
Frecuentes |
Disnea |
14 (4 %) |
3 (< 1 %) |
0 | |
|
Frecuentes |
Tos |
12 (3 %) |
0 |
0 | |
|
Frecuentes |
Neumotórax |
7 (2 %) |
2 (< 1 %) |
1 (< 1 %) | |
|
Frecuentes |
Hipo |
4 (1 %) |
0 |
0 | |
|
Trastornos respiratorios, torácicos y mediastínicos |
Frecuentes |
Hemorragia pulmonar |
4 (1 %) |
1 (< 1 %) |
0 |
|
Poco frecuentes |
Dolor orofaríngeo |
3 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Hemorragia bronquial |
2 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Rinorrea |
1 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Hemoptisis |
1 (< 1 %) |
0 |
0 | |
|
Raras |
Enfermedad pulmonar intersticial/neumonitisf |
desconocida |
desconocida |
desconocida |
|
Muy frecuentes |
Diarrea |
174 (46 %) |
17 (4 %) |
0 | |
|
Muy frecuentes |
Náusea |
167 (44 %) |
8 (2 %) |
0 | |
|
Muy frecuentes |
Vómitos |
96 (25 %) |
7 (2 %) |
0 | |
|
Muy frecuentes |
Dolor abdominal3 |
55 (14 %) |
4 (1 %) |
0 | |
|
Muy frecuentes |
Estomatitis |
41 (11 %) |
1 (< 1 %) |
0 | |
|
Frecuentes |
Distensión abdominal |
16 (4 %) |
2 (1 %) |
0 | |
|
Frecuentes |
Sequedad bucal |
14 (4 %) |
0 |
0 | |
|
Frecuentes |
Dispepsia |
12 (3 %) |
0 |
0 | |
|
Frecuentes |
Hemorragia bucal |
5 (1 %) |
0 |
0 | |
|
Frecuentes |
Flatulencia |
5 (1 %) |
0 |
0 | |
|
Frecuentes |
Hemorragia anal |
4 (1 %) |
0 |
0 | |
|
Trastornos gastrointestinales |
Poco frecuentes |
Hemorragia gastrointestinal |
2 (< 1 %) |
0 |
0 |
|
Poco frecuentes |
Hemorragia rectal |
2 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Fístula enterocutánea |
1 (< 1 %) |
1 (< 1 %) |
0 | |
|
Poco frecuentes |
Hemorragia gástrica |
1 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Melenas |
2 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Hemorragia esofágica |
1 (< 1 %) |
0 |
1 (< 1 %) | |
|
Poco frecuentes |
Peritonitis |
1 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Hemorragia retroperitoneal |
1 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Hemorragia gastrointestinal superior |
1 (< 1 %) |
1 (< 1 %) |
0 | |
|
Poco frecuentes |
Perforación del ileón |
1 (< 1 %) |
0 |
1 (< 1 %) | |
|
Trastornos hepatobiliares |
Poco frecuentes |
Función hepática anormal |
2 (< 1 %) |
0 |
1 (< 1 %) |
|
Muy frecuentes |
Cambios de color del pelo |
93 (24 %) |
0 |
0 | |
|
Muy frecuentes |
Hipopigmentación de la piel |
80 (21 %) |
0 |
0 | |
|
Muy frecuentes |
Erupción exfoliativa |
52 (14 %) |
2 (< 1 %) |
0 | |
|
Frecuentes |
Alopecia |
30 (8 %) |
0 |
0 | |
|
Frecuentes |
Trastornos de la pielc |
26 (7 %) |
4 (1 %) |
0 | |
|
Frecuentes |
Piel seca |
21 (5 %) |
0 |
0 | |
|
Frecuentes |
Hiperhidrosis |
18 (5 %) |
0 |
0 | |
|
Trastornos de la piel y del tejido subcutáneo |
Frecuentes |
Trastornos de las uñas |
13 (3 %) |
0 |
0 |
|
Frecuentes |
Prurito |
11 (3 %) |
0 |
0 | |
|
Frecuentes |
Eritema |
4 (1 %) |
0 |
0 | |
|
Poco frecuentes |
Úlcera de la piel |
3 (< 1 %) |
1 (< 1 %) |
0 | |
|
Poco frecuentes |
Erupción cutánea |
1 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Erupción papular |
1 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Reacción de fotosensibilidad |
1 (< 1 %) |
0 |
0 | |
|
Poco frecuentes |
Síndrome de eritrodisestesia palmoplantar |
2 (<1 %) |
0 |
0 | |
|
Trastornos |
Frecuentes |
Dolor musculoesquelético |
35 (9 %) |
2 (< 1 %) |
0 |
|
musculoesqueléticos |
Frecuentes |
Mialgia |
28 (7 %) |
2 (< 1 %) |
0 |
|
y del tejido |
Frecuentes |
Espasmos musculares |
8 (2 %) |
0 |
0 |
|
conjuntivo |
Poco frecuentes |
Artralgia |
2 (< 1 %) |
0 |
0 |
|
Trastornos renales y urinarios |
Poco frecuentes |
Proteinuria |
2 (<1 %) |
0 |
0 |
|
Trastornos del aparato reproductor y de la mama |
Poco frecuentes |
Hemorragia vaginal |
3 (< 1 %) |
0 |
0 |
|
Poco frecuentes |
Menorragia |
1 (< 1 %) |
0 |
0 | |
|
Muy frecuentes |
Fatiga |
178 (47 %) |
34 (9 %) |
1 (< 1 %) | |
|
Trastornos |
Frecuentes |
Edemab |
18 (5 %) |
1 (< 1 %) |
0 |
|
generales y |
Frecuentes |
Dolor en el pecho |
12 (3 %) |
4 (1 %) |
0 |
|
alteraciones en el |
Frecuentes |
Escalofríos |
10 (3 %) |
0 |
0 |
|
lugar de administración |
Poco frecuentes |
Inflamación de las e mucosas |
1 (<1 %) |
0 |
0 |
|
Poco frecuentes |
Astenia |
1 (< 1 %) |
0 |
0 |
|
Exploraciones complementariash |
Muy frecuentes |
Pérdida de peso |
86 (23 %) |
5 (1 %) |
0 |
|
Frecuentes |
Examen anormal de oídos, nariz y gargantae |
29 (8 %) |
4 (1 %) |
0 | |
|
Frecuentes |
Elevación de alanina aminotransferasa |
8 (2 %) |
4 (1 %) |
2 (< 1 %) | |
|
Frecuentes |
Colesterol en sangre anormal |
6 (2 %) |
0 |
0 | |
|
Frecuentes |
Elevación de aspartato aminotransferasa |
5 (1 %) |
2 (< 1 %) |
2 (< 1 %) | |
|
Frecuentes |
Elevación de gamma glutamyltransferasa |
4 (1 %) |
0 |
3 (< 1 %) | |
|
Poco frecuentes |
Incremento de bilirrubina en sangre |
2 (<1 %) |
0 |
0 | |
|
Poco frecuentes |
Aspartato aminotransferasa |
2 (< 1 %) |
0 |
2 (< 1 %) | |
|
Poco frecuentes |
Alanina aminotransferasa |
1 (< 1 %) |
0 |
1 (< 1 %) | |
|
Poco frecuentes |
Disminución del recuento de plaquetas |
1 (< 1 %) |
0 |
1 (< 1 %) | |
|
Poco frecuentes |
Prolongación del intervalo QT del electrocardiograma |
2 (< 1 %) |
1 (< 1 %) |
0 |
f Reacciones adversas relacionadas con el tratamiento y notificadas durante el periodo postcomercialización (notificación espontánea de casos y reacciones adversas graves procedentes de todos los ensayos clínicos con pazopanib).
Los siguientes términos han sido combinados: a Dolor abdominal, dolor abdominal superior y dolor gastrointestinal b Edema, edema periférico y edema palpebral
c La mayoría de los casos fueron síndrome de eritrodisestesia palmoplantar
d Acontecimientos tromboembólicos venosos - incluye trombosis venosa profunda, embolismo pulmonar y términos de trombosis
e La mayoría de estos casos se describieron como mucositis
f La frecuencia está basada en las tablas de valores del laboratorio procedentes de VEG110727 (N = 240). Estos fueron notificados por los investigadores como acontecimientos adversos menos frecuentes que los indicados en las tablas de valores del laboratorio.
g Acontecimientos de disfunción cardiaca - incluye disfunción del ventrículo izquierdo, fallo cardiaco y cardiomiopatía restrictiva
h La frecuencia está basada en los acontecimientos adversos notificados por los investigadores. Las anomalías del laboratorio fueron notificadas por los investigadores como acontecimientos adversos menos frecuentes que los indicados en las tablas de valores del laboratorio.
En pacientes con ascendencia del Este Asiático, se observaron con mayor frecuencia casos de neutropenia, trombocitopenia y síndrome de eritrodisestesia palmoplantar.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Anexo V*.
4.9 Sobredosis
En los estudios clínicos se ha evaluado el empleo de dosis superiores a 2.000 mg de pazopanib. Se ha observado fatiga de Grado 3 (toxicidad limitante de dosis) e hipertensión de Grado 3 en 1 de cada 3 pacientes que recibieron dosis de 2.000 mg y 1.000 mg de pazopanib al día, respectivamente.
No existe un antídoto específico para la sobredosis con pazopanib y el tratamiento de la sobredosis debe consistir en medidas de soporte.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Agentes antineoplásicos, otros agentes antineoplásicos, inhibidores de protein kinasa, código ATC: L01XE11
Mecanismo de acción
Pazopanib administrado por vía oral, es un potente inhibidor de tirosin kinasa (ITK) que inhibe múltiples Receptores del Factor de Crecimiento Endotelial Vascular (VEGFR)-1, -2 y -3, inhibe los receptores del factor de crecimiento derivado de plaquetas (PDGFR)-a y -p, e inhibe el receptor del factor de células madre (c-KIT), con valores CI50, de 10, 30, 47, 71, 84 y 74 nM, respectivamente. En experimentos preclínicos, pazopanib produjo una inhibición dependiente de la dosis, de la autofosforilación inducida por ligando de los receptores VEGFR-2, c-Kit y PDGFR-p en las células. In vivo, pazopanib inhibió la fosforilación de VEGFR-2 inducida por VEGF en los pulmones de ratón, la angiogénesis en varios modelos animales y el crecimiento de múltiples xenotransplantes de tumores humanos en ratones.
Farmacogenómica
En un metanálisis farmacogenético de datos procedentes de 31 ensayos clínicos de pazopanib administrado o bien en monoterapia o bien en combinación con otros agentes, se observó ALT > 5 x LSN (Grado 3 NCI CTC) en un 19% de los portadores del alelo HLA-B*57:01 y en un 10% de los no portadores. En esta base de datos, 133/2235 (6%) de los pacientes eran portadores del alelo HLA-B*57:01 (ver sección 4.4).
Estudios clínicos
Carcinoma de Células Renales (CCR)
Se evaluó la seguridad y la eficacia de pazopanib en CCR en un estudio aleatorizado, doble ciego, multicéntrico, controlado con placebo. Los pacientes (N = 435) con CCR avanzado y/o metastásico fueron aleatorizados para recibir 800 mg de pazopanib una vez al día o placebo. El objetivo primario del estudio fue determinar y comparar en los dos brazos de tratamiento, la supervivencia libre de progresión (SLP) siendo la variable secundaria principal la supervivencia global (SG). Los otros objetivos fueron evaluar la tasa de respuesta global y la duración de la respuesta.
Del total de 435 pacientes en este ensayo, 233 pacientes no habían recibido tratamiento previo y 202 eran pacientes en segunda línea que recibieron un tratamiento previo con IL-2 o INFa. El estado funcional de los pacientes (ECOG) fue similar entre los grupos de pazopanib y placebo (ECOG 0:
42% vs. 41%; ECOG 1: 58% vs. 59%). La mayoría de los pacientes tenían factores de pronóstico MSKCC (Memorial Sloan Kettering Cancer Centre) / Motzer, favorables (39 %) o intermedios (54 %). Todos los pacientes presentaron histología de células claras o predominante histología de células claras. Aproximadamente la mitad de los pacientes tenían 3 o más órganos implicados en su enfermedad y la mayoría de los pacientes presentaban el pulmón (74 %), y/o los ganglios linfáticos (54%) como localización metastásica de la enfermedad en la situación inicial.
Una proporción similar de pacientes en cada brazo no habían recibido tratamiento previo o habían sido pretratados con citoquinas (53 % y 47 % en el brazo de pazopanib; 54 % y 46% en el brazo de placebo). En el grupo pretratado con citoquinas, la mayoría (75%) habían recibido tratamiento basado en interferón.
Proporciones similares de pacientes en cada brazo tuvieron nefrectomía previa (89% y 88% en los brazos de pazopanib y placebo, respectivamente) y/o radioterapia previa (22% y 15% en los brazos de pazopanib y placebo, respectivamente).
El análisis primario de la variable principal SLP está basada en la evaluación de la enfermedad mediante una revisión radiológica independiente en toda la población de estudio (pacientes que no han recibido tratamiento previo y pretratados con citoquinas).
|
Tabla 4: Resultados de eficacia glo |
jal en CCR por una evaluación independiente (VEG105192) | |||
|
Variables/Población de estudio |
Pazopanib |
Placebo |
HR (IC 95 %) |
Valor de P (uno de los lados) |
|
SLP ITT global* Mediana (meses) |
N = 290 9,2 |
N = 145 4,2 |
0,46 (0,34; 0,62) |
< 0,0000001 |
|
Tasa de respuesta % (IC 95 %) |
N = 290 30 (25,1;35,6) |
N = 145 3 (0,5; 6,4) |
< 0,001 | |
HR = Hazard ratio; ITT = intención de tratar; SLP = supervivencia libre de progresión. * - Poblaciones que no han recibido tratamiento previo y pretratadas con citoquinas.
Figura 1 Curva de Kaplan-Meier para la supervivencia libre de progresión según una evaluación independiente para la población global (Poblaciones que no han recibido tratamiento previo y poblaciones pretratadas con citoquinas) (VEG105192).

Eje horizontal: Meses; Eje vertical: Porcentaje Libre de Progresión. Pazopanib (N = 290) Mediana de 9,2 meses; Placebo (N = 145) Mediana de 4,2 meses; Harzard ratio = 0,46; IC 95 % (0,34; 0,62), P < 0,0000001
Figura 2: Curva de Kaplan-Meier para la supervivencia libre de progresión según una evaluación independiente para la población que no ha recibido tratamiento previo (VEG105192).
[1.8
G.6-
PazurjaniLi ir-J ¿5)
Hernán 11 l mentira
nacelKiN . 7£
Hed an 2.3 mónita
Hazard ftatlo - ü.40
P^0 KlQGÜm
C.O
Mnntha
Eje horizontal: Meses; Eje vertical: Porcentaje Libre de Progresión. Pazopanib (N = 155) Mediana de 11,1 meses; Placebo (N = 78) Mediana de 2,8 meses; Harzard ratio = 0,40; IC 95 % (0,27; 0,60), P < 0,0000001
Figura 3 Curva de Kaplan-Meier para la supervivencia libre de progresión según una evaluación independiente para la población pretratada con citoquinas (VEG105192).

Eje horizontal: Meses; Eje vertical: Porcentaje Libre de Progresión. Pazopanib (N = 135) Mediana de 7,4 meses; Placebo (N = 67) Mediana de 4,2 meses; Harzard ratio = 0,54; IC 95 % (0,35; 0,84), P < 0,001
Para los pacientes que respondieron al tratamiento, la mediana del tiempo hasta la respuesta fue de
11,9 semanas y la mediana de la duración de la respuesta fue de 58,7 semanas según la revisión independiente (VEG105192).
Los datos de la mediana de la supervivencia global (SG) especificados en el protocolo como análisis final de supervivencia fueron 22,9 meses y 20,5 meses [HR = 0,91 (IC 95 %: 0,71 - 1,16; p = 0,224)] para los pacientes aleatorizados en el brazo de pazopanib y placebo respectivamente. Los resultados de SG están sujetos a posibles sesgos ya que el 54 % de los pacientes en el brazo placebo recibieron pazopanib en la parte de extensión del estudio tras progresión de la enfermedad. El sesenta y seis por ciento de los pacientes en el brazo del placebo recibieron tratamiento al finalizar el estudio en comparación con el 30 % de los pacientes en el brazo de pazopanib.
No se observaron diferencias estadísticamente significativas entre los grupos de tratamiento para la Calidad de Vida Global utilizando EORTC QLQ-C30 y EuroQoL EQ-5D.
En un ensayo Fase 2 de 225 pacientes con carcinoma de células renales localmente recurrente o metastásico, la tasa de respuesta objetiva fue del 35 % y la mediana de la duración de la respuesta fue de 68 semanas, según la revisión independiente. La mediana de la SLP fue de 11,9 meses.
Se ha evaluado la seguridad, eficacia y calidad de vida de pazopanib frente a sunitinib en un estudio Fase III de no inferioridad, randomizado, abierto y con grupos paralelos (VEG108844).
En el estudio VEG108844, los pacientes (N=1.110) con CCR localmente avanzado y/o metastásico que no hubiesen recibido tratamiento sistémico previo, fueron randomizados para recibir 800 mg de pazopanib una vez al día de forma continuada ó 50 mg de sunitinib una vez al día en ciclos de 6 semanas consistentes en 4 semanas de tratamiento, seguidas de 2 semanas sin tratamiento.
El objetivo primario de este estudio fue evaluar y comparar la SLP en pacientes tratados con pazopanib frente aquellos tratados con sunitinib. Las características demográficas fueron similares entre los grupos de tratamiento. Las características de la enfermedad en el diagnóstico inicial y en las pruebas de control fueron similares entre los grupos de tratamiento, con una mayoría de pacientes con histología de células claras y enfermedad en estadío IV.
El estudio VEG108844 alcanzó la variable primaria de SLP y demostró la no inferioridad de pazopanib frente a sunitinib, siendo el límite superior del IC al 95 % para el Riesgo Relativo (Hazard Ratio) menor que el margen de no inferioridad de 1,25 especificado en el protocolo. Los resultados globales de eficacia se resumen en la Tabla 5.
Tabla 5: Resultados globales de eficacia (VEG108844)
|
Variables |
Pazopanib N = 557 |
Sunitinib N = 553 |
HR (95 % CI) |
|
SLP Resultados globales Mediana (meses) (IC 95 %) |
8,4 (8,3; 10,9) |
9,5 (8,3; 11,0) |
1,047 (0,898; 1,220) |
|
Supervivencia Global Mediana (meses) (IC 95 %) |
28,3 (26,0; 35,5) |
29,1 (25,4; 33,1) |
0,915a (0,786; 1,065) |
HR = Hazard Ratio; SLP = Supervivencia libre de progresión3 Valor de P = 0,245 (a los 2 lados)
Figura 4: Curva de Kaplan-Meier para la supervivencia libre de progresión realizada por una evaluación independiente para la población total (VEG108844)

Se realizó un análisis de subgrupos de la SLP incluyendo 20 factores pronósticos y demográficos. El 95 % de los intervalos de confianza para todos los subgrupos incluía un valor estimado de riesgo relativo de 1. De los 20 subgrupos, en los tres más pequeños, el valor estimado de riesgo relativo fue superior a 1,25, por ejemplo, en sujetos sin nefrectomía previa (n=186, HR=1,403 IC 95 % [0,955; 2,061]), LDH basal > 1,5 x LSN (n=68, HR=1,72 IC 95 % [0,943; 3,139], y MSKCC: riesgo bajo (n=119, HR=1,472 IC 95 % [0,937; 2,313].
La eficacia y seguridad de pazopanib en STB fue evaluada en un estudio pivotal de fase III, multicéntrico, randomizado, doble ciego, controlado con placebo (VEG110727). Un total de 369 pacientes con STB avanzado fueron randomizados para recibir 800 mg de pazopanib una vez al día o placebo.
De forma general, solamente se permitió participar en el estudio a aquellos pacientes con determinados subtipos histológicos de STB. Por lo tanto la eficacia y seguridad de pazopanib sólo se puede considerar establecida para esos subtipos de STB y el tratamiento con pazopanib se debe restringir a dichos subtipos de STB.
Los siguientes tipos de tumores fueron incluidos:
Fibroblástico (fibrosarcoma del adulto, mixofibrosarcoma, fibrosarcoma epitelioide esclerosante, tumores fibrosos solitarios malignos), los llamados fibrohistocíticos (histocitioma fibroso maligno pleomórfico [HFM], HFM de células gigantes, HFM inflamatorio), leiomiosarcoma, tumores glomus malignos, músculo esqueléticos (rabdomiosarcoma pleomórfico y alveolar), vascular (hemangioendotelioma epiteliode, angiosarcoma), de diferenciación incierta (sinovial, epitelioide, de parte blanda alveolar, de células claras, desmoplásico de células pequeñas redondas, rabdoide extrarrenal, de mesenquioma maligno, PEComa, sarcoma intimal), tumor maligno de la vaina del nervio periférico, sarcomas de tejidos blandos indiferenciados no especificado (NOS) y otros tipos de sarcoma (no figuran como no elegibles).
Los siguientes tipos de tumores fueron excluidos:
Sarcoma adipocítico (todos los subtipos), todos los rabdomiosarcomas que eran no alveolares o pleomórficos, condrosarcoma, osteosarcoma, tumores Ewing/tumores neuroectodérmicos primitivos (PNET), GIST, sarcoma dermatofibromatosis protuberans, sarcoma miofibroblástico inflamatorio, mesotelioma maligno y tumores mixtos del mesodermo del útero.
Hay que tener en cuenta que los pacientes con sarcoma adipocítico fueron excluidos del estudio pivotal de fase III, debido a que en el estudio preliminar de fase II (VEG20002) la actividad observada con pazopanib en sarcomas adipocíticos (SLP a la semana 12) no alcanzó la tasa de respuesta preestablecida que permitía la realización de posteriores análisis clínicos.
Los otros principales criterios de inclusión del estudio VEG110727 fueron: evidencias histológicas de STB maligno de grado alto o intermedio y enfermedad progresiva durante los 6 meses de tratamiento para la enfermedad metastásica, o recurrente durante 12 meses de tratamiento (neo)-/adyuvante.
El noventa y ocho por ciento (98 %) de los sujetos habían recibido doxorrubicina anteriormente, el 70 % ifosfamida y el 65 % de los sujetos habían recibido al menos tres o más fármacos quimioterápicos antes de incluirse en el estudio.
Los pacientes fueron estratificados por factores de la escala de evaluación del estado funcional de la OMS (WHO PS) (0 o 1) al inicio del estudio y por el número de líneas de tratamiento sistémico previo que recibieron para enfermedad avanzada (0 o 1 vs 2 o más). En cada grupo de tratamiento hubo un porcentaje ligeramente superior de sujetos que recibieron más de 2 líneas de tratamiento sistémico previo para enfermedad avanzada (58 % y 55 % para los brazos de placebo y pazopanib respectivamente) comparado con aquellos que recibieron 0 o 1 línea de tratamiento sistémico previo (42 % y 45 % para los brazos de placebo y pazopanib respectivamente). La mediana de la duración del seguimiento de sujetos (definida desde la fecha de randomización a la fecha de la última visita o la muerte) fue similar en ambos grupos de tratamiento (9,36 meses para placebo [rango de 0,69 a 23,0 meses] y 10,04 meses para pazopanib [rango de 0,2 a 24,3 meses]).
El objetivo primario del estudio clínico fue la supervivencia libre de progresión (SLP evaluada mediante una revisión radiológica independiente); entre las variables secundarias se incluyeron la supervivencia global (SG), la tasa respuesta global y la duración de la respuesta.
Tabla 6: Resultados de eficacia global en STB por una evaluación independiente (VEG110727)
|
Variables primarias /población del estudio |
Pazopanib |
Placebo |
HR (IC 95 %) |
Valor de P (dos lados) |
|
SLP ITT Global Mediana (semanas) |
N = 246 20,0 |
N = 123 7,0 |
0,35 (0,26; 0,48) |
< 0,001 |
|
Leiomiosarcoma Mediana (semanas) |
N = 109 20,1 |
N = 49 8,1 |
0,37 (0,23; 0,60) |
< 0,001 |
|
Sarcoma sinovial subgrupos Mediana (semanas) |
N = 25 17,9 |
N = 13 4,1 |
0,43 (0,19; 0,98) |
0,005 |
|
“Otros subgrupos de STB” Mediana (semanas) |
N = 112 20,1 |
N = 61 4,3 |
0,39 (0,25; 0,60) |
< 0,001 |
|
SG | ||||
|
ITT Global Mediana (meses) |
N = 246 12,6 |
N = 123 10,7 |
0,87 (0,67; 1,12) |
0,256 |
|
Leiomiosarcoma* Mediana (meses) |
N = 109 16,7 |
N = 49 14,1 |
0,84 (0,56; 1,26 |
0,363 |
|
SG | ||||
|
Sarcoma sinovial subgrupos* Mediana (meses) |
N = 25 8,7 |
N = 13 21,6 |
1,62 (0,79; 3,33) |
0,115 |
|
‘Otros subgrupos de STC’* Mediana (meses) |
N = 112 10,3 |
N = 61 9,5 |
0,84 (0,59; 1,21) |
0,325 |
|
Tasas de respuesta (RC+RP) % (IC 95 %) |
4 (2,3; 7,9) |
0 (0,0; 3,0) | ||
|
Duración de la respuesta Mediana (semanas) (IC 95 %) |
38,9 (16,7; 40,0) |
HR = Hazard ratio; ITT = Población por intención de tratar; SLP = Supervivencia libre de progresión; RC = Respuesta completa; RP = Respuesta parcial. SG = Supervivencia global
* La supervivencia global para los respectivos subgrupos histológicos de STB (leiomiosarcoma, sarcoma sinovial y “otros” STB) debe ser interpretada con precaución debido al reducido número de sujetos y los amplios intervalos de confianza.
Según las evaluaciones del investigador, se observó una mejora similar en la SLP en el brazo de pazopanib comparado con placebo (HR en el conjunto de la población por intención de tratar: 0,39; IC 95 % de 0,30 a 0,52; p < 0,001).
Figura 5: Curva de Kaplan-Meier para la supervivencia libre de progresión en STB según una evaluación independiente para la población global total (VEG110727)

El análisis final de SG se realizó después de que se produjeran el 76 % (280/369) de los acontecimientos (HR 0,87, IC 95 % 0,67; 1,12 p = 0,256) y no se observaron diferencias significativas en la SG entre los dos grupos de tratamiento.
Población pediátrica
La Agencia Europea del Medicamento ha eximido de la obligación de presentar los resultados de los estudios con Votrient en todos los subgrupos de población pediátrica en el tratamiento del carcinoma de riñón y de pelvis renal (excluyendo nefroblastoma, nefroblastomatosis, sarcoma de células claras, nefroma mesoblastico, carcinoma medular renal y tumor rabdoide del riñon).
La Agencia Europea del Medicamento ha aplazado la obligación de presentar los resultados de los estudios con Votrient en uno o más subgrupos de población pediátrica en el tratamiento de rabdomiosarcoma, sarcoma de tejidos blandos de tipo no-rabdomiosarcoma y la familia de tumores de tipo sarcoma de Ewing. Ver la sección 4.2 para mayor información acerca del uso pediátrico.
5.2 Propiedades farmacocinéticas
Absorción
Tras la administración oral de una dosis única de 800 mg de pazopanib a pacientes con tumores sólidos, se obtuvo la concentración plasmática máxima (Cmax) de aproximadamente 19 ± 13 pg/ml tras una mediana de 3,5 horas (intervalo 1,0-11,9 horas) y se obtuvo un AUC0_W de aproximadamente 650 ± 500 pg.h/ml. La dosis diaria produjo un aumento de entre 1,23 a 4 veces el AUC0-T. No hubo un aumento constante en el AUC o en la Cmax a dosis de pazopanib mayores de 800 mg.
La exposición sistémica a pazopanib se ve aumentada cuando se administra con alimentos.
La administración de pazopanib con alimentos con alto o bajo contenido en grasas produjo un incremento en el AUC y la Cmax de aproximadamente dos veces. Por lo tanto, se debe administrar pazopanib como mínimo dos horas después de las comidas o una hora antes de las comidas (ver sección 4.2).
La administración de un comprimido machacado de 400 mg de pazopanib aumentó el AUC(0-72) en un 46 % y la Cmax aproximadamente 2 veces y disminuyó la tmax aproximadamente 2 horas en comparación con la administración de un comprimido entero. Estos resultados indican que la biodisponibilidad y la velocidad de absorción oral de pazopanib aumentan tras la administración de comprimidos machacados en relación con la administración de comprimidos enteros (ver sección 4.2).
Distribución
La unión de pazopanib a proteínas plasmáticas humanas in vivo fue mayor del 99 %, independientemente de la concentración, en el intervalo de 10-100 pg/ml. Los estudios in vitro sugieren que pazopanib es sustrato de P-gp y BCRP.
Biotransformación
Los resultados de estudios in vivo demostraron que el metabolismo de pazopanib está mediado principalmente por CYP3A4, con menor contribución de CYP1A2 y CYP2C8. Los cuatro metabolitos principales de pazopanib representaban sólo el 6% de la exposición en plasma. Uno de estos metabolitos inhibe la proliferación de células endoteliales de vena umbilical humana estimulada por VEGF, con una potencia similar a la de pazopanib. El resto de los metabolitos son de 10 a 20 veces menos activos. Por tanto, la actividad de pazopanib depende principalmente de la exposición a la molécula original.
Eliminación
Pazopanib se elimina lentamente, con una semivida media de 30,9 horas tras la administración de la dosis recomendada de 800 mg. La eliminación se produce principalmente a través de las heces; la eliminación renal representa < 4 % de la dosis administrada.
Poblaciones especiales
Insuficiencia renal: los resultados indican que menos del 4 % de la dosis de pazopanib administrada oralmente se excreta en la orina como pazopanib y metabolitos. Los resultados de un modelo farmacocinético poblacional (datos de individuos con valores del aclaramiento de creatinina entre 30,8 ml/min y 150 ml/min) indicaron que es improbable que la insuficiencia renal tenga un efecto clínicamente relevante en la farmacocinética de pazopanib. No se requieren ajustes de la dosis en pacientes con aclaramiento de creatinina superior a 30 ml/min. Se recomienda tener precaución en los pacientes con aclaramiento de creatinina inferior a 30 ml/min debido a que no hay experiencia del uso de pazopanib en esta población de pacientes (ver sección 4.2).
Insuficiencia hepática:
Leve:
La mediana de la Cmax y el AUC(0.24 h) de pazopanib en estado estacionario en los pacientes con alteraciones leves de los parámetros hepáticos (definidas como valores normales de bilirrubina y cualquier grado de elevación de ALT o elevación de los valores de bilirrubina de hasta 1,5 veces el LSN independientemente de los valores de ALT) después de la administración de 800 mg una vez al día es similar a la mediana en los pacientes con función hepática normal (ver Tabla 7). En pacientes con alteraciones leves de las pruebas hepáticas en suero, la dosis recomendada es de 800 mg de pazopanib una vez al día (ver sección 4.2).
Moderada:
En pacientes con insuficiencia hepática moderada (definida como una elevación de bilirrubina > 1,5 a 3 veces el LSN independientemente de los niveles de ALT) la dosis máxima tolerada (DMT) fue de 200 mg de pazopanib una vez al día. Los valores de la mediana de Cmax y AUC(0-24) en estado estacionario tras la administración de 200 mg de pazopanib una vez al día en pacientes con insuficiencia hepática moderada, fueron aproximadamente el 44 % y el 39 % respectivamente de los valores de las medianas correspondientes tras la administración de 800 mg una vez al día en pacientes con función hepática normal (ver Tabla 7).
En base a los datos de seguridad y tolerabilidad, la dosis de pazopanib se debe reducir a 200 mg una vez al día en individuos con insuficiencia hepática moderada (ver sección 4.2).
Grave:
Los valores de la mediana de Cmax y AUC(0-24) en estado estacionario tras la administración de 200 mg de pazopanib una vez al día en pacientes con insuficiencia hepática grave, fueron aproximadamente el 18 % y el 15 % respectivamente de los valores de las medianas tras la administración de 800 mg una vez al día en pacientes con función hepática normal. En base a la disminución de la exposición y la reserva hepática limitada, pazopanib no está recomendado en pacientes con insuficiencia hepática grave (definida como bilirrubina total > 3 x LSN independientemente de los niveles de ALT) (ver sección 4.2).
Tabla 7: Medianas farmacocinéticas de pazopanib calculadas en estado estacionario, en sujetos con insuficiencia hepática.
|
Grupo |
Dosis investigada |
Cmax (^g/ml) |
AUC (0-24) (pg x hr/ml) |
Dosis recomendada |
|
Función hepática normal |
800 mg una vez al día |
52,0 (17,1-85,7) |
888,2 (345,5-1482) |
800 mg una vez al día |
|
Insuficiencia hepática leve |
800 mg una vez al día |
33,5 (11,3-104,2) |
774,2 (214,7-2034,4) |
800 mg una vez al día |
|
Insuficiencia hepática moderada |
200 mg una vez al día |
22,2 (4,2-32,9) |
256,8 (65,7-487,7) |
200 mg una vez al día |
|
Insuficiencia hepática grave |
200 mg una vez al día |
9,4 (2,4-24,3) |
130,6 (46,9-473,2) |
No está recomendado |
5.3 Datos preclínicos sobre seguridad
El perfil de seguridad preclínica de pazopanib fue evaluado en ratones, ratas, conejos y monos. En los estudios a dosis repetidas en roedores, los efectos en una variedad de tejidos (hueso, dientes, lecho de la uña, órganos reproductivos, tejidos hematológicos, riñón y páncreas) parecen estar relacionados con la farmacología de la inhibición de VEGFR y/o la interrupción de las vías de señalización de VEGF y con la mayoría de los efectos que ocurren a niveles de exposición plasmática inferiores a los observados en la clínica. Otros efectos observados incluyeron pérdida de peso corporal, diarrea y/o morbilidad que fueron, o bien secundarios a los efectos gastrointestinales locales causados por la elevada exposición del medicamento en la mucosa local (monos) o bien, efectos farmacológicos (roedores). Se observaron lesiones hepáticas proliferativas (focos de eosinófilos y adenoma) en hembras de ratón a exposiciones 2,5 veces la exposición en humanos basada en el AUC.
En estudios de toxicidad juvenil, cuando se administraron dosis de pazopanib a ratas antes de ser destetadas, desde el día 9 hasta el día 14 después del parto, pazopanib originó muertes y desarrollo/maduración anormal en el riñón, pulmón, hígado y corazón a dosis de aproximadamente 0,1 veces la exposición clínica según el AUC en humanos adultos. Cuando se administraron dosis de pazopanib a ratas después de ser destetadas desde el día 21 hasta el día 62 después del parto, los hallazgos toxicológicos fueron semejantes a los vistos en ratas adultas a exposiciones comparables.
Los pacientes humanos pediátricos presentan mayor riesgo de padecer efectos en los huesos y los dientes al compararlos con pacientes adultos, dado que estos cambios, entre los que se incluyen inhibición del crecimiento (extremidades acortadas), fragilidad en los huesos y remodelación de los dientes, se presentaron en ratas juveniles a dosis > 10 mg/Kg/día (aproximadamente igual a 0,1-0,2 veces la exposición clínica según el AUC en humanos adultos) (ver sección 4.4).
Efectos reproductivos, en la_ fertilidad y teratogénicos
Pazopanib ha mostrado ser embriotóxico y teratogénico cuando se administró en ratas y conejos a exposiciones más de 300 veces inferiores a la exposición en humanos (basada en el AUC). Los efectos incluyeron fertilidad femenina reducida, pérdida pre y post-implantación aumentada, resorciones tempranas, mortalidad embrional, disminución del peso corporal fetal y malformación cardiovascular. En roedores también se observó disminución del cuerpo lúteo, aumento de quistes y atrofia de ovarios. En un estudio de fertilidad en ratas macho no hubo efecto sobre el apareamiento o la fertilidad, pero se observaron disminuciones en el peso del testículo y del epidídimo, con reducciones en las tasas de producción de esperma, movilidad del esperma y concentraciones de esperma testicular, observados a exposiciones 0,3 veces la exposición en humanos en base al AUC.
Genotoxicidad
Pazopanib no causó daño genético cuando se analizó en pruebas de genotoxicidad (test de Ames, test de aberración cromosómica de linfocitos periféricos humanos y micronúcleos de ratas in vivo). Un intermedio sintético utilizado en la fabricación de pazopanib, que también está presente en pequeñas cantidades en el principio activo final, no fue mutagénico en el Test de Ames pero fue genotóxico en el test de linfoma en ratón y en el test de micronúcleos de ratón in vivo.
Carcinogenicidad
En estudios de carcinogenicidad de dos años con pazopanib, se observaron aumentos en el número de adenomas en el hígado detectados en ratones y de adenocarcinomas duodenales detectados en ratas. En base a la patogénesis específica de roedores y el mecanismo ligado a estos hallazgos, no se considera que representen un aumento del riesgo carcinogénico para los pacientes tratados con pazopanib.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Núcleo del comprimido
Estearato de magnesio Celulosa microcristalina Povidona (K30)
Glicolato sódico de almidón (tipo A)
Cubierta _ pelicular
Hipromelosa Macrogol 400 Polisorbato 80 Dióxido de titanio (E171)
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
2 años.
6.4 Precauciones especiales de conservación
No requiere condiciones especiales de conservación.
6.5 Naturaleza y contenido del envase
Frascos de PEAD con un tapón de polipropileno resistente a los niños que contiene 30 ó 60 comprimidos.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación
Ninguna especial.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Novartis Europharm Limited Frimley Business Park Camberley GU16 7SR Reino Unido
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/10/628/003
EU/1/10/628/004
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 14 de junio de 2010
Fecha de la última renovación de la autorización: 18 de junio de 2013
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu/.
A. FABRICANTES RESPONSABLES DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
A. FABRICANTES RESPONSABLES DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección de los fabricantes responsables de la liberación de los lotes
Glaxo Operations UK Ltd (trading as Glaxo Wellcome Operations)
Priory Street Ware
Hertfordshire SG12 0DJ Reino Unido
Glaxo Wellcome, S.A.
Avda. Extremadura, 3
09400 Aranda De Duero, Burgos
España
Novartis Pharmaceuticals UK Limited
Frimley Business Park
Frimley
Camberley, Surrey GU16 7SR Reino Unido
Novartis Pharma GmbH RoonstraBe 25 D-90429 Nuremberg Alemania
El prospecto impreso del medicamento debe especificar el nombre y dirección del fabricante responsable de la liberación del lote en cuestión.
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica restringida (ver Anexo I: Ficha Técnica o Resumen de las Características del Producto, sección 4.2).
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
El Titular de la Autorización de Comercialización (TAC) presentará los informes periódicos de seguridad para este medicamento de conformidad con las exigencias establecidas en la lista de fechas de referencia de la Unión (lista EURD) prevista en el artículo 107ter, párrafo 7, de la Directiva 2001/83/CE y publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado en la versión del PGR incluido en el Módulo 1.8.2 de la Autorización de Comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos.
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
Si coincide la presentación de un IPS con la actualización del PGR, ambos documentos se pueden presentar conjuntamente.
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
1. NOMBRE DEL MEDICAMENTO
Votrient 200 mg comprimidos recubiertos con película pazopanib
2. PRINCIPIO(S) ACTIVO(S)
Cada comprimido recubierto con película contiene 200 mg de pazopanib (como hidrocloruro).
3. LISTA DE EXCIPIENTES
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
30 comprimidos recubiertos con película 90 comprimidos recubiertos con película
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Vía oral.
Leer el prospecto antes de utilizar este medicamento.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Novartis Europharm Limited Frimley Business Park Camberley GU16 7SR Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/10/628/001
EU/1/10/628/002
13. NÚMERO(S) DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
votrient 200 mg
1. NOMBRE DEL MEDICAMENTO
Votrient 200 mg comprimidos recubiertos con película pazopanib
2. PRINCIPIO(S) ACTIVO(S)
Cada comprimido recubierto con película contiene 200 mg de pazopanib (como hidrocloruro).
3. LISTA DE EXCIPIENTES
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
30 comprimidos recubiertos con película 90 comprimidos recubiertos con película
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Vía oral.
Leer el prospecto antes de utilizar este medicamento.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Novartis Europharm Limited Frimley Business Park Camberley GU16 7SR Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/10/628/001
EU/1/10/628/002
13. NÚMERO(S) DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
1. NOMBRE DEL MEDICAMENTO
Votrient 400 mg comprimidos recubiertos con película pazopanib
2. PRINCIPIO(S) ACTIVO(S)
Cada comprimido recubierto con película contiene 400 mg de pazopanib (como hidrocloruro).
3. LISTA DE EXCIPIENTES
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
30 comprimidos recubiertos con película 60 comprimidos recubiertos con película
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Vía oral.
Leer el prospecto antes de utilizar este medicamento.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Novartis Europharm Limited Frimley Business Park Camberley GU16 7SR Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/10/628/003
EU/1/10/628/004
13. NÚMERO(S) DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
votrient 400 mg
1. NOMBRE DEL MEDICAMENTO
Votrient 400 mg comprimidos recubiertos con película pazopanib
2. PRINCIPIO(S) ACTIVO(S)
Cada comprimido recubierto con película contiene 400 mg de pazopanib (como hidrocloruro).
3. LISTA DE EXCIPIENTES
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
30 comprimidos recubiertos con película 60 comprimidos recubiertos con película
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Vía oral.
Leer el prospecto antes de utilizar este medicamento.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Novartis Europharm Limited Frimley Business Park Camberley GU16 7SR Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/10/628/003
EU/1/10/628/004
13. NÚMERO(S) DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
B. PROSPECTO
Prospecto: Información para el usuario
Votrient 200 mg comprimidos recubiertos con película Votrient 400 mg comprimidos recubiertos con película
Pazopanib
Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es Votrient y para qué se utiliza
2. Qué necesita saber antes de empezar a tomar Votrient
3. Cómo tomar Votrient
4. Posibles efectos adversos
5. Conservación de Votrient
6. Contenido del envase e información adicional
1. Qué es Votrient y para qué se utiliza
Votrient es un tipo de medicamento denominado inhibidor de la proteína kinasa. Funciona impidiendo
la actividad de las proteínas que están implicadas en el crecimiento y la propagación de células
cancerígenas.
Votrient se utiliza en adultos para el tratamiento de:
- cáncer de riñón avanzado o expandido a otros órganos
- algunos tipos de sarcoma de tejidos blandos, que es un tipo de cáncer que afecta al tejido conjuntivo del organismo. Puede aparecer en músculos, vasos sanguíneos, tejido adiposo o en otros tejidos que conectan, rodean y protegen los órganos.
2. Qué necesita saber antes de empezar a tomar Votrient
No tome Votrient
- si es alérgico a pazopanib o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
- Consulte con su médico si cree que esto puede sucederle. No tome Votrient.
Advertencias y precauciones
Antes de tomar Votrient, su médico necesita saber:
- si tiene una enfermedad del corazón
- si tiene una enfermedad del hígado
- si ha tenido un fallo cardiaco o un ataque al corazón
- si ha tenido un colapso pulmonar previo
- si ha tenido problemas de sangrado, coagulación sanguínea o estrechamiento de las arterias
- si ha tenido problemas de estómago o de intestino como perforación (agujero) o fístula (pasajes anormales que se forman entre algunas partes del intestino).
- Consulte con su médico si cree que puede tener cualquiera de estos problemas. Su médico decidirá si Votrient es adecuado para usted. Puede que necesite pruebas adicionales para comprobar que su corazón y su hígado están funcionando adecuadamente.
Presión arterial elevada y Votrient
Votrient puede elevar su presión arterial. Su médico comprobará su presión arterial antes de tomar Votrient y mientras lo esté tomando. Si tiene la presión arterial elevada recibirá tratamiento con medicamentos que ayuden a reducirla.
- Informe a su médico si tiene la presión arterial elevada.
Si va a ser sometido a una operación
Su médico le dirá que deje de tomar Votrient al menos 7 días antes de su operación ya que esto puede afectar a la cicatrización de las heridas. Su tratamiento se reanudará cuando las heridas hayan cicatrizado adecuadamente.
Afecciones que pueden requerir su atención
Votrient puede hacer que otras afecciones empeoren o causar efectos adversos graves, como enfermedades cardiacas, sangrado y problemas de tiroides. Debe estar atento a ciertos síntomas mientras esté tomando Votrient, para reducir el riesgo de cualquier problema. Vea “Afecciones que requieren su atención ” en la Sección 4.
Niños y adolescentes
Votrient no está recomendado en personas menores de 18 años. Todavía no se conoce cómo funciona en este grupo de edad. Además, no se debe utilizar en niños menores de 2 años de edad debido a problemas de seguridad.
Otros medicamentos y Votrient
Informe a su médico o farmacéutico si está tomando, ha tomado recientemente o podría tener que tomar cualquier otro medicamento. Entre estos se incluyen las plantas medicinales y los medicamentos adquiridos sin receta.
Algunos medicamentos pueden afectar al funcionamiento de Votrient o aumentar la probabilidad de que sufra efectos adversos. Votrient también puede afectar al funcionamiento de otros medicamentos. Entre estos se incluyen:
- claritromicina, ketoconazol, itraconazol, rifampicina, telitromicina, voriconazol (utilizados para tratar infecciones)
- atazanavir, indinavir, nelfinavir, ritonavir, saquinavir (utilizados para tratar el VIH)
- nefazodona (utilizado para tratar la depresión)
- simvastatina y posiblemente otras estatinas (utilizadas para el tratamiento de los niveles altos de colesterol)
- medicamentos que reducen la ácidez del estómago. El tipo de medicamento que esté tomando para reducir la acidez de estómago (por ejemplo, un inhibidor de la bomba de protones, antagonistas de los receptores H2 o antiácidos) puede afectar a cómo ha de tomar Votrient.
Consulte con su médico o con su enfermero para obtener más información.
- Informe a su médico o farmacéutico si está tomando alguno de estos medicamentos.
Toma de Votrient con alimentos y bebidas
No tome Votrient con alimentos, ya que estos afectan a la absorción del medicamento. Tómelo al menos dos horas después de la comida o una hora antes de la comida.
No beba zumo de pomelo mientras esté en tratamiento con Votrient, ya que esto puede aumentar la probabilidad de aparición de efectos adversos.
Embarazo, lactancia y fertilidad
Votrient no está recomendado si está embarazada. No se conoce el efecto de Votrient durante el embarazo.
- Informe a su médico si está embarazada o está planeando quedarse embarazada.
- Utilice un método anticonceptivo fiable mientras esté tomando Votrient, y al menos durante 2 semanas después, para prevenir el embarazo.
- Si se queda embarazada durante el tratamiento con Votrient, informe a su médico.
No dé el pecho mientras esté tomando Votrient. No se conoce si los componentes de Votrient pasan a la leche materna. Informe a su médico de esto.
La fertilidad se puede ver afectada por el tratamiento con Votrient. Consulte con su médico sobre esto.
Conducción y uso de máquinas
Votrient puede producir efectos adversos que pueden afectar su capacidad para conducir o utilizar máquinas.
- Evite conducir o utilizar máquinas si se siente mareado, cansado o débil, o si está bajo de energía.
Siga exactamente las instrucciones de administración de Votrient indicadas por su médico.
Consulte a su médico o farmacéutico si tiene dudas.
Cuánto tomar
La dosis normal es de dos comprimidos de Votrient 400 mg comprimidos (800 mg de pazopanib) tomados una vez al día. Esta es la dosis máxima por día. Puede que su médico necesite reducirle la dosis si sufre efectos adversos.
Cuándo tomarlo
No tome Votrient con alimentos. Tómelo al menos dos horas después de la comida o una hora antes de la comida. Por ejemplo, puede tomarlo dos horas después del desayuno o una hora antes de la comida. Tome Votrient a la misma hora del día.
Trague los comprimidos enteros con agua, y uno detrás de otro. No rompa o machaque los comprimidos ya que esto afecta a la manera en la que el medicamento se absorbe y puede aumentar la posibilidad de producir efectos adversos.
Si toma más Votrient del que debe
Si toma más comprimidos de lo que debiera, pida consejo a su médico o farmacéutico. Si es posible muéstreles el envase o este prospecto.
Si olvida tomar Votrient
No tome una dosis doble para compensar las dosis olvidadas. Sólo tome su siguiente dosis a la hora habitual.
No interrumpa el tratamiento con Votrient
Tome Votrient durante el tiempo que le haya recomendado su médico. No interrumpa el tratamiento a menos que su médico se lo aconseje.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Afecciones que requieren su atención
Inflamación del cerebro (un trastorno en el cerebro conocido como síndrome de leucoencefalopatía posterior reversible). En raras ocasiones, Votrient puede provocar inflamación del cerebro, que puede poner en riesgo su vida. Entre los síntomas se incluyen:
- pérdida del habla
- cambios en la vista
- convulsiones (ataques epilépticos)
- confusión
- Deje de tomar Votrient y busque atención médica inmediatamente si presenta cualquiera de estos síntomas o si tiene dolor de cabeza acompañado de alguno de estos síntomas.
Enfermedades de corazón
Votrient puede afectar al ritmo cardiaco (prolongación del intervalo QT) que en algunas personas puede desencadenar una enfermedad del corazón potencialmente grave, conocida como Torsade de Pointes. Esto puede provocar una aceleración del ritmo cardiaco que puede dar lugar a una pérdida del conocimiento. El riesgo de estos problemas puede ser mayor en personas que ya tengan problemas de corazón, o que estén tomando otros medicamentos. Le controlarán cualquier problema de corazón mientras esté tomando Votrient.
- Informe a su médico si nota cualquier cambio inusual en el latido del corazón, como latidos demasiado rápidos o demasiado lentos.
Inflamación del pulmón
Votrient puede causar, en raras cocasiones, inflamación del pulmón (neumonitis), que en algunas personas puede llegar a ser mortal. Los síntomas incluyen dificultad al respirar o tos. Le controlarán cualquier problema de pulmón mientras esté tomando Votrient.
- Informe a su médico tan pronto como le sea posible si sufre alguno de estos síntomas. Sangrado
Votrient puede causar hemorragias graves en el aparato digestivo (en el estómago, garganta, recto o intestino), o en los pulmones, riñones, boca, vagina y cerebro, aunque esto es poco frecuente. Entre los síntomas se incluyen:
- sangre en las heces o heces negras
- sangre en la orina
- dolor de estómago
- tos/vomitar sangre
- Informe a su médico tan pronto como le sea posible si sufre alguno de estos síntomas. Problemas de tiroides
Votrient puede disminuir la cantidad de hormona tiroidea producida en su cuerpo. Se le controlará esto mientras esté tomando Votrient.
Visión borrosa o alteración de la visión
Votrient puede causar la separación o el desgarro de la parte posterior del ojo (desprendimiento de retina o desgarro). Esto puede provocar visión borrosa o alteraciones en la visión.
- Informe a su médico si nota cualquier cambio en la visión
Efectos adversos muy frecuentes
Pueden afectar a más de 1 de cada 10 personas:
- presión arterial elevada
- diarrea
- sentirse o estar mareado (náuseas o vómitos)
- dolor de estómago
- pérdida de apetito
- pérdida de peso
- alteraciones del gusto o pérdida del gusto
- irritación en la boca
- dolor de cabeza
- dolor tumoral
- falta de energía, sensación de debilidad o cansancio
- cambios en el color del pelo
- pérdida inusual del cabello o fragilidad
- pérdida de pigmentación de la piel
- erupción cutánea donde la piel puede descamarse
- enrojecimiento e inflamación en las palmas de las manos y en las plantas de los pies.
- Informe a su médico o farmacéutico si alguno de estos efectos adversos se vuelve problemático.
Efectos adversos muy frecuentes que pueden aparecer en sus análisis de sangre u orina:
- aumento de las enzimas hepáticas
- descenso de la albúmina en sangre
- proteínas en la orina
- decenso del número de plaquetas (células sanguíneas que intervienen en la coagulación de la sangre)
- descenso del número de glóbulos blancos.
Efectos adversos frecuentes
Pueden afectar hasta 1 de cada 10 personas:
- indigestión, sentirse hinchado, flatulencia
- sangrado de nariz
- boca seca o úlceras bucales
- infecciones
- adormecimiento anormal
- dificultad para dormir
- dolor en el pecho, dificultad para respirar, dolor en las piernas, inflamación de las piernas/pies. Estos pueden ser signos de coagulación sanguínea en el organismo (tromboembolismo). Si el coágulo se libera, puede viajar hacia los pulmones y puede llegar a ser una amenaza para la salud o incluso provocar la muerte.
- menor eficacia del corazón para bombear la sangre al resto del cuerpo (disfunción cardiaca)
- latidos lentos del corazón
- sangrado por la boca, recto o pulmones
- mareo
- visión borrosa
- sofocos
- hinchazón causada por retención de líquidos en la cara, manos, tobillos, pies o párpados
- hormigueo, debilidad o adormecimiento de las manos, brazos, piernas o pies
- trastornos en la piel, enrojecimiento, picor, piel seca
- trastornos en las uñas
- quemazón, picor, picazón o sensación de hormigueo en la piel
- sensación de frialdad, con escalofríos
- sudoración excesiva
- deshidratación
- dolor de músculos, articulaciones, tendones o dolor en el pecho, espasmos musculares
- ronquera
- dificultad para respirar
- tos
- tos con sangre
- hipo
- los pulmones se colapsan y el aire se queda atrapado en el espacio que existe entre los pulmones y el pecho, causando a menudo dificultad para respirar (neumotórax).
- Informe a su médico o farmacéutico si alguno de estos efectos adversos se vuelve problemático.
Efectos adversos frecuentes que pueden aparecer en sus análisis de sangre u orina:
- baja actividad de la glándula tiroides
- alteración de la función hepática
- aumento de la bilirrubina (sustancia producida por el hígado)
- aumento de las lipasas (enzima implicada en la digestión)
- aumento de la creatinina (sustancia producida en los músculos)
- cambios en los niveles de otras sustancias químicas/enzimas de la sangre. Su médico le informará de los resultados de los análisis de sangre.
Efectos adversos poco frecuentes
Pueden afectar hasta 1 de cada 100 personas:
- ictus
- disminución temporal del suministro de sangre al cerebro (mini-ictus)
- interrupción del suministro de sangre a una parte del corazón o ataque al corazón (infarto de miocardio)
- trombos acompañados por un descenso de glóbulos rojos y otras células involucradas en la coagulación sanguínea. Estos pueden causar daños en órganos como el cerebro y los riñones.
- dificultad repentina para respirar, especialmente cuando se acompaña de dolor agudo de pecho y/o respiración rápida (embolismo pulmonar)
- sangrado grave en el aparato digestivo (en el estómago, garganta o intestino), o en los riñones, la vagina y el cerebro
- alteraciones del ritmo cardiaco (prolongación del intervalo QT)
- agujero (perforación) en el estómago o intestino
- conductos anormales que se forman entre partes del intestino (fístula)
- períodos menstruales pesados o irregulares
- aumentos bruscos de la presión arterial
- inflamación del páncreas (pancreatitis)
- hígado inflamado, que no funciona bien o dañado
- coloración amarillenta de la piel o del blanco de los ojos (ictericia)
- inflamación del revestimiento de la cavidad abdominal (peritonitis)
- moqueo
- erupciones que pueden picar o inflamarse (manchas planas o abultadas, o ampollas)
- movimientos intestinales frecuentes
- aumento de la sensibilidad de la piel a la luz del sol
- menor sensibilidad, especialmente en la piel
Efectos adversos raros
Pueden afectar hasta 1 de cada 1.000 personas:
- inflamación del pulmón (neumonitis).
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Anexo V*. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice Votrient después de la fecha de caducidad que aparece en el frasco y en el estuche después de CAD. La fecha de caducidad es el último día del mes que se indica.
Este medicamento no requiere ninguna condición especial de conservación.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que no necesita. De esta forma ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de Votrient
El principio activo es pazopanib (como hidrocloruro). Votrient comprimidos viene en diferentes dosis. Votrient 200 mg: cada comprimido contiene 200 mg de pazopanib.
Votrient 400 mg: cada comprimido contiene 400 mg de pazopanib.
Los demás componentes en los comprimidos de 200 y 400 mg son: hipromelosa, macrogol 400, estearato de magnesio, celulosa microcristalina, polisorbato 80, povidona (K30), glicolato sódico de almidón (tipo A), dióxido de titanio (E171). Los comprimidos de 200 mg contienen además óxido de hierro rojo (E172).
Aspecto del producto y contenido del envase
Votrient 200 mg comprimidos recubiertos con película son comprimidos con forma de cápsula, de color rosa, marcados con GS JT en una cara. Se suministran en frascos de 30 ó 90 comprimidos.
Votrient 400 mg comprimidos recubiertos con película son comprimidos con forma de cápsula, de color blanco, marcados con GS UHL en una cara. Se suministran en frascos de 30 ó 60 comprimidos.
Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización
Novartis Europharm Limited Frimley Business Park Camberley GU16 7SR Reino Unido
Responsable de la fabricación
Glaxo Operations UK Ltd (trading as Glaxo Wellcome Operations), Priory Street, Ware, Hertfordshire, SG12 0DJ, Reino Unido.
Glaxo Wellcome, S.A., Avda. Extremadura, 3, 09400 Aranda de Duero, Burgos, España.
Novartis Pharmaceuticals UK Limited, Frimley Business Park, Frimley, Camberley, Surrey GU16 7SR, Reino Unido
Novartis Pharma GmbH, RoonstraBe 25, D-90429 Nuremberg, Alemania
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
|
Belgie/Belgique/Belgien Novartis Pharma N.V. Tél/Tel: +32 2 246 16 11 |
Lietuva Novartis Pharma Services Inc. Tel: +370 5 269 16 50 |
|
Bt^rapnn Novartis Pharma Services Inc. Ten: +359 2 489 98 28 |
Luxembourg/Luxemburg Novartis Pharma N.V. Tél/Tel: +32 2 246 16 11 |
|
Ceská republika Novartis s.r.o. Tel: +420 225 775 111 |
Magyarország Novartis Hungária Kft. Pharma Tel.: +36 1 457 65 00 |
|
Danmark Novartis Healthcare A/S Tlf: +45 39 16 84 00 |
Malta Novartis Pharma Services Inc. Tel: +356 2122 2872 |
|
Deutschland Novartis Pharma GmbH Tel: +49 911 273 0 |
Nederland Novartis Pharma B.V. Tel: +31 26 37 82 555 |
|
Eesti Novartis Pharma Services Inc. Tel: +372 66 30 810 |
Norge Novartis Norge AS Tlf: +47 23 05 20 00 |
|
EXXáda Novartis (Hellas) A.E.B.E. Tpk: +30 210 281 17 12 |
Osterreich Novartis Pharma GmbH Tel: +43 1 86 6570 |
|
España Novartis Farmacéutica, S.A. Tel: +34 93 306 42 00 |
Polska Novartis Poland Sp. z o.o. Tel.: +48 22 375 4888 |
|
France Novartis Pharma S.A.S. Tél: +33 1 55 47 66 00 |
Portugal Novartis Farma - Produtos Farmacéuticos, S.A Tel: +351 21 000 8600 |
|
Hrvatska Novartis Hrvatska d.o.o. Tel. +385 1 6274 220 |
Romania Novartis Pharma Services Romania SRL Tel: +40 21 31299 01 |
|
Ireland Novartis Ireland Limited Tel: +353 1 260 12 55 |
Slovenija Novartis Pharma Services Inc. Tel: +386 1 300 75 50 |
|
Ísland Vistor hf. Sími: +354 535 7000 |
Slovenská republika Novartis Slovakia s.r.o. Tel: +421 2 5542 5439 |
|
Italia Novartis Farma S.p.A. Tel: +39 02 96 54 1 |
Suomi/Finland Novartis Finland Oy Puh/Tel: +358 (0)10 6133 200 |
|
Kúnpoq Novartis Pharma Services Inc. TpL +357 22 690 690 |
Sverige Novartis Sverige AB Tel: +46 8 732 32 00 |
|
Latvija Novartis Pharma Services Inc. Tel: +371 67 887 070 |
United Kingdom Novartis Pharmaceuticals UK Ltd. Tel: +44 1276 698370 |
|
Fecha de la última revisión de este prospecto: |
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu/.
99