Voltadol Forte 23,2 Mg/G Gel
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
Voltadol Forte 23,2 mg/g gel.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada gramo de Voltadol Forte contiene:
23,2 mg de diclofenaco dietilamina, (que corresponden a 20 mg de diclofenaco sódico).
Excipientes:
Propilenglicol.......................50 mg
Butilhidroxitolueno.................0,2 mg
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA Gel
El gel es, homogéneo, blanco o prácticamente blanco, y de apariencia cremosa.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Voltadol Forte está indicado en adultos y adolescentes mayores de 14 años. Alivio local del dolor y de la inflamación leves y ocasionales.
4.2 Posología y forma de administración
USO CUTÁNEO
Adultos y adolescentes mayores de 14 años:
Aplicar el gel sobre el área afectada 2 veces al día, cada 12 horas, (preferiblemente mañana y noche), con un suave masaje sobre la piel. La cantidad de gel necesaria depende del tamaño del área afectada por el dolor: normalmente entre 2 g y 4 g (aproximadamente el tamaño de una cereza y una nuez respectivamente) de Voltadol Forte son suficientes para tratar un área de entre 400 y 800 cm2.
Después de la aplicación, deben lavarse las manos a no ser que éstas sean el lugar de tratamiento.
Si los síntomas empeoran o persisten después de 5 días de tratamiento, debe evaluarse la situación clínica.
Niños y adolescentes menores de 14 años:
Este medicamento no está recomendado para uso en niños menores de 14 años, debido a la ausencia de datos sobre seguridad y eficacia.
Población de edad avanzada:
Puede utilizarse la dosis normal de adultos.
4.3 Contraindicaciones
• Hipersensibilidad al diclofenaco o a alguno de los excipientes de este medicamento.
• En los pacientes que hayan sufrido previamente ataques de asma, urticaria o rinitis aguda provocada por el ácido acetilsalicílico u otro fármaco antiinflamatorio no esteroideo (AINE).
• No aplicar sobre heridas, lesiones eczematosas, mucosas, ni en quemaduras.
• En niños y adolescentes menores de 14 años.
En el tercer trimestre de embarazo.
4.4 Advertencias y precauciones especiales de empleo
• No utilizar en zonas extensas. Utilizar exclusivamente en la zona afectada.
La posibilidad de sufrir efectos adversos sistémicos derivados de la aplicación de Voltadol Forte no puede ser excluida cuando la preparación se utiliza en grandes áreas de la piel durante un tiempo prolongando.
• Debe aplicarse sobre piel sana e intacta, sin lesiones ni heridas abiertas.
• Evitar el contacto con los ojos y mucosas.
• No ingerir.
• No utilizar simultáneamente en la misma zona con otras preparaciones tópicas.
• No debe utilizarse con vendajes oclusivos.
• No exponer al sol la zona tratada para reducir el riesgo de aparición de reacciones de fotosensibilidad (pudiendo aparecer en la piel lesiones como eczema, erupcion vesículo-ampollosa...).
Advertencias especiales sobre excipientes:
Este medicamento puede producir irritación de la piel porque contiene propilenglicol asímismo puede producir reacciones locales en la piel (como dermatitis de contacto) o irritaciones de los ojos y membranas mucosas porque contiene butilhidroxitolueno.
4.5 Interacción con otros medicamentos y otras formas de interacción
No es probable que se produzcan interacciones ya que la absorción sistémica de diclofenaco desde la aplicación tópica es muy baja. No obstante, se valorará la conveniencia de utilizar otros analgésicos durante el tratamiento con este medicamento.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No se dispone de datos clínicos suficientes sobre el uso de diclofenaco por vía cutánea durante el embarazo.
Aunque por uso cutáneo la absorción sistémica es muy pequeña, este medicamento no debe utilizarse durante el embarazo salvo criterio médico, ya que los AINEs especialmente durante el tercer trimestre, pueden producir distocia retrasar el parto y ocasionar efectos adversos en el sistema cardiovascular fetal, como por ejemplo el cierre prematuro del ductus arteriosus.
Estudios en animales han mostrado toxicidad reproductiva después de la administración sistémica (ver sección 5.3).
Lactancia
No se conoce si el diclofenaco aplicado de forma tópica se excreta en la leche materna, por lo que no se recomienda el uso de Voltadol Forte durante la lactancia, salvo criterio médico. En caso de que su administración fuera necesaria, Voltadol Forte no deberá ser aplicado sobre los pechos o sobre una gran superficie de la piel, ni durante un periodo prolongado de tiempo.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La aplicación cutánea de Voltadol Forte no influye sobre la habilidad para conducir y utilizar máquinas.
4.8 Reacciones adversas
Las reacciones adversas incluyen reacciones locales, leves y pasajeras en el lugar de aplicación. En algunos casos muy raros pueden ocurrir reacciones alérgicas.
Las reacciones adversas relacionadas con el diclofenaco dietilamina por vía tópica comunicadas durante el periodo de comercialización se listan en la Tabla 1, utilizándose la siguiente clasificación: frecuentes (> 1/100 a < 1/10); poco frecuentes (> 1/1.000 a < 1/100); raras (> 1/10.000 a < 1/1.000); muy raras (< 1/10.000), incluyendo casos aislados.
Tabla 1
|
Trastornos respiratorios, torácicos y mediastínicos | ||
|
Muy raros: |
Asma. | |
|
Trastornos de la piel y del tejido subcutáneo | ||
|
Frecuentes: |
Erupción, eczema, eritema, dermatitis (incluida dermatitis de contacto). | |
|
Raros: |
Dermatitis ampollosa. | |
|
Muy raros: |
Reacciones de fotosensibilidad. | |
|
Infecciones e infestaciones | ||
|
Muy raras: |
Erupción pustular. | |
|
Trastornos del sistema inmunológico | ||
|
Muy raros: |
Hipersensibilidad, edema angioneurótico. | |
La absorción sistémica de diclofenaco por vía tópica es muy baja comparada con los niveles plasmáticos del principio activo después de la administración oral de diclofenaco. Por lo tanto, la probabilidad de que se produzcan reacciones adversas sistémicas (como trastornos digestivos o renales, broncoespasmo) es muy baja tras la aplicación tópica, en comparación con la frecuencia de reacciones adversas asociadas a la administración oral de diclofenaco. Sin embargo, si se usa el diclofenaco sobre una gran zona de piel y durante un largo período de tiempo, pueden ocurrir reacciones adversas sistémicas.
En caso de observar la aparición de reacciones adversas, se deben notificar a los sistemas de farmacovigilancia y, si fuera necesario, suspender el tratamiento.
Notificación de sospechas de reaciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: www.notificaRAM.es
4.9 Sobredosis
No es probable que se produzcan casos de sobredosis por la baja absorción sistémica del diclofenaco aplicado de forma tópica.
No obstante, se pueden esperar efectos adversos, similares a aquellos observados tras una sobredosis de diclofenaco en comprimidos, cuando se produce una ingesta accidental de Voltadol Forte (1 tubo de 50 g contiene el equivalente a 1000 mg de diclofenaco sódico). En caso de ingestión accidental, que pueda derivar en reacciones adversas sistémicas, se adoptarán las medidas terapéuticas habituales en casos de sobredosis con medicamentos antiiflamatorios no esteroideos. Debe considerarse el lavado gástrico y el uso de carbón activado, especialmente si la ingestión es reciente.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Preparados con antiinflamatorios no esteroideos para uso tópico. Diclofenaco. Código ATC: M02A A15.
Diclofenaco es un fármaco antiinflamatorio no esteroideo (AINE) con marcadas propiedades analgésicas, antiinflamatorias y antipiréticas. El mecanismo de acción principal de diclofenaco es la inhibición de la síntesis de las prostaglandinas.
Voltadol Forte es una forma farmacéutica de aplicación tópica con actividad local antiinflamatoria y analgésica.
La eficacia de Voltadol aplicado 2 veces al día, cada 12 horas, fue evaluada en un ensayo aleatorizado, doble ciego ( estudio VOPO-P-307), que incluyó dos brazos de tratamiento activo con Voltadol (administrado dos veces y tres veces al día) y controlado con placebo en 242 pacientes con esguince agudo de tobillo de grado I y II. Los pacientes en el estudio presentaron unos valores basales medios de dolor en movimiento basados en una escala visual analógica (VAS) de 100 mm de 75.4 mm en el brazo de Voltadol administrado tres veces al día, 75.4 mm en el brazo de Voltadol administrado dos veces al día y 74.6 mm en el brazo de placebo. Los niveles medios basales de dolor en reposo fueron de 36.8 mm, 36.5 mm y 36.0 mm respectivamente sobre una VAS de 100mm.
A los 3 y 5 días de tratamiento se observó una mejora del dolor en base a la variable primaria del estudio: dolor en movimiento, en los brazos activos en comparación con el brazo de placebo (p <0,0001). A los 5 días de tratamiento, la disminución en la puntuación media del dolor en reposo fue estadísticamente significativa en comparación con placebo (p < 0.0001), se observó una diferencia media de 7.3 mm sobre la escala de 100 mm (VAS) entre los brazos de Voltadol administrado dos veces al día y el brazo de placebo.
Figura 1. Dolor en reposo-Población ITT
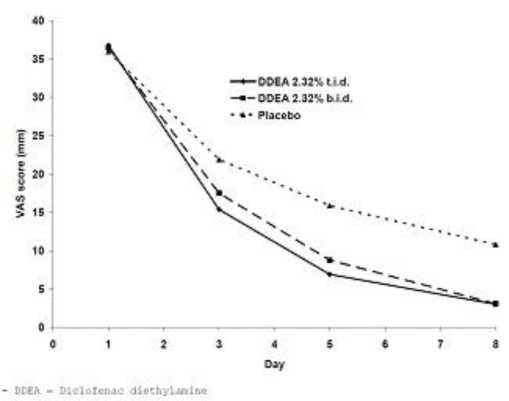
DDEA 2,32% t.id.: Voltadol 2.32 mg/g gel administrado 3 veces al día.
DDEA 2,32% b.id.: Voltadol 2.32 mg/g gel administrado 2 veces al día.
A los 5 días también se produjo una disminución estadísticamente significativa de la inflamación local en el brazo de Voltadol administrado 2 veces al día en comparación con placebo (p <0,0001).
5.2 Propiedades farmacocinéticas Absorción
La cantidad de diclofenaco absorbida a través de la piel es proporcional al tamaño del área afectada, y depende tanto del total de la dosis aplicada como del grado de hidratación de la piel. Tras la administración tópica sobre aproximadamente 400 cm2 de piel, la exposición sistémica determinada mediante la concentración plasmática (tras aplicación de Voltadol Forte en una pauta de 2 aplicaciones diarias) es equivalente a la de Voltadol en una pauta de 4 administraciones diarias. La biodisponibilidad relativa del diclofenaco (relación AUC) para Voltadol Forte comparado con los comprimidos fue del 4,5% a los 7 días de tratamiento (dosis equivalente de diclofenaco sódico.
La absorción no se modificó por la aplicación de vendajes hidratantes o permeables al vapor.
Distribución
Las concentraciones de diclofenaco han sido medidas tanto en plasma, tejido sinovial y fluido sinovial después de la aplicación tópica de Voltadol Forte en las articulaciones de la mano y la rodilla. Las concentraciones plasmáticas máximas son aproximadamente 100 veces menores que tras la administración oral de la misma cantidad de diclofenaco. El 99,7% de diclofenaco se une a las proteínas séricas, principalmente a la albúmina (99,4%).
Metabolismo
La biotransformación del diclofenaco implica en parte la glucouronidación de la molécula intacta, si bien se producen principalmente hidroxilaciones únicas o múltiples que generan varios metabolitos fenólicos, la mayoría de los cuales se convierten en conjugados glucourónidos. Dos de los metabolitos fenólicos son biológicamente activos, aunque en mucho menor medida que el diclofenaco.
Eliminación
El aclaramiento sistémico total de diclofenaco es de 263 ± 56 ml/min. La semivida plasmática terminal es de 1-2 horas. Cuatro de los metabolitos, incluidos los dos activos, tienen semividas plasmáticas cortas de entre 1 y 3 horas. Un metabolito, 3"-hidroxi-4"-metoxi-diclofenaco, tiene una semivida más larga pero es virtualmente inactivo. El diclofenaco y sus metabolitos se excretan principalmente por la orina.
Farmacocinética en poblaciones especiales de pacientes
No se prevee acumulación de diclofenaco ni de sus metabolitos en pacientes con insuficiencia renal. En pacientes con hepatitis crónica o cirrosis no descompensada, la cinética y el metabolismo del diclofenaco son los mismos que en los pacientes sin enfermedades hepáticas.
5.3 Datos preclínicos sobre seguridad
Los datos preclínicos obtenidos en estudios de toxicidad aguda y a dosis repetidas, así como en estudios de genotoxicidad, mutagénesis y carcinogénesis con diclofenaco han revelado que no existe un riesgo específico para humanos a las dosis terapéuticas previstas. No existe evidencia de que el diclofenaco tenga un potencial teratogénico en ratones, ratas o conejos.
El diclofenaco no influyó en la fertilidad de las ratas progenitoras. El desarrollo prenatal, perinatal y postnatal de la progenie, no se vio afectado.
Voltadol Forte fue bien tolerado en estudios diversos. No se observó potencial de fototoxicidad y el gel de diclofenaco no causo sensibilización cutánea o irritación.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Butilhidroxitolueno (E 321) carbómero,
cetomacrogol 1000, caprilocaprato de cocoílo, dietilamina, alcohol isopropílico, propilenglicol, parafina líquida, alcohol oleílico,
esencia de eucalipto y agua purificada.
6.2 Incompatibilidades No procede.
6.3 Periodo de validez
3 años.
6.4 Precauciones especiales de conservación
No conservar a temperatura superior a 30°C
6.5 Naturaleza y contenido del envase
Tubo de aluminio laminado constituido por varias capas de polietileno de baja densidad, aluminio y polietileno de alta densidad (capa interna), unidas a una pieza de polietileno de alta densidad, que está sellada por una pieza moldeada de forma característica para permitir la apertura del tubo mediante su ensamblaje con la parte exterior del tapón. El tubo se cierra con un tapón de rosca de polipropileno, dotado de un bajorrelieve en la parte externa que sirve para insertarlo en la pieza que sella el tubo, y mediante un giro, elimina dicho sello para la primera utilización del tubo.
Tamaños del envase: 50 g.
6.6 Precauciones especiales de eliminación y otras manipulaciones
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local o se procederá a su devolución a la farmacia.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
GLAXOSMITHKLINE CONSUMER HEALTHCARE S.A. □□
Parque Tecnológico de Madrid, Calle de Severo Ochoa, 2M 28760 Tres Cantos, Madrid - España^
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Enero 2014
10. FECHA DE LA REVISIÓN DEL TEXTO
6 de 6