Vistabel 4 Unidades Allergan/0,1 Ml Polvo Para Solucion Inyectable
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
Vistabel 4 Unidades Allergan /0,1ml polvo para solución inyectable
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Toxina botulínica de tipo A1............4 Unidades Allergan por 0,1ml de solución reconstituida.
1de Clostridium botulinum
Las Unidades Allergan no son intercambiables con otros medicamentos que contengan toxina botulínica. Vial de 50 unidades.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Polvo para solución inyectable.
Polvo blanco.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Vistabel está indicado para la mejoría temporal en la apariencia de las siguientes líneas faciales en pacientes adultos cuando la intensidad de las mismas es de moderada a grave y tiene un impacto psicológico importante:
• Líneas verticales entre las cejas producidas en máximo fruncimiento (líneas glabelares) .
• Líneas del canto lateral (patas de gallo) producidas en máxima sonrisa.
• Patas de gallo producidas en máxima sonrisa y líneas glabelares producidas en máximo fruncimiento tratadas simultáneamente.
4.2 Posología y forma de administración
Posología
Consulte las recomendaciones específicas para cada indicación descritas a continuación.
Las unidades de toxina botulínica no son intercambiables de un producto a otro. Las dosis recomendadas en Unidades Allergan son diferentes de otras preparaciones a base de toxina botulínica.
Pacientes de edad avanzada
Los datos clínicos de fase 3 de los que se dispone para el uso de Vistabel en pacientes mayores de 65 años (ver sección 5.1) son limitados.
No se requiere ningún ajuste específico de dosis para pacientes de edad avanzada.
Población pediátrica
No se ha demostrado la seguridad y eficacia de Vistabel en el tratamiento de líneas glabelares producidas en máximo fruncimiento o patas de gallo producidas en máxima sonrisa en personas menores de 18 años. El uso de Vistabel no está recomendado en personas con edad inferior a 18 años (ver sección 4.4).
Forma de administración
Vistabel sólo debe ser administrado por médicos con la cualificación y experiencia adecuadas, en este tratamiento y en el uso del equipo apropiado.
Una vez reconstituido, Vistabel debe utilizarse para una sola sesión de inyección(es) por paciente. El remanente de producto no utilizado se debe eliminar tal y como se indica en la sección 6.6. Se deben tomar precauciones en la preparación y administración del producto, así como en la eliminación de la solución no utilizada (ver sección 4.4 y 6.6).
El volumen a inyectar recomendado por punto de inyección muscular es de 0,1 ml. Ver también la tabla de dilución en la sección 6.6.
Para las instrucciones de uso, manipulación y eliminación de los viales, ver sección 6.6.
Se debe tener cuidado con el fín de asegurar que Vistabel no se inyecta en un vaso sanguineo cuando se inyecta en las líneas verticales entre las cejas producidas en máximo fruncimiento (también conocidas como líneas glabelares) o en las líneas del canto lateral producidas en máxima sonrisa (también conocidas como patas de gallo), ver sección 4.4.
Instrucciones de administración para las líneas glabelares producidas en máximo fruncimiento:
Se inyecta Vistabel reconstituido (50 Unidades / 1,25 ml) utilizando una aguja estéril de calibre 30. En cada uno de los 5 puntos de inyección (ver figura 1) se administran 0,1 ml (4 Unidades): 2 inyecciones en cada músculo corrugador y 1 inyección en el músculo procerus para alcanzar una dosis total de 20 Unidades.
Antes de inyectar, se coloca el dedo índice o el pulgar firmemente debajo del borde orbital para evitar la extravasación por debajo del mismo. Durante la inyección la aguja se debe orientar superiormente y medialmente. Para reducir el riesgo de ptosis palpebral, no se debe exceder la dosis máxima de 4 Unidades en cada punto de inyección ni tampoco se debe exceder el número de puntos de inyección. Además, se debe evitar inyectar cerca del músculo elevador superior del párpado, especialmente en pacientes con complejos ceja-depresor (depresor superciliar) más grandes. Las inyecciones en el músculo corrugador se deben realizar en la parte central de dicho músculo, a una distancia de al menos 1 cm por encima del borde orbital.
Figura 1:
ÜE
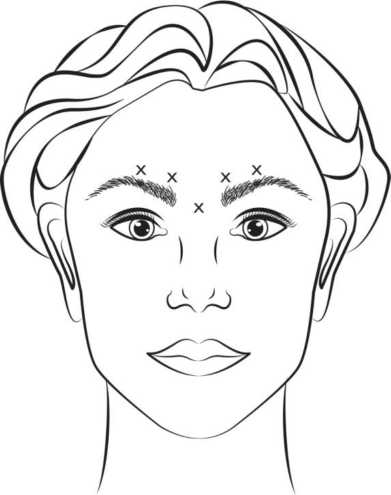
La mejoría de las líneas glabelares producidas en máximo fruncimiento tiene lugar por lo general, durante la semana posterior al tratamiento. Se ha demostrado que el efecto del tratamiento dura hasta 4 meses después de la inyección.
Los intervalos entre tratamientos no deben ser inferiores a tres meses. En caso de que falle el tratamiento o disminuya el efecto después de inyecciones repetidas, se deberán utilizar métodos de tratamiento alternativos.
Instrucciones de administración para las patas de gallo producidas en máxima sonrisa:
Se inyecta Vistabel reconstituido (50 Unidades / 1,25 ml) utilizando una aguja estéril de calibre 30. Se administran 0,1 ml (4 Unidades) en cada uno de los 3 puntos de inyección por lado (un total de 6 puntos de inyección) en la zona lateral del músculo orbicular del ojo para alcanzar una dosis total de 24 Unidades con un volumen total de 0,6 ml (12 Unidades por lado).
Para reducir el riesgo de ptosis palpebral, no se debe superar la dosis máxima de 4 Unidades por punto de inyección ni el número de puntos de inyección, Además, las inyecciones deben realizarse alejándose del borde orbital, manteniendo así una distancia segura del músculo que controla la elevación del párpado.
Las inyecciones deben administrarse orientando el bisel de la aguja hacia arriba y alejándose del ojo. La primera inyección (A) debe hacerse aproximadamente de 1,5 a 2,0 cm orientada hacia al exterior del canto lateral y en la línea del borde orbital. Si las líneas de la región de las patas de gallo quedan por encima y por debajo del canto lateral, inyectar tal y como se muestra en la figura 2. En caso de que las líneas de las patas de gallo estén principalmente por debajo del canto lateral, inyectar tal y como se muestra en la figura 3.
Figura 2: Figura 3:
ÜE
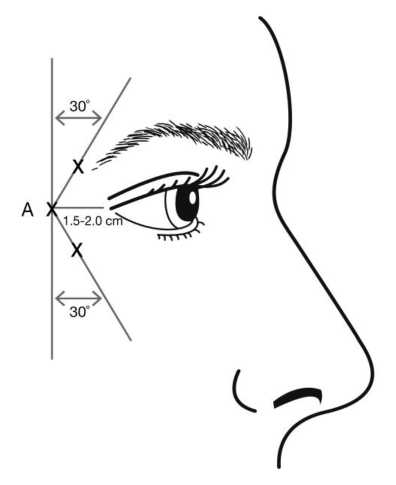
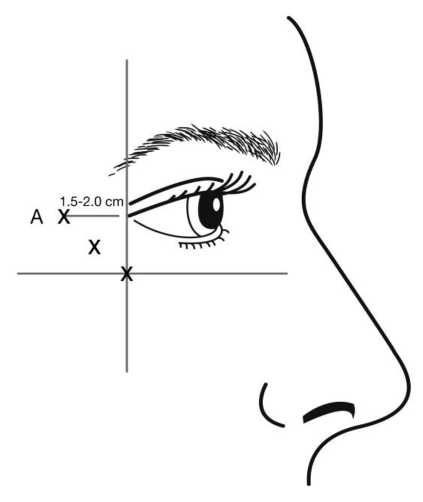
En caso de tratamiento simultáneo de las líneas glabelares producidas en máximo fruncimiento, la dosis es de 24 Unidades para las patas de gallo producidas en máxima sonrisa y de 20 Unidades para las líneas glabelares (ver las Instrucciones de administración para las líneas glabelares y la figura 1), para alcanzar una dosis total de 44 Unidades con un volumen total de 1,1 ml.
La mejoría de la gravedad de las patas de gallo producidas en máxima sonrisa, cuando la evaluó el investigador, se produjo en la primera semana después del tratamiento. Se demostró que el efecto se mantuvo durante una mediana de 4 meses después de la inyección.
No se debe repetir el tratamiento con una frecuencia inferior a 3 meses.
Información general
En caso de que el tratamiento no sea eficaz después de la primera sesión, es decir si después de un mes tras la inyección, no se observa mejoría clínica significativa respecto a la situación inicial, se deberán tomar las siguientes medidas:
• Analizar las causas del fallo, por ejemplo, inyección en músculos erróneos, técnica de inyección, formación de anticuerpos frente a la toxina, dosis insuficiente;
• Evaluar nuevamente si es adecuado el tratamiento con toxina botulínica tipo A;
En ausencia de efectos no deseados secundarios a la primera sesión de tratamiento, iniciar una segunda sesión de tratamiento con al menos tres meses de intervalo entre ambas sesiones.
Para las líneas glabelares producidas en máximo fruncimiento, en caso de dosis insuficiente, iniciar una segunda sesión ajustando la dosis total hasta un máximo de 40 ó 50 Unidades, en base al análisis de falta de respuesta al tratamiento previo.
No se ha evaluado la eficacia y la seguridad de inyecciones repetidas con Vistabel durante más de 12 meses.
4.3 Contraindicaciones
Vistabel está contraindicado,
- En personas con una conocida hipersensibilidad a toxina botulínica tipo A o a cualquiera de los excipientes de la formulación incluidos en la sección 6.1.
- En caso de miastenia grave o de Síndrome Eaton Lambert.
- En caso de presencia de infección en los puntos en que se pretende inyectar.
4.4 Advertencias y precauciones especiales de empleo
Deberán tomarse precauciones especiales para la preparación y administración del producto al igual que para la eliminación de la solución sobrante (ver las secciones 4.2 y 6.6).
Este medicamento contiene menos de 1 mmol de sodio (23 mg) por dosis, es decir, es esencialmente “libre de sodio”.
Antes de administrar Vistabel es necesario conocer la anatomía relevante y cualquier alteración de la misma debida a intervenciones quirúrgicas previas y se debe evitar la inyección en estructuras anatómicas vulnerables. No se debe sobrepasar las dosis ni la frecuencia de administración de Vistabel recomendadas.
En muy raros casos se puede presentar una reacción anafiláctica después de la inyección de toxina botulínica. Se debe disponer de epinefrina (adrenalina) o algún otro remedio anti-anafiláctico.
Los pacientes con trastornos neuromusculares no diagnosticados tiene un riesgo más alto de efectos sistémicos clínicamente relevantes incluidos disfagia grave y compromiso respiratorio a las dosis habituales de toxina botulínica tipo A. En algunos de estos casos, la disfagia ha durado varios meses y se ha necesitado la inserción de una sonda nasogástrica (ver sección 4.3).
Se debe tener precaución en el tratamiento de pacientes con esclerosis lateral amiotrófica o con trastornos neuromusculares periféricos con Vistabel.
Se han notificado muy raramente reacciones adversas posiblemente relacionadas con la diseminación a distancia de la toxina lejos del sitio de administración.(ver sección 4.8). Los pacientes tratados con dosis terapéuticas pueden experimentar debilidad muscular exagerada. Las dificultades para tragar y respirar son serias y pueden desencadenar la muerte. No se recomienda la inyección de Vistabel en pacientes con antecedentes de disfagia y aspiración.
Se debe advertir a los pacientes y cuidadores que busquen asistencia médica en caso de que se presenten alteraciones en la deglución, en el habla o respiratorios.
Una dosificación demasiado frecuente o excesiva puede aumentar el riesgo de formación de anticuerpos. La formación de anticuerpos puede provocar un fracaso del tratamiento de la toxina botulínica tipo A incluso para otras indicaciones.
Como se espera con cualquier procedimiento de inyección, puede aparecer dolor localizado, inflamación, parestesia, hipoestesia, dolor a la palpación, hinchazón/edema, eritema, infección localizada, sangrado y/o hematomas.
El dolor relacionado con las agujas y/o la ansiedad han resultado en respuestas vasovagales, incluidos hipotensión sintomática transitoria y síncope.
Se debe tener precaución al utilizar Vistabel en presencia de inflamación en el(los) lugar(es) propuesto(s) de inyección o cuando el músculo a tratar esté excesivamente debilitado o atrofiado.
Se debe tener precaución para asegurar que Vistabel no se inyecta en un vaso sanguíneo cuando se inyecta en las líneas glabelares producidas en máximo fruncimiento o las patas de gallo producidas en máxima sonrisa , ver sección 4.2.
Existe riesgo de ptosis palpebral tras el tratamiento; consultar la sección 4.2 para las instrucciones de administración sobre cómo reducir este riesgo al mínimo.
El uso de Vistabel no está recomendado en pacientes con edad inferior a 18 años. Los datos clínicos de fase 3 de Vistabel en pacientes mayores de 65 años son limitados.
4.5 Interacción con otros medicamentos y otras formas de interacción
Teóricamente, el efecto de la toxina botulínica se puede ver potenciado por los antibióticos aminoglucósidos o espectinomicina, o por otros fármacos que interfieran con la transmisión neuromuscular (como por ejemplo agentes bloqueantes neuromusculares).
No se conoce el efecto de la administración de diferentes serotipos de neurotoxina botulínica al mismo tiempo o con varios meses de diferencia. La debilidad neuromuscular excesiva puede verse agravada por la administración de otra toxina botulínica antes de la resolución de los efectos de una toxina botulínica administrada previamente.
No se han realizado estudios específicos que permitan establecer la interacción clínica con otros fármacos. No se han descrito otras interacciones clínicamente significativas en esta indicación.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No se dispone de datos suficientes sobre el uso de toxina botulínica tipo A en mujeres embarazadas. Estudios en animales han mostrado toxicidad reproductora (véase Sección 5.3). Se desconoce el riesgo potencial en humanos. No se recomienda el uso de Vistabel durante el embarazo ni en mujeres en edad fértil que no estén utilizando métodos anticonceptivos.
Lactancia
Se desconoce si Vistabel se excreta en la leche humana, por lo que su uso no está recomendado durante la lactancia.
Fertilidad
No hay datos adecuados sobre los efectos en la fertilidad del uso de toxina botulínica tipo A en mujeres en edad fértil. Los estudios en ratas macho y hembra han demostrado reducciones en la fertilidad (ver sección 5.3).
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No se han realizado estudios sobre la capacidad para conducir y utilizar máquinas. Sin embargo, Vistabel puede provocar astenia, debilidad muscular, mareos y trastornos visuales, lo cual puede afectar a la capacidad para conducir y utilizar máquinas.
4.8 Reacciones adversas
a) Generales
Las reacciones adversas consideradas como relacionados con Vistabel por los investigadores en ensayos clínicos controlados para líneas glabelares producidas en máximo fruncimiento se notificaron en un 23,5% (placebo: 19,2%) de los pacientes. En el ciclo 1 de tratamiento en los ensayos clínicos controlados pivotales de patas de gallo producidas en máxima sonrisa, dichos acontecimientos se notificaron en un 7,6% (24 Unidades en patas de gallo solamente) y un 6,2% (44 Unidades: 24 Unidades en las patas de gallo administradas simultáneamente con 20 Unidades en las líneas glabelares) de los pacientes en comparación con el 4,5% observado con placebo.
Las reacciones adversas pueden estar relacionadas con el tratamiento, con la técnica de inyección o con ambos. En general, las reacciones adversas se producen durante los días siguientes a la inyección y son transitorios. La mayoría de las reacciones adversas descritas son de severidad de leve a moderada.
La debilidad muscular local es la acción farmacológica esperada de la toxina botulínica. No obstante, se han notificado casos de debilidad en músculos adyacentes y/o en músculos alejados del lugar de inyección. La blefaroptosis, que puede ser debida a la técnica de inyección empleada, está asociada al efecto farmacológico de Vistabel. Al igual que con la administración de cualquier inyección, puede aparecer dolor/quemazón/escozor, edema y/o hematomas asociados a la inyección. También se han notificado fiebre y síndrome gripal tras la inyección de toxina botulínica tipo A.
b) Reacciones adversas - frecuencia
Las reacciones adversas se clasifican según el Sistema de Clasificación de Órganos y según la frecuencia que se define a continuación: Muy frecuentes (>1/10); Frecuentes (>1/100, <1/10); Poco frecuentes (>1/1000, <1/100); Raras (>1/10000, <1/1000); Muy raras (<1/10000).
Líneas glabelares
|
Sistema de Clasificación de Órganos |
Término preferido |
Frecuencia |
|
Infecciones e infestaciones |
Infección |
Poco frecuentes |
|
Trastornos psiquiátricos |
Ansiedad |
Poco frecuentes |
|
Trastornos del sistema nervioso |
Cefalea, parestesia |
Frecuentes |
|
Mareo |
Poco frecuentes | |
|
Trastornos oculares |
Ptosis palpebral |
Frecuentes |
|
Blefaritis, dolor de ojos, trastornos visuales (incluido visión borrosa) |
Poco frecuentes | |
|
Trastornos gastrointestinales |
Náuseas |
Frecuentes |
|
Sequedad de boca |
Poco frecuentes | |
|
Trastornos de la piel y del tejido |
Eritema, tensión de la piel |
Frecuentes |
|
subcutáneo |
Edema (cara, párpado, periorbital), reacción de fotosensibilidad, prurito, sequedad de la piel |
Poco frecuentes |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Debilidad muscular localizada |
Frecuentes |
|
Fasciculaciones musculares |
Poco frecuentes | |
|
Trastornos generales y alteraciones en el lugar de la administración |
Dolor en la cara, edema en el punto de inyección, equimosis, dolor en el punto de inyección, irritación en el punto de inyección |
Frecuentes |
|
Síndrome gripal, astenia, fiebre |
Poco frecuentes |
Patas de sallo
Se notificaron las siguientes reacciones adversas en estudios clínicos doble ciego, controlados con placebo tras la inyección de Vistabel 24 Unidades únicamente para las patas de gallo:
|
Sistema de Clasificación de Órganos |
Término preferido |
Frecuencia |
|
Trastornos oculares |
Edema palpebral |
Frecuentes |
|
Trastornos generales y alteraciones en el lugar de administración |
Hemorragia en el punto de inyección*, hematoma en el punto de inyección* |
Frecuentes |
|
Dolor en el punto de inyección*, parestesia en el punto de inyección |
Poco frecuentes |
*reacciones adversas relacionadas con el procedimiento
Patas de gallo y líneas glabelares
Se notificaron las siguientes reacciones adversas en estudios clínicos doble ciego, controlados con placebo tras la inyección de Vistabel 44 Unidades (tratamiento simultáneo de las patas de gallo y las líneas glabelares):
|
Sistema de Clasificación de Órganos |
Término preferido |
Frecuencia |
|
Trastornos generales y alteraciones en el lugar de |
Hematoma en el punto de inyección* |
Frecuentes |
|
administración | ||
|
Hemorragia en el punto de inyección*, dolor en el punto de inyección* |
Poco frecuentes |
*reacciones adversas relacionadas con el procedimiento
No se observaron cambios en el perfil de seguridad tras la administración repetida.
c) Datos Post-Comercialización (frecuencia no conocida)
Desde la introducción en el mercado del fármaco para el tratamiento de líneas glabelares, patas de gallo y otras indicaciones clínicas, se han notificado las siguientes reacciones adversas:
|
Sistema de Clasificación de Órganos |
Término preferido |
|
Trastornos del sistema inmunológico |
Anafilaxia, angioedema, enfermedad del suero y urticaria |
|
Trastornos del metabolismo y de la nutrición |
Anorexia |
|
Trastornos del sistema nervioso |
Plexopatía braquial, disfonía, disartria, paresia facial, hipoestesia, debilidad muscular, miastenia gravis, neuropatía periférica, parestesia, radiculopatía, síncope y parálisis facial |
|
Trastornos oculares |
Glaucoma de ángulo cerrado (en el tratamiento de blefaroespasmo), lagoftalmos, estrabismo, visión borrosa y trastornos visuales |
|
Trastornos del oido y del laberinto |
Hipoacusia, tinnitus y vértigo |
|
Trastornos respiratorios, torácicos y mediastínicos |
Neumonía por aspiración, disnea, broncoespasmo, depresión respiratoria e insuficiencia respiratoria |
|
Trastornos gastrointestinales |
Dolor abdominal, diarrea, sequedad de boca, disfagia, náuseas y vómitos |
|
Trastornos de la piel y del tejido subcutáneo |
Alopecia, dermatitis psoriasiforme, eritema multiforme, hiperhidrosis, madarosis, prurito y erupción cutánea |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Atrofia muscular y mialgia |
|
Trastornos generales y alteraciones en el lugar de administración |
Atrofia por denervación, malestar y fiebre (pirexia) |
Se han notificado muy raramente con la toxina botulínica reacciones adversas posiblemente relacionadas con la diseminación de la toxina lejos del sitio de administración (por ejemplo, debilidad muscular, disfagia, estreñimiento o neumonía por aspiración que pueden ser mortales (ver sección 4.4).
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de medicamentos de Uso Humano: https://www.notificaram.es.
4.9 Sobredosis
La sobredosis de Vistabel es un término relativo y depende de la dosis, del lugar de inyección y de las propiedades subyacentes del tejido. No se ha descrito ningún caso de toxicidad sistémica como consecuencia de la inyección accidental de toxina botulínica tipo A. Una dosis excesiva puede producir parálisis neuromuscular local o a distancia, generalizada y profunda. No se ha descrito ningún caso de ingestión de toxina botulínica tipo A.
Los signos de sobredosificación no son aparentes inmediatamente después de la inyección. En caso de inyección o ingestión accidental se debe someter al paciente a supervisión médica durante varios días para detectar posibles signos o síntomas de debilidad generalizada o parálisis muscular.
En pacientes que muestren síntomas de intoxicación por toxina botulínica tipo A (debilidad generalizada, ptosis, diplopía, alteraciones al tragar o hablar, o paresia de los músculos respiratorios) se deberá considerar la hospitalización de los mismos.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Relajantes musculares, agente de acción periférica.
Código ATC M03A X01.
La toxina botulínica tipo A (neurotoxina de Clostridium botulinum) bloquea la liberación de acetilcolina a nivel de las terminaciones nerviosas colinérgicas periféricas por escindir SNAP-25, proteína necesaria para que se produzca adecuadamente la fijación y liberación de acetilcolina de las vesículas situadas en las terminaciones nerviosas dando lugar a la denervación del músculo y por tanto a una parálisis.
Tras la inyección, la toxina botulínica inicialmente se une rápidamente y con elevada afinidad a receptores específicos de la superficie celular. A continuación, la toxina pasa a través de la membrana plasmática mediante endocitosis mediada por receptores. Finalmente es translocada al citosol. Este último paso lleva
10 de 16 MINISTKODE
SANIDAD, POLITICA SOCIAL E IGUALDAD Apenca esparto» de medie amentos y pfoouctos saltaros
consigo una inhibición progresiva de la liberación de acetilcolina. Los signos clínicos se manifiestan a los 2-3 días, con un efecto máximo a las 5-6 semanas de la inyección.
Normalmente la recuperación tras la inyección intramuscular se produce a las 12 semanas de la inyección a medida que las terminales nerviosas se ramifican y conectan nuevamente con placas terminales.
Datos clínicos:
Líneas glabelares
En los estudios clínicos se incluyeron 537 pacientes que al fruncir al máximo el entrecejo presentaban líneas glabelaresde moderadas a graves.
Las inyecciones de Vistabel redujeron de modo significativo la gravedad de las líneas glabelares producidas en máximo fruncimiento hasta un máximo de 4 meses, medidas según la evaluación del investigador en máximo fruncimiento y por la evaluación global del sujeto respecto al cambio de aspecto de sus líneas glabelares producidas en máximo fruncimiento. Ninguno de los parámetros clínicos incluía una evaluación objetiva del impacto psicológico. Treinta días después de la inyección, los investigadores consideraron que el 80% (325/405) de los pacientes tratados con Vistabel era respondedor (ninguna gravedad o muy leve en máximo fruncimiento), respecto al 3% (4/132) de los pacientes tratados con placebo. Al mismo tiempo, el 89% (362/405) de los pacientes tratados con Vistabel manifestó haber experimentado una mejoría moderada o importante, frente a un 7% (9/132) de los pacientes tratados con placebo.
Las inyecciones de Vistabel también redujeron considerablemente la gravedad de las líneas glabelares en estado relajado. De los 537 pacientes participantes, el 39% (210/537) presentaba líneas glabelares de moderadas a graves en estado relajado (un 15% no presentaba líneas en estado relajado). De éstos, se consideró que el 74% (119/161) de los pacientes tratados con Vistabel había respondido positivamente (ninguna o leve gravedad) a los treinta días de la inyección, frente a un 20% (10/49) de los pacientes tratados con placebo.
Los datos clínicos de fase 3 en pacientes de edad superior a 65 años tratados con Vistabel
son limitados. Sólo el 6,0% (32/537) de los pacientes era de edad superior a 65 años y los resultados de
eficacia obtenidos en esta población fueron menores.
Patas de gallo
Se incluyeron 1362 pacientes que presentaban únicamente patas de gallo de intensidad moderada a grave producidas en máxima sonrisa, (N=445, estudio 191622-098) o acompañadas de líneas glabelares de intensidad moderada a grave producidas en máximo fruncimiento (N=917, estudio 191622-099).
Las inyecciones de Vistabel redujeron de manera significativa la gravedad de las patas de gallo producidas en máxima sonrisa en comparación con placebo en todas la visitas de seguimiento (p <0,001) hasta un máximo de 5 meses. Esto se midió a través de la proporción de pacientes que alcanzaron un nivel de gravedad ausente o leve de las patas de gallo producidas en máxima sonrisa en ambos estudios pivotales; hasta el día 150 (final del estudio) en el estudio 191622-098 y hasta el día 120 (final del primer ciclo de tratamiento en el estudio 191622-099). Tanto en las evaluaciones del sujeto como del investigador, la proporción de sujetos que alcanzó una gravedad ausente o leve de las patas de gallo producidas en máxima sonrisa fue mayor en los pacientes con patas de gallo producidas en máxima sonrisa de intensidad moderada en el momento inicial, en comparación con los pacientes con patas de gallo producidas en máxima sonrisa de intensidad grave en el inicio. En la tabla 1 se resumen los resultados en el día 30, la visita de seguimiento en que se midió la variable principal de la eficacia.
En el estudio 191622-104 (extensión del estudio 191622-099), se incluyeron 101 pacientes aleatorizados previamente a placebo para recibir su primer tratamiento con la dosis de 44 Unidades. Los pacientes tratados con Vistabel presentaron un resultado estadísticamente significativo en la variable principal de eficacia en comparación con placebo en el día 30 tras su primer tratamiento activo. La tasa de respuesta fue similar al grupo de 44 Unidades en el día 30 tras su primer tratamiento activo en el estudio 191622-099. Un total de 123 pacientes recibieron 4 ciclos de 44 Unidades de Vistabel para el tratamiento combinado de las patas de gallo y las líneas glabelares.
Tabla 1. Día 30. Evaluación por parte del investigador y del paciente de las patas de gallo producidas en máxima sonrisa: tasa de respondedores (% de pacientes que lograron un nivel de gravedad ausente o leve de las patas de gallo)
|
Estudio clínico |
Dosis |
Vistabel |
Placebo |
Vistabel |
Placebo |
|
Evaluación de |
investigador |
Evaluación de |
paciente | ||
|
191622-098 |
24 Unidades (patas de gallo) |
66,7%* (148/222) |
6,7% (15/223) |
58,1%* (129/222) |
5,4% (12/223) |
|
191622-099 |
24 Unidades (patas de gallo) |
54,9%* (168/306) |
3,3% (10/306) |
45,8%* (140/306) |
3,3% (10/306) |
|
44 Unidades (24 Unidades patas de gallo; 20 Unidades líneas glabelares) |
59,0%* (180/305) |
3,3% (10/306) |
48,5%* (148/305) |
3,3% (10/306) |
*p < 0,001 (Vistabel en comparación con placebo)
Se observaron mejoras desde el inicio en la evaluación por parte de los sujetos de la apariencia de las patas de gallo producidas en máxima sonrisa con Vistabel (24 Unidades y 44 Unidades) en comparación con placebo, en el día 30 y en todas las visitas de seguimiento tras cada ciclo de tratamiento en ambos estudios pivotales (p < 0,001).
El tratamiento con 24 Unidades de Vistabel también redujo de manera significativa la gravedad de las patas de gallo en reposo. De los 528 pacientes tratados, un 63% (330/528) presentaba patas de gallo de intensidad moderada a grave en reposo en el momento inicial. De estos, un 58% (192/330) de los pacientes tratados con Vistabel fueron considerados como respondedores (gravedad ausente o leve) treinta días después de la inyección, en comparación con un 11% (39/352) de los pacientes tratados con placebo.
También se observaron mejoras en la autoevaluación por parte de los sujetos respecto a la edad y el atractivo con Vistabel (24 Unidades y 44 Unidades) en comparación con placebo utilizando el cuestionario Facial Line Outcomes (FLO-11) en la visita para medir la variable primaria en el día 30 (p<0,001) y en las siguientes visitas de seguimiento en ambos estudios pivotales.
En los estudios pivotales, un 3,9% (53/1362) de los pacientes era mayor de 65 años. Los pacientes de este grupo de edad presentaron una respuesta al tratamiento según la evaluación del investigador de un 36% (en el día 30) para Vistabel (24 Unidades y 44 Unidades). Cuando se analizaron por grupos de edad de <50 años y >50 años, ambas poblaciones mostraron mejorías estadísticamente significativas en comparación con placebo. La respuesta al tratamiento para Vistabel 24 Unidades, según lo evaluado por el investigador, fue menor en el grupo de sujetos >50 años que en el de <50 años (42,0% y 71,2%, respectivamente).
La respuesta general al tratamiento con Vistabel para las patas de gallo producidas en máxima sonrisa es menor (60%) que la observada en el tratamiento de las líneas glabelares producidas en máximo fruncimiento (80%).
En 916 pacientes (517 pacientes con 24 Unidades y 399 pacientes con 44 Unidades) tratados con Vistabel se analizaron muestras para analizar la formación de anticuerpos. En ningún paciente se detectó la presencia de anticuerpos neutralizantes.
5.2 Propiedades farmacocinéticas
a) Características generales del principio activo:
Estudios de distribución realizados en ratas muestran que tras su inyección el complejo 125I-toxina botulínica A difunde lentamente por el músculo gastrocnemio, sufre un rápido metabolismo sistémico y se excreta vía urinaria. En el músculo, la cantidad de sustancia marcada se reduce hasta aproximadamente la mitad en aproximadamente 10 horas. En el punto de inyección, la radioactividad se encuentra unida a grandes moléculas proteicas, mientras que en el plasma se une a moléculas pequeñas, lo que indica un rápido metabolismo sistémico del sustrato. En las 24 horas post inyección, el 60% de la radioactividad se excreta por orina. Probablemente, la toxina se metaboliza mediante proteasas y los componentes moleculares se reciclan a través de los circuitos metabólicos normales.
Dada la naturaleza de este producto, no se han llevado a cabo los habituales estudios de absorción, distribución, biotransformación y eliminación.
b) Características en los pacientes:
Se cree que la distribución sistémica de las dosis terapéuticas de Vistabel es muy pequeña.
Estudios clínicos realizados empleando técnicas electromiográficas de fibra única muestran una actividad muscular electrofisiológica aumentada en músculos alejados del punto de inyección, sin ir ésta acompañada de ningún signo o síntoma clínico.
5.3 Datos preclínicos sobre seguridad
En estudios de reproducción en ratones, ratas y conejos, se observó toxicidad embrionaria con dosis altas (retraso en la osificación y reducción de peso corporal fetal). No se observaron efectos teratogénicos en estas especies. En ratas los efectos adversos sobre la fertilidad masculina y el ciclo estral y fertilidad femeninos sólo tuvieron lugar a dosis altas.
Los estudios sobre toxicidad aguda, toxicidad de dosis repetidas, tolerancia local, mutagenicidad, antigenicidad y de compatibilidad sanguínea no mostraron efectos adversos locales inusuales o sistémicos a niveles de dosis clínicamente relevantes.
6 . DATOS FARMACÉUTICOS 6.1 Lista de excipientes
Albúmina humana.
Cloruro sódico.
6.2 Incompatibilidades
Dado que no se dispone de estudios de incompatibilidad, no se recomienda el uso de este producto junto con otros fármacos.
6.3 Periodo de validez
Tres años.
Una vez reconstituido, se recomienda el uso inmediato de la solución. Sin embargo, se ha demostrado que permanece estable desde el punto de vista físico y químico durante 24 horas a +2°C - + 8°C.
6.4 Precauciones especiales de conservación
Conservar en el frigorífico (2°C - 8°C).
Para las condiciones de conservación del producto reconstituido ver sección 6.3.
6.5 Naturaleza y contenido del envase
Polvo en un vial (cristal de Tipo I ) con un tapón de goma de clorobutilo y un precinto de aluminio;
Vial de 50 Unidades Allergan de toxina botulínica tipo A- envase con uno o envase con dos viales PUEDE QUE SOLAMENTE ESTÉN COMERCIALIZADOS ALGUNOS TAMAÑOS DE ENVASES.
6.6 Precauciones especiales de eliminación
La reconstitución debe realizarse de acuerdo a las normas de buenas prácticas, en particular en lo que respecta a la asepsia. Vistabel se debe reconstituir con una solución para inyección de cloruro sódico al 0,9% sin conservantes para inyección. De acuerdo con la tabla para diluciones que se muestra a continuación, se debe introducir la cantidad de 9 mg/ml de la solución inyectable (0,9%) que se indica en una jeringa para obtener una solución reconstituida con una concentración de 4Unidades/0,1 ml.
|
Cantidad de disolvente añadido |
Dosis resultante |
|
al vial de 50 Unidades |
(Unidades por 0,1 ml) |
|
(solución al 0,9% de cloruro sódico para | |
|
inyección) | |
|
1,25 ml |
4,0 Unidades |
Se debe limpiar con alcohol la parte central del tapón de goma.
Para evitar la desnaturalización de Vistabel, inyecte el disolvente poco a poco en el vial y gire con suavidad el mismo para evitar la formación de burbujas. Deseche el vial si el vacío no hace que el disolvente entre en el mismo. Una vez reconstituido, deberá hacerse una inspección visual de la solución antes de usarla. Sólo se debe usar una solución clara, entre incolora y ligeramente amarillenta libre de partículas.
Vistabel debe ser utilizado para el tratamiento de un solo paciente durante una sola sesión.
Procedimiento a seguir para una eliminación segura de viales, jeringuillas y materiales usados:
Inmediatamente después del uso, toda la solución de Vistabel reconstituido que quede en el vial y/o en la jeringuilla debe ser desactivado, antes de su eliminación, con 2 ml de solución de hipoclorito al 0,5% o lejía al 1 % y debe ser eliminado de acuerdo con los procedimientos locales establecidos.
Los viales, las jeringuillas y materiales usados no se deben vaciar sino que se deben depositar en contenedores adecuados y ser eliminados según los procedimientos locales establecidos.
Recomendaciones en caso de accidente durante la manipulación de la toxina botulínica.
En caso de accidente cuando se está manipulando el producto, bien el polvo secado al vacío o bien reconstituido, deben tomarse inmediatamente las medidas adecuadas, que se describen a continuación:
• La toxina es muy sensible al calor y a determinados agentes químicos.
• Se debe limpiar cualquier vertido, bien con un material absorbente empapado en una solución de hipoclorito sódico (solución de lejía) si es el producto secado al vacío, o con un material absorbente seco si se trata del producto reconstituido.
• Las superficies contaminadas se deben limpiar con un material absorbente empapado en una solución de hipoclorito sódico (solución de lejía) y luego secarlas.
• Si se rompe un vial, recoja con cuidado los trozos de cristal y limpie el producto como se indicó anteriormente, evitando cortes en la piel.
• Si salpicara a la piel, lávese con una solución de hipoclorito sódico y luego aclárese bien con abundante agua.
• Si salpicara a los ojos, límpiese cuidadosamente con abundante agua, o con una solución de limpieza ocular.
• Si el daño lo sufriera el propio operador, (si se corta o se pincha), proceda como se ha descrito anteriormente y tome las medidas médicas oportunas en función de la dosis inyectada.
Se deberán seguir estrictamente estas instrucciones de uso, manipulación y eliminación.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Allergan Pharmaceuticals Ireland
Westport
County Mayo
Irlanda
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
65.837
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización 12/Enero/ 2004 Fecha de la última renovación 20/Febrero/2008
10. FECHA DE LA REVISIÓN DEL TEXTO
Febrero 2015
16 de 16