Victoza 6 Mg/Ml Solucion Inyectable En Pluma Precargada
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
1. NOMBRE DEL MEDICAMENTO
Victoza 6 mg/ml solución inyectable en pluma precargada
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
1 ml de solución contiene 6 mg de liraglutida*. Una pluma precargada contiene 18 mg de liraglutida en 3 ml.
* análogo humano del péptido-1 similar al glucagón (GLP-1) producido por tecnología de ADN recombinante en Saccharomyces cerevisiae.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Solución inyectable.
Solución transparente, incolora o casi incolora e isotónica; pH=8,15.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Victoza está indicado en el tratamiento de adultos con diabetes mellitus tipo 2 para alcanzar el control glucémico en:
Monoterapia
Cuando la dieta y el ejercicio por sí solos no logran un control glucémico adecuado en pacientes en los que el uso de metformina se considera inadecuado debido a intolerancia o contraindicaciones.
Terapia combinada
En combinación con medicamentos hipoglucemiantes orales y/o insulina basal cuando estos, junto con dieta y ejercicio, no logran un control glucémico adecuado (ver secciones 4.4 y 5.1 para consultar los datos disponibles sobre las diferentes combinaciones).
4.2 Posología y forma de administración
Posología
Con el fin de mejorar la tolerancia gastrointestinal, la dosis inicial es de 0,6 mg de liraglutida al día. Transcurrida al menos una semana, debe incrementarse la dosis a 1,2 mg. Se espera que algunos pacientes se beneficien de un incremento en la dosis de 1,2 mg a 1,8 mg y, en función de la respuesta clínica, al menos una semana después, es posible aumentar la dosis a 1,8 mg para lograr así una nueva mejora del control glucémico. No se recomiendan dosis diarias superiores a 1,8 mg.
Es posible añadir Victoza a un tratamiento existente con metformina o a una terapia combinada de metformina y una tiazolidindiona. La dosis empleada de metformina y tiazolidindiona en ese momento puede mantenerse sin cambios.
Es posible añadir Victoza a un tratamiento existente con una sulfonilurea o a una terapia combinada de metformina y una sulfonilurea o una insulina basal. Cuando se añade Victoza a una terapia con sulfonilurea o insulina basal, se debe considerar la disminución de la dosis de la sulfonilurea o insulina basal para reducir el riesgo de hipoglucemia (ver sección 4.4).
No es necesario llevar a cabo un autocontrol glucémico con el fin de ajustar la dosis de Victoza. Sin embargo, al iniciar un tratamiento con Victoza en combinación con una sulfonilurea o una insulina basal, puede que sea necesario llevar a cabo un autocontrol glucémico con el fin de ajustar la dosis de la sulfonilurea o la insulina basal.
Poblaciones especiales
Pacientes de edad avanzada (>65 años)
No es necesario un ajuste de dosis en función de la edad. La experiencia terapéutica en pacientes >75 años es limitada (ver sección 5.2).
Insuficiencia renal
No es necesario un ajuste de dosis en pacientes con insuficiencia renal leve o moderada (aclaramiento de creatinina 60-90 ml/min y 30-59 ml/min respectivamente). No existe experiencia terapéutica en pacientes con insuficiencia renal grave (aclaramiento de creatinina por debajo de 30 ml/min). Actualmente no se puede recomendar el uso de Victoza en pacientes con disfunción renal grave, incluidos los pacientes con enfermedad renal en etapa terminal (ver sección 5.2).
Insuficiencia hepática
No se recomienda un ajuste de dosis en pacientes con insuficiencia hepática leve o moderada. No se recomienda el uso de Victoza en pacientes con insuficiencia hepática grave (ver sección 5.2).
Población pediátrica
No se ha establecido la seguridad y eficacia de Victoza en niños y adolescentes menores de 18 años (ver sección 5.1). No se dispone de datos.
Forma de administración
Victoza no se debe administrar por vía intravenosa o intramuscular.
Victoza se administra una vez al día en cualquier momento, con independencia de las comidas, y se puede inyectar de forma subcutánea en el abdomen, en el muslo o en la parte superior del brazo.
Tanto el lugar de inyección como el momento de la administración pueden modificarse sin necesidad de ajustar la dosis. No obstante, es preferible que Victoza se inyecte en torno a la misma hora del día, una vez que se haya elegido la hora del día más conveniente. Para más instrucciones sobre la administración, ver sección 6.6.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
No se debe utilizar liraglutida en pacientes con diabetes mellitus tipo 1 o para el tratamiento de la cetoacidosis diabética.
Liraglutida no es un sustituto de la insulina.
La experiencia en pacientes con insuficiencia cardiaca congestiva de clase I y II según la New York Heart Association (NYHA) es limitada y, por lo tanto, liraglutida se debe utilizar con precaución. No existe experiencia en pacientes con insuficiencia cardiaca congestiva de clase III y IV según la NYHA y, por lo tanto, liraglutida no se recomienda en estos pacientes.
La experiencia en pacientes con enfermedad inflamatoria intestinal y gastroparesia diabética es limitada. No se recomienda el uso de liraglutida en estos pacientes ya que se asocia a reacciones adversas gastrointestinales transitorias, como náuseas, vómitos y diarrea.
Pancreatitis aguda
El uso de agonistas del receptor de GLP-1 se ha asociado con un riesgo de desarrollar pancreatitis aguda. Se han notificado pocos casos de pancreatitis aguda. Se debe informar a los pacientes de los síntomas característicos de la pancreatitis aguda. Ante la sospecha de pancreatitis, se debe interrumpir el tratamiento con Victoza, y este no se debe reanudar si se confirma la pancreatitis aguda. Se debe extremar la precaución en pacientes con antecedentes de pancreatitis.
Enfermedad tiroidea
Se han notificado acontecimientos adversos tiroideos en ensayos clínicos que incluyen aumento de calcitonina en sangre, bocio y neoplasia tiroidea, especialmente en pacientes con enfermedad tiroidea pre-existente y, por lo tanto, liraglutida se debe utilizar con precaución.
Hipoglucemia
Los pacientes a los que se les administra liraglutida en combinación con una sulfonilurea o una insulina basal podrían presentar un riesgo mayor de hipoglucemia (ver sección 4.8). Es posible disminuir el riesgo de hipoglucemia reduciendo la dosis de sulfonilurea o insulina basal.
Deshidratación
Se han notificado signos y síntomas de deshidratación que incluyen insuficiencia renal y fallo renal agudo en pacientes en tratamiento con liraglutida. Se debe advertir a los pacientes en tratamiento con liraglutida de que existe un riesgo potencial de deshidratación relacionado con los efectos adversos gastrointestinales y de que tomen precauciones para evitar la pérdida de líquidos.
4.5 Interacción con otros medicamentos y otras formas de interacción
In vitro, liraglutida ha demostrado un potencial muy bajo de estar implicada en interacciones farmacocinéticas con otras sustancias activas relacionadas con el citocromo P450 y la unión a proteínas plasmáticas.
El leve retraso en el vaciamiento gástrico asociado a liraglutida puede influir en la absorción de medicamentos orales administrados de forma concomitante. Los estudios de interacción no han demostrado ningún retraso clínicamente significativo en la absorción y, por lo tanto, no se requiere ajuste de dosis. Pocos pacientes tratados con liraglutida notificaron al menos un episodio de diarrea grave. La diarrea puede influir en la absorción de medicamentos de administración oral concomitante.
Warfarina y otros derivados de la cumarina
No se han realizado estudios de interacciones. No se puede excluir una interacción clínicamente significativa con principios activos con escasa solubilidad o índice terapéutico estrecho, tales como la warfarina. Al inicio del tratamiento con liraglutida en pacientes tratados con warfarina u otros derivados de la cumarina, se recomienda un control de la INR (Razón Internacional Normalizada) más frecuente.
Paracetamol
Liraglutida no modificó la exposición general del paracetamol tras la administración de una dosis única de 1.000 mg. Se produjo una disminución del 31% en la Cmax de paracetamol y un retraso en el tmax medio de hasta 15 min. No es necesario un ajuste de dosis en el uso concomitante de paracetamol.
Atorvastatina
Liraglutida no modificó la exposición general de atorvastatina hasta un grado clínicamente significativo tras la administración de una dosis única de 40 mg de atorvastatina. Por lo tanto, no es necesario un ajuste de dosis de atorvastatina cuando se administra con liraglutida. Se produjo una disminución del 38% en la Cmax de atorvastatina y el tmax medio se retrasó de 1 h a 3 h con liraglutida.
Griseofulvina
Liraglutida no modificó la exposición general de la griseofulvina tras la administración de una dosis única de 500 mg de griseofulvina. Se produjo un aumento del 37% en la Cmax de griseofulvina y el tmax medio permaneció inalterado. No es necesario un ajuste de dosis de griseofulvina y otros componentes de baja solubilidad y alta permeabilidad.
Digoxina
La administración de una única dosis de 1 mg de digoxina con liraglutida produjo una reducción en la AUC de digoxina de un 16%; la Cmax disminuyó un 31%. Se produjo un retraso en el tmax medio de la digoxina de 1 h a 1,5 h. No es necesario un ajuste de dosis de digoxina en base a estos resultados.
Lisinopril
La administración de una única dosis de 20 mg de lisinopril con liraglutida mostró una reducción en la AUC de lisinopril de un 15%; la Cmax disminuyó un 27%. Se produjo un retraso en el tmax medio del lisinopril que pasó de 6 h a 8 h con liraglutida. No es necesario un ajuste de dosis de lisinopril en base a estos resultados.
Anticonceptivos orales
Tras la administración de una única dosis de un medicamento anticonceptivo oral, liraglutida disminuyó la Cmax de etinilestradiol y levonorgestrel un 12% y un 13% respectivamente. Se produjo un retraso en el tmax de alrededor de 1,5 h con liraglutida para ambos compuestos. No se observó ningún efecto clínicamente significativo sobre la exposición general ni al etinilestradiol ni al levonorgestrel. Se prevé por lo tanto que el efecto anticonceptivo permanezca inalterado cuando se administran de forma conjunta con liraglutida.
Insulina
No se han observado interacciones farmacocinéticas o farmacodinámicas entre liraglutida e insulina detemir, cuando se administra una dosis única de insulina detemir 0,5 U/kg con liraglutida 1,8 mg una vez alcanzada la homeostasia en pacientes con diabetes tipo 2.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No existen datos suficientes sobre la utilización de liraglutida en mujeres embarazadas. Los estudios en animales han mostrado toxicidad reproductiva (ver sección 5.3). Se desconoce el riesgo en seres humanos.
No se debe administrar liraglutida durante el embarazo, en su lugar se recomienda el uso de insulina. Se debe interrumpir el tratamiento con Victoza en caso de que una paciente desee quedarse embarazada o si se produce un embarazo.
Lactancia
Se desconoce si liraglutida se excreta en la leche materna. Estudios realizados en animales han
mostrado que la transferencia a la leche de liraglutida y metabolitos de estrecha relación estructural es baja. Estudios no clínicos han mostrado una reducción en el crecimiento neonatal relacionada con el tratamiento en crías de rata en periodo de lactancia (ver sección 5.3). Dada la falta de experiencia, no se debe usar Victoza durante el periodo de lactancia.
Fertilidad
Los estudios en animales no han revelado efectos nocivos relacionados con la fertilidad, aparte de una ligera disminución en el número de implantes vivos.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de Victoza sobre la capacidad para conducir y utilizar máquinas es nula o insignificante. Se debe advertir a los pacientes que extremen las precauciones para evitar una hipoglucemia mientras conducen y utilizan máquinas, en especial cuando se utilice Victoza en combinación con una sulfonilurea o una insulina basal.
4.8 Reacciones adversas
Resumen del perfil de seguridad
En cinco ensayos clínicos de gran tamaño a largo plazo, más de 2.500 pacientes recibieron tratamiento con Victoza solo o en combinación con metformina, una sulfonilurea (con o sin metformina) o metformina más rosiglitazona.
Las reacciones adversas notificadas con mayor frecuencia durante los ensayos clínicos fueron los trastornos gastrointestinales: náuseas y diarrea fueron muy frecuentes, mientras que vómitos, estreñimiento, dolor abdominal y dispepsia fueron frecuentes. Al inicio de la terapia, estas reacciones adversas gastrointestinales pueden aparecer con mayor frecuencia. Estas reacciones suelen disminuir una vez transcurridos algunos días o semanas de tratamiento continuado. También fueron frecuentes cefalea y nasofaringitis. Además, resultó ser frecuente la hipoglucemia, y muy frecuente si se utiliza liraglutida en combinación con una sulfonilurea. La hipoglucemia grave se ha observado principalmente cuando se combina con una sulfonilurea.
Tabla de reacciones adversas
En la Tabla 1 se enumeran las reacciones adversas notificadas en ensayos de fase 3 controlados a largo plazo y en notificaciones espontáneas (poscomercialización).
Las frecuencias de las notificaciones espontáneas relacionadas (poscomercialización) se han calculado en base a su incidencia en ensayos clínicos de fase 3.
Las frecuencias se definen del siguiente modo: muy frecuentes (>1/10); frecuentes (>1/100 a <1/10); poco frecuentes (>1/1.000 a <1/100); raras (>1/10.000 a <1/1.000); muy raras (<1/10.000); frecuencia no conocida (no puede estimarse a partir de los datos disponibles). Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
Tabla 1 Reacciones adversas en ensayos a largo plazo controlados de fase 3 y notificaciones espontáneas (poscomercialización)
|
Sistema de clasificación de órganos MedDRA |
Muy frecuentes |
Frecuentes |
Poco frecuentes |
Raras |
Muy raras |
|
Infecciones e infestaciones |
Nasofaringitis Bronquitis | ||||
|
Trastornos del sistema inmunológico |
Reacciones anafilácticas |
|
Trastornos del metabolismo y de la nutrición |
Hipoglucemia Anorexia Disminución del apetito |
Deshidratación | |||
|
Trastornos del sistema nervioso |
Cefalea Mareo | ||||
|
Trastornos cardiacos |
Aumento de la frecuencia cardiaca | ||||
|
Trastornos gastrointestinales |
Náuseas Diarrea |
Vómitos Dispepsia Dolor abdominal superior Estreñimiento Gastritis Flatulencia Distensión abdominal Enfermedad de reflujo gastroesofágico Malestar abdominal Dolor de muelas |
Obstrucción intestinal |
Pancreatitis (incluida pancreatitis necrosante) | |
|
Trastornos de la piel y del tejido subcutáneo |
Sarpullido |
Urticaria Prurito | |||
|
Trastornos renales y urinarios |
Insuficiencia renal Fallo renal agudo | ||||
|
Trastornos generales y alteraciones en el lugar de administración |
Fatiga Reacciones en el lugar de inyección |
Malestar | |||
|
Exploraciones complementarias |
Aumento de lipasa* Aumento de amilasa* |
* Solo de los ensayos clínicos controlados de fase 3b y 4 donde se midieron.
Descripción de las reacciones adversas seleccionadas
En un ensayo clínico con liraglutida en monoterapia, la frecuencia de hipoglucemia notificada con liraglutida resultó inferior a la frecuencia notificada por los pacientes tratados con un comparador activo (glimepirida). Las reacciones adversas notificadas con mayor frecuencia fueron trastornos gastrointestinales, infecciones e infestaciones.
Hipoglucemia
La mayoría de los episodios confirmados de hipoglucemia en los ensayos clínicos fueron leves. No se observaron episodios de hipoglucemia grave en el ensayo con liraglutida en monoterapia. Se puede producir con poca frecuencia hipoglucemia grave y se ha observado principalmente cuando liraglutida se combina con una sulfonilurea (0,02 casos/paciente año). Se observaron muy pocos episodios (0,001 casos/paciente año) al administrar liraglutida en combinación con antidiabéticos orales distintos de las sulfonilureas. El riesgo de hipoglucemia es bajo con el uso combinado de insulina basal y liraglutida (1,0 acontecimientos por paciente/año, ver sección 5.1).
Reacciones adversas gastrointestinales
Al combinar liraglutida con metformina, el 20,7% de los pacientes notificó al menos un episodio de náuseas y el 12,6% de los pacientes notificó al menos un episodio de diarrea. Al combinar liraglutida con una sulfonilurea, el 9,1% de los pacientes notificó al menos un episodio de náuseas y el 7,9% de los pacientes notificó al menos un episodio de diarrea. La mayor parte de los episodios fueron de leves a moderados y se produjeron de una forma dependiente de la dosis. Con el tratamiento continuado, la frecuencia y la gravedad disminuyeron en la mayoría de los pacientes que sufrieron náuseas en un primer momento.
Los pacientes mayores de 70 años pueden experimentar más efectos gastrointestinales al ser tratados con liraglutida.
Los pacientes con insuficiencia renal leve y moderada (aclaramiento de creatinina 60-90 ml/min y 3059 ml/min respectivamente) pueden experimentar más efectos gastrointestinales al ser tratados con liraglutida.
Interrupción del tratamiento
En los ensayos controlados a largo plazo (26 semanas o más) la incidencia de interrupción del tratamiento debido a las reacciones adversas fue del 7,8% en pacientes tratados con liraglutida y del 3,4% en pacientes tratados con el comparador. Las reacciones adversas más frecuentes que condujeron a la interrupción del tratamiento en pacientes tratados con liraglutida fueron náuseas (2,8% de los pacientes) y vómitos (1,5%).
Reacciones en el lugar de inyección
Se han notificado reacciones en el lugar de inyección en aproximadamente el 2% de los pacientes que recibieron Victoza en ensayos controlados a largo plazo (26 semanas o más). Estas reacciones, por lo general, han sido leves.
Pancreatitis
Durante los ensayos clínicos a largo plazo con Victoza, se han notificado pocos casos (<0,2%) de pancreatitis aguda. También se han notificado casos de pancreatitis durante su comercialización.
Reacciones alérgicas
Durante la comercialización de Victoza, se han notificado reacciones alérgicas que incluyen urticaria, sarpullido y prurito.
Durante la comercialización de Victoza, se han notificado pocos casos de reacciones anafilácticas con síntomas adicionales tales como hipotensión, palpitaciones, disnea y edema. Se han notificado pocos casos de angioedema (0,05%) durante todos los ensayos clínicos a largo plazo con Victoza,
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Apéndice V.
4.9 Sobredosis
Durante los ensayos clínicos y la comercialización, se han notificado casos de sobredosis de hasta 40 veces (72 mg) la dosis de mantenimiento recomendada. En general, los pacientes notificaron náuseas, vómitos y diarrea intensos. Ninguno de los pacientes notificó hipoglucemia grave. Todos los pacientes se recuperaron sin complicaciones.
En caso de sobredosis, se debe iniciar el tratamiento de soporte adecuado en función de los síntomas y signos clínicos del paciente.
PROPIEDADES FARMACOLÓGICAS
5.
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: fármacos utilizados en la diabetes, otros fármacos hipoglucemiantes, excluyendo las insulinas. Código ATC: A10BX07
Mecanismo de acción
Liraglutida es un análogo del GLP-1 con un 97% de homología de secuencia con el GLP-1 humano que se une al receptor de GLP-1 y lo activa. El receptor de GLP-1 es el objetivo del GLP-1 nativo, una hormona incretina endógena que potencia la secreción de insulina dependiente de la glucosa en las células beta pancreáticas. A diferencia del GLP-1 nativo, liraglutida tiene un perfil farmacocinético y farmacodinámico en humanos adecuado para su administración una vez al día. Tras la administración subcutánea, el perfil de acción retardada se basa en tres mecanismos: autoasociación, que tiene como resultado una absorción lenta, unión a la albúmina y una estabilidad enzimática superior con respecto a la dipeptidil peptidasa- 4 (DPP-4) y a la enzima endopeptidasa neutra (EPN), cuyo resultado es una semivida plasmática prolongada.
La acción de liraglutida es mediada a través de una interacción específica con los receptores de GLP-1, lo que produce un aumento del adenosín monofosfato cíclico (cAMP). Liraglutida estimula la secreción de insulina de un modo dependiente de la glucosa. De forma simultánea, liraglutida disminuye la secreción de glucagón inadecuadamente elevada, también de un modo dependiente de la glucosa. De manera que cuando la glucosa en sangre es elevada, se estimula la secreción de insulina y se inhibe la de glucagón. En cambio, durante la hipoglucemia, liraglutida disminuye la secreción de insulina y no afecta a la secreción de glucagón. El mecanismo hipoglucemiante también implica un retraso leve en el vaciamiento gástrico. Liraglutida reduce el peso corporal y la masa grasa corporal mediante mecanismos que implican una reducción del apetito y de la ingesta calórica.
El GLP-1 es un regulador fisiológico del apetito y de la ingesta de alimentos, pero el mecanismo exacto de acción no está completamente claro. En estudios llevados a cabo con animales, la administración periférica de liraglutida supuso la absorción en regiones específicas del cerebro implicadas en la regulación del apetito, donde liraglutida, a través de la activación específica del receptor de GLP-1 (GLP-1R) aumentó las señales de saciedad básicas y redujo las señales de hambre básicas que permitieron perder peso.
Efectos farmacodinámicos
Liraglutida tiene una duración de acción de 24 horas y mejora el control glucémico al disminuir la glucosa en sangre posprandial y en ayunas en pacientes con diabetes mellitus tipo 2.
Eficacia clínica y seguridad
Se han llevado a cabo cinco ensayos clínicos controlados, aleatorizados y de doble ciego para evaluar los efectos de liraglutida sobre el control glucémico (Tabla 2). El tratamiento con liraglutida produjo mejoras clínica y estadísticamente significativas en la hemoglobina glicosilada A1c (HbA1c), la glucosa plasmática en ayunas y la glucosa posprandial, en comparación con el placebo.
Estos ensayos incluyeron a 3.978 pacientes expuestos con diabetes tipo 2 (2.501 pacientes tratados con liraglutida), 53,7% hombres y 46,3% mujeres, 797 pacientes (508 tratados con liraglutida) tenían >65 años y 113 pacientes (66 tratados con liraglutida) tenían >75 años.
Se han llevado a cabo ensayos adicionales con liraglutida que incluyeron 1.901 pacientes en cuatro ensayos clínicos controlados, aleatorizados y abiertos (que incluyeron 464, 658, 323 y 177 sujetos) y un ensayo clínico controlado, aleatorizado y de doble ciego en sujetos con diabetes tipo 2 e insuficiencia renal moderada (279 pacientes).
• Control glucémico
Monoterapia
Liraglutida en monoterapia durante 52 semanas dio como resultado reducciones estadísticamente significativas y sostenidas de la HbAic en comparación con glimepirida 8 mg (-0,84% para 1,2 mg, -1,14% para 1,8 mg frente a -0,51% para el comparador) en pacientes tratados previamente con dieta y ejercicio o en monoterapia con antidiabéticos orales en no más de la dosis media-máxima (Tabla 2).
Combinación con antidiabéticos orales
Liraglutida en terapia combinada durante 26 semanas con metformina, glimepirida o metformina y rosiglitazona, dio como resultado reducciones estadísticamente significativas (p<0,0001) y sostenidas de la HbA1c en comparación con los pacientes que recibieron placebo (Tabla 2).
Tabla 2 Liraglutida en monoterapia (52 semanas) y en combinación con antidiabéticos orales
(26 semanas)_______
|
N |
Valor de referencia de HbA1c media (%) |
Cambio de HbA1c media respecto al valor de referencia (%) |
Pacientes (%) que lograron una HbAlc<7% |
Valor de referencia del peso medio (kg) |
Cambio del peso medio respecto al valor de referencia (kg) | |
|
Monoterapia | ||||||
|
Liraglutida 1,2 mg |
251 |
8,18 |
-0,841 |
42,81, 58,33 |
92,1 |
-2,05** |
|
Liraglutida 1,8 mg |
246 |
8,19 |
-1,14** |
50,91, 62,03 |
92,6 |
-2,45** |
|
Glimepirida 8 mg/día |
248 |
8,23 |
-0,51 |
27,81, 30,83 |
93,3 |
1,12 |
|
Añadida a metformina (2. |
000 mg/día) | |||||
|
Liraglutida 1,2 mg |
240 |
8,3 |
-0,97f |
35,31, 52,82 |
88,5 |
-2,58** |
|
Liraglutida 1,8 mg |
242 |
8,4 |
-1,00f |
42,41, 66,32 |
88,0 |
-2,79** |
|
Placebo |
121 |
8,4 |
0,09 |
10,81, 22,52 |
91,0 |
-1,51 |
|
Glimepirida 4 mg/día |
242 |
8,4 |
-0,98 |
36,31, 56,02 |
89,0 |
0,95 |
|
Añadida a glimepirida (4 |
mg/día) | |||||
|
Liraglutida 1,2 mg |
228 |
8,5 |
-1,08** |
34,51, 57,42 |
80,0 |
0,32** |
|
Liraglutida 1,8 mg |
234 |
8,5 |
-1,13** |
41,6\ 55,92 |
83,0 |
-0,23** |
|
Placebo |
114 |
8,4 |
0,23 |
7,51, 11,82 |
81,9 |
-0,10 |
|
Rosiglitazona 4 mg/día |
231 |
8,4 |
-0,44 |
21,91 36,12 |
80,6 |
2,11 |
|
Añadida a metformina (2.000 mg/día) + rosiglitazona (4 mg dos veces al día) | ||||||
|
Liraglutida 1,2 mg |
177 |
8,48 |
-1,48 |
57,51 |
95,3 |
-1,02 |
|
Liraglutida 1,8 mg |
178 |
8,56 |
-1,48 |
53,71 |
94,9 |
-2,02 |
|
Placebo |
175 |
8,42 |
-0,54 |
28,11 |
98,5 |
0,60 |
|
Añadida a metformina (2.000 mg/día) + glime¡ |
pirida (4 mg/día) | |||||
|
Liraglutida 1,8 mg |
230 |
8,3 |
-1,331 |
53,11 |
85,8 |
-1,81** |
|
Placebo |
114 |
8,3 |
-0,24 |
15,31 |
85,4 |
-0,42 |
|
Insulina glargina4 |
232 |
8,1 |
-1,09 |
45,81 |
85,2 |
1,62 |
*Superioridad (p<0,01) frente al comparador activo; **Superioridad (p<0,0001) frente al comparador activo; No-inferioridad (p<0,0001) frente al comparador activo
1todos los pacientes; 2monoterapia previa con antidiabéticos orales; 3 pacientes tratados previamente con dieta 4la posología de insulina glargina fue abierta y se aplicó de acuerdo la Directriz de titulación de insulina glargina. La titulación de la dosis de insulina glargina fue realizada por el paciente tras las instrucciones del investigador:
Directriz de titulación de insulina glargina
|
Automedición de glucosa plasmática en ayunas |
Aumento en la dosis de insulina glargina (UI) |
|
<5,5 mmol/l (<100 mg/dl) Objetivo |
No ajuste |
|
>5,5 y <6,7 mmol/l (>100 y <120 mg/dl) |
0-2 UIa |
a Según la recomendación individualizada del investigador en la última visita, por ejemplo en función de si el paciente ha sufrido hipoglucemia.
Combinación con insulina
En un ensayo clínico de 104 semanas, el 57% de los pacientes con diabetes tipo 2 tratados con insulina degludec en combinación con metformina alcanzaron el objetivo de HbA1c < 7%. El resto de pacientes continuaron en un ensayo abierto de 26 semanas y fueron aleatorizados para añadir a su tratamiento o liraglutida o una dosis única de insulina aspart (con la comida principal). En el brazo de insulina degludec + liraglutida, la dosis de insulina se redujo un 20% para minimizar el riesgo de hipoglucemia. La adición de liraglutida resultó en una mayor reducción, de forma estadísticamente significativa, de la HbA1c (-0,73% para liraglutida frente a -0,40% para el comparador) y del peso corporal (-3,03 frente a 0,72 kg). La tasa de episodios de hipoglucemia (por paciente/año de exposición) fue menor, de forma estadísticamente significativa, cuando se añadió liraglutida en comparación con la adición de una dosis única de insulina aspart (1,0 frente a 8,15; razón: 0,13; IC 95%: 0,08 a 0,21).
En un ensayo clínico de 52 semanas, la adición de insulina detemir a liraglutida 1,8 mg y metformina en pacientes que no alcanzan objetivos glucémicos con liraglutida y metformina solos, dio lugar a una disminución desde el nivel basal de la HbA1c de 0,54%, en comparación al 0,20% en el grupo control con liraglutida 1,8 mg y metformina. La pérdida de peso fue continua. Hubo un pequeño aumento en la tasa de episodios hipoglucémicos leves (0,23 frente a 0,03 acontecimientos por paciente/año).
Uso en pacientes con insuficiencia renal
En un ensayo doble ciego en el que se comparaba la eficacia y seguridad de liraglutida 1,8 mg frente a placebo como tratamiento añadido a la insulina y/o antidiabéticos orales en pacientes con diabetes tipo 2 e insuficiencia renal moderada, liraglutida fue superior al tratamiento con placebo en la reducción de la HbA1c después de 26 semanas (-1,05% vs -0,38%). Significativamente más pacientes alcanzaron una HbA1c por debajo del 7% con liraglutida en comparación con placebo (52,8% vs 19,5%). Se observó en ambos grupos una disminución del peso corporal: -2,4 kg con liraglutida vs -
1,09 kg con placebo. Existió un riesgo comparable de episodios hipoglucémicos entre los dos grupos de tratamiento. El perfil de seguridad de liraglutida fue, por lo general, similar al observado en otros estudios con liraglutida.
• Proporción de pacientes que consiguieron reducciones de HbA1c Tras 52 semanas, el tratamiento solo con liraglutida dio como resultado una proporción estadísticamente significativa mayor de pacientes que alcanzaron una HbA1c <6,5% en comparación con los pacientes que recibieron glimepirida (37,6% para 1,8 mg y 28,0% para 1,2 mg frente al 16,2% del comparador).
Tras 26 semanas, liraglutida en combinación con metformina, glimepirida, o metformina y rosiglitazona, dio como resultado una proporción estadísticamente significativa mayor de pacientes que alcanzaron una HbA1c <6,5% en comparación con los pacientes que recibieron estos medicamentos solos.
• Glucosa plasmática en ayunas
El tratamiento con liraglutida solo y en combinación con uno o dos antidiabéticos orales produjo una reducción de la glucosa plasmática en ayunas de 13-43,5 mg/dl (0,72-2,42 mmol/l). Esta reducción se observó en las primeras dos semanas de tratamiento.
• Glucosa posprandial
Liraglutida reduce la glucosa posprandial en las tres comidas diarias en 31-49 mg/dl (1,68-2,71 mmol/l). 1
basada en mediciones tales como el modelo de evaluación de la homeostasia para la función de la célula beta (HOMA-B) y la relación proinsulina/insulina. En un subgrupo de pacientes con diabetes tipo 2 (N=29) se demostró una mejora en la secreción de insulina de fase uno y dos tras 52 semanas de tratamiento con liraglutida.
• Peso corporal
Liraglutida sola y en combinación con metformina, metformina y glimepirida o metformina y rosiglitazona se asoció a una reducción de peso sostenida a lo largo de la duración de los ensayos en un rango entre 1,0 kg y 2,8 kg.
La reducción de peso observada fue más significativa cuanto mayor era el índice de masa corporal (IMC) basal.
• Evaluación cardiovascular
Presión arterial
A lo largo de la duración de los ensayos, liraglutida disminuyó la presión arterial sistólica una media de 2,3 a 6,7 mmHg desde los niveles basales y en comparación con el comparador activo, la disminución fue de 1,9 a 4,5 mmHg.
El análisis post-hoc de los principales acontecimientos adversos cardiovasculares graves (muerte cardiovascular, infarto de miocardio, accidente cerebrovascular) de todos los ensayos en fase 2 y 3 a medio y largo plazo (que van desde 26 hasta 100 semanas de duración), que incluyeron 5.607 pacientes (3.651 expuestos a liraglutida), no mostraron ningún aumento del riesgo cardiovascular (razón entre las incidencias de 0,75 (95% IC 0,35; 1,63) para la variable de resultado combinada para liraglutida frente a todos los comparadores (metformina, glimepirida, rosiglitazona, insulina glargina, placebo)). Los pacientes con alto riesgo cardiovascular fueron excluidos de los ensayos y la incidencia de los principales acontecimientos cardiovasculares graves en los ensayos fueron bajas (6,02 por 1.000 pacientes/año en pacientes tratados con liraglutida y 10,45 en pacientes tratados con todos los comparadores), descartando conclusiones firmes.
• Inmunogenicidad
De acuerdo a las propiedades potencialmente inmunogénicas de los medicamentos que contienen proteínas o péptidos, los pacientes pueden desarrollar anticuerpos antiliraglutida tras el tratamiento con liraglutida. Como promedio, el 8,6% de los pacientes desarrolló anticuerpos. La formación de anticuerpos no se ha asociado con una reducción en la eficacia de liraglutida.
Población pediátrica
La Agencia Europea de Medicamentos ha concedido al titular un aplazamiento para presentar los resultados de los ensayos realizados con Victoza en uno o más grupos de la población pediátrica en diabetes mellitus tipo 2 (ver sección 4.2 para consultar la información sobre el uso en población pediátrica).
Otros datos clínicos
En un ensayo abierto en el que se comparaba la eficacia y seguridad de liraglutida (1,2 mg y 1,8 mg) y sitagliptina (un inhibidor DPP-4, 100 mg) en pacientes mal controlados con tratamiento de metformina (HbAJc media 8,5%), liraglutida a ambas dosis fue estadísticamente superior al tratamiento con sitaglipina en la reducción de la HbA1c después de 26 semanas (-1,24%, -1,50% vs -0,90%, p<0,0001). Los pacientes tratados con liraglutida tuvieron una pérdida de peso corporal significativa comparado con la de los pacientes tratados con sitagliptina (-2,9 kg y -3,4 kg vs -1,0 kg, p<0,0001). Una mayor proporción de pacientes tratados con liraglutida experimentaron náuseas transitorias frente a los pacientes tratados con sitagliptina (20,8% y 27,1% para liraglutida vs. 4,6% para sitagliptina). Las reducciones de HbAJc y la superioridad frente a sitagliptina observada después de 26 semanas de tratamiento con liraglutida (1,2 mg y 1,8 mg) se mantuvieron después de 52 semanas de tratamiento (-1,29% y -1,51% vs -0,88%, p<0,0001). El cambio de tratamiento con sitagliptina a tratamiento con liraglutida a pacientes después de 52 semanas de tratamiento, dio como resultado una reducción adicional y estadísticamente significativa de la HbAic (-0,24% y -0,45%, 95% IC: -0,41 a -0,07 y -0,67 a -0,23) en la semana 78, pero no hubo grupo control formal.
En un ensayo abierto en el que se comparaba la eficacia y seguridad de liraglutida 1,8 mg una vez al día y exenatida 10 mcg dos veces al día en pacientes mal controlados en tratamiento con metformina y/o sulfonilurea (HbA1c media 8,3%), liraglutida fue estadísticamente superior al tratamiento con exenatida en la reducción de la HbA1c después de 26 semanas (-1,12% vs -0,79%; diferencia estimada del tratamiento (-0,33, 95% IC: -0,47 hasta -0,18). Un número de pacientes significativamente superior alcanzó una HbA1c por debajo de 7% con liraglutida frente a exenatida (54,2% vs 43,4%, p=0,0015). Ambos tratamientos dieron como resultado una pérdida de peso corporal media de aproximadamente 3 kg. El cambio de tratamiento con exenatida a tratamiento con liraglutida a pacientes después de 26 semanas, dio como resultado una reducción adicional y estadísticamente significativa de la HbA1c (-0,32%, 95% IC: -0,41 a -0,24) en la semana 40, pero no hubo grupo control formal. Durante las 26 semanas hubo 12 acontecimientos graves en 235 pacientes (5,1%) que estaban en tratamiento con liraglutida, mientras que con exenatida hubo 6 acontecimientos graves en 232 pacientes (2,6%). No hubo un patrón coherente en relación al sistema de clasificación de órganos de los acontecimientos.
En un ensayo abierto en el que se comparaba la eficacia y seguridad de liraglutida 1,8 mg con lixisenatida 20 mcg en 404 pacientes mal controlados en tratamiento con metformina (HbA1c media 8,4%), liraglutida fue superior a lixisenatida en la reducción de la HbA1c después de 26 semanas de tratamiento (-1,83% vs. -1,21%, p<0,0001). Un número de pacientes significativamente superior alcanzó una HbA1c por debajo de 7% con liraglutida frente a lixisenatida (74,2% vs. 45,5%, p<0,0001), así como el objetivo de HbA1c inferior o igual a 6,5% (54,6% vs. 26,2%, p<0,0001). Se observó una pérdida de peso corporal en ambos grupos de tratamiento (-4,3 kg con liraglutida y -3,7 kg con lixisenatida). Se notificaron efectos adversos gastrointestinales más frecuentemente en el tratamiento con liraglutida (43,6% vs. 37,1%).
5.2 Propiedades farmacocinéticas
Absorción
La absorción de liraglutida tras la administración por vía subcutánea es lenta, alcanzando su concentración máxima a las 8-12 horas tras su administración. La concentración máxima estimada de liraglutida fue de 9,4 nmol/l para una única dosis subcutánea de 0,6 mg de liraglutida. Con dosis de 1,8 mg de liraglutida, la media de la concentración en estado estacionario de liraglutida (AUCt/24) alcanzó aproximadamente los 34 nmol/l. La exposición a liraglutida incrementó de forma proporcional a la dosis. El coeficiente de variación intraindividual para el AUC de liraglutida fue del 11% con la administración de una única dosis.
La biodisponibilidad absoluta de liraglutida tras su administración por vía subcutánea es de aproximadamente un 55%.
Distribución
El volumen de distribución aparente tras la administración por vía subcutánea es de 11-17 l. El volumen medio de distribución tras la administración intravenosa de liraglutida es de 0,07 l/kg. Liraglutida se encuentra ampliamente ligada a proteínas plasmáticas (>98%).
Biotransformación
Durante 24 horas tras la administración de una única dosis radiomarcada de [3H]-liraglutida a sujetos sanos, el componente mayoritario en plasma fue liraglutida intacta. Se detectaron dos metabolitos minoritarios en el plasma (<9% y <5% de la exposición a radioactividad plasmática total). Liraglutida se metaboliza de un modo similar al de las grandes proteínas sin que se haya identificado un órgano específico como ruta principal de eliminación.
Tras una dosis de [3H]-liraglutida, no se detectó liraglutida intacta en orina o heces. Únicamente una proporción menor de la radioactividad administrada se excretó en forma de metabolitos relacionados con liraglutida a través de orina o heces (6% y 5% respectivamente). La radiactividad en orina y heces se excretó principalmente durante los primeros 6-8 días y correspondió a tres metabolitos minoritarios respectivamente.
El aclaramiento medio tras la administración por vía subcutánea de una única dosis de liraglutida es de aproximadamente 1,2 l/h con una vida media de eliminación de aproximadamente 13 horas.
Poblaciones especiales
Pacientes de edad avanzada:
La edad no tuvo ningún efecto clínicamente relevante sobre la farmacocinética de liraglutida según los resultados de un ensayo farmacocinético realizado en sujetos sanos y del análisis de datos farmacocinéticos de la población en pacientes (entre 18 y 80 años).
Sexo:
El sexo no tuvo ningún efecto clínicamente significativo sobre la farmacocinética de liraglutida según los resultados del análisis de datos farmacocinéticos de la población en pacientes de sexo masculino y femenino y de un ensayo farmacocinético realizado en sujetos sanos.
Origen étnico:
El origen étnico no tuvo ningún efecto clínicamente relevante sobre la farmacocinética de liraglutida según los resultados del análisis farmacocinético de la población en el que se incluyeron pacientes de grupos de población blanca, negra, asiática e hispanoamericana.
Obesidad:
El análisis farmacocinético de la población sugiere que el índice de masa corporal (IMC) no tiene ningún efecto significativo sobre la farmacocinética de liraglutida.
Insuficiencia hepática:
Se evaluó la farmacocinética de liraglutida en pacientes con diversos grados de insuficiencia hepática en un ensayo de dosis única. La exposición a liraglutida disminuyó un 13-23% en pacientes con insuficiencia hepática de leve a moderada en comparación con los sujetos sanos.
La exposición fue significativamente menor (44%) en pacientes con insuficiencia hepática grave (puntuación Child Pugh >9).
Insuficiencia renal:
La exposición a liraglutida disminuyó en pacientes con insuficiencia renal en comparación con los individuos con una función renal normal. La exposición a liraglutida disminuyó un 33%, un 14%, un 27% y un 26% en pacientes con insuficiencia renal leve (aclaramiento de creatinina, CrCl 5080 ml/min), moderada (CrCl 30-50 ml/min) y grave (CrCl <30 ml/min) y con enfermedad renal en etapa terminal con necesidad de diálisis, respectivamente.
Del mismo modo, en un ensayo clínico de 26 semanas, los pacientes con diabetes tipo 2 e insuficiencia renal moderada (CrCl 30-59 ml/min, ver sección 5.1) tuvieron una exposición a liraglutida un 26% menor en comparación con pacientes con diabetes tipo 2 y función renal normal o insuficiencia renal leve que fueron incluidos en otro ensayo.
5.3 Datos preclínicos sobre seguridad
Los datos de los estudios no clínicos no muestran riesgos especiales para los seres humanos según los estudios convencionales de farmacología de seguridad, toxicidad a dosis repetidas o genotoxicidad.
Se observaron tumores no letales en células C de tiroides en estudios de carcinogenicidad de dos años en ratas y ratones. En ratas no se ha observado el nivel sin efecto adverso observado (NOAEL). Estos tumores no se observaron en monos tratados durante 20 meses. Estos hallazgos en roedores están provocados por un mecanismo específico no genotóxico mediado por el receptor GLP-1 al que los roedores son especialmente sensibles. La relevancia en humanos es probablemente baja pero no se puede excluir completamente. No se ha detectado ningún otro tumor relacionado con el tratamiento.
Los estudios en animales no sugieren efectos perjudiciales directos en términos de fertilidad, pero sí un leve aumento de las muertes embrionarias tempranas a la dosis más alta. La administración de Victoza durante el periodo intermedio de gestación provocó una reducción en el peso de la madre y en el crecimiento del feto con efectos no claros sobre las costillas en ratas y en la variación esquelética en el conejo. El crecimiento neonatal se redujo en el caso de las ratas durante su exposición a Victoza y continuó durante el periodo de destete en el grupo de dosis elevada. Se desconoce si la disminución en el crecimiento de las crías se debe a una reducción en la ingesta de leche debido a un efecto directo del GLP-1 o a una reducción de la producción de leche materna a causa de una disminución de la ingesta calórica.
Después de la inyección intraarterial de liraglutida a conejos, se observaron hemorragias de leves a moderadas, eritema e hinchazón en el lugar de inyección.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Fosfato disódico dihidrato
Propilenglicol
Fenol
Agua para preparaciones inyectables
6.2 Incompatibilidades
Las sustancias añadidas a Victoza pueden provocar la degradación de liraglutida. En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros.
6.3 Periodo de validez
30 meses.
Después de la primera utilización: 1 mes.
6.4 Precauciones especiales de conservación
Conservar en nevera (entre 2°C y 8°C).
No congelar.
Conservar lejos del congelador.
Después del primer uso: conservar por debajo de 30°C o en nevera (entre 2°C y 8°C). No congelar. Conservar la pluma con el capuchón puesto para protegerla de la luz.
6.5 Naturaleza y contenido del envase
Cartucho (vidrio tipo 1) con un émbolo (bromobutilo) y un tapón (bromobutilo/poliisopreno) dentro de una pluma precargada desechable multidosis hecha de poliolefina y poliacetal.
Cada pluma contiene 3 ml de solución, pudiendo suministrar 30 dosis de 0,6 mg, 15 dosis de 1,2 mg o 10 dosis de 1,8 mg.
Envases con 1, 2, 3, 5 o 10 plumas precargadas.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Victoza no se debe utilizar si no tiene un aspecto transparente e incoloro o casi incoloro.
Victoza no se debe utilizar si se ha congelado.
Victoza se puede administrar con agujas de una longitud de hasta 8 mm y un grosor de 32G o mayor. La pluma está diseñada para su utilización con agujas desechables NovoFine o NovoTwist.
Las agujas no están incluidas.
Se debe indicar al paciente que deseche la aguja después de cada inyección de acuerdo a las normativas locales y que conserve la pluma sin la aguja puesta. De esta forma se evita la contaminación, las infecciones y la pérdida de producto. Así también se garantiza que la dosificación es precisa.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Novo Nordisk A/S Novo Allé DK-2880 Bagsv^rd Dinamarca
8. NÚMERO DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/09/529/001-005
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización 30/Junio/2009 Fecha de la última renovación 11/Abril/2014
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
A. FABRICANTE DEL PRINCIPIO ACTIVO BIOLÓGICO Y FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
A. FABRICANTE DEL PRINCIPIO ACTIVO BIOLÓGICO Y FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección del fabricante del principio activo biológico
Novo Nordisk A/S Hallas Allé DK-4400 Kalundborg Dinamarca
Nombre y dirección del fabricante responsable de la liberación de los lotes
Novo Nordisk A/S Novo Allé DK-2880 Bagsv^rd Dinamarca
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica.
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
Los requerimientos para la presentación de los informes periódicos de seguridad para este medicamento se establecen en la lista de fechas de referencia de la Unión (lista EURD) prevista en el artículo 107quater, apartado 7, de la Directiva 2001/83/CE y las posteriores actualizaciones publicadas en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado en la versión del PGR incluido en el Módulo 1.8.2 de la Autorización de Comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos.
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva
información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
Victoza 6 mg/ml solución inyectable en pluma precargada Liraglutida
1 ml contiene 6 mg de liraglutida. Una pluma precargada contiene 18 mg de liraglutida
Fosfato disódico dihidrato, propilenglicol, fenol y agua para preparaciones inyectables
Solución inyectable.
1 pluma
2 plumas
3 plumas 5 plumas 10 plumas
Cada pluma contiene 3 ml de solución, pudiendo suministrar 30 dosis de 0,6 mg, 15 dosis de 1,2 mg o 10 dosis de 1,8 mg.
Leer el prospecto antes de utilizar este medicamento.
Vía subcutánea
La pluma Victoza está diseñada para su utilización con agujas desechables NovoFine o NovoTwist. Las agujas no están incluidas.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
No conservar la pluma con la aguja puesta. Para ser utilizado por una sola persona
8. FECHA DE CADUCIDAD
CAD
Deseche la pluma 1 mes después del primer uso.
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Conservar en nevera. No congelar.
Después del primer uso, conservar la pluma por debajo de 30°C o en nevera. No congelar. Conservar la pluma con el capuchón puesto para protegerla de la luz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Novo Nordisk A/S Novo Allé DK-2880 Bagsv^rd Dinamarca
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/09/529/001 1 x 3 ml EU/1/09/529/002 2 x 3 ml EU/1/09/529/003 3 x 3 ml EU/1/09/529/004 5 x 3 ml EU/1/09/529/005 10 x 3 ml
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Victoza
INFORMACIÓN MÍNIMA QUE DEBE INCLUIRSE EN PEQUEÑOS ACONDICIONAMIENTOS PRIMARIOS
ETIQUETA DE PLUMA PRECARGADA_
1. NOMBRE DEL MEDICAMENTO Y VÍA DE ADMINISTRACIÓN
Victoza 6 mg/ml inyectable
Liraglutida
Vía subcutánea
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
3 ml
6. OTROS
Novo Nordisk A/S
B. PROSPECTO
Victoza 6 mg/ml solución inyectable en pluma precargada
Liraglutida
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico, farmacéutico o enfermero.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico, farmacéutico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es Victoza y para qué se utiliza
2. Qué necesita saber antes de empezar a usar Victoza
3. Cómo usar V ictoza
4. Posibles efectos adversos
5. Conservación de Victoza
6. Contenido del envase e información adicional
1. Qué es Victoza y para qué se utiliza
Victoza contiene el principio activo liraglutida. Ayuda a su cuerpo a reducir su nivel de azúcar en sangre únicamente cuando este nivel de azúcar está demasiado elevado. Además hace más lento el paso de los alimentos por su estómago.
Victoza se utiliza él solo si su nivel de azúcar en sangre no está controlado de forma adecuada únicamente con dieta y ejercicio, y no puede utilizar metformina (otro medicamento para la diabetes).
Victoza se utiliza junto con otros medicamentos para la diabetes, cuando estos no son suficientes para controlar su nivel de azúcar en sangre. Estos pueden ser:
• antidiabéticos orales (medicamentos como metformina, pioglitazona, sulfonilurea) y/o insulina basal, un tipo de insulina que funciona durante todo el día.
2. Qué necesita saber antes de empezar a usar Victoza No use Victoza
- si es alérgico a liraglutida o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
Advertencias y precauciones
Consulte a su médico, farmacéutico o enfermero:
• antes de empezar a usar Victoza.
• si usted tiene o ha tenido una enfermedad del páncreas.
Este medicamento no debe utilizarse si tiene diabetes tipo 1 (su cuerpo no produce nada de insulina) o cetoacidosis diabética (una complicación de la diabetes que se caracteriza por un alto nivel de azúcar en sangre y un aumento del esfuerzo para respirar). No es una insulina y, por lo tanto, no se debe utilizar como un sustituto de insulina.
No se recomienda el uso de Victoza si tiene una enfermedad renal grave o está en diálisis.
No se recomienda el uso de Victoza si tiene una enfermedad hepática grave.
Hay poca o ninguna experiencia con este medicamento en pacientes con insuficiencia cardiaca. No está recomendado si padece insuficiencia cardiaca grave.
No se recomienda este medicamento si tiene un problema grave de estómago o de intestino que produce un retraso del vaciado del estómago (llamado gastroparesia), o enfermedad inflamatoria intestinal.
Si presenta síntomas de pancreatitis aguda, como dolor de estómago intenso y continuo, debe consultar a su médico inmediatamente (ver sección 4).
Si padece enfermedad de tiroides, incluyendo nódulos tiroideos y aumento de tamaño de la glándula tiroides, consulte a su médico.
En algunos casos, cuando se inicia un tratamiento con Victoza, se puede experimentar una deshidratación (pérdida de líquidos), por ejemplo, en caso de sufrir vómitos, náuseas y diarrea. Es importante evitar la deshidratación bebiendo mucho líquido. Hable con su médico si tiene alguna duda.
Niños y adolescentes
Victoza no está recomendado en niños y adolescentes menores de 18 años ya que la seguridad y eficacia no se han establecido todavía en estos grupos de edad.
Uso de Victoza con otros medicamentos
Informe a su médico, farmacéutico o enfermero si está utilizando, ha utilizado recientemente o pudiera tener que utilizar cualquier otro medicamento.
En concreto, informe a su médico, farmacéutico o enfermero si está utilizando medicamentos que contengan alguno de los siguientes principios activos:
• Sulfonilurea (como glimepirida o glibenclamida). Puede sufrir hipoglucemia (nivel de azúcar en sangre bajo) cuando utilice Victoza junto con una sulfonilurea, ya que las sulfonilureas aumentan el riesgo de hipoglucemia. Cuando empiece a utilizar estos medicamentos juntos por primera vez, su médico puede indicarle que reduzca la dosis de sulfonilurea. Para consultar los síntomas de aviso de una bajada de azúcar en sangre, ver sección 4. Si también está tomando una sulfonilurea (como glimepirida o glibenclamida), su médico puede solicitarle un análisis de sus niveles de azúcar en sangre. Esto ayudará a su médico a decidir si es necesario cambiar la dosis de sulfonilurea.
• Warfarina u otros medicamentos anticoagulantes. Pueden ser necesarios análisis de sangre más frecuentes para determinar la capacidad de coagulación de su sangre.
Embarazo y lactancia
Informe a su médico si está embarazada, si cree que puede estarlo o si planea estarlo. Victoza no debe utilizarse durante el embarazo porque se desconoce si podría dañar al feto.
Se desconoce si Victoza pasa a la leche materna, por tanto, no utilice este medicamento durante el periodo de lactancia.
Conducción y uso de máquinas
El bajo nivel de azúcar en sangre (hipoglucemia) puede reducir su capacidad de concentración. Evite conducir o usar máquinas si experimenta síntomas de hipoglucemia. Ver sección 4 para consultar los síntomas de aviso de una bajada de azúcar en sangre. Consulte a su médico para más información.
3. Cómo usar Victoza
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico.
En caso de duda, consulte de nuevo a su médico, farmacéutico o enfermero.
• La dosis inicial es 0,6 mg una vez al día, durante al menos una semana.
• Su médico le indicará cuándo aumentar esa dosis a 1,2 mg una vez al día.
• Su médico puede indicarle que siga aumentando la dosis a 1,8 mg una vez al día, si su glucosa
en sangre no se controla adecuadamente con una dosis de 1,2 mg.
No cambie la dosis a menos que su médico se lo indique.
Victoza se administra como una inyección bajo la piel (subcutánea). No la inyecte en una vena o músculo. Las mejores zonas para la inyección son la parte frontal del muslo, la zona del abdomen o la parte superior del brazo.
Puede administrarse la inyección en cualquier momento del día, con independencia de las comidas. Una vez que haya decidido la hora del día más conveniente, es preferible que se inyecte Victoza en torno a la misma hora del día.
Antes de utilizar la pluma por primera vez, su médico o enfermero le mostrarán cómo utilizarla.
En la otra cara de este prospecto encontrará instrucciones detalladas sobre su uso.
Si usa más Victoza del que debe
Si usa más Victoza del que debe, consulte con su médico inmediatamente. Puede que necesite tratamiento médico. Puede que experimente náuseas, vómitos o diarrea.
Si olvidó usar Victoza
Si olvida una dosis, use Victoza tan pronto como se acuerde.
Sin embargo, si han pasado más de 12 horas desde que debería haber usado Victoza, sáltese la dosis olvidada. Adminístrese la siguiente dosis, al día siguiente, como de costumbre.
No use una dosis doble o aumente la dosis del día siguiente para compensar la dosis olvidada.
Si interrumpe el tratamiento con Victoza
No interrumpa el tratamiento con Victoza sin consultar con su médico. Si lo interrumpe, puede que aumenten sus niveles de azúcar en sangre.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico, farmacéutico o enfermero.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no
todas las personas los sufran.
Efectos adversos graves
Frecuentes: pueden afectar hasta 1 de cada 10 personas
• Hipoglucemia (nivel de azúcar en sangre bajo). Los síntomas de aviso de una bajada de azúcar en sangre pueden aparecer repentinamente e incluir: sudor frío, piel fría y pálida, dolor de cabeza, palpitaciones, náuseas, apetito excesivo, trastornos visuales, somnolencia, sensación de debilidad, nerviosismo, ansiedad, confusión, dificultad de concentración y temblores. Su médico le indicará cómo tratar el bajo nivel de azúcar en sangre y qué tiene que hacer en el caso de que observe estos síntomas de aviso. Esto es más probable que suceda si también utiliza una sulfonilurea o insulina basal. Puede que su médico reduzca su dosis de estos medicamentos antes de que empiece a usar Victoza.
Raros: pueden afectar hasta 1 de cada 1.000 personas
• Una reacción alérgica grave (reacción anafiláctica) con síntomas adicionales tales como problemas respiratorios, hinchazón de la garganta y de la cara, palpitaciones, etc. Si nota alguno de estos síntomas, busque ayuda médica inmediatamente y consulte a su médico tan pronto como sea posible.
• Obstrucción intestinal. Una forma grave de estreñimiento con síntomas adicionales tales como dolor de estómago, hinchazón, vómitos, etc.
Muy raros: pueden afectar hasta 1 de cada 10.000 personas
• Casos de inflamación del páncreas (pancreatitis). La pancreatitis puede ser una enfermedad grave y potencialmente mortal. Deje de usar Victoza y contacte con su médico inmediatamente si usted nota alguno de los siguientes efectos adversos graves:
dolor intenso y persistente en el abdomen (zona del estómago) que puede llegar hasta la espalda, así como náuseas y vómitos, ya que podría ser un signo de una inflamación del páncreas (pancreatitis).
Otros efectos adversos
Muy frecuentes: pueden afectar a más de 1 de cada 10 personas
• Náuseas. Este efecto desaparece normalmente con el tiempo.
• Diarrea. Este efecto desaparece normalmente con el tiempo.
Frecuentes
• Vómitos.
Cuando se inicia el tratamiento con Victoza, en algunos casos se puede experimentar pérdida de líquidos/deshidratación. Por ejemplo en caso de vómitos, náuseas y diarrea. Es importante evitar la deshidratación bebiendo mucho líquido.
• Dolor de cabeza
• Indigestión
• Estómago inflamado (gastritis). Los síntomas incluyen dolor de estómago, náuseas y vómitos.
• Enfermedad de reflujo gastroesofágico (ERGE). Los síntomas incluyen pirosis.
• Vientre (abdomen) hinchado o dolor abdominal
• Malestar abdominal
• Estreñimiento
• Gases (flatulencia)
• Disminución del apetito
• Bronquitis
• Resfriado común
• Mareos
• Pulso acelerado
• Cansancio
• Dolor de muelas
• Reacciones en el lugar de la inyección (hematomas, dolor, irritación, picor y sarpullido).
• Aumento de las enzimas pancreáticas (como lipasa y amilasa).
Poco frecuentes: pueden afectar hasta 1 de cada 100 personas
• Reacciones alérgicas tales como prurito (picor) y urticaria (un tipo de sarpullido cutáneo)
• Deshidratación, a veces con una disminución de la función renal
• Malestar (no sentirse bien).
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
Conservación de Victoza
5.
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la etiqueta y en la caja de la pluma después de CAD. La fecha de caducidad es el último día del mes que se indica.
Antes de usar:
Conservar en nevera (entre 2°C y 8°C). No congelar. Mantener alejado del congelador.
Durante el uso:
Puede conservar la pluma durante un mes si se almacena por debajo de 30°C o en nevera (entre 2°C y 8°C), alejado del congelador. No congelar.
Cuando no se utilice, conservar la pluma con el capuchón puesto para protegerla de la luz.
No utilice este medicamento si observa que la solución no es transparente e incolora o casi incolora.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de Victoza
- El principio activo es liraglutida. 1 ml de solución inyectable contiene 6 mg de liraglutida. Una pluma precargada contiene 18 mg de liraglutida.
- Los demás componentes son fosfato disódico dihidrato, propilenglicol, fenol y agua para preparaciones inyectables.
Aspecto del producto y contenido del envase
Victoza se suministra como una solución inyectable transparente, incolora o casi incolora en una pluma precargada. Cada pluma contiene 3 ml de solución, pudiendo suministrar 30 dosis de 0,6 mg, 15 dosis de 1,2 mg o 10 dosis de 1,8 mg.
Victoza está disponible en envases de 1, 2, 3, 5 o 10 plumas. Puede que solamente estén comercializados algunos tamaños de envases.
Las agujas no están incluidas.
Titular de la autorización de comercialización y responsable de la fabricación
Novo Nordisk A/S Novo Allé DK-2880 Bagsv^rd Dinamarca
Fecha de la última revisión de este prospecto:
Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu/
INSTRUCCIONES DE USO DE LA PLUMA VICTOZA
Lea detenidamente estas instrucciones antes de utilizar su pluma.
Su pluma contiene 18 mg de liraglutida. Puede seleccionar dosis de 0,6 mg, 1,2 mg y 1,8 mg.
La pluma está diseñada para ser utilizada con agujas de inyección desechables NovoFine o NovoTwist de una longitud de hasta 8 mm y un grosor de 32G o mayor (0,25/0,23 mm).
Aguja (ejemplo)
Capuchón Capuchón
exterior de interior de Lengüeta
la aguja la aguja Aguja de papel
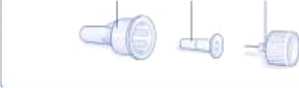

Pluma Victoza

Símbolo de comprobación de fluj o

Preparación de la pluma
Compruebe el nombre y el color de la etiqueta de su
pluma para asegurarse de que contiene liraglutida. El uso de un medicamento incorrecto podría producirle graves daños.
Retire el capuchón de la pluma.
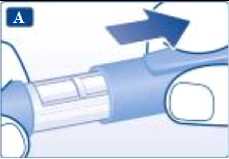
Retire la lengüeta de papel de una nueva aguja desechable. Enrosque recta y firmemente la aguja en la pluma.
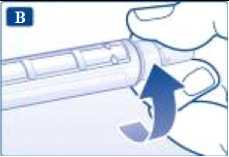
Retire el capuchón exterior de la aguja y guárdelo para más tarde.
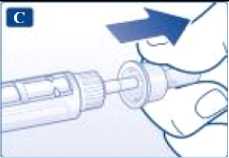
Retire el capuchón interior de la aguja y deséchelo.
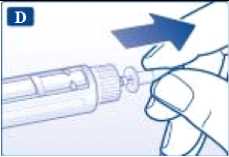
A Utilice siempre una aguja nueva para cada inyección. Así se reduce el riesgo de contaminación, infección, pérdida de liraglutida, que las agujas se atasquen y las dosificaciones inexactas.
A Tenga cuidado de no doblar o dañar la aguja.
A No intente volver a poner nunca el capuchón interior de la aguja. Podría pincharse con la
Mantenimiento de su pluma
• No trate de reparar la pluma o desmontarla.
• Mantenga la pluma alejada del polvo, la suciedad y todo tipo de líquidos.
• Limpie la pluma con un paño humedecido en un detergente suave.
• No trate de lavarla, sumergirla o lubricarla; esto puede dañar la pluma._
A Información importante
• No comparta su pluma o agujas con ninguna otra persona.
• Mantenga su pluma fuera del alcance de otras personas, especialmente de los niños. Con cada nueva pluma, compruebe el flujo
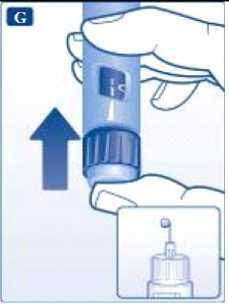
Compruebe el flujo antes de la primera inyección con cada pluma nueva. Si su pluma está ya en uso, vaya a “Selección de la dosis”, paso H.
Gire el selector de dosis hasta que el indicador señale el símbolo de comprobación de flujo.

Sujete la pluma con la aguja apuntando hacia arriba. Golpee el cartucho suavemente con el dedo varias veces. De este modo las burbujas de aire se concentran en la parte superior del cartucho.
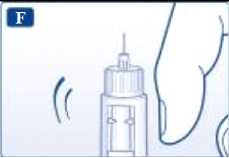
Mantenga la aguja hacia arriba y pulse el pulsador hasta que el indicador señale 0 mg.
Una gota de liraglutida debe aparecer en la punta de la aguja. Si no aparece ninguna gota, repita los pasos E a G hasta cuatro veces.
Si aún no se ve ninguna gota de liraglutida, cambie la aguja y repita los pasos E a G una vez más.
No use la pluma si todavía no ha aparecido una gota de liraglutida. Esto indica que la pluma está defectuosa y debe utilizar una nueva.
A Si se le ha caído la pluma en una superficie dura o sospecha que no funciona correctamente, _coloque siempre una nueva aguja desechable y compruebe el flujo antes de utilizarla._
Selección de la dosis
Compruebe siempre que el indicador señala 0 mg.
Gire el selector de dosis hasta que el indicador señale la dosis necesaria (0,6 mg, 1,2 mg o 1,8 mg).
Si selecciona por error una dosis equivocada, para cambiarla solo hay que girar el selector de dosis hacia atrás o hacia delante hasta que el indicador señale la dosis correcta.
Tenga cuidado de no presionar el pulsador de inyección mientras gira el selector de dosis hacia atrás, ya que puede salir liraglutida.
Si el selector de dosis se detiene antes de que el indicador señale la dosis necesaria, significa que no queda suficiente liraglutida para una dosis completa. En ese caso puede:
Dividir su dosis en dos inyecciones:
Gire el selector de dosis en cualquier dirección hasta que el indicador señale 0,6 mg o 1,2 mg. Inyecte la dosis. Después prepare una pluma nueva e inyéctese el número restante de mg para completar su dosis.
Solo debe dividir su dosis entre la pluma actual y una pluma nueva si ha recibido la formación adecuada o los consejos de su profesional sanitario. Utilice una calculadora para planificar las dosis. Si divide la dosis de forma equivocada, puede inyectarse demasiada o muy poca cantidad de liraglutida.
Inyecte la dosis completa con una pluma nueva:
Si el selector de dosis se detiene antes de que el indicador señale 0,6 mg, prepare una pluma nueva e inyéctese con ella la dosis completa.

|
0,6 mg seleccionados |
SIS |
|
M mg seleccionados |
fE¡ |
|
1,8 mg seleccionados | |
A No intente seleccionar otras dosis que no sean 0,6 mg, 1,2 mg o 1,8 mg. Los números del visor tienen que estar alineados de manera exacta con el indicador para asegurar que recibe la dosis correcta.
Oirá un clic cada vez que gire el selector de dosis. No utilice estos clics para seleccionar su dosis.
No utilice la escala del cartucho para medir la cantidad de liraglutida que se va a inyectar ya que no es lo bastante preciso.
Inyección de la dosis
Introduzca la aguja bajo la piel según la técnica de inyección aconsejada por su médico o enfermero. A continuación, siga estas instrucciones:
Presione el pulsador hasta que el indicador señale 0 mg. Tenga cuidado de no tocar el visor con los otros dedos ni de pulsar el selector de dosis de lado mientras se inyecta.
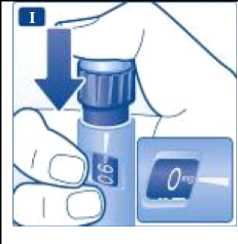
|
El motivo es que se puede bloquear la inyección. Mantenga presionado el pulsador y deje la aguja bajo la piel durante al menos 6 segundos. Esto garantiza que se administra la dosis completa. | ||
|
Retire la aguja. A continuación, puede que vea una gota de liraglutida en la punta de la aguja. Esto es normal y no afecta a su dosis. |
"t siJ | |
|
Inserte la punta de la aguja en el capuchón exterior de la aguja sin tocar la aguja o el capuchón exterior de la aguja. |
° e~7 jj | |
|
Cuando la aguja quede protegida, presione con cuidado el capuchón exterior de la aguja hasta el fondo. A continuación, desenrosque la aguja. Deseche con cuidado la aguja y vuelva a colocar el capuchón de la pluma. Cuando la pluma esté vacía, deséchela con cuidado sin ninguna aguja puesta. Por favor deseche la pluma y la aguja de acuerdo a las normativas locales. | ||
|
Retire siempre la aguja después de cada inyección, y guarde su pluma sin la aguja puesta. Así se reduce el riesgo de contaminación, infección, pérdida de liraglutida, que las agujas se atasquen y las dosificaciones inexactas. Los cuidadores deben prestar mucha atención al manejar agujas usadas para evitar pinchazos accidentales e infección. | ||
ANEXO IV
CONCLUSIONES CIENTÍFICAS Y MOTIVOS PARA LA MODIFICACIÓN DE LAS CONDICIONES DE LAS AUTORIZACIONES DE COMERCIALIZACIÓN
Conclusiones científicas
Teniendo en cuenta lo dispuesto en el Informe de Evaluación del Comité para la Evaluación de Riesgos en Farmacovigilancia (PRAC) sobre los informes periódicos de seguridad (IPS) para liraglutida las conclusiones científicas del Comité de Medicamentos de Uso Humano (CHMP) son las siguientes:
De acuerdo a la señal de aumento de lipasa y los acontecimientos de aumento en los valores medios de lipasa observados en los ensayos clínicos y de las fuentes poscomercialización, el PRAC consideró que se debe actualizar la información del producto para añadir las reacciones adversas “aumento de lipasa” y “aumento de amilasa” con una frecuencia clasificada como de frecuente en la sección 4.8 del Resumen de las Características del Producto. El prospecto se debe actualizar en consecuencia.
Por lo tanto, en vista de los datos presentados en el IPS revisado, el PRAC considera que los cambios de la información del producto de los medicamentos que contienen liraglutida estaban justificados.
El CHMP está de acuerdo con las conclusiones científicas del PRAC.
Motivos para la modificación de las condiciones de las autorizaciones de comercialización
De acuerdo con las conclusiones científicas para liraglutida, el CHMP considera que el balance beneficio-riesgo de los medicamentos que contienen liraglutida no se modifica sujeto a los cambios propuestos en la información del producto.
El CHMP recomienda que se modifiquen las condiciones de las autorizaciones de comercialización.
35
Función de las células beta
Los ensayos clínicos realizados con liraglutida indican una función mejorada de las células beta