Vepesid 50 Mg Capsulas Blandas
an
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
VEPESID 50 mg cápsulas blandas VEPESID 100 mg cápsulas blandas
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Vepesid 50 mg cápsulas blandas: cada cápsula contiene 50 mg de etopósido.
Vepesid 100 mg cápsulas blandas: cada cápsula contiene 100 mg de etopósido.
Excipientes con efecto conocido:
Cada cápsula de 50 mg contiene 0,47 mg de la sal de sodio de parahidroxibenzoato de propilo (E-217) y 0,93 mg de la sal de sodio de parahidroxibenzoato de etilo (E-215)
Cada cápsula de 100 mg contiene 0,61 mg de la sal de sodio de parahidroxibenzoato de propilo (E-217) y 1,22 mg de la sal de sodio de parahidroxibenzoato de etilo (E-215).
Para consultar la lista completa de excipientes ver sección 6.1.
3. FORMA FARMACÉUTICA Cápsula de gelatina blanda.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Tumores testiculares: en primera línea de tratamiento, en regímenes de poliquimioterapia junto con los procedimientos quirúrgicos y/o radioterápicos adecuados.
Tumores testiculares refractarios: en terapia de combinación con otros agentes quimioterápicos de uso clínico en pacientes con tumores testiculares refractarios ya tratados con cirugía, quimioterapia y radioterapia adecuadas.
Carcinoma microcítico de pulmón: en terapia de combinación con otros agentes quimioterápicos de uso clínico en pacientes con este tipo de tumores. (Datos preliminares han puesto de manifiesto que etopósido puede ser también eficaz en otros tipos histológicos de carcinoma de pulmón).
Enfermedad de Hodgkin.
Linfomas malignos (no Hodgkin).
Leucemia aguda monocítica y mielomonocítica.
4.2 Posología y forma de administración

Posología
La dosis habitual de etopósido es de 100 a 200 mg/m2/día, durante los días 1° al 5° del ciclo consecutivos, ó 200 mg/m2/día durante los días 1°, 3° y 5° del ciclo cada 3-4 semanas cuando se administra en combinación con otros medicamentos utilizados para el tratamiento de la enfermedad.
La dosis de Vepesid se calcula en base a la dosis recomendada para la administración intravenosa (IV), considerando que su biodisponibilidad parece depender de la dosis administrada. Una dosis de 100 mg vía oral sería comparable a una dosis de 75 mg vía IV; una dosis de 400 mg vía oral sería comparable a una dosis de 200 mg vía IV. La biodisponibilidad de Vepesid tras la administración de cualquier dosis por vía oral, varía de paciente a paciente (variabilidad interindividual). Este aspecto debe considerarse al prescribir este medicamento. Como consecuencia de esta variabilidad interindividual, es preciso ajustar la dosificación para alcanzar el efecto terapéutico deseado.
Las dosis diarias superiores a 200 mg se deben administrar divididas (dos veces al día)
Las cápsulas deben tomarse preferiblemente con el estómago vacío
La dosificación debe modificarse teniendo en cuenta el efecto mielosupresor de otros medicamentos administrados en combinación, o los producidos por la radioterapia o quimioterapia previa que pueda comprometer la reserva de la médula ósea.
Los pacientes no deberán comenzar un nuevo ciclo de tratamiento con Vepesid si el recuento de neutrófilos es menor de 1500 células/ mm3 o el recuento de plaquetas es menor de 100.000/mm3a menos que estén causados por la enfermedad maligna.
Las dosis posteriores a la dosis inicial, deben ajustarse si el recuento de neutrófilos es menor de 500 células/mm3 y se produce durante más de cinco días o está asociado a fiebre o infección, si el recuento de plaquetas es inferior a 25.000 células/mm3 o si se desarrolla cualquier otra toxicidad grado 3 ó 4 o si el aclaramiento renal es inferior a 50 ml/min (ver sección 4.4).
Un esquema alternativo de dosificación para Vepesid es 50 mg/m2 diarios durante 2 a 3 semanas, con ciclos repetidos tras una semana de descanso o hasta la recuperación de la mielosupresión.
Insuficiencia renal: en pacientes que presenten insuficiencia renal, se debe tener en cuenta la siguiente modificación de la dosis inicial, en función del aclaramiento de creatinina (ver sección 4.4)
Aclaramiento de creatinina Dosis de etopósido
> 50 ml/min 15-50 ml/min
100% de la dosis 75% de la dosis
Las dosis siguientes se deben basar en la tolerancia del paciente y el efecto clínico. No hay datos disponibles con un aclaramiento de creatinina < 15 ml/min y deberían considerarse reducciones de dosis
posteriores en estos pacientes.
Insuficiencia hepática: en pacientes que presenten insuficiencia hepática se debe tener en cuenta la
Agencia esparioiaóe medicamentos y proouctos san-tanos
ÍTTI
debe reducirse en un 50%, mientras que se debe interrumpir su administración si la bilirrubina total es superior a 5 mg/dl.
Población pediátrica: No se ha estudiado de forma sistemática la seguridad y eficacia en pacientes pediátricos.
Forma de administración Vía oral
4.3 Contraindicaciones
Vepesid está contraindicado en pacientes con antecedentes de hipersensibilidad a etopósido o a alguno de los excipientes incluidos en la sección 6.1
También está contraindicado en:
- Insuficiencia hepática grave.
- Embarazo y Lactancia.
El uso concomitante de la vacuna de la fiebre amarilla o de otras vacunas con virus vivos está contraindicada en paciente inmunosuprimidos (ver sección 4.5)
4.4 Advertencias y precauciones especiales de empleo
Vepesid debe administrarse bajo la supervisión de un médico con experiencia en la utilización de quimioterapia anticancerosa. Puede originar mielosupresión grave con las consiguientes infecciones o hemorragias.
En todos los casos en los que se piense iniciar una quimioterapia con etopósido, el médico
deberá considerar la necesidad y el beneficio del medicamento frente al riesgo de posibles
reacciones adversas. La mayoría de estas reacciones adversas son reversibles si se detectan
rápidamente. Si aparecen reacciones graves, debe reducirse o interrumpirse la dosificación y
deben tomarse las medidas correctoras adecuadas, de acuerdo con el criterio del médico. La
reinstauración del tratamiento debe realizarse con precaución y con una adecuada
consideración de la necesidad adicional del fármaco, poniendo una atención especial a la
posible recurrencia de toxicidad. Los pacientes con bajos niveles de albúmina sérica pueden tener un mayor
riesgo de presentar toxicidad asociada con etopósido.
Tras la administración de etopósido, se han comunicado casos mortales de mielosupresión.
Los pacientes que empiecen un tratamiento con Vepesid se deberán controlar cuidadosa y frecuentemente durante y después del tratamiento. .La toxicidad más frecuentemente asociada a la terapia con Vepesid es la supresión de la médula ósea que es dosis-limitante (ver sección 4.2).
Se deben realizar los siguientes recuentos al inicio del tratamiento con Vepesid y antes de administrar cada dosis: hemoglobina, recuento de plaquetas, recuento y formula diferencial de leucocitos . Si se ha recibido radioterapia o quimioterapia antes de empezar el tratamiento con etopósido, se debe permitirun intervalo adecuado para permitir la recuperación de la médula ósea.
ÍTTI
Vepesid no debe administrase a pacientes con un recuento de neutrófilos menor de 1500 células/mm3 o si el recuento de plaquetas es inferior a 100.000 células/mm3 a menos que estén causados por la enfermedad maligna.
Las dosis posteriores a la dosis inicial, deben ajustarse si el recuento de neutrófilos es menor de 500 células/mm3 y se produce durante más de cinco días o está asociado a fiebre o infección, si el recuento de plaquetas es inferior a 25.000 células/mm3 o si se desarrolla cualquier otra toxicidad grado 3 ó 4 o si el aclaramiento renal es inferior a 50 ml/min. La dosis debe modificarse teniendo en cuenta el efecto mielosupresor de otros medicamentos que se administren en combinación o los efectos de un tratamiento previo con radioterapia o quimioterapia que pueden haber comprometido las reservas de médula ósea.
La incidencia de leucemia aguda, que puede ocurrir con o sin síndrome mielodisplásico se ha descrito en pacientes que fueron tratados con etopósido incluído en regímenes quimioterápicos. No se conocen el riesgo acumulativo ni los factores de predisposición relativos al desarrollo de leucemia secundaria. Se han sugerido pero no se han definido claramente tanto los regímenes de administración como las dosis acumuladas de etoposido.
Una anormalidad en el cromosoma 11q23 se ha observado en algunos casos de leucemia secundaria en pacientes que habían recibido epidofilotoxinas. Esta anormalidad también se ha visto en pacientes que desarrollaron leucemia secundaria después de ser tratados con regímenes quimioterápicos que no contenían epidofilotoxinas y en leucemias producidas de novo. Otra característica asociada con leucemia secundaria en pacientes que habían recibido epidofilotoxinas aparece con período de latencia corto, con tiempo medio para el desarrollo de la leucemia de aproximadamente 32 meses.
Los médicos deberán tener en cuenta la posible aparición de reacciones anafilácticas cuya sintomatología incluye escalofríos, fiebre, taquicardia, broncoespasmo, disnea e hipotensión que podrán ser mortales. El tratamiento es sintomático. La administración debe interrumpirse inmediatamente, iniciándose la administración de agentes presores, corticosteroides, antihistamínicos y/o expansores de volumen del plasma, según criterio médico.
Los pacientes con insuficiencia hepática y renal se deben monitorizar regularmente, se recomienda realizar controles periódicos de las funciones renal y hepática debido al riesgo de acumulación.
Los niveles de sangre circulante por lo general regresan a la normalidad durante un periodo de 21 días, dependiendo de si el etopósido se ha administrado en monoterapia o en tratamiento combinado.
Las infecciones bacterianas han de estar bajo control antes de iniciar el tratamiento con etopósido.
Conocido el potencial mutagénico de etopósido, se recomienda una contracepción efectiva tanto a los hombres como a las mujeres tratados con este medicamento, para evitar la concepción de un hijo durante el tratamiento y hasta 6 meses después de finalizar el mismo. Se recomienda consejo genético para pacientes que deseen tener hijos al final del tratamiento. Como etopósido puede disminuir la fertilidad, se debe considerar la conservación del esperma por aquellos que deseen ser padres en el futuro (ver sección 4.6).
Población pediátrica
La seguridad y eficacia en pacientes pediátricos no se ha estudiado de forma sistemática.
"I ■"
an
Pacientes de edad avanzada
Se recomienda precaución, debido a un mayor riesgo de aparición de reacciones adversas, fundamentalmente mielosupresión, cardiotoxicidad, y alteraciones en el sistema nervioso central.
Puede producir reacciones alérgicas (posiblemente retardadas) porque contiene sal de sodio de parahidroxibenzoato de propilo y sal de sodio de parahidroxibenzoato de etilo.
4.5 Interacción con otros medicamentos y otras formas de interacción
Dosis elevadas de ciclosporina, que alcancen concentraciones superiores a 2000 ng/ml, administradas conjuntamente con etopósido oral han provocado un incremento del 80% de la exposición de etopósido (AUC) y un descenso del 38% del aclaramiento total de etopósido comparado con la administración única del mismo.
El tratamiento concomitante con cisplatino se asocia con un aclaramiento total corporal reducido de etopósido.
El tratamiento concomitante con antiepilépticos (fenitoína, fenobarbital) se asocia con una disminución de los niveles de etopósido, con posible pérdida de su actividad antineoplásica, por inducción de su metabolismo hepático.
El tratamiento concomitante con warfarina puede producir una elevación del INR (Ratio Internacional Normalizada) por lo que se recomienda una monitorización rigurosa.
Existe un incremento del riesgo de enfermedad vacunal sistémica mortal con el uso de la vacuna de la fiebre amarilla. Las vacunas de virus vivos están contraindicadas en pacientes inmunosuprimidos (ver sección 4.3)
Deben esperarse efectos aditivos o sinérgicos con el uso previo o concomitante de otros medicamentos con efecto mielosupresor similar a etopósido como ciclofosfamida, BCNU, CCNU, 5-fluorouracilo, vinblastina, y adriamicina. Con mitomicina se ha registrado potenciación de la toxicidad a nivel pulmonar.(ver sección 4.4 )
La fenilbutazona, el salicilato sódico y el ácido acetil salicílico pueden afectar la unión del etopósido a las proteínas, que in vitro es del 97%.
Se ha notificado resistencia cruzada entre antraciclinas y etopósido en estudios preclínicos.
La administración de etopósido con medicamentos de los que se conoce que inhiben la actividad de la fosfatasa se debe realizar con precaución.
Atovacuona: posible aumento de los niveles plasmáticos de etopósido con posibilidad de aparición de efectos adversos.
Ofloxacina: en algunos estudios se ha registrado disminución de los niveles de quinolona, por reducción de su absorción provocada por etopósido
4.6 Fertilidad, embarazo y lactancia Embarazo:
Vepesid puede causar daño fetal si se administra a mujeres embarazadas.
Vepesid ha demostrado ser teratogénico en ratón y rata. No se han realizado estudios adecuados y controlados en mujeres embarazadas. Si este medicamento se administra durante el embarazo, o si la paciente queda embarazada durante el tratamiento, debe ser advertida de los posibles riesgos para el feto. Debe aconsejarse a las mujeres en edad fértil que eviten quedar embarazadas durante la terapia con etopósido y que informen a su médico de inmediato si esto ocurriera.
Fertilidad:
Conocido el potencial mutagénico de etopósido, se recomienda una contracepción efectiva tanto a los hombres como a las mujeres tratados con este medicamento, para evitar la concepción de un hijo durante y hasta 6 meses después del tratamiento. Se recomienda consejo genético para pacientes que deseen tener hijos al final del tratamiento. Como etopósido puede disminuir la fertilidad, debe considerarse la conservación del esperma por aquellos que deseen ser padres en el futuro (ver sección 4.4 )
Lactancia:
Se desconoce si etopósido se excreta en la leche materna. Debido a que muchos medicamentos se excretan en la leche materna y a las posibles reacciones adversas en lactantes, deberá tomarse la decisión de interrumpir la lactancia o interrumpir el tratamiento con este medicamento valorando la importancia del tratamiento para la madre.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No se han realizado estudios del efecto de Vepesid sobre la capacidad para conducir o utilizar máquinas. Si el paciente experimenta reacciones adversas como náuseas, vómitos, fatiga o somnolencia debería evitar conducir y utilizar máquinas. (ver sección 4.8 )
4.8 Reacciones adversas
La incidencia de las reacciones adversas descritas a continuación se deriva de estudios en donde se ha utilizado etopósido como agente único.
A continuación se presenta el listado de reacciones adversas en función de los sistemas afectados y en orden decreciente de frecuencia según los criterios: muy frecuentes (>1/10), frecuentes (>1/100 a <1/10), poco frecuentes (>1/1000 a <1/100), raras (>1/10000 a <1/1000) y muy raras (<1/10000)
REACCIONES ADVERSAS NOTIFICADAS CON VEPESID
(Terminología MedDRA)
|
Neoplasmas benignos (incluyendo quistes y pólipos |
Frecuentes |
Leucemia aguda |
|
Trastornos de la sangre y del sistema linfático* |
Muy frecuentes |
Mielosupresión*, leucopenia, trombocitopenia. neutropenia, anemia |
|
Trastornos cardíacos |
Frecuentes |
Infarto de miocardio, arritmia |
|
Trastornos del Sistema Inmunitario |
Raros |
Reacciones tipo anafiláctico |
|
Trastornos del sistema |
Frecuentes |
Mareos |
|
nervioso |
Poco frecuentes |
Neuropatía periférica |
|
Raros |
Ataques epilépticos***, neuritis óptica, ceguera cortical transitoria, neurotoxicidades ( somnolencia, fatiga) | |
|
Trastornos vasculares |
Frecuentes |
Hipotensión sistólica transitoria, hipertensión |
|
Trastornos respiratorios, torácicos, y mediastínicos |
Raros |
Fibrosis pulmonar, neumonitis intersticial |
|
Trastornos gastrointestinales |
Muy frecuentes |
Dolor abdominal, estreñimiento, náuseas, vómitos. anorexia |
|
Frecuentes |
Mucositis(incluyendo estomatitis y esofagitis), diarrea | |
|
Raros |
Disfagia, disgeusia | |
|
Trastornos hepatobiliares |
Muy frecuentes |
Hepatotoxicidad |
|
Trastornos de la piel y del tejido subcutáneo |
Muy frecuentes |
Alopecia, pigmentación |
|
Frecuentes |
Erupción cutánea, urticaria, prurito | |
|
Raros |
Síndrome de Stevens-Johnson, neurolisis epidérmica tóxica, dermatitis en zonas sometidas a radioterapia | |
|
Trastornos generales y alteraciones en el lugar de administración |
Muy frecuentes |
Astenia, malestar |
|
Frecuentes |
Flebitis |
*Se ha notificado mielosupresión con resultado mortal
*** Los ataque epilépticos se asociaron ocasionalmente con reacciones alérgicas
ÍTTI
que utilizaron
La incidencia de las reacciones adversas descritas a continuación se deriva de estudios Vepesid en tratamientos como agente único
Toxicidad hematológica
de etopósido. La generalmente se
Se notificó mielosupresión con resultado mortal después de la administración mielosupresión es frecuentemente dosis limitante. La recuperación de la médula ósea completa en el día 20 y no se ha notificado toxicidad acumulativa.
Los valores mínimos de los recuentos de granulocitos y plaquetas tienden a ocurrir de 10-14 días después de la administración de etoposido dependiendo del esquema de tratamiento. .
En pacientes tratados con etoposido, se observaron leucopenia y leucopenia grave (menos de 1000 células/mm3) en el 60-91%; y en el 7-17% respectivamente. Trombocitopenia y trombocitopenia grave (menos de 50.000 plaquetas/mm3 en un 28-41%. También fueron muy frecuentes notificaciones de fiebre e infección en pacientes con neutropenia tratados con etopósido.
Toxicidad gastrointestinal
Las mayores toxicidades gastrointestinales de Vepesid son náuseas y vómitos que generalmente se controlan con tratamiento antiemético.
Alopecia
Alopecia reversible, que a veces progresa a calvicie total, se observó en un 44% de los pacientes tratados con Vepesid .
Cambios en la presión sanguínea Hipotensión
Hipotensión transitoria se ha notificado en pacientes tratados con Vepesid y no se ha asociado con toxicidad cardíaca o cambios electrocardiográficos. La hipotensión generalmente responde al cese de la administración de etopósido u otros tratamientos si procede,
No se ha notificado hipotensión retardada.
Hipertensión
En estudios clínicos con Vepesid se notificaron episodios de hipertensión. Si se produce hipertensión clínicamente significativa en pacientes que reciben Vepesid debe iniciarse un tratamiento soporte adecuado.
Reacciones alérgicas
Se han notificado reacciones de tipo anafiláctico se han notificado durante o inmediatamente después de la administración de etopósido. Reacciones de tipo anafiláctico pueden producirse con las dosis iniciales de Vepesid.
Se han notificado reacciones agudas mortales asociadas con broncoespasmo. Se notise ficó rubor facial en un 2% de los pacientes y erupciones cutáneas en un 3% con Vepesid.
Complicaciones metabólicas
Se ha notificado síndrome de lisis tumoral (a veces mortal) después de la administración de Vepesid en asociación con otros medicamentos quimioterápicos.
Notificación de sospechas de reacciones adversas:
ÍTTI
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: https://www.notificaRam.es
4.9 Sobredosis
Se han descrito casos de acidosis metabólica y casos de toxicidad hepática grave en pacientes que recibieron dosis de etopósido mayores a las recomendadas.
No se conoce antídoto para la sobredosificación por etopósido.
El tratamiento en estos casos debe ser sintomático, interrumpiendo la administración del medicamento y administrando las medidas de soporte necesarias para la reversión de los síntomas. Los pacientes deben monitorizarse cuidadosamente.
5. PROPIEDADES FARMACOLÓGICAS
Grupo farmacoterapéutico: Alcaloides de plantas y otros productos naturales. Derivados de la podofilotoxina. Código ATC: L01CB 01.
El etopósido, principio activo de Vepesid 50 mg cápsulas blandas y Vepesid 100 mg cápsulas blandas, es un derivado semisintético de la podofilotoxina, utilizado en el tratamiento de ciertas enfermedades neoplásicas.
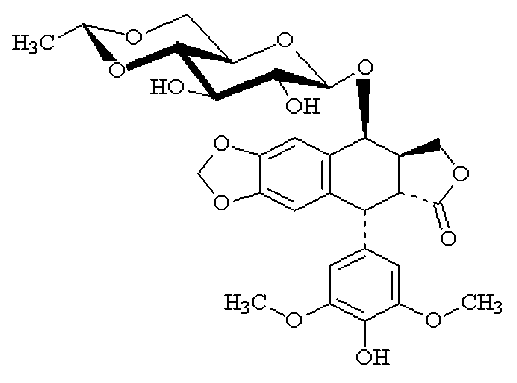
Es muy soluble en metanol y cloroformo, ligeramente soluble en etanol y poco soluble en agua y éter. Se hace más miscible en agua mediante disolventes orgánicos. Químicamente es el 4’-demetil-epipodofilotoxin-9-[4,6-0-(R)-etiliden-P-D-glucopiranósido]. Tiene un peso molecular de 588,58 y su fórmula molecular es C29H32013. Su fórmula estructural es:
5.1 Propiedades farmacodinámicas
Mecanismo de acción
Etopósido produce la interrupción de la metafase en fibroblastos de pollo. Sin embargo, su actividad principal parece producirse al final de la fase S y principio de la G2 del ciclo celular, en células de mamífero. Se han observado dos respuestas dosis-dependiente diferentes. A concentraciones elevadas (10
ÍTTI
pg/ml o más) se produce lisis celular al inicio de la mitosis; a concentraciones bajas (0,3-10 pg/ml) se produce la inhibición al inicio de la profase. Esto no interfiere el proceso de ensamblaje microtubular.
Efectos farmacodinámicos
El efecto macromolecular predominante de etopósido parece estar relacionado con la inducción de la rotura de la doble hélice de DNA mediante una interacción con la DNA-topoisomerasa II o la formación de radicales libres.
5.2 Propiedades farmacocinéticas
La disponibilidad de etopósido tras la administración intravenosa se describe como un proceso bifásico, con una vida media de distribución de 1.5 horas y una vida media de eliminación terminal en el rango de 4 a 11 horas. Los valores del aclaramiento corporal total se encuentran dentro de un rango de 33 a 48 ml/min ó 16 a 36 ml/min y, al igual que la vida media de eliminación terminal, son independientes de la dosis por encima de 100-600 mg/m2. En este mismo rango de dosis, los valores AUC Y Cmax aumentaron proporcionalmente a la dosis. Etopósido no se acumula en plasma tras la administración diaria de 100 mg/m2 durante 4 a 6 días.
Los volúmenes medios de distribución en estado estacionario están en el rango de 18 a 29 litros o de 7 a 17 l/m2. Etopósido penetra difícilmente en LCR. Aunque puede detectarse en LCR y en tumores intracerebrales, las concentraciones son mucho más bajas que en tumores extracerebrales y en plasma. Las concentraciones de etopósido son superiores en pulmones normales que en pulmones metastásicos, y son similares en tumores primarios y en el miometrio sano. In vitro, etopósido se une con gran afinidad a las proteínas plasmáticas humanas (97%). En niños existe una relación inversa entre los niveles plasmáticos de albúmina y el aclaramiento renal de etopósido. En un estudio realizado in vitro referente a los efectos de otros fármacos sobre la unión de 14C-etopósido a proteínas plasmáticas, solamente fenilbutazona, salicilato sódico y aspirina son capaces de desplazar la unión de etopósido a las proteínas plasmáticas.
La proporción de etopósido unido está relacionado directamente con la albúmina sérica en pacientes oncológicos y en voluntarios sanos. La fracción de etopósido no ligada está relacionada de forma significativa con la bilirrubina en pacientes oncológicos. Por lo tanto, parece existir una significativa relación inversa entre la concentración de albúmina sérica y la fracción libre de etopósido (ver sección 4.4).
Tras la administración intravenosa de 14C-etopósido (100-124 mg/m2), la media de recuperación de la radioactividad en orina fue el 56% de la dosis a las 120 horas, el 45% de la misma fue excretada como etopósido la recuperación fecal de la radioactividad fue del 44% de la dosis a las 120 horas.
En niños, el 55% de la dosis se excreta en orina como etopósido en 24 horas. El aclaramiento medio renal de etopósido es de 7 a 10 ml/min/m2, o un 35% del aclaramiento corporal total dentro de un rango de dosis de 80 a 600 mg/m2. Etopósido se elimina por vía tanto renal como no renal, p.e. metabolismo y excreción biliar. No se conoce el efecto de la insuficiencia renal sobre el aclaramiento plasmático de etopósido en niños.
La excreción biliar del fármaco inalterado y/o de los metabolitos es una importante vía de eliminación de etopósido ya que la recuperación fecal de la radioactividad es del 44% de la dosis intravenosa. El metabolito hidroxiácido [4’-dimetil-ácido epipodofílico-9-(4,6-0-etiliden-p-D-glucopiranósido)], formado por la apertura del anillo lactona, se encontró en la orina de adultos y niños. También está presente en el plasma humano, supuestamente como isómero trans. Los conjugados sulfato y/o glucorónido de etopósido también se excretan en la orina humana. Sólo un 8% o menos de una dosis intravenosa se excretan en la
ÍTTI
orina como metabolitos radiomarcados de 14C-etopósido. Adicionalmente, se produce la O-demetilación del anillo dimetoxifenol por medio del isoenzima CYP450 3A4, originando el catecol correspondiente.
El aclaramiento corporal total de etopósido en adultos, está relacionado con el aclaramiento de creatinina, la concentración de albúmina sérica y el aclaramiento no renal. En pacientes oncológicos adultos con alteración de la función hepática, el aclaramiento corporal total de etopósido no está disminuido. Los pacientes con insuficiencia renal en tratamiento con etopósido han mostrado un descenso del aclaramiento corporal total, un incremento del AUC y un volumen de distribución inferior en el estado estacionario (ver sección 4.2). El tratamiento concomitante con cisplatino está asociado con un descenso del aclaramiento corporal total de etopósido. En niños, los niveles elevados de GPT están asociados con la reducción del aclaramiento corporal total del fármaco. La administración previa de cisplatino puede ocasionar un descenso del aclaramiento corporal total en niños.
Aunque se han observado diferencias secundarias en los parámetros farmacocinéticos entre pacientes de distinto sexo y entre pacientes de edades <65 años y >65 años, no se consideran clínicamente significativas.
Tanto tras la perfusión intravenosa como después de la administración de cápsulas orales, los valores de Cmáx y AUC mostraron una marcada variabilidad intra- e inter-individual. Esto da lugar a una variabilidad en la estimación de la biodisponibilidad oral absoluta de las cápsulas blandas orales de etopósido.
Los valores de Cmáx y AUC de las cápsulas de etopósido administradas oralmente en dosis de hasta aproximadamente 250 mg, están consistentemente en el mismo rango que los valores de Cmáx y AUC de una dosis intravenosa de la mitad del tamaño de la dosis oral. El valor medio general de la biodisponibilidad de la cápsula oral es aproximadamente del 50% (entre 25 - 76%). Un estudio reciente llega a la conclusión de que la biodisponibilidad media de una dosis oral de 100 mg fue de 76 + 22%. Una dosis de 400 mg de VEPESID cápsulas blandas ha demostrado ser biodisponible en un 48 + 18%.
No hay evidencia de un efecto de primer paso de etopósido. Por ejemplo, no existe una correlación entre la biodisponibilidad oral absoluta de las cápsulas de etopósido y el aclaramiento no renal. No existe evidencia de cualquier otra diferencia en el metabolismo y excreción de etopósido tras la administración de cápsulas orales comparado con la perfusión intravenosa.
5.3 Datos preclínicos sobre seguridad
En un estudio teratológico en ratas SPF a dosis de 0,13, 0,4, 1,2 y 3,6 mg/kg/día, administrados por vía intravenosa los días del 6 al 15 de la gestación, etopósido se asoció con toxicidad maternal dependiente de la dosis, embriotoxicidad y teratogenicidad en niveles de dosificación de 0,4 mg/kg/día y superiores. Con las dos dosis más elevadas se originaron el 90 y 100% de reabsorciones embrionarias. Con 0,4 y 1,2 mg/kg, disminuyeron los pesos fetales y se produjeron anomalías fetales, incluyendo anomalías graves en el esqueleto, exencefalia y encefalocele y anoftalmia. Con la dosis de 1,2 mg/kg se observó una mortalidad prenatal del 92% con un 50% de fetos implantados anómalos. Incluso con la menor dosis analizada, 0,13 mg/kg, se observó un aumento significativo en la osificación retardada.
Un estudio en ratones albinos-suizos, administrando una inyección intraperitoneal diaria de etopósido en dosis de 1,0, 1,5 y 2 mg/kg los días 6, 7 y 8 de gestación, revela embriotoxicidad relacionada con la dosis, anomalías craneales diversas, malformaciones graves del esqueleto, así como un incremento de la incidencia de muertes intrauterinas y una disminución significativa de la media de los pesos corporales fetales. No estuvo afectada la ganancia de peso de las madres.
ÍTTI
Etopósido induce aberraciones en el número cromosómico y en la estructura de células murinas embriónicas.
Carcinogénesis: No se han realizado estudios de carcinogenicidad en animales de laboratorio con etopósido. Debido a su mecanismo de acción, debe considerarse la posibilidad de que sea carcinogénico en humanos.
Raramente se ha descrito leucemia aguda, con o sin fase preleucémica, en pacientes tratados con etopósido asociado a otros medicamentos antineoplásicos. No se conocen ni el riesgo acumulativo ni los factores predisponentes relacionados con el desarrollo de una leucemia secundaria. Se ha sugerido que pueden influir tanto las pautas de administración como las dosis acumuladas de etopósido, pero no se han definido claramente.
En pacientes que habían recibido epipodofilotoxinas se ha observado una anomalía en el cromosoma 11q23, en algunos casos de leucemia secundaria. Esta anomalía también se ha detectado en pacientes que desarrollaron leucemia secundaria después de haber sido tratados con regímenes de quimioterapia que no incluían epipodofilotoxinas y en leucemias de nueva aparición. Otra característica que se ha asociado con la leucemia secundaria en pacientes tratados con epipodofilotoxinas parece ser el acortamiento del periodo de latencia, con una media del tiempo medio que tarda en desarrollarse la leucemia de unos 32 meses.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Contenido de la cápsula:
Acido cítrico anhidro Macrogol 400 Glicerol,
Agua purificada
Cubierta de la cápsula:
Gelatina
Glicerol,
Parahidroxibenzoato de propilo,sal de sodio (E-217)
Parahidroxibenzoato de etilo, sal de sodio (E-215)
Óxido de hierro rojo (E-172)
Dióxido de titanio (E-171)
6.2 Incompatibilidades
No se han descrito.
6.3 Periodo de validez
Las cápsulas blandas de Vepesid conservadas en sus envases originales son estables durante un período de 36 meses.
6.4 Precauciones especiales de conservación
Vepesid50 mg cápsulas blandas y Vepesid 100 mg cápsulas blandas deberán conservarse por debajo de 25°C.
ÍTTI
6.5 Naturaleza y contenido del envase
Vepesid50 mg cápsulas blandas: blisteres de PVC/aclar con 10 cápsulas por blister y dos blisteres (20 cápsulas) por estuche.
Vepesid 100 mg cápsulas blandas: blísteres de PVC/aclar con 10 cápsulas por blíster y un blíster (10 cápsulas) por estuche.
6.6 Precauciones especiales de eliminación y otras manipulaciones Manipulación
Como sucede con todos los medicamentos citostáticos, Vepesid 50 mg cápsulas blandas y Vepesid 100 mg cápsulas blandas debe manipularse con precaución.
Se deben seguir los procedimientos para una adecuada manipulación y eliminación de medicamentos antineoplásicos.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
BRISTOL-MYERS SQUIBB, S.A.
C/ Quintanavides, 15
28050-MADRID
España
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
Vepesid50 mg cápsulas blandas: 56.488 Vepesid100 mg cápsulas blandas: 56.108
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Vepesid 50 mg cápsulas blandas: 16 de abril de 1986/ 30 de enero de 2002/ 30 de enero 2007/ 31 de octubre de 2011
Vepesid 100 mg cápsulas blandas: 20 de julio de 1984/ 29 de abril de 2003/ 30 de enero de 2007/ 31 de octubre de 2011
10. FECHA DE LA REVISIÓN DEL TEXTO
Diciembre 2014
13 de 13