Veinfibro 1% Solucion Inyectable
fjljp
fjljp
STTÍ
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
1. NOMBRE DEL MEDICAMENTO
Veinfibro 1 % solución inyectable
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada ml de solución inyectable contiene 10 mg de tetradecilsulfato de sodio.
Cada ampolla de 2 ml contiene 20 mg de tetradecilsulfato de sodio.
Contiene 20 mg/ml de alcohol bencílico.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Solución inyectable
Solución, transparente, incolora y estéril. pH: 7,5 - 7,9.
Osmolaridad: 247 - 273 mOsm/kg.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Para el tratamiento de venas varicosas primarias no complicadas, venas varicosas residuales o recurrentes tras cirugía, venas reticulares, vénulas y arañas vasculares de las extremidades inferiores que muestren dilatación.
Veinfibro está indicado en adultos.
4.2 Posología y forma de administración
Forma de administración
Veinfibro debe administrarse únicamente por vía intravenosa. La concentración necesaria dependerá del tamaño y del grado de varicosidad. Las arañas vasculares deberán tratarse con la solución al 0,2 % y las venas reticulares con la solución al 0,5%. La solución al 1% es más útil para varices pequeñas o medianas y la solución al 3 % para varices grandes. El tamaño de las venas varicosas no visibles se debe medir con ultrasonidos.
El esclerosante deberá ser administrado por vía intravenosa en pequeñas alícuotas en múltiples puntos de la vena a tratar. El objetivo es lograr la destrucción óptima de la pared del vaso con la menor concentración de esclerosante necesaria para un resultado clínico. Si la concentración es demasiado alta se puede producir necrosis u otras secuelas adversas.
Para ver el método Tessari de preparación de la espuma, consultar el final de esta sección 4.2 y a la sección 6.6. Se pueden usar otras técnicas como DSS, Easyfoam y Sterive, las cuales consisten esencialmente en mezclar esclerosante y aire estéril realizando repetidas transferencias entre dos jeringas conectadas. En la sección 6.6 se detallan instrucciones específicas de preparación.
Se deberá mantener una técnica estrictamente aséptica durante el manejo de Veinfibro.
Veinfibro es un producto parenteral de un solo uso. Una vez abierto el envase, utilizar inmediatamente y desechar cualquier porción sin utilizar.
Inspeccione visualmente que no haya materia particulada antes de usar. Las soluciones que contienen materia particulada no se deben usar.
Posología recomendada
Adultos y ancianos
|
Concentración |
Volumen normal inyectado por vía intravenosa en los lugares apropiados por sesión |
Volumen total máximo a inyectar por sesión | ||
|
Veinfibro 1 % |
Líquido |
Espuma* |
Líquido |
Espuma* |
|
0,1 a 1,0 ml |
0,5 a 2,0 ml |
10 ml |
16 ml | |
* El volumen es la suma de los componentes de líquido y aire
Cuando se requiera especial precaución, se recomienda administrar una dosis de prueba de 0,25 a 0,5 ml de Veinfibro y observar al paciente durante varias horas antes de administrar una segunda dosis o una dosis mayor.
Puesto que el volumen a inyectar está limitado por sesión, a menudo son necesarias repetidas sesiones (2 a 4 de media). Para prevenir una posible reacción alérgica, se recomienda dar una pequeña dosis de prueba de Veinfibro al comienzo de cada sesión.
Cuando el esclerosante se administra como espuma.
Veinfibro 1 % y 3 % se pueden convertir en espuma para ser usado en el tratamiento de venas más grandes. La espuma debe de ser preparada justo antes de ser usada y administrada por un médico formado adecuadamente en la correcta generación y administración de la espuma. Idealmente debería ser administrado bajo la guía de una ecografía.
Población pediátrica
Veinfibro no está indicado para niños.
4.3 Contraindicaciones
- Hipersensibilidad al tetradecilsulfato de sodio o a cualquier componente del preparado y condiciones alérgicas.
- Pacientes que por cualquier motivo no puedan andar, pacientes encamados.
- Pacientes con un riesgo alto de trombosis, por ejemplo pacientes con una predisposición congénita a los coágulos de sangre o con múltiples factores de riesgo como anticonceptivos hormonales o terapia de sustitución hormonal, obesidad significativa, fumadores o con prolongados períodos de inmovilidad.
- Tromboflebitis superficial aguda reciente, trombosis de las venas profundas o embolismo pulmonar.
- Cirugía reciente.
- Varices provocadas por tumores pélvicos o abdominales a menos que el tumor haya sido extirpado.
- Enfermedades sistémicas incontroladas como la diabetes mellitus, hipertiroidismo tóxico, tuberculosis, asma, neoplasia, sepsis, discrasias sanguíneas y enfermedades agudas respiratorias o de la piel.
- Cáncer en evolución.
- Incompetencia valvular significativa de las venas profundas.
- Enfermedad oclusiva arterial.
- Grandes venas superficiales con amplias comunicaciones a las venas profundas.
- Flebitis migratoria.
- Celulitis aguda.
- Infecciones agudas.
Además cuando el esclerosante se ha convertido en espuma:
- Foramen oval permeable (FOP) sintomático conocido.
4.4 Advertencias y precauciones especiales de uso
Veinfibro deberá ser administrado únicamente por un profesional de la salud experimentado en anatomía venosa y en diagnóstico y tratamiento de las enfermedades que afectan al sistema venoso y que esté familiarizado con una técnica de inyección correcta.
Antes del tratamiento el profesional sanitario debe investigar los factores de riesgo del paciente e informarles sobre los riesgos de esta técnica. Hay que recordar que a escleroterapia está contraindicada en pacientes con un alto riesgo de sufrir eventos tromboembólicos pero también se debe evitar en la mayoría de situaciones cuando el riesgo es menor. La escleroterapia está particularmente no recomendada en pacientes con un historial de eventos tromboembólicos.
No obstante si se juzgara necesaria la escleroterapia, se puede iniciar una anticoagulación preventiva.
Debido al riesgo de paso del producto, burbujas o partículas al corazón derecho, la presencia de FOP puede aumentar la aparición de efectos adversos graves de tipo arterial. En pacientes con un historial de migraña con aura, eventos cerebro-vasculares graves o hipertensión pulmonar, se recomienda descartar un FOP antes de la escleroterapia. En pacientes con FOP asintomático pero conocido, se recomienda usar volúmenes más pequeños y evitar la maniobra de Valsalva en los minutos posteriores a la inyección.
Usar volúmenes más pequeños en pacientes con un historial de migraña.
Deberán extremarse las precauciones durante la colocación intravenosa de la aguja y usar el volumen efectivo mínimo en cada lugar de inyección ya que pueden producirse efectos adversos locales graves, incluída necrosis tisular, tras extravasación.
Nunca deberá inyectarse un esclerosante en una arteria puesto que esto podría causar una extensa necrosis tisular y resultar en pérdida de la extremidad. Se recomienda la inyección bajo ecografía dúplex para evitar extravasación e inyección arterial.
Los profesionales de la salud deberán hacer un seguimiento del paciente durante y después de administrar Veinfibro. Pueden darse síntomas de hipersensibilidad (rojez, prurito, tos) o síntomas neurológicos (escotoma, amaurosis, migraña con aura, parestesia, déficit focal).
Se deberá tener especial cuidado en pacientes con dificultades respiratorias (asma bronquial) o una fuerte predisposición a alergias (ver sección 4.2).
Deberá haber un equipo de reanimación de emergencia disponible. Se ha informado de reacciones alérgicas, incluida anafilaxia. Se debe considerar la posibilidad de una reacción anafiláctica, y el médico debe estar preparado para tratarla correctamente.
Debido al peligro de extensión de la trombosis hacia el sistema de venas profundas, se deberá realizar una evaluación exhaustiva pre-inyección para comprobar la competencia valvular y se deberán
íifci
inyectar pequeñas cantidades (no superior a los 2 ml) del medicamento en las varicosidades de forma lenta. La permeabilidad de las venas profundas deberá ser determinada por medio de pruebas no invasivas como la ecografía dúplex. No se deberá realizar una escleroterapía venosa si los tests como el de Trendelenburg y Perthes y la angiografía muestran una incompetencia significativa de las válvulas o de las venas profundas.
El profesional sanitario deberá ver al paciente de nuevo tras 1 mes para realizar un control de la eficacia y seguridad del tratamiento por medio de una evaluación clínica y con ecografía.
Se ha informado del desarrollo de trombosis venosas profundas y embolismos pulmonares después del tratamiento con escleropatía de venas superficiales. Los pacientes deberán tener un seguimiento posttratamiento de duración suficiente para poder evaluar posibles desarrollos de trombosis de las venas profundas. Se puede producir embolismo hasta cuatro semanas después de la inyección de tetradecilsulfato de sodio. Una compresión post-tratamiento adecuada puede hacer disminuir la incidencia de trombosis de las venas profundas.
Se requiere precaución extrema en pacientes con enfermedades arteriales subyacentes como aterosclerosis o tromboangeítis obliterante (enfermedad de Buerger).
Será necesario un cuidado especial cuando se inyecte en el pie y zona maleolar por el riesgo incrementado de inyección involuntaria en la arteria.
Es más probable que se produzca pigmentación si la sangre se extravasa en el lugar de la inyección (especialmente a la hora de tratar venas superficiales más pequeñas) y no se utiliza compresión.
Además cuando el esclerosante se ha convertido en espuma:
Foramen oval permeable (FOP) asintomático conocido. Los pacientes con un FOP han demostrado tener una mayor probabilidad de sufrir efectos adversos como por ejemplo eventos neurológicos temporales, perturbaciones visuales y migraña.
El tratamiento deberá efectuarse con precaución en personas con antecedentes de migraña. Los pacientes con migraña previa han demostrado tener más probabilidad de sufrir perturbaciones visuales y migraña, especialmente después de inyecciones con esclerosante en espuma.
Para el tratamiento de varices tronculares deberá haber una distancia mínima de 8 a 10 cm entre el lugar de la inyección de espuma y la unión safenofemoral.
Si la insuficiencia venosa está asociada con un linfoedema, la inyección de esclerosante podría empeorar el dolor local y la inflamación durante días o varias semanas. Deberá informarse a los pacientes de que esta reacción puede ocurrir, la cual no pone en peligro la eficacia.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios de interacción.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No se ha establecido la seguridad de uso durante el embarazo. No hay datos o son insuficientes sobre el uso de tetradecilsulfato de sodio en mujeres embarazadas. Los estudios con animales son
íifci
insuficientes respecto a la toxicidad reproductiva. El tratamiento deberá ser pospuesto hasta el nacimiento del hijo.
Veinfibro deberá ser utilizado solo cuando sea claramente necesario para un alivio sintomático y cuando las ventajas potenciales superen a los riesgos potenciales para el feto.
Lactancia
No se sabe si el tetradecilsulfato de sodio se excreta en la leche materna. Se deberán tomar precauciones a la hora de usarlo en madres lactantes.
Fertilidad
No se sabe si el tetradecilsulfato de sodio afecta la fertilidad.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
Se podrán añadir un vendaje o medias de compresión después del tratamiento. Esto podría afectar a la capacidad de conducir.
4.8 Reacciones adversas
Los efectos adversos más comunes son dolor durante la inyección, urticaria, tromboflebitis superficial y pigmentación temporal de la piel después del tratamiento. Raras veces puede darse una pigmentación permanente a lo largo del segmento esclerosado de la vena. Se puede producir una úlcera tras extravasación del fármaco. Es importante usar la menor dosis posible para esclerosar la vena puesto que muchos de los efectos adversos frecuentes están causados por usar una concentración demasiado alta.
Aunque de forma muy rara, se ha informado de inyección intra-arterial dando como resultado necrosis significativa del tejido, incluida pérdida de la extremidad.
Los efectos secundarios más graves son shock anafiláctico y embolismo pulmonar y se han registrado muertes en pacientes que recibían tetradecilsulfato de sodio .
A continuación se incluyen las reacciones adversas por órgano y frecuencia estimada de aparición de acuerdo a los datos clínicos publicados. La frecuencia está definida usando la siguiente convención:
Muy frecuentes (>1/10)
Frecuentes (>1/100 a < 1/10)
Poco frecuentes (> 1/1000 a < 1/100)
Raras (>1/10.000 a < 1/1000)
Muy raras incluyendo episodios aislados (<1/10.000)
|
Trastornos del sistema inmunológico | |
|
Reacciones alérgicas sistémicas como shock anafiláctico, asma, urticaria generalizada |
Muy raras |
|
Trastornos del sistema nervioso | |
|
Dolor de cabeza, migraña, alteraciones locales de la sensibilidad (parestesias) Reacciones vasovagales como desmayo, confusión, mareo, pérdida de consciencia. |
Muy raras |
|
Daños en nervios tras la extravasación del fármaco |
Muy raras |
|
Debilidad (hemipáresis, hemiplegia), ataque isquémico transitorio |
Muy raras |
|
(AIT), palpitaciones. | |
|
Apoplejía |
Muy raras |
|
Trastornos oculares | |
|
Escotoma, escotoma escintilante |
Muy raras |
|
Trastornos vasculares | |
|
Tromboflebitis superficial, flebitis. |
Frecuentes |
|
Capilarización (crecimiento de arañas vasculares en la zona tratada). |
Poco frecuentes |
|
Trombosis de las venas profundas (muscular y distal principalmente). |
Muy raras |
|
Embolismo pulmonar, vasculitis, colapso circulatorio |
Muy raras |
|
Necrosis del tejido distal tras la inyección intra-arterial que puede conducir a gangrena. En la mayoría de casos está implicada la arteria tibial posterior por encima del maléolo medial. Se puede producir espasmos arteriales a pesar de la inyección intravenosa. |
Muy raras |
|
Trastornos respiratorios | |
|
Tos, dificultad para respirar, sensación de presión, opresión en el pecho. |
Muy raras |
|
Trastornos gastrointestinales | |
|
Náuseas, vómitos, diarrea, sensación de inflamación en la lengua, boca seca. |
Muy raras |
|
Trastornos de la piel y del tejido subcutáneo | |
|
Coloración de la piel (hiperpigmentación, más raros: hematoma y equimosis). |
Poco frecuentes |
|
Reacciones locales alérgicas y no alérgicas de la piel como por ejemplo eritema, urticaria, dermatitis, inflamación/induración. |
Poco frecuentes |
|
Deterioro local y necrosis de piel y tejidos. |
Raras |
|
Trastornos generales | |
|
Dolor o escozor (corto plazo en el lugar de la inyección), |
Frecuentes |
|
Fiebre, sofocos. |
Muy raras |
4.9 Sobredosis
No se han registrado casos de sobredosis sistémicas. Usar una concentración mayor de la recomendada en venas pequeñas puede provocar pigmentación y/o necrosis del tejido local.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Esclerosantes en inyección local.
Código ATC: C05BB04
El tetradecilsulfato de sodio es un agente esclerosante. La inyección intravenosa causa una inflamación en la íntima y formación de trombo. Esto normalmente ocluye la vena inyectada. La posterior formación de tejido fibroso resulta en una obliteración parcial o completa de la vena que puede o no ser permanente.
5.2 Propiedades farmacocinéticas
am
Absorción
Veinfibro , que contiene tetradecilsulfato de sodio , se administra directamente en el lumen del segmento aislado de la vena/vénula.
Distribución
En humanos, la mayor parte (75 %) de una dosis inyectada de tetradecilsulfato de sodio marcada radioactivamente al 3 % desaparece rápidamente del lugar de inyección en la vena varicosa vacía hacia los vasos sanguíneos comunicantes con un paso rápido hacia las venas profundas de la pantorrilla.
En ratas, a las 72 horas de administrar una dosis intravenosa de tetradecilsulfato de sodio radiomarcado, los niveles de radioactividad encontrados en las muestras de tejido (hígado, riñón, lípidos, músculo-esquelético) fueron extremadamente bajos. Aunque hubo alguna evidencia de radiactividad asociada al lugar de inyección, los niveles fueron muy bajos.
Biotransformación
No se ha confirmado el metabolismo del tetradecilsulfato de sodio.
Eliminación
De una dosis radiomarcada y administrada por vía intravenosa, se recuperó el 70 % en la orina de las ratas en las 24 horas posteriores a la dosis. Al final del período de 72 horas post-dosis, el 73,5 % de la radiactividad había sido recuperada en orina y 18,2 % en heces.
Insuficiencia hepática/renal
No se han realizado estudios farmacocinéticos en pacientes con insuficiencia hepática o renal.
5.3 Datos preclínicos sobre seguridad
No hay datos adicionales de relevancia para el prescriptor distintos a los ya mencionados en otras secciones de la ficha técnica.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Alcohol bencílico Fosfato de disodio dodecahidratado Fosfato dihidrógeno de potasio Hidróxido de sodio (para el ajuste del pH)
Agua para preparaciones inyectables
6.2 Incompatibilidades
Este medicamento es incompatible con la heparina.
En ausencia de estudios de compatibilidad, este medicamento no deberá mezclarse con otros.
6.3 Periodo de validez
3 años.
am
Debe utilizarse inmediatamente después de la primera apertura.
6.4 Precauciones especiales de conservación
No requiere condiciones especiales de conservación.
No congelar. Conservar los envases en la caja de cartón para protegerlos de la luz.
6.5 Naturaleza y contenidos del envase
Ampolla de 2 ml (vidrio de tipo I). Tamaños de envases: 5 ampollas.
6.6 Precauciones especiales de eliminación y otras manipulaciones
La espuma debe de ser preparada justo antes de su uso y debe ser administrada por un médico formado adecuadamente en la correcta preparación y administración de la espuma.
Se deberá mantener una técnica estrictamente aséptica durante la preparación de la espuma.
Elaboración de la espuma usando la técnica Tessari
Para elaborar la espuma se extrae 1 ml de líquido esclerosante a una jeringa estéril y se recogen 3 ml o
4 ml de aire estéril en otra jeringa estéril. El aire se recoge a través de un filtro de 0,2 micras para garantizar su esterilidad. Después se conectan las jeringas usando una válvula estéril de tres vías (Figura 1).
Después se fuerza el paso de la mezcla de aire y esclerosante de una jeringa a otra a través de la válvula de 3 vías, aproximadamente 20 veces para producir una espuma suave y consistente (Figuras 2 y 3).
Entonces se quita la jeringa que contiene la espuma y se inyecta en la vena inmediatamente (Figura
4).
La espuma esclerosante debe ser utilizada en los sesenta segundos siguientes a su elaboración. Después de sesenta segundos se deberá desechar toda espuma sobrante. Se deberá preparar más espuma si fuera necesario.
La calidad de la espuma deberá ser comprobada antes de ser administrada. Deberá tener un aspecto homogéneo sin grandes burbujas perceptibles a simple vista.
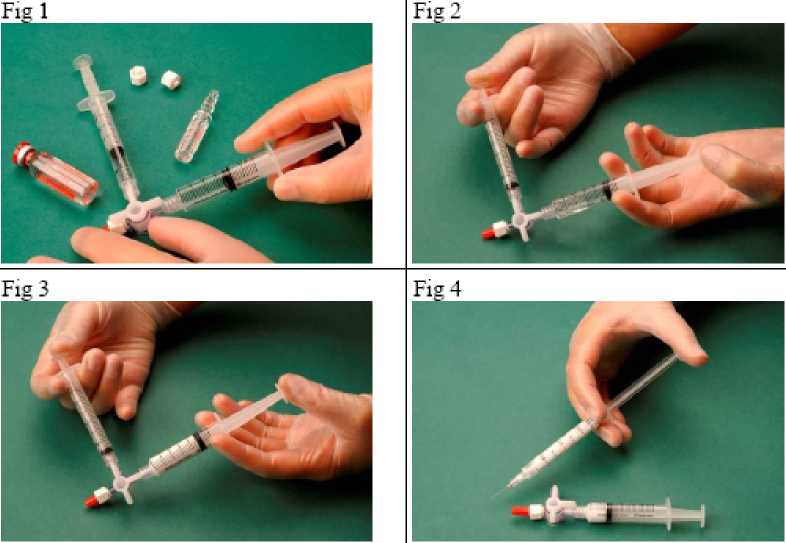
La calidad de la espuma depende de criterios específicos:

1. La concentración de producto: La espuma solo se puede preparar con concentraciones de 1 y 3 % de tetradecilsulfato de sodio.
2. La proporción de líquido y aire: A menudo esta proporción es de 1 volumen de líquido por 3 volúmenes de aire.
3. Número de pasos hacia delante y detrás: el médico deberá seguir de forma precisa el número de movimientos definidos para cada técnica.
4. La consistencia macroscópica de la espuma: la calidad de la espuma deberá ser comprobada fuera de la jeringa antes de ser administrada. La espuma debe ser homogénea, suave y cohesiva sin grandes burbujas visibles. Si hubiera grandes burbujas visibles, la espuma deberá ser desechada y se deberá preparar una nueva espuma.
5. El tiempo total de preparación de la espuma: la preparación deberá durar unos 10 segundos desde el primer al último movimiento de transferencia.
6. El tiempo máximo entre la preparación y la inyección: la espuma esclerosante debe ser utilizada en los sesenta segundos posteriores a ser producida. Después de sesenta segundos se deberá desechar toda espuma sobrante. Se deberá preparar más espuma si fuera necesario.
Precauciones especiales de eliminación
Ninguna especial.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
STD Pharmaceutical Products Ltd
Plough Lane
Hereford
HR4 0EL
Reino Unido
8. NÚMERO DE AUTORIZACIÓN DE COMERCIALIZACIÓN
am
Completar a nivel nacional.
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE AUTORIZACIÓN
Enero de 2013
10. FECHA DE LA REVISIÓN (PARCIAL) DEL TEXTO 08/2012