Urapidil Accord 5 Mg/Ml Solucion Inyectable Y Para Perfusion Efg
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
Urapidil Accord 5 mg/ml solución inyectable y para perfusión EFG
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ampolla de 10 ml contiene Urapidil 50 mg
Cada ampolla de 10 ml contiene 1000 mg de propilenglicol.
Cada ampolla de 10 ml contiene 4,36 mg de sodio.
Para consultar la lista completa de excipientes ver sección 6.1
3. FORMA FARMACÉUTICA
Solución inyectable y para perfusión
La solución es clara, transparente o ligeramente marrón.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
• Crisis hipertensivas
• Hipertensión arterial en los períodos peri y post-operatorio, especialmente en neurocirugía y cirugía cardíaca en adultos y niños.
• Protección peri-operatoria contra incrementos tensionales provocados por maniobras indispensables en el curso de la anestesia (intubación, extubación, ...).
4.2 Posología y forma de administración
Se realizará según el esquema adjunto. Teniendo en cuenta la duración de los estudios toxicológicos disponibles, la duración de utilización de Urapidil Accord será, como máximo de siete días.
UTILIZACIÓN PERIOPERATORIA
Inyección Intravenosa
Perfusión intravenosa o jeringa eléctrica
Dosis Inicial Dosis de mantenimiento Dosis Inicial
Reducción
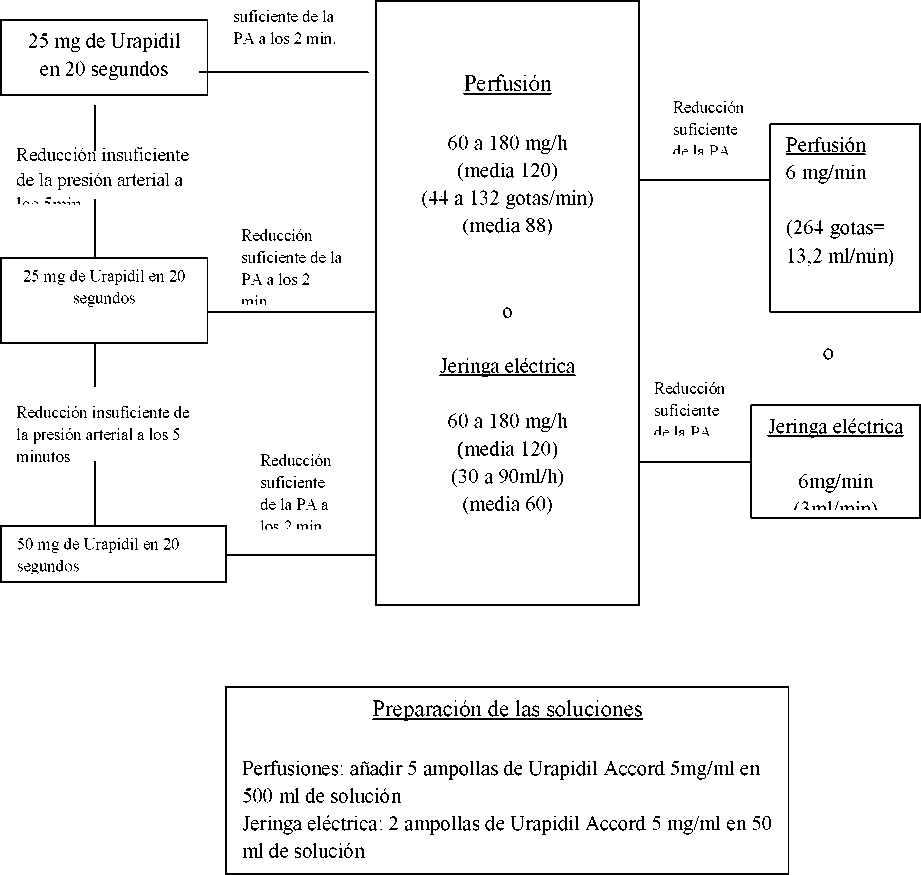
Recomendación posológica para la utilización antes de la operación
Niños:
Dosis inicial:2mg/Kg/h
Dosis de manteniento:0,8 mg/kg/h
Urapidil Accord ampollas inyectables puede utilizarse como máximo durante 7 días
URGENCIAS HIPERTENSIVAS
Inyección Intravenosa
Perfusión intravenosa o jeringa eléctrica
Dosis Inicial
Dosis de mantenimiento
Dosis Inicial
Reducción
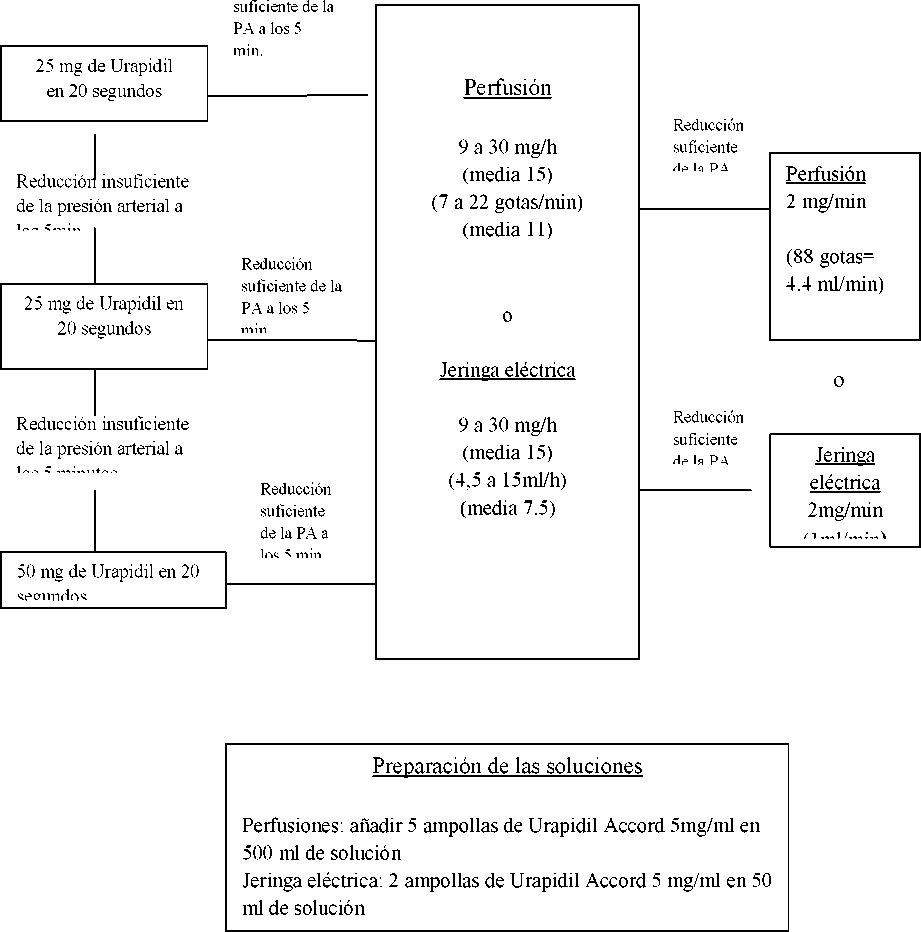
Recomendación posológica para el tratamiento de accesos de hipertensión
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
Urapidil Accord no debería utilizarse en pacientes con estenosis del istmo de la aorta o shunt arteriovenoso (con la excepción de shunt diálisis inactiva hemodinámicamente).
4.4 Advertencias y precauciones especiales de empleo
Se requiere un especial cuidado cuando Urapidil Accord se utilice en:
- fallo cardiaco, cuya causa sea un daño funcional mecánico (p.ej. estenosis de la válvula aórtica o mitral), en embolia pulmonar o acción deteriorada del corazón como resultado de desórdenes pericardiales.
- niños, ya que no se han realizado estudios en este grupo de pacientes.
- pacientes con disfunción hepática.
- pacientes con disfunción renal de moderada a grave.
- pacientes de edad avanzada.
- pacientes que están recibiendo cimetidina concomitantemente (ver sección “Interacción con otros medicamentos y otras formas de interacción”).
Si el paciente ha recibido previamente otros agentes antihipertensivos, no debe utilizarse Urapidil Accord _ hasta que haya transcurrido el tiempo necesario para que la acción de dicha medicación se haya establecido. Además, la dosis de Urapidil Accord debe reducirse de acuerdo a dicha medicación.
Una disminución excesivamente rápida en la tensión arterial puede dar lugar a bradicardia o paro cardíaco.
Excipientes
Este medicamento contiene menos de 1 mmol (23 mg) de sodio por ampolla, por lo que se considera esencialmente “exento de sodio”.
4.5 Interacción con otros medicamentos y otras formas de interacción
La acción antihipertensiva de Urapidil Accord U puede ser potenciada por la administración simultánea de antagonistas del receptor alfa-adrenérgico y otros antihipertensivos, así como por estados de hipovolemia (diarrea, vómitos) y por el alcohol.
La administración concomitante de cimetidina podría incrementar en un 15 % los niveles séricos de urapidil.
Actualmente no se recomienda el tratamiento en combinación con inhibidores de la ECA por no disponer de suficiente información sobre dicho tratamiento.
Urapidil en dosis altas puede prolongar la duración de la acción de barbitúricos.
4.6 Fertilidad, embarazo y lactancia
Durante el embarazo Urapidil Accord debería administrarse sólo cuando sea estrictamente necesario, ya que por el momento no se dispone de datos de seguridad durante el primer y el segundo trimestre de embarazo y la experiencia sobre su uso en el tercer trimestre es insuficiente. Los estudios en animales no han revelado ninguna evidencia de daños en el embrión.
Urapidil Accord Uno debe utilizarse durante el periodo de lactancia.
Debido a la diferente respuesta de cada individuo, incluso cuando se utilice de acuerdo con las instrucciones de uso, Urapidil Accord puede alterar la capacidad de conducción y utilización de maquinaria o para trabajar sin apoyo firme. Esto suele ocurrir especialmente al comienzo del tratamiento, cuando se cambia el producto y en combinación con alcohol.
4.8 Reacciones adversas
Muy frecuentes (>1/10), Frecuentes (> U1/100, < 1/10), Poco frecuentes (>1/1000, <1/100), Raras (>1/10000, <1/1000), Muy raras (< 1/10000),
La mayoría de los efectos adversos enunciados a continuación son debidos a un descenso rápido de la presión arterial que según nuestra experiencia desaparece en unos minutos, incluso durante la perfusión; el tratamiento podría interrumpirse en función de la gravedad de los efectos adversos.
Trastornos cardíacos
Poco frecuentes: palpitaciones, taquicardia, bradicardia, sensación de opresión precordial y disnea.
Trastornos gastrointestinales
Frecuentes: náuseas Poco frecuentes: vómitos
Trastornos generales y alteraciones en el lugar de administración
Poco frecuentes: fatiga
Exploraciones complementarias
Poco frecuentes: latidos cardíacos irregulares
Muy raras: En asociación temporal con la administración oral de Urapidil se ha observado una disminución en el recuento de plaquetas, aunque no se ha podido establecer una relación causal con el tratamiento con Urapidil p. ej. mediante estudios inmunohematológicos.
Trastornos del sistema nervioso
Frecuentes: vértigo, cefalea
Trastornos psiquiátricos
Muy raros: agitación
Trastornos del aparato reproductor y de la mama
Raros: priapismo
Trastornos respiratorios, torácicos y mediastínicos
Raro: congestión nasal
Trastornos de la piel y del tejido subcutáneo
Poco frecuentes: transpiración abundante
Muy raros: reacciones alérgicas como prurito, enrojecimiento de la piel y exantema.
¡m
Síntomas de sobredosis:
- Síntomas circulatorios: Vértigo, hipotensión ortostática, colapso
- Síntomas del sistema nervioso central: Fatiga y alteración de la velocidad de reacción.
Tratamiento en caso de intoxicación:
Una reducción excesiva de la presión arterial puede mitigarse colocando al paciente con las piernas elevadas y efectuando expansión volémica. Si estas medidas no resultan adecuadas, puede administrarse un agente vasoconstrictor mediante inyección intravenosa lentamente, monitorizando los niveles de presión arterial.
La inyección intravenosa de catecolaminas (como adrenalina, 0.5-1.0 mg en 10 ml de solución salina isotónica) es necesaria en muy raros casos.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Antagonistas alfa-adrenoreceptores, código ATC: C02CA06
Urapidil Accord _es un vasodilatador que presenta un mecanismo de acción dual. Por un lado, es un antagonista selectivo de los receptores ai adrenérgicos postsinápticos periféricos. Por otro lado, a nivel central regula la presión arterial y el tono simpático mediante una inhibición de los receptores a1 adrenérgicos y una estimulación de los receptores 5 HT1A serotoninérgicos. En el hipertenso, estos efectos se traducen rápidamente en una disminución de las tensiones arteriales sistólica y diastólica, en decúbito, en posición de pie, en reposo y en esfuerzo, sin aumento reflejo de la frecuencia cardíaca. El descenso de la presión arterial es secundario a la reducción de las resistencias totales periféricas sin modificación del gasto cardíaco. Cuando hay un aumento de las resistencias pulmonares, para una misma dosis de urapidil, el descenso de estas resistencias es superior al de las resistencias totales periféricas.
No se ha comprobado ningún efecto sobre el broncoespasmo. Las secreciones de renina y aldosterona no aumentan. No se ha observado efecto de primera dosis, ni taquifilaxia, ni fenómeno de rebote. En el curso de los estudios, el urapidil no ha modificado el equilibrio hidroelectrolítico, el metabolismo de los lípidos, la tolerancia a los hidratos de carbono, las funciones hepáticas y renales y/o las constantes hematológicas.
En los pacientes que sufren de enfermedad pulmonar con insuficiencia respiratoria crónica (hipoxia e hipercapnia) e hipertensión arterial pulmonar secundaria, diversos estudios han demostrado que el urapidil tiene una acción vasodilatadora en la circulación pulmonar. No existe ningún efecto nocivo sobre la función ventilatoria, la broncorreactividad y los intercambios gaseosos.
Estudios efectuados en neurocirugía han puesto de manifiesto la ausencia de elevación de la presión intracraneal y el mantenimiento de los parámetros hemodinámicas intracraneales después de la administración de urapidil por vía intravenosa.
5.2 Propiedades farmacocinéticas
Después de la administración i.v. la concentración plasmática disminuye 10 minutos y después permanece en meseta durante aproximadamente 1 hora. La vida media de eliminación sérica es de 2,7 horas como
¡m
media. Urapidil se metaboliza esencialmente a nivel hepático en tres metabolitos, el principal de los cuales, en el hombre, es el derivado parahidroxilo (M1), que es inactivo.
Del 50 al 70% de la dosis administrada se elimina en forma de metabolitos en orina mientras que del 15 al 20% del producto original se elimina sin cambios. El resto se elimina por las heces.
La unión con las proteínas plasmáticas es del 80%.
5.3 Datos preclínicos sobre seguridad
La DL50 de urapidil es de 70 a 180 veces la dosis máxima terapéutica diaria media, con inyección “in bolus”, y de 100 a 840 veces con infusión i.v.
Ninguno de los resultados de los estudios de toxicidad por administración repetida indican un uso clínico restrictivo de urapidil.
Urapidil no demostró propiedades mutagénicas.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Propilenglicol, hidrogenofosfato de sodio dihidrato, dihidrogenofosfato de sodio dihidrato, ácido clorhídrico, hidróxido de sodio y agua para inyectables.
6.2 Incompatibilidades
Urapidil Accord no debe mezclarse con soluciones alcalinas para inyección o infusión, puesto que puede producirse enturbiamiento o floculación debido a las propiedades ácidas de la solución de la inyección.
6.3 Periodo de validez
3 años
Se ha demostrado la estabilidad química y física de la formulación preparada para ser utilizada durante 50 horas a 15-25°C. Urapidilo Accord es compatible con las siguientes soluciones para infusión: solución de cloruro sódico (NaCl 0.9%), solución glucosada al 5% o solución glucosada al 10%. No deben utilizarse soluciones alcalinas.
Desde el punto de vista microbiológico, la formulación preparada para su uso debe utilizarse inmediatamente.
Si no se utiliza inmediatamente, la conservación dentro del tiempo y las condiciones de uso son responsabilidad del manipulador.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
6.4 Precauciones especiales de conservación
No conservar a temperatura superior a 30°C.
Para las condiciones de conservación del medicamento diluido, ver sección 6.3.
6.5 Naturaleza y contenido del envase
Urapidil Accord se presenta en forma de una ampolla de vidrio transparente tipo I de 10 ml en un envase unitario de conteniendo 5 ampollas.
6.6 Precauciones especiales de eliminación y otras manipulaciones
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Accord Healthcare, S.L.U.
World Trade Center
Moll de Barcelona s/n, Edifici Est,
6a planta 08039 Barcelona
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Noviembre 2012
10. FECHA DE LA REVISIÓN DEL TEXTO
8 de 8