Trypsone Polvo Y Disolvente Para Solucion Para Perfusion

MINISTERIO
DE SANIDAD, POLÍTICA SOCIAL E IGUALDAD
|
íit |
k agencia española de 1 medicamentos y | productos sanitarios |
1. NOMBRE DEL MEDICAMENTO
Trypsone 20 mg/ml polvo y disolvente para solución para perfusión
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Alfa-1 -antitripsina
Trypsone se presenta como polvo y disolvente para solución para perfusión, con un contenido nominal de 0,5 g o 1 g de alfa-1-antitripsina por vial.
El producto contiene 0,02 g/ml (0,5 g/25 ml o 1 g/50 ml) de alfa-1-antitripsina, cuando se reconstituye con 25 ml o 50 ml, respectivamente, de agua para inyectables.
La actividad específica de Trypsone es > 0,5 mg de alfa-1-antitripsina activa/mg de proteína.
Este medicamento contiene 4,37 mmol de sodio por vial de 0,5 g y 8,74 mmol de sodio por vial de 1 g. Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Polvo y disolvente para solución para perfusión.
Vial conteniendo polvo blanco o blanco ligeramente amarillo-verdoso o amarillo y vial con agua para inyectables (disolvente).
4. DATOS CLÍNICOS
4.1. Indicaciones terapéuticas
La administración de Trypsone está indicada en el tratamiento de sustitución crónico en cierto tipo de pacientes con déficit congénito de alfa-1-antitripsina (fenotipos: Pi ZZ, PiZ (null), Pi (null) (null), PiS Z) con enfisema panacinar clínicamente demostrable.
4.2. Posología y forma de administración
Posología
En el adulto, la dosis recomendada de Trypsone es de 60 mg/kg de peso corporal administrado mediante perfusión intravenosa una vez por semana.
No se ha establecido la seguridad de Trypsone en menores de 18 años.
Forma de administración
Reconstituir el producto como se describe en sección 6.6. El producto debe administrarse por vía intravenosa a una velocidad aproximada de 0,08 ml/kg/min.
Correo electrónicoI
C/ CAMPEZO, 1 - EDIFICIO 8 28022 MADRID
Se atenderán exclusivamente incidencias informáticas sobre la aplicación CIMA (http://www.aemps.gob.es/cima)

4.3. Contraindicaciones
Trypsone no debe administrarse a:
- Pacientes con déficit selectivo de IgA y que poseen anticuerpos frente a la IgA.
- Pacientes con hipersensibilidad al principio activo o a alguno de los excipientes (ver sección 4.4).
4.4. Advertencias y precauciones especiales de empleo
Como otros coloides, tras la administración de Trypsone puede producirse un aumento del volumen plasmático, por lo que debe emplearse con precaución en pacientes con riesgo de sobrecarga circulatoria.
Para prevenir la transmisión de enfermedades infecciosas cuando se administran medicamentos derivados de la sangre o plasma humanos, se toman medidas estándar como la selección de donantes, análisis de marcadores específicos de infecciones en las donaciones individuales y en las mezclas de plasma, así como la inclusión de etapas en el proceso de fabricación para eliminar / inactivar virus. A pesar de esto, cuando se administran medicamentos derivados de la sangre o plasma humanos, la posibilidad de transmisión de agentes infecciosos no se puede excluir totalmente. Esto también se refiere a virus y agentes infecciosos emergentes o de naturaleza desconocida.
Las medidas tomadas se consideran efectivas para virus envueltos tales como el VIH, el VHB y el VHC y para el virus no envuelto VHA. Las medidas tomadas pueden tener un valor limitado para virus no envueltos tales como el parvovirus B19. La infección por parvovirus B19 puede ser grave para una mujer embarazada (infección fetal) y para sujetos con inmunodeficiencia o con una producción aumentada de hematíes (ej. con anemia hemolítica).
Se recomienda la vacunación apropiada (hepatitis A y B) para los pacientes que reciban regularmente concentrados de alfa-1-antitripsina.
Es altamente recomendable que cada vez que se administre Trypsone a un paciente se deje constancia del nombre del medicamento y n° de lote administrado a fin de mantener una relación entre el paciente y el lote de producto.
Advertencias sobre excipientes: Este medicamento contiene 4,37 mmol de sodio por vial de 0,5 g y 8,74 mmol de sodio por vial de 1 g. Lo que deberá tenerse en cuenta en el tratamiento de pacientes con dietas pobres en sodio.
4.5. Interacción con otros medicamentos y otras formas de interacción
No se han observado interacciones de alfa-1-antitripsina humana con otros medicamentos.
4.6. Embarazo y lactancia
No se han realizado estudios de seguridad en mujeres embarazadas, por lo que en estos casos sólo deberá administrarse Trypsone cuando el beneficio supere el riesgo potencial.
Se desconoce si Trypsone se excreta en la leche materna, por lo que no debe administrarse a mujeres en periodo de lactancia.

4.7. Efectos sobre la capacidad para conducir y utilizar máquinas.
La influencia de Trypsone sobre la capacidad para conducir y utilizar máquinas es nula o insignificante.
4.8. Reacciones adversas
Rara vez se han observado reacciones alérgicas o de hipersensibilidad (que pueden incluir angioedema, sensación de ardor y picor en el lugar de infusión, escalofríos, enrojecimiento, erupciones cutáneas que pueden llegar a urticaria generalizada, cefalea, hipotensión, somnolencia, náuseas, inquietud, taquicardia, opresión torácica, hormigueo, vómitos, dificultad al respirar) en pacientes tratados con productos que contienen alfa-1-antitripsina. Tales reacciones normalmente remiten cuando se disminuye la velocidad de perfusión o cuando ésta se suspende. En ciertos casos, estas reacciones han progresado hasta anafilaxia grave (incluyendo shock). En estos casos, la perfusión debe suspenderse inmediatamente y se debe iniciar el tratamiento apropiado.
En raras ocasiones se ha observado fiebre.
Para seguridad en relación con los agentes transmisibles, ver sección 4.4.
4.9. Sobredosis
No se han notificado casos de sobredosis.
5. PROPIEDADES FARMACOLÓGICAS
5.1. Propiedades farmacodinámicas
Grupo farmacoterapéutico: antifibrinolíticos, inhibidores de proteinasa. Código ATC: B02AB 02.
La alfa-1-antitripsina es una proteína que circula por la sangre. Es uno de los inhibidores de proteinasa humana más importantes, siendo el responsable de más del 90% de la capacidad antiproteolítica del tracto respiratorio inferior. Su objetivo fisiológico es la elastasa del neutrófilo (EN), una potente proteasa que en grandes cantidades puede producir la destrucción de las paredes alveolares.
La deficiencia de alfa-1-antitripsina es un trastorno hereditario que se caracteriza por una producción anormal de la proteína alfa-1-antitripsina.
La administración de alfa-1-antitripsina exógena permite aumentar el nivel de alfa-1-antitripsina en suero. Ello conlleva incrementos en las concentraciones pulmonares y la restauración del equilibrio proteasa/antiproteasa, lo que previene o desacelera la destrucción del tejido pulmonar.
5.2. Propiedades farmacocinéticas
Se ha realizado un ensayo clínico para obtener los parámetros farmacocinéticos de alfa-1-antitripsina
siendo estos: la semivida in vivo es de 5,9 ± 1,2 días, aclaramiento renal 0,30 ± 0,06 ml/min, concentración máxima (C max.) 37,1 ± 4,8 pmol/1 y volumen de distribución (Vd) 3,5 ± 0,6 1.
5.3. Datos preclínicos sobre seguridad

La alfa-1-antitripsina es un componente normal del plasma humano.
Las pruebas de toxicidad a dosis única son poco relevantes y no permiten la estimación de la dosis tóxica letal o de la relación dosis-efecto.
Las pruebas de toxicidad con dosis repetidas en animales son impracticables debido a la formación de anticuerpos.
La alfa-1-antitripsina no ha sido asociada con toxicidad embrio-fetal ni potencial carcinogénico ni mutagénico.
No se han descrito signos de toxicidad aguda en animales de experimentación.
6. DATOS FARMACÉUTICOS
6.1. Lista de excipientes
- Cloruro.
- Fosfato.
- Agua para inyectables (disolvente).
6.2. Incompatibilidades
Trypsone no debe mezclarse con otros medicamentos.
6.3. Período de validez
3 años.
La solución reconstituida debe ser utilizada inmediatamente o en el plazo de 3 horas.
6.4. Precauciones especiales de conservación
No conservar a temperatura superior a 30 °C. No congelar.
6.5. Naturaleza y contenido del envase
Trypsone se presenta en viales de vidrio tipo II, que contienen 0,5 ó 1 g de alfa-1-antitripsina (polvo para perfusión) y un vial de vidrio tipo I con 25 ml (0,5 g) o 50 ml (1 g) de agua para inyectables (disolvente).
Cada vial de Trypsone va acompañado de un accesorio para su preparación.
Puede que sólo estén comercializados algunos tamaños de envases.
Contenido de la caja: 1 vial de liofilizado, 1 vial de disolvente y accesorio.
6.6. Precauciones especiales de eliminación y otras manipulaciones
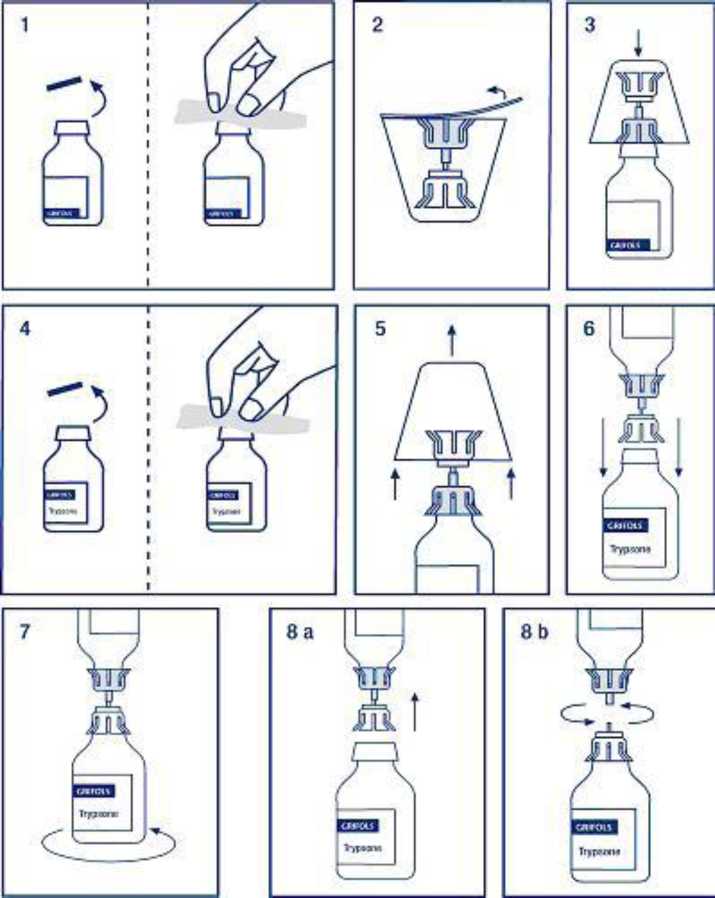
Preparación de la solución:

1. Desprecintar el vial del disolvente y desinfectar el tapón con una solución antiséptica.
2. Desprecintar el adaptador Mix2Vial.
3. Sujetar el adaptador, aún en el interior de su envoltorio, y perforar firmemente el tapón del vial del disolvente con el terminal azul del adaptador.
4. Desprecintar el vial del producto liofilizado y desinfectar el tapón con una solución antiséptica.
5. Sujetando el vial del disolvente, retirar con cuidado el envoltorio del adaptador.
6. Invertir el vial del disolvente, con el adaptador unido, y perforar firmemente el tapón del vial del producto liofilizado con el terminal transparente del adaptador. El disolvente se trasvasará automáticamente al vial del producto liofilizado.
7. Con los dos viales todavía unidos por el adaptador, girar suavemente el vial del producto procurando no producir espuma hasta la total disolución. No agitar.
El producto debe ser administrado por vía intravenosa, antes de 3 horas después de su reconstitución.
Para proceder a la administración del producto deberá retirarse previamente el adaptador (8a), excepto en aquellos casos en que sea necesario administrar el contenido de más de un vial de Trypsone. En este caso, el contenido de los viales puede ser trasvasado mediante técnicas asépticas a un recipiente para infusión intravenosa compatible, retirando la parte azul del adaptador (8b).
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
Generalmente la solución es clara o ligeramente opalescente. No utilizar soluciones que presenten turbidez o sedimentos.
Una vez reconstituida, la solución debe desecharse si se observan partículas en su interior.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Instituto Grifols, S.A.
Can Guasch, 2 - Parets del Valles 08150 Barcelona - ESPAÑA
8. NÚMERO DE AUTORIZACIÓN DE COMERCIALIZACIÓN
65456
9. FECHA DE LA PRIMERA AUTORIZACIÓN /RENOVACIÓN DE LA AUTORIZACIÓN
30 Junio 2003
10. FECHA DE LA REVISIÓN DEL TEXTO
Texto revisado: Octubre 2009
La información detallada en este medicamento está disponible en la página web de la Agencia Española de Medicamentos y Productos Sanitarios.


Agencia española de
medicamentos y
productos sanitarios