Trisenox 1 Mg/Ml, Concentrado Para Solucion Para Perfusion
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
1. NOMBRE DEL MEDICAMENTO
TRISENOX 1 mg/ml, concentrado para solución para perfusión
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
1 ml de TRISENOX contiene 1 mg de Trióxido de arsénico Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Concentrado para solución para perfusión Solución acuosa estéril, transparente e incolora.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
TRISENOX está indicado en la inducción de la remisión y consolidación en los pacientes adultos con leucemia promielocítica aguda (APL) recidivante/refractaria, caracterizada por la presencia de la traslocación t(15;17) y/o por la presencia del gen leucemia promielocítica/receptor alfa del ácido retinoico (PML/RAR-alfa). El tratamiento previo debe haber incluido un retinoide y quimioterapia.
No se ha examinado el índice de respuesta de otros subtipos de leucemia aguda mieloblástica a TRISENOX.
4.2 Posología y forma de administración Posología
TRISENOX se administrará bajo la supervisión de un médico con experiencia en el tratamiento de las leucemias agudas y deberán seguirse los procedimientos especiales de monitorización descritos en la Sección 4.4. Se recomienda la misma dosis en adultos y pacientes de edad avanzada.
Programa para el tratamiento de inducción
TRISENOX se administrará por vía intravenosa a una dosis fija de 0,15 mg/kg/día administrada diariamente hasta que se obtenga la remisión en la médula ósea (menos del 5% de blastos presentes en la médula ósea sin presencia de células leucémicas). Si no se produce la remisión en la médula ósea en 50 días, debe interrumpirse la dosificación.
Programa de consolidación
El tratamiento de consolidación debe comenzar de 3 a 4 semanas después de finalizar la terapia de inducción. TRISENOX se administrará por vía intravenosa en dosis de 0,15 mg/kg/día durante 25 dosis administradas 5 días a la semana, seguido de 2 días de descanso, durante 5 semanas.
Retraso, modificación y reinicio de la dosificación
El tratamiento con TRISENOX debe interrumpirse, ajustarse o suspenderse antes de finalizar la terapia programada en cualquier momento que se observe un grado de toxicidad G3 o superior según los Criterios de Toxicidad Común del Instituto Nacional del Cáncer y se juzgue que es posible que esté relacionada con el tratamiento con TRISENOX. Los pacientes que experimenten dichas reacciones, que se considere que tienen relación con TRISENOX, deben iniciar de nuevo el tratamiento sólo después de la remisión del acontecimiento tóxico o después de la recuperación de los niveles basales de la alteración que produjo la interrupción. En estos casos, el tratamiento debe iniciarse al 50% de la dosis diaria anterior. Si no se produce recurrencia del acontecimiento tóxico en el transcurso de 3 días desde la reinstauración del tratamiento a la dosis reducida, la dosis diaria puede aumentarse gradualmente hasta alcanzar el 100% de la dosis original. Los pacientes que experimenten recidiva de la toxicidad deben abandonar el tratamiento.
Ver sección 4.4 en caso de anomalías del ECG y de los electrolitos.
Pacientes con insuficiencia hepática y/o renal
Se recomienda precaución en el uso de TRISENOX en pacientes con insuficiencia hepática y/o renal ya que solo se dispone de escasa información en los distintos tipos de insuficiencia hepática y renal.
Población pediátrica
No se ha establecido la seguridad y eficacia de TRISENOX en niños de edad superior a los 17 años. Los datos actualmente disponibles en niños de edad comprendida entre 5 y 16 años están descritos en la sección 5.1, sin embargo no se puede hacer una recomendación posológica. No se dispone de datos en pacientes pediátricos de edad inferior a 5 años.
Forma de administración
TRISENOX se administrará por vía intravenosa en un período de 1-2 horas. La duración de la perfusión se puede ampliar hasta 4 horas si se observan reacciones vasomotoras. No se requiere el uso de un catéter venoso central. Debe hospitalizarse a los pacientes al principio del tratamiento debido a los síntomas de la enfermedad y para asegurar una monitorización adecuada.
Para consultar las instrucciones de preparación del medicamento antes de la administración, ver sección 6.6.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
Los pacientes con APL clínicamente inestable tienen un mayor riesgo y necesitarán una monitorización más frecuente de los niveles de electrolitos y de glucemia, al igual que pruebas más frecuentes de los parámetros hematológicos, hepáticos, renales y de coagulación.
Síndrome de activación leucocitaria (síndrome de diferenciación de APL): El 27% de los pacientes con APL tratados con TRISENOX han mostrado síntomas similares a los observados en un síndrome denominado ácido retinoico-leucemia promielocítica aguda (RA-APL) o síndrome de diferenciación de APL, caracterizado por fiebre, disnea, aumento de peso, infiltrados pulmonares y derrames pleurales o pericárdicos, con o sin leucocitosis. Este síndrome puede producir la muerte. No se ha estudiado totalmente el tratamiento del síndrome, pero la administración de esteroides a dosis altas ante la primera sospecha del síndrome de diferenciación de APL parece mitigar los signos y los síntomas. Al aparecer los primeros signos indicadores del síndrome (fiebre sin explicación, disnea y/o aumento de peso, hallazgos anormales en la auscultación torácica o alteraciones radiológicas), se debe iniciar inmediatamente el tratamiento con esteroides a dosis altas (10 mg de dexametasona por vía intravenosa, administrados dos veces al día) independientemente del recuento leucocitario y debe continuarse durante al menos 3 días o más, hasta que cedan los signos y los síntomas. La mayoría de los pacientes no requieren interrupción del tratamiento con TRISENOX durante el tratamiento del síndrome de diferenciación de APL. Se recomienda no añadir quimioterapia al tratamiento con esteroides, ya que no hay experiencia con esteroides y quimioterapia durante el tratamiento del síndrome de activación leucocitaria ocasionado por TRISENOX. La experiencia posterior a la comercialización indica que se puede producir un síndrome parecido en los pacientes con otros tipos de cáncer. La monitorización y el tratamiento de estos pacientes debe llevarse a cabo tal y como se ha descrito anteriormente.
Alteraciones en el electrocardiograma (ECG): El trióxido de arsénico puede prolongar el intervalo Q-T y producir un bloqueo auriculoventricular completo. La prolongación del intervalo Q-T puede producir arritmia ventricular en “torsades de pointes” que puede producir la muerte. El tratamiento previo con antraciclinas puede aumentar el riesgo de prolongación del intervalo Q-T. El riesgo de taquicardia ventricular en “torsades de pointes” está relacionado con el grado de prolongación del intervalo Q-T, administración concomitante de medicamentos que prolongan el intervalo Q-T (tales como antiarrítmicos de clase Ia y III, (p. ej. quinidina, amiodarona, sotalol, dofetilida), antipsicóticos (p. ej. tioridazina), antidepresivos (p. ej. amitriptilina), algunos macrólidos (p. ej. eritromicina), algunos antihistamínicos (p. ej. terfenadina y astemizol), algunos antibióticos derivados de la quinolona (p. ej. esparfloxacino) y otros medicamentos individuales conocidos por aumentar el intervalo Q-T (p. ej. cisaprida)), antecedentes de taquicardia ventricular en “torsades de pointes”, prolongación del intervalo Q-T preexistente, insuficiencia cardíaca congestiva, administración de diuréticos que produzcan pérdida de potasio, amfotericina B o enfermedades que puedan producir hipocalemia o hipomagnesemia. En los estudios clínicos, el 40% de los pacientes tratados con TRISENOX experimentó por lo menos una prolongación del intervalo Q-T corregido (Q-Tc) mayor de 500 ms. Se observó una prolongación del intervalo Q-Tc entre 1 y 5 semanas después de la perfusión de TRISENOX, volviendo al valor basal en un plazo de 8 semanas después de la perfusión de TRISENOX. Una paciente (que recibió múltiples medicamentos concomitantes, entre los que se incluía la amfotericina B) padeció taquicardia ventricular en “torsades de pointes” asintomática durante el tratamiento de inducción con trióxido de arsénico para una recaída de APL.
Recomendaciones de monitorización de electrolitos y ECG: Antes de iniciar el tratamiento con TRISENOX, se realizará un electrocardiograma de 12 derivaciones junto a una analítica de los electrolitos séricos (potasio, calcio y magnesio), así como de la creatinina. Se corregirán las alteraciones preexistentes de los electrolitos y, si es posible, se interrumpirán los medicamentos que prolonguen el intervalo Q-T. Deberá monitorizarse a los pacientes que presenten factores de riesgo de prolongación del intervalo Q-Tc o factores de riesgo de taquicardia ventricular en “torsades de pointes” mediante monitorización cardiaca continua (ECG). Para un intervalo Q-Tc mayor de 500 ms, deben completarse las medidas correctoras y volverse a evaluar el Q-Tc con ECG en serie antes de considerar el uso de TRISENOX. Durante el tratamiento con TRISENOX, las concentraciones de potasio se mantendrán por encima de los 4 mEq/l y las de magnesio, por encima de 1,8 mg/dl. Se volverán a evaluar aquellos pacientes que alcancen un valor del intervalo Q-T absoluto > 500 ms y se emprenderán las acciones inmediatas dirigidas a corregir los factores de riesgo concomitantes, si los hubiera, al mismo tiempo que debe considerarse el riesgo/beneficio de continuar frente a suspender el tratamiento con TRISENOX. En caso de síncope, latidos cardíacos rápidos o irregulares, debe hospitalizarse al paciente y monitorizarse de forma continua, se valorarán los electrolitos séricos, interrumpiéndose temporalmente el tratamiento con TRISENOX hasta que el intervalo Q-T descienda por debajo de 460 ms, se corrijan las alteraciones de electrolitos y remita el síncope y el latido cardíaco irregular. No hay datos sobre el efecto de TRISENOX sobre el intervalo Q-Tc durante la perfusión. Durante la inducción y la consolidación, se obtendrán electrocardiogramas dos veces por semana y con mayor frecuencia en los pacientes clínicamente inestables.
Retraso y modificación de la dosis: El tratamiento con TRISENOX debe interrumpirse, ajustarse o suspenderse antes de finalizar la terapia programada en cualquier momento que se observe un grado de toxicidad G3 o superior según los Criterios de Toxicidad Común del Instituto Nacional del Cáncery se juzgue que es posible que esté relacionada con el tratamiento con TRISENOX(ver sección 4.2).
Analítica: Se monitorizarán por lo menos dos veces por semana los niveles de electrolitos y de glucemia, al igual que pruebas de los parámetros hematológicos, hepáticos, renales y de coagulación, y con mayor frecuencia en los pacientes clínicamente inestables durante la fase de inducción, y al menos una vez por semana durante la fase de consolidación.
Pacientes con insuficiencia renal:
Se recomienda precaución en el uso de TRISENOX en pacientes con insuficiencia renal ya que solo se dispone de información limitada en los distintos tipos de insuficiencia renal. La experiencia en pacientes con insuficiencia renal grave es insuficiente para determinar si es preciso un ajuste de la dosis.
No se ha estudiado el uso de TRISENOX en pacientes sometidos a diálisis.
Pacientes con insuficiencia hepática:
Se recomienda precaución en el uso de TRISENOX en pacientes con insuficiencia hepática ya que solo se dispone de información limitada en los distintos tipos de insuficiencia hepática. La experiencia en pacientes con insuficiencia hepática grave es insuficiente para determinar si es preciso un ajuste de la dosis.
Pacientes de edad avanzada: Hay datos clínicos limitados sobre el uso de TRISENOX en pacientes de edad avanzada. Deberán tomarse precauciones en estos pacientes.
Hiperleucocitosis: El tratamiento con TRISENOX ha sido asociado con el desarrollo de hiperleucocitosis (>10 x 103/pl) en algunos pacientes. No pareció existir una relación entre los recuentos basales de leucocitos y el desarrollo de hiperleucocitosis, ni una correlación entre el recuento basal y los recuentos máximos de leucocitos. La hiperleucocitosis no se ha tratado nunca con quimioterapia adicional, y remitió al continuar el tratamiento con TRISENOX. Los recuentos de leucocitos durante la fase de consolidación no fueron tan altos como durante el tratamiento de inducción, siendo <10 x 103/pl, excepto en un paciente que presentó un recuento de leucocitos de 22 x 103/pl durante la consolidación. 20 pacientes (50%) experimentaron leucocitosis; sin embargo, el recuento leucocitario, en todos estos pacientes, disminuyó o se normalizó antes de la remisión en la médula ósea y no fue necesaria la quimioterapia citotóxica o leucoféresis.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han realizado valoraciones formales de las interacciones farmacocinéticas entre TRISENOX y otros medicamentos. Cabe esperar una prolongación del intervalo Q-T/Q-Tc durante el tratamiento con TRISENOX, habiéndose descrito la presencia de taquicardia ventricular en “torsades de pointes” y bloqueo cardíaco completo. El riesgo de taquicardia ventricular en “torsades de pointes”es mayor en los pacientes que reciben o han recibido medicamentos que provocan hipocalemia o hipomagnesemia, como los diuréticos o la amfotericina B. Se aconseja precaución cuando se administra simultáneamente TRISENOX con otros medicamentos que prolonguen el intervalo Q-T/Q-Tc, como los antibióticos macrólidos, el antipsicótico tioridazina o medicamentos que provoquen hipocalemia o hipomagnesemia. En la Sección 4.4, se facilita información adicional sobre los medicamentos que prolongan el intervalo Q-T. Se desconoce la influencia de TRISENOX sobre la eficacia de otros medicamentos antileucémicos.
4.6 Fertilidad, embarazo y lactancia
Anticoncepción en hombres y mujeres
Los hombres y las mujeres en edad fértil deben utilizar métodos anticonceptivos efectivos durante el tratamiento con TRISENOX.
Embarazo
El trióxido de arsénico ha demostrado embriotoxicidad y teratogenicidad en estudios realizados en animales (ver sección 5.3). No hay estudios realizados en mujeres gestantes que usen TRISENOX.
Por lo tanto, se informará a la paciente sobre los posibles daños en el feto si se usa este medicamento durante el embarazo, o si la paciente queda embarazada durante el tratamiento.
Lactancia
El arsénico se excreta en la leche materna. Debido a la posibilidad de que TRISENOX provoque reacciones adversas graves en los lactantes, se debe interrumpir la lactancia antes y a lo largo del tratamiento.
Fertilidad
No se han realizado estudios clínicos o no clínicos de fertilidad con TRISENOX.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No se han realizado estudios de los efectos sobre la capacidad para conducir y utilizar máquinas.
4.8 Reacciones adversas
Se produjeron reacciones adversas relacionadas de grado 3 y 4 según los Criterios de Toxicidad Común (CTC) en el 37% de los pacientes en los ensayos clínicos. Los acontecimientos comunicados con más frecuencia fueron hiperglucemia, hipocalemia, neutropenia y aumento de la alanina aminotransferasa (ALT). La leucocitosis se presentó en el 50% de los pacientes con APL, determinada por pruebas hematológicas.
Las reacciones adversas graves fueron frecuentes (1-10%) y no inesperadas en esta población. Las reacciones adversas graves atribuidas a TRISENOX fueron el síndrome de diferenciación de APL (3), leucocitosis (3), un intervalo Q-T prolongado (4, uno con taquicardia ventricular tipo ”torsade de pointes”), fibrilación auricular/flúter auricular (1), hiperglucemia (2) y varias reacciones adversas graves relacionadas con hemorragias, infecciones, dolor, diarrea y náuseas.
En general, los acontecimientos adversos debidos al tratamiento tendieron a disminuir con el tiempo, quizás como consecuencia de la mejoría del proceso patológico subyacente. Los pacientes tendieron a tolerar mejor el tratamiento de consolidación y mantenimiento con una toxicidad menor que en el tratamiento de inducción. Es probable que esto se deba a un fenómeno de enmascaramiento/confusión entre los acontecimientos adversos, el escaso control del propio proceso patológico al inicio del tratamiento y la medicación concomitante necesaria para el control de los síntomas y la morbilidad.
Las siguientes reacciones adversas se han notificado en ensayos clínicos y/o experiencia postcomercialización. Las reacciones adversas se relacionan a continuación de acuerdo con los términos preferidos de la clasificación de órganos del sistema MedDRA y las frecuencias observadas durante los ensayos clínicos de TRISENOX realizados en 52 pacientes con APL recidivante/refractaria. Las frecuencias se definen como: muy frecuentes >1/10, frecuentes >1/100 a <1/10, poco frecuentes >1/1.000 a <1/100, frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
|
Cualquier grado |
Grados >3 | |
|
Infecciones e infestaciones Herpes zóster |
Frecuente |
Frecuencia no conocida |
|
Sepsis |
Frecuencia no conocida |
Frecuencia no conocida |
|
Neumonía |
Frecuencia no conocida |
Frecuencia no conocida |
|
Trastornos de la sangre y del sistema linfático | ||
|
Neutropenia febril |
Frecuente |
Frecuente |
|
Leucocitosis |
Frecuente |
Frecuente |
|
Neutropenia |
Frecuente |
Frecuente |
|
Pancitopenia |
Frecuente |
Frecuente |
|
T rombocitopenia |
Frecuente |
Frecuente |
|
Cualquier grado |
Grados >3 | |
|
Anemia |
Frecuente |
Frecuencia no conocida |
|
Leucopenia |
Frecuencia no conocida |
Frecuencia no conocida |
|
Linfopenia |
Frecuencia no conocida |
Frecuencia no conocida |
|
Trastornos del metabolismo y de la nutrición | ||
|
Hiperglucemia |
Muy frecuente |
Muy frecuente |
|
Hipocalemia |
Muy frecuente |
Muy frecuente |
|
Hipomagnesemia |
Muy frecuente |
Frecuente |
|
Hipermagnesemia |
Frecuente |
Frecuencia no conocida |
|
Hipernatremia |
Frecuente |
Frecuente |
|
Cetoacidosis |
Frecuente |
Frecuente |
|
Deshidratación |
Frecuencia no conocida |
Frecuencia no conocida |
|
Retención de líquidos |
Frecuencia no conocida |
Frecuencia no conocida |
|
Trastornos psiquiátricos | ||
|
Estado de confusión |
Frecuencia no conocida |
Frecuencia no conocida |
|
Trastornos del sistema nervioso | ||
|
Parestesia |
Muy frecuente |
Frecuente |
|
Mareos |
Muy frecuente |
Frecuencia no conocida |
|
Cefalea |
Muy frecuente |
Frecuencia no conocida |
|
Convulsiones |
Frecuente |
Frecuencia no conocida |
|
Trastornos oculares | ||
|
Visión borrosa |
Frecuente |
Frecuencia no conocida |
|
Trastornos cardíacos | ||
|
Taquicardia |
Muy frecuente |
Frecuente |
|
Derrame pericárdico |
Frecuente |
Frecuente |
|
Extrasístoles ventriculares |
Frecuente |
Frecuencia no conocida |
|
Insuficiencia cardíaca |
Frecuencia no conocida |
Frecuencia no conocida |
|
Taquicardia ventricular |
Frecuencia no conocida |
Frecuencia no conocida |
|
Trastornos vasculares Vasculitis |
Frecuente |
Frecuente |
|
Hipotensión |
Frecuente |
Frecuencia no conocida |
|
Trastornos respiratorios, torácicos y mediastínicos | ||
|
Síndrome de diferenciación |
Muy frecuente |
Muy frecuente |
|
Disnea |
Muy frecuente |
Frecuente |
|
Hipoxia |
Frecuente |
Frecuente |
|
Derrame pleural |
Frecuente |
Frecuente |
|
Dolor pleurítico |
Frecuente |
Frecuente |
|
Hemorragia pulmonar alveolar |
Frecuente |
Frecuente |
|
Neumonitis |
Frecuencia no conocida |
Frecuencia no conocida |
|
Trastornos gastrointestinales | ||
|
Diarrea |
Muy frecuente |
Frecuente |
|
Vómitos |
Muy frecuente |
Frecuencia no conocida |
|
Náuseas |
Muy frecuente |
Frecuencia no conocida |
|
Dolor abdominal |
Frecuente |
Frecuente |
|
Trastornos de la piel y del tejido subcutáneo | ||
|
Prurito |
Muy frecuente |
Frecuencia no conocida |
|
Rash |
Muy frecuente |
Frecuencia no conocida |
|
Eritema |
Frecuente |
Frecuente |
|
Edema facial |
Frecuente |
Frecuencia no conocida |
|
Trastornos musculoesqueléticos y del tejido conjuntivo | ||
|
Mialgia |
Muy frecuente |
Frecuente |
|
Artralgia |
Frecuente |
Frecuente |
|
Cualquier grado |
Grados >3 | |
|
Dolor óseo |
Frecuente |
Frecuente |
|
Trastornos renales y urinarios Insuficiencia renal |
Frecuente |
Frecuencia no conocida |
|
Trastornos generales y alteraciones |
en el lugar de administración | |
|
Pirexia |
Muy frecuente |
Frecuente |
|
Dolor |
Muy frecuente |
Frecuente |
|
Fatiga |
Muy frecuente |
Frecuencia no conocida |
|
Edema |
Muy frecuente |
Frecuencia no conocida |
|
Dolor torácico |
Frecuente |
Frecuente |
|
Escalofríos |
Frecuente |
Frecuencia no conocida |
|
Exploraciones complementarias Aumento de la alanin aminotransferasa |
Muy frecuente |
Frecuente |
|
Aumento de la aspartato aminotransferasa |
Muy frecuente |
Frecuente |
|
Q-T prolongado en ECG |
Muy frecuente |
Frecuente |
|
Hiperbilirrubinemia |
Frecuente |
Frecuente |
|
Aumento de la creatinina en sangre |
Frecuente |
Frecuencia no conocida |
|
Aumento de peso |
Frecuente |
Frecuencia no conocida |
|
Aumento de la gamma, ^ ° Frecuencia no conocida* glutamiltransferasa |
Frecuencia no conocida* | |
*En el estudio CALGB C9710, se describieron 2 casos de aumento de la GGTde grado >3 entre los 200 pacientes que recibieron ciclos de consolidación de TRISENOX (ciclo 1 y ciclo 2) frente al grupo de control que no recibió ninguno.
Durante el tratamiento con TRISENOX, 14 de los 52 pacientes estudiados en los ensayos de APL presentaron uno o más síntomas del síndrome de diferenciación de APL, caracterizado por fiebre, disnea, aumento de peso, infiltrados pulmonares y derrames pericárdicos o pleurales con o sin leucocitosis (ver sección 4.4). Veintisiete pacientes presentaron leucocitosis (leucocitos > 10 x 103/pl) durante la inducción, 4 de los cuales tuvieron valores por encima de los 100.000/pl. Los recuentos basales de leucocitos no se correlacionaron con el desarrollo de la leucocitosis en el estudio y los recuentos de leucocitos durante el tratamiento de consolidación no fueron tan altos como durante la fase de inducción. En estos estudios, la leucocitosis no se trató con medicamentos quimioterápicos. Los medicamentos que se usaron para reducir el recuento de leucocitos aumentaron con frecuencia la toxicidad asociada a la leucocitosis, no demostrándose eficaz ningún enfoque estándar. Un paciente tratado en un programa de uso compasivo falleció de infarto cerebral debido a la leucocitosis, después del tratamiento con medicamentos quimioterápicos para reducir el recuento de leucocitos. El enfoque recomendado es la observación, interviniendo sólo en casos seleccionados.
La mortalidad en los estudios pivotales debida a la coagulación intravascular diseminada (CID) asociada a hemorragias fue muy frecuente (> 10%), resultando congruente con la mortalidad prematura descrita en la literatura.
El trióxido de arsénico puede prolongar el intervalo Q-T (ver sección 4.4), lo que puede producir la aparición de taquicardia ventricular tipo “torsades de pointes”, que puede resultar mortal. El riesgo de taquicardia ventricular en “torsades de pointes”está relacionado con el grado de prolongación del intervalo Q-T, administración concomitante de medicamentos que prolongan el intervalo Q-T, antecedentes de taquicardia ventricular en “torsades de pointes”, prolongación del intervalo Q-T preexistente, insuficiencia cardíaca congestiva, administración de diuréticos que produzcan pérdida de potasio u otras enfermedades que puedan producir hipocalemia o hipomagnesemia. Una paciente (que recibió múltiples medicamentos concomitantes, entre los que se incluía la amfotericina B) sufrió taquicardia ventricular en “torsades de pointes”asintomática durante el tratamiento de inducción con trióxido de arsénico por recaída de APL. Esta paciente pudo continuar con la consolidación sin nuevas evidencias de prolongación del intervalo Q-T.
La neuropatía periférica, caracterizada por parestesia/disestesia, es un efecto frecuente y muy conocido del arsénico medioambiental. Sólo dos pacientes abandonaron precozmente el tratamiento debido a este acontecimiento adverso, y uno recibió nuevamente TRISENOX en un protocolo posterior. El 44% de los pacientes experimentó síntomas que podían asociarse con neuropatía, la mayoría de carácter leve a moderado, y reversibles cuando se interrumpió el tratamiento con TRISENOX.
En la experiencia post-comercialización, se ha notificado también un síndrome de diferenciación, como el síndrome del ácido retinoico, en el tratamiento de otras neoplasias distintas de la LPA con TRISENOX.
Notificación de sospechas de reacciones adversas
Es importante notificar las sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación, incluido en el Anexo V.
4.9 Sobredosis
Si aparecen síntomas que indican una toxicidad grave aguda por arsénico (como convulsiones, debilidad muscular y confusión), se interrumpirá inmediatamente el tratamiento con TRISENOX y se valorará la administración de una terapia quelante con penicilamina en una dosis diaria de < 1 g al día. La duración del tratamiento con penicilamina se debe evaluar teniendo en cuenta los valores del laboratorio correspondientes al arsénico en orina. Para los pacientes que no puedan tomar medicamentos por vía oral, se puede considerar la administración de dimercaprol a dosis de 3 mg/kg por vía intramuscular cada 4 horas hasta que haya remitido toda toxicidad que ponga en peligro la vida del paciente de forma inminente. A continuación, se puede administrar penicilamina en una dosis diaria de < 1 g al día. En presencia de coagulopatía, se recomienda la administración oral del agente quelante succímero de ácido dimercaptosuccínico (DCI) 10 mg/kg ó 350 mg/m2 cada 8 horas durante 5 días y después, cada 12 horas durante 2 semanas. Para los pacientes con sobredosis de arsénico aguda y grave, se debe considerar la diálisis.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Otros antineoplásicos, código ATC: L01XX27 Mecanismo de acción
El mecanismo de acción del TRISENOX no se conoce por completo. El trióxido de arsénico produce cambios morfológicos y fragmentación del ácido desoxirribonucléico (ADN) característicos de apoptosis en las células de leucemia promielocítica NB4 humanas in vitro. El trióxido de arsénico produce asimismo lesión o degradación de la proteína de fusión Leucemia promielocítica/ Receptor alfa del ácido retinoico (PML/RAR-alfa).
Eficacia clínica y seguridad
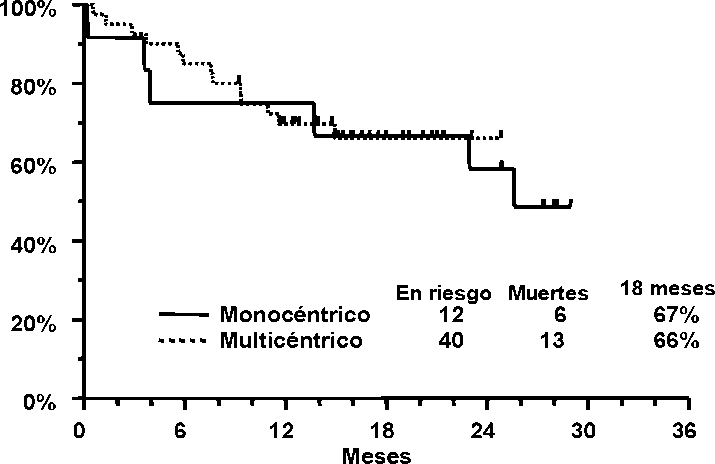
Se ha investigado TRISENOX en 52 pacientes con APL tratados previamente con un régimen de antraciclinas y retinoides en dos estudios abiertos de un solo grupo y no comparativos. Uno era un estudio clínico realizado por un solo investigador (n=12) y el otro, era un estudio multicéntrico realizado en nueve hospitales (n= 40). Los pacientes del primer estudio recibieron una dosis media de 0,16 mg/kg/día de TRISENOX (rango 0,06 a 0,20 mg/kg/día), mientras que en el estudio multicéntrico los pacientes recibieron una dosis fija de 0,15 mg/kg/día. El TRISENOX se administró por vía intravenosa durante 1 ó 2 horas, hasta que la médula ósea quedara libre de células leucémicas hasta un máximo de 60 días. Los pacientes con remisión completa recibieron una terapia de consolidación con TRISENOX durante otras 25 dosis en un período de 5 semanas. La terapia de consolidación comenzó 6 semanas (rango, 3-8) después de la inducción en el estudio unicéntrico, y 4 semanas (rango, 3-6) después de la inducción en el estudio multicéntrico. Se definió la remisión completa (RC) como la ausencia de células leucémicas visibles en la médula ósea y la recuperación periférica de plaquetas y leucocitos.
Los pacientes del estudio unicéntrico habían recidivado después de 1-6 regímenes previos de tratamiento y 2 pacientes habían recidivado después del trasplante de células madre. Los pacientes del estudio multicéntrico habían recidivado después de 1-4 regímenes previos de tratamiento y 5 pacientes habían recidivado después del transplante de células madre. La mediana de edad en el estudio unicéntrico era de 33 años (rango de edades, de 9 a 75). La mediana de edad en el estudio multicéntrico fue de 40 años (rango de edades, de 5 a 73).
Los resultados se resumen en la siguiente tabla.
|
Ensayo unicéntrico N=12 |
Ensayo multicéntrico N=40 | |
|
Dosis de TRISENOX, mg/kg/día (mediana, rango) |
0,16 (0,06 - 0,20) |
0,15 |
|
Remisión completa (RC) |
11 (92%) |
34 (85%) |
|
Tiempo hasta la remisión en médula ósea (mediana) |
32 días |
35 días |
|
Tiempo hasta la remisión completa (mediana) |
54 días |
59 días |
|
Supervivencia a los 18 meses |
67% |
66% |
El estudio unicéntrico incluyó 2 pacientes pediátricos (< 18 años), que lograron una remisión completa. El ensayo multicéntrico incluyó 5 pacientes pediátricos (< 18 años), 3 de los cuales alcanzaron una remisión completa. No se administró el tratamiento a ningún niño menor de 5 años de edad.
En el tratamiento de seguimiento después de la fase de consolidación, 7 pacientes en el estudio unicéntrico y 18 pacientes en el estudio multicéntrico recibieron un nuevo tratamiento de mantenimiento con TRISENOX. Se realizó trasplante de células madre en tres pacientes del estudio unicéntrico y en 15 pacientes del estudio multicéntrico, después de completar el tratamiento con TRISENOX. La mediana de duración de la remisión completa según Kaplan-Meier en el estudio unicéntrico fue de 14 meses y no se alcanzó en el estudio multicéntrico. En el último seguimiento, 6 de los 12 pacientes en el estudio unicéntrico seguían vivos con una mediana de tiempo de seguimiento de 28 meses (rango, de 25 a 29). En el estudio multicéntrico, 27 de los 40 pacientes seguían vivos con una mediana de tiempo de seguimiento de 16 meses (rango, de 9 a 25). A continuación, se muestran las estimaciones de Kaplan-Meier de la supervivencia a los 18 meses en cada estudio.
En la siguiente tabla, se muestra la confirmación citogenética de conversión a un genotipo normal y la detección de la conversión de PML/RARa a la normalidad mediante la reacción en cadena de la polimerasa - trascriptasa reversa (RT-PCR).
Citogenética después de la terapia con TRISENOX
|
Ensayo piloto unicéntrico N con remisión completa = 11 |
Ensayo multicéntrico N con remisión completa = 34 | |
|
Citogenética | ||
|
convencional | ||
|
[t(15;17)] | ||
|
Ausente |
8 (73%) |
31 (91%) |
|
Presente |
1 (9%) |
0% |
|
No evaluable |
2 (18%) |
3 (9%) |
|
RT-PCR para | ||
|
PML/RARa | ||
|
Negativo |
8 (73%) |
27 (79%) |
|
Positivo |
3 (27%) |
4 (12%) |
|
No evaluable |
0 |
3 (9%) |
Se observaron respuestas en todos los grupos de edad estudiados, entre los 6 y los 75 años. La tasa de respuestas fue similar en ambos sexos. No hay experiencia del efecto de TRISENOX sobre la variante de APL que contiene las traslocaciones cromosómicas t(11;17) y t(5;17).
Población pediátrica
La experiencia en niños es limitada. Cinco de los 7 pacientes menores de 18 años de edad (rango de 5 a 16 años) tratados con TRISENOX a la dosis recomendada de 0,15 mg/kg/día alcanzaron una remisión completa (ver sección 4.2).
5.2 Propiedades farmacocinéticas
Cuando se disuelve el trióxido de arsénico inorgánico liofilizado, se forma inmediatamente el producto de hidrólisis ácido arsenioso (Asm). El Asm constituye la especie farmacológicamente activa del trióxido de arsénico.
Distribución
El volumen de distribución(Vd) del Asm es amplio (>400 l) lo que indica una distribución significativa en los tejidos con una insignificante tasa de unión a proteínas. El Vd es también dependiente del peso, aumentando al aumentar el peso corporal. El arsénico total se acumula principalmente en hígado, riñón y corazón y en menor medida en pulmón, cabello y uñas.
Biotransformación
El metabolismo del trióxido de arsénico implica la oxidación del ácido arsenioso (AsIII), especie activa del trióxido de arsénico, a ácido arsénico (AsV), así como la metilación oxidativa a ácido monometilarsénico (MMAV) y dimetilarsénico (DMAV) mediada por las metiltransferasas, que tiene lugar principalmente en el hígado. Los metabolitos pentavalentes, MMAV y DMAV, son de aparición lenta en plasma (aproximadamente 10-24 horas tras la primera administración de trióxido de arsénico), aunque debido a su semivida más prolongada, su acumulación tras administración múltiple es mayor que la de AsIII. El grado de acumulación de estos metabolitos depende de la pauta de dosificación. La acumulación fue aproximadamente de 1,4 a 8 veces superior tras la administración múltiple, en comparación con la administración de dosis única. El AsV se encuentra presente en el plasma únicamente en niveles relativamente reducidos.
Los estudios enzimáticos in vitro realizados con microsomas hepáticos humanos revelaron que el trióxido de arsénico no tiene actividad inhibidora de los sustratos de las principales enzimas del citocromo P450 como 1A2, 2A6, 2B6, 2C8, 2C9, 2C19, 2D6, 2E1,3A4/5, 4A9/11. No es de esperar que los fármacos que son sustratos para estos enzimas P450 interaccionencon TRISENOX.
Eliminación
Aproximadamente el 15% de la dosis de TRISENOX administrada se excreta en la orina como Asm inalterado. Los metabolitos metilados de Asm (MMAV, DMAV) se excretan principalmente por la orina. La concentración plasmática de Asm disminuye desde el pico de concentración plasmática siguiendo un patrón bifásico, con una semivida media de eliminación terminal de 10 a 14 horas. El aclaramiento total de Asm a lo largo del intervalo de dosis únicas de 7-32 mg (administradas como 0,15 mg/kg) es de 49 l/h y el aclaramiento renal es de 9 l/h. En el intervalo de dosis estudiado, el aclaramiento no es dependiente del peso del individuo o la dosis administrada. Los valores medios estimados de semivida de eliminación terminal de los metabolitos MMAVy DMAV son de 32 horas y 70 horas, respectivamente.
Insuficiencia renal
El aclaramiento plasmático de As111 no se vió alterado en pacientes con insuficiencia renal leve (aclaramiento de creatinina de 50-80 ml/min) o moderada (aclaramiento de creatinina de 30-49 ml/min). El aclaramiento plasmático de As111 en pacientes con insuficiencia renal grave (aclaramiento de creatinina inferior a 30 ml/min) fue un 40% inferior al de los pacientes con la función renal normal (ver sección 4.4).
La exposición sistémica a MMAVy DMAV tiende a ser mayor en pacientes con insuficiencia renal; se desconoce la consecuencia clínica de esto aun cuando no se observó un aumento de la toxicidad.
Insuficiencia hepática
Los datos farmacocinéticos de pacientes con carcinoma hepatocelular que presentan insuficiencia hepática leve a moderada evidencian que AsIII o AsV no se acumulan tras las perfusiones de dos veces por semana. No se observó ninguna tendencia clara a un aumento de la exposición sistémica a AsIII, AsV, MMAV o DMAV con la disminución de la función hepática, en la evaluación de la AUC normalizada por dosis (por mg de dosis).
Linealidad/No linealidad
La exposición sistémica (AUC) parece ser lineal a lo largo de todo el intervalo de dosis únicas de 7 a 32 mg (administradas como 0,15 mg/kg). La disminución del pico de concentración plasmática de AsIII se produce siguiendo un patrón bifásico y se caracteriza por una fase inicial de distribución rápida seguida de una fase terminal de eliminación lenta. Tras la administración de 0,15 mg/kg en una pauta de una vez al día (n=6) o bien de dos veces a la semana (n=3), se observó que el grado de acumulación de AsIII fue aproximadamente el doble del observado tras la perfusión única. El grado de acumulación fue ligeramente superior al esperado considerando los resultados de dosis únicas.
5.3 Datos preclínicos sobre seguridad
Los estudios limitados de toxicidad reproductiva del trióxido de arsénico en animales indican embriotoxicidad y teratogenicidad (defectos en el tubo neural, anoftalmia y microftalmia) en administración de 1-10 veces la dosis clínica recomendada (mg/m2). No se han realizado estudios de fertilidad con TRISENOX. Los compuestos arsénicos inducen aberraciones cromosómicas y trasformaciones morfológicas de las células de mamíferos in vitro e in vivo. No se han realizado estudios formales sobre la carcinogenicidad del trióxido de arsénico, sin embargo, el trióxido de arsénico y otros compuestos de arsénico inorgánicos son reconocidos como carcinógenos en los seres humanos.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Hidróxido sódico
Ácido clorhídrico como ajustador de pH Agua para preparaciones inyectables
6.2 Incompatibilidades
En ausencia de estudios de incompatibilidad, este medicamento no debe mezclarse con otros, excepto con los mencionados en la sección 6.6.
6.3 Periodo de validez 4 años
Después de diluir en soluciones intravenosas, TRISENOX es química y físicamente estable durante 24 horas a 15°-30°C y durante 48 horas refrigerado (2-8°C). Desde el punto de vista microbiológico, el producto debe utilizarse inmediatamente. Si no se utiliza inmediatamente, las condiciones y tiempos de conservación antes del uso son responsabilidad del usuario y normalmente no deberían ser superiores a 24 horas a 2-8°C, al menos que la dilución se haya llevado a cabo en condiciones asépticas validadas y controladas.
6.4 Precauciones especiales de conservación
No congelar.
6.5 Naturaleza y contenido del envase
Ampolla de vidrio de borosilicato de tipo I de 10 ml. Cada envase contiene 10 ampollas.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Preparación de TRISENOX
Debe seguirse estrictamente una técnica aséptica durante la manipulación de TRISENOX ya que no contiene conservantes.
TRISENOX se diluirá con 100 a 250 ml de solución de glucosa 50 mg/ml (5%) para inyección o solución de cloruro sódico al 9 mg/ml (0,9%) para inyección, inmediatamente después de extraerlo de la ampolla. Para un solo uso. Las porciones no usadas de cada ampolla se desecharán de la forma adecuada. No guarde ninguna porción no utilizada para su administración posterior.
TRISENOX no debe mezclarse ni administrarse concomitantemente por la misma vía intravenosa con otros medicamentos.
TRISENOX se inyectará por vía intravenosa durante 1-2 horas, pero la duración de la perfusión se puede prolongar hasta las 4 horas si se observan reacciones vasomotoras. No se requiere un catéter venoso central.
La solución diluida debe ser trasparente e incolora. Antes de administrarse, todas las soluciones parenterales deben inspeccionarse visualmente por si hubiera partículas y decoloración. No utilice la preparación si hubiera indicios de partículas.
Procedimiento para la eliminación correcta
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Teva B.V.
Swensweg 5 2031 GA Haarlem Países Bajos
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/02/204/001
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 05/marzo/2002 Fecha de la última renovación: 05/marzo/2007
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
A. FABRICANTE(S) RESPONSABLE(S) DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES RELATIVAS AL USO SEGURO Y EFICAZ DEL MEDICAMENTO
A. FABRICANTE(S) RESPONSABLE(S) DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección del fabricante responsable de la liberación de los lotes
Almac Pharma Services Limited Almac House,
20 Seagoe Industrial Estate Craigavon BT63 5QD Reino Unido
Teva Operations Poland Sp. z o.o. ul. Mogilska 80 31-546 Kraków Polonia
El prospecto impreso del medicamento debe especificar el nombre y dirección del fabricante responsable de la liberación del lote en cuestión.
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica restringida (Ver Anexo I: Ficha Técnica o Resumen de las Características del Producto, sección 4.2).
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
El Titular de la Autorización de Comercialización (TAC) presentará los informes periódicos de seguridad para este medicamento de conformidad con las exigencias establecidas en la lista de fechas de referencia de la Unión (lista EURD) prevista en el artículo 107ter, párrafo 7, de la Directiva 2001/83/CE y publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
No procede.
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
{CAJA DE EMBALAJE}
1. NOMBRE DEL MEDICAMENTO
TRISENOX 1 mg/ml, concentrado para solución para perfusión Trióxido de arsénico
2. PRINCIPIO(S) ACTIVO(S)
Un ml contiene 1 mg de trióxido de arsénico
3. LISTA DE EXCIPIENTES
Demás componentes: hidróxido sódico ácido clorhídrico
agua para preparaciones inyectables
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
concentrado para solución para perfusión 10 ampollas de 10 ml (10 mg/10 ml)
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Vía intravenosa, para un solo uso
Debe ser diluido antes de usar - Leer el prospecto antes de utilizar este medicamento.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
Citotóxico: manipular con precaución
8. FECHA DE CADUCIDAD
CAD Lea el prospecto para ver la caducidad del producto diluido
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
No congelar
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Teva B.V. Swensweg 5 2031 GA Haarlem Países Bajos
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/02/204/001
13. NÚMERO DE LOTE
Lote:
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
<Se acepta la justificación para no incluir la información en Braille>
{ETIQUETA DE LA AMPOLLA}
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
TRISENOX 1 mg/ml, concentrado para solución para perfusión Trióxido de arsénico Vía intravenosa
2. FORMA DE ADMINISTRACIÓN
Para un solo uso, debe ser diluido - ver el prospecto
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote:
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
10 mg/10 ml
6. OTROS
B. PROSPECTO
Prospecto: información para el usuario
TRISENOX 1 mg/ml concentrado para solución para perfusión
Trióxido de arsénico
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico, farmacéutico o enfermero.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico, farmacéutico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto:
1. Qué es TRISENOX y para qué se utiliza
2. Qué necesita saber antes de empezar a usar TRISENOX
3. Cómo usar TRISENOX
4. Posibles efectos adversos
5. Conservación de TRISENOX
6. Contenido del envase e información adicional
1. Qué es TRISENOX y para qué se utiliza
TRISENOX se utiliza en pacientes adultos con leucemia promielocítica aguda (APL) cuya enfermedad no ha respondido a otros tratamientos. APL es un tipo único de leucemia mieloide, una enfermedad que produce leucocitos, hemorragias y moratones anormales.
2. Qué necesita saber antes de empezar a usar TRISENOX
Informe a su médico o farmacéutico si está tomando o ha tomado recientemente cualquier otro medicamento, incluso los adquiridos sin receta.
TRISENOX debe inyectarse bajo la supervisión de un médico con experiencia en el tratamiento de las leucemias agudas.
No use TRISENOX:
Si es alérgico al trióxido de arsénico o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
Advertencias y precauciones
Consulte a su médico, farmacéutico o enfermero antes de empezar a usar TRISENOX.
• Su médico tomará las siguientes precauciones:
- Se realizarán pruebas para analizar la cantidad de potasio, magnesio, calcio y creatinina en
sangre antes de la primera dosis de TRISENOX.
- Se le debe realizar un registro eléctrico del corazón (electrocardiograma o ECG) antes de la
primera dosis.
- Los análisis de sangre (potasio y calcio) se repetirán mientras siga con el tratamiento con
TRISENOX.
- Adicionalmente se le practicará un electrocardiograma dos veces por semana.
- Si tiene riesgo de un cierto tipo de anomalía del ritmo cardíaco (p. ej. taquicardia ventricular en
“torsades de pointes” o prolongación del intervalo Q-T ), se le monitorizará el corazón continuamente.
• Informe a su médico si padece insuficiencia renal o hepática.
• TRISENOX no está recomendado en niños de edad inferior a 18 años.
Uso de TRISENOX con otros medicamentos
Informe a su médico si toma algún medicamento que pueda causar un cambio en el ritmo cardíaco, entre los que se incluyen:
• algunos tipos de antiarrítmicos (medicamentos utilizados para corregir los latidos cardíacos irregulares, p. ej. quinidina, amiodarona, sotalol, dofetilida)
• medicamentos para tratar la psicosis (pérdida de contacto con la realidad; p. ej. la tioridazina)
• medicamentos para tratar la depresión (p. ej. amitriptilina)
• algunos tipos de medicamentos para tratar las infecciones bacterianas (p. ej. eritromicina y esparfloxacino)
• algunos medicamentos para tratar las alergias como la alergia al polen, llamados antihistamínicos (p. ej. terfenadina y astemizol)
• cualquier medicamento que produzca una disminución del nivel de magnesio o de potasio en la sangre (p. ej. amfotericina B)
• cisaprida (medicamento utilizado para paliar ciertos problemas de estómago).
El efecto de estos medicamentos en el latido cardíaco puede empeorar con TRISENOX. Debe asegurarse de que informa a su médico sobre todos los medicamentos que toma.
Uso de TRISENOX con alimentos y bebidas
- no hay restricciones en cuanto a la comida o bebida mientras reciba TRISENOX.
Embarazo
Consulte a su médico o farmacéutico antes de utilizar cualquier medicamento.
TRISENOX puede producir daños en el feto si se administra a mujeres embarazadas.
Si puede quedarse embarazada, debe utilizar un método anticonceptivo eficaz durante el tratamiento con TRISENOX.
Si está embarazada o se queda embarazada durante el tratamiento con TRISENOX, deberá pedir consejo a su médico.
Los hombres deben utilizar métodos anticonceptivos efectivos durante el tratamiento con TRISENOX.
Lactancia
Consulte a su médico o farmacéutico antes de utilizar cualquier medicamento.
El arsénico de TRISENOX pasa a la leche materna.
Como TRISENOX puede dañar a los lactantes, evite la lactancia mientras esté en tratamiento con TRISENOX.
Conducción y uso de máquinas
Se desconoce el efecto de TRISENOX sobre la capacidad para conducir. Si experimenta malestar o no se encuentra bien después de una inyección de TRISENOX, debe esperar a que desaparezcan los síntomas antes de conducir o utilizar máquinas.
TRISENOX contiene sodio
Trisenox contiene menos de 1 mmol de sodio (23 mg) por dosis. Esto significa que el medicamento está esencialmente “exento de sodio”.
Forma y vía de administración
TRISENOX debe diluirse con una solución que contenga glucosa o una solución que contenga cloruro sódico.
Trisenox suele ser administrado por un médico o un enfermero. Se administra mediante un gotero (perfusión) introducido en una vena durante 1-2 horas, pero la perfusión puede durar más si aparecen efectos secundarios como sofocos y vértigos.
Duración y frecuencia del tratamiento
Su médico le administrará TRISENOX una vez al día en una perfusión. En el primer ciclo de tratamiento, puede que reciba tratamiento cada día hasta un máximo de 50 días, o hasta que su médico considere que su enfermedad ha mejorado. Si su enfermedad responde a TRISENOX, se le administrará un segundo ciclo de tratamiento de 25 dosis, que se administrarán 5 días a la semana (seguidos de 2 días de interrupción) durante 5 semanas. Su médico decidirá cuánto tiempo exactamente debe continuar con el tratamiento de TRISENOX.
TRISENOX no debe mezclarse o inyectarse a través del mismo tubo con otros medicamentos.
Si su médico le administra más TRISENOX del que debe
Podrá experimentar convulsiones, debilidad muscular y confusión. Si ocurriera esto, debe interrumpirse el tratamiento con TRISENOX inmediatamente y su médico le tratará la sobredosis de arsénico.
Si tiene cualquier otra duda sobre el uso de este producto, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Informe a su médico o enfermero inmediatamente si nota uno de los siguientes efectos adversos ya que podrían ser los signos de una condición grave llamada “síndrome de diferenciación”, la cual podría ser mortal:
- dificultad para respirar
- tos
- dolor torácico
- fiebre
Informe a su médico o enfermero inmediatamente si nota uno o más de los siguientes efectos adversos ya que podrían ser signos de una reacción alérgica:
- dificultad para respirar
- fiebre
- aumento repentino de peso
- retención de agua
- desvanecimiento
- palpitaciones (latido cardíaco fuerte que se siente en el pecho)
Mientras esté en tratamiento con TRISENOX, puede experimentar alguna de las siguientes reacciones:
Efectos adversos muy frecuentes: pueden afectar a más de 1 de cada 10 personas.
- fatiga (cansancio), dolor, fiebre, dolor de cabeza
- náuseas, vómitos, diarrea
- mareos, dolor muscular, entumecimiento u hormigueo
- erupción cutánea o picor, aumento del azúcar en sangre, edema (inflamación debida a un exceso de líquido)
- falta de aliento, palpitaciones, anomalías en el electrocardiograma
- disminución del potasio o del magnesio en la sangre, anomalías de las pruebas de función hepática o renal incluyendo la presencia excesiva de bilirrubina o gamma-glutamiltransferasa en sangre
Efectos adversos frecuentes: pueden afectar hasta 1 de cada 10 personas.
- disminución del recuento hemático (plaquetas, glóbulos rojos y/o leucocitos), aumento del recuento de leucocitos
- escalofríos, aumento de peso
- fiebre debida a una infección y niveles reducidos de leucocitos, infección por herpes zóster
- dolor torácico, sangrado pulmonar, hipoxia (nivel de oxígeno reducido), acumulación de líquido en el pericardio o en el pulmón, hipotensión, alteración del ritmo cardíaco
- ataques, dolor óseo o articular, inflamación de los vasos sanguíneos
- aumento de sodio o magnesio, presencia de cetonas en sangre y orina (cetoacidosis), anomalías de las pruebas de función renal, insuficiencia renal
- dolor de estómago (abdomen)
- enrojecimiento de la piel, hinchazón facial, visión borrosa
Frecuencia no conocida: no puede estimarse a partir de los datos disponibles.
- infección pulmonar, infección de la sangre
- inflamación de los pulmones con dolor torácico y dificultad respiratoria, insuficiencia cardíaca,
- deshidratación, confusión
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Anexo V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de TRISENOX
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la etiqueta de la ampolla.
No congelar.
Después de la dilución, si no se utiliza inmediatamente, las condiciones y tiempos de almacenamiento antes del uso son responsabilidad del médico y normalmente no serán superiores a 24 horas a 2°C -8°C, a menos que la dilución se haya llevado a cabo en un ambiente estéril.
No utilice este medicamento si observa partículas extrañas o si la solución está decolorada.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
- El principio activo es trióxido de arsénico 1 mg/ml
- Los demás componentes son hidróxido sódico, ácido clorhídrico y agua para inyección Aspecto del producto y contenido del envase
TRISENOX es un concentrado para solución para perfusión. TRISENOX se suministra en ampollas de vidrio en forma de solución concentrada estéril, transparente, incolora, acuosa que se prepara y diluye en el hospital y se administra como perfusión en un vaso sanguíneo. Cada caja contiene 10 ampollas de vidrio de un solo uso. Cada ampolla contiene 10 mg de trióxido de arsénico.
Titular de la autorización de comercialización y responsable de la fabricación
- Titular de la autorización de comercialización:
Teva B.V., Swensweg 5, 2031 GA Haarlem, Países Bajos
- Responsable de la fabricación:
Almac Pharma Services Limited, Almac House, 20 Seagoe Industrial Estate, Craigavon, BT63 5QD, Reino Unido
Teva Operations Poland Sp. z o.o., ul. Mogilska 80, 31-546 Kraków, Polonia Fecha de la última revisión de este prospecto: {MM/AAAA}
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
También existen enlaces a otras páginas web sobre enfermedades raras y medicamentos huérfanos.
<--------------------------------------------------------------------------------------------------------------------------
Esta información está destinada únicamente a médicos o profesionales del sector sanitario:
DEBE SEGUIRSE ESTRICTAMENTE UNA TÉCNICA ASÉPTICA DURANTE LA MANIPULACIÓN DE TRISENOX YA QUE NO TIENE CONSERVANTES.
Dilución de TRISENOX
TRISENOX debe diluirse antes de la administración.
El personal debe estar debidamente entrenado para manejar y diluir el trióxido de arsénico y debe llevar un equipo protector adecuado.
Apertura de la ampolla: Sostenga la ampolla de TRISENOX con la punta de color hacia arriba y delante de usted. Agítela o dele unos golpecitos para que cualquier fluido que esté en la boquilla pase al cuerpo de la ampolla. Ahora presione con el pulgar en la punta coloreada y rompa la ampolla mientras sostiene el cuerpo de la ampolla firmemente con la otra mano.
Dilución: Inserte con cuidado la aguja de una jeringa en la ampolla y extraiga todo el contenido. TRISENOX debe diluirse inmediatamente después con 100 a 250 ml de solución de glucosa 50 mg/ml (5%) para inyección o solución de cloruro sódico 9 mg/ml (0,9%) para inyección.
Las porciones no usadas de cada ampolla se desecharán de la forma adecuada. No guarde ninguna porción no utilizada para su administración posterior.
Uso de TRISENOX
Para un solo uso. TRISENOX no debe mezclarse ni administrarse concomitantemente por la misma vía intravenosa con otros medicamentos.
TRISENOX se inyectará por vía intravenosa durante 1-2 horas, pero la duración de la perfusión se puede prolongar hasta 4 horas si se observan reacciones vasomotoras. No se requiere un catéter venoso central.
La solución diluida debe ser transparente e incolora. Antes de administrarse, todas las soluciones parenterales deben inspeccionarse visualmente por si hubiera partículas y decoloración. No utilice la preparación si hubiera indicios de partículas.
Después de diluir en soluciones intravenosas, TRISENOX es química y físicamente estable durante 24 horas a 15°-30°C y durante 48 horas refrigerado (2-8°C). Desde el punto de vista microbiológico, el producto debe utilizarse inmediatamente. Si no se utiliza inmediatamente, las condiciones y tiempos de almacenamiento antes del uso son responsabilidad del usuario y normalmente no serán superiores a 24 horas a 2-8°C, a menos que la dilución se haya llevado a cabo en condiciones asépticas validadas y controladas.
Procedimiento para la eliminación correcta
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
28