Trevicta 175 Mg Suspension Inyectable De Liberacion Prolongada
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
1. NOMBRE DEL MEDICAMENTO
TREVICTA 175 mg suspensión inyectable de liberación prolongada TREVICTA 263 mg suspensión inyectable de liberación prolongada TREVICTA 350 mg suspensión inyectable de liberación prolongada TREVICTA 525 mg suspensión inyectable de liberación prolongada
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
175 mg suspensión inyectable de liberación prolongada
Cada jeringa precargada contiene 273 mg de palmitato de paliperidona equivalentes a 175 mg de paliperidona.
263 mg suspensión inyectable de liberación prolongada
Cada jeringa precargada contiene 410 mg de palmitato de paliperidona equivalentes a 263 mg de paliperidona.
350 mg suspensión inyectable de liberación prolongada
Cada jeringa precargada contiene 546 mg de palmitato de paliperidona equivalentes a 350 mg de paliperidona.
525 mg suspensión inyectable de liberación prolongada
Cada jeringa precargada contiene 819 mg de palmitato de paliperidona equivalentes a 525 mg de paliperidona.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Suspensión inyectable de liberación prolongada.
La suspensión es de color blanco a blanquecino. La suspensión tiene un pH neutro (aproximadamente 7,0).
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
TREVICTA, inyección trimestral, está indicado para el tratamiento de mantenimiento de la esquizofrenia en pacientes adultos clínicamente estables con la formulación inyectable mensual de palmitato de paliperidona (ver sección 5.1).
4.2 Posología y forma de administración
Posología
Los pacientes que están adecuadamente tratados con palmitato de paliperidona inyectable mensual (preferiblemente durante cuatro meses o más) y no requieren ajuste de dosis pueden ser cambiados a TREVICTA.
TREVICTA debe ser iniciado en sustitución de la siguiente dosis programada de palmitato de paliperidona inyectable mensual (± 7 días). La dosis de TREVICTA se debe basar en la dosis previa de palmitato de paliperidona inyectable mensual, utilizando una dosis 3,5 veces más alta como se indica en la tabla siguiente:
Dosis de TREVICTA en pacientes tratados adecuadamente con palmitato de paliperidona _inyectable mensual_
|
Si la última dosis de palmitato de paliperidona inyectable mensual es de |
TREVICTA se iniciará en la dosis siguiente |
|
50 mg |
175 mg |
|
75 mg |
263 mg |
|
100 mg |
350 mg |
|
150 mg |
525 mg |
No se ha estudiado la dosis de TREVICTA equivalente a la dosis de 25 mg de palmitato de paliperidona inyectable mensual.
Después de la dosis inicial de TREVICTA, este medicamento se administrará mediante inyección intramuscular una vez cada 3 meses (± 2 semanas, ver también la sección Dosis omitidas).
Si es necesario, se puede ajustar la dosis de TREVICTA cada 3 meses en incrementos dentro del intervalo de 175 a 525 mg en función de la tolerabilidad del paciente y/o de la eficacia. Debido a la acción prolongada de TREVICTA, la respuesta del paciente al ajuste de la dosis puede no ser evidente hasta que han transcurrido varios meses (ver sección 5.2). Si el paciente sigue presentando síntomas, se le tratará conforme a la práctica clínica.
Cambio desde otros medicamentos antipsicóticos
TREVICTA se debe usar solo después de que el paciente haya sido tratado adecuadamente con la formulación inyectable mensual de palmitato de paliperidona preferiblemente durante cuatro meses o más.
Cambio desde TREVICTA a otros medicamentos antipsicóticos
Si se suspende la administración de TREVICTA, se deben tener en cuenta sus características de liberación prolongada.
Cambio desde TREVICTA a palmitato de paliperidona inyectable mensual
Para cambiar desde TREVICTA a palmitato de paliperidona inyectable mensual, este se administrará en el momento en que se deba administrar la dosis siguiente de TREVICTA, dividiendo la dosis por 3,5 según se indica en la tabla siguiente. No es necesaria la dosis de inicio según se describe en la ficha técnica de palmitato de paliperidona inyectable mensual. El palmitato de paliperidona inyectable mensual se seguirá administrando una vez al mes tal como se describe en su ficha técnica.
Dosis de palmitato de paliperidona inyectable mensual en los pacientes que cambian desde
TREVICTA
|
Si la última dosis de TREVICTA es de |
Iniciar palmitato de paliperidona inyectable mensual 3 meses después en la dosis siguiente |
|
175 mg |
50 mg |
|
263 mg |
75 mg |
|
350 mg |
100 mg |
|
525 mg |
150 mg |
Cambio desde TREVICTA a los comprimidos diarios de liberación prolongada de paliperidona oral Para cambiar desde TREVICTA a los comprimidos de palmitato de paliperidona de liberación prolongada, se debe iniciar la administración diaria de los comprimidos 3 meses después de la última dosis de TREVICTA y continuar el tratamiento con los comprimidos de paliperidona de liberación prolongada según se describe en la tabla siguiente. La tabla siguiente indica las pautas recomendadas de conversión de las dosis para que los pacientes previamente estabilizados con diferentes dosis de
TREVICTA obtengan una exposición a paliperidona similar con los comprimidos de paliperidona de liberación prolongada.
Dosis de los comprimidos de paliperidona de liberación prolongada para los pacientes que
cambian desde TREVICTA*
|
Tiempo transcurrido desde la última dosis de TREVICTA | |||
|
de la semana 12 a 18, incluida |
de la semana 19 a la 24, incluida |
desde la semana 25 y en adelante | |
|
Última dosis de TREVICTA (semana 0) |
Dosis diaria de los comprimidos de paliperidona de liberación prolongada | ||
|
175 mg |
3 mg |
3 mg |
3 mg |
|
263 mg |
3 mg |
3 mg |
6 mg |
|
350 mg |
3 mg |
6 mg |
9 mg |
|
525 mg |
6 mg |
9 mg |
12 mg |
* Todas las dosis de los comprimidos de paliperidona de liberación prolongada diarios se debe adaptar siempre al paciente individual, teniendo en cuenta variables como los motivos del cambio, la respuesta al tratamiento previo con paliperidona, la gravedad de los síntomas psicóticos y/o la tendencia a presentar efectos adversos.
Dosis omitidas
Margen de administración
TREVICTA se debe inyectar una vez cada 3 meses. Para no omitir una dosis de TREVICTA se puede administrar a los pacientes la inyección hasta 2 semanas antes o después del momento en que se cumple el trimestre.
Dosis omitidas
|
Si se ha omitido la dosis programada y el tiempo transcurrido desde la última inyección es de |
Medida |
|
> 3 meses y medio a 4 meses |
Se administrará la inyección lo antes posible y a continuación se reanudará el calendario de inyecciones trimestrales. |
|
de 4 meses a 9 meses |
Se seguirá la pauta de reanudación recomendada que se indica en la tabla siguiente. |
|
> 9 meses |
Se reanudará el tratamiento con palmitato de paliperidona inyectable mensual según se describe en la ficha técnica del producto. Se podrá reanudar la administración de TREVICTA después de que el paciente haya sido tratado adecuadamente con la formulación inyectable mensual de palmitato de paliperidona preferiblemente durante cuatro meses o más. |
Pauta recomendada de reanudación del tratamiento después de 4 a 9 meses de interrupción de
TREVICTA
|
Si la última |
Se administrarán dos dosis de palmitato de |
A continuación se | |
|
dosis de |
paliperidona inyectable mensual con un |
administrará TREVICTA | |
|
TREVICTA |
intervalo de una semana (en el deltoides) |
(en el deltoides3 o el glúteo) | |
|
fue de |
Día 1 |
Día 8 |
1 mes después del día 8 |
|
175 mg |
50 mg |
50 mg |
175 mg |
|
263 mg |
75 mg |
75 mg |
263 mg |
|
350 mg |
100 mg |
100 mg |
350 mg |
|
525 mg |
100 mg |
100 mg |
525 mg |
Ver también la Información reservada para médicos y profesionales sanitarios donde se describe la selección de la aguja para inyección en el deltoides en función del peso corporal.
Poblaciones especiales
Población de edad avanzada
No se ha establecido la eficacia ni la seguridad en la población mayor de 65 años.
En general, la dosis de TREVICTA recomendada en pacientes de edad avanzada con función renal normal es la misma que para los adultos más jóvenes con función renal normal. Dado que los pacientes de edad avanzada pueden presentar una reducción de la función renal, ver debajo en Insuficiencia renal las recomendaciones de dosificación para pacientes con insuficiencia renal.
Insuficiencia renal
TREVICTA no se ha estudiado de manera sistemática en pacientes con insuficiencia renal (ver sección 5.2). En pacientes con insuficiencia renal leve (aclaramiento de creatinina > 50 a <80 ml/min), se debe ajustar la dosis y se estabilizará al paciente con palmitato de paliperidona inyectable mensual y después se hará la transición a TREVICTA.
No se recomienda utilizar TREVICTA en pacientes con insuficiencia renal moderada o grave (aclaramiento de creatinina <50 ml/min).
Insuficiencia hepática
No se ha estudiado el uso de TREVICTA en pacientes con insuficiencia hepática. Según la experiencia con paliperidona oral no es necesario ajustar la dosis en pacientes con insuficiencia hepática leve o moderada. Paliperidona no se ha estudiado en pacientes con insuficiencia hepática grave, por lo que se recomienda precaución en estos pacientes (ver sección 5.2).
Población pediátrica
No se ha establecido la seguridad y eficacia de TREVICTA en niños y adolescentes menores de 18 años. No se dispone de datos.
Forma de administración
TREVICTA está indicado para administración intramuscular únicamente. No se debe administrar por ninguna otra vía. Cada inyección se administrará solo por un profesional sanitario, que administrará la dosis completa en una sola inyección. Se debe inyectar lenta y profundamente en el músculo deltoides o en el glúteo. Si aparecen molestias en el lugar de inyección, se considerará el cambio del glúteo al deltoides (y viceversa) en sucesivas inyecciones (ver sección 4.8).
TREVICTA se debe administrar usando únicamente las agujas de pared fina que se facilitan en el envase de TREVICTA. Para la administración de TREVICTA no se utilizarán las agujas que se facilitan en el envase de la inyección mensual de palmitato de paliperidona ni otras agujas comercialmente disponibles (ver Información reservada para médicos o profesionales sanitarios).
Se inspeccionará visualmente el contenido de la jeringa precargada para descartar la presencia de cuerpos extraños o decoloración antes de la administración. Es importante agitar enérgicamente la jeringa con la punta hacia arriba y la muñeca relajada durante al menos 15 segundos para garantizar una suspensión homogénea. TREVICTA debe ser administrado dentro de los 5 minutos siguientes a la agitación. Si transcurren más de 5 minutos antes de la inyección, agitar otra vez enérgicamente durante al menos 15 segundos para resuspender el medicamento (ver Información reservada para médicos o profesionales ).
Administración en el deltoides
El tamaño especificado de la aguja para administración de TREVICTA en el músculo deltoides está determinado por el peso del paciente.
• En pacientes de peso > 90 kg, se debe utilizar la aguja de pared fina de 22 G 1/
(0,72 mm x 38,1 mm).
• En pacientes de peso < 90 kg, se debe utilizar la aguja de pared fina de 22 G 1 (0,72 mm x 25,4 mm).
Se debe administrar en el centro del músculo deltoides. Las inyecciones deltoideas se deben alternar entre los dos músculos deltoides.
Administración en el glúteo
Para la administración de TREVICTA en el músculo glúteo, se utilizará la aguja de pared fina de 22 G 1% (0,72 mm x 38,1 mm), sin tener en cuenta el peso corporal. La administración se debe hacer en el cuadrante superior externo del músculo glúteo. Las inyecciones en el glúteo se deben alternar entre los dos músculos glúteos.
Administración incompleta
Para evitar la administración incompleta de TREVICTA, se debe agitar enérgicamente la jeringa precargada durante al menos 15 segundos en los 5 minutos que preceden a la administración para asegurar una suspensión homogénea (ver Información reservada para médicos o profesionales sanitarios).
Sin embargo, si la dosis inyectada ha sido incompleta, la dosis restante de la jeringa no se debe reinyectar y no se debe administrar otra dosis dada la dificultad de calcular la proporción de la dosis que se administró realmente. Se vigilará estrechamente al paciente y se controlará clínicamente de forma apropiada hasta la siguiente inyección trimestral programada de TREVICTA.
4.3 Contraindicaciones
Hipersensibilidad al principio activo, a risperidona o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
Uso en estados psicóticos graves o de agitación aguda
No se debe utilizar TREVICTA para controlar estados psicóticos graves o de agitación aguda en los que es necesario un control inmediato de los síntomas.
Intervalo QT
Se debe tener precaución al prescribir paliperidona a pacientes con enfermedad cardiovascular conocida o con antecedentes familiares de prolongación del QT y cuando se usa a la vez que otros medicamentos que se espera que prolonguen el intervalo QT.
Síndrome neuroléptico maligno
Se han notificado casos de Síndrome Neuroléptico Maligno (SNM) con paliperidona, que se caracteriza por hipertermia, rigidez muscular, inestabilidad autónoma, alteración de la consciencia y elevación de la creatinfosfoquinasa sérica. Otros síntomas clínicos incluyen mioglobinuria (rabdomioisis) y fallo renal agudo. Si un paciente presenta signos o síntomas indicativos de SMN, se suspenderá la paliperidona. Se tendrá en cuenta la acción prolongada de TREVICTA.
Discinesia tardía
Los medicamentos con propiedades antagonistas del receptor de la dopamina se han asociado con la inducción de discinesia tardía, que se caracteriza por movimientos rítmicos involuntarios, predominantemente de la lengua y/o de la cara. Si aparecen signos y síntomas de discinesia tardía, se debe considerar la posibilidad de suspender la administración de todos los antipsicóticos, incluido la paliperidona. Se tendrá en cuenta la acción prolongada de TREVICTA.
Leucopenia, neutropenia y agranulocitosis
Se han notificado acontecimientos de leucopenia, neutropenia y agranulocitosis en relación con paliperidona. Los pacientes con antecedentes de recuento de glóbulos blancos bajo clínicamente relevante o de leucopenia/neutropenia inducida por medicamentos se deben someter a vigilancia estrecha durante los primeros meses de tratamiento y se considerará la suspensión de TREVICTA ante el primer signo de leucopenia clínicamente relevante sin que intervengan otros factores causantes. A los pacientes con neutropenia clínicamente relevante se les monitorizará estrechamente a fin de detectar la aparición de fiebre u otros síntomas o signos de infección y, si se presentan estos síntomas, se administrará un tratamiento rápido. A los pacientes con neutropenia grave (recuento total de neutrófilos < 1 x 109/L) se les retirará la administración de TREVICTA y se les hará un seguimiento de los niveles de glóbulos blancos hasta su recuperación. Se tendrá en cuenta la acción prolongada de TREVICTA.
Reacciones de hipersensibilidad
Se pueden producir reacciones de hipersensibilidad incluso en pacientes que previamente han tolerado risperidona oral o paliperidona oral (ver sección 4.8).
Hiperglucemia y diabetes mellitus
Se han notificado hiperglucemia, diabetes mellitus y exacerbación de una diabetes preexistente, incluso coma diabético y cetoacidosis con el uso de paliperidona. Se recomienda una vigilancia clínica adecuada, conforme a la práctica antipsicótica habitual. En los pacientes tratados con TREVICTA se vigilará la aparición de síntomas de hiperglucemia (como polidipsia, poliuria, polifagia y astenia) y los pacientes con diabetes mellitus deben ser monitorizados regularmente de un empeoramiento del control de la glucosa.
Aumento de peso
Se han notificado casos de aumento significativos de peso relacionados con el uso de TREVICTA. El peso debe ser controlado con regularidad.
Uso en pacientes con tumores dependientes de prolactina
Estudios de cultivo de tejidos indican que la prolactina puede estimular el crecimiento celular en tumores de mama humanos. Aunque hasta ahora no se ha demostrado una asociación clara con la administración de antipsicóticos en los estudios clínicos y epidemiológicos, se recomienda precaución en pacientes que tengan antecedentes clínicos relevantes. La paliperidona se debe utilizar con precaución en los pacientes con un tumor preexistente que pueda ser dependiente de prolactina.
Hipotensión ortostática
Paliperidona puede inducir hipotensión ortostática en algunos pacientes, debido a su actividad bloqueante alfa-adrenérgica. En los ensayos clínicos de TREVICTA, el 0,3 % de los pacientes notificaron reacciones adversas asociadas a hipotensión ortostática. TREVICTA se debe utilizar con precaución en pacientes con enfermedades cardiovasculares (p. ej., insuficiencia cardíaca, infarto o isquemia de miocardio, anomalías de la conducción), enfermedades cerebrovasculares o trastornos que predispongan al paciente a la hipotensión (p. ej., deshidratación e hipovolemia).
Convulsiones
TREVICTA se debe utilizar con precaución en pacientes con antecedentes de convulsiones o de otros trastornos que puedan reducir el umbral convulsivo.
Insuficiencia renal
Las concentraciones plasmáticas de paliperidona son más elevadas en pacientes con insuficiencia renal. En pacientes con insuficiencia renal leve (aclaramiento de creatinina >50 a <80 ml/min), se ajustará la dosis y se estabilizará al paciente con palmitato de paliperidona inyectable mensual y después se hará la transición a TREVICTA. No se recomienda utilizar TREVICTA en pacientes con insuficiencia renal moderada o grave (aclaramiento de creatinina < 50 ml/min) (ver secciones 4.2 y 5.2).
Insuficiencia hepática
No se dispone de datos de pacientes con insuficiencia hepática grave (clase C de Child-Pugh). Se recomienda precaución si se utiliza paliperidona en estos pacientes.
Pacientes de edad avanzada con demencia
TREVICTA no se ha estudiado en pacientes de edad avanzada con demencia. No se recomienda la administración de TREVICTA a pacientes de edad avanzada con demencia, debido al riesgo aumentado de mortalidad global y de reacciones adversas cerebrovasculares.
La experiencia obtenida con risperidona que se describe a continuación se considera aplicable también a paliperidona.
Mortalidad global
En un metaanálisis de 17 ensayos clínicos controlados, los pacientes de edad avanzada con demencia tratados con otros antipsicóticos atípicos, como risperidona, aripiprazol, olanzapina y quetiapina, tuvieron un aumento del riesgo de mortalidad en comparación con el placebo. En los tratados con risperidona, la mortalidad fue del 4 % en comparación con el 3,1 % de los pacientes que recibieron placebo.
Reacciones adversas cerebrovasculares
En ensayos clínicos aleatorizados y controlados con placebo en los que pacientes con demencia recibieron tratamiento con algunos antipsicóticos atípicos como risperidona, aripiprazol y olanzapina se ha observado que el riesgo de reacciones adversas cerebrovasculares se multiplica por 3 aproximadamente. Se desconoce el mecanismo de este aumento del riesgo.
Enfermedad de Parkinson y demencia con cuerpos de Lewy
Los médicos deben sopesar los riesgos y beneficios de prescribir TREVICTA a pacientes con enfermedad de Parkinson o con demencia con cuerpos de Lewy (DCL), porque ambos grupos tienen un mayor riesgo de Síndrome Neuroléptico Maligno y una mayor sensibilidad a los antipsicóticos. Las manifestaciones de este aumento de la sensibilidad pueden incluir confusión, embotamiento, inestabilidad postural y caídas frecuentes, además de síntomas extrapiramidales.
Priapismo
Se ha notificado que los medicamentos antipsicóticos (entre ellos paliperidona) con efectos de bloqueo alfa adrenérgico inducen priapismo. Se indicará al paciente que solicite asistencia médica urgente si el priapismo no se ha resuelto en el trascurso de 4 horas.
Regulación de la temperatura corporal
Se ha atribuido a los antipsicóticos la alteración de la capacidad del organismo de reducir la temperatura corporal central. Se recomienda tomar las medidas oportunas cuando se prescriba TREVICTA a pacientes que vayan a experimentar circunstancias que puedan contribuir a una elevación de la temperatura corporal central, p. ej., ejercicio intenso, exposición a calor extremo, tratamiento concomitante con medicamentos de actividad anticolinérgica o deshidratación.
Tromboembolismo venoso
Se han notificado casos de tromboembolismo venoso (TEV) con el uso de antipsicóticos. Dado que los pacientes tratados con antipsicóticos presentan a menudo factores de riesgo añadido de TEV, se identificarán todos los posibles factores de riesgo de TEV antes y en el transcurso del tratamiento con TREVICTA, y se adoptarán medidas preventivas.
Efecto antiemético
En los estudios preclínicos con paliperidona se observó un efecto antiemético. Si se produce este efecto en los seres humanos, puede enmascarar los signos y síntomas de la sobredosis de determinados medicamentos o de trastornos como la obstrucción intestinal, el síndrome de Reye y los tumores cerebrales.
Administración
Se debe tener cuidado para evitar la inyección involuntaria de TREVICTA en un vaso sanguíneo. Síndrome del iris flácido intraoperatorio
Se ha observado síndrome del iris flácido intraoperatorio (IFIS) durante la cirugía de cataratas en pacientes tratados con medicamentos con efecto antagonista alfa1a-adrenérgico, como TREVICTA (ver sección 4.8).
El IFIS puede aumentar el riesgo de complicaciones oculares durante y después de la intervención. El oftalmólogo debe ser informado del uso actual o pasado de medicamentos con efecto antagonista alfa1a-adrenérgico antes de la cirugía. El beneficio potencial de la interrupción del tratamiento con bloqueantes alfa1 antes de la cirugía de cataratas no ha sido establecido y debe ser sopesado frente al riesgo de interrumpir el tratamiento antipsicótico.
4.5 Interacción con otros medicamentos y otras formas de interacción
Se recomienda precaución al prescribir TREVICTA con medicamentos que prolongan el intervalo QT, como antiarrítmicos de la clase IA (por ejemplo, quinidina o disopiramida) y antiarrítmicos de la clase III (por ejemplo, amiodarona o sotalol), algunos antihistamínicos, antibióticos (por ejemplo, fluoroquinolonas), algunos antipsicóticos y algunos antipalúdicos (por ejemplo, mefloquina). Esta lista es indicativa y no exhaustiva.
Posibilidad de que TREVICTA afecte a otros medicamentos
No se espera que paliperidona produzca interacciones farmacocinéticas clínicamente relevantes con medicamentos metabolizados por las isoenzimas del citocromo P-450.
Dado que paliperidona actúa principalmente sobre el sistema nervioso central (SNC) (ver sección 4.8), se debe usar con precaución la combinación de TREVICTA con otros medicamentos que actúan sobre el sistema nervioso central, como los ansiolíticos, la mayoría de los antipsicóticos, los hipnóticos, los opiáceos etc. o el alcohol.
La paliperidona puede antagonizar el efecto de la levodopa y de otros agonistas de la dopamina. Si se considera necesario administrar esta combinación, sobre todo para la enfermedad de Parkinson terminal, se prescribirá la dosis mínima eficaz de cada tratamiento.
Debido a su capacidad de inducir hipotensión ortostática (ver sección 4.4), es posible observar un efecto aditivo cuando se administra TREVICTA con otros medicamentos que tienen esta capacidad, como otros antipsicóticos o los antidepresivos tricíclicos.
Se recomienda precaución al combinar la paliperidona con otros medicamentos que disminuyen el umbral convulsivo (por ejemplo, fenotiacinas o butirofenonas, antidepresivos tricíclicos o ISRS, tramadol, mefloquina, etc.).
La administración concomitante de los comprimidos de liberación prolongada de paliperidona en el estado estacionario (12 mg una vez al día) con comprimidos de liberación prolongada de valproato sódico (de 500 mg a 2.000 mg una vez al día) no afectó a la farmacocinética en el estado estacionario del valproato.
No se han llevado a cabo estudios de interacción entre TREVICTA y el litio, sin embargo, no es probable que se produzcan una interacción farmacocinética.
Posibilidad de que otros medicamentos afecten a TREVICTA
Los estudios in vitro indican que las enzimas CYP2D6 y CYP3A4 pueden tener una intervención mínima en el metabolismo de la paliperidona, pero no hay indicios in vitro ni in vivo de que esas isoenzimas desempeñen un papel importante en el metabolismo de paliperidona. La administración conjunta de paliperidona oral con paroxetina, un potente inhibidor de la CYP2D6, no tuvo un efecto clínicamente significativo sobre la farmacocinética de paliperidona.
La administración conjunta de paliperidona oral de liberación prolongada una vez al día con carbamazepina 200 mg dos veces al día produjo una reducción de aproximadamente un 37 % de los valores medios de Cmáx y AUC en estado estacionario de paliperidona. Esta disminución se debe, en gran parte, a un aumento del 35 % de la depuración renal de paliperidona, probablemente como consecuencia de la inducción de la gp-P renal por carbamazepina. Una disminución menor de la cantidad de principio activo excretado inalterado en la orina sugiere que hubo un efecto mínimo sobre el metabolismo de CYP o la biodisponibilidad de paliperidona durante la administración concomitante de carbamazepina. Con dosis más altas de carbamazepina podrían aparecer disminuciones mayores de las concentraciones plasmáticas de paliperidona. Al iniciar el tratamiento con carbamazepina se debe revisar, y aumentar si es necesario, la dosis de TREVICTA. Por el contrario, al suspender el uso de carbamazepina se debe volver a evaluar la dosis de TREVICTA y reducirse en caso necesario. Se tendrá en cuenta la acción prolongada de TREVICTA.
La administración concomitante de una dosis única oral de paliperidona en forma de comprimidos de liberación prolongada de 12 mg con comprimidos de liberación prolongada de valproato sódico (dos comprimidos de 500 mg una vez al día) produjo un incremento de aproximadamente el 50 % en los valores de Cmáx y AUC de paliperidona, probablemente debido al aumento de la absorción oral. Dado que no se han observado efectos sobre el aclaramiento sistémico, no es previsible una interacción clínicamente relevante entre los comprimidos de liberación prolongada de valproato sódico y la inyección intramuscular de TREVICTA. No se ha estudiado esta interacción con TREVICTA.
Uso concomitante de TREVICTA con risperidona o paliperidona oral
Debido a que paliperidona es el principal metabolito activo de risperidona, se debe tener precaución cuando TREVICTA sea administrado de forma conjunta con risperidona o con paliperidona oral durante períodos prolongados de tiempo. Los datos de seguridad relacionados con el uso concomitante de TREVICTA con otros antipsicóticos son limitados.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No existen datos suficientes sobre la utilización de paliperidona en mujeres embarazadas. El palmitato de paliperidona en inyección intramuscular y la paliperidona en administración oral no mostraron efectos teratógenos en estudios realizados en animales, pero se observaron otros tipos de toxicidad para la reproducción (ver sección 5.3). Los neonatos expuestos a paliperidona durante el tercer trimestre del embarazo tienen riesgo de sufrir reacciones adversas después del parto, entre ellas síntomas extrapiramidales y/o de abstinencia de intensidad y duración variables. Se han descrito casos de agitación, hipertonía, hipotonía, temblor, somnolencia, dificultad respiratoria o trastornos de alimentación. En consecuencia, se recomienda una vigilancia estrecha del recién nacido.
Debido a que se ha detectado paliperidona en el plasma hasta 18 meses después de administrar una dosis única de TREVICTA, se tendrá en cuenta la acción prolongada de TREVICTA, porque la exposición materna a TREVICTA antes y durante el embarazo podría provocar reacciones adversas en los recién nacidos.
Lactancia
La paliperidona se excreta por la leche materna en tal medida que es probable que se produzcan efectos en el lactante si se administra en dosis terapéuticas a mujeres lactantes. Debido a que se ha detectado paliperidona en el plasma hasta 18 meses después de administrar una dosis única de TREVICTA, se tendrá en cuenta la acción prolongada de TREVICTA, porque los lactantes podrían estar en riesgo incluso si la administración de TREVICTA es muy anterior a la lactancia. TREVICTA no se debe utilizar durante la lactancia.
Fertilidad
No se observaron efectos relevantes en estudios no clínicos.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de paliperidona sobre la capacidad para conducir y utilizar máquinas es pequeña o moderada debido a sus posibles efectos sobre el sistema nervioso y la visión, como sedación, somnolencia, síncope o visión borrosa (ver sección 4.8). Por tanto, se debe aconsejar a los pacientes que no conduzcan ni utilicen máquinas hasta conocer su sensibilidad individual a TREVICTA.
4.8 Reacciones adversas
Resumen del perfil de seguridad
Las reacciones adversas al medicamento observadas con mayor frecuencia notificadas en > 5 % de los pacientes en dos ensayos clínicos controlados a doble ciego de TREVICTA, fueron aumento de peso, infección de las vías respiratorias altas, ansiedad, cefalea, insomnio y reacción en el lugar de inyección.
Tabla de reacciones adversas
A continuación se recogen todas las RAM notificadas con paliperidona en función de la frecuencia estimada en los ensayos clínicos realizados con TREVICTA y con palmitato de paliperidona inyectable mensual. Se aplican los siguientes términos y frecuencias: muy frecuentes (> 1/10), frecuentes (> 1/100 a < 1/10), poco frecuentes (> 1/1.000 a < 1/100), raras (> 1/10.000 a < 1/1.000), muy raras (< 1/10.000) y frecuencia no conocida (no se puede estimar a partir de los datos disponibles).
|
Sistema de clasificación de órganos |
Reacción adversa al medicamento | ||||
|
Frecuencia | |||||
|
Muy frecuentes |
Frecuentes |
Poco frecuentes |
Raras |
Frecuencia no conocida3 | |
|
Infecciones e infestaciones |
infección de vías respiratorias altas, infección urinaria, gripe |
neumonía, bronquitis, infección de vías respiratorias, sinusitis, cistitis, otitis, amigdalitis, onicomicosis, celulitis |
infección oftálmica, acarodermatitis, absceso subcutáneo | ||
|
Trastornos de la sangre y del sistema linfático |
disminución del recuento de glóbulos blancos, trombocitopenia, anemia |
neutropenia, aumento del recuento de eosinófilos |
agranulocitosis | ||
|
Trastornos del sistema inmunológico |
hipersensibilidad |
reacción anafiláctica | |||
|
Trastornos endocrinos |
hiperprolactinemiab |
secreción inadecuada de hormona antidiurética, glucosuria | |||
|
Trastornos del metabolismo y de la nutrición |
hiperglucemia, aumento de peso, pérdida de peso |
diabetes mellitus, hiperinsulinemia, aumento del apetito, anorexia, disminución del apetito, triglicéridos en sangre elevados, colesterol en sangre elevado |
cetoacidosis diabética, hipoglucemia, polidipsia |
intoxicación por agua | |
|
Trastornos psiquiátricos |
insomnio'1 |
agitación, depresión, ansiedad |
trastornos del sueño, disminución de la libido, nerviosismo, pesadillas |
manía, estado de confusión, embotamiento afectivo, anorgasmia | |
|
Trastornos del sistema nervioso |
parkinsonismo0 , acatisia0, sedación/somn olencia, distonía0, mareo, discinesias0, temblor, cefalea |
discinesia tardía, síncope, hiperactividad psicomotriz, mareo postural, trastornos de la atención, disartria, disgeusia, hipoestesia, parestesia |
síndrome neuroléptico maligno, isquemia cerebral, falta de respuesta a los estímulos, pérdida del conocimiento, reducción del nivel de conciencia, convulsionesd, trastornos del equilibrio |
coma diabético, coordinación anómala, temblor de cabeza | |
|
Trastornos oculares |
visión borrosa, conjuntivitis, ojo seco |
glaucoma, trastornos de los movimientos oculares, rotación anormal de los ojos, fotofobia, aumento del lagrimeo, hiperemia ocular |
síndrome del iris flácido | ||
|
Trastornos del oído y del laberinto |
vértigo, acúfenos, dolor de oídos | ||||
|
Trastornos cardíacos |
bradicardia, taquicardia |
bloqueo auriculoventricular, trastornos de la conducción, prolongación del intervalo QT en el electrocardiograma, síndrome de taquicardia postural ortostática, anomalías del electrocardiograma, palpitaciones |
fibrilación auricular, arritmia sinusal | ||
|
Trastornos vasculares |
hipertensión |
hipotensión, hipotensión ortostática |
trombosis venosa, rubor |
embolia pulmonar, isquemia | |
|
Trastornos respiratorios, torácicos y mediastínicos |
tos, congestión nasal |
disnea, dolor faringolaríngeo, epistaxis |
síndrome de apnea del sueño, congestión pulmonar, congestión respiratoria, sibilancias |
hiperventilación, neumonía por aspiración, estertores, disfonía |
No es posible determinar la frecuencia de las reacciones adversas notificadas después de la comercialización, ya que dependen de notificaciones espontáneas. Por tanto, la frecuencia de estas reacciones adversas se define como 'no conocida'.
|
Trastornos gastrointestinales |
dolor abdominal, vómitos, náuseas, estreñimiento, diarrea, dispepsia, odontalgia |
molestias abdominales, gastroenteritis, sequedad de boca, flatulencia |
pancreatitis, edema lingual, incontinencia fecal, fecaloma, disfagia, queilitis |
obstrucción intestinal, íleo | |
|
Trastornos hepatobiliares |
niveles elevados de transaminasas |
niveles elevados de gamma- glutamiltransferasa y de enzimas hepáticas |
ictericia | ||
|
Trastornos de la piel y del tejido subcutáneo |
erupción de la piel |
urticaria, prurito, alopecia, eccema, sequedad de la piel, eritema, acné |
erupción farmacológica, hiperqueratosis, caspa |
angioedema, trastornos de la pigmentación, dermatitis seborreica | |
|
Trastornos osteomusculares y del tejido conjuntivo |
dolor osteomuscular, dolor lumbodorsal, artralgia |
valores elevados de creatinfosfoquinasa en sangre, espasmos musculares, rigidez articular, debilidad muscular, dolor cervical |
hinchazón de las articulaciones |
rabdomiólisis, alteraciones posturales | |
|
Trastornos renales y urinarios |
incontinencia urinaria, polaquiuria, disuria |
retención urinaria | |||
|
Embarazo, puerperio y enfermedades perinatales |
síndrome de abstinencia neonatal (ver sección 4.6) | ||||
|
Trastornos del aparato reproductor y de la mama |
amenorrea |
disfunción eréctil, trastornos de la eyaculación, retrasos de la menstruación, trastornos menstrualesd, ginecomastia, galactorrea, disfunción sexual, dolor mamario |
hinchazón o malestar mamario, aumento del tamaño de las mamas, flujo vaginal |
priapismo | |
|
Trastornos generales y alteraciones en el lugar de administración |
fiebre, astenia, fatiga, reacciones en el lugar de inyección |
edema facial, edemad, alteraciones de la marcha, dolor torácico, molestias en el pecho, malestar general, induración |
hipotermia, escalofríos, aumento de la temperatura corporal, polidipsia, síndrome de abstinencia de fármacos/drogas, abscesos en el lugar de inyección, celulitis en el lugar de inyección, quistes en el lugar de inyección, hematomas en el lugar de inyección |
descenso de la temperatura corporal, necrosis en el lugar de inyección, úlceras en el lugar de inyección | |
|
Lesiones traumáticas, intoxicaciones y complicaciones de procedimientos terapéuticos |
caídas |
a
b
c
d
Ver el apartado ‘Hiperprolactinemia’ a continuación.
Ver el apartado ‘Síntomas extrapiramidales’ a continuación.
Insomnio' comprende: El insomnio inicial y el insomnio medio; onvulsiones incluye: Convulsiones, y convulsiones del gran mal; trastornos menstruales incluye: Trastornos menstruales, retrasos de la menstruación, menstruación irregular, oligomenorrea; edema incluye: Edema generalizado, edema, edema periférico, edema puntiforme.
Reacciones adversas observadas con las formulaciones de risperidona
Paliperidona es el metabolito activo de la risperidona, de modo que los perfiles de reacciones adversas de estas sustancias (incluidas las formulaciones orales e inyectables) son relevantes entre sí.
Descripción de algunas reacciones adversas
Reacción anafiláctica
Durante la experiencia poscomercialización, en raras ocasiones se han notificado casos de una reacción anafiláctica después de la inyección de palmitato de paliperidona mensual en pacientes que previamente han tolerado risperidona oral o paliperidona oral (ver sección 4.4).
Reacciones en el lugar de la inyección
En los ensayos clínicos de TREVICTA, el 5,3 % de los pacientes notificaron reacciones adversas en el lugar de inyección. Ninguno de estos acontecimientos fue grave o motivó la suspensión del tratamiento. Según la clasificación realizada por los investigadores, síntomas como induración, rubefacción e hinchazón no se presentaron o fueron leves en > 95 % de las evaluaciones. El dolor en el lugar de inyección valorado por el paciente en una escala analógica visual era escaso, y su intensidad disminuía con el tiempo.
Síntomas extrapiramidales (SEP)
En los ensayos clínicos de TREVICTA se notificaron acatisia, discinesia, distonía, parkinsonismo y temblor en el 3,9 %, 0,8 %, 0,9 %, 3,6 % y 1,4 % de los pacientes, respectivamente.
Los síntomas extrapiramidales (SEP) incluyeron los siguientes términos: parkinsonismo (trastorno extrapiramidal, síntomas extrapiramidales, fenómeno on-off, enfermedad de Parkinson, crisis parkinsoniana, hipersecreción salival, rigidez osteomuscular, parkinsonismo, babeo, rigidez en rueda dentada, bradicinesia, hipocinesia, facies en máscara, tirantez muscular, acinesia, rigidez nucal, rigidez muscular, marcha parkinsoniana, reflejo glabelar alterado y temblor parkinsoniano en reposo), acatisia (incluye acatisia, inquietud, hipercinesia y síndrome de las piernas inquietas), discinesia (incluye discinesia, corea, trastornos del movimiento, espasmos musculares, coreoatetosis, atetosis y mioclonía), distonía (incluye distonía, espasmo cervical, emprostótonos, crisis oculógiras, distonía bucomandibular, risa sardónica, tetania, hipertonía, tortícolis, contracciones musculares involuntarias, contractura muscular, blefaroespasmo, oculogiración, parálisis lingual, espasmo facial, laringoespasmo, miotonía, opistótonos, espasmo bucofaringeo, pleurotótonos, espasmo lingual y trismus) y temblor.
Aumento de peso
En el estudio a largo plazo de retirada aleatorizada, se notificaron aumentos anormales de > 7 % de peso corporal desde el momento inicial hasta el momento final del estudio, analizados a doble ciego, en el 10 % de los pacientes del grupo de TREVICTA y el 1 % de los pacientes del grupo de placebo.
A la inversa, se notificaron reducciones anormales del peso corporal (> 7 %) desde el momento inicial hasta el momento final en un estudio doble ciego controlado con placebo, en el 1 % de los pacientes del grupo de TREVICTA y el 8 % de los pacientes del grupo de placebo. Las variaciones medias del peso corporal desde el momento inicial hasta el momento final en un estudio doble ciego controlado con placebo, fueron de +0,94 kg y -1,28 kg en los grupos de TREVICTA y placebo, respectivamente.
Hiperprolactinemia
Durante la fase de doble ciego del estudio a largo plazo de retirada aleatorizada, se observaron niveles de prolactina por encima del intervalo de referencia (> 13,13 ng/ml en los varones y > 26,72 ng/ml en las mujeres) en un porcentaje más elevado de varones y mujeres del grupo de TREVICTA que del grupo placebo (9 % frente a 3 % y 5 % frente a 1 %, respectivamente). En el grupo de TREVICTA, la variación media entre el momento inicial y el final en un estudio doble ciego controlado con placebo fue de +2,90 ng/ml para los varones (frente a -10,26 ng/ml en el grupo placebo) y de +7,48 ng/ml para las mujeres (frente a -32,93 ng/ml en el grupo placebo). Una mujer (2,4 %) del grupo de TREVICTA tuvo una reacción adversa de amenorrea, mientras que no se observaron reacciones adversas potencialmente relacionadas con la prolactina en ninguna mujer del grupo placebo. No hubo reacciones adversas potencialmente relacionadas con la prolactina en ninguno de los grupos de varones.
Efecto de clase
Con el uso de antipsicóticos pueden aparecer prolongación del intervalo QT, arritmias ventriculares (fibrilación ventricular, taquicardia ventricular), muerte súbita inexplicada, paro cardíaco y Torsades de pointes.
Se han notificado casos de TEV, entre ellos de embolia pulmonar y de trombosis venosa profunda, con el uso de medicamentos antipsicóticos.
Notificación de sospechas de reacciones adversas
. Se invita a los sistema nacional
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento profesionales sanitarios a notificar las sospechas de reacciones adversas a través del de notificación incluido en el Apéndice V.
4.9 Sobredosis
Síntomas
En general, los signos y síntomas previstos son los resultantes de la exageración de los efectos farmacológicos conocidos de paliperidona, es decir, somnolencia y sedación, taquicardia e hipotensión, prolongación del QT y síntomas extrapiramidales. Se han descrito Torsades de pointes y fibrilación ventricular en un paciente expuesto a sobredosis de paliperidona oral. En caso de sobredosis aguda se debe tener en cuenta la posibilidad de que estén implicados varios fármacos.
Tratamiento
Al evaluar las medidas terapéuticas y de recuperación, se tendrán en cuenta la naturaleza de liberación prolongada del medicamento, así como la prolongada vida media de paliperidona. No hay ningún antídoto específico para paliperidona. Se utilizarán medidas de apoyo generales. Hay que establecer y mantener una vía respiratoria despejada y garantizar que la oxigenación y la ventilación sean adecuadas.
El control cardiovascular debe empezar inmediatamente e incluir un control electrocardiográfico continuo para controlar posibles arritmias. La hipotensión y el fracaso circulatorio se deben tratar con las medidas adecuadas, como administración de líquidos por vía intravenosa y/o de simpaticomiméticos. En caso de síntomas extrapiramidales graves, se debe administrar medicación anticolinérgica. Se debe mantener una supervisión y un control estrictos y continuos hasta que el paciente se recupere.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Psicolépticos, otros fármacos antipsicóticos, código ATC: N05AX13 TREVICTA contiene una mezcla racémica de paliperidona (+) y (-).
Mecanismo de acción
Paliperidona es un agente bloqueante selectivo de los efectos de las monoaminas cuyas propiedades farmacológicas son diferentes de las de los neurolépticos tradicionales. Paliperidona se une estrechamente a los receptores serotoninérgicos 5-HT2 y dopaminérgicos D-2. Asimismo, paliperidona bloquea los receptores alfa ladrenérgicos y, en menor medida, los receptores histaminérgicos H-1 y los receptores alfa 2 adrenérgicos. La actividad farmacológica de los enantiómeros (+) y (-) de paliperidona es similar desde el punto de vista cualitativo y cuantitativo.
Paliperidona no se une a los receptores colinérgicos. Aunque se trata de un potente antagonista de D2, motivo por el que se cree que alivia los síntomas de la esquizofrenia, produce menos catalepsia y menos reducción de las funciones motoras que los neurolépticos tradicionales. La preponderancia del antagonismo central de la serotonina puede disminuir la tendencia de paliperidona a producir efectos secundarios extrapiramidales.
Eficacia clínica
La eficacia de TREVICTA para el tratamiento de mantenimiento de la esquizofrenia en pacientes que han sido tratados adecuadamente durante al menos 4 meses con la formulación inyectable mensual de palmitato de paliperidona y las últimas dos dosis de la misma concentración se evaluó en un estudio a largo plazo de retirada aleatorizado, doble ciego y controlado con placebo y en un estudio de no inferioridad a largo plazo, doble ciego y controlado con fármaco activo. En ambos estudios, el criterio de valoración principal era la recaída.
En el estudio a largo plazo de retirada aleatorizada, 506 pacientes adultos que cumplían los criterios DSM-IV de esquizofrenia se incorporaron en la fase abierta de transición y recibieron dosis flexibles de palmitato de paliperidona inyectable mensual administradas en el músculo deltoides o glúteo (50-150 mg) durante 17 semanas (los ajustes de dosis fueron en las semanas 5 y 9). Un total de 379 pacientes recibieron una dosis única de TREVICTA en el músculo deltoides o glúteo durante la fase de estabilización abierta (la dosis era 3,5 veces la última dosis de palmitato de paliperidona mensual). Los pacientes que se consideraban clínicamente estabilizados al final de la fase de estabilización de 12 semanas se aleatorizaron en proporción 1:1 para recibir TREVICTA o un placebo en una fase doble ciego de duración variable (la dosis de TREVICTA fue la misma que la última dosis recibida durante la fase de estabilización; esta dosis se mantuvo fija durante toda la fase de doble ciego). En este periodo, 305 pacientes sintomáticamente estables fueron aleatorizados para continuar el tratamiento con TREVICTA (n = 160) o placebo (n = 145) hasta que se produjese la recaída, la retirada prematura o el final del estudio. La variable principal de eficacia fue el tiempo hasta la primera recaída. Un análisis provisional realizado cuando se habían aleatorizado 283 pacientes y se habían observado 42 acontecimientos de recaída, demostró un tiempo hasta la recaída significativamente más prolongado (p < 0,001) en los pacientes tratados con TREVICTA que en los pacientes que recibieron placebo. El veintitrés por ciento (23 %) de los pacientes del grupo placebo y el 7,4 % de los pacientes del grupo de TREVICTA experimentaron un acontecimiento de recaída. Se puso fin al estudio teniendo en cuenta estos resultados de eficacia. La razón de riesgos fue 3,45 (IC del 95 %: 1,73; 6,88), lo que indica una disminución del 71 % del riesgo de recaída en el grupo de TREVICTA en comparación con el placebo. En la figura 1 se representa la gráfica de Kaplan-Meier del tiempo hasta la recaída para cada grupo de tratamiento. También se representa el tiempo hasta la recaída en el grupo de placebo (mediana, 274 días), significativamente más breve que en el grupo de TREVICTA (no fue posible calcular la mediana, debido al escaso porcentaje de pacientes con recaída [7,4 %]).
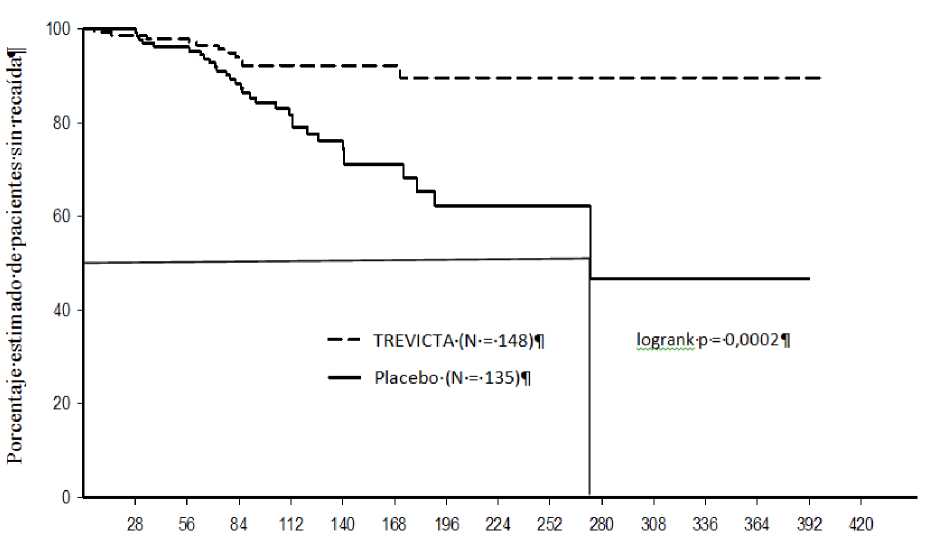
Figura 1: Gráfica de Kaplan-Meier del tiempo hasta la recaída - Análisis intermedio
En el estudio de no inferioridad, 1.429 pacientes con enfermedad aguda (puntuación PANSS total media en el momento inicial: 85,7) que cumplían los criterios DSM-IV de esquizofrenia se incorporaron a la fase abierta y recibieron tratamiento con palmitato de paliperidona inyectable mensual durante 17 semanas. Se permitía ajustar la dosis (esto es, 50 mg, 75 mg, 100 mg o 150 mg) después de 5 semanas y 9 inyecciones y el lugar de inyección podía ser el deltoides o el glúteo. De los pacientes que cumplían los criterios de aleatorización en las semanas 14 y 17, 1.016 fueron aleatorizados en proporción 1:1 para seguir recibiendo una vez al mes la inyección de palmitato de paliperidona mensual o bien cambiar a TREVICTA, multiplicando por 3,5 la dosis de las semanas 9 y 13 de palmitato de paliperidona inyectable mensual, durante un periodo de 48 semanas. Los pacientes recibieron TREVICTA una vez cada 3 meses y una medicación inyectable placebo durante los meses restantes para mantener el ciego. En este estudio, el criterio de valoración de la eficacia principal era el porcentaje de pacientes sin recaída al final de la fase doble ciego de 48 semanas, basado en la estimación de Kaplan-Meier de las 48 semanas (TREVICTA: 91,2 %, palmitato de paliperidona inyectable mensual: 90,0 %). No fue posible calcular la mediana de tiempo hasta la recaída en ninguno de los grupos, dado el escaso porcentaje de pacientes con recaídas. La diferencia (IC 95 %) entre los grupos de tratamiento fue del 1,2 % (-2,7 %, 5,1 %), lo que satisface el criterio de no inferioridad basado en un margen de -10 %. Por tanto, el grupo de tratamiento con TREVICTA fue no inferior al grupo tratado con palmitato de paliperidona inyectable mensual. Las mejorías funcionales, determinadas según la Escala de Funcionamiento Personal y Social (PSP), que se observaron durante la fase de estabilización abierta se mantuvieron durante la fase de doble ciego en ambos de tratamiento.
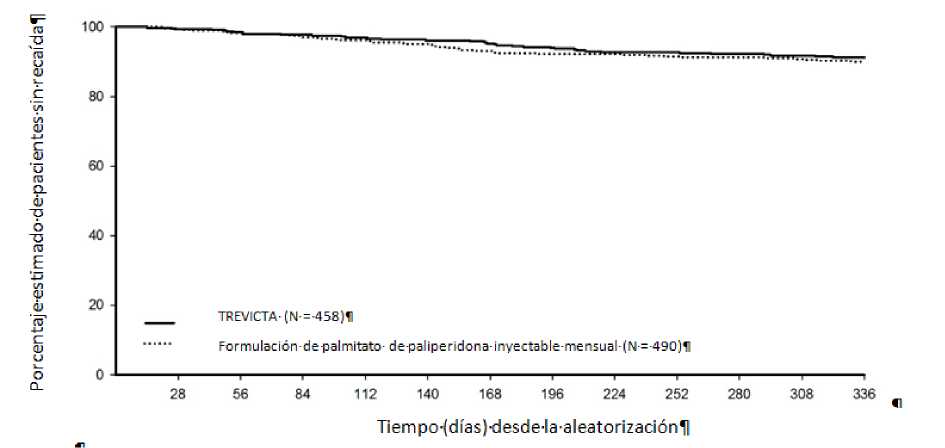
Figura 2: Gráfica de Kaplan-Meier del tiempo hasta la recaída comparando TREVICTA y palmitato de
paliperidona inyectable mensual
Los resultados de eficacia eran consistentes entre los subgrupos de población (sexo, edad y grupo étnico) en ambos estudios.
Población pediátrica
La Agencia Europea de Medicamentos ha eximido al titular de la obligación de presentar los resultados de los ensayos realizados con TREVICTA en los diferentes grupos de la población pediátrica en esquizofrenia. Ver sección 4.2 para consultar la información sobre el uso en población pediátrica.
5.2 Propiedades farmacocinéticas
Absorción y distribución
Debido a su hidrosolubilidad extremadamente baja, la formulación trimestral de palmitato de paliperidona se disuelve lentamente después de la inyección intramuscular antes de hidrolizarse a paliperidona y absorberse a la circulación sistémica. La liberación del principio activo comienza ya a partir del día 1 y dura hasta 18 meses.
Los datos presentados en este apartado se basan en un análisis de farmacocinética poblacional.
Después de una sola dosis intramuscular de TREVICTA, las concentraciones plasmáticas de paliperidona aumentan gradualmente hasta alcanzar concentraciones plasmáticas máximas en una mediana de Tmáx de 30-33 días. Tras la inyección intramuscular de TREVICTA en dosis de 175—
525 mg en el músculo deltoides se observó, en promedio, una Cmáx del 11-12 % más elevada que la que se obtiene tras la inyección en el músculo glúteo. El perfil de liberación y la pauta de administración de TREVICTA dan lugar a concentraciones terapéuticas sostenidas. La exposición total a paliperidona después de la administración de TREVICTA es proporcional a la dosis en un intervalo de dosificación de 175-525 mg y aproximadamente proporcional a la dosis en cuanto a valores de Cmáx. La relación media pico-valle en el estado estacionario para una dosis de TREVICTA es de 1,6 después de la administración en el glúteo y de 1,7 después de la administración en el músculo deltoides.
La paliperidona racémica se une en un 74 % a las proteínas plasmáticas.
Tras la administración de TREVICTA, los enantiómeros (+) y (-) de la paliperidona se interconvierten, alcanzando un cociente entre el AUC (+) y (-) de aproximadamente 1,7-1,8.
Biotransformación y eliminación
En un estudio realizado con 14C-paliperidona oral de liberación inmediata, una semana después de la administración de una dosis oral única de 1 mg de 14C-paliperidona de liberación inmediata, el 59 % de la dosis fue excretada inalterada con la orina, indicando que la paliperidona no se metaboliza masivamente en el hígado. Se recuperó aproximadamente el 80 % de la radiactividad administrada en la orina y el 11 % en las heces. Se han identificado cuatro vías metabólicas in vivo, ninguna de las cuales representó más del 10 % de la dosis: desalquilación, hidroxilación, deshidrogenación y escisión de benzisoxazol. Aunque en estudios in vitro se señalaron que las enzimas CYP2D6 y CYP3A4 pueden intervenir en el metabolismo de la paliperidona, no hay datos in vivo de que estas isoenzimas desempeñen un papel significativo en el metabolismo de la paliperidona. En los análisis de farmacocinética de la población no se observó ninguna diferencia apreciable del aclaramiento aparente de paliperidona tras la administración de paliperidona oral entre los metabolizadores rápidos y lentos de los sustratos de la CYP2D6. En estudios in vitro realizados con microsomas hepáticos humanos se demostró que la paliperidona no inhibe sustancialmente el metabolismo de los medicamentos metabolizados por las isoenzimas del citocromo P450, como CYP1A2, CYP2A6, CYP2C8/9/10, CYP2D6, CYP2E1, CYP3A4 y CYP3A5.
Estudios in vitro han demostrado que la paliperidona es sustrato de la P-gp y un inhibidor débil de la P-gp a concentraciones elevadas. No existen datos in vivo y no se conoce su importancia clínica.
Según el análisis de farmacocinética poblacional, la vida media aparente de paliperidona después de la administración de TREVICTA en el intervalo de dosis de 175-525 mg está comprendida entre 84-95 días cuando se inyecta en el deltoides y 118-139 días cuando se inyecta en el glúteo.
Comparación de palmitato de paliperidona inyectable trimestral de larga acción con otras formulaciones de paliperidona
TREVICTA está diseñado para liberar paliperidona durante un periodo de 3 meses, mientras que la inyección mensual de palmitato de paliperidona se administra una vez al mes. TREVICTA, cuando se administra a dosis 3,5 veces más altas que la dosis correspondiente de palmitato de paliperidona inyectable mensual (ver sección 4.2), produce exposiciones a la paliperidona similares a las que se obtienen con la dosis correspondiente de palmitato de paliperidona inyectable mensual y con la dosis diaria equivalente de los comprimidos de paliperidona de liberación prolongada. El intervalo de exposición obtenido con TREVICTA está dentro del intervalo de exposición obtenido con las dosis aprobadas de los comprimidos de paliperidona de liberación prolongada.
Insuficiencia hepática
Paliperidona no se metaboliza ampliamente en el hígado. Aunque no se ha investigado el uso de TREVICTA en pacientes con insuficiencia hepática, no es necesario un ajuste de dosis en los pacientes con insuficiencia hepática leve o moderada. En un estudio en el que participaron pacientes con insuficiencia hepática moderada (clase B de Child-Pugh) las concentraciones plasmáticas de paliperidona libre fueron similares a las observadas en personas sanas. No se ha investigado el uso de paliperidona en pacientes con insuficiencia hepática grave.
Insuficiencia renal
TREVICTA no se ha estudiado de manera sistemática en pacientes con insuficiencia renal. Se ha estudiado la eliminación de una dosis oral única de un comprimido de 3 mg de paliperidona de liberación prolongada en pacientes con diversos grados de función renal. La eliminación de la paliperidona disminuye al disminuir el aclaramiento de creatinina estimado. El aclaramiento total de paliperidona disminuyó un 32 % en pacientes con insuficiencia renal leve (CrCl= 50 a < 80 ml/min), un 64 % en pacientes con insuficiencia renal moderada (CrCl = 30 a < 50 ml/min) y un 71 % en pacientes con insuficiencia renal grave (CrCl = 10 a < 30 ml/min), lo que corresponde a un aumento medio de la exposición (AUCmf) de 1,5, 2,6 y 4,8 veces, respectivamente, en comparación con personas sanas.
Población de edad avanzada
El análisis de farmacocinética poblacional no ha revelado indicios de diferencias farmacocinéticas relacionadas con la edad.
Índice de masa corporal (IMC)/peso corporal
En los pacientes obesos y con sobrepeso se observaron valores de Cmáx más bajos. En el estado estacionario aparente de TREVICTA, las concentraciones valle eran similares en los pacientes normales, con sobrepeso y obesos.
Raza
El análisis de farmacocinética poblacional no ha revelado indicios de diferencias farmacocinéticas relacionadas con el origen racial.
Sexo
El análisis de farmacocinética poblacional no ha revelado indicios de diferencias farmacocinéticas relacionadas con el sexo.
Tabaquismo
Según estudios in vitro realizados con enzimas hepáticas humanas, paliperidona no es sustrato de la CYP1A2; por lo tanto, el consumo de tabaco no tiene un efecto en la farmacocinética de paliperidona. El efecto del consumo de tabaco sobre la farmacocinética de paliperidona no se ha estudiado en el caso de TREVICTA. Un análisis de farmacocinética poblacional basado en los datos obtenidos con comprimidos de liberación prolongada de paliperidona demostró una exposición a paliperidona ligeramente más baja en los fumadores que en los no fumadores. No es probable que esta diferencia tenga relevancia clínica.
5.3 Datos preclínicos sobre seguridad
Los estudios de toxicidad a dosis repetidas de palmitato de paliperidona (formulación mensual) en inyección intramuscular y de paliperidona en administración oral a ratas y perros mostraron efectos fundamentalmente farmacológicos, como sedación y efectos mediados por la prolactina en glándulas mamarias y genitales. En animales tratados con palmitato de paliperidona se observó una reacción inflamatoria en el lugar de inyección intramuscular. Se produjo la formación ocasional de abscesos.
En estudios sobre la reproducción de las ratas con risperidona oral, que se convierte en gran medida en paliperidona en ratas y en seres humanos, se observaron efectos adversos en el peso al nacer y en la supervivencia de las crías. No se han observado embriotoxicidad ni malformaciones después de la administración intramuscular de palmitato de paliperidona a ratas gestantes a dosis máximas (160 mg/kg/día), equivalentes a 2,2 veces el nivel de exposición de los humanos a la dosis máxima recomendada de 525 mg. Otros antagonistas de la dopamina han tenido efectos negativos en el desarrollo de la motricidad y del aprendizaje en las crías cuando se administraron a animales gestantes.
Ni el palmitato de paliperidona ni la paliperidona han demostrado ser genotóxicos. En estudios sobre el potencial carcinogénico de la risperidona oral en ratas y ratones se observaron aumentos de los adenomas hipofisarios (ratón), de los adenomas del páncreas endocrino (rata) y de los adenomas de las glándulas mamarias (en ambas especies). Se evaluó el potencial carcinogénico del palmitato de paliperidona administrado en inyección intramuscular a ratas. Se observó un incremento estadísticamente significativo de adenocarcinomas de las glándulas mamarias en ratas hembra a las que se administraron dosis de 10, 30 y 60 mg/kg/mes. Las ratas macho experimentaron un incremento estadísticamente significativo de adenomas y carcinomas de las glándulas mamarias cuando se expusieron a dosis de 30 y 60 mg/kg/mes, que representan 0,6 y 1,2 veces el nivel de exposición humana a la dosis máxima recomendada de 525 mg. Estos tumores pueden estar relacionados con el antagonismo prolongado de la dopamina D2 y con la hiperprolactinemia. Se desconoce la relevancia de estos hallazgos tumorales en roedores para el riesgo en seres humanos.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Polisorbato 20 Polietilenglicol 4000 Ácido cítrico monohidratado Dihidrogenofosfato sódico monohidratado Hidróxido de sodio (para ajuste del pH)
Agua para preparaciones inyectables
6.2 Incompatibilidades
Este medicamento no se debe mezclar con otros medicamentos.
6.3 Periodo de validez
2 años
6.4 Precauciones especiales de conservación
Este medicamento no requiere condiciones especiales de conservación.
6.5 Naturaleza y contenido del envase
Jeringa precargada (copolímero de olefina cíclica) con émbolo, tope trasero y capuchón protector (goma bromobutílica), equipada con una aguja de seguridad de pared fina de 22 G 1/ pulgadas (0,72 mm x 38,1 mm) y una aguja de seguridad de pared fina de 22 G 1 pulgadas (0,72 mm x 25,4 mm).
Tamaño del envase:
Envases con 1 jeringa precargada y 2 agujas
6.6 Precauciones especiales de eliminación y otras manipulaciones
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se debe realizar de acuerdo con la normativa local.
En el prospecto del envase se incluyen instrucciones completas del uso y manejo de TREVICTA (Ver
Información reservada para médicos o profesionales sanitarios).
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Janssen-Cilag International NV Turnhoutseweg 30 B-2340 Beerse Bélgica
EU/1/14/971/007
EU/1/14/971/008
EU/1/14/971/009
EU/1/14/971/010
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 5 de diciembre de 2014 10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
A. FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
Nombre y dirección del fabricante responsable de la liberación de los lotes
Janssen Pharmaceutica NV Turnhoutseweg 30 B-2340 Beerse Bélgica
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica.
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
Los requerimientos para la presentación de los informes periódicos de seguridad para este medicamento se establecen en la lista de fechas de referencia de la Unión (lista EURD) prevista en el artículo 107quater, apartado 7, de la Directiva 2001/83/CE y cualquier actualización posterior publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN
SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado en la versión del PGR incluido en el Módulo 1.8.2 de la Autorización de Comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos.
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR CAJA DE CARTÓN
1. NOMBRE DEL MEDICAMENTO
TREVICTA 175 mg suspensión inyectable de liberación prolongada paliperidona
2. PRINCIPIO(S) ACTIVO(S)
Cada jeringa precargada contiene palmitato de paliperidona equivalente a 175 mg de paliperidona.
3. LISTA DE EXCIPIENTES
Excipientes: polisorbato 20, polietilenglicol 4000, ácido cítrico monohidratado, dihidrogenofosfato sódico monohidratado, hidróxido de sodio, agua para preparaciones inyectables
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Suspensión de liberación prolongada para inyección
1 jeringa precargada
2 agujas
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento. Vía intramuscular

Administrar cada 3 meses
Agitar la jeringa enérgicamente durante al menos 15 segundos
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Janssen-Cilag International NV Tumhoutseweg 30 B-2340 Beerse Bélgica
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/14/971/007
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
trevicta 175 mg
17. IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D
Incluido el código de barras 2D que lleva el identificador único
18. IDENTIFICADOR ÚNICO - INFORMACIÓN EN CARACTERES VISUALES
PC:
SN:
NN:
INFORMACIÓN MÍNIMA QUE DEBE INCLUIRSE EN PEQUEÑOS ACONDICIONAMIENTOS PRIMARIOS
JERINGA PRECARGADA
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
TREVICTA 175 mg inyectable
paliperidona
IM
2. FORMA DE ADMINISTRACIÓN

3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
175 mg
6. OTROS
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR CAJA DE CARTÓN
1. NOMBRE DEL MEDICAMENTO
TREVICTA 263 mg suspensión inyectable de liberación prolongada paliperidona
2. PRINCIPIO(S) ACTIVO(S)
Cada jeringa precargada contiene palmitato de paliperidona equivalente a 263 mg de paliperidona.
3. LISTA DE EXCIPIENTES
Excipientes: polisorbato 20, polietilenglicol 4000, ácido cítrico monohidratado, dihidrogenofosfato sódico monohidratado, hidróxido de sodio, agua para preparaciones inyectables
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Suspensión de liberación prolongada para inyección
1 jeringa precargada
2 agujas
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento. Vía intramuscular

Administrar cada 3 meses
Agitar la jeringa enérgicamente durante al menos 15 segundos
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Janssen-Cilag International NV Tumhoutseweg 30 B-2340 Beerse Bélgica
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/14/971/008
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
trevicta 263 mg
17. IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D
Incluido el código de barras 2D que lleva el identificador único
18. IDENTIFICADOR ÚNICO - INFORMACIÓN EN CARACTERES VISUALES
PC:
SN:
NN:
INFORMACIÓN MÍNIMA QUE DEBE INCLUIRSE EN PEQUEÑOS ACONDICIONAMIENTOS PRIMARIOS
JERINGA PRECARGADA
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
TREVICTA 263 mg inyectable
paliperidona
IM
2. FORMA DE ADMINISTRACIÓN

Agitar enérgicamente
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
263 mg
6. OTROS
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR CAJA DE CARTÓN
1. NOMBRE DEL MEDICAMENTO
TREVICTA 350 mg suspensión inyectable de liberación prolongada paliperidona
2. PRINCIPIO(S) ACTIVO(S)
Cada jeringa precargada contiene palmitato de paliperidona equivalente a 350 mg de paliperidona.
3. LISTA DE EXCIPIENTES
Excipientes: polisorbato 20, polietilenglicol 4000, ácido cítrico monohidratado, dihidrogenofosfato sódico monohidratado, hidróxido de sodio, agua para preparaciones inyectables
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Suspensión de liberación prolongada para inyección
1 jeringa precargada
2 agujas
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento. Vía intramuscular

Administrar cada 3 meses
Agitar la jeringa enérgicamente durante al menos 15 segundos
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Janssen-Cilag International NV Tumhoutseweg 30 B-2340 Beerse Bélgica
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/14/971/009
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
trevicta 350 mg
17. IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D
Incluido el código de barras 2D que lleva el identificador único
18. IDENTIFICADOR ÚNICO - INFORMACIÓN EN CARACTERES VISUALES
PC:
SN:
NN:
INFORMACIÓN MÍNIMA QUE DEBE INCLUIRSE EN PEQUEÑOS ACONDICIONAMIENTOS PRIMARIOS
JERINGA PRECARGADA
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
TREVICTA 350 mg inyectable
paliperidona
IM
2. FORMA DE ADMINISTRACIÓN

Agitar enérgicamente
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
350 mg
6. OTROS
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR CAJA DE CARTÓN
1. NOMBRE DEL MEDICAMENTO
TREVICTA 525 mg suspensión inyectable de liberación prolongada paliperidona
2. PRINCIPIO(S) ACTIVO(S)
Cada jeringa precargada contiene palmitato de paliperidona equivalente a 525 mg de paliperidona.
3. LISTA DE EXCIPIENTES
Excipientes: polisorbato 20, polietilenglicol 4000, ácido cítrico monohidratado, dihidrogenofosfato sódico monohidratado, hidróxido de sodio, agua para preparaciones inyectables
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Suspensión de liberación prolongada para inyección
1 jeringa precargada
2 agujas
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento. Vía intramuscular

Administrar cada 3 meses
Agitar la jeringa enérgicamente durante al menos 15 segundos
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Janssen-Cilag International NV Tumhoutseweg 30 B-2340 Beerse Bélgica
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/14/971/010
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
trevicta 525 mg
17. IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D
Incluido el código de barras 2D que lleva el identificador único
18. IDENTIFICADOR ÚNICO - INFORMACIÓN EN CARACTERES VISUALES
PC:
SN:
NN:
INFORMACIÓN MÍNIMA QUE DEBE INCLUIRSE EN PEQUEÑOS ACONDICIONAMIENTOS PRIMARIOS
JERINGA PRECARGADA
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
TREVICTA 525 mg inyectable
paliperidona
IM
2. FORMA DE ADMINISTRACIÓN
Agitar enérgicamente
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
525 mg
6. OTROS
B. PROSPECTO
Prospecto: información para el usuario
TREVICTA 175 mg suspensión inyectable de liberación prolongada TREVICTA 263 mg suspensión inyectable de liberación prolongada TREVICTA 350 mg suspensión inyectable de liberación prolongada TREVICTA 525 mg suspensión inyectable de liberación prolongada
paliperidona
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico, farmacéutico o enfermero.
- Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos secundarios que no aparezcan en este folleto. Ver sección 4.
Contenido del prospecto
1. Qué es TREVICTA y para qué se utiliza
2. Qué necesita saber antes de empezar a usar TREVICTA
3. Cómo usar TREVICTA
4. Posibles efectos adversos
5. Conservación de TREVICTA
6. Contenido del envase e información adicional
1. Qué es TREVICTA y para qué se utiliza
TREVICTA contiene el principio activo paliperidona, que pertenece a la clase de los medicamentos antipsicóticos y se utiliza como tratamiento de mantenimiento para combatir los síntomas de la esquizofrenia en pacientes adultos.
Si usted ha respondido bien al tratamiento con palmitato de paliperidona inyectable administrado una vez al mes, su médico puede decidir iniciar el tratamiento con TREVICTA.
La esquizofrenia es un trastorno con síntomas "positivos" y "negativos". Positivo significa un exceso de síntomas que normalmente no están presentes. Por ejemplo, una persona con esquizofrenia puede escuchar voces o ver cosas que no existen (denominadas alucinaciones), tener creencias erróneas (denominadas delirios) o tener una desconfianza en los demás fuera de lo normal. Negativo se refiere a la falta de conductas o sentimientos que normalmente están presentes. Por ejemplo, una persona con esquizofrenia se puede encerrar en sí misma y no responder a ningún estímulo emocional o pueden tener problemas para hablar de una manera clara y lógica. Las personas que padecen este trastorno también se pueden sentir deprimidas, ansiosas, culpables o tensas.
TREVICTA puede aliviar los síntomas de su enfermedad y reducir la probabilidad de que se vuelvan a presentar.
2. Qué necesita saber antes de empezar a usar TREVICTA No debe usar TREVICTA
- si es alérgico a la paliperidona o a alguno de los demás componentes de este medicamento (incluidos en la sección 6).
- si es alérgico a otros medicamentos antipsicóticos incluida risperidona.
Advertencias y precauciones
Consulte a su médico, farmacéutico o enfermero antes de empezar a usar TREVICTA.
Este medicamento no se ha estudiado en pacientes de edad avanzada con demencia. Sin embargo, los pacientes de edad avanzada con demencia, que están siendo tratados con otros medicamentos similares, pueden tener un aumento de riesgo de ataque cerebral o muerte (ver sección 4).
Todos los medicamentos tienen efectos adversos y algunos de los efectos adversos de este medicamento pueden empeorar los síntomas de otras patologías. Por esa razón, es importante que comente con su médico cualquiera de las siguientes enfermedades, que podrían empeorar durante el tratamiento con este medicamento.
- si tiene la enfermedad de Parkinson
- si se le ha diagnosticado una enfermedad cuyos síntomas incluyen temperatura elevada y rigidez muscular (conocido como Síndrome Neuroléptico Maligno)
- si ha tenido espasmos o movimientos bruscos que no puede controlar en la cara, la lengua u otras partes del cuerpo (discinesia tardía)
- si en el pasado se le han detectado recuentos bajos de glóbulos blancos (que pueden haber sido provocados por otros medicamentos o no)
- si es diabético o tiene tendencia a la diabetes
- si ha tenido cáncer de mama o un tumor en la hipófisis (una glándula del cerebro)
- si padece alguna enfermedad cardíaca o si recibe tratamiento para enfermedades cardíacas que pueden hacerle más propenso a una reducción de la presión arterial
- si tiene la presión arterial baja cuando se incorpora o sienta bruscamente
- si tiene antecedentes de convulsiones
- si tiene problemas renales
- si tiene problemas de hígado
- si tiene erección prolongada y/o dolorosa
- si tiene dificultad para controlar la temperatura corporal o presenta un calentamiento excesivo
- si tiene una concentración sanguínea anormalmente elevada de la hormona prolactina o si tiene un posible tumor dependiente de prolactina
- si usted o alguien de su familia tienen antecedentes de coágulos sanguíneos, ya que los antipsicóticos se han asociado con la formación de coágulos.
Si se encuentra en alguna de estas situaciones, hable con su médico, ya que puede ser necesario ajustarle la dosis o vigilar su estado durante algún tiempo.
Teniendo en cuenta que, raramente, se ha observado un número peligrosamente bajo de determinado tipo de glóbulos blancos encargados de combatir las infecciones en la sangre en los pacientes que reciben este medicamento, es posible que el médico decida practicarle recuentos de leucocitos.
Incluso si usted ha tolerado previamente paliperidona oral o risperidona, raramente ocurren reacciones alérgicas después de recibir inyecciones de TREVICTA. Solicite ayuda médica inmediatamente si experimenta una erupción cutánea, hinchazón de la garganta, picor o problemas de la respiración, ya que éstos pueden ser signos de una reacción alérgica grave.
Este medicamento puede hacerle aumentar de peso. Un aumento de peso significativo podría ser perjudicial para su salud. El médico le controlará regularmente el peso corporal.
Dado que se ha observado diabetes mellitus o empeoramiento de una diabetes mellitus preexistente, en algunos pacientes que estaban usando este medicamento, el médico debe vigilar los posibles signos de hiperglucemia. En los pacientes con diabetes mellitus preexistente se debe controlar regularmente el nivel de glucosa en sangre.
Dado que este medicamento puede reducir el reflejo del vómito, existe la posibilidad de que enmascare la respuesta normal del organismo a la ingestión de sustancias tóxicas u otras enfermedades.
Durante la intervención en el ojo por turbidez de las lentes (cataratas), la pupila (el círculo negro situado en medio del ojo), puede no aumentar de tamaño como se necesita. Además, el iris (la parte coloreada del ojo) se puede poner flácido durante la cirugía y esto puede causar daño en el ojo. Si usted está pensando en ser operado de los ojos, asegúrese de informar a su oftalmólogo que está usando este medicamento.
Niños y adolescentes
No utilice este medicamento en niños y adolescentes menores de 18 años de edad. No se conoce su seguridad ni su eficacia en estos pacientes.
Otros medicamentos y TREVICTA
Informe a su médico si está tomando, ha tomado recientemente o podría tener que tomar cualquier otro medicamento.
Si toma este medicamento con carbamazepina (un antiepiléptico y estabilizador del estado de ánimo) puede que tenga que modificar la dosis de este medicamento.
Dado que este medicamento actúa principalmente en el cerebro, el uso de otros medicamentos con acción cerebral podría exagerar efectos secundarios como la somnolencia u otros efectos sobre el cerebro como otros medicamentos psiquiátricos, opioides, antihistamínicos y medicamentos para dormir.
Debido a que este medicamento puede hacer disminuir la presión arterial, se debe tener precaución al combinarlo con otros medicamentos que reducen la presión arterial.
Este medicamento puede reducir el efecto de los medicamentos que se usan para la enfermedad de Parkinson y el síndrome de piernas inquietas (p. ej., levodopa).
Este medicamento puede provocar una anomalía del electrocardiograma (ECG) que indica que los impulsos eléctricos tardan en llegar a una parte concreta del corazón (conocido como “prolongación del intervalo QT”). Entre los medicamentos que ejercen este efecto figuran algunos medicamentos que se usan para regular el ritmo cardíaco o tratar infecciones, además de otros antipsicóticos.
Si tiene antecedentes de convulsiones, este medicamento puede aumentar la probabilidad de que vuelva a presentarlas. Otros medicamentos que ejercen este efecto incluyen algunos medicamentos que se usan para tratar la depresión o las infecciones y otros antipsicóticos.
TREVICTA con alcohol
El alcohol se debe evitar.
Embarazo y lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento. No debe usar este medicamento durante el embarazo sin haberlo comentado antes con su médico. En niños recién nacidos de madres que han recibido paliperidona en el último trimestre (los tres últimos meses del embarazo) pueden aparecer los síntomas siguientes: temblores, rigidez o debilidad muscular, somnolencia, agitación, trastornos de la respiración y dificultad para alimentarse. Si su hijo manifiesta alguno de estos síntomas, solicite atención médica para su hijo.
Este medicamento puede pasar de la madre al hijo a través de la leche materna y ser perjudicial para el niño. Por este motivo no debe dar el pecho mientras esté usando este medicamento.
Conducción y uso de máquinas
Durante el tratamiento con este medicamento pueden aparecer mareos, cansancio extremo y problemas de visión (ver sección 4). Estos efectos se deben tener en cuenta en los casos en que se requiera una atención máxima, por ejemplo al conducir vehículos o manejar maquinaria.
Información importante sobre algunos de los componentes de TREVICTA
El intervalo normal de dosificación para este medicamento contiene menos de 1 mmol de sodio (23 mg) por dosis, es decir que se puede considerar como esencialmente "exento de sodio".
3. Cómo usar TREVICTA
Este medicamento es administrado por un médico o profesional sanitario El médico le indicará cuándo se debe administrar la siguiente inyección. Es importante que no omita la dosis programada. Si no puede asistir a su cita con el médico, asegúrese de llamarle de inmediato para concertar otra cita tan pronto como sea posible.
Se le administrará una inyección de TREVICTA en la parte superior del brazo o en la nalga una vez cada 3 meses.
En función de los síntomas que tenga, el médico aumentará o reducirá la cantidad de medicamento que se le administrará en la siguiente inyección programada.
Pacientes con trastornos renales
Si padece algún trastorno renal leve, el médico determinará la dosis adecuada de TREVICTA basándose en la dosis de palmitato de paliperidona inyectable mensual que haya estado recibiendo. Si padece un trastorno renal grave o moderado no debe usar este medicamento.
Población de edad avanzada
Si tiene la función renal disminuida, el médico determinará la dosis adecuada de este medicamento.
Si recibe más TREVICTA del que debe
Este medicamento se le administrará bajo supervisión médica; por lo tanto, es improbable que reciba más cantidad de la debida.
Si un paciente recibe una cantidad excesiva de paliperidona puede presentar los síntomas siguientes: Somnolencia o sedación, aceleración de la frecuencia cardíaca, presión arterial baja, alteraciones del electrocardiograma (registro eléctrico del corazón) o movimientos lentos y anormales de la cara, el cuerpo, los brazos o las piernas.
Si interrumpe el tratamiento con TREVICTA
Si deja de recibir las inyecciones pueden empeorar los síntomas de la esquizofrenia. No debe dejar de usar este medicamento a menos que se lo indique su médico.
Si tiene cualquier otra duda sobre el uso de este producto, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este puede producir efectos adversos, aunque no todas las
personas los sufran.
Informe inmediatamente a su médico si:
• presenta coágulos sanguíneos en las venas, especialmente en las piernas (los síntomas son hinchazón, dolor y enrojecimiento de las piernas), que a través de los vasos sanguíneos pueden llegar hasta los pulmones causándole dolor en el pecho y dificultad para respirar
• observa un cambio brusco de su estado mental o una debilidad o entumecimiento repentinos de cara, brazos o piernas, especialmente en un solo lado del cuerpo; o si le cuesta hablar, aunque sea un tiempo breve. Puede ser signo de un ictus
• presenta fiebre, rigidez muscular, sudores o un nivel de conciencia reducido (un trastorno llamado “Síndrome Neuroléptico Maligno"). Puede necesitar tratamiento médico inmediato
• es varón y tiene erecciones prolongadas o dolorosas. Es lo que se denomina priapismo. Puede necesitar tratamiento médico inmediato
• tiene espasmos o movimientos bruscos que no puede controlar en la cara, la lengua u otras partes del cuerpo (discinesia tardía)
• sufre una reacción alérgica grave caracterizada por fiebre, hinchazón de la boca, la cara, los labios o la lengua, dificultad respiratoria, picor, erupción de la piel y a veces bajada de la tensión (lo que constituye una “reacción anafiláctica”). Incluso si ha tolerado previamente la risperidona oral o la paliperidona oral, raramente podría sufrir reacciones alérgicas después de recibir las inyecciones de paliperidona
• tiene previsto someterse a una operación en el ojo, asegúrese de decir a su oftalmólogo que está recibiendo este medicamento. Durante una operación del ojo por opacidad de las lentes (cataratas), es posible que el iris (la parte coloreada del ojo) quede flácido durante la cirugía (lo que se denomina “síndrome del iris flácido”) con el consiguiente daño ocular
• presenta un número peligrosamente bajo de un tipo de células blancas de la sangre necesarias para combatir las infecciones sanguíneas.
Pueden aparecer los siguientes efectos adversos:
Efectos adversos muy frecuentes: pueden afectar a más de 1 de cada 10 personas
• dificultad para conciliar o mantener el sueño.
Efectos adversos frecuentes: pueden afectar hasta 1 de cada 10 personas
• síntomas de resfriado común, infección de las vías urinarias, sensación de tener la gripe
• concentración elevada de azúcar en sangre, aumento de peso, pérdida de peso
• irritabilidad, depresión, ansiedad
• sensación de inquietud
• parkinsonismo: movimientos lentos, con temblor, rigidez y caminar arrastrando los pies
• temblor (agitación)
• distonía: contracción involuntaria lenta o sostenida de los músculos. Aunque puede afectar a cualquier parte del cuerpo (y dar lugar a posturas anormales), la distonía es más común en la cara, con movimientos anómalos de los ojos, la boca, la lengua o la mandíbula
• mareo, somnolencia o sensación de estar menos alerta, dolor de cabeza
• frecuencia cardíaca enlentecida o acelerada
• hipertensión arterial
• tos, congestión nasal
• dolor abdominal, vómitos, náuseas, estreñimiento, diarrea, indigestión, dolor dental.
• aumento de la concentración de transaminasas hepáticas en la sangre
• erupción de la piel
• dolor de huesos o músculos, dolor de espalda, dolor en las articulaciones
• falta de periodos menstruales
• fiebre, debilidad, fatiga (cansancio)
• reacciones en el lugar de inyección, con picor, dolor o hinchazón.
Efectos adversos poco frecuentes (pueden afectar hasta 1 de cada 100 pacientes)
• neumonía, infección en el pecho (bronquitis), infección de las vías respiratorias, sinusitis, infección de la vejiga, infección de oídos, amigdalitis, infección de las uñas por hongos, infecciones de la piel
• reducción del número de glóbulos blancos, reducción de plaquetas (células necesarias para detener las hemorragias)
• anemia
• reacción alérgica
• TREVICTA puede elevar la concentración sanguínea de una hormona llamada "prolactina" presente en los análisis de sangre (lo que puede causar o no síntomas). Los síntomas que pueden aparecer en caso de elevación de la prolactina son: (en varones) hinchazón de las mamas, dificultad para tener o mantener una erección u otras disfunciones sexuales, (en mujeres)
molestias en las mamas, secreción de leche por las mamas, falta de periodos menstruales u otros problemas con el ciclo menstrual
• diabetes o empeoramiento de la diabetes, aumento de la concentración sanguínea de insulina (hormona que regula los niveles de azúcar en la sangre), aumento del apetito, pérdida del apetito que resulta en malnutrición y disminución del peso corporal, disminución del apetito, triglicéridos (un tipo de grasas) altos en la sangre, aumento del colesterol en la sangre.
• trastornos del sueño, disminución del deseo sexual, nerviosismo, pesadillas
• desmayo, deseo apremiante de mover determinadas partes del cuerpo, mareo al ponerse de pie, problemas de atención, trastornos del habla, pérdida o alteración del sentido del gusto, menor sensibilidad de la piel para el dolor y el tacto, sensación de hormigueo, pinchazos o entumecimiento de la piel
• visión borrosa, infección ocular u ojos enrojecidos, sequedad de ojos
• sensación de que todo da vueltas (vértigo), zumbido de oídos, dolor de oídos
• interrupción de la conducción entre las partes superiores e inferiores del corazón, trastornos de la conducción eléctrica cardíaca, prolongación del intervalo QT del corazón, aceleración de los latidos al ponerse de pie, anomalías en el registro eléctrico del corazón (electrocardiograma o ECG), sensación de palpitación o aleteos en el pecho (palpitaciones)
• tensión baja, hipotensión al ponerse de pie (debido a este efecto, algunas personas tratadas con TREVICTA pueden sentir debilidad o mareos, o pueden desmayarse cuando se levantan o se sientan de forma repentina)
• dificultad para respirar, dolor de garganta, hemorragia nasal
• molestias abdominales, infección gástrica o intestinal, sequedad de boca, expulsión excesiva de gases o flatulencias
• aumento de la GGT (una enzima del hígado llamada gamma glutamiltransferasa) en la sangre, aumento de las enzimas hepáticas en la sangre
• aparición de habones (o urticaria), picor, caída del cabello, eccema, sequedad de piel, enrojecimiento de la piel, acné
• aumento de la CPK (creatinfosfoquinasa) en la sangre, una enzima que a veces se libera con la degradación muscular, espasmos musculares, rigidez de las articulaciones, debilidad muscular, dolor de cuello
• incontinencia (falta de control) de la orina, micción frecuente, dolor al orinar.
• dificultad para tener y mantener las erecciones (disfunción eréctil), trastornos de la eyaculación, falta de periodos menstruales o alteraciones del ciclo (en las mujeres), desarrollo de las mamas en los varones, secreción de leche por las mamas, disfunción sexual, dolor de mamas
• hinchazón de cara, boca, ojos o labios, hinchazón del cuerpo, los brazos o las piernas, cambios de la forma de caminar, dolor o molestias en el pecho, sensación de malestar general, endurecimiento de la piel
• caídas.
Efectos adversos raros: pueden afectar hasta 1 de cada 1.000 pacientes
• infección de ojos, sarna, formación de un absceso bajo la piel
• disminución del número de glóbulos blancos que protegen frente a las infecciones, aumento de los eosinófilos (un tipo de glóbulos blancos) en la sangre
• secreción inapropiada de una hormona que controla el volumen de orina, presencia de azúcar en la orina
• complicaciones de la diabetes no controlada con peligro para la vida, disminución del azúcar en la sangre, ingesta excesiva de agua.
• estado de ánimo exaltado (manía), confusión, ausencia de emociones, incapacidad de alcanzar el orgasmo
• glaucoma (aumento de la presión interna del ojo), alteraciones de los movimientos oculares, "ojos en blanco"
• hipersensibilidad de los ojos a la luz, exceso de lagrimeo, ojos enrojecidos.
• fibrilación auricular (una alteración del ritmo cardíaco), latidos irregulares
• dificultad para respirar (apnea del sueño) durante el sueño, congestión pulmonar, congestión de las vías respiratorias
• sibilancias (pitidos al respirar)
• inflamación del páncreas, hinchazón de la lengua, incontinencia de las heces, excreción de heces muy endurecidas, dificultad para tragar, labios agrietados
• erupción de la piel relacionada con el medicamento, engrasamiento de la piel, caspa
• hinchazón de las articulaciones
• incapacidad para orinar
• malestar mamario, hinchazón de las glandulas mamarias, aumento del tamaño de las mamas, flujo vaginal.
• temperatura corporal muy baja, escalofríos, aumento de la temperatura corporal, sensación de sed, síntomas de abstinencia del medicamento, acumulación de pus debida a infección en el lugar de inyección, infección de las capas profundas de la piel, quiste en el lugar de inyección, hematomas (moratones) en el lugar de inyección.
Frecuencia no conocida: no se puede estimar a partir de los datos disponibles
• reacción alérgica grave caracterizada por fiebre, hinchazón de la boca, la cara, los labios o la lengua, dificultad respiratoria, picor, erupción de la piel, y, a veces, bajada de la tensión
• ingestión de cantidades de agua peligrosamente excesivas
• coma por diabetes no controlada, alteraciones de la coordinación, sacudidas de la cabeza
• respiración superficial y agitada, neumonía causada por la aspiración de alimentos, sonidos pulmonares crepitantes, alteraciones de la voz
• obstrucción intestinal, falta de movimiento intestinal que causa una obstrucción intestinal
• color amarillo de la piel y los ojos (ictericia)
• reacción alérgica grave con hinchazón que puede afectar a la garganta y provocar dificultad para respirar, decoloración de la piel, descamación, picor del cuero cabelludo o de la piel
• degradación de las fibras musculares y dolor muscular (rabdomiolisis), postura anómala
• los recién nacidos cuya madre haya tomado TREVICTA durante el embarazo pueden experimentar efectos adversos del medicamento y/o síntomas de abstinencia, como irritabilidad, contracciones musculares lentas o mantenidas, temblores, insomnio, problemas respiratorios o alimentarios
• disminución de la temperatura corporal, acumulación de células muertas en la piel que rodea al punto de inyección, úlcera en el lugar de inyección.
Notificación de efectos secundarios
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos secundarios que no aparezcan en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la notificación de efectos secundarios usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de TREVICTA
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en el envase. La fecha de caducidad es el último día del mes que se indica.
Este medicamento no requiere condiciones especiales de conservación.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma ayudará a proteger el medio ambiente.
Composición de TREVICTA
El principio activo es paliperidona.
Cada jeringa precargada de TREVICTA 175 mg contiene 273 mg de palmitato de paliperidona. Cada jeringa precargada de TREVICTA 263 mg contiene 410 mg de palmitato de paliperidona. Cada jeringa precargada de TREVICTA 350 mg contiene 546 mg de palmitato de paliperidona. Cada jeringa precargada de TREVICTA 525 mg contiene 819 mg de palmitato de paliperidona.
Los demás componentes son:
Polisorbato 20 Polietilenglicol 4000 Ácido cítrico monohidratado Dihidrogenofosfato sódico monohidratado Hidróxido de sodio (para ajuste del pH)
Agua para preparaciones inyectables
Aspecto del producto y contenido del envase
TREVICTA es una suspensión inyectable de liberación prolongada, de color blanco a blanquecino, que se presenta en una jeringa precargada que el médico o enfermero agitarán enérgicamente para homogeneizar la suspensión antes de inyectarla.
Cada envase contiene 1 jeringa precargada y 2 agujas.
Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización
Janssen-Cilag International NV Turnhoutseweg 30 B-2340 Beerse Bélgica
Responsable la fabricación
Janssen Pharmaceutica NV Turnhoutseweg 30 B-2340 Beerse Bélgica
Pueden solicitar más información respecto a este titular de la autorización de comercialización.
Belgie/Belgique/Belgien
Janssen-Cilag NV Tel/Tél: +32 14 64 94 11
Et^rapnn
’^^OHCtH & fl^OHCtH Etnrapna” EOOfl Ten.:+359 2 489 9400
Ceská republika JANSSEN-CILAG s.r.o.
Tel:+420 227 012 227
Danmark
JANSSEN-CILAG A/S Tlf: +45 45 94 82 82
medicamento dirigiéndose al representante local del
Lietuva
UAB “JOHNSON & JOHNSON”Tel: +370 5 278 68 88
Luxembourg/Luxemburg
Janssen-Cilag NV Tél/Tel: +32 14 64 94 11
Magyarország JANSSEN-CILAG Kft.
Tel.:+36 1 884 2858
Malta
AM MANGION LTD Tel: +356 2397 6000
Deutschland
JANSSEN-CILAG GmbH Tel: +49 2137-955-955
Eesti
UAB “JOHNSON & JOHNSON” Eesti filiaal Tel.: + 372 617 7410
EXláha
JANSSEN-CILAG Oap^aKenxix^ A.E.B.E Tn^: +30 210 80 90 000
España
JANSSEN-CILAG, S.A.
Tel: +34 91 722 81 00
France
JANSSEN-CILAG
Tel: 0800 25 50 75 / + 33 1 55 00 40 03 Hrvatska
Johnson & Johnson S.E. d.o.o.
Tel: +385 1 6610 700
Ireland
JANSSEN-CILAG Ltd.
Tel: +44 1494 567 444
Ísland
JANSSEN-CILAG C/o Vistor hf Sími: +354 535 7000
Italia
Janssen-Cilag SpA Tel: +39 02/2510.1
Kúnpoq
BapváPag Xar^nnavay^g AxS Tn^: +357 22 207 700
Latvija
UAB “JOHNSON & JOHNSON” filíale Latvija Tel: +371 6789 3561
Nederland
JANSSEN-CILAG B.V.
Tel: +31 13 583 73 73
Norge
JANSSEN-CILAG AS Tlf: + 47 24 12 65 00
Osterreich
Janssen-Cilag Pharma GmbH Tel: +43 1 610 300
Polska
JANSSEN-CILAG Polska Sp. z o.o.
Tel.: + 48 22 -237 6000
Portugal
JANSSEN-CILAG FARMACEUTICA, LDA Tel: +351 21 43 68 835
Romanía
Johnson & Johnson Romania SRL Tel: +40 21 207 1800
Slovenija
Johnson & Johnson d.o.o.
Tel: + 386 1401 18 30
Slovenská republika
Johnson & Johnson s.r.o.
Tel: +421 232 408 400
Suomi/Finland
JANSSEN-CILAG OY Puh/Tel: +358 207 531 300
Sverige
JANSSEN-CILAG AB Tel: +46 8 626 50 00
United Kingdom
JANSSEN-CILAG Ltd. Tel: +44 1494 567 444
Fecha de la última revisión de este prospecto:
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu/.
Esta información está destinada únicamente a los médicos o profesionales sanitarios, que deben leerla junto con la información de prescripción completa (Resumen de las Características del Producto).

Administrar cada 3 meses
Agitar la jeringa enérgicamente durante al menos 15 segundos
Para inyección intramuscular exclusivamente. No administrar por ninguna otra vía.
Importante
Lea las instrucciones completas antes de usar el producto. Para asegurar una administración adecuada de TREVICTA, es necesario leer atentamente estas instrucciones de uso.
TREVICTA debe ser administrado por un profesional sanitario como inyección única. NO fraccionar la dosis en inyecciones repetidas.
TREVICTA está indicado para administración intramuscular exclusivamente. Inyectar lenta y profundamente en el músculo procurando evitar la inyección en un vaso sanguíneo.
Dosificación
TREVICTA se administrará una vez cada 3 meses.
Preparación
Desprenda la etiqueta de la jeringa e incorpórela a la historia clínica del paciente.
TREVICTA requiere una agitación más enérgica y prolongada que el palmitato de paliperidona inyectable mensual. Agite la jeringa enérgicamente, con el extremo mirando hacia arriba, durante al menos 15 segundos en el intervalo de 5 minutos que precede a la administración (ver paso 2).
Selección de la aguja de seguridad de pared fina
Las agujas de seguridad de pared fina están diseñadas para ser utilizadas con TREVICTA. Es importante utilizar únicamente las agujas que se facilitan en el envase de TREVICTA.
Jeringa Aguja de seguridad Precargada de pared fina
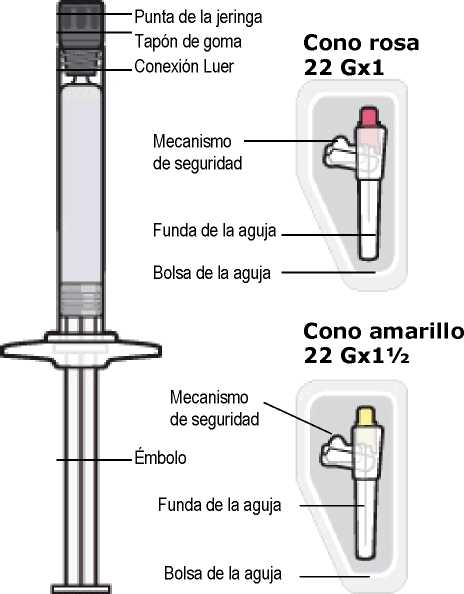
La selección de la aguja está determinada por el lugar de inyección y el peso del paciente.
Si la inyección se administra en el músculo deltoides
Si el paciente pesa: Menos de 90 kg
cono rosa
Si la inyección se administra en el músculo glúteo
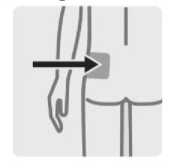
22Gx1
Con independencia del peso del paciente:
cono amarillo

90 kg o más
cono amarillo


Deseche inmediatamente la aguja que no se ha usado en un contenedor aprobado para objetos punzantes. No conserve la aguja para un futuro uso.
2 Preparación de la inyección
►
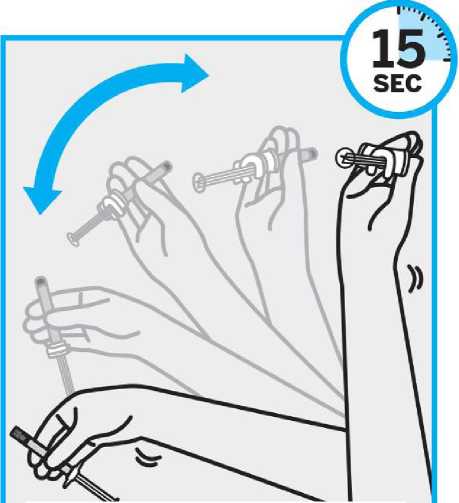

AGITAR ENÉRGICAMENTE durante al menos 15 segundos.
Con la punta hacia arriba AGITAR ENÉRGICAMENTE con la muñeca relajada durante al menos 15 segundos para garantizar una suspensión homogénea.
NOTA: Este medicamento requiere una agitación más enérgica y prolongada que el palmitato de paliperidona inyectable mensual.
Avance al paso siguiente inmediatamente después de agitar la jeringa. Si han transcurrido más de 5 minutos antes de la inyección, agite enérgicamente, con la punta de la jeringa mirando hacia arriba, y de nuevo durante al menos 15 segundos para resuspender la medicación.
\_/
Compruebe la suspensión
Después de agitar la jeringa durante al menos 15 segundos, compruebe el aspecto de la suspensión en el visor.
La suspensión debe presentar un aspecto uniforme y color blanco lechoso.
Es normal que aparezcan pequeñas burbujas de aire.
Abra el blíster de la aguja y retire el tapón.
Primero, abra el blíster de la aguja despegando hasta la mitad la cubierta. Apóyese sobre una superficie limpia.
Luego, con la jeringa mirando hacia arriba, haga girar el tapón de goma tirando hacia fuera para extraerlo.
Sujete el blíster de la aguja.
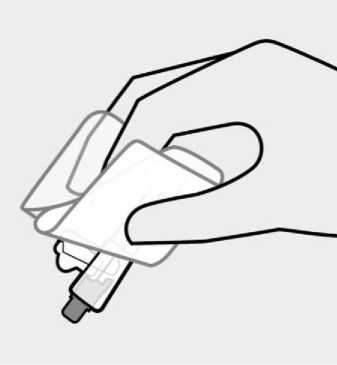
Doble hacia atrás la lámina que cubre la aguja y la bandeja de plástico. A continuación, agarre con firmeza la funda de la aguja sujetándola por el blíster, como se indica.
Acople la aguja
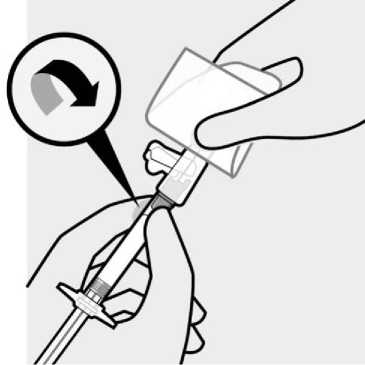
Con la otra mano, sujete la jeringa por la conexión del lúer y acople en ella la aguja de seguridad con un suave giro en el sentido de las agujas del reloj.
No retire el blíster hasta haber encajado perfectamente la jeringa y la aguja.
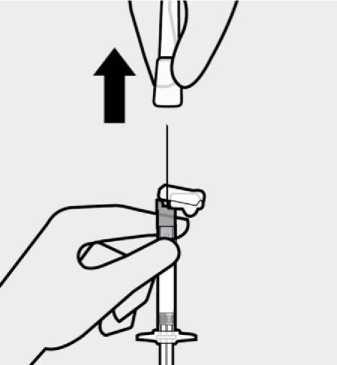
Retire el capuchón de la aguja
Quite el capuchón de la aguja tirando de ella en línea recta.
No gire el capuchón, ya que se podría soltar la aguja de la jeringa.
Elimine las burbujas de aire
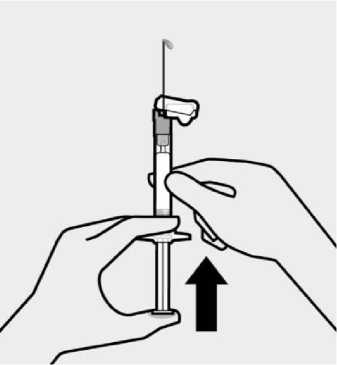
Dé unos pequeños golpecitos a la jeringa, con la punta hacia arriba, para que asciendan las burbujas de aire que pueda haber.
Lenta y cuidadosamente, presione el émbolo hacia arriba para sacar el aire.
3 Inyecte
Inyecte la dosis
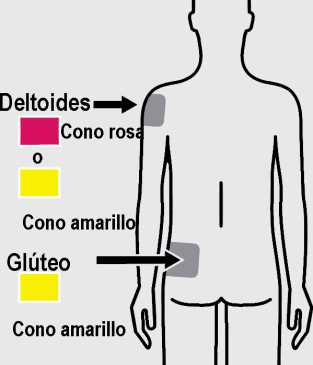
Lentamente inyecte el contenido íntegro de la jeringa intramuscularmente, de forma profunda en el deltoides o el glúteo.
No administrar por ninguna otra vía.
Después de la inyección
Después de la inyección, ayúdese con el pulgar o con una superficie plana para activar el mecanismo de seguridad de la aguja. La aguja estará segura cuando se oiga un “clic".

Deseche la jeringa y la aguja sin usar en un contenedor aprobado para objetos punzantes.
Las agujas de seguridad de pared fina están diseñadas específicamente para la administración de TREVICTA. Deseche la aguja sin usar, no la conserve para un futuro uso.
60