Tilad 2Mg Suspension Para Inhalacion En Envase A Presion
"I
an
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
Tilad 2 mg suspensión para inhalación en envase a presión
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Nedocromil sódico.
Cada envase contiene 1,4085 % p/p de nedocromil sódico en forma de suspensión. Cada inhalación libera 2 mg de nedocromil sódico desde la válvula, lo que suponen 1,9 mg desde el aplicador bucal.
Para consultar la lista completa de excipientes ver sección 6.1.
3. FORMA FARMACÉUTICA
Suspensión para inhalación en envase a presión.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Tilad está indicado para el tratamiento del asma bronquial (ya sea intrínseca ó extrínseca) e incluye bronquitis asmáticas, asma de aparición tardía, asma inducida por ejercicio y broncoespasmo provocado por diversos estímulos como aire frío, alergenos inhalados, contaminantes atmosféricos y otras sustancias irritantes.
Tratamiento concomitante del asma con todos los demás medicamentos utilizados en este proceso. En muchos casos la acción terapéutica de nedocromil sódico hace posible eliminar o reducir dosis de otros medicamentos.
4.2 Posología y forma de administración
Tilad sólo se debe administrar por vía inhalatoria.
- Adultos y niños mayores de 6 años: La posología habitual es de 2 inhalaciones 2 veces al día (8 mg/día) ó 4 veces al día (16 mg en los casos más graves). La dosis debe ajustarse dentro de este intervalo dependiendo de las necesidades del paciente. Como dosis inicial se recomienda la mínima.
- Existe experiencia clínica limitada de la utilización de Tilad en niños de 2 a 6 años. La pauta posológica empleada en este grupo de edad fue la misma que la administrada en adultos y niños mayores de 6 años.
Para la correcta administración del preparado ver apartado 6.6 (Instrucciones de uso y manipulación).
4.3 Contraindicaciones
Hipersensibilidad al nedocromil sódico o a alguno de los excipientes.
ÍTTI
4.4 Advertencias y precauciones especiales de empleo
Tilad 2 mg suspensión para inhalación, libre de gases clorofluorocarbonados (CFC), está indicado para su uso diario y regular. No debe utilizarse como tratamiento sintomático en los ataques agudos de broncoespasmo.
4.5 Interacción con otros medicamentos y otras formas de interacción
Nedocromil sódico ha sido usado en asociación con numerosos medicamentos incluyendo los habituales en el tratamiento de la obstrucción bronquial: agonistas p-adrenérgicos orales o inhalados, corticosteroides orales o inhalados, teofilinas y otras metilxantinas y bromuro de ipratropio. No se han observado incompatibilidades con otros fármacos ni en las personas ni en los animales.
4.6 Fertilidad, embarazo y lactancia Embarazo:
Los estudios en animales gestantes y lactantes no han demostrado un peligro derivado del uso de nedocromil sódico. Sin embargo, como con todos los nuevos medicamentos, se debe tener precaución durante el embarazo (especialmente durante el primer trimestre) y durante la lactancia.
Lactancia:
En base a sus propiedades físico-químicas y en los resultados de los estudios en animales, se considera que solamente pueden pasar cantidades insignificantes de nedocromil sódico a la leche materna. No hay información disponible que sugiera que el uso de nedocromil sódico durante el período de lactancia produzca efectos no deseables en el bebé.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
Tilad 2 mg suspensión para inhalación, libre de gases clorofluorocarbonados (CFC), no produce ningún efecto conocido sobre la capacidad para conducir y utilizar maquinaria.
4.8 Reacciones adversas
Se ha utilizado la siguiente clasificación basada en las frecuencias:
Muy frecuentes (>1/10); frecuentes (>1/100 a <1/10); poco frecuentes (>1/100 a <1/10); raras (>1/10.000 a <1/1.000); muy raras (<1/10.000); frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
En ensayos clínicos llevados a cabo en pacientes tratados con nedocromil sódico administrado por vía inhalatoria, se han notificado las siguientes reacciones adversas con sus frecuencias:
Trastornos gastrointestinales
Muy frecuentes: dolor abdominal, vómitos y náuseas.
Frecuentes: dispepsia.
Trastornos respiratorios, torácicos y mediastínicos
Muy frecuentes: tos, broncoespasmo.
Trastornos del sistema nervioso
ÍTTI
Muy frecuentes: dolor de cabeza.
Frecuentes: disgeusia.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de medicamentos de Uso Humano: https: //www .notificaram.es.
4.9 Sobredosis
Incluso a dosis elevadas, los estudios en animales no han mostrado evidencias de efectos tóxicos significativos con nedocromil sódico. Tampoco los estudios llevados a cabo en humanos con nedocromil sódico, han revelado ningún riesgo de seguridad con este medicamento.
Por tanto, es poco probable que la sobredosis ocasione problemas. Sin embargo, si se sospechase una sobredosificación, el tratamiento debe ser sintomático y dirigido al control de los síntomas relevantes.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
El nedocromil sódico, agente antiasmático y antialérgico que pertenece a la familia de las cromonas, se administra por vía inhalatoria.
Inhibe la liberación o la síntesis de potentes mediadores celulares broncoconstrictores, pro-inflamatorios y quimiotácticos (histamina, prostaglandinas D2, leucotrienos C4 y B4, 5HETE). En el momento de la activación por agentes no específicos o IgE dependientes, el nedocromil sódico modifica las reacciones inflamatorias locales responsables de la hiperactividad bronquial. Además, el nedocromil sódico in vitro inhibe parcialmente la movilización y activación de las poblaciones celulares (eosinófilos, neutrófilos, plaquetas) inducidas por la liberación local de mediadores quimiotácticos.
En los estudios de provocación, la dosis única de nedocromil sódico ofrece protección frente al broncoespasmo provocado por ejercicio, alergenos inhalatorios, aire frío, contaminantes ambientales y otros irritantes. La administración continua de nedocromil sódico reduce la hiperreactividad bronquial que se observa en pacientes con enfermedad obstructiva reversible de la vía aérea.
5.2 Propiedades farmacocinéticas
Absorción:
Tras la inhalación de la dosis única de nedocromil sódico de 4 mg, la máxima concentración plasmática de 2,8 ng/ml se alcanza a los 15 minutos, siendo la fase de eliminación monoexponencial con una semivida media de 91 minutos.
Distribución:
El paso del nedocromil sódico a circulación sistémica es bastante reducido. Por un lado tiene lugar un paso transpulmonar y por otro lado la absorción digestiva de la fracción deglutida (2 a 3% de la dosis administrada).
Biotransformación y eliminación:
El nedocromil no se metaboliza. En tratamiento crónico, en el que se realizan 4 administraciones diarias, las concentraciones plasmáticas máximas alcanzan un nivel mantenido de 2 ng/ml durante 90 minutos, después la concentración disminuye, presentando una vida media de 90 minutos. No se evidencia ningún tipo de efecto acumulativo tras un periodo de doce meses de tratamiento.
5.3 Datos preclínicos sobre seguridad
Los estudios realizados en animales no han demostrado efectos tóxicos del nedocromil sódico tras administrarse incluso a altas dosis.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Povidona K30, polietilenglicol 600, levomentol y 1, 1, 1, 2, 3, 3, 3 heptafluoropropano (HFA).
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
2 años.
6.4 Precauciones especiales de conservación
No conservar a temperatura superior a 30°C. No congelar. No exponerlo directamente al sol. Mantenerlo alejado del calor. No perforar el envase o arrojarlo al fuego aunque esté vacío.
6.5 Naturaleza y contenido del envase
Envase a presión con válvula dosificadora, y un aplicador bucal de plástico con tapón.
El envase es de aluminio y la válvula dosificadora libera 112 inhalaciones, a partir de la primera carga. Cada una de ellas contiene 2 mg de nedocromil sódico desde la válvula, lo que suponen 1,9 mg desde el aplicador bucal.
6.6 Precauciones especiales de eliminación y otras manipulaciones
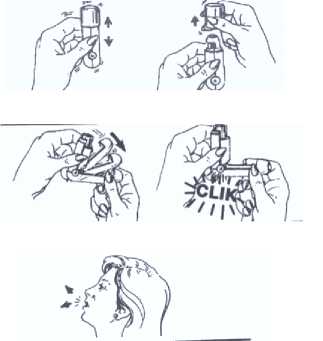
Si utiliza por primera vez el envase tiene que comprobar su funcionamiento, realizando cuatro pulsaciones para asegurarse de que sale el producto. Si no se ha usado durante 2 días ó más, se aconseja hacer 2 pulsaciones antes de su uso.
4 de 6 MINISTERIO DE
SANIDAD, POLITICA SOCIAL E IGUALDAD Agencia espanoiaóe medie amentos y oroouctos san-lanos
1. Agitar y quitar el tapón
2. MUY IMPORTANTE: Abrir completamente el aplicador bucal hasta que se oiga un “CLIK”.
3. Mantenerlo apartado de la boca.
Inclinar la cabeza hacia atrás y expulsar el aire lentamente, pero
no en su totalidad
mo tiempo nhalación.
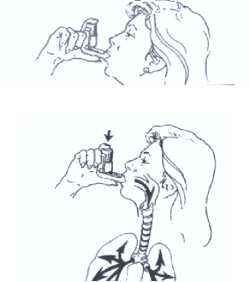
4. Introducir en la boca solamente el extremo y cerrarla
5. Inspirar por la boca, lenta y profundamente, y al mis presionar hacia abajo el envase, para hacer salir una i
Contener la respiración. Retirar el inhalador.
Respirar normalmente y repetir otra vez.
Si el producto se escapa en forma de nube por la abertura, normalmente se debe a:
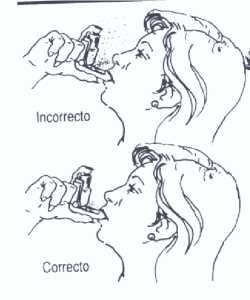
1. Que se presiona el envase metálico antes de que haya comenzado a inspirar.
2. Que se presiona el envase metálico después de que haya terminado de inspirar.
3. Por no inspirar con la suficiente profundidad.
Si esto ocurre, repita la operación siguiendo las instrucciones.
Utilización con cámara de inhalación
En el caso de que el paciente necesite utilizar una cámara de inhalación que le permita mantener el medicamento liberado hasta que sea inhalado, debe hacer lo siguiente:
1. Sacar el envase metálico de Tilad del aplicador bucal e introducirlo en el aplicador bucal que aparece en el envase de la cámara de inhalación.
2. Introducir el aplicador bucal en el extremo opuesto a la boquilla de la cámara de inhalación.
3. Utilizar la cámara de inhalación de acuerdo a las correspondientes instrucciones.
Instrucciones de limpieza.
Es muy importante mantener el inhalador limpio y seco desde el momento en que se comience a utilizar.
De esta manera se evita la acumulación de polvo en la pieza de plástico amarilla, que con el paso del tiempo puede ser difícil de eliminar y causaría el bloqueo del inhalador.
Deberá lavarse todas las noches según las siguientes instrucciones:

SANIDAD, POLIT1C A SOCIAL E IGUALDAD Agencia espanosa de medicamentos y proouctos saltaros
2l2
íth
1. Quitar el tapón azul y sacar el envase metálico. No introducir el envase metálico en agua.
2. Lavar la pieza amarilla de plástico en profundidad, con agua caliente, y en ambos sentidos, durante al menos un minuto, incluso si no se observa acumulación de
5 de 6
"I
an
polvo en la misma.
3. Sacudir la pieza de plástico amarilla para eliminar el exceso de agua, especialmente donde se inserta la boquilla del envase metálico. Dejar secar las piezas de plástico en un lugar cálido, durante toda la noche.
4. Asegurarse de que la pieza de plástico amarilla está completamente seca antes de volver a colocar el envase metálico o el tapón azul.
5. Si el inhalador se bloquea, sumergir la pieza de plástico amarilla en agua caliente, durante 20 minutos, antes de lavarla debajo del grifo con agua caliente, en ambos sentidos (como indica el paso 2). No intentar desbloquear el inhalador con un alfiler, ya que se dañaría.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él,
se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Sanofi-aventis, S.A.
C/ Josep Pla, 2 08019 -Barcelona
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
N° de Registro: 58.605
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Fechas de la primera autorización: Septiembre 1990
10. FECHA DE LA REVISIÓN DEL TEXTO
Febrero 2012
6 de 6