Temodal 100 Mg Capsulas Duras
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
1. NOMBRE DEL MEDICAMENTO
Temodal 5 mg cápsulas duras
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada cápsula dura contiene 5 mg de temozolomida (temozolomide).
Excipiente con efecto conocido:
Cada cápsula dura contiene 132,8 mg de lactosa anhidra.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Cápsula dura (cápsula).
Las cápsulas duras tienen un cuerpo blanco opaco, una tapa verde opaca, y están impresas con tinta negra. La tapa lleva impreso “Temodal”. El cuerpo lleva impreso “5 mg”, el logo de Schering-Plough y dos rayas.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Temodal está indicado en el tratamiento de:
- pacientes adultos con glioblastoma multiforme de nuevo diagnóstico concomitante con radioterapia (RT) y posteriormente como tratamiento en monoterapia.
- niños a partir de tres años de edad, adolescentes y pacientes adultos con glioma maligno, tal como glioblastoma multiforme o astrocitoma anaplásico, que presentan recurrencia o progresión después de terapia estándar.
4.2 Posología y forma de administración
Temodal sólo debe ser prescrito por médicos con experiencia en el tratamiento oncológico de tumores cerebrales.
Puede administrarse terapia antiemética (ver sección 4.4).
Posología
Pacientes adultos con glioblastoma multiforme de nuevo diagnóstico
Temodal se administra en combinación con radioterapia focal (fase concomitante) seguido de hasta 6 ciclos de monoterapia con temozolomida (TMZ) (fase de monoterapia).
Fase concomitante
Se administra TMZ a una dosis de 75 mg/m2 al día por vía oral durante 42 días como tratamiento concomitante a la radioterapia focal (60 Gy administrados en 30 fracciones). No se recomiendan reducciones de dosis, pero se decidirá semanalmente el retraso o la suspensión de la administración de TMZ de acuerdo a los criterios de toxicidad hematológica y no hematológica. La administración de TMZ se puede continuar durante todo el periodo concomitante de 42 días (hasta 49 días) si se cumplen todas y cada una de las siguientes condiciones:
- recuento absoluto de neutrófilos (RAN) > 1,5 x 109/l
- recuento de trombocitos > 100 x 109/l
- toxicidad no hematológica según los criterios de toxicidad común (CTC) < Grado 1 (excepto para alopecia, náuseas y vómitos).
Durante el tratamiento se deberá realizar semanalmente un hemograma completo. La administración de TMZ se deberá interrumpir o suspender permanentemente durante la fase concomitante de acuerdo a los criterios de toxicidad hematológica y no hematológica según la Tabla 1.
|
Tabla 1. Interrupción o suspensión de la dosificación con TMZ durante el tratamiento concomitante de radioterapia y TMZ | ||
|
Toxicidad |
Interrupción de TMZa |
Suspensión de TMZ |
|
Recuento Absoluto de Neutrófilos |
> 0,5 y < 1,5 x 109/l |
< 0,5 x 109/l |
|
Recuento de Trombocitos |
> 10 y < 100 x 109/l |
< 10 x 109/l |
|
Toxicidad no hematológica según CTC (excepto para alopecia, náuseas y vómitos) |
Grado 2 según CTC |
Grado 3 ó 4 según CTC |
a: El tratamiento con TMZ concomitante se puede continuar si se cumplen todas y cada una de las siguientes condiciones: recuento absoluto de neutrófilos > 1,5 x 109/l, recuento de trombocitos > 100 x 109/l, toxicidad no hematológica según CTC < Grado 1 (excepto para alopecia, náuseas y vómitos).
Fase de monoterapia
Cuatro semanas después de completar la fase concomitante de TMZ + RT, se administran hasta 6 ciclos de TMZ en monoterapia. La dosis en el Ciclo 1 (monoterapia) es de 150 mg/m2 una vez al día, durante 5 días, seguido de 23 días sin tratamiento. Al principio del Ciclo 2, la dosis se aumenta a 200 mg/m2 si la toxicidad no hematológica según CTC en el Ciclo 1 es de Grado < 2 (excepto para alopecia, náuseas y vómitos), el recuento absoluto de neutrófilos (RAN) es > 1,5 x 109/l y el recuento de trombocitos > 100 x 109/l. Si la dosis no se aumentó en el Ciclo 2, no se deberá aumentar la dosis en los ciclos posteriores. Si se aumentó la dosis, se mantiene a 200 mg/m2 al día durante los primeros 5 días de cada ciclo posterior, excepto si se produce toxicidad. Las reducciones y suspensiones de dosis durante la fase de monoterapia se deberán realizar de acuerdo a las Tablas 2 y 3.
Durante el tratamiento se deberá realizar un hemograma completo en el Día 22 (21 días después de la primera dosis de TMZ). La dosis se reducirá o se suspenderá la administración de acuerdo a la Tabla 3.
|
Tabla 2. Niveles de dosis de TMZ para el tratamiento en monoterapia | ||
|
Nivel de dosis |
Dosis de TMZ (mg/m2/día) |
Observaciones |
|
-1 |
100 |
Reducción por toxicidad previa |
|
0 |
150 |
Dosis durante el Ciclo 1 |
|
1 |
200 |
Dosis durante los Ciclos 2-6 en ausencia de toxicidad |
|
Tabla 3. Reducción o suspensión de la dosis de TMZ durante el tratamiento en monoterapia | ||
|
Toxicidad |
Reducir TMZ 1 nivel de dosisa |
Suspender TMZ |
|
Recuento absoluto de neutrófilos |
< 1,0 x 109/l |
Ver nota b |
|
Recuento de trombocitos |
< 50 x 109/l |
Ver nota b |
|
Toxicidad no hematológica según CTC (excepto para alopecia, náuseas y vómitos) |
Grado 3 según CTC |
Grado 4b según CTC |
a: Los niveles de dosis de TMZ aparecen en la Tabla 2. b: Se suspende TMZ si:
• El nivel de dosis -1 (100 mg/m2) todavía provoca toxicidad inaceptable
• La misma toxicidad no hematológica de Grado 3 (excepto para alopecia, náuseas, vómitos) vuelve a aparecer tras la reducción de dosis.
Pacientes adultos y _pediátricos de 3 años de edad o mayores con glioma maligno recurrente o progresivo:
Un ciclo de tratamiento es de 28 días. En pacientes no tratados previamente con quimioterapia, TMZ se administra por vía oral a la dosis de 200 mg/m2 una vez al día durante los primeros 5 días seguido de una interrupción del tratamiento de 23 días (un total de 28 días). En los pacientes tratados previamente con quimioterapia, la dosis inicial es de 150 mg/m2 una vez al día, que debe incrementarse en el segundo ciclo a 200 mg/m2 una vez al día, durante 5 días si no apareciera toxicidad hematológica (ver sección 4.4).
Poblaciones especiales
Población pediátrica
En pacientes de edad igual o superior a 3 años, sólo debe usarse TMZ en glioma maligno recurrente o progresivo. La experiencia en estos niños es muy limitada (ver secciones 4.4 y 5.1). No se ha establecido la seguridad y la eficacia de TMZ en niños menores de 3 años. No se dispone de datos.
Pacientes con disfunción hepática o renal
La farmacocinética de la TMZ fue comparable en pacientes con función hepática normal y en aquellos con disfunción hepática leve o moderada. No hay datos disponibles sobre la administración de TMZ a pacientes con disfunción hepática grave (Clase C de Child) o con disfunción renal. En base a las propiedades farmacocinéticas de la TMZ, es improbable que se requieran reducciones de dosis en pacientes con disfunción hepática grave o cualquier grado de disfunción renal. Sin embargo, se debe tener precaución al administrar TMZ a estos pacientes.
Pacientes de edad avanzada
En base al análisis farmacocinético en pacientes de 19-78 años de edad, el aclaramiento de TMZ no se ve afectado por la edad. Sin embargo, los pacientes de edad avanzada (> 70 años de edad) parecen tener un aumento en el riesgo de neutropenia y trombocitopenia (ver sección 4.4).
Forma de administración
Temodal cápsulas duras debe administrarse en estado de ayuno.
Las cápsulas deben tragarse enteras con un vaso de agua y no deben abrirse o masticarse.
Si después de la administración de la dosis se produce vómito, no debe administrarse una segunda dosis ese día.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a algunos de los excipientes incluidos en la sección 6.1. Hipersensibilidad a la dacarbazina (DTIC).
Mielosupresión severa (ver sección 4.4).
4.4 Advertencias y precauciones especiales de empleo
Infecciones oportunistas y reactivación de infecciones
Durante el tratamiento con TMZ, se han observado infecciones oportunistas (como neumonía por Pneumocystis jirovecii) y reactivación de infecciones (como VHB, CMV) (ver sección 4.8).
Los pacientes que recibieron concomitantemente TMZ y RT en un ensayo piloto durante el régimen prolongado de 42 días presentaron un especial riesgo de desarrollar neumonía por Pneumocystis jirovecii (PCP). Por lo tanto, se requiere profilaxis frente a PCP en todos los pacientes que reciban concomitantemente TMZ y RT durante el régimen de 42 días (hasta un máximo de 49 días) con independencia del recuento de linfocitos. Si se produce linfopenia, deben continuar con la profilaxis hasta que la recuperación de la linfopenia sea de un grado < 1.
Puede haber una mayor incidencia de PCP cuando se administra TMZ durante un régimen de dosificación más largo. No obstante, todos los pacientes que reciban TMZ, en especial los pacientes que reciban esteroides, deberán ser vigilados estrechamente en cuanto al desarrollo de PCP con independencia del régimen. Se han notificado casos de insuficiencia respiratoria mortal en pacientes en tratamiento con TMZ, en particular en combinación con dexametasona u otros esteroides.
VHB
Se ha notificado hepatitis debida a una reactivación del virus de la hepatitis B (VHB), resultando en algunos casos mortal. Se debe consultar a los expertos en enfermedades hepáticas antes de iniciar el tratamiento en pacientes con serología para la hepatitis B positiva (incluyendo aquellos pacientes con la enfermedad activa). Durante el tratamiento, los pacientes deben ser controlados y tratados como corresponda.
Hepatotoxicidad
Se han notificado lesiones hepáticas incluyendo insuficiencia hepática mortal en pacientes tratados con TMZ (ver sección 4.8). Se deben determinar los valores basales de la función hepática antes de iniciar el tratamiento. Si fueran anómalos, el médico debe evaluar el beneficio/riesgo antes de iniciar el tratamiento con temozolamida, incluyendo el riesgo potencial de insuficiencia hepática mortal. En pacientes en un ciclo de tratamiento de 42 días, las pruebas se deben repetir en mitad del ciclo. En todos los pacientes, las pruebas de la función hepática se deben repetir después de cada ciclo de tratamiento. El médico debe evaluar el beneficio/riesgo de continuar el tratamiento en pacientes con anomalías significativas de la función hepática. La toxicidad hepática puede aparecer varias semanas o más, después del último tratamiento con temozolomida.
Neoplasias malignas
También se han observado casos muy raros de síndrome mielodisplásico y neoplasias secundarias, incluyendo leucemia mieloide (ver sección 4.8).
Terapia antiemética
Las náuseas y los vómitos se asocian muy frecuentemente con TMZ.
Se puede administrar la terapia antiemética antes o después de la administración de TMZ.
Pacientes adultos con glioblastoma multiforme de nuevo diagnóstico
Se recomienda profilaxis antiemética antes de la dosis inicial de la fase concomitante, y se recomienda encarecidamente durante la fase de monoterapia.
Pacientes con glioma maligno recurrente o progresivo
Los pacientes que hayan experimentado fuertes vómitos (Grado 3 ó 4) en ciclos de tratamiento previos pueden precisar tratamiento antiemético.
Parámetros de laboratorio
Los pacientes en tratamiento con TMZ pueden presentar mielosupresión, incluyendo pancitopenia prolongada, que puede derivar en anemia aplásica que, en ciertos casos, puede terminar en fallecimiento. En algunos casos, la exposición a medicamentos concomitantes asociados a la anemia aplásica, tales como carbamazepina, fenitoína y sulfametoxazol/trimetoprima complica la valoración. Antes de la administración, deberán cumplirse los siguientes parámetros de laboratorio: RAN > 1,5 x 109/1 y recuento de plaquetas > 100 x 109/l. Deberá practicarse un hemograma completo el Día 22 (21 días después de la primera dosis) o dentro de las 48 horas de dicho día, y una vez a la semana hasta que el RAN sea > 1,5 x 109/l y el recuento de plaquetas sea > 100 x 109/l. Si el RAN disminuyera a < 1,0 x 109/l o el recuento de plaquetas fuera < 50 x 109/l durante cualquier ciclo, se disminuirá un nivel de dosis en el siguiente ciclo (ver sección 4.2). Los niveles de dosis son de 100 mg/m2, 150 mg/m2 y 200 mg/m2. La dosis más baja recomendada es de 100 mg/m2.
Población pediátrica
No hay experiencia clínica sobre el empleo de TMZ en niños menores de 3 años de edad. La experiencia en niños mayores y adolescentes es muy limitada (ver sección 4.2 y 5.1).
Pacientes de edad avanzada (> 70 años de edad)
Los pacientes de edad avanzada parecen presentar un mayor riesgo de neutropenia y trombocitopenia que los pacientes más jóvenes. Por lo tanto, se debe tener precaución especial cuando se administre TMZ a pacientes de edad avanzada.
Pacientes varones
Debe advertirse a los hombres que vayan a ser tratados con TMZ que eviten dejar embarazada a su pareja durante los 6 meses posteriores al tratamiento y que busquen asesoramiento sobre crioconservación del esperma antes del tratamiento (ver sección 4.6).
Lactosa
Este medicamento contiene lactosa. Los pacientes con intolerancia hereditaria a galactosa, insuficiencia de lactasa de Lapp o malabsorción de glucosa o galactosa no deben tomar este medicamento.
4.5 Interacción con otros medicamentos y otras formas de interacción
En otro estudio en fase I, la administración de TMZ con ranitidina no provocó modificaciones del grado de absorción de la temozolomida o de la exposición a su metabolito activo monometil triazenoimidazol carboxamida (MTIC).
La administración de TMZ con los alimentos resultó en una disminución del 33 % de la Cmax y en una disminución del 9 % del área bajo la curva (AUC).
Como no se puede excluir que el cambio en la Cmax sea clínicamente importante, Temodal no debe administrarse junto a alimentos.
En base a un análisis de la farmacocinética de población observado en ensayos en fase II, la coadministración de dexametasona, proclorperazina, fenitoína, carbamazepina, ondansetrón, antagonistas de los receptores H2 o fenobarbital no modificó la eliminación de la TMZ. Se asoció la coadministración de ácido valproico con una pequeña pero estadísticamente significativa disminución del aclaramiento de TMZ.
No se han llevado a cabo estudios para determinar el efecto de TMZ sobre el metabolismo o eliminación de otros fármacos. No obstante, dado que TMZ no experimenta metabolismo hepático y muestra una baja unión a proteínas, es improbable que afecte a la farmacocinética de otros medicamentos (ver sección 5.2).
El empleo de TMZ en combinación con otros agentes mielosupresores puede aumentar la probabilidad de mielosupresión.
Población pediátrica
Los estudios de interacciones se han realizado sólo en adultos.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No hay datos en mujeres embarazadas. En los estudios preclínicos en ratas y conejos tratados con 150 mg/m2 de TMZ se observó teratogenia y/o toxicidad fetal (ver sección 5.3).
Temodal no debe administrarse a mujeres embarazadas. Si se debe considerar su uso durante el embarazo, la paciente debe ser informada del riesgo potencial para el feto.
Lactancia
Se desconoce si TMZ se excreta en la leche materna; por tanto, se debe interrumpir la lactancia durante el tratamiento con TMZ.
Mujeres en edad fértil
Se debe aconsejar a las mujeres en edad fértil el uso de un método anticonceptivo eficaz para evitar el embarazo mientras estén en tratamiento con TMZ.
Fertilidad masculina
TMZ puede tener efectos genotóxicos. Por lo tanto, se advierte a los hombres que vayan a ser tratados con ella que eviten dejar embarazada a su pareja hasta que hayan transcurrido 6 meses desde la última dosis y que busquen asesoramiento sobre crioconservación del esperma antes del tratamiento dada la posibilidad de infertilidad irreversible debido a la terapia con TMZ.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
TMZ tiene una influencia baja sobre la capacidad para conducir y utilizar máquinas debido a la fatiga y somnolencia (ver sección 4.8).
4.8 Reacciones adversas
Experiencia de ensayos clínicos
En pacientes tratados con TMZ, ya sea en combinación con RT o como monoterapia tras RT para glioblastoma multiforme de nuevo diagnóstico o como monoterapia en pacientes con glioma recurrente o progresivo, las reacciones adversas muy frecuentes notificadas fueron similares: náuseas, vómitos, estreñimiento, anorexia, cefalea y fatiga. Se notificaron de manera muy frecuente convulsiones en pacientes con glioblastoma multiforme de nuevo diagnóstico que recibieron monoterapia, y se notificó sarpullido muy frecuentemente en pacientes con glioblastoma multiforme de nuevo diagnóstico que recibieron TMZ en combinación con RT y también en monoterapia, y se notificó frecuentemente en glioma recurrente. La mayoría de las alteraciones de parámetros hematológicos se notificaron, según lo esperado, como frecuentes o muy frecuentes en ambas indicaciones (Tablas 4 y 5); después de cada tabla se recogen las frecuencias relativas a los parámetros de laboratorio de grados 3 y 4.
En las tablas, los efectos adversos se clasifican según la clasificación por órganos y sistemas y la frecuencia. Los grupos de frecuencia se definen según la siguiente convención: Muy frecuentes (> 1/10); Frecuentes (> 1/100 a < 1/10); Poco frecuentes (> 1/1.000 a < 1/100); Raras (> 1/10.000 a < 1/1.000); Muy raras (< 1/10.000). Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
Glioblastoma multiforme de nuevo diagnóstico
La Tabla 4 incluye reacciones adversas derivadas del tratamiento en pacientes con glioblastoma multiforme de nuevo diagnóstico durante las fases de tratamiento concomitante y en monoterapia.
|
Tabla 4. Acontecimientos derivados del tratamiento durante las fases de tratamiento concomitante y en monoterapia en pacientes con glioblastoma multiforme de nuevo diagnóstico | ||
|
Clasificación por órganos y sistemas |
TMZ + radioterapia concomitante n=288* |
TMZ en monoterapia n=224 |
|
Infecciones e infestaciones | ||
|
Frecuentes: |
Infección, herpes simple, infección de una herida, faringitis, candidiasis oral |
Infección, candidiasis oral |
|
Poco frecuentes: |
Herpes simple, herpes zoster, síntomas pseudogripales | |
|
Trastornos de la sangre y del sistema linfático | ||
|
Frecuentes: |
Neutropenia, trombocitopenia, linfopenia, leucopenia |
Neutropenia febril, trombocitopenia, anemia, leucopenia |
|
Poco frecuentes: |
Neutropenia febril, anemia |
Linfopenia, petequia |
|
Trastornos endocrinos | ||
|
Poco frecuentes: |
Cushingoide |
Cushingoide |
|
Trastornos del metabolismo y de la nutrición | ||
|
Muy frecuentes: |
Anorexia |
Anorexia |
|
Frecuentes: |
Hiperglucemia, pérdida de peso |
Pérdida de peso |
|
Poco frecuentes: |
Hipopotasemia, aumento de la fosfatasa alcalina, aumento de peso |
Hiperglucemia, aumento de peso |
|
Trastornos psiquiátricos | ||
|
Frecuentes: |
Ansiedad, labilidad emocional, insomnio |
Ansiedad, depresión, labilidad emocional, insomnio |
|
Poco frecuentes: |
Agitación, apatía, alteración del comportamiento, depresión, alucinaciones |
Alucinaciones, amnesia |
|
Trastornos del sistema nervioso | ||
|
Muy frecuentes: |
Cefalea |
Convulsiones, cefalea |
|
Frecuentes: |
Convulsiones, pérdida de conocimiento, somnolencia, afasia, alteración del equilibrio, mareo, confusión, pérdida de memoria, disminución de la concentración, neuropatía, parestesia, trastorno en el habla, temblor |
Hemiparesia, afasia, alteración del equilibrio, somnolencia, confusión, mareo, pérdida de memoria, disminución de la concentración, disfasia, trastorno neurológico (NOS), neuropatía, neuropatía periférica, parestesia, trastorno en el habla, temblor |
|
Poco frecuentes: |
Status epilepticus, trastorno extrapiramidal, hemiparesia, ataxia, trastorno cognitivo, disfasia, trastorno de la marcha, hiperestesia, hipoestesia, trastorno neurológico (NOS), neuropatía periférica |
Hemiplejía, ataxia, alteración en la coordinación, trastorno de la marcha, hiperestesia, trastorno sensorial |
|
Trastornos oculares | ||
|
Frecuentes: |
Visión borrosa |
Defecto en el campo visual, visión borrosa, diplopía |
|
Poco frecuentes: |
Hemianopsia, disminución de la agudeza visual, trastorno en la visión, defecto en el campo visual, dolor ocular |
Disminución de la agudeza visual, dolor ocular, sequedad ocular |
|
Trastornos del oído y del laberinto | ||
|
Frecuentes: |
Trastorno en la audición |
Trastorno en la audición, tinnitus |
|
Poco frecuentes: |
Otitis media, tinnitus, hiperacusia, otalgia |
Sordera, vértigo, otalgia |
|
Trastornos cardiacos | ||
|
Poco frecuentes: |
Palpitaciones | |
|
Trastornos vasculares | ||
|
Frecuentes: |
Hemorragia, edema, edema de piernas |
Hemorragia, trombosis venosa profunda, edema de piernas |
|
Poco frecuentes: |
Hemorragia cerebral, hipertensión |
Embolismo pulmonar, edema, edema periférico |
|
Trastornos respiratorios, torácicos y mediastínicos | ||
|
Frecuentes: |
Disnea, tos |
Disnea, tos |
|
Poco frecuentes: |
Neumonía, infección respiratoria superior, congestión nasal |
Neumonía, sinusitis, infección respiratoria superior, bronquitis |
|
Trastornos gastrointestinales | ||
|
Muy frecuentes: |
Estreñimiento, náuseas, vómitos |
Estreñimiento, náuseas, vómitos |
|
Frecuentes: |
Estomatitis, diarrea, dolor abdominal, dispepsia, disfagia |
Estomatitis, diarrea, dispepsia, disfagia, sequedad de boca |
|
Poco frecuentes: |
Distensión abdominal, incontinencia fecal, trastorno gastrointestinal (NOS), gastroenteritis, hemorroides | |
|
Trastornos de la piel y del tejido subcutáneo | ||
|
Muy frecuentes: |
Sarpullido, alopecia |
Sarpullido, alopecia |
|
Frecuentes: |
Dermatitis, sequedad cutánea, eritema, prurito |
Sequedad cutánea, prurito |
|
Poco frecuentes: |
Exfoliación cutánea, reacción de fotosensibilidad, alteración en la pigmentación |
Eritema, alteración en la pigmentación, aumento de la sudoración |
|
Trastornos musculoesqueléticos y del tejido conjuntivo | ||
|
Frecuentes: |
Debilidad muscular, artralgia |
Debilidad muscular, artralgia, dolor musculoesquelético, mialgia |
|
Poco frecuentes: |
Miopatía, dolor de espalda, dolor musculoesquelético, mialgia |
Miopatía, dolor de espalda |
|
Trastornos renales y urinarios | ||
|
Frecuentes: |
Polaquiuria, incontinencia urinaria |
Incontinencia urinaria |
|
Poco frecuentes: |
Disuria | |
|
Trastornos del aparato reproductor y de la mama | ||
|
Poco frecuentes: |
Impotencia |
Hemorragia vaginal, menorragia, amenorrea, vaginitis, dolor de mama |
|
Trastornos generales y alteraciones en el lugar de administración | ||
|
Muy frecuentes: |
Fatiga |
Fatiga |
|
Frecuentes: |
Reacción alérgica, fiebre, lesión por radiación, edema facial, dolor, alteración del gusto |
Reacción alérgica, fiebre, lesión por radiación, dolor, alteración del gusto |
|
Poco frecuentes: |
Astenia, rubor, sofocos, empeoramiento de una enfermedad, escalofríos, cambio de color de la lengua, parosmia, sed |
Astenia, edema facial, dolor, empeoramiento de una enfermedad, escalofríos, trastorno dental |
|
Exploraciones complementarias | ||
|
Frecuentes: |
Aumento de ALT |
Aumento de ALT |
|
Poco frecuentes: |
Aumento de enzimas hepáticas, aumento de Gamma GT, aumento de AST | |
*Un paciente que se aleatorizó al brazo de RT únicamente, recibió TMZ + RT.
Resultados de laboratorio
Se observó mielosupresión (neutropenia y trombocitopenia), que es toxicidad limitante de dosis conocida para la mayoría de los agentes citotóxicos, incluido TMZ. Cuando las alteraciones en las pruebas de laboratorio y las reacciones adversas se sumaron entre las fases de tratamiento concomitante y en monoterapia, se observaron alteraciones en neutrófilos de Grado 3 o de Grado 4, incluyendo acontecimientos neutropénicos, en el 8 % de los pacientes. Se observaron alteraciones en los trombocitos de Grado 3 o Grado 4, incluyendo acontecimientos trombocitopénicos en el 14 % de los pacientes que recibieron TMZ.
Glioma maligno recurrente o progresivo
En los ensayos clínicos, las reacciones adversas que se produjeron más frecuentemente relacionadas con el tratamiento fueron los trastornos gastrointestinales, concretamente náuseas (43 %) y vómitos (36 %). Estas reacciones fueron normalmente de Grado 1 ó 2 (0-5 episodios de vómitos en 24 horas) y se autolimitaron o controlaron rápidamente con tratamiento antiemético estándar. La incidencia de náuseas y vómitos intensos fue del 4 %.
La Tabla 5 incluye reacciones adversas notificadas durante ensayos clínicos en glioma maligno recurrente o progresivo y después de la comercialización de Temodal.
_Tabla 5. Reacciones adversas en pacientes con glioma maligno recurrente o progresivo
Infecciones e infestaciones
Raras:
Infecciones oportunistas, incluyendo PCP
|
Trastornos de la sangre y del sistema linfático | |
|
Muy frecuentes: |
Neutropenia o linfopenia (grado 3-4), trombocitopenia (grado 3-4) |
|
Poco frecuentes: |
Pancitopenia, anemia (grado 3-4), leucopenia |
|
Trastornos del metabolismo y de la nutrición | |
|
Muy frecuentes: |
Anorexia |
|
Frecuentes: |
Pérdida de peso |
|
Trastornos del sistema nervioso | |
|
Muy frecuentes: |
Cefalea |
|
Frecuentes: |
Somnolencia, mareo, parestesia |
|
Trastornos respiratorios, torácicos y mediastínicos | |
|
Frecuentes: |
Disnea |
|
Trastornos gastrointestinales | |
|
Muy frecuentes: |
Vómitos, náuseas, estreñimiento |
|
Frecuentes: |
Diarrea, dolor abdominal, dispepsia |
|
Trastornos de la piel y del tejido subcutáneo | |
|
Frecuentes: |
Sarpullido, prurito, alopecia |
|
Muy raros: |
Eritema multiforme, eritrodermia, urticaria, exantema |
|
Trastornos generales y alteraciones en el lugar de administración | |
|
Muy frecuentes: |
Fatiga |
|
Frecuentes: |
Fiebre, astenia, escalofríos, malestar general, dolor, alteraciones en el gusto |
|
Muy raras: |
Reacciones alérgicas, incluyendo anafilaxia, angioedema |
Resultados de laboratorio
Se produjeron trombocitopenia y neutropenia de Grados 3 ó 4 en el 19 % y 17 %, respectivamente, de los pacientes tratados por glioma maligno. Esto provocó la hospitalización y/o interrupción del tratamiento con TMZ en el 8 % y 4 %, respectivamente. La mielosupresión fue previsible (normalmente dentro de los primeros ciclos, con el valor más bajo de parámetros hematológicos (nadir) entre el Día 21 y el Día 28), y la recuperación fue rápida, generalmente en 1-2 semanas. No se observó evidencia de una mielosupresión de tipo acumulativo. La presencia de trombocitopenia puede incrementar el riesgo de hemorragia, y la presencia de neutropenia o leucopenia puede incrementar el riesgo de infección.
Género
En un análisis de farmacocinética basada en la población sobre la experiencia en ensayos clínicos se disponía de los datos del nadir de los recuentos de neutrófilos para 101 mujeres y 169 hombres, y del nadir de plaquetas para 110 mujeres y 174 hombres. En el primer ciclo de terapia hubo tasas más altas de neutropenia de Grado 4 (RAN < 0,5 x 109/l), 12 % frente al 5 %, y trombocitopenia (< 20 x 109/l),
9 % frente al 3 %, en mujeres que en hombres. En una serie de datos de 400 pacientes con glioma recurrente, tras el primer ciclo de terapia, se produjo neutropenia de Grado 4 en el 8 % de las mujeres frente al 4 % de los hombres, y trombocitopenia de Grado 4 en el 8 % de las mujeres frente al 3 % de los hombres. En un ensayo con 288 pacientes con glioblastoma multiforme de nuevo diagnóstico, se produjo, en el primer ciclo de terapia, neutropenia de Grado 4 en el 3 % de las mujeres frente al 0 % de los hombres, y trombocitopenia de Grado 4 en el 1 % de las mujeres frente al 0 % de los hombres.
Población pediátrica
Se ha estudiado TMZ por vía oral en pacientes pediátricos (edad 3-18 años) con glioma recurrente del tronco encefálico o astrocitoma de alto grado recurrente, en un régimen de administración diaria durante 5 días cada 28 días. Aunque los datos son limitados, cabe esperar que la tolerancia en niños sea similar a la de los adultos. No se ha determinado la seguridad de TMZ en niños menores de 3 años.
Experiencia postcomercialización
Se han identificado las siguientes reacciones adversas graves durante la exposición postcomercialización:
|
Tabla 6. Resumen de los acontecimientos notificados con temozolomida en la postcomercialización | |
|
Infecciones e infestaciones* | |
|
Poco frecuentes: |
infección por citomegalovirus, reactivación de la infección de tipo citomegalovirus, virus de hepatitis B1 |
|
Trastornos de la sangre y del sistema linfático | |
|
Muy raras: |
pancitopenia prolongada, anemia aplásica1 |
|
Neoplasias benignas, malignas y no especificadas | |
|
Muy raras: |
síndrome mielodisplásico, tumores malignos secundarios, incluyendo leucemia mieloide |
|
Trastornos endocrinos* | |
|
Poco frecuentes: |
diabetes insípida |
|
Trastornos respiratorios, torácicos y mediastínicos | |
|
Muy raras: |
neumonitis intersticial/neumonitis, fibrosis pulmonar, insuficiencia respiratoria1 |
|
Trastornos hepatobiliares* | |
|
Frecuentes: |
enzimas hepáticas aumentadas |
|
Poco frecuentes: |
hiperbilirrubinemia, colestasis, hepatitis, lesión hepática, insuficiencia hepática1 |
|
Trastornos de la piel y del tejido subcutáneo | |
|
Muy raras: |
necrolisis epidérmica tóxica, syndrome de Stevens-Johnson |
1 Incluyendo casos con desenlace mortal Frecuencias estimadas a partir de los ensayos clínicos pertinentes.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Anexo V.
4.9 Sobredosis
Se han evaluado clínicamente en pacientes dosis de 500, 750, 1.000 y 1.250 mg/m2 (dosis total por ciclo de 5 días). La toxicidad limitante de dosis fue hematológica y se notificó con todas las dosis, pero se espera que sea más grave a dosis más altas. Un paciente recibió una sobredosis de 10.000 mg (dosis total por ciclo de 5 días) y las reacciones adversas que se notificaron fueron pancitopenia, pirexia, fracaso multiorgánico y muerte. Se han notificado casos de pacientes que han tomado la dosis recomendada durante más de 5 días de tratamiento (hasta 64 días) notificándose reacciones adversas como supresión de médula ósea, con o sin infección, en algunos casos grave y prolongada, con resultado de muerte. En caso de sobredosis, es necesaria una evaluación hematológica. Se deben tomar medidas generales de soporte si fuera necesario.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Agentes antineoplásicos - Otros agentes alquilantes, código ATC: L01A X03.
Mecanismo de acción
La temozolomida es un triazeno, que a pH fisiológico sufre una rápida conversión química a la monometil tiazenoimidazol carboxamida activa (MTIC). Se considera que la citotoxicidad del MTIC es consecuencia, fundamentalmente, de una alquilación en la posición O6 de la guanina, con una alquilación adicional que se produce en la posición N7. Se considera que las lesiones citotóxicas que se desarrollan posteriormente conllevan una reparación aberrante del metilo añadido.
Eficacia clínica y seguridad
Glioblastoma multiforme de nuevo diagnóstico
Se aleatorizaron un total de 573 pacientes para recibir o TMZ + RT (n=287) o RT sola (n=286). Los pacientes del brazo de TMZ + RT recibieron TMZ concomitante (75 mg/m2) una vez al día, empezando el primer día de RT hasta el último día de RT, durante 42 días (hasta un máximo de 49 días). Este tratamiento iba seguido de TMZ en monoterapia (150 - 200 mg/m2) en los Días 1 - 5 de cada ciclo de 28 días, hasta 6 ciclos, empezando 4 semanas después de la finalización de la RT. Los pacientes del brazo control sólo recibieron RT. Se necesitó profilaxis frente a neumonía por Pneumocystis jirovecii (PCP) durante la RT y la terapia combinada con TMZ.
En la fase de seguimiento se administró TMZ como terapia de rescate en 161 pacientes de los 282 (57 %) del brazo de RT sola, y en 62 pacientes de los 277 (22 %) del brazo de TMZ + RT.
El hazard ratio (HR) para la supervivencia global fue de 1,59 (95 % IC para HR=1,33 -1,91) con un rango logarítmico de p < 0,0001 a favor del brazo de TMZ. La probabilidad estimada de sobrevivir 2 o más años (26 % frente a 10 %) es mayor para el brazo de RT + TMZ. La adición de TMZ concomitante a la RT, seguida de TMZ en monoterapia en el tratamiento de pacientes con glioblastoma multiforme de nuevo diagnóstico, demostró una mejoría en la supervivencia global (SG) estadísticamente significativa en comparación con la RT sola (Figura 1).
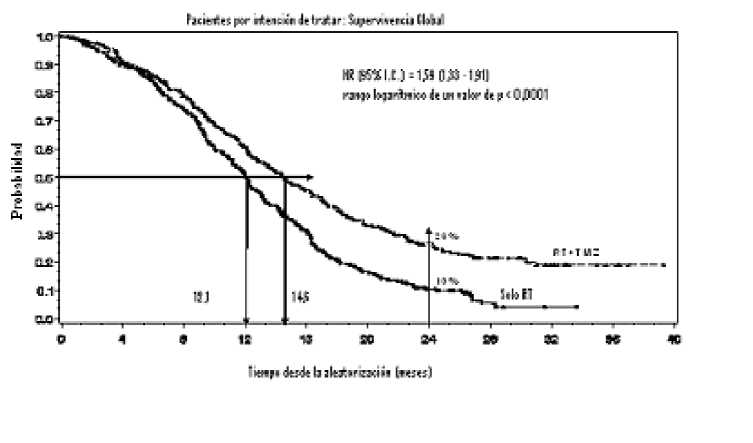
Figura 1 Curvas de Kaplan-Meier para la supervivencia global (población por intención de
tratar)
Los resultados del ensayo no fueron coherentes en el subgrupo de pacientes con un estado funcional bajo (Performance Status OMS PS =2, n=70), en el que la supervivencia global y el tiempo hasta la progresión fueron similares en ambos brazos. No obstante, este grupo de pacientes no parece presentar riesgos inaceptables.
Los datos sobre eficacia clínica en pacientes con glioblastoma multiforme (índice de estado funcional de Karnofsky [KPS] > 70), progresivo o recurrente, después de cirugía y RT se basaron en dos ensayos clínicos con TMZ oral. Uno fue un ensayo no comparativo sobre 138 pacientes (el 29 % recibió quimioterapia previa), y el otro fue un ensayo aleatorizado con brazo control activo de TMZ frente a procarbazina sobre un total de 225 pacientes (el 67 % recibió tratamiento previo con quimioterapia basada en nitrosourea). En ambos ensayos, la variable principal de valoración fue la supervivencia libre de progresión (SLP) definida por los escáneres de IRM o empeoramiento neurológico. En el ensayo no comparativo, la SLP a los 6 meses fue del 19 %, la mediana de la SLP fue de 2,1 meses, y la mediana de la supervivencia global de 5,4 meses. La tasa de respuesta objetiva (ORR) en base a las IRM fue del 8 %.
En el ensayo aleatorizado de brazo control activo, la SLP a los 6 meses fue significativamente mayor para TMZ que para la procarbazina (21 % frente al 8 %, respectivamente - prueba de chi-cuadrado p= 0,008) con una mediana de la SLP de 2,89 y 1,88 meses respectivamente (Test de rango logarítmico, p = 0,0063). La mediana de la supervivencia fue de 7,34 y 5,66 meses para TMZ y procarbazina, respectivamente (rango logarítmico de p = 0,33). A los 6 meses la fracción de pacientes que sobrevivieron fue significativamente superior en el brazo de TMZ (60 %) en comparación con el brazo de procarbazina (44 %) (prueba de chi-cuadrado p = 0,019). En los pacientes que recibieron quimioterapia previa se observó un beneficio en aquellos con un KPS > 80.
Los datos sobre el tiempo hasta el empeoramiento del estado neurológico favorecieron a TMZ sobre la procarbazina, al igual que los datos sobre el tiempo hasta el empeoramiento del estado funcional (decrece hasta KPS de < 70 o decrece al menos 30 puntos). En estas variables de valoración la mediana del tiempo hasta progresión osciló entre los 0,7 y 2,1 meses más para TMZ que para la procarbazina (Test de rango logarítmico, p = < 0,01 a 0,03).
Astrocitoma anaplásico recurrente
En un ensayo de fase II, multicéntrico y prospectivo, dirigido a evaluar la seguridad y la eficacia de la TMZ oral en el tratamiento de pacientes con un astrocitoma anaplásico en su primera recaída, la SLP a los 6 meses fue del 46 %. La mediana de la SLP fue de 5,4 meses. La mediana de la supervivencia global fue de 14,6 meses. La tasa de respuesta, basada en la evaluación practicada por un revisor central, fue del 35 % (13 RC y 43 RP) en la población analizada por intención de tratar (ITT) n=162.
Se comunicó enfermedad estable en 43 pacientes. La supervivencia libre de episodios a los 6 meses en la población analizada por ITT fue del 44 %, con una mediana de la supervivencia libre de episodios de 4,6 meses, cifra que fue similar a la hallada en la supervivencia libre de progresión de la enfermedad. En la población elegible desde el punto de vista de la histología, los resultados de eficacia fueron similares. El alcance de una respuesta objetiva radiológica o el mantenimiento del estado libre de progresión de la enfermedad se asoció firmemente al mantenimiento o la mejoría de la calidad de vida.
Población pediátrica
Se ha estudiado TMZ por vía oral en pacientes pediátricos (edad 3-18 años) con glioma recurrente del tronco encefálico o astrocitoma de alto grado recurrente, en un régimen de administración diaria durante 5 días cada 28 días. La tolerancia a TMZ es similar a la de los adultos.
5.2 Propiedades farmacocinéticas
TMZ se hidroliza espontáneamente a pH fisiológico principalmente a los metabolitos activos, 3-metil(triazeno-1-il)imidazol-4-carboxamida (MTIC). MTIC se hidroliza espontáneamente a 5-amino-imidazol-4-carboxamida (AIC), un conocido intermediario en la biosíntesis de purinas y ácidos nucleicos, y a metilhidrazina, que se cree que es el metabolito alquilante activo. Se cree que la citotoxicidad de MTIC se debe fundamentalmente a la alquilación del ADN principalmente en las
posiciones O6 y N7 de la guanina. En relación al AUC de temozolomida, la exposición a MTIC y AIC es ~ 2,4 % y 23 %, respectivamente. In vivo, el t1/2 de MTIC fue similar a la de TMZ, 1,8 h.
Absorción
Tras la administración oral a pacientes adultos, TMZ se absorbió rápidamente, con concentraciones máximas alcanzadas tan solo 20 minutos después de la administración (tiempo promedio entre 0,5 y 1,5 horas). Tras la administración oral de TMZ marcada con 14C, la excreción fecal promedio de 14C durante los siguientes 7 días después de la dosis fue de 0,8 % indicando la absorción completa.
Distribución
TMZ demuestra baja unión a proteínas (10 % a 20 %), y por lo tanto, no se espera que interactúe con sustancias de alta afinidad por proteínas.
Los estudios de tomografía por emisión de positrones (TEP) en seres humanos y los datos preclínicos sugieren que TMZ cruza la barrera hematoencefálica rápidamente y está presente en el LCR. La penetración del LCR se confirmó en un paciente, la exposición del LCR basada en el AUC de TMZ fue aproximadamente de un 30 % de éste en el plasma, lo que es coherente con los datos en animales.
Eliminación
La vida media en el plasma (t1/2) es aproximadamente de 1,8 horas. La ruta principal de eliminación del 14C es la renal. Tras la administración oral, aproximadamente el 5 % al 10 % de la dosis se recupera sin cambios en la orina durante 24 horas, y el resto se excreta como temozolomida ácida, 5-aminoimidazol-4-carboxamida (AIC) o metabolitos polares sin identificar.
Las concentraciones en plasma aumentan de manera relacionada con la dosis. El aclaramiento del plasma, el volumen de distribución y la vida media son independientes de la dosis.
Poblaciones especiales
El análisis de la farmacocinética basada en la población de TMZ reveló que el aclaramiento de TMZ en el plasma fue independiente de la edad, función renal o consumo de tabaco. En un estudio farmacocinético diferente, los perfiles farmacocinéticos del plasma en pacientes con disfunción hepática leve a moderada fueron similares a los observados en pacientes con función hepática normal.
Los pacientes pediátricos presentaron un AUC mayor que los pacientes adultos; no obstante, la dosis máxima tolerada (DMT) fue de 1.000 mg/m2 por ciclo en niños y en adultos.
5.3 Datos preclínicos sobre seguridad
Se llevaron a cabo estudios de toxicidad tras un solo ciclo (administración durante 5 días, 23 días sin tratamiento), 3 ciclos y 6 ciclos en ratas y perros. Las dianas principales de la toxicidad fueron la médula ósea, el sistema linforreticular, los testículos, el tracto gastrointestinal, y, a dosis superiores, que fueron letales para del 60 % al 100 % de las ratas y perros tratados, se produjo la degeneración de la retina. La mayoría de la toxicidad mostró evidencia de reversibilidad, excepto las reacciones adversas sobre el sistema reproductor masculino y la degeneración de la retina. No obstante, dado que las dosis implicadas en la degeneración de la retina se encontraban en el intervalo de dosis letal y no se ha observado un efecto comparable en los estudios clínicos, no se consideró que este resultado tuviera relevancia clínica.
TMZ es un agente alquilante embriotóxico, teratogénico y genotóxico. TMZ es más tóxica en la rata y el perro que en los seres humanos, y la dosis clínica se acerca a la dosis letal mínima en ratas y perros. Las reducciones, relacionadas con la dosis, en los leucocitos y las plaquetas parecen ser unos indicadores sensibles de toxicidad. En el estudio de administración a ratas durante 6 ciclos, se observaron varias neoplasias, incluyendo carcinoma de mama, queratoacantoma y adenoma de células basales mientras que en los estudios en perros no se obse rvaron tumores o alteraciones preneoplásicas. La rata parece ser particularmente sensible a los efectos oncogénicos de TMZ, con la aparición de los primeros tumores dentro de los 3 meses del inicio del tratamiento. Este periodo de latencia es muy corto incluso para un agente alquilante.
Los resultados de los test de Ames/salmonella y de aberración cromosómica en Linfocitos de Sangre Periférica Humana (HPBL) mostraron una respuesta positiva de mutagenicidad.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Contenido de la cápsula:
lactosa anhidra,
sílice anhidra coloidal,
glicolato sódico de almidón tipo A,
ácido tartárico,
ácido esteárico.
Cuerpos de las cápsulas: gelatina,
dióxido de titanio (E 171), lauril sulfato sódico, óxido amarillo de hierro (E 172), carmín de índigo (E 132).
Impresión:
goma laca,
propilenglicol,
agua purificada,
hidróxido amónico,
hidróxido de potasio,
óxido negro de hierro (E 172).
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
3 años
6.4 Precauciones especiales de conservación
Presentación en frascos
No conservar a temperatura superior a 30°C.
Conservar en el frasco original para protegerlo de la humedad. Mantener el frasco perfectamente cerrado.
Presentación en sobres
No conservar a temperatura superior a 30°C.
6.5 Naturaleza y contenido del envase
Presentación en frascos
Frascos de vidrio ámbar de tipo I con cierre de polipropileno a prueba de niños, que contienen 5 ó 20 cápsulas duras.
El envase de cartón contiene 1 frasco.
Presentación en sobres
Los sobres están compuestos por polietileno de baja densidad lineal (capa más interna), aluminio y tereftalato de polietileno.
Cada sobre contiene 1 cápsula dura y se dispensa en envase de cartón.
El envase de cartón contiene 5 ó 20 cápsulas duras, selladas en sobres individualmente.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Las cápsulas no se deben abrir. Si una cápsula se rompiera, se debe evitar el contacto del contenido en polvo con la piel o membranas mucosas. Si Temodal entra en contacto con la piel o mucosas, debe lavarse inmediata y concienzudamente con jabón y agua.
Se debe informar a los pacientes para que mantengan las cápsulas fuera de la vista y del alcance de los niños, preferiblemente en un armario cerrado con llave. La ingestión accidental puede ser mortal en niños.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU Reino Unido
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/98/096/001
EU/1/98/096/002
EU/1/98/096/024
EU/1/98/096/025
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 26/enero/1999 Fecha de la última renovación: 26/enero/2009
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
1. NOMBRE DEL MEDICAMENTO
Temodal 20 mg cápsulas duras
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada cápsula dura contiene 20 mg de temozolomida (temozolomide).
Excipiente con efecto conocido:
Cada cápsula dura contiene 182,2 mg de lactosa anhidra.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Cápsula dura (cápsula).
Las cápsulas duras tienen un cuerpo blanco opaco, una tapa amarilla opaca, y están impresas con tinta negra. La tapa lleva impreso “Temodal”. El cuerpo lleva impreso “20 mg”, el logo de Schering-Plough y dos rayas.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Temodal está indicado en el tratamiento de:
- pacientes adultos con glioblastoma multiforme de nuevo diagnóstico concomitante con radioterapia (RT) y posteriormente como tratamiento en monoterapia.
- niños a partir de tres años de edad, adolescentes y pacientes adultos con glioma maligno, tal como glioblastoma multiforme o astrocitoma anaplásico, que presentan recurrencia o progresión después de terapia estándar.
4.2 Posología y forma de administración
Temodal sólo debe ser prescrito por médicos con experiencia en el tratamiento oncológico de tumores cerebrales.
Puede administrarse terapia antiemética (ver sección 4.4).
Posología
Pacientes adultos con glioblastoma multiforme de nuevo diagnóstico
Temodal se administra en combinación con radioterapia focal (fase concomitante) seguido de hasta 6 ciclos de monoterapia con temozolomida (TMZ) (fase de monoterapia).
Fase concomitante
Se administra TMZ a una dosis de 75 mg/m2 al día por vía oral durante 42 días como tratamiento concomitante a la radioterapia focal (60 Gy administrados en 30 fracciones). No se recomiendan reducciones de dosis, pero se decidirá semanalmente el retraso o la suspensión de la administración de TMZ de acuerdo a los criterios de toxicidad hematológica y no hematológica. La administración de TMZ se puede continuar durante todo el periodo concomitante de 42 días (hasta 49 días) si se cumplen todas y cada una de las siguientes condiciones:
- recuento absoluto de neutrófilos (RAN) > 1,5 x 109/l
- recuento de trombocitos > 100 x 109/l
- toxicidad no hematológica según los criterios de toxicidad común (CTC) < Grado 1 (excepto para alopecia, náuseas y vómitos).
Durante el tratamiento se deberá realizar semanalmente un hemograma completo. La administración de TMZ se deberá interrumpir o suspender permanentemente durante la fase concomitante de acuerdo a los criterios de toxicidad hematológica y no hematológica según la Tabla 1.
|
Tabla 1. Interrupción o suspensión de la dosificación con TMZ durante el tratamiento concomitante de radioterapia y TMZ | ||
|
Toxicidad |
Interrupción de TMZa |
Suspensión de TMZ |
|
Recuento Absoluto de Neutrófilos |
> 0,5 y < 1,5 x 109/l |
< 0,5 x 109/l |
|
Recuento de Trombocitos |
> 10 y < 100 x 109/l |
< 10 x 109/l |
|
Toxicidad no hematológica según CTC (excepto para alopecia, náuseas y vómitos) |
Grado 2 según CTC |
Grado 3 ó 4 según CTC |
a: El tratamiento con TMZ concomitante se puede continuar si se cumplen todas y cada una de las siguientes condiciones: recuento absoluto de neutrófilos > 1,5 x 109/l, recuento de trombocitos > 100 x 109/l, toxicidad no hematológica según CTC < Grado 1 (excepto para alopecia, náuseas y vómitos).
Fase de monoterapia
Cuatro semanas después de completar la fase concomitante de TMZ + RT, se administran hasta 6 ciclos de TMZ en monoterapia. La dosis en el Ciclo 1 (monoterapia) es de 150 mg/m2 una vez al día, durante 5 días, seguido de 23 días sin tratamiento. Al principio del Ciclo 2, la dosis se aumenta a 200 mg/m2 si la toxicidad no hematológica según CTC en el Ciclo 1 es de Grado < 2 (excepto para alopecia, náuseas y vómitos), el recuento absoluto de neutrófilos (RAN) es > 1,5 x 109/l y el recuento de trombocitos > 100 x 109/l. Si la dosis no se aumentó en el Ciclo 2, no se deberá aumentar la dosis en los ciclos posteriores. Si se aumentó la dosis, se mantiene a 200 mg/m2 al día durante los primeros 5 días de cada ciclo posterior, excepto si se produce toxicidad. Las reducciones y suspensiones de dosis durante la fase de monoterapia se deberán realizar de acuerdo a las Tablas 2 y 3.
Durante el tratamiento se deberá realizar un hemograma completo en el Día 22 (21 días después de la primera dosis de TMZ). La dosis se reducirá o se suspenderá la administración de acuerdo a la Tabla 3.
|
Tabla 2. Niveles de dosis de TMZ para el tratamiento en monoterapia | ||
|
Nivel de dosis |
Dosis de TMZ (mg/m2/día) |
Observaciones |
|
-1 |
100 |
Reducción por toxicidad previa |
|
0 |
150 |
Dosis durante el Ciclo 1 |
|
1 |
200 |
Dosis durante los Ciclos 2-6 en ausencia de toxicidad |
|
Tabla 3. Reducción o suspensión de la dosis de TMZ durante el tratamiento en monoterapia | ||
|
Toxicidad |
Reducir TMZ 1 nivel de dosisa |
Suspender TMZ |
|
Recuento absoluto de neutrófilos |
< 1,0 x 109/l |
Ver nota b |
|
Recuento de trombocitos |
< 50 x 109/l |
Ver nota b |
|
Toxicidad no hematológica según CTC (excepto para alopecia, náuseas y vómitos) |
Grado 3 según CTC |
Grado 4b según CTC |
a: Los niveles de dosis de TMZ aparecen en la Tabla 2. b: Se suspende TMZ si:
• El nivel de dosis -1 (100 mg/m2) todavía provoca toxicidad inaceptable
• La misma toxicidad no hematológica de Grado 3 (excepto para alopecia, náuseas, vómitos) vuelve a aparecer tras la reducción de dosis.
Pacientes adultos y _pediátricos de 3 años de edad o mayores con glioma maligno recurrente o progresivo:
Un ciclo de tratamiento es de 28 días. En pacientes no tratados previamente con quimioterapia, TMZ se administra por vía oral a la dosis de 200 mg/m2 una vez al día durante los primeros 5 días seguido de una interrupción del tratamiento de 23 días (un total de 28 días). En los pacientes tratados previamente con quimioterapia, la dosis inicial es de 150 mg/m2 una vez al día, que debe incrementarse en el segundo ciclo a 200 mg/m2 una vez al día, durante 5 días si no apareciera toxicidad hematológica (ver sección 4.4).
Poblaciones especiales
Población pediátrica
En pacientes de edad igual o superior a 3 años, sólo debe usarse TMZ en glioma maligno recurrente o progresivo. La experiencia en estos niños es muy limitada (ver secciones 4.4 y 5.1). No se ha establecido la seguridad y la eficacia de TMZ en niños menores de 3 años. No se dispone de datos.
Pacientes con disfunción hepática o renal
La farmacocinética de la TMZ fue comparable en pacientes con función hepática normal y en aquellos con disfunción hepática leve o moderada. No hay datos disponibles sobre la administración de TMZ a pacientes con disfunción hepática grave (Clase C de Child) o con disfunción renal. En base a las propiedades farmacocinéticas de la TMZ, es improbable que se requieran reducciones de dosis en pacientes con disfunción hepática grave o cualquier grado de disfunción renal. Sin embargo, se debe tener precaución al administrar TMZ a estos pacientes.
Pacientes de edad avanzada
En base al análisis farmacocinético en pacientes de 19-78 años de edad, el aclaramiento de TMZ no se ve afectado por la edad. Sin embargo, los pacientes de edad avanzada (> 70 años de edad) parecen tener un aumento en el riesgo de neutropenia y trombocitopenia (ver sección 4.4).
Forma de administración
Temodal cápsulas duras debe administrarse en estado de ayuno.
Las cápsulas deben tragarse enteras con un vaso de agua y no deben abrirse o masticarse.
Si después de la administración de la dosis se produce vómito, no debe administrarse una segunda dosis ese día.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a algunos de los excipientes incluidos en la sección 6.1. Hipersensibilidad a la dacarbazina (DTIC).
Mielosupresión severa (ver sección 4.4).
4.4 Advertencias y precauciones especiales de empleo
Infecciones oportunistas y reactivación de infecciones
Durante el tratamiento con TMZ, se han observado infecciones oportunistas (como neumonía por Pneumocystis jirovecii) y reactivación de infecciones (como VHB, CMV) (ver sección 4.8).
Los pacientes que recibieron concomitantemente TMZ y RT en un ensayo piloto durante el régimen prolongado de 42 días presentaron un especial riesgo de desarrollar neumonía por Pneumocystis jirovecii (PCP). Por lo tanto, se requiere profilaxis frente a PCP en todos los pacientes que reciban concomitantemente TMZ y RT durante el régimen de 42 días (hasta un máximo de 49 días) con independencia del recuento de linfocitos. Si se produce linfopenia, deben continuar con la profilaxis hasta que la recuperación de la linfopenia sea de un grado < 1.
Puede haber una mayor incidencia de PCP cuando se administra TMZ durante un régimen de dosificación más largo. No obstante, todos los pacientes que reciban TMZ, en especial los pacientes que reciban esteroides, deberán ser vigilados estrechamente en cuanto al desarrollo de PCP con independencia del régimen. Se han notificado casos de insuficiencia respiratoria mortal en pacientes en tratamiento con TMZ, en particular en combinación con dexametasona u otros esteroides.
VHB
Se ha notificado hepatitis debida a una reactivación del virus de la hepatitis B (VHB), resultando en algunos casos mortal. Se debe consultar a los expertos en enfermedades hepáticas antes de iniciar el tratamiento en pacientes con serología para la hepatitis B positiva (incluyendo aquellos pacientes con la enfermedad activa). Durante el tratamiento, los pacientes deben ser controlados y tratados como corresponda.
Hepatotoxicidad
Se han notificado lesiones hepáticas incluyendo insuficiencia hepática mortal en pacientes tratados con TMZ (ver sección 4.8). Se deben determinar los valores basales de la función hepática antes de iniciar el tratamiento. Si fueran anómalos, el médico debe evaluar el beneficio/riesgo antes de iniciar el tratamiento con temozolamida, incluyendo el riesgo potencial de insuficiencia hepática mortal. En pacientes en un ciclo de tratamiento de 42 días, las pruebas se deben repetir en mitad del ciclo. En todos los pacientes, las pruebas de la función hepática se deben repetir después de cada ciclo de tratamiento. El médico debe evaluar el beneficio/riesgo de continuar el tratamiento en pacientes con anomalías significativas de la función hepática. La toxicidad hepática puede aparecer varias semanas o más, después del último tratamiento con temozolomida.
Neoplasias malignas
También se han observado casos muy raros de síndrome mielodisplásico y neoplasias secundarias, incluyendo leucemia mieloide (ver sección 4.8).
Terapia antiemética
Las náuseas y los vómitos se asocian muy frecuentemente con TMZ.
Se puede administrar la terapia antiemética antes o después de la administración de TMZ.
Pacientes adultos con glioblastoma multiforme de nuevo diagnóstico
Se recomienda profilaxis antiemética antes de la dosis inicial de la fase concomitante, y se recomienda encarecidamente durante la fase de monoterapia.
Pacientes con glioma maligno recurrente o _progresivo
Los pacientes que hayan experimentado fuertes vómitos (Grado 3 ó 4) en ciclos de tratamiento previos pueden precisar tratamiento antiemético.
Parámetros de laboratorio
Los pacientes en tratamiento con TMZ pueden presentar mielosupresión, incluyendo pancitopenia prolongada, que puede derivar en anemia aplásica que, en ciertos casos, puede terminar en fallecimiento. En algunos casos, la exposición a medicamentos concomitantes asociados a la anemia aplásica, tales como carbamazepina, fenitoína y sulfametoxazol/trimetoprima complica la valoración. Antes de la administración, deberán cumplirse los siguientes parámetros de laboratorio: RAN > 1,5 x 109/1 y recuento de plaquetas > 100 x 109/l. Deberá practicarse un hemograma completo el Día 22 (21 días después de la primera dosis) o dentro de las 48 horas de dicho día, y una vez a la semana hasta que el RAN sea > 1,5 x 109/l y el recuento de plaquetas sea > 100 x 109/l. Si el RAN disminuyera a < 1,0 x 109/l o el recuento de plaquetas fuera < 50 x 109/l durante cualquier ciclo, se disminuirá un nivel de dosis en el siguiente ciclo (ver sección 4.2). Los niveles de dosis son de 100 mg/m2, 150 mg/m2 y 200 mg/m2. La dosis más baja recomendada es de 100 mg/m2.
Población pediátrica
No hay experiencia clínica sobre el empleo de TMZ en niños menores de 3 años de edad. La experiencia en niños mayores y adolescentes es muy limitada (ver sección 4.2 y 5.1).
Pacientes de edad avanzada (> 70 años de edad)
Los pacientes de edad avanzada parecen presentar un mayor riesgo de neutropenia y trombocitopenia que los pacientes más jóvenes. Por lo tanto, se debe tener precaución especial cuando se administre TMZ a pacientes de edad avanzada.
Pacientes varones
Debe advertirse a los hombres que vayan a ser tratados con TMZ que eviten dejar embarazada a su pareja durante los 6 meses posteriores al tratamiento y que busquen asesoramiento sobre crioconservación del esperma antes del tratamiento (ver sección 4.6).
Lactosa
Este medicamento contiene lactosa. Los pacientes con intolerancia hereditaria a galactosa, insuficiencia de lactasa de Lapp o malabsorción de glucosa o galactosa no deben tomar este medicamento.
4.5 Interacción con otros medicamentos y otras formas de interacción
En otro estudio en fase I, la administración de TMZ con ranitidina no provocó modificaciones del grado de absorción de la temozolomida o de la exposición a su metabolito activo monometil triazenoimidazol carboxamida (MTIC).
La administración de TMZ con los alimentos resultó en una disminución del 33 % de la Cmax y en una disminución del 9 % del área bajo la curva (AUC).
Como no se puede excluir que el cambio en la Cmax sea clínicamente importante, Temodal no debe administrarse junto a alimentos.
En base a un análisis de la farmacocinética de población observado en ensayos en fase II, la coadministración de dexametasona, proclorperazina, fenitoína, carbamazepina, ondansetrón, antagonistas de los receptores H2 o fenobarbital no modificó la eliminación de la TMZ. Se asoció la coadministración de ácido valproico con una pequeña pero estadísticamente significativa disminución del aclaramiento de TMZ.
No se han llevado a cabo estudios para determinar el efecto de TMZ sobre el metabolismo o eliminación de otros fármacos. No obstante, dado que TMZ no experimenta metabolismo hepático y muestra una baja unión a proteínas, es improbable que afecte a la farmacocinética de otros medicamentos (ver sección 5.2).
El empleo de TMZ en combinación con otros agentes mielosupresores puede aumentar la probabilidad de mielosupresión.
Población pediátrica
Los estudios de interacciones se han realizado sólo en adultos.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No hay datos en mujeres embarazadas. En los estudios preclínicos en ratas y conejos tratados con 150 mg/m2 de TMZ se observó teratogenia y/o toxicidad fetal (ver sección 5.3).Temodal no debe administrarse a mujeres embarazadas. Si se debe considerar su uso durante el embarazo, la paciente debe ser informada del riesgo potencial para el feto.
Lactancia
Se desconoce si TMZ se excreta en la leche materna; por tanto, se debe interrumpir la lactancia durante el tratamiento con TMZ.
Mujeres en edad fértil
Se debe aconsejar a las mujeres en edad fértil el uso de un método anticonceptivo eficaz para evitar el embarazo mientras estén en tratamiento con TMZ.
Fertilidad masculina
TMZ puede tener efectos genotóxicos. Por lo tanto, se advierte a los hombres que vayan a ser tratados con ella que eviten dejar embarazada a su pareja hasta que hayan transcurrido 6 meses desde la última dosis y que busquen asesoramiento sobre crioconservación del esperma antes del tratamiento dada la posibilidad de infertilidad irreversible debido a la terapia con TMZ.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
TMZ tiene una influencia baja sobre la capacidad para conducir y utilizar máquinas debido a la fatiga y somnolencia (ver sección 4.8).
4.8 Reacciones adversas
Experiencia de ensayos clínicos
En pacientes tratados con TMZ, ya sea en combinación con RT o como monoterapia tras RT para glioblastoma multiforme de nuevo diagnóstico o como monoterapia en pacientes con glioma recurrente o progresivo, las reacciones adversas muy frecuentes notificadas fueron similares: náuseas, vómitos, estreñimiento, anorexia, cefalea y fatiga. Se notificaron de manera muy frecuente convulsiones en pacientes con glioblastoma multiforme de nuevo diagnóstico que recibieron monoterapia, y se notificó sarpullido muy frecuentemente en pacientes con glioblastoma multiforme de nuevo diagnóstico que recibieron TMZ en combinación con RT y también en monoterapia, y se notificó frecuentemente en glioma recurrente. La mayoría de las alteraciones de parámetros hematológicos se notificaron, según lo esperado, como frecuentes o muy frecuentes en ambas indicaciones (Tablas 4 y 5); después de cada tabla se recogen las frecuencias relativas a los parámetros de laboratorio de grados 3 y 4.
En las tablas, los efectos adversos se clasifican según la clasificación por órganos y sistemas y la frecuencia. Los grupos de frecuencia se definen según la siguiente convención: Muy frecuentes (> 1/10); Frecuentes (> 1/100 a < 1/10); Poco frecuentes (> 1/1.000 a < 1/100); Raras (> 1/10.000 a < 1/1.000); Muy raras (< 1/10.000). Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
Glioblastoma multiforme de nuevo diagnóstico
La Tabla 4 incluye reacciones adversas derivadas del tratamiento en pacientes con glioblastoma multiforme de nuevo diagnóstico durante las fases de tratamiento concomitante y en monoterapia.
|
Tabla 4. Acontecimientos derivados del tratamiento durante las fases de tratamiento concomitante y en monoterapia en pacientes con glioblastoma multiforme de nuevo diagnóstico | ||
|
Clasificación por órganos y sistemas |
TMZ + radioterapia concomitante n=288* |
TMZ en monoterapia n=224 |
|
Infecciones e infestaciones | ||
|
Frecuentes: |
Infección, herpes simple, infección de una herida, faringitis, candidiasis oral |
Infección, candidiasis oral |
|
Poco frecuentes: |
Herpes simple, herpes zoster, síntomas pseudogripales | |
|
Trastornos de la sangre y del sistema linfático | ||
|
Frecuentes: |
Neutropenia, trombocitopenia, linfopenia, leucopenia |
Neutropenia febril, trombocitopenia, anemia, leucopenia |
|
Poco frecuentes: |
Neutropenia febril, anemia |
Linfopenia, petequia |
|
Trastornos endocrinos | ||
|
Poco frecuentes: |
Cushingoide |
Cushingoide |
|
Trastornos del metabolismo y de la nutrición | ||
|
Muy frecuentes: |
Anorexia |
Anorexia |
|
Frecuentes: |
Hiperglucemia, pérdida de peso |
Pérdida de peso |
|
Poco frecuentes: |
Hipopotasemia, aumento de la fosfatasa alcalina, aumento de peso |
Hiperglucemia, aumento de peso |
|
Trastornos psiquiátricos | ||
|
Frecuentes: |
Ansiedad, labilidad emocional, insomnio |
Ansiedad, depresión, labilidad emocional, insomnio |
|
Poco frecuentes: |
Agitación, apatía, alteración del comportamiento, depresión, alucinaciones |
Alucinaciones, amnesia |
|
Trastornos del sistema nervioso | ||
|
Muy frecuentes: |
Cefalea |
Convulsiones, cefalea |
|
Frecuentes: |
Convulsiones, pérdida de conocimiento, somnolencia, afasia, alteración del equilibrio, mareo, confusión, pérdida de memoria, disminución de la concentración, neuropatía, parestesia, trastorno en el habla, temblor |
Hemiparesia, afasia, alteración del equilibrio, somnolencia, confusión, mareo, pérdida de memoria, disminución de la concentración, disfasia, trastorno neurológico (NOS), neuropatía, neuropatía periférica, parestesia, trastorno en el habla, temblor |
|
Poco frecuentes: |
Status epilepticus, trastorno extrapiramidal, hemiparesia, ataxia, trastorno cognitivo, disfasia, trastorno de la marcha, hiperestesia, hipoestesia, trastorno neurológico (NOS), neuropatía periférica |
Hemiplejía, ataxia, alteración en la coordinación, trastorno de la marcha, hiperestesia, trastorno sensorial |
|
Trastornos oculares | ||
|
Frecuentes: |
Visión borrosa |
Defecto en el campo visual, visión borrosa, diplopía |
|
Poco frecuentes: |
Hemianopsia, disminución de la agudeza visual, trastorno en la visión, defecto en el campo visual, dolor ocular |
Disminución de la agudeza visual, dolor ocular, sequedad ocular |
|
Trastornos del oído y del laberinto | ||
|
Frecuentes: |
Trastorno en la audición |
Trastorno en la audición, tinnitus |
|
Poco frecuentes: |
Otitis media, tinnitus, hiperacusia, otalgia |
Sordera, vértigo, otalgia |
|
Trastornos cardiacos | ||
|
Poco frecuentes: |
Palpitaciones | |
|
Trastornos vasculares | ||
|
Frecuentes: |
Hemorragia, edema, edema de piernas |
Hemorragia, trombosis venosa profunda, edema de piernas |
|
Poco frecuentes: |
Hemorragia cerebral, hipertensión |
Embolismo pulmonar, edema, edema periférico |
|
Trastornos respiratorios, torácicos y mediastínicos | ||
|
Frecuentes: |
Disnea, tos |
Disnea, tos |
|
Poco frecuentes: |
Neumonía, infección respiratoria superior, congestión nasal |
Neumonía, sinusitis, infección respiratoria superior, bronquitis |
|
Trastornos gastrointestinales | ||
|
Muy frecuentes: |
Estreñimiento, náuseas, vómitos |
Estreñimiento, náuseas, vómitos |
|
Frecuentes: |
Estomatitis, diarrea, dolor abdominal, dispepsia, disfagia |
Estomatitis, diarrea, dispepsia, disfagia, sequedad de boca |
|
Poco frecuentes: |
Distensión abdominal, incontinencia fecal, trastorno gastrointestinal (NOS), gastroenteritis, hemorroides | |
|
Trastornos de la piel y del tejido subcutáneo | ||
|
Muy frecuentes: |
Sarpullido, alopecia |
Sarpullido, alopecia |
|
Frecuentes: |
Dermatitis, sequedad cutánea, eritema, prurito |
Sequedad cutánea, prurito |
|
Poco frecuentes: |
Exfoliación cutánea, reacción de fotosensibilidad, alteración en la pigmentación |
Eritema, alteración en la pigmentación, aumento de la sudoración |
|
Trastornos musculoesqueléticos y del tejido conjuntivo | ||
|
Frecuentes: |
Debilidad muscular, artralgia |
Debilidad muscular, artralgia, dolor musculoesquelético, mialgia |
|
Poco frecuentes: |
Miopatía, dolor de espalda, dolor musculoesquelético, mialgia |
Miopatía, dolor de espalda |
|
Trastornos renales y urinarios | ||
|
Frecuentes: |
Polaquiuria, incontinencia urinaria |
Incontinencia urinaria |
|
Poco frecuentes: |
Disuria | |
|
Trastornos del aparato reproductor y de la mama | ||
|
Poco frecuentes: |
Impotencia |
Hemorragia vaginal, menorragia, amenorrea, vaginitis, dolor de mama |
|
Trastornos generales y alteraciones en el lugar de administración | ||
|
Muy frecuentes: |
Fatiga |
Fatiga |
|
Frecuentes: |
Reacción alérgica, fiebre, lesión por radiación, edema facial, dolor, alteración del gusto |
Reacción alérgica, fiebre, lesión por radiación, dolor, alteración del gusto |
|
Poco frecuentes: |
Astenia, rubor, sofocos, empeoramiento de una enfermedad, escalofríos, cambio de color de la lengua, parosmia, sed |
Astenia, edema facial, dolor, empeoramiento de una enfermedad, escalofríos, trastorno dental |
|
Exploraciones complementarias | ||
|
Frecuentes: |
Aumento de ALT |
Aumento de ALT |
|
Poco frecuentes: |
Aumento de enzimas hepáticas, aumento de Gamma GT, aumento de AST | |
*Un paciente que se aleatorizó al brazo de RT únicamente, recibió TMZ + RT.
Resultados de laboratorio
Se observó mielosupresión (neutropenia y trombocitopenia), que es toxicidad limitante de dosis conocida para la mayoría de los agentes citotóxicos, incluido TMZ. Cuando las alteraciones en las pruebas de laboratorio y las reacciones adversas se sumaron entre las fases de tratamiento concomitante y en monoterapia, se observaron alteraciones en neutrófilos de Grado 3 o de Grado 4, incluyendo acontecimientos neutropénicos, en el 8 % de los pacientes. Se observaron alteraciones en los trombocitos de Grado 3 o Grado 4, incluyendo acontecimientos trombocitopénicos en el 14 % de los pacientes que recibieron TMZ.
Glioma maligno recurrente o progresivo
En los ensayos clínicos, las reacciones adversas que se produjeron más frecuentemente relacionadas con el tratamiento fueron los trastornos gastrointestinales, concretamente náuseas (43 %) y vómitos (36 %). Estas reacciones fueron normalmente de Grado 1 ó 2 (0-5 episodios de vómitos en 24 horas) y se autolimitaron o controlaron rápidamente con tratamiento antiemético estándar. La incidencia de náuseas y vómitos intensos fue del 4 %.
La Tabla 5 incluye reacciones adversas notificadas durante ensayos clínicos en glioma maligno recurrente o progresivo y después de la comercialización de Temodal.
_Tabla 5. Reacciones adversas en pacientes con glioma maligno recurrente o progresivo
Infecciones e infestaciones
Raras:
Infecciones oportunistas, incluyendo PCP
|
Trastornos de la sangre y del sistema linfático | |
|
Muy frecuentes: |
Neutropenia o linfopenia (grado 3-4), trombocitopenia (grado 3-4) |
|
Poco frecuentes: |
Pancitopenia, anemia (grado 3-4), leucopenia |
|
Trastornos del metabolismo y de la nutrición | |
|
Muy frecuentes: |
Anorexia |
|
Frecuentes: |
Pérdida de peso |
|
Trastornos del sistema nervioso | |
|
Muy frecuentes: |
Cefalea |
|
Frecuentes: |
Somnolencia, mareo, parestesia |
|
Trastornos respiratorios, torácicos y mediastínicos | |
|
Frecuentes: |
Disnea |
|
Trastornos gastrointestinales | |
|
Muy frecuentes: |
Vómitos, náuseas, estreñimiento |
|
Frecuentes: |
Diarrea, dolor abdominal, dispepsia |
|
Trastornos de la piel y del tejido subcutáneo | |
|
Frecuentes: |
Sarpullido, prurito, alopecia |
|
Muy raros: |
Eritema multiforme, eritrodermia, urticaria, exantema |
|
Trastornos generales y alteraciones en el lugar de administración | |
|
Muy frecuentes: |
Fatiga |
|
Frecuentes: |
Fiebre, astenia, escalofríos, malestar general, dolor, alteraciones en el gusto |
|
Muy raras: |
Reacciones alérgicas, incluyendo anafilaxia, angioedema |
Resultados de laboratorio
Se produjeron trombocitopenia y neutropenia de Grados 3 ó 4 en el 19 % y 17 %, respectivamente, de los pacientes tratados por glioma maligno. Esto provocó la hospitalización y/o interrupción del tratamiento con TMZ en el 8 % y 4 %, respectivamente. La mielosupresión fue previsible (normalmente dentro de los primeros ciclos, con el valor más bajo de parámetros hematológicos (nadir) entre el Día 21 y el Día 28), y la recuperación fue rápida, generalmente en 1-2 semanas. No se observó evidencia de una mielosupresión de tipo acumulativo. La presencia de trombocitopenia puede incrementar el riesgo de hemorragia, y la presencia de neutropenia o leucopenia puede incrementar el riesgo de infección.
Género
En un análisis de farmacocinética basada en la población sobre la experiencia en ensayos clínicos se disponía de los datos del nadir de los recuentos de neutrófilos para 101 mujeres y 169 hombres, y del nadir de plaquetas para 110 mujeres y 174 hombres. En el primer ciclo de terapia hubo tasas más altas de neutropenia de Grado 4 (RAN < 0,5 x 109/l), 12 % frente al 5 %, y trombocitopenia (< 20 x 109/l),
9 % frente al 3 %, en mujeres que en hombres. En una serie de datos de 400 pacientes con glioma recurrente, tras el primer ciclo de terapia, se produjo neutropenia de Grado 4 en el 8 % de las mujeres frente al 4 % de los hombres, y trombocitopenia de Grado 4 en el 8 % de las mujeres frente al 3 % de los hombres. En un ensayo con 288 pacientes con glioblastoma multiforme de nuevo diagnóstico, se produjo, en el primer ciclo de terapia, neutropenia de Grado 4 en el 3 % de las mujeres frente al 0 % de los hombres, y trombocitopenia de Grado 4 en el 1 % de las mujeres frente al 0 % de los hombres.
Población pediátrica
Se ha estudiado TMZ por vía oral en pacientes pediátricos (edad 3-18 años) con glioma recurrente del tronco encefálico o astrocitoma de alto grado recurrente, en un régimen de administración diaria durante 5 días cada 28 días. Aunque los datos son limitados, cabe esperar que la tolerancia en niños sea similar a la de los adultos. No se ha determinado la seguridad de TMZ en niños menores de 3 años.
Experiencia postcomercialización
Se han identificado las siguientes reacciones adversas graves durante la exposición postcomercialización:
|
Tabla 6. Resumen de los acontecimientos notificados con temozolomida en la postcomercialización | |
|
Infecciones e infestaciones* | |
|
Poco frecuentes: |
infección por citomegalovirus, reactivación de infección de tipo citomegalovirus, virus hepatitis B1 |
|
Trastornos de la sangre y del sistema linfático | |
|
Muy raras: |
pancitopenia prolongada, anemia aplásica1 |
|
Neoplasias benignas, malignas y no especificadas | |
|
Muy raras: |
síndrome mielodisplásico, tumores malignos secundarios, incluyendo leucemia mieloide |
|
Trastornos endocrinos* | |
|
Poco frecuentes: |
diabetes insípida |
|
Trastornos respiratorios, torácicos y mediastínicos | |
|
Muy raras: |
neumonitis intersticial/neumonitis, fibrosis pulmonar, insuficiencia respiratoria1 |
|
Trastornos hepatobiliares * | |
|
Frecuentes: |
enzimas hepáticas aumentadas |
|
Poco frecuentes: |
hiperbilirrubinemia, colestasis, hepatitis, lesión hepática, insuficiencia hepática1 |
|
Trastornos de la piel y del tejido subcutáneo | |
|
Muy raras: |
necrolisis epidérmica tóxica, syndrome de Stevens-Johnson |
1 Incluyendo casos con desenlace mortal Frecuencias estimadas a partir de los ensayos clínicos pertinentes.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Anexo V.
4.9 Sobredosis
Se han evaluado clínicamente en pacientes dosis de 500, 750, 1.000 y 1.250 mg/m2 (dosis total por ciclo de 5 días). La toxicidad limitante de dosis fue hematológica y se notificó con todas las dosis, pero se espera que sea más grave a dosis más altas. Un paciente recibió una sobredosis de 10.000 mg (dosis total por ciclo de 5 días) y las reacciones adversas que se notificaron fueron pancitopenia, pirexia, fracaso multiorgánico y muerte. Se han notificado casos de pacientes que han tomado la dosis recomendada durante más de 5 días de tratamiento (hasta 64 días) notificándose reacciones adversas como supresión de médula ósea, con o sin infección, en algunos casos grave y prolongada, con resultado de muerte. En caso de sobredosis, es necesaria una evaluación hematológica. Se deben tomar medidas generales de soporte si fuera necesario.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Agentes antineoplásicos - Otros agentes alquilantes, código ATC: L01A X03.
La temozolomida es un triazeno, que a pH fisiológico sufre una rápida conversión química a la monometil tiazenoimidazol carboxamida activa (MTIC). Se considera que la citotoxicidad del MTIC es consecuencia, fundamentalmente, de una alquilación en la posición O6 de la guanina, con una alquilación adicional que se produce en la posición N7. Se considera que las lesiones citotóxicas que se desarrollan posteriormente conllevan una reparación aberrante del metilo añadido.
Eficacia clínica y seguridad
Glioblastoma multiforme de nuevo diagnóstico
. Los
- 5 de Los
Se aleatorizaron un total de 573 pacientes para recibir o TMZ + RT (n=287) o RT sola (n=286) pacientes del brazo de TMZ + RT recibieron TMZ concomitante (75 mg/m2) una vez al día, empezando el primer día de RT hasta el último día de RT, durante 42 días (hasta un máximo de 49 días). Este tratamiento iba seguido de TMZ en monoterapia (150 - 200 mg/m2) en los Días 1 cada ciclo de 28 días, hasta 6 ciclos, empezando 4 semanas después de la finalización de la RT. pacientes del brazo control sólo recibieron RT. Se necesitó profilaxis frente a neumonía por Pneumocystis jirovecii (PCP) durante la RT y la terapia combinada con TMZ.
En la fase de seguimiento se administró TMZ como terapia de rescate en 161 pacientes de los 282 (57 %) del brazo de RT sola, y en 62 pacientes de los 277 (22 %) del brazo de TMZ + RT.
El hazard ratio (HR) para la supervivencia global fue de 1,59 (95 % IC para HR=1,33 -1,91) con un rango logarítmico de p < 0,0001 a favor del brazo de TMZ. La probabilidad estimada de sobrevivir 2 o más años (26 % frente a 10 %) es mayor para el brazo de RT + TMZ. La adición de TMZ concomitante a la RT, seguida de TMZ en monoterapia en el tratamiento de pacientes con glioblastoma multiforme de nuevo diagnóstico, demostró una mejoría en la supervivencia global (SG) estadísticamente significativa en comparación con la RT sola (Figura 1).
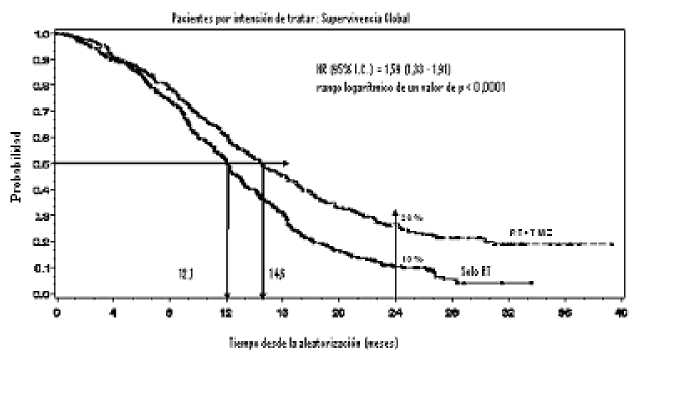
Figura 1 Curvas de Kaplan-Meier para la supervivencia global (población por intención de
tratar)
Los resultados del ensayo no fueron coherentes en el subgrupo de pacientes con un estado funcional bajo (Performance Status OMS PS =2, n=70), en el que la supervivencia global y el tiempo hasta la progresión fueron similares en ambos brazos. No obstante, este grupo de pacientes no parece presentar riesgos inaceptables.
Glioma maligno recurrente o progresivo
Los datos sobre eficacia clínica en pacientes con glioblastoma multiforme (índice de estado funcional de Karnofsky [KPS] > 70), progresivo o recurrente, después de cirugía y RT se basaron en dos
ensayos clínicos con TMZ oral. Uno fue un ensayo no comparativo sobre 138 pacientes (el 29 % recibió quimioterapia previa), y el otro fue un ensayo aleatorizado con brazo control activo de TMZ frente a procarbazina sobre un total de 225 pacientes (el 67 % recibió tratamiento previo con quimioterapia basada en nitrosourea). En ambos ensayos, la variable principal de valoración fue la supervivencia libre de progresión (SLP) definida por los escáneres de IRM o empeoramiento neurológico. En el ensayo no comparativo, la SLP a los 6 meses fue del 19 %, la mediana de la SLP fue de 2,1 meses, y la mediana de la supervivencia global de 5,4 meses. La tasa de respuesta objetiva (ORR) en base a las IRM fue del 8 %.
En el ensayo aleatorizado de brazo control activo, la SLP a los 6 meses fue significativamente mayor para TMZ que para la procarbazina (21 % frente al 8 %, respectivamente - prueba de chi-cuadrado p= 0,008) con una mediana de la SLP de 2,89 y 1,88 meses respectivamente (Test de rango logarítmico, p = 0,0063). La mediana de la supervivencia fue de 7,34 y 5,66 meses para TMZ y procarbazina, respectivamente (rango logarítmico de p = 0,33). A los 6 meses la fracción de pacientes que sobrevivieron fue significativamente superior en el brazo de TMZ (60 %) en comparación con el brazo de procarbazina (44 %) (prueba de chi-cuadrado p = 0,019). En los pacientes que recibieron quimioterapia previa se observó un beneficio en aquellos con un KPS > 80.
Los datos sobre el tiempo hasta el empeoramiento del estado neurológico favorecieron a TMZ sobre la procarbazina, al igual que los datos sobre el tiempo hasta el empeoramiento del estado funcional (decrece hasta KPS de < 70 o decrece al menos 30 puntos). En estas variables de valoración la mediana del tiempo hasta progresión osciló entre los 0,7 y 2,1 meses más para TMZ que para la procarbazina (Test de rango logarítmico, p = < 0,01 a 0,03).
Astrocitoma anaplásico recurrente
En un ensayo de fase II, multicéntrico y prospectivo, dirigido a evaluar la seguridad y la eficacia de la TMZ oral en el tratamiento de pacientes con un astrocitoma anaplásico en su primera recaída, la SLP a los 6 meses fue del 46 %. La mediana de la SLP fue de 5,4 meses. La mediana de la supervivencia global fue de 14,6 meses. La tasa de respuesta, basada en la evaluación practicada por un revisor central, fue del 35 % (13 RC y 43 RP) en la población analizada por intención de tratar (ITT) n=162.
Se comunicó enfermedad estable en 43 pacientes. La supervivencia libre de episodios a los 6 meses en la población analizada por ITT fue del 44 %, con una mediana de la supervivencia libre de episodios de 4,6 meses, cifra que fue similar a la hallada en la supervivencia libre de progresión de la enfermedad. En la población elegible desde el punto de vista de la histología, los resultados de eficacia fueron similares. El alcance de una respuesta objetiva radiológica o el mantenimiento del estado libre de progresión de la enfermedad se asoció firmemente al mantenimiento o la mejoría de la calidad de vida.
Población pediátrica
Se ha estudiado TMZ por vía oral en pacientes pediátricos (edad 3-18 años) con glioma recurrente del tronco encefálico o astrocitoma de alto grado recurrente, en un régimen de administración diaria durante 5 días cada 28 días. La tolerancia a TMZ es similar a la de los adultos.
5.2 Propiedades farmacocinéticas
TMZ se hidroliza espontáneamente a pH fisiológico principalmente a los metabolitos activos, 3-metil(triazeno-1-il)imidazol-4-carboxamida (MTIC). MTIC se hidroliza espontáneamente a 5-amino-imidazol-4-carboxamida (AIC), un conocido intermediario en la biosíntesis de purinas y ácidos nucleicos, y a metilhidrazina, que se cree que es el metabolito alquilante activo. Se cree que la citotoxicidad de MTIC se debe fundamentalmente a la alquilación del ADN principalmente en las posiciones O6 y N7 de la guanina. En relación al AUC de temozolomida, la exposición a MTIC y AIC es ~ 2,4 % y 23 %, respectivamente. In vivo, el ti/2 de MTIC fue similar a la de TMZ, 1,8 h..
Tras la administración oral a pacientes adultos, TMZ se absorbió rápidamente, con concentraciones máximas alcanzadas tan solo 20 minutos después de la administración (tiempo promedio entre 0,5 y
1,5 horas). Tras la administración oral de TMZ marcada con 14C, la excreción fecal promedio de 14C durante los siguientes 7 días después de la dosis fue de 0,8 % indicando la absorción completa.
Distribución
TMZ demuestra baja unión a proteínas (10 % a 20 %), y por lo tanto, no se espera que interactúe con sustancias de alta afinidad por proteínas.
Los estudios de tomografía por emisión de positrones (TEP) en seres humanos y los datos preclínicos sugieren que TMZ cruza la barrera hematoencefálica rápidamente y está presente en el LCR. La penetración del LCR se confirmó en un paciente, la exposición del LCR basada en el AUC de TMZ fue aproximadamente de un 30 % de éste en el plasma, lo que es coherente con los datos en animales.
Eliminación
La vida media en el plasma (t1/2) es aproximadamente de 1,8 horas. La ruta principal de eliminación del 14C es la renal. Tras la administración oral, aproximadamente el 5 % al 10 % de la dosis se recupera sin cambios en la orina durante 24 horas, y el resto se excreta como temozolomida ácida, 5-aminoimidazol-4-carboxamida (AIC) o metabolitos polares sin identificar.
Las concentraciones en plasma aumentan de manera relacionada con la dosis. El aclaramiento del plasma, el volumen de distribución y la vida media son independientes de la dosis.
Poblaciones especiales
El análisis de la farmacocinética basada en la población de TMZ reveló que el aclaramiento de TMZ en el plasma fue independiente de la edad, función renal o consumo de tabaco. En un estudio farmacocinético diferente, los perfiles farmacocinéticos del plasma en pacientes con disfunción hepática leve a moderada fueron similares a los observados en pacientes con función hepática normal.
Los pacientes pediátricos presentaron un AUC mayor que los pacientes adultos; no obstante, la dosis máxima tolerada (DMT) fue de 1.000 mg/m2 por ciclo en niños y en adultos.
5.3 Datos preclínicos sobre seguridad
Se llevaron a cabo estudios de toxicidad tras un solo ciclo (administración durante 5 días, 23 días sin tratamiento), 3 ciclos y 6 ciclos en ratas y perros. Las dianas principales de la toxicidad fueron la médula ósea, el sistema linforreticular, los testículos, el tracto gastrointestinal, y, a dosis superiores, que fueron letales para del 60 % al 100 % de las ratas y perros tratados, se produjo la degeneración de la retina. La mayoría de la toxicidad mostró evidencia de reversibilidad, excepto las reacciones adversas sobre el sistema reproductor masculino y la degeneración de la retina. No obstante, dado que las dosis implicadas en la degeneración de la retina se encontraban en el intervalo de dosis letal y no se ha observado un efecto comparable en los estudios clínicos, no se consideró que este resultado tuviera relevancia clínica.
TMZ es un agente alquilante embriotóxico, teratogénico y genotóxico. TMZ es más tóxica en la rata y el perro que en los seres humanos, y la dosis clínica se acerca a la dosis letal mínima en ratas y perros. Las reducciones, relacionadas con la dosis, en los leucocitos y las plaquetas parecen ser unos indicadores sensibles de toxicidad. En el estudio de administración a ratas durante 6 ciclos, se observaron varias neoplasias, incluyendo carcinoma de mama, queratoacantoma y adenoma de células basales mientras que en los estudios en perros no se observaron tumores o alteraciones preneoplásicas. La rata parece ser particularmente sensible a los efectos oncogénicos de TMZ, con la aparición de los primeros tumores dentro de los 3
meses del inicio del tratamiento. Este periodo de latencia es muy corto incluso para un agente alquilante.
Los resultados de los test de Ames/salmonella y de aberración cromosómica en Linfocitos de Sangre Periférica Humana (HPBL) mostraron una respuesta positiva de mutagenicidad.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Contenido de la cápsula:
lactosa anhidra,
sílice anhidra coloidal,
glicolato sódico de almidón tipo A,
ácido tartárico,
ácido esteárico.
Cuerpos de las cápsulas: gelatina,
dióxido de titanio (E 171),
lauril sulfato sódico,
óxido amarillo de hierro (E 172).
Impresión:
goma laca,
propilenglicol,
agua purificada,
hidróxido amónico,
hidróxido de potasio,
óxido negro de hierro (E 172).
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
3 años
6.4 Precauciones especiales de conservación
Presentación en frascos
No conservar a temperatura superior a 30°C.
Conservar en el frasco original para protegerlo de la humedad. Mantener el frasco perfectamente cerrado.
Presentación en sobres
No conservar a temperatura superior a 30°C.
6.5 Naturaleza y contenido del envase
Presentación en frascos
Frascos de vidrio ámbar de tipo I con cierre de polipropileno a prueba de niños, que contienen 5 ó 20 cápsulas duras.
El envase de cartón contiene 1 frasco.
Presentación en sobres
Los sobres están compuestos por polietileno de baja densidad lineal (capa más interna), aluminio y tereftalato de polietileno.
Cada sobre contiene 1 cápsula dura y se dispensa en envase de cartón.
El envase de cartón contiene 5 ó 20 cápsulas duras, selladas en sobres individualmente.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Las cápsulas no se deben abrir. Si una cápsula se rompiera, se debe evitar el contacto del contenido en polvo con la piel o membranas mucosas. Si Temodal entra en contacto con la piel o mucosas, debe lavarse inmediata y concienzudamente con jabón y agua.
Se debe informar a los pacientes para que mantengan las cápsulas fuera de la vista y del alcance de los niños, preferiblemente en un armario cerrado con llave. La ingestión accidental puede ser mortal en niños.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU Reino Unido
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/98/096/003
EU/1/98/096/004
EU/1/98/096/013
EU/1/98/096/014
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 26/enero/1999 Fecha de la última renovación: 26/enero/2009
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
1. NOMBRE DEL MEDICAMENTO
Temodal 100 mg cápsulas duras
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada cápsula dura contiene 100 mg de temozolomida (temozolomide).
Excipiente con efecto conocido:
Cada cápsula dura contiene 175,7 mg de lactosa anhidra.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Cápsula dura (cápsula).
Las cápsulas duras tienen un cuerpo blanco opaco, una tapa rosa opaca, y están impresas con tinta negra. La tapa lleva impreso “Temodal”. El cuerpo lleva impreso “100 mg”, el logo de Schering-Plough y dos rayas.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Temodal está indicado en el tratamiento de:
- pacientes adultos con glioblastoma multiforme de nuevo diagnóstico concomitante con radioterapia (RT) y posteriormente como tratamiento en monoterapia.
- niños a partir de tres años de edad, adolescentes y pacientes adultos con glioma maligno, tal como glioblastoma multiforme o astrocitoma anaplásico, que presentan recurrencia o progresión después de terapia estándar.
4.2 Posología y forma de administración
Temodal sólo debe ser prescrito por médicos con experiencia en el tratamiento oncológico de tumores cerebrales.
Puede administrarse terapia antiemética (ver sección 4.4).
Posología
Pacientes adultos con glioblastoma multiforme de nuevo diagnóstico
Temodal se administra en combinación con radioterapia focal (fase concomitante) seguido de hasta 6 ciclos de monoterapia con temozolomida (TMZ) (fase de monoterapia).
Fase concomitante
Se administra TMZ a una dosis de 75 mg/m2 al día por vía oral durante 42 días como tratamiento concomitante a la radioterapia focal (60 Gy administrados en 30 fracciones). No se recomiendan reducciones de dosis, pero se decidirá semanalmente el retraso o la suspensión de la administración de TMZ de acuerdo a los criterios de toxicidad hematológica y no hematológica. La administración de TMZ se puede continuar durante todo el periodo concomitante de 42 días (hasta 49 días) si se cumplen todas y cada una de las siguientes condiciones:
- recuento absoluto de neutrófilos (RAN) > 1,5 x 109/l
- recuento de trombocitos > 100 x 109/l
- toxicidad no hematológica según los criterios de toxicidad común (CTC) < Grado 1 (excepto para alopecia, náuseas y vómitos).
Durante el tratamiento se deberá realizar semanalmente un hemograma completo. La administración de TMZ se deberá interrumpir o suspender permanentemente durante la fase concomitante de acuerdo a los criterios de toxicidad hematológica y no hematológica según la Tabla 1.
|
Tabla 1. Interrupción o suspensión de la dosificación con TMZ durante el tratamiento concomitante de radioterapia y TMZ | ||
|
Toxicidad |
Interrupción de TMZa |
Suspensión de TMZ |
|
Recuento Absoluto de Neutrófilos |
> 0,5 y < 1,5 x 109/l |
< 0,5 x 109/l |
|
Recuento de Trombocitos |
> 10 y < 100 x 109/l |
< 10 x 109/l |
|
Toxicidad no hematológica según CTC (excepto para alopecia, náuseas y vómitos) |
Grado 2 según CTC |
Grado 3 ó 4 según CTC |
a: El tratamiento con TMZ concomitante se puede continuar si se cumplen todas y cada una de las siguientes condiciones: recuento absoluto de neutrófilos > 1,5 x 109/l, recuento de trombocitos > 100 x 109/l, toxicidad no hematológica según CTC < Grado 1 (excepto para alopecia, náuseas y vómitos).
Fase de monoterapia
Cuatro semanas después de completar la fase concomitante de TMZ + RT, se administran hasta 6 ciclos de TMZ en monoterapia. La dosis en el Ciclo 1 (monoterapia) es de 150 mg/m2 una vez al día, durante 5 días, seguido de 23 días sin tratamiento. Al principio del Ciclo 2, la dosis se aumenta a 200 mg/m2 si la toxicidad no hematológica según CTC en el Ciclo 1 es de Grado < 2 (excepto para alopecia, náuseas y vómitos), el recuento absoluto de neutrófilos (RAN) es > 1,5 x 109/l y el recuento de trombocitos > 100 x 109/l. Si la dosis no se aumentó en el Ciclo 2, no se deberá aumentar la dosis en los ciclos posteriores. Si se aumentó la dosis, se mantiene a 200 mg/m2 al día durante los primeros 5 días de cada ciclo posterior, excepto si se produce toxicidad. Las reducciones y suspensiones de dosis durante la fase de monoterapia se deberán realizar de acuerdo a las Tablas 2 y 3.
Durante el tratamiento se deberá realizar un hemograma completo en el Día 22 (21 días después de la primera dosis de TMZ). La dosis se reducirá o se suspenderá la administración de acuerdo a la Tabla 3.
|
Tabla 2. Niveles de dosis de TMZ para el tratamiento en monoterapia | ||
|
Nivel de dosis |
Dosis de TMZ (mg/m2/día) |
Observaciones |
|
-1 |
100 |
Reducción por toxicidad previa |
|
0 |
150 |
Dosis durante el Ciclo 1 |
|
1 |
200 |
Dosis durante los Ciclos 2-6 en ausencia de toxicidad |
|
Tabla 3. Reducción o suspensión de la dosis de TMZ durante el tratamiento en monoterapia | ||
|
Toxicidad |
Reducir TMZ 1 nivel de dosisa |
Suspender TMZ |
|
Recuento absoluto de neutrófilos |
< 1,0 x 109/l |
Ver nota b |
|
Recuento de trombocitos |
< 50 x 109/l |
Ver nota b |
|
Toxicidad no hematológica según CTC (excepto para alopecia, náuseas y vómitos) |
Grado 3 según CTC |
Grado 4b según CTC |
a: Los niveles de dosis de TMZ aparecen en la Tabla 2. b: Se suspende TMZ si:
• El nivel de dosis -1 (100 mg/m2) todavía provoca toxicidad inaceptable
• La misma toxicidad no hematológica de Grado 3 (excepto para alopecia, náuseas, vómitos) vuelve a aparecer tras la reducción de dosis.
Pacientes adultos y _pediátricos de 3 años de edad o mayores con glioma maligno recurrente o progresivo:
Un ciclo de tratamiento es de 28 días. En pacientes no tratados previamente con quimioterapia, TMZ se administra por vía oral a la dosis de 200 mg/m2 una vez al día durante los primeros 5 días seguido de una interrupción del tratamiento de 23 días (un total de 28 días). En los pacientes tratados previamente con quimioterapia, la dosis inicial es de 150 mg/m2 una vez al día, que debe incrementarse en el segundo ciclo a 200 mg/m2 una vez al día, durante 5 días si no apareciera toxicidad hematológica (ver sección 4.4).
Poblaciones especiales
Población pediátrica
En pacientes de edad igual o superior a 3 años, sólo debe usarse TMZ en glioma maligno recurrente o progresivo. La experiencia en estos niños es muy limitada (ver secciones 4.4 y 5.1). No se ha establecido la seguridad y la eficacia de TMZ en niños menores de 3 años. No se dispone de datos.
Pacientes con disfunción hepática o renal
La farmacocinética de la TMZ fue comparable en pacientes con función hepática normal y en aquellos con disfunción hepática leve o moderada. No hay datos disponibles sobre la administración de TMZ a pacientes con disfunción hepática grave (Clase C de Child) o con disfunción renal. En base a las propiedades farmacocinéticas de la TMZ, es improbable que se requieran reducciones de dosis en pacientes con disfunción hepática grave o cualquier grado de disfunción renal. Sin embargo, se debe tener precaución al administrar TMZ a estos pacientes.
Pacientes de edad avanzada
En base al análisis farmacocinético en pacientes de 19-78 años de edad, el aclaramiento de TMZ no se ve afectado por la edad. Sin embargo, los pacientes de edad avanzada (> 70 años de edad) parecen tener un aumento en el riesgo de neutropenia y trombocitopenia (ver sección 4.4).
Forma de administración
Temodal cápsulas duras debe administrarse en estado de ayuno.
Las cápsulas deben tragarse enteras con un vaso de agua y no deben abrirse o masticarse.
Si después de la administración de la dosis se produce vómito, no debe administrarse una segunda dosis ese día.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a algunos de los excipientes incluidos en la sección 6.1. Hipersensibilidad a la dacarbazina (DTIC).
Mielosupresión severa (ver sección 4.4).
4.4 Advertencias y precauciones especiales de empleo
Infecciones oportunistas y reactivación de infecciones
Durante el tratamiento con TMZ, se han observado infecciones oportunistas (como neumonía por Pneumocystis jirovecii) y reactivación de infecciones (como VHB, CMV) (ver sección 4.8).
Los pacientes que recibieron concomitantemente TMZ y RT en un ensayo piloto durante el régimen prolongado de 42 días presentaron un especial riesgo de desarrollar neumonía por Pneumocystis jirovecii (PCP). Por lo tanto, se requiere profilaxis frente a PCP en todos los pacientes que reciban concomitantemente TMZ y RT durante el régimen de 42 días (hasta un máximo de 49 días) con independencia del recuento de linfocitos. Si se produce linfopenia, deben continuar con la profilaxis hasta que la recuperación de la linfopenia sea de un grado < 1.
Puede haber una mayor incidencia de PCP cuando se administra TMZ durante un régimen de dosificación más largo. No obstante, todos los pacientes que reciban TMZ, en especial los pacientes que reciban esteroides, deberán ser vigilados estrechamente en cuanto al desarrollo de PCP con independencia del régimen. Se han notificado casos de insuficiencia respiratoria mortal en pacientes en tratamiento con TMZ, en particular en combinación con dexametasona u otros esteroides.
VHB
Se ha notificado hepatitis debida a una reactivación del virus de la hepatitis B (VHB), resultando en algunos casos mortal. Se debe consultar a los expertos en enfermedades hepáticas antes de iniciar el tratamiento en pacientes con serología para la hepatitis B positiva (incluyendo aquellos pacientes con la enfermedad activa). Durante el tratamiento, los pacientes deben ser controlados y tratados como corresponda.
Hepatotoxicidad
Se han notificado lesiones hepáticas incluyendo insuficiencia hepática mortal en pacientes tratados con TMZ (ver sección 4.8). Se deben determinar los valores basales de la función hepática antes de iniciar el tratamiento. Si fueran anómalos, el médico debe evaluar el beneficio/riesgo antes de iniciar el tratamiento con temozolamida, incluyendo el riesgo potencial de insuficiencia hepática mortal. En pacientes en un ciclo de tratamiento de 42 días, las pruebas se deben repetir en mitad del ciclo. En todos los pacientes, las pruebas de la función hepática se deben repetir después de cada ciclo de tratamiento. El médico debe evaluar el beneficio/riesgo de continuar el tratamiento en pacientes con anomalías significativas de la función hepática. La toxicidad hepática puede aparecer varias semanas o más, después del último tratamiento con temozolomida.
Neoplasias malignas
También se han observado casos muy raros de síndrome mielodisplásico y neoplasias secundarias, incluyendo leucemia mieloide (ver sección 4.8).
Terapia antiemética
Las náuseas y los vómitos se asocian muy frecuentemente con TMZ.
Se puede administrar la terapia antiemética antes o después de la administración de TMZ.
Pacientes adultos con glioblastoma multiforme de nuevo diagnóstico
Se recomienda profilaxis antiemética antes de la dosis inicial de la fase concomitante, y se recomienda encarecidamente durante la fase de monoterapia.
Pacientes con glioma maligno recurrente o progresivo
Los pacientes que hayan experimentado fuertes vómitos (Grado 3 ó 4) en ciclos de tratamiento previos pueden precisar tratamiento antiemético.
Parámetros de laboratorio
Los pacientes en tratamiento con TMZ pueden presentar mielosupresión, incluyendo pancitopenia prolongada, que puede derivar en anemia aplásica que, en ciertos casos, puede terminar en fallecimiento. En algunos casos, la exposición a medicamentos concomitantes asociados a la anemia aplásica, tales como carbamazepina, fenitoína y sulfametoxazol/trimetoprima complica la valoración. Antes de la administración, deberán cumplirse los siguientes parámetros de laboratorio: RAN > 1,5 x 109/1 y recuento de plaquetas > 100 x 109/l. Deberá practicarse un hemograma completo el Día 22 (21 días después de la primera dosis) o dentro de las 48 horas de dicho día, y una vez a la semana hasta que el RAN sea > 1,5 x 109/l y el recuento de plaquetas sea > 100 x 109/l. Si el RAN disminuyera a < 1,0 x 109/l o el recuento de plaquetas fuera < 50 x 109/l durante cualquier ciclo, se disminuirá un nivel de dosis en el siguiente ciclo (ver sección 4.2). Los niveles de dosis son de 100 mg/m2, 150 mg/m2 y 200 mg/m2. La dosis más baja recomendada es de 100 mg/m2.
Población pediátrica
No hay experiencia clínica sobre el empleo de TMZ en niños menores de 3 años de edad. La experiencia en niños mayores y adolescentes es muy limitada (ver sección 4.2 y 5.1).
Pacientes de edad avanzada (> 70 años de edad)
Los pacientes de edad avanzada parecen presentar un mayor riesgo de neutropenia y trombocitopenia que los pacientes más jóvenes. Por lo tanto, se debe tener precaución especial cuando se administre TMZ a pacientes de edad avanzada.
Pacientes varones
Debe advertirse a los hombres que vayan a ser tratados con TMZ que eviten dejar embarazada a su pareja durante los 6 meses posteriores al tratamiento y que busquen asesoramiento sobre crioconservación del esperma antes del tratamiento (ver sección 4.6).
Lactosa
Este medicamento contiene lactosa. Los pacientes con intolerancia hereditaria a galactosa, insuficiencia de lactasa de Lapp o malabsorción de glucosa o galactosa no deben tomar este medicamento.
4.5 Interacción con otros medicamentos y otras formas de interacción
En otro estudio en fase I, la administración de TMZ con ranitidina no provocó modificaciones del grado de absorción de la temozolomida o de la exposición a su metabolito activo monometil triazenoimidazol carboxamida (MTIC).
La administración de TMZ con los alimentos resultó en una disminución del 33 % de la Cmax y en una disminución del 9 % del área bajo la curva (AUC).
Como no se puede excluir que el cambio en la Cmax sea clínicamente importante, Temodal no debe administrarse junto a alimentos.
En base a un análisis de la farmacocinética de población observado en ensayos en fase II, la coadministración de dexametasona, proclorperazina, fenitoína, carbamazepina, ondansetrón, antagonistas de los receptores H2 o fenobarbital no modificó la eliminación de la TMZ. Se asoció la coadministración de ácido valproico con una pequeña pero estadísticamente significativa disminución del aclaramiento de TMZ.
No se han llevado a cabo estudios para determinar el efecto de TMZ sobre el metabolismo o eliminación de otros fármacos. No obstante, dado que TMZ no experimenta metabolismo hepático y muestra una baja unión a proteínas, es improbable que afecte a la farmacocinética de otros medicamentos (ver sección 5.2).
El empleo de TMZ en combinación con otros agentes mielosupresores puede aumentar la probabilidad de mielosupresión.
Población pediátrica
Los estudios de interacciones se han realizado sólo en adultos.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No hay datos en mujeres embarazadas. En los estudios preclínicos en ratas y conejos tratados con 150 mg/m2 de TMZ se observó teratogenia y/o toxicidad fetal (ver sección 5.3).
Temodal no debe administrarse a mujeres embarazadas. Si se debe considerar su uso durante el embarazo, la paciente debe ser informada del riesgo potencial para el feto.
Lactancia
Se desconoce si TMZ se excreta en la leche materna; por tanto, se debe interrumpir la lactancia durante el tratamiento con TMZ.
Mujeres en edad fértil
Se debe aconsejar a las mujeres en edad fértil el uso de un método anticonceptivo eficaz para evitar el embarazo mientras estén en tratamiento con TMZ.
Fertilidad masculina
TMZ puede tener efectos genotóxicos. Por lo tanto, se advierte a los hombres que vayan a ser tratados con ella que eviten dejar embarazada a su pareja hasta que hayan transcurrido 6 meses desde la última dosis y que busquen asesoramiento sobre crioconservación del esperma antes del tratamiento dada la posibilidad de infertilidad irreversible debido a la terapia con TMZ.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
TMZ tiene una influencia baja sobre la capacidad para conducir y utilizar máquinas debido a la fatiga y somnolencia (ver sección 4.8).
4.8 Reacciones adversas
Experiencia de ensayos clínicos
En pacientes tratados con TMZ, ya sea en combinación con RT o como monoterapia tras RT para glioblastoma multiforme de nuevo diagnóstico o como monoterapia en pacientes con glioma recurrente o progresivo, las reacciones adversas muy frecuentes notificadas fueron similares: náuseas, vómitos, estreñimiento, anorexia, cefalea y fatiga. Se notificaron de manera muy frecuente convulsiones en pacientes con glioblastoma multiforme de nuevo diagnóstico que recibieron monoterapia, y se notificó sarpullido muy frecuentemente en pacientes con glioblastoma multiforme de nuevo diagnóstico que recibieron TMZ en combinación con RT y también en monoterapia, y se notificó frecuentemente en glioma recurrente. La mayoría de las alteraciones de parámetros hematológicos se notificaron, según lo esperado, como frecuentes o muy frecuentes en ambas indicaciones (Tablas 4 y 5); después de cada tabla se recogen las frecuencias relativas a los parámetros de laboratorio de grados 3 y 4.
En las tablas, los efectos adversos se clasifican según la clasificación por órganos y sistemas y la frecuencia. Los grupos de frecuencia se definen según la siguiente convención: Muy frecuentes (> 1/10); Frecuentes (> 1/100 a < 1/10); Poco frecuentes (> 1/1.000 a < 1/100); Raras (> 1/10.000 a < 1/1.000); Muy raras (< 1/10.000). Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
Glioblastoma multiforme de nuevo diagnóstico
La Tabla 4 incluye reacciones adversas derivadas del tratamiento en pacientes con glioblastoma multiforme de nuevo diagnóstico durante las fases de tratamiento concomitante y en monoterapia.
|
Tabla 4. Acontecimientos derivados del tratamiento durante las fases de tratamiento concomitante y en monoterapia en pacientes con glioblastoma multiforme de nuevo diagnóstico | ||
|
Clasificación por órganos y sistemas |
TMZ + radioterapia concomitante n=288* |
TMZ en monoterapia n=224 |
|
Infecciones e infestaciones | ||
|
Frecuentes: |
Infección, herpes simple, infección de una herida, faringitis, candidiasis oral |
Infección, candidiasis oral |
|
Poco frecuentes: |
Herpes simple, herpes zoster, síntomas pseudogripales | |
|
Trastornos de la sangre y del sistema linfático | ||
|
Frecuentes: |
Neutropenia, trombocitopenia, linfopenia, leucopenia |
Neutropenia febril, trombocitopenia, anemia, leucopenia |
|
Poco frecuentes: |
Neutropenia febril, anemia |
Linfopenia, petequia |
|
Trastornos endocrinos | ||
|
Poco frecuentes: |
Cushingoide |
Cushingoide |
|
Trastornos del metabolismo y de la nutrición | ||
|
Muy frecuentes: |
Anorexia |
Anorexia |
|
Frecuentes: |
Hiperglucemia, pérdida de peso |
Pérdida de peso |
|
Poco frecuentes: |
Hipopotasemia, aumento de la fosfatasa alcalina, aumento de peso |
Hiperglucemia, aumento de peso |
|
Trastornos psiquiátricos | ||
|
Frecuentes: |
Ansiedad, labilidad emocional, insomnio |
Ansiedad, depresión, labilidad emocional, insomnio |
|
Poco frecuentes: |
Agitación, apatía, alteración del comportamiento, depresión, alucinaciones |
Alucinaciones, amnesia |
|
Trastornos del sistema nervioso | ||
|
Muy frecuentes: |
Cefalea |
Convulsiones, cefalea |
|
Frecuentes: |
Convulsiones, pérdida de conocimiento, somnolencia, afasia, alteración del equilibrio, mareo, confusión, pérdida de memoria, disminución de la concentración, neuropatía, parestesia, trastorno en el habla, temblor |
Hemiparesia, afasia, alteración del equilibrio, somnolencia, confusión, mareo, pérdida de memoria, disminución de la concentración, disfasia, trastorno neurológico (NOS), neuropatía, neuropatía periférica, parestesia, trastorno en el habla, temblor |
|
Poco frecuentes: |
Status epilepticus, trastorno extrapiramidal, hemiparesia, ataxia, trastorno cognitivo, disfasia, trastorno de la marcha, hiperestesia, hipoestesia, trastorno neurológico (NOS), neuropatía periférica |
Hemiplejía, ataxia, alteración en la coordinación, trastorno de la marcha, hiperestesia, trastorno sensorial |
|
Trastornos oculares | ||
|
Frecuentes: |
Visión borrosa |
Defecto en el campo visual, visión borrosa, diplopía |
|
Poco frecuentes: |
Hemianopsia, disminución de la agudeza visual, trastorno en la visión, defecto en el campo visual, dolor ocular |
Disminución de la agudeza visual, dolor ocular, sequedad ocular |
|
Trastornos del oído y del laberinto | ||
|
Frecuentes: |
Trastorno en la audición |
Trastorno en la audición, tinnitus |
|
Poco frecuentes: |
Otitis media, tinnitus, hiperacusia, otalgia |
Sordera, vértigo, otalgia |
|
Trastornos cardiacos | ||
|
Poco frecuentes: |
Palpitaciones | |
|
Trastornos vasculares | ||
|
Frecuentes: |
Hemorragia, edema, edema de piernas |
Hemorragia, trombosis venosa profunda, edema de piernas |
|
Poco frecuentes: |
Hemorragia cerebral, hipertensión |
Embolismo pulmonar, edema, edema periférico |
|
Trastornos respiratorios, torácicos y mediastínicos | ||
|
Frecuentes: |
Disnea, tos |
Disnea, tos |
|
Poco frecuentes: |
Neumonía, infección respiratoria superior, congestión nasal |
Neumonía, sinusitis, infección respiratoria superior, bronquitis |
|
Trastornos gastrointestinales | ||
|
Muy frecuentes: |
Estreñimiento, náuseas, vómitos |
Estreñimiento, náuseas, vómitos |
|
Frecuentes: |
Estomatitis, diarrea, dolor abdominal, dispepsia, disfagia |
Estomatitis, diarrea, dispepsia, disfagia, sequedad de boca |
|
Poco frecuentes: |
Distensión abdominal, incontinencia fecal, trastorno gastrointestinal (NOS), gastroenteritis, hemorroides | |
|
Trastornos de la piel y del tejido subcutáneo | ||
|
Muy frecuentes: |
Sarpullido, alopecia |
Sarpullido, alopecia |
|
Frecuentes: |
Dermatitis, sequedad cutánea, eritema, prurito |
Sequedad cutánea, prurito |
|
Poco frecuentes: |
Exfoliación cutánea, reacción de fotosensibilidad, alteración en la pigmentación |
Eritema, alteración en la pigmentación, aumento de la sudoración |
|
Trastornos musculoesqueléticos y del tejido conjuntivo | ||
|
Frecuentes: |
Debilidad muscular, artralgia |
Debilidad muscular, artralgia, dolor musculoesquelético, mialgia |
|
Poco frecuentes: |
Miopatía, dolor de espalda, dolor musculoesquelético, mialgia |
Miopatía, dolor de espalda |
|
Trastornos renales y urinarios | ||
|
Frecuentes: |
Polaquiuria, incontinencia urinaria |
Incontinencia urinaria |
|
Poco frecuentes: |
Disuria | |
|
Trastornos del aparato reproductor y de la mama | ||
|
Poco frecuentes: |
Impotencia |
Hemorragia vaginal, menorragia, amenorrea, vaginitis, dolor de mama |
|
Trastornos generales y alteraciones en el lugar de administración | ||
|
Muy frecuentes: |
Fatiga |
Fatiga |
|
Frecuentes: |
Reacción alérgica, fiebre, lesión por radiación, edema facial, dolor, alteración del gusto |
Reacción alérgica, fiebre, lesión por radiación, dolor, alteración del gusto |
|
Poco frecuentes: |
Astenia, rubor, sofocos, empeoramiento de una enfermedad, escalofríos, cambio de color de la lengua, parosmia, sed |
Astenia, edema facial, dolor, empeoramiento de una enfermedad, escalofríos, trastorno dental |
|
Exploraciones complementarias | ||
|
Frecuentes: |
Aumento de ALT |
Aumento de ALT |
|
Poco frecuentes: |
Aumento de enzimas hepáticas, aumento de Gamma GT, aumento de AST | |
*Un paciente que se aleatorizó al brazo de RT únicamente, recibió TMZ + RT.
Resultados de laboratorio
Se observó mielosupresión (neutropenia y trombocitopenia), que es toxicidad limitante de dosis conocida para la mayoría de los agentes citotóxicos, incluido TMZ. Cuando las alteraciones en las pruebas de laboratorio y las reacciones adversas se sumaron entre las fases de tratamiento concomitante y en monoterapia, se observaron alteraciones en neutrófilos de Grado 3 o de Grado 4, incluyendo acontecimientos neutropénicos, en el 8 % de los pacientes. Se observaron alteraciones en los trombocitos de Grado 3 o Grado 4, incluyendo acontecimientos trombocitopénicos en el 14 % de los pacientes que recibieron TMZ.
Glioma maligno recurrente o progresivo
En los ensayos clínicos, las reacciones adversas que se produjeron más frecuentemente relacionadas con el tratamiento fueron los trastornos gastrointestinales, concretamente náuseas (43 %) y vómitos (36 %). Estas reacciones fueron normalmente de Grado 1 ó 2 (0-5 episodios de vómitos en 24 horas) y se autolimitaron o controlaron rápidamente con tratamiento antiemético estándar. La incidencia de náuseas y vómitos intensos fue del 4 %.
La Tabla 5 incluye reacciones adversas notificadas durante ensayos clínicos en glioma maligno recurrente o progresivo y después de la comercialización de Temodal.
_Tabla 5. Reacciones adversas en pacientes con glioma maligno recurrente o progresivo
Infecciones e infestaciones
Raras:
Infecciones oportunistas, incluyendo PCP
|
Trastornos de la sangre y del sistema linfático | |
|
Muy frecuentes: |
Neutropenia o linfopenia (grado 3-4), trombocitopenia (grado 3-4) |
|
Poco frecuentes: |
Pancitopenia, anemia (grado 3-4), leucopenia |
|
Trastornos del metabolismo y de la nutrición | |
|
Muy frecuentes: |
Anorexia |
|
Frecuentes: |
Pérdida de peso |
|
Trastornos del sistema nervioso | |
|
Muy frecuentes: |
Cefalea |
|
Frecuentes: |
Somnolencia, mareo, parestesia |
|
Trastornos respiratorios, torácicos y mediastínicos | |
|
Frecuentes: |
Disnea |
|
Trastornos gastrointestinales | |
|
Muy frecuentes: |
Vómitos, náuseas, estreñimiento |
|
Frecuentes: |
Diarrea, dolor abdominal, dispepsia |
|
Trastornos de la piel y del tejido subcutáneo | |
|
Frecuentes: |
Sarpullido, prurito, alopecia |
|
Muy raros: |
Eritema multiforme, eritrodermia, urticaria, exantema |
|
Trastornos generales y alteraciones en el lugar de administración | |
|
Muy frecuentes: |
Fatiga |
|
Frecuentes: |
Fiebre, astenia, escalofríos, malestar general, dolor, alteraciones en el gusto |
|
Muy raras: |
Reacciones alérgicas, incluyendo anafilaxia, angioedema |
Resultados de laboratorio
Se produjeron trombocitopenia y neutropenia de Grados 3 ó 4 en el 19 % y 17 %, respectivamente, de los pacientes tratados por glioma maligno. Esto provocó la hospitalización y/o interrupción del tratamiento con TMZ en el 8 % y 4 %, respectivamente. La mielosupresión fue previsible (normalmente dentro de los primeros ciclos, con el valor más bajo de parámetros hematológicos (nadir) entre el Día 21 y el Día 28), y la recuperación fue rápida, generalmente en 1-2 semanas. No se observó evidencia de una mielosupresión de tipo acumulativo. La presencia de trombocitopenia puede incrementar el riesgo de hemorragia, y la presencia de neutropenia o leucopenia puede incrementar el riesgo de infección.
Género
En un análisis de farmacocinética basada en la población sobre la experiencia en ensayos clínicos se disponía de los datos del nadir de los recuentos de neutrófilos para 101 mujeres y 169 hombres, y del nadir de plaquetas para 110 mujeres y 174 hombres. En el primer ciclo de terapia hubo tasas más altas de neutropenia de Grado 4 (RAN < 0,5 x 109/l), 12 % frente al 5 %, y trombocitopenia (< 20 x 109/l),
9 % frente al 3 %, en mujeres que en hombres. En una serie de datos de 400 pacientes con glioma recurrente, tras el primer ciclo de terapia, se produjo neutropenia de Grado 4 en el 8 % de las mujeres frente al 4 % de los hombres, y trombocitopenia de Grado 4 en el 8 % de las mujeres frente al 3 % de los hombres. En un ensayo con 288 pacientes con glioblastoma multiforme de nuevo diagnóstico, se produjo, en el primer ciclo de terapia, neutropenia de Grado 4 en el 3 % de las mujeres frente al 0 % de los hombres, y trombocitopenia de Grado 4 en el 1 % de las mujeres frente al 0 % de los hombres.
Población pediátrica
Se ha estudiado TMZ por vía oral en pacientes pediátricos (edad 3-18 años) con glioma recurrente del tronco encefálico o astrocitoma de alto grado recurrente, en un régimen de administración diaria durante 5 días cada 28 días. Aunque los datos son limitados, cabe esperar que la tolerancia en niños sea similar a la de los adultos. No se ha determinado la seguridad de TMZ en niños menores de 3 años.
Experiencia postcomercialización
Se han identificado las siguientes reacciones adversas graves durante la exposición postcomercialización:
|
Tabla 6. Resumen de los acontecimientos notificados con temozolomida en la postcomercialización | |
|
Infecciones e infestaciones* | |
|
Poco frecuentes: |
infección por citomegalovirus, reactivación de infección de tipo citomegalovirus, virus hepatitis B1 |
|
Trastornos de la sangre y del sistema linfático | |
|
Muy raras: |
pancitopenia prolongada, anemia aplásica1 |
|
Neoplasias benignas, malignas y no especificadas | |
|
Muy raras: |
síndrome mielodisplásico, tumores malignos secundarios, incluyendo leucemia mieloide |
|
Trastornos endocrinos* | |
|
Poco frecuentes: |
diabetes insípida |
|
Trastornos respiratorios, torácicos y mediastínicos | |
|
Muy raras: |
neumonitis intersticial/neumonitis, fibrosis pulmonar, insuficiencia respiratoria1 |
|
Trastornos hepatobiliares* | |
|
Frecuentes: |
enzimas hepáticas aumentadas |
|
Poco frecuentes: |
hiperbilirrubinemia, colestasis, hepatitis, lesión hepática, insuficiencia hepática1 |
|
Trastornos de la piel y del tejido subcutáneo | |
|
Muy raras: |
necrolisis epidérmica tóxica, syndrome de Stevens-Johnson |
1 Incluyendo casos con desenlace mortal Frecuencias estimadas a partir de los ensayos clínicos pertinentes.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Anexo V.
4.9 Sobredosis
Se han evaluado clínicamente en pacientes dosis de 500, 750, 1.000 y 1.250 mg/m2 (dosis total por ciclo de 5 días). La toxicidad limitante de dosis fue hematológica y se notificó con todas las dosis, pero se espera que sea más grave a dosis más altas. Un paciente recibió una sobredosis de 10.000 mg (dosis total por ciclo de 5 días) y las reacciones adversas que se notificaron fueron pancitopenia, pirexia, fracaso multiorgánico y muerte. Se han notificado casos de pacientes que han tomado la dosis recomendada durante más de 5 días de tratamiento (hasta 64 días) notificándose reacciones adversas como supresión de médula ósea, con o sin infección, en algunos casos grave y prolongada, con resultado de muerte. En caso de sobredosis, es necesaria una evaluación hematológica. Se deben tomar medidas generales de soporte si fuera necesario.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Agentes antineoplásicos - Otros agentes alquilantes, código ATC: L01A X03.
Mecanismo de acción
La temozolomida es un triazeno, que a pH fisiológico sufre una rápida conversión química a la monometil tiazenoimidazol carboxamida activa (MTIC). Se considera que la citotoxicidad del MTIC es consecuencia, fundamentalmente, de una alquilación en la posición O6 de la guanina, con una alquilación adicional que se produce en la posición N7. Se considera que las lesiones citotóxicas que se desarrollan posteriormente conllevan una reparación aberrante del metilo añadido.
Eficacia clínica y seguridad
Glioblastoma multiforme de nuevo diagnóstico
Se aleatorizaron un total de 573 pacientes para recibir o TMZ + RT (n=287) o RT sola (n=286). Los pacientes del brazo de TMZ + RT recibieron TMZ concomitante (75 mg/m2) una vez al día, empezando el primer día de RT hasta el último día de RT, durante 42 días (hasta un máximo de 49 días). Este tratamiento iba seguido de TMZ en monoterapia (150 - 200 mg/m2) en los Días 1 - 5 de cada ciclo de 28 días, hasta 6 ciclos, empezando 4 semanas después de la finalización de la RT. Los pacientes del brazo control sólo recibieron RT. Se necesitó profilaxis frente a neumonía por Pneumocystis jirovecii (PCP) durante la RT y la terapia combinada con TMZ.
En la fase de seguimiento se administró TMZ como terapia de rescate en 161 pacientes de los 282 (57 %) del brazo de RT sola, y en 62 pacientes de los 277 (22 %) del brazo de TMZ + RT.
El hazard ratio (HR) para la supervivencia global fue de 1,59 (95 % IC para HR=1,33 -1,91) con un rango logarítmico de p < 0,0001 a favor del brazo de TMZ. La probabilidad estimada de sobrevivir 2 o más años (26 % frente a 10 %) es mayor para el brazo de RT + TMZ. La adición de TMZ concomitante a la RT, seguida de TMZ en monoterapia en el tratamiento de pacientes con glioblastoma multiforme de nuevo diagnóstico, demostró una mejoría en la supervivencia global (SG) estadísticamente significativa en comparación con la RT sola (Figura 1).
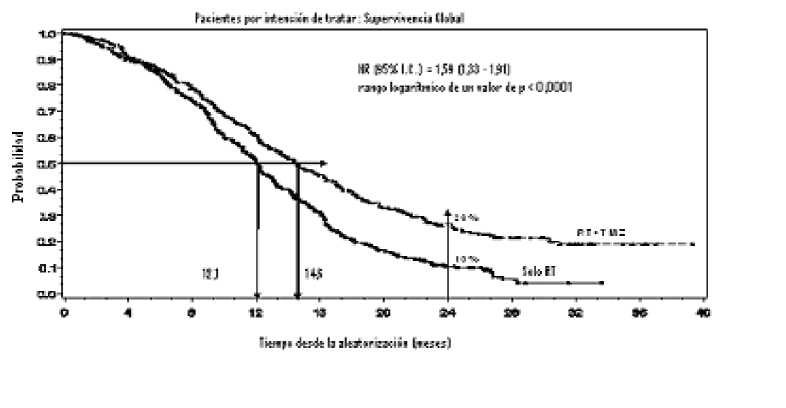
Figura 1 Curvas de Kaplan-Meier para la supervivencia global (población por intención de
tratar)
Los resultados del ensayo no fueron coherentes en el subgrupo de pacientes con un estado funcional bajo (Performance Status OMS PS =2, n=70), en el que la supervivencia global y el tiempo hasta la progresión fueron similares en ambos brazos. No obstante, este grupo de pacientes no parece presentar riesgos inaceptables.
Los datos sobre eficacia clínica en pacientes con glioblastoma multiforme (índice de estado funcional de Karnofsky [KPS] > 70), progresivo o recurrente, después de cirugía y RT se basaron en dos ensayos clínicos con TMZ oral. Uno fue un ensayo no comparativo sobre 138 pacientes (el 29 % recibió quimioterapia previa), y el otro fue un ensayo aleatorizado con brazo control activo de TMZ frente a procarbazina sobre un total de 225 pacientes (el 67 % recibió tratamiento previo con quimioterapia basada en nitrosourea). En ambos ensayos, la variable principal de valoración fue la supervivencia libre de progresión (SLP) definida por los escáneres de IRM o empeoramiento neurológico. En el ensayo no comparativo, la SLP a los 6 meses fue del 19 %, la mediana de la SLP fue de 2,1 meses, y la mediana de la supervivencia global de 5,4 meses. La tasa de respuesta objetiva (ORR) en base a las IRM fue del 8 %.
En el ensayo aleatorizado de brazo control activo, la SLP a los 6 meses fue significativamente mayor para TMZ que para la procarbazina (21 % frente al 8 %, respectivamente - prueba de chi-cuadrado p= 0,008) con una mediana de la SLP de 2,89 y 1,88 meses respectivamente (Test de rango logarítmico, p = 0,0063). La mediana de la supervivencia fue de 7,34 y 5,66 meses para TMZ y procarbazina, respectivamente (rango logarítmico de p = 0,33). A los 6 meses la fracción de pacientes que sobrevivieron fue significativamente superior en el brazo de TMZ (60 %) en comparación con el brazo de procarbazina (44 %) (prueba de chi-cuadrado p = 0,019). En los pacientes que recibieron quimioterapia previa se observó un beneficio en aquellos con un KPS > 80.
Los datos sobre el tiempo hasta el empeoramiento del estado neurológico favorecieron a TMZ sobre la procarbazina, al igual que los datos sobre el tiempo hasta el empeoramiento del estado funcional (decrece hasta KPS de < 70 o decrece al menos 30 puntos). En estas variables de valoración la mediana del tiempo hasta progresión osciló entre los 0,7 y 2,1 meses más para TMZ que para la procarbazina (Test de rango logarítmico, p = < 0,01 a 0,03).
Astrocitoma anaplásico recurrente
En un ensayo de fase II, multicéntrico y prospectivo, dirigido a evaluar la seguridad y la eficacia de la TMZ oral en el tratamiento de pacientes con un astrocitoma anaplásico en su primera recaída, la SLP a los 6 meses fue del 46 %. La mediana de la SLP fue de 5,4 meses. La mediana de la supervivencia global fue de 14,6 meses. La tasa de respuesta, basada en la evaluación practicada por un revisor central, fue del 35 % (13 RC y 43 RP) en la población analizada por intención de tratar (ITT) n=162.
Se comunicó enfermedad estable en 43 pacientes. La supervivencia libre de episodios a los 6 meses en la población analizada por ITT fue del 44 %, con una mediana de la supervivencia libre de episodios de 4,6 meses, cifra que fue similar a la hallada en la supervivencia libre de progresión de la enfermedad. En la población elegible desde el punto de vista de la histología, los resultados de eficacia fueron similares. El alcance de una respuesta objetiva radiológica o el mantenimiento del estado libre de progresión de la enfermedad se asoció firmemente al mantenimiento o la mejoría de la calidad de vida.
Población pediátrica
Se ha estudiado TMZ por vía oral en pacientes pediátricos (edad 3-18 años) con glioma recurrente del tronco encefálico o astrocitoma de alto grado recurrente, en un régimen de administración diaria durante 5 días cada 28 días. La tolerancia a TMZ es similar a la de los adultos.
5.2 Propiedades farmacocinéticas
TMZ se hidroliza espontáneamente a pH fisiológico principalmente a los metabolitos activos, 3-metil(triazeno-1-il)imidazol-4-carboxamida (MTIC). MTIC se hidroliza espontáneamente a 5-amino-imidazol-4-carboxamida (AIC), un conocido intermediario en la biosíntesis de purinas y ácidos nucleicos, y a metilhidrazina, que se cree que es el metabolito alquilante activo. Se cree que la citotoxicidad de MTIC se debe fundamentalmente a la alquilación del ADN principalmente en las
posiciones O6 y N7 de la guanina. En relación al AUC de temozolomida, la exposición a MTIC y AIC es ~ 2,4 % y 23 %, respectivamente. In vivo, el t1/2 de MTIC fue similar a la de TMZ, 1,8 h..
Absorción
Tras la administración oral a pacientes adultos, TMZ se absorbió rápidamente, con concentraciones máximas alcanzadas tan solo 20 minutos después de la administración (tiempo promedio entre 0,5 y
1,5 horas). Tras la administración oral de TMZ marcada con 14C, la excreción fecal promedio de 14C durante los siguientes 7 días después de la dosis fue de 0,8 % indicando la absorción completa.
Distribución
TMZ demuestra baja unión a proteínas (10 % a 20 %), y por lo tanto, no se espera que interactúe con sustancias de alta afinidad por proteínas.
Los estudios de tomografía por emisión de positrones (TEP) en seres humanos y los datos preclínicos sugieren que TMZ cruza la barrera hematoencefálica rápidamente y está presente en el LCR. La penetración del LCR se confirmó en un paciente, la exposición del LCR basada en el AUC de TMZ fue aproximadamente de un 30 % de éste en el plasma, lo que es coherente con los datos en animales.
Eliminación
La vida media en el plasma (t1/2) es aproximadamente de 1,8 horas. La ruta principal de eliminación del 14C es la renal. Tras la administración oral, aproximadamente el 5 % al 10 % de la dosis se recupera sin cambios en la orina durante 24 horas, y el resto se excreta como temozolomida ácida, 5-aminoimidazol-4-carboxamida (AIC) o metabolitos polares sin identificar.
Las concentraciones en plasma aumentan de manera relacionada con la dosis. El aclaramiento del plasma, el volumen de distribución y la vida media son independientes de la dosis.
Poblaciones especiales
El análisis de la farmacocinética basada en la población de TMZ reveló que el aclaramiento de TMZ en el plasma fue independiente de la edad, función renal o consumo de tabaco. En un estudio farmacocinético diferente, los perfiles farmacocinéticos del plasma en pacientes con disfunción hepática leve a moderada fueron similares a los observados en pacientes con función hepática normal.
Los pacientes pediátricos presentaron un AUC mayor que los pacientes adultos; no obstante, la dosis máxima tolerada (DMT) fue de 1.000 mg/m2 por ciclo en niños y en adultos.
5.3 Datos preclínicos sobre seguridad
Se llevaron a cabo estudios de toxicidad tras un solo ciclo (administración durante 5 días, 23 días sin tratamiento), 3 ciclos y 6 ciclos en ratas y perros. Las dianas principales de la toxicidad fueron la médula ósea, el sistema linforreticular, los testículos, el tracto gastrointestinal, y, a dosis superiores, que fueron letales para del 60 % al 100 % de las ratas y perros tratados, se produjo la degeneración de la retina. La mayoría de la toxicidad mostró evidencia de reversibilidad, excepto las reacciones adversas sobre el sistema reproductor masculino y la degeneración de la retina. No obstante, dado que las dosis implicadas en la degeneración de la retina se encontraban en el intervalo de dosis letal y no se ha observado un efecto comparable en los estudios clínicos, no se consideró que este resultado tuviera relevancia clínica.
TMZ es un agente alquilante embriotóxico, teratogénico y genotóxico. TMZ es más tóxica en la rata y el perro que en los seres humanos, y la dosis clínica se acerca a la dosis letal mínima en ratas y perros. Las reducciones, relacionadas con la dosis, en los leucocitos y las plaquetas parecen ser unos indicadores sensibles de toxicidad. En el estudio de administración a ratas durante 6 ciclos, se observaron varias neoplasias, incluyendo carcinoma de mama, queratoacantoma y adenoma de células basales mientras que en los estudios en perros no se obse rvaron tumores o alteraciones preneoplásicas. La rata parece ser particularmente sensible a los efectos oncogénicos de TMZ, con la aparición de los primeros tumores dentro de los 3 meses del inicio del tratamiento. Este periodo de latencia es muy corto incluso para un agente alquilante.
Los resultados de los test de Ames/salmonella y de aberración cromosómica en Linfocitos de Sangre Periférica Humana (HPBL) mostraron una respuesta positiva de mutagenicidad.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Contenido de la cápsula:
lactosa anhidra,
sílice anhidra coloidal,
glicolato sódico de almidón tipo A,
ácido tartárico,
ácido esteárico.
Cuerpos de las cápsulas: gelatina,
dióxido de titanio (E 171), lauril sulfato sódico, óxido rojo de hierro (E 172).
Impresión:
goma laca,
propilenglicol,
agua purificada,
hidróxido amónico,
hidróxido de potasio,
óxido negro de hierro (E 172).
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
3 años
6.4 Precauciones especiales de conservación
Presentación en frascos
No conservar a temperatura superior a 30°C.
Conservar en el frasco original para protegerlo de la humedad. Mantener el frasco perfectamente cerrado.
Presentación en sobres
No conservar a temperatura superior a 30°C.
6.5 Naturaleza y contenido del envase
Presentación en frascos
Frascos de vidrio ámbar de tipo I con cierre de polipropileno a prueba de niños, que contienen 5 ó 20 cápsulas duras.
El envase de cartón contiene 1 frasco.
Presentación en sobres
Los sobres están compuestos por polietileno de baja densidad lineal (capa más interna), aluminio y tereftalato de polietileno.
Cada sobre contiene 1 cápsula dura y se dispensa en envase de cartón.
El envase de cartón contiene 5 ó 20 cápsulas duras, selladas en sobres individualmente.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Las cápsulas no se deben abrir. Si una cápsula se rompiera, se debe evitar el contacto del contenido en polvo con la piel o membranas mucosas. Si Temodal entra en contacto con la piel o mucosas, debe lavarse inmediata y concienzudamente con jabón y agua.
Se debe informar a los pacientes para que mantengan las cápsulas fuera de la vista y del alcance de los niños, preferiblemente en un armario cerrado con llave. La ingestión accidental puede ser mortal en niños.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU Reino Unido
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/98/096/005
EU/1/98/096/006
EU/1/98/096/015
EU/1/98/096/016
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 26/enero/1999 Fecha de la última renovación: 26/enero/2009
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
1. NOMBRE DEL MEDICAMENTO
Temodal 140 mg cápsulas duras
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada cápsula dura contiene 140 mg de temozolomida (temozolomide).
Excipiente con efecto conocido:
Cada cápsula dura contiene 246 mg de lactosa anhidra.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Cápsula dura (cápsula).
Las cápsulas duras tienen un cuerpo blanco opaco, una tapa azul, y están impresas con tinta negra. La tapa lleva impreso “Temodal”. El cuerpo lleva impreso “140 mg”, el logo de Schering-Plough y dos rayas.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Temodal está indicado en el tratamiento de:
- pacientes adultos con glioblastoma multiforme de nuevo diagnóstico concomitante con radioterapia (RT) y posteriormente como tratamiento en monoterapia.
- niños a partir de tres años de edad, adolescentes y pacientes adultos con glioma maligno, tal como glioblastoma multiforme o astrocitoma anaplásico, que presentan recurrencia o progresión después de terapia estándar.
4.2 Posología y forma de administración
Temodal sólo debe ser prescrito por médicos con experiencia en el tratamiento oncológico de tumores cerebrales.
Puede administrarse terapia antiemética (ver sección 4.4).
Posología
Pacientes adultos con glioblastoma multiforme de nuevo diagnóstico
Temodal se administra en combinación con radioterapia focal (fase concomitante) seguido de hasta 6 ciclos de monoterapia con temozolomida (TMZ) (fase de monoterapia).
Fase concomitante
Se administra TMZ a una dosis de 75 mg/m2 al día por vía oral durante 42 días como tratamiento concomitante a la radioterapia focal (60 Gy administrados en 30 fracciones). No se recomiendan reducciones de dosis, pero se decidirá semanalmente el retraso o la suspensión de la administración de TMZ de acuerdo a los criterios de toxicidad hematológica y no hematológica. La administración de TMZ se puede continuar durante todo el periodo concomitante de 42 días (hasta 49 días) si se cumplen todas y cada una de las siguientes condiciones:
- recuento absoluto de neutrófilos (RAN) > 1,5 x 109/l
- recuento de trombocitos > 100 x 109/l
- toxicidad no hematológica según los criterios de toxicidad común (CTC) < Grado 1 (excepto para alopecia, náuseas y vómitos).
Durante el tratamiento se deberá realizar semanalmente un hemograma completo. La administración de TMZ se deberá interrumpir o suspender permanentemente durante la fase concomitante de acuerdo a los criterios de toxicidad hematológica y no hematológica según la Tabla 1.
|
Tabla 1. Interrupción o suspensión de la dosificación con TMZ durante el tratamiento concomitante de radioterapia y TMZ | ||
|
Toxicidad |
Interrupción de TMZa |
Suspensión de TMZ |
|
Recuento Absoluto de Neutrófilos |
> 0,5 y < 1,5 x 109/l |
< 0,5 x 109/l |
|
Recuento de Trombocitos |
> 10 y < 100 x 109/l |
< 10 x 109/l |
|
Toxicidad no hematológica según CTC (excepto para alopecia, náuseas y vómitos) |
Grado 2 según CTC |
Grado 3 ó 4 según CTC |
a: El tratamiento con TMZ concomitante se puede continuar si se cumplen todas y cada una de las siguientes condiciones: recuento absoluto de neutrófilos > 1,5 x 109/l, recuento de trombocitos > 100 x 109/l, toxicidad no hematológica según CTC < Grado 1 (excepto para alopecia, náuseas y vómitos).
Fase de monoterapia
Cuatro semanas después de completar la fase concomitante de TMZ + RT, se administran hasta 6 ciclos de TMZ en monoterapia. La dosis en el Ciclo 1 (monoterapia) es de 150 mg/m2 una vez al día, durante 5 días, seguido de 23 días sin tratamiento. Al principio del Ciclo 2, la dosis se aumenta a 200 mg/m2 si la toxicidad no hematológica según CTC en el Ciclo 1 es de Grado < 2 (excepto para alopecia, náuseas y vómitos), el recuento absoluto de neutrófilos (RAN) es > 1,5 x 109/l y el recuento de trombocitos > 100 x 109/l. Si la dosis no se aumentó en el Ciclo 2, no se deberá aumentar la dosis en los ciclos posteriores. Si se aumentó la dosis, se mantiene a 200 mg/m2 al día durante los primeros 5 días de cada ciclo posterior, excepto si se produce toxicidad. Las reducciones y suspensiones de dosis durante la fase de monoterapia se deberán realizar de acuerdo a las Tablas 2 y 3.
Durante el tratamiento se deberá realizar un hemograma completo en el Día 22 (21 días después de la primera dosis de TMZ). La dosis se reducirá o se suspenderá la administración de acuerdo a la Tabla 3.
|
Tabla 2. Niveles de dosis de TMZ para el tratamiento en monoterapia | ||
|
Nivel de dosis |
Dosis de TMZ (mg/m2/día) |
Observaciones |
|
-1 |
100 |
Reducción por toxicidad previa |
|
0 |
150 |
Dosis durante el Ciclo 1 |
|
1 |
200 |
Dosis durante los Ciclos 2-6 en ausencia de toxicidad |
|
Tabla 3. Reducción o suspensión de la dosis de TMZ durante el tratamiento en monoterapia | ||
|
Toxicidad |
Reducir TMZ 1 nivel de dosisa |
Suspender TMZ |
|
Recuento absoluto de neutrófilos |
< 1,0 x 109/l |
Ver nota b |
|
Recuento de trombocitos |
< 50 x 109/l |
Ver nota b |
|
Toxicidad no hematológica según CTC (excepto para alopecia, náuseas y vómitos) |
Grado 3 según CTC |
Grado 4b según CTC |
a: Los niveles de dosis de TMZ aparecen en la Tabla 2. b: Se suspende TMZ si:
• El nivel de dosis -1 (100 mg/m2) todavía provoca toxicidad inaceptable
• La misma toxicidad no hematológica de Grado 3 (excepto para alopecia, náuseas, vómitos) vuelve a aparecer tras la reducción de dosis.
Pacientes adultos y _pediátricos de 3 años de edad o mayores con glioma maligno recurrente o progresivo:
Un ciclo de tratamiento es de 28 días. En pacientes no tratados previamente con quimioterapia, TMZ se administra por vía oral a la dosis de 200 mg/m2 una vez al día durante los primeros 5 días seguido de una interrupción del tratamiento de 23 días (un total de 28 días). En los pacientes tratados previamente con quimioterapia, la dosis inicial es de 150 mg/m2 una vez al día, que debe incrementarse en el segundo ciclo a 200 mg/m2 una vez al día, durante 5 días si no apareciera toxicidad hematológica (ver sección 4.4).
Poblaciones especiales
Población pediátrica
En pacientes de edad igual o superior a 3 años, sólo debe usarse TMZ en glioma maligno recurrente o progresivo. La experiencia en estos niños es muy limitada (ver secciones 4.4 y 5.1). No se ha establecido la seguridad y la eficacia de TMZ en niños menores de 3 años. No se dispone de datos.
Pacientes con disfunción hepática o renal
La farmacocinética de la TMZ fue comparable en pacientes con función hepática normal y en aquellos con disfunción hepática leve o moderada. No hay datos disponibles sobre la administración de TMZ a pacientes con disfunción hepática grave (Clase C de Child) o con disfunción renal. En base a las propiedades farmacocinéticas de la TMZ, es improbable que se requieran reducciones de dosis en pacientes con disfunción hepática grave o cualquier grado de disfunción renal. Sin embargo, se debe tener precaución al administrar TMZ a estos pacientes.
Pacientes de edad avanzada
En base al análisis farmacocinético en pacientes de 19-78 años de edad, el aclaramiento de TMZ no se ve afectado por la edad. Sin embargo, los pacientes de edad avanzada (> 70 años de edad) parecen tener un aumento en el riesgo de neutropenia y trombocitopenia (ver sección 4.4).
Forma de administración
Temodal cápsulas duras debe administrarse en estado de ayuno.
Las cápsulas deben tragarse enteras con un vaso de agua y no deben abrirse o masticarse.
Si después de la administración de la dosis se produce vómito, no debe administrarse una segunda dosis ese día.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a algunos de los excipientes incluidos en la sección 6.1. Hipersensibilidad a la dacarbazina (DTIC).
Mielosupresión severa (ver sección 4.4).
4.4 Advertencias y precauciones especiales de empleo
Infecciones oportunistas y reactivación de infecciones
Durante el tratamiento con TMZ, se han observado infecciones oportunistas (como neumonía por Pneumocystis jirovecii) y reactivación de infecciones (como VHB, CMV) (ver sección 4.8).
Los pacientes que recibieron concomitantemente TMZ y RT en un ensayo piloto durante el régimen prolongado de 42 días presentaron un especial riesgo de desarrollar neumonía por Pneumocystis jirovecii (PCP). Por lo tanto, se requiere profilaxis frente a PCP en todos los pacientes que reciban concomitantemente TMZ y RT durante el régimen de 42 días (hasta un máximo de 49 días) con independencia del recuento de linfocitos. Si se produce linfopenia, deben continuar con la profilaxis hasta que la recuperación de la linfopenia sea de un grado < 1.
Puede haber una mayor incidencia de PCP cuando se administra TMZ durante un régimen de dosificación más largo. No obstante, todos los pacientes que reciban TMZ, en especial los pacientes que reciban esteroides, deberán ser vigilados estrechamente en cuanto al desarrollo de PCP con independencia del régimen. Se han notificado casos de insuficiencia respiratoria mortal en pacientes en tratamiento con TMZ, en particular en combinación con dexametasona u otros esteroides.
VHB
Se ha notificado hepatitis debida a una reactivación del virus de la hepatitis B (VHB), resultando en algunos casos mortal. Se debe consultar a los expertos en enfermedades hepáticas antes de iniciar el tratamiento en pacientes con serología para la hepatitis B positiva (incluyendo aquellos pacientes con la enfermedad activa). Durante el tratamiento, los pacientes deben ser controlados y tratados como corresponda.
Hepatotoxicidad
Se han notificado lesiones hepáticas incluyendo insuficiencia hepática mortal en pacientes tratados con TMZ (ver sección 4.8). Se deben determinar los valores basales de la función hepática antes de iniciar el tratamiento. Si fueran anómalos, el médico debe evaluar el beneficio/riesgo antes de iniciar el tratamiento con temozolamida, incluyendo el riesgo potencial de insuficiencia hepática mortal. En pacientes en un ciclo de tratamiento de 42 días, las pruebas se deben repetir en mitad del ciclo. En todos los pacientes, las pruebas de la función hepática se deben repetir después de cada ciclo de tratamiento. El médico debe evaluar el beneficio/riesgo de continuar el tratamiento en pacientes con anomalías significativas de la función hepática. La toxicidad hepática puede aparecer varias semanas o más, después del último tratamiento con temozolomida.
Neoplasias malignas
También se han observado casos muy raros de síndrome mielodisplásico y neoplasias secundarias, incluyendo leucemia mieloide (ver sección 4.8).
Terapia antiemética
Las náuseas y los vómitos se asocian muy frecuentemente con TMZ.
Se puede administrar la terapia antiemética antes o después de la administración de TMZ.
Pacientes adultos con glioblastoma multiforme de nuevo diagnóstico
Se recomienda profilaxis antiemética antes de la dosis inicial de la fase concomitante, y se recomienda encarecidamente durante la fase de monoterapia.
Pacientes con glioma maligno recurrente o _progresivo
Los pacientes que hayan experimentado fuertes vómitos (Grado 3 ó 4) en ciclos de tratamiento previos pueden precisar tratamiento antiemético.
Parámetros de laboratorio
Los pacientes en tratamiento con TMZ pueden presentar mielosupresión, incluyendo pancitopenia prolongada, que puede derivar en anemia aplásica que, en ciertos casos, puede terminar en fallecimiento. En algunos casos, la exposición a medicamentos concomitantes asociados a la anemia aplásica, tales como carbamazepina, fenitoína y sulfametoxazol/trimetoprima complica la valoración. Antes de la administración, deberán cumplirse los siguientes parámetros de laboratorio: RAN > 1,5 x 109/1 y recuento de plaquetas > 100 x 109/l. Deberá practicarse un hemograma completo el Día 22 (21 días después de la primera dosis) o dentro de las 48 horas de dicho día, y una vez a la semana hasta que el RAN sea > 1,5 x 109/l y el recuento de plaquetas sea > 100 x 109/l. Si el RAN disminuyera a < 1,0 x 109/l o el recuento de plaquetas fuera < 50 x 109/l durante cualquier ciclo, se disminuirá un nivel de dosis en el siguiente ciclo (ver sección 4.2). Los niveles de dosis son de 100 mg/m2, 150 mg/m2 y 200 mg/m2. La dosis más baja recomendada es de 100 mg/m2.
Población pediátrica
No hay experiencia clínica sobre el empleo de TMZ en niños menores de 3 años de edad. La experiencia en niños mayores y adolescentes es muy limitada (ver sección 4.2 y 5.1).
Pacientes de edad avanzada (> 70 años de edad)
Los pacientes de edad avanzada parecen presentar un mayor riesgo de neutropenia y trombocitopenia que los pacientes más jóvenes. Por lo tanto, se debe tener precaución especial cuando se administre TMZ a pacientes de edad avanzada.
Pacientes varones
Debe advertirse a los hombres que vayan a ser tratados con TMZ que eviten dejar embarazada a su pareja durante los 6 meses posteriores al tratamiento y que busquen asesoramiento sobre crioconservación del esperma antes del tratamiento (ver sección 4.6).
Lactosa
Este medicamento contiene lactosa. Los pacientes con intolerancia hereditaria a galactosa, insuficiencia de lactasa de Lapp o malabsorción de glucosa o galactosa no deben tomar este medicamento.
4.5 Interacción con otros medicamentos y otras formas de interacción
En otro estudio en fase I, la administración de TMZ con ranitidina no provocó modificaciones del grado de absorción de la temozolomida o de la exposición a su metabolito activo monometil triazenoimidazol carboxamida (MTIC).
La administración de TMZ con los alimentos resultó en una disminución del 33 % de la Cmax y en una disminución del 9 % del área bajo la curva (AUC).
Como no se puede excluir que el cambio en la Cmax sea clínicamente importante, Temodal no debe administrarse junto a alimentos.
En base a un análisis de la farmacocinética de población observado en ensayos en fase II, la coadministración de dexametasona, proclorperazina, fenitoína, carbamazepina, ondansetrón, antagonistas de los receptores H2 o fenobarbital no modificó la eliminación de la TMZ. Se asoció la coadministración de ácido valproico con una pequeña pero estadísticamente significativa disminución del aclaramiento de TMZ.
No se han llevado a cabo estudios para determinar el efecto de TMZ sobre el metabolismo o eliminación de otros fármacos. No obstante, dado que TMZ no experimenta metabolismo hepático y muestra una baja unión a proteínas, es improbable que afecte a la farmacocinética de otros medicamentos (ver sección 5.2).
El empleo de TMZ en combinación con otros agentes mielosupresores puede aumentar la probabilidad de mielosupresión.
Población pediátrica
Los estudios de interacciones se han realizado sólo en adultos.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No hay datos en mujeres embarazadas. En los estudios preclínicos en ratas y conejos tratados con 150 mg/m2 de TMZ se observó teratogenia y/o toxicidad fetal (ver sección 5.3).
Temodal no debe administrarse a mujeres embarazadas. Si se debe considerar su uso durante el embarazo, la paciente debe ser informada del riesgo potencial para el feto.
Lactancia
Se desconoce si TMZ se excreta en la leche materna; por tanto, se debe interrumpir la lactancia durante el tratamiento con TMZ.
Mujeres en edad fértil
Se debe aconsejar a las mujeres en edad fértil el uso de un método anticonceptivo eficaz para evitar el embarazo mientras estén en tratamiento con TMZ.
Fertilidad masculina
TMZ puede tener efectos genotóxicos. Por lo tanto, se advierte a los hombres que vayan a ser tratados con ella que eviten dejar embarazada a su pareja hasta que hayan transcurrido 6 meses desde la última dosis y que busquen asesoramiento sobre crioconservación del esperma antes del tratamiento dada la posibilidad de infertilidad irreversible debido a la terapia con TMZ.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
TMZ tiene una influencia baja sobre la capacidad para conducir y utilizar máquinas debido a la fatiga y somnolencia (ver sección 4.8).
4.8 Reacciones adversas
Experiencia de ensayos clínicos
En pacientes tratados con TMZ, ya sea en combinación con RT o como monoterapia tras RT para glioblastoma multiforme de nuevo diagnóstico o como monoterapia en pacientes con glioma recurrente o progresivo, las reacciones adversas muy frecuentes notificadas fueron similares: náuseas, vómitos, estreñimiento, anorexia, cefalea y fatiga. Se notificaron de manera muy frecuente convulsiones en pacientes con glioblastoma multiforme de nuevo diagnóstico que recibieron monoterapia, y se notificó sarpullido muy frecuentemente en pacientes con glioblastoma multiforme de nuevo diagnóstico que recibieron TMZ en combinación con RT y también en monoterapia, y se notificó frecuentemente en glioma recurrente. La mayoría de las alteraciones de parámetros hematológicos se notificaron, según lo esperado, como frecuentes o muy frecuentes en ambas indicaciones (Tablas 4 y 5); después de cada tabla se recogen las frecuencias relativas a los parámetros de laboratorio de grados 3 y 4.
En las tablas, los efectos adversos se clasifican según la clasificación por órganos y sistemas y la frecuencia. Los grupos de frecuencia se definen según la siguiente convención: Muy frecuentes (> 1/10); Frecuentes (> 1/100 a < 1/10); Poco frecuentes (> 1/1.000 a < 1/100); Raras (> 1/10.000 a < 1/1.000); Muy raras (< 1/10.000). Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
Glioblastoma multiforme de nuevo diagnóstico
La Tabla 4 incluye reacciones adversas derivadas del tratamiento en pacientes con glioblastoma multiforme de nuevo diagnóstico durante las fases de tratamiento concomitante y en monoterapia.
|
Tabla 4. Acontecimientos derivados del tratamiento durante las fases de tratamiento concomitante y en monoterapia en pacientes con glioblastoma multiforme de nuevo diagnóstico | ||
|
Clasificación por órganos y sistemas |
TMZ + radioterapia concomitante n=288* |
TMZ en monoterapia n=224 |
|
Infecciones e infestaciones | ||
|
Frecuentes: |
Infección, herpes simple, infección de una herida, faringitis, candidiasis oral |
Infección, candidiasis oral |
|
Poco frecuentes: |
Herpes simple, herpes zoster, síntomas pseudogripales | |
|
Trastornos de la sangre y del sistema linfático | ||
|
Frecuentes: |
Neutropenia, trombocitopenia, linfopenia, leucopenia |
Neutropenia febril, trombocitopenia, anemia, leucopenia |
|
Poco frecuentes: |
Neutropenia febril, anemia |
Linfopenia, petequia |
|
Trastornos endocrinos | ||
|
Poco frecuentes: |
Cushingoide |
Cushingoide |
|
Trastornos del metabolismo y de la nutrición | ||
|
Muy frecuentes: |
Anorexia |
Anorexia |
|
Frecuentes: |
Hiperglucemia, pérdida de peso |
Pérdida de peso |
|
Poco frecuentes: |
Hipopotasemia, aumento de la fosfatasa alcalina, aumento de peso |
Hiperglucemia, aumento de peso |
|
Trastornos psiquiátricos | ||
|
Frecuentes: |
Ansiedad, labilidad emocional, insomnio |
Ansiedad, depresión, labilidad emocional, insomnio |
|
Poco frecuentes: |
Agitación, apatía, alteración del comportamiento, depresión, alucinaciones |
Alucinaciones, amnesia |
|
Trastornos del sistema nervioso | ||
|
Muy frecuentes: |
Cefalea |
Convulsiones, cefalea |
|
Frecuentes: |
Convulsiones, pérdida de conocimiento, somnolencia, afasia, alteración del equilibrio, mareo, confusión, pérdida de memoria, disminución de la concentración, neuropatía, parestesia, trastorno en el habla, temblor |
Hemiparesia, afasia, alteración del equilibrio, somnolencia, confusión, mareo, pérdida de memoria, disminución de la concentración, disfasia, trastorno neurológico (NOS), neuropatía, neuropatía periférica, parestesia, trastorno en el habla, temblor |
|
Poco frecuentes: |
Status epilepticus, trastorno extrapiramidal, hemiparesia, ataxia, trastorno cognitivo, disfasia, trastorno de la marcha, hiperestesia, hipoestesia, trastorno neurológico (NOS), neuropatía periférica |
Hemiplejía, ataxia, alteración en la coordinación, trastorno de la marcha, hiperestesia, trastorno sensorial |
|
Trastornos oculares | ||
|
Frecuentes: |
Visión borrosa |
Defecto en el campo visual, visión borrosa, diplopía |
|
Poco frecuentes: |
Hemianopsia, disminución de la agudeza visual, trastorno en la visión, defecto en el campo visual, dolor ocular |
Disminución de la agudeza visual, dolor ocular, sequedad ocular |
|
Trastornos del oído y del laberinto | ||
|
Frecuentes: |
Trastorno en la audición |
Trastorno en la audición, tinnitus |
|
Poco frecuentes: |
Otitis media, tinnitus, hiperacusia, otalgia |
Sordera, vértigo, otalgia |
|
Trastornos cardiacos | ||
|
Poco frecuentes: |
Palpitaciones | |
|
Trastornos vasculares | ||
|
Frecuentes: |
Hemorragia, edema, edema de piernas |
Hemorragia, trombosis venosa profunda, edema de piernas |
|
Poco frecuentes: |
Hemorragia cerebral, hipertensión |
Embolismo pulmonar, edema, edema periférico |
|
Trastornos respiratorios, torácicos y mediastínicos | ||
|
Frecuentes: |
Disnea, tos |
Disnea, tos |
|
Poco frecuentes: |
Neumonía, infección respiratoria superior, congestión nasal |
Neumonía, sinusitis, infección respiratoria superior, bronquitis |
|
Trastornos gastrointestinales | ||
|
Muy frecuentes: |
Estreñimiento, náuseas, vómitos |
Estreñimiento, náuseas, vómitos |
|
Frecuentes: |
Estomatitis, diarrea, dolor abdominal, dispepsia, disfagia |
Estomatitis, diarrea, dispepsia, disfagia, sequedad de boca |
|
Poco frecuentes: |
Distensión abdominal, incontinencia fecal, trastorno gastrointestinal (NOS), gastroenteritis, hemorroides | |
|
Trastornos de la piel y del tejido subcutáneo | ||
|
Muy frecuentes: |
Sarpullido, alopecia |
Sarpullido, alopecia |
|
Frecuentes: |
Dermatitis, sequedad cutánea, eritema, prurito |
Sequedad cutánea, prurito |
|
Poco frecuentes: |
Exfoliación cutánea, reacción de fotosensibilidad, alteración en la pigmentación |
Eritema, alteración en la pigmentación, aumento de la sudoración |
|
Trastornos musculoesqueléticos y del tejido conjuntivo | ||
|
Frecuentes: |
Debilidad muscular, artralgia |
Debilidad muscular, artralgia, dolor musculoesquelético, mialgia |
|
Poco frecuentes: |
Miopatía, dolor de espalda, dolor musculoesquelético, mialgia |
Miopatía, dolor de espalda |
|
Trastornos renales y urinarios | ||
|
Frecuentes: |
Polaquiuria, incontinencia urinaria |
Incontinencia urinaria |
|
Poco frecuentes: |
Disuria | |
|
Trastornos del aparato reproductor y de la mama | ||
|
Poco frecuentes: |
Impotencia |
Hemorragia vaginal, menorragia, amenorrea, vaginitis, dolor de mama |
|
Trastornos generales y alteraciones en el lugar de administración | ||
|
Muy frecuentes: |
Fatiga |
Fatiga |
|
Frecuentes: |
Reacción alérgica, fiebre, lesión por radiación, edema facial, dolor, alteración del gusto |
Reacción alérgica, fiebre, lesión por radiación, dolor, alteración del gusto |
|
Poco frecuentes: |
Astenia, rubor, sofocos, empeoramiento de una enfermedad, escalofríos, cambio de color de la lengua, parosmia, sed |
Astenia, edema facial, dolor, empeoramiento de una enfermedad, escalofríos, trastorno dental |
|
Exploraciones complementarias | ||
|
Frecuentes: |
Aumento de ALT |
Aumento de ALT |
|
Poco frecuentes: |
Aumento de enzimas hepáticas, aumento de Gamma GT, aumento de AST | |
*Un paciente que se aleatorizó al brazo de RT únicamente, recibió TMZ + RT.
Resultados de laboratorio
Se observó mielosupresión (neutropenia y trombocitopenia), que es toxicidad limitante de dosis conocida para la mayoría de los agentes citotóxicos, incluido TMZ. Cuando las alteraciones en las pruebas de laboratorio y las reacciones adversas se sumaron entre las fases de tratamiento concomitante y en monoterapia, se observaron alteraciones en neutrófilos de Grado 3 o de Grado 4, incluyendo acontecimientos neutropénicos, en el 8 % de los pacientes. Se observaron alteraciones en los trombocitos de Grado 3 o Grado 4, incluyendo acontecimientos trombocitopénicos en el 14 % de los pacientes que recibieron TMZ.
Glioma maligno recurrente o progresivo
En los ensayos clínicos, las reacciones adversas que se produjeron más frecuentemente relacionadas con el tratamiento fueron los trastornos gastrointestinales, concretamente náuseas (43 %) y vómitos (36 %). Estas reacciones fueron normalmente de Grado 1 ó 2 (0-5 episodios de vómitos en 24 horas) y se autolimitaron o controlaron rápidamente con tratamiento antiemético estándar. La incidencia de náuseas y vómitos intensos fue del 4 %.
La Tabla 5 incluye reacciones adversas notificadas durante ensayos clínicos en glioma maligno recurrente o progresivo y después de la comercialización de Temodal.
_Tabla 5. Reacciones adversas en pacientes con glioma maligno recurrente o progresivo
Infecciones e infestaciones
Raras:
Infecciones oportunistas, incluyendo PCP
|
Trastornos de la sangre y del sistema linfático | |
|
Muy frecuentes: |
Neutropenia o linfopenia (grado 3-4), trombocitopenia (grado 3-4) |
|
Poco frecuentes: |
Pancitopenia, anemia (grado 3-4), leucopenia |
|
Trastornos del metabolismo y de la nutrición | |
|
Muy frecuentes: |
Anorexia |
|
Frecuentes: |
Pérdida de peso |
|
Trastornos del sistema nervioso | |
|
Muy frecuentes: |
Cefalea |
|
Frecuentes: |
Somnolencia, mareo, parestesia |
|
Trastornos respiratorios, torácicos y mediastínicos | |
|
Frecuentes: |
Disnea |
|
Trastornos gastrointestinales | |
|
Muy frecuentes: |
Vómitos, náuseas, estreñimiento |
|
Frecuentes: |
Diarrea, dolor abdominal, dispepsia |
|
Trastornos de la piel y del tejido subcutáneo | |
|
Frecuentes: |
Sarpullido, prurito, alopecia |
|
Muy raros: |
Eritema multiforme, eritrodermia, urticaria, exantema |
|
Trastornos generales y alteraciones en el lugar de administración | |
|
Muy frecuentes: |
Fatiga |
|
Frecuentes: |
Fiebre, astenia, escalofríos, malestar general, dolor, alteraciones en el gusto |
|
Muy raras: |
Reacciones alérgicas, incluyendo anafilaxia, angioedema |
Resultados de laboratorio
Se produjeron trombocitopenia y neutropenia de Grados 3 ó 4 en el 19 % y 17 %, respectivamente, de los pacientes tratados por glioma maligno. Esto provocó la hospitalización y/o interrupción del tratamiento con TMZ en el 8 % y 4 %, respectivamente. La mielosupresión fue previsible (normalmente dentro de los primeros ciclos, con el valor más bajo de parámetros hematológicos (nadir) entre el Día 21 y el Día 28), y la recuperación fue rápida, generalmente en 1-2 semanas. No se observó evidencia de una mielosupresión de tipo acumulativo. La presencia de trombocitopenia puede incrementar el riesgo de hemorragia, y la presencia de neutropenia o leucopenia puede incrementar el riesgo de infección.
Género
En un análisis de farmacocinética basada en la población sobre la experiencia en ensayos clínicos se disponía de los datos del nadir de los recuentos de neutrófilos para 101 mujeres y 169 hombres, y del nadir de plaquetas para 110 mujeres y 174 hombres. En el primer ciclo de terapia hubo tasas más altas de neutropenia de Grado 4 (RAN < 0,5 x 109/l), 12 % frente al 5 %, y trombocitopenia (< 20 x 109/l),
9 % frente al 3 %, en mujeres que en hombres. En una serie de datos de 400 pacientes con glioma recurrente, tras el primer ciclo de terapia, se produjo neutropenia de Grado 4 en el 8 % de las mujeres frente al 4 % de los hombres, y trombocitopenia de Grado 4 en el 8 % de las mujeres frente al 3 % de los hombres. En un ensayo con 288 pacientes con glioblastoma multiforme de nuevo diagnóstico, se produjo, en el primer ciclo de terapia, neutropenia de Grado 4 en el 3 % de las mujeres frente al 0 % de los hombres, y trombocitopenia de Grado 4 en el 1 % de las mujeres frente al 0 % de los hombres.
Población pediátrica
Se ha estudiado TMZ por vía oral en pacientes pediátricos (edad 3-18 años) con glioma recurrente del tronco encefálico o astrocitoma de alto grado recurrente, en un régimen de administración diaria durante 5 días cada 28 días. Aunque los datos son limitados, cabe esperar que la tolerancia en niños sea similar a la de los adultos. No se ha determinado la seguridad de TMZ en niños menores de 3 años.
Experiencia postcomercialización
Se han identificado las siguientes reacciones adversas graves durante la exposición postcomercialización:
|
Tabla 6. Resumen de los acontecimientos notificados con temozolomida en la postcomercialización | |
|
Infecciones e infestaciones* | |
|
Poco frecuentes: |
infección por citomegalovirus, reactivación de infección de tipo citomegalovirus, virus hepatitis B1 |
|
Trastornos de la sangre y del sistema linfático | |
|
Muy raras: |
pancitopenia prolongada, anemia aplásica1 |
|
Neoplasias benignas, malignas y no especificadas | |
|
Muy raras: |
síndrome mielodisplásico, tumores malignos secundarios, incluyendo leucemia mieloide |
|
Trastornos endocrinos* | |
|
Poco frecuentes: |
diabetes insípida |
|
Trastornos respiratorios, torácicos y mediastínicos | |
|
Muy raras: |
neumonitis intersticial/neumonitis, fibrosis pulmonar, insuficiencia respiratoria1 |
|
Trastornos hepatobiliares* | |
|
Frecuentes: |
enzimas hepáticas aumentadas |
|
Poco frecuentes: |
hiperbilirrubinemia, colestasis, hepatitis, lesión hepática, insuficiencia hepática1 |
|
Trastornos de la piel y del tejido subcutáneo | |
|
Muy raras: |
necrolisis epidérmica tóxica, syndrome de Stevens-Johnson |
1 Incluyendo casos con desenlace mortal Frecuencias estimadas a partir de los ensayos clínicos pertinentes.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Anexo V.
4.9 Sobredosis
Se han evaluado clínicamente en pacientes dosis de 500, 750, 1.000 y 1.250 mg/m2 (dosis total por ciclo de 5 días). La toxicidad limitante de dosis fue hematológica y se notificó con todas las dosis, pero se espera que sea más grave a dosis más altas. Un paciente recibió una sobredosis de 10.000 mg (dosis total por ciclo de 5 días) y las reacciones adversas que se notificaron fueron pancitopenia, pirexia, fracaso multiorgánico y muerte. Se han notificado casos de pacientes que han tomado la dosis recomendada durante más de 5 días de tratamiento (hasta 64 días) notificándose reacciones adversas como supresión de médula ósea, con o sin infección, en algunos casos grave y prolongada, con resultado de muerte. En caso de sobredosis, es necesaria una evaluación hematológica. Se deben tomar medidas generales de soporte si fuera necesario.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Agentes antineoplásicos - Otros agentes alquilantes, código ATC: L01A X03.
Mecanismo de acción
La temozolomida es un triazeno, que a pH fisiológico sufre una rápida conversión química a la monometil tiazenoimidazol carboxamida activa (MTIC). Se considera que la citotoxicidad del MTIC es consecuencia, fundamentalmente, de una alquilación en la posición O6 de la guanina, con una alquilación adicional que se produce en la posición N7. Se considera que las lesiones citotóxicas que se desarrollan posteriormente conllevan una reparación aberrante del metilo añadido.
Eficacia clínica y seguridad
Glioblastoma multiforme de nuevo diagnóstico
. Los
- 5 de Los
Se aleatorizaron un total de 573 pacientes para recibir o TMZ + RT (n=287) o RT sola (n=286) pacientes del brazo de TMZ + RT recibieron TMZ concomitante (75 mg/m2) una vez al día, empezando el primer día de RT hasta el último día de RT, durante 42 días (hasta un máximo de 49 días). Este tratamiento iba seguido de TMZ en monoterapia (150 - 200 mg/m2) en los Días 1 cada ciclo de 28 días, hasta 6 ciclos, empezando 4 semanas después de la finalización de la RT. pacientes del brazo control sólo recibieron RT. Se necesitó profilaxis frente a neumonía por Pneumocystis jirovecii (PCP) durante la RT y la terapia combinada con TMZ.
En la fase de seguimiento se administró TMZ como terapia de rescate en 161 pacientes de los 282 (57 %) del brazo de RT sola, y en 62 pacientes de los 277 (22 %) del brazo de TMZ + RT.
El hazard ratio (HR) para la supervivencia global fue de 1,59 (95 % IC para HR=1,33 -1,91) con un rango logarítmico de p < 0,0001 a favor del brazo de TMZ. La probabilidad estimada de sobrevivir 2 o más años (26 % frente a 10 %) es mayor para el brazo de RT + TMZ. La adición de TMZ concomitante a la RT, seguida de TMZ en monoterapia en el tratamiento de pacientes con glioblastoma multiforme de nuevo diagnóstico, demostró una mejoría en la supervivencia global (SG) estadísticamente significativa en comparación con la RT sola (Figura 1).

Figura 1 Curvas de Kaplan-Meier para la supervivencia global (población por intención de
tratar)
Los resultados del ensayo no fueron coherentes en el subgrupo de pacientes con un estado funcional bajo (Performance Status OMS PS =2, n=70), en el que la supervivencia global y el tiempo hasta la progresión fueron similares en ambos brazos. No obstante, este grupo de pacientes no parece presentar riesgos inaceptables.
Glioma maligno recurrente o progresivo
Los datos sobre eficacia clínica en pacientes con glioblastoma multiforme (índice de estado funcional de Karnofsky [KPS] > 70), progresivo o recurrente, después de cirugía y RT se basaron en dos
ensayos clínicos con TMZ oral. Uno fue un ensayo no comparativo sobre 138 pacientes (el 29 % recibió quimioterapia previa), y el otro fue un ensayo aleatorizado con brazo control activo de TMZ frente a procarbazina sobre un total de 225 pacientes (el 67 % recibió tratamiento previo con quimioterapia basada en nitrosourea). En ambos ensayos, la variable principal de valoración fue la supervivencia libre de progresión (SLP) definida por los escáneres de IRM o empeoramiento neurológico. En el ensayo no comparativo, la SLP a los 6 meses fue del 19 %, la mediana de la SLP fue de 2,1 meses, y la mediana de la supervivencia global de 5,4 meses. La tasa de respuesta objetiva (ORR) en base a las IRM fue del 8 %.
En el ensayo aleatorizado de brazo control activo, la SLP a los 6 meses fue significativamente mayor para TMZ que para la procarbazina (21 % frente al 8 %, respectivamente - prueba de chi-cuadrado p= 0,008) con una mediana de la SLP de 2,89 y 1,88 meses respectivamente (Test de rango logarítmico, p = 0,0063). La mediana de la supervivencia fue de 7,34 y 5,66 meses para TMZ y procarbazina, respectivamente (rango logarítmico de p = 0,33). A los 6 meses la fracción de pacientes que sobrevivieron fue significativamente superior en el brazo de TMZ (60 %) en comparación con el brazo de procarbazina (44 %) (prueba de chi-cuadrado p = 0,019). En los pacientes que recibieron quimioterapia previa se observó un beneficio en aquellos con un KPS > 80.
Los datos sobre el tiempo hasta el empeoramiento del estado neurológico favorecieron a TMZ sobre la procarbazina, al igual que los datos sobre el tiempo hasta el empeoramiento del estado funcional (decrece hasta KPS de < 70 o decrece al menos 30 puntos). En estas variables de valoración la mediana del tiempo hasta progresión osciló entre los 0,7 y 2,1 meses más para TMZ que para la procarbazina (Test de rango logarítmico, p = < 0,01 a 0,03).
Astrocitoma anaplásico recurrente
En un ensayo de fase II, multicéntrico y prospectivo, dirigido a evaluar la seguridad y la eficacia de la TMZ oral en el tratamiento de pacientes con un astrocitoma anaplásico en su primera recaída, la SLP a los 6 meses fue del 46 %. La mediana de la SLP fue de 5,4 meses. La mediana de la supervivencia global fue de 14,6 meses. La tasa de respuesta, basada en la evaluación practicada por un revisor central, fue del 35 % (13 RC y 43 RP) en la población analizada por intención de tratar (ITT) n=162.
Se comunicó enfermedad estable en 43 pacientes. La supervivencia libre de episodios a los 6 meses en la población analizada por ITT fue del 44 %, con una mediana de la supervivencia libre de episodios de 4,6 meses, cifra que fue similar a la hallada en la supervivencia libre de progresión de la enfermedad. En la población elegible desde el punto de vista de la histología, los resultados de eficacia fueron similares. El alcance de una respuesta objetiva radiológica o el mantenimiento del estado libre de progresión de la enfermedad se asoció firmemente al mantenimiento o la mejoría de la calidad de vida.
Población pediátrica
Se ha estudiado TMZ por vía oral en pacientes pediátricos (edad 3-18 años) con glioma recurrente del tronco encefálico o astrocitoma de alto grado recurrente, en un régimen de administración diaria durante 5 días cada 28 días. La tolerancia a TMZ es similar a la de los adultos.
5.2 Propiedades farmacocinéticas
TMZ se hidroliza espontáneamente a pH fisiológico principalmente a los metabolitos activos, 3-metil(triazeno-1-il)imidazol-4-carboxamida (MTIC). MTIC se hidroliza espontáneamente a 5-amino-imidazol-4-carboxamida (AIC), un conocido intermediario en la biosíntesis de purinas y ácidos nucleicos, y a metilhidrazina, que se cree que es el metabolito alquilante activo. Se cree que la citotoxicidad de MTIC se debe fundamentalmente a la alquilación del ADN principalmente en las posiciones O6 y N7 de la guanina. En relación al AUC de temozolomida, la exposición a MTIC y AIC es ~ 2,4 % y 23 %, respectivamente. In vivo, el ti/2 de MTIC fue similar a la de TMZ, 1,8 h..
Absorción
Tras la administración oral a pacientes adultos, TMZ se absorbió rápidamente, con concentraciones máximas alcanzadas tan solo 20 minutos después de la administración (tiempo promedio entre 0,5 y
1,5 horas). Tras la administración oral de TMZ marcada con 14C, la excreción fecal promedio de 14C durante los siguientes 7 días después de la dosis fue de 0,8 % indicando la absorción completa.
Distribución
TMZ demuestra baja unión a proteínas (10 % a 20 %), y por lo tanto, no se espera que interactúe con sustancias de alta afinidad por proteínas.
Los estudios de tomografía por emisión de positrones (TEP) en seres humanos y los datos preclínicos sugieren que TMZ cruza la barrera hematoencefálica rápidamente y está presente en el LCR. La penetración del LCR se confirmó en un paciente, la exposición del LCR basada en el AUC de TMZ fue aproximadamente de un 30 % de éste en el plasma, lo que es coherente con los datos en animales.
Eliminación
La vida media en el plasma (t1/2) es aproximadamente de 1,8 horas. La ruta principal de eliminación del 14C es la renal. Tras la administración oral, aproximadamente el 5 % al 10 % de la dosis se recupera sin cambios en la orina durante 24 horas, y el resto se excreta como temozolomida ácida, 5-aminoimidazol-4-carboxamida (AIC) o metabolitos polares sin identificar.
Las concentraciones en plasma aumentan de manera relacionada con la dosis. El aclaramiento del plasma, el volumen de distribución y la vida media son independientes de la dosis.
Poblaciones especiales
El análisis de la farmacocinética basada en la población de TMZ reveló que el aclaramiento de TMZ en el plasma fue independiente de la edad, función renal o consumo de tabaco. En un estudio farmacocinético diferente, los perfiles farmacocinéticos del plasma en pacientes con disfunción hepática leve a moderada fueron similares a los observados en pacientes con función hepática normal.
Los pacientes pediátricos presentaron un AUC mayor que los pacientes adultos; no obstante, la dosis máxima tolerada (DMT) fue de 1.000 mg/m2 por ciclo en niños y en adultos.
5.3 Datos preclínicos sobre seguridad
Se llevaron a cabo estudios de toxicidad tras un solo ciclo (administración durante 5 días, 23 días sin tratamiento), 3 ciclos y 6 ciclos en ratas y perros. Las dianas principales de la toxicidad fueron la médula ósea, el sistema linforreticular, los testículos, el tracto gastrointestinal, y, a dosis superiores, que fueron letales para del 60 % al 100 % de las ratas y perros tratados, se produjo la degeneración de la retina. La mayoría de la toxicidad mostró evidencia de reversibilidad, excepto las reacciones adversas sobre el sistema reproductor masculino y la degeneración de la retina. No obstante, dado que las dosis implicadas en la degeneración de la retina se encontraban en el intervalo de dosis letal y no se ha observado un efecto comparable en los estudios clínicos, no se consideró que este resultado tuviera relevancia clínica.
TMZ es un agente alquilante embriotóxico, teratogénico y genotóxico. TMZ es más tóxica en la rata y el perro que en los seres humanos, y la dosis clínica se acerca a la dosis letal mínima en ratas y perros. Las reducciones, relacionadas con la dosis, en los leucocitos y las plaquetas parecen ser unos indicadores sensibles de toxicidad. En el estudio de administración a ratas durante 6 ciclos, se observaron varias neoplasias, incluyendo carcinoma de mama, queratoacantoma y adenoma de células basales mientras que en los estudios en perros no se observaron tumores o alteraciones preneoplásicas. La rata parece ser particularmente sensible a los efectos oncogénicos de TMZ, con la aparición de los primeros tumores dentro de los 3 meses del inicio del tratamiento. Este periodo de latencia es muy corto incluso para un agente alquilante.
Los resultados de los test de Ames/salmonella y de aberración cromosómica en Linfocitos de Sangre Periférica Humana (HPBL) mostraron una respuesta positiva de mutagenicidad.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Contenido de la cápsula:
lactosa anhidra,
sílice anhidra coloidal,
glicolato sódico de almidón tipo A,
ácido tartárico,
ácido esteárico.
Cuerpos de las cápsulas: gelatina,
dióxido de titanio (E 171), lauril sulfato sódico, carmín de índigo (E 132).
Impresión:
goma laca,
propilenglicol,
agua purificada,
hidróxido amónico,
hidróxido de potasio,
óxido negro de hierro (E 172).
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
3 años
6.4 Precauciones especiales de conservación
Presentación en frascos
No conservar a temperatura superior a 30°C.
Conservar en el frasco original para protegerlo de la humedad. Mantener el frasco perfectamente cerrado.
Presentación en sobres
No conservar a temperatura superior a 30°C.
6.5 Naturaleza y contenido del envase
Presentación en frascos
Frascos de vidrio ámbar de tipo I con cierre de polipropileno a prueba de niños, que contienen 5 ó 20 cápsulas duras.
El envase de cartón contiene 1 frasco.
Presentación en sobres
Los sobres están compuestos por polietileno de baja densidad lineal (capa más interna), aluminio y tereftalato de polietileno.
Cada sobre contiene 1 cápsula dura y se dispensa en envase de cartón.
El envase de cartón contiene 5 ó 20 cápsulas duras, selladas en sobres individualmente.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Las cápsulas no se deben abrir. Si una cápsula se rompiera, se debe evitar el contacto del contenido en polvo con la piel o membranas mucosas. Si Temodal entra en contacto con la piel o mucosas, debe lavarse inmediata y concienzudamente con jabón y agua.
Se debe informar a los pacientes para que mantengan las cápsulas fuera de la vista y del alcance de los niños, preferiblemente en un armario cerrado con llave. La ingestión accidental puede ser mortal en niños.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU Reino Unido
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/98/096/009
EU/1/98/096/010
EU/1/98/096/017
EU/1/98/096/018
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA
AUTORIZACIÓN
Fecha de la primera autorización: 26/enero/1999 Fecha de la última renovación: 26/enero/2009
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
1. NOMBRE DEL MEDICAMENTO
Temodal 180 mg cápsulas duras
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada cápsula dura contiene 180 mg de temozolomida (temozolomide).
Excipiente con efecto conocido:
Cada cápsula dura contiene 316,3 mg de lactosa anhidra.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Cápsula dura (cápsula).
Las cápsulas duras tienen un cuerpo blanco opaco, una tapa naranja opaca, y están impresas con tinta negra. La tapa lleva impreso “Temodal”. El cuerpo lleva impreso “180 mg”, el logo de Schering-Plough y dos rayas.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Temodal está indicado en el tratamiento de:
- pacientes adultos con glioblastoma multiforme de nuevo diagnóstico concomitante con radioterapia (RT) y posteriormente como tratamiento en monoterapia.
- niños a partir de tres años de edad, adolescentes y pacientes adultos con glioma maligno, tal como glioblastoma multiforme o astrocitoma anaplásico, que presentan recurrencia o progresión después de terapia estándar.
4.2 Posología y forma de administración
Temodal sólo debe ser prescrito por médicos con experiencia en el tratamiento oncológico de tumores cerebrales.
Puede administrarse terapia antiemética (ver sección 4.4).
Posología
Pacientes adultos con glioblastoma multiforme de nuevo diagnóstico
Temodal se administra en combinación con radioterapia focal (fase concomitante) seguido de hasta 6 ciclos de monoterapia con temozolomida (TMZ) (fase de monoterapia).
Fase concomitante
Se administra TMZ a una dosis de 75 mg/m2 al día por vía oral durante 42 días como tratamiento concomitante a la radioterapia focal (60 Gy administrados en 30 fracciones). No se recomiendan reducciones de dosis, pero se decidirá semanalmente el retraso o la suspensión de la administración de TMZ de acuerdo a los criterios de toxicidad hematológica y no hematológica. La administración de TMZ se puede continuar durante todo el periodo concomitante de 42 días (hasta 49 días) si se cumplen todas y cada una de las siguientes condiciones:
- recuento absoluto de neutrófilos (RAN) > 1,5 x 109/l
- recuento de trombocitos > 100 x 109/l
- toxicidad no hematológica según los criterios de toxicidad común (CTC) < Grado 1 (excepto para alopecia, náuseas y vómitos).
Durante el tratamiento se deberá realizar semanalmente un hemograma completo. La administración de TMZ se deberá interrumpir o suspender permanentemente durante la fase concomitante de acuerdo a los criterios de toxicidad hematológica y no hematológica según la Tabla 1.
|
Tabla 1. Interrupción o suspensión de la dosificación con TMZ durante el tratamiento concomitante de radioterapia y TMZ | ||
|
Toxicidad |
Interrupción de TMZa |
Suspensión de TMZ |
|
Recuento Absoluto de Neutrófilos |
> 0,5 y < 1,5 x 109/l |
< 0,5 x 109/l |
|
Recuento de Trombocitos |
> 10 y < 100 x 109/l |
< 10 x 109/l |
|
Toxicidad no hematológica según CTC (excepto para alopecia, náuseas y vómitos) |
Grado 2 según CTC |
Grado 3 ó 4 según CTC |
a: El tratamiento con TMZ concomitante se puede continuar si se cumplen todas y cada una de las siguientes condiciones: recuento absoluto de neutrófilos > 1,5 x 109/l, recuento de trombocitos > 100 x 109/l, toxicidad no hematológica según CTC < Grado 1 (excepto para alopecia, náuseas y vómitos).
Fase de monoterapia
Cuatro semanas después de completar la fase concomitante de TMZ + RT, se administran hasta 6 ciclos de TMZ en monoterapia. La dosis en el Ciclo 1 (monoterapia) es de 150 mg/m2 una vez al día, durante 5 días, seguido de 23 días sin tratamiento. Al principio del Ciclo 2, la dosis se aumenta a 200 mg/m2 si la toxicidad no hematológica según CTC en el Ciclo 1 es de Grado < 2 (excepto para alopecia, náuseas y vómitos), el recuento absoluto de neutrófilos (RAN) es > 1,5 x 109/l y el recuento de trombocitos > 100 x 109/l. Si la dosis no se aumentó en el Ciclo 2, no se deberá aumentar la dosis en los ciclos posteriores. Si se aumentó la dosis, se mantiene a 200 mg/m2 al día durante los primeros 5 días de cada ciclo posterior, excepto si se produce toxicidad. Las reducciones y suspensiones de dosis durante la fase de monoterapia se deberán realizar de acuerdo a las Tablas 2 y 3.
Durante el tratamiento se deberá realizar un hemograma completo en el Día 22 (21 días después de la primera dosis de TMZ). La dosis se reducirá o se suspenderá la administración de acuerdo a la Tabla 3.
|
Tabla 2. Niveles de dosis de TMZ para el tratamiento en monoterapia | ||
|
Nivel de dosis |
Dosis de TMZ (mg/m2/día) |
Observaciones |
|
-1 |
100 |
Reducción por toxicidad previa |
|
0 |
150 |
Dosis durante el Ciclo 1 |
|
1 |
200 |
Dosis durante los Ciclos 2-6 en ausencia de toxicidad |
|
Tabla 3. Reducción o suspensión de la dosis de TMZ durante el tratamiento en monoterapia | ||
|
Toxicidad |
Reducir TMZ 1 nivel de dosisa |
Suspender TMZ |
|
Recuento absoluto de neutrófilos |
< 1,0 x 109/l |
Ver nota b |
|
Recuento de trombocitos |
< 50 x 109/l |
Ver nota b |
|
Toxicidad no hematológica según CTC (excepto para alopecia, náuseas y vómitos) |
Grado 3 según CTC |
Grado 4b según CTC |
a: Los niveles de dosis de TMZ aparecen en la Tabla 2. b: Se suspende TMZ si:
• El nivel de dosis -1 (100 mg/m2) todavía provoca toxicidad inaceptable
• La misma toxicidad no hematológica de Grado 3 (excepto para alopecia, náuseas, vómitos) vuelve a aparecer tras la reducción de dosis.
Pacientes adultos y _pediátricos de 3 años de edad o mayores con glioma maligno recurrente o progresivo:
Un ciclo de tratamiento es de 28 días. En pacientes no tratados previamente con quimioterapia, TMZ se administra por vía oral a la dosis de 200 mg/m2 una vez al día durante los primeros 5 días seguido de una interrupción del tratamiento de 23 días (un total de 28 días). En los pacientes tratados previamente con quimioterapia, la dosis inicial es de 150 mg/m2 una vez al día, que debe incrementarse en el segundo ciclo a 200 mg/m2 una vez al día, durante 5 días si no apareciera toxicidad hematológica (ver sección 4.4).
Poblaciones especiales
Población pediátrica
En pacientes de edad igual o superior a 3 años, sólo debe usarse TMZ en glioma maligno recurrente o progresivo. La experiencia en estos niños es muy limitada (ver secciones 4.4 y 5.1). No se ha establecido la seguridad y la eficacia de TMZ en niños menores de 3 años. No se dispone de datos.
Pacientes con disfunción hepática o renal
La farmacocinética de la TMZ fue comparable en pacientes con función hepática normal y en aquellos con disfunción hepática leve o moderada. No hay datos disponibles sobre la administración de TMZ a pacientes con disfunción hepática grave (Clase C de Child) o con disfunción renal. En base a las propiedades farmacocinéticas de la TMZ, es improbable que se requieran reducciones de dosis en pacientes con disfunción hepática grave o cualquier grado de disfunción renal. Sin embargo, se debe tener precaución al administrar TMZ a estos pacientes.
Pacientes de edad avanzada
En base al análisis farmacocinético en pacientes de 19-78 años de edad, el aclaramiento de TMZ no se ve afectado por la edad. Sin embargo, los pacientes de edad avanzada (> 70 años de edad) parecen tener un aumento en el riesgo de neutropenia y trombocitopenia (ver sección 4.4).
Forma de administración
Temodal cápsulas duras debe administrarse en estado de ayuno.
Las cápsulas deben tragarse enteras con un vaso de agua y no deben abrirse o masticarse.
Si después de la administración de la dosis se produce vómito, no debe administrarse una segunda dosis ese día.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a algunos de los excipientes incluidos en la sección 6.1. Hipersensibilidad a la dacarbazina (DTIC).
Mielosupresión severa (ver sección 4.4).
4.4 Advertencias y precauciones especiales de empleo
Infecciones oportunistas y reactivación de infecciones
Durante el tratamiento con TMZ, se han observado infecciones oportunistas (como neumonía por Pneumocystis jirovecii) y reactivación de infecciones (como VHB, CMV) (ver sección 4.8).
Los pacientes que recibieron concomitantemente TMZ y RT en un ensayo piloto durante el régimen prolongado de 42 días presentaron un especial riesgo de desarrollar neumonía por Pneumocystis jirovecii (PCP). Por lo tanto, se requiere profilaxis frente a PCP en todos los pacientes que reciban concomitantemente TMZ y RT durante el régimen de 42 días (hasta un máximo de 49 días) con independencia del recuento de linfocitos. Si se produce linfopenia, deben continuar con la profilaxis hasta que la recuperación de la linfopenia sea de un grado < 1.
Puede haber una mayor incidencia de PCP cuando se administra TMZ durante un régimen de dosificación más largo. No obstante, todos los pacientes que reciban TMZ, en especial los pacientes que reciban esteroides, deberán ser vigilados estrechamente en cuanto al desarrollo de PCP con independencia del régimen. Se han notificado casos de insuficiencia respiratoria mortal en pacientes en tratamiento con TMZ, en particular en combinación con dexametasona u otros esteroides.
VHB
Se ha notificado hepatitis debida a una reactivación del virus de la hepatitis B (VHB), resultando en algunos casos mortal. Se debe consultar a los expertos en enfermedades hepáticas antes de iniciar el tratamiento en pacientes con serología para la hepatitis B positiva (incluyendo aquellos pacientes con la enfermedad activa). Durante el tratamiento, los pacientes deben ser controlados y tratados como corresponda.
Hepatotoxicidad
Se han notificado lesiones hepáticas incluyendo insuficiencia hepática mortal en pacientes tratados con TMZ (ver sección 4.8). Se deben determinar los valores basales de la función hepática antes de iniciar el tratamiento. Si fueran anómalos, el médico debe evaluar el beneficio/riesgo antes de iniciar el tratamiento con temozolamida, incluyendo el riesgo potencial de insuficiencia hepática mortal. En pacientes en un ciclo de tratamiento de 42 días, las pruebas se deben repetir en mitad del ciclo. En todos los pacientes, las pruebas de la función hepática se deben repetir después de cada ciclo de tratamiento. El médico debe evaluar el beneficio/riesgo de continuar el tratamiento en pacientes con anomalías significativas de la función hepática. La toxicidad hepática puede aparecer varias semanas o más, después del último tratamiento con temozolomida.
Neoplasias malignas
También se han observado casos muy raros de síndrome mielodisplásico y neoplasias secundarias, incluyendo leucemia mieloide (ver sección 4.8).
Terapia antiemética
Las náuseas y los vómitos se asocian muy frecuentemente con TMZ.
Se puede administrar la terapia antiemética antes o después de la administración de TMZ.
Pacientes adultos con glioblastoma multiforme de nuevo diagnóstico
Se recomienda profilaxis antiemética antes de la dosis inicial de la fase concomitante, y se recomienda encarecidamente durante la fase de monoterapia.
Pacientes con glioma maligno recurrente o progresivo
Los pacientes que hayan experimentado fuertes vómitos (Grado 3 ó 4) en ciclos de tratamiento previos pueden precisar tratamiento antiemético.
Parámetros de laboratorio
Los pacientes en tratamiento con TMZ pueden presentar mielosupresión, incluyendo pancitopenia prolongada, que puede derivar en anemia aplásica que, en ciertos casos, puede terminar en fallecimiento. En algunos casos, la exposición a medicamentos concomitantes asociados a la anemia aplásica, tales como carbamazepina, fenitoína y sulfametoxazol/trimetoprima complica la valoración. Antes de la administración, deberán cumplirse los siguientes parámetros de laboratorio: RAN > 1,5 x 109/1 y recuento de plaquetas > 100 x 109/l. Deberá practicarse un hemograma completo el Día 22 (21 días después de la primera dosis) o dentro de las 48 horas de dicho día, y una vez a la semana hasta que el RAN sea > 1,5 x 109/l y el recuento de plaquetas sea > 100 x 109/l. Si el RAN disminuyera a < 1,0 x 109/l o el recuento de plaquetas fuera < 50 x 109/l durante cualquier ciclo, se disminuirá un nivel de dosis en el siguiente ciclo (ver sección 4.2). Los niveles de dosis son de 100 mg/m2, 150 mg/m2 y 200 mg/m2. La dosis más baja recomendada es de 100 mg/m2.
Población pediátrica
No hay experiencia clínica sobre el empleo de TMZ en niños menores de 3 años de edad. La experiencia en niños mayores y adolescentes es muy limitada (ver sección 4.2 y 5.1).
Pacientes de edad avanzada (> 70 años de edad)
Los pacientes de edad avanzada parecen presentar un mayor riesgo de neutropenia y trombocitopenia que los pacientes más jóvenes. Por lo tanto, se debe tener precaución especial cuando se administre TMZ a pacientes de edad avanzada.
Pacientes varones
Debe advertirse a los hombres que vayan a ser tratados con TMZ que eviten dejar embarazada a su pareja durante los 6 meses posteriores al tratamiento y que busquen asesoramiento sobre crioconservación del esperma antes del tratamiento (ver sección 4.6).
Lactosa
Este medicamento contiene lactosa. Los pacientes con intolerancia hereditaria a galactosa, insuficiencia de lactasa de Lapp o malabsorción de glucosa o galactosa no deben tomar este medicamento.
4.5 Interacción con otros medicamentos y otras formas de interacción
En otro estudio en fase I, la administración de TMZ con ranitidina no provocó modificaciones del grado de absorción de la temozolomida o de la exposición a su metabolito activo monometil triazenoimidazol carboxamida (MTIC).
La administración de TMZ con los alimentos resultó en una disminución del 33 % de la Cmax y en una disminución del 9 % del área bajo la curva (AUC).
Como no se puede excluir que el cambio en la Cmax sea clínicamente importante, Temodal no debe administrarse junto a alimentos.
En base a un análisis de la farmacocinética de población observado en ensayos en fase II, la coadministración de dexametasona, proclorperazina, fenitoína, carbamazepina, ondansetrón, antagonistas de los receptores H2 o fenobarbital no modificó la eliminación de la TMZ. Se asoció la coadministración de ácido valproico con una pequeña pero estadísticamente significativa disminución del aclaramiento de TMZ.
No se han llevado a cabo estudios para determinar el efecto de TMZ sobre el metabolismo o eliminación de otros fármacos. No obstante, dado que TMZ no experimenta metabolismo hepático y muestra una baja unión a proteínas, es improbable que afecte a la farmacocinética de otros medicamentos (ver sección 5.2).
El empleo de TMZ en combinación con otros agentes mielosupresores puede aumentar la probabilidad de mielosupresión.
Población pediátrica
Los estudios de interacciones se han realizado sólo en adultos.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No hay datos en mujeres embarazadas. En los estudios preclínicos en ratas y conejos tratados con 150 mg/m2 de TMZ se observó teratogenia y/o toxicidad fetal (ver sección 5.3).
Temodal no debe administrarse a mujeres embarazadas. Si se debe considerar su uso durante el embarazo, la paciente debe ser informada del riesgo potencial para el feto.
Lactancia
Se desconoce si TMZ se excreta en la leche materna; por tanto, se debe interrumpir la lactancia durante el tratamiento con TMZ.
Mujeres en edad fértil
Se debe aconsejar a las mujeres en edad fértil el uso de un método anticonceptivo eficaz para evitar el embarazo mientras estén en tratamiento con TMZ.
Fertilidad masculina
TMZ puede tener efectos genotóxicos. Por lo tanto, se advierte a los hombres que vayan a ser tratados con ella que eviten dejar embarazada a su pareja hasta que hayan transcurrido 6 meses desde la última dosis y que busquen asesoramiento sobre crioconservación del esperma antes del tratamiento dada la posibilidad de infertilidad irreversible debido a la terapia con TMZ.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
TMZ tiene una influencia baja sobre la capacidad para conducir y utilizar máquinas debido a la fatiga y somnolencia (ver sección 4.8).
4.8 Reacciones adversas
Experiencia de ensayos clínicos
En pacientes tratados con TMZ, ya sea en combinación con RT o como monoterapia tras RT para glioblastoma multiforme de nuevo diagnóstico o como monoterapia en pacientes con glioma recurrente o progresivo, las reacciones adversas muy frecuentes notificadas fueron similares: náuseas, vómitos, estreñimiento, anorexia, cefalea y fatiga. Se notificaron de manera muy frecuente convulsiones en pacientes con glioblastoma multiforme de nuevo diagnóstico que recibieron monoterapia, y se notificó sarpullido muy frecuentemente en pacientes con glioblastoma multiforme de nuevo diagnóstico que recibieron TMZ en combinación con RT y también en monoterapia, y se notificó frecuentemente en glioma recurrente. La mayoría de las alteraciones de parámetros hematológicos se notificaron, según lo esperado, como frecuentes o muy frecuentes en ambas indicaciones (Tablas 4 y 5); después de cada tabla se recogen las frecuencias relativas a los parámetros de laboratorio de grados 3 y 4.
En las tablas, los efectos adversos se clasifican según la clasificación por órganos y sistemas y la frecuencia. Los grupos de frecuencia se definen según la siguiente convención: Muy frecuentes (> 1/10); Frecuentes (> 1/100 a < 1/10); Poco frecuentes (> 1/1.000 a < 1/100); Raras (> 1/10.000 a < 1/1.000); Muy raras (< 1/10.000). Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
Glioblastoma multiforme de nuevo diagnóstico
La Tabla 4 incluye reacciones adversas derivadas del tratamiento en pacientes con glioblastoma multiforme de nuevo diagnóstico durante las fases de tratamiento concomitante y en monoterapia.
|
Tabla 4. Acontecimientos derivados del tratamiento durante las fases de tratamiento concomitante y en monoterapia en pacientes con glioblastoma multiforme de nuevo diagnóstico | ||
|
Clasificación por órganos y sistemas |
TMZ + radioterapia concomitante n=288* |
TMZ en monoterapia n=224 |
|
Infecciones e infestaciones | ||
|
Frecuentes: |
Infección, herpes simple, infección de una herida, faringitis, candidiasis oral |
Infección, candidiasis oral |
|
Poco frecuentes: |
Herpes simple, herpes zoster, síntomas pseudogripales | |
|
Trastornos de la sangre y del sistema linfático | ||
|
Frecuentes: |
Neutropenia, trombocitopenia, linfopenia, leucopenia |
Neutropenia febril, trombocitopenia, anemia, leucopenia |
|
Poco frecuentes: |
Neutropenia febril, anemia |
Linfopenia, petequia |
|
Trastornos endocrinos | ||
|
Poco frecuentes: |
Cushingoide |
Cushingoide |
|
Trastornos del metabolismo y de la nutrición | ||
|
Muy frecuentes: |
Anorexia |
Anorexia |
|
Frecuentes: |
Hiperglucemia, pérdida de peso |
Pérdida de peso |
|
Poco frecuentes: |
Hipopotasemia, aumento de la fosfatasa alcalina, aumento de peso |
Hiperglucemia, aumento de peso |
|
Trastornos psiquiátricos | ||
|
Frecuentes: |
Ansiedad, labilidad emocional, insomnio |
Ansiedad, depresión, labilidad emocional, insomnio |
|
Poco frecuentes: |
Agitación, apatía, alteración del comportamiento, depresión, alucinaciones |
Alucinaciones, amnesia |
|
Trastornos del sistema nervioso | ||
|
Muy frecuentes: |
Cefalea |
Convulsiones, cefalea |
|
Frecuentes: |
Convulsiones, pérdida de conocimiento, somnolencia, afasia, alteración del equilibrio, mareo, confusión, pérdida de memoria, disminución de la concentración, neuropatía, parestesia, trastorno en el habla, temblor |
Hemiparesia, afasia, alteración del equilibrio, somnolencia, confusión, mareo, pérdida de memoria, disminución de la concentración, disfasia, trastorno neurológico (NOS), neuropatía, neuropatía periférica, parestesia, trastorno en el habla, temblor |
|
Poco frecuentes: |
Status epilepticus, trastorno extrapiramidal, hemiparesia, ataxia, trastorno cognitivo, disfasia, trastorno de la marcha, hiperestesia, hipoestesia, trastorno neurológico (NOS), neuropatía periférica |
Hemiplejía, ataxia, alteración en la coordinación, trastorno de la marcha, hiperestesia, trastorno sensorial |
|
Trastornos oculares | ||
|
Frecuentes: |
Visión borrosa |
Defecto en el campo visual, visión borrosa, diplopía |
|
Poco frecuentes: |
Hemianopsia, disminución de la agudeza visual, trastorno en la visión, defecto en el campo visual, dolor ocular |
Disminución de la agudeza visual, dolor ocular, sequedad ocular |
|
Trastornos del oído y del laberinto | ||
|
Frecuentes: |
Trastorno en la audición |
Trastorno en la audición, tinnitus |
|
Poco frecuentes: |
Otitis media, tinnitus, hiperacusia, otalgia |
Sordera, vértigo, otalgia |
|
Trastornos cardiacos | ||
|
Poco frecuentes: |
Palpitaciones | |
|
Trastornos vasculares | ||
|
Frecuentes: |
Hemorragia, edema, edema de piernas |
Hemorragia, trombosis venosa profunda, edema de piernas |
|
Poco frecuentes: |
Hemorragia cerebral, hipertensión |
Embolismo pulmonar, edema, edema periférico |
|
Trastornos respiratorios, torácicos y mediastínicos | ||
|
Frecuentes: |
Disnea, tos |
Disnea, tos |
|
Poco frecuentes: |
Neumonía, infección respiratoria superior, congestión nasal |
Neumonía, sinusitis, infección respiratoria superior, bronquitis |
|
Trastornos gastrointestinales | ||
|
Muy frecuentes: |
Estreñimiento, náuseas, vómitos |
Estreñimiento, náuseas, vómitos |
|
Frecuentes: |
Estomatitis, diarrea, dolor abdominal, dispepsia, disfagia |
Estomatitis, diarrea, dispepsia, disfagia, sequedad de boca |
|
Poco frecuentes: |
Distensión abdominal, incontinencia fecal, trastorno gastrointestinal (NOS), gastroenteritis, hemorroides | |
|
Trastornos de la piel y del tejido subcutáneo | ||
|
Muy frecuentes: |
Sarpullido, alopecia |
Sarpullido, alopecia |
|
Frecuentes: |
Dermatitis, sequedad cutánea, eritema, prurito |
Sequedad cutánea, prurito |
|
Poco frecuentes: |
Exfoliación cutánea, reacción de fotosensibilidad, alteración en la pigmentación |
Eritema, alteración en la pigmentación, aumento de la sudoración |
|
Trastornos musculoesqueléticos y del tejido conjuntivo | ||
|
Frecuentes: |
Debilidad muscular, artralgia |
Debilidad muscular, artralgia, dolor musculoesquelético, mialgia |
|
Poco frecuentes: |
Miopatía, dolor de espalda, dolor musculoesquelético, mialgia |
Miopatía, dolor de espalda |
|
Trastornos renales y urinarios | ||
|
Frecuentes: |
Polaquiuria, incontinencia urinaria |
Incontinencia urinaria |
|
Poco frecuentes: |
Disuria | |
|
Trastornos del aparato reproductor y de la mama | ||
|
Poco frecuentes: |
Impotencia |
Hemorragia vaginal, menorragia, amenorrea, vaginitis, dolor de mama |
|
Trastornos generales y alteraciones en el lugar de administración | ||
|
Muy frecuentes: |
Fatiga |
Fatiga |
|
Frecuentes: |
Reacción alérgica, fiebre, lesión por radiación, edema facial, dolor, alteración del gusto |
Reacción alérgica, fiebre, lesión por radiación, dolor, alteración del gusto |
|
Poco frecuentes: |
Astenia, rubor, sofocos, empeoramiento de una enfermedad, escalofríos, cambio de color de la lengua, parosmia, sed |
Astenia, edema facial, dolor, empeoramiento de una enfermedad, escalofríos, trastorno dental |
|
Exploraciones complementarias | ||
|
Frecuentes: |
Aumento de ALT |
Aumento de ALT |
|
Poco frecuentes: |
Aumento de enzimas hepáticas, aumento de Gamma GT, aumento de AST | |
*Un paciente que se aleatorizó al brazo de RT únicamente, recibió TMZ + RT.
Resultados de laboratorio
Se observó mielosupresión (neutropenia y trombocitopenia), que es toxicidad limitante de dosis conocida para la mayoría de los agentes citotóxicos, incluido TMZ. Cuando las alteraciones en las pruebas de laboratorio y las reacciones adversas se sumaron entre las fases de tratamiento concomitante y en monoterapia, se observaron alteraciones en neutrófilos de Grado 3 o de Grado 4, incluyendo acontecimientos neutropénicos, en el 8 % de los pacientes. Se observaron alteraciones en los trombocitos de Grado 3 o Grado 4, incluyendo acontecimientos trombocitopénicos en el 14 % de los pacientes que recibieron TMZ.
Glioma maligno recurrente o progresivo
En los ensayos clínicos, las reacciones adversas que se produjeron más frecuentemente relacionadas con el tratamiento fueron los trastornos gastrointestinales, concretamente náuseas (43 %) y vómitos (36 %). Estas reacciones fueron normalmente de Grado 1 ó 2 (0-5 episodios de vómitos en 24 horas) y se autolimitaron o controlaron rápidamente con tratamiento antiemético estándar. La incidencia de náuseas y vómitos intensos fue del 4 %.
La Tabla 5 incluye reacciones adversas notificadas durante ensayos clínicos en glioma maligno recurrente o progresivo y después de la comercialización de Temodal.
|
Tabla 5. Reacciones adversas en pacientes con glioma maligno recurrente o progresivo | |
|
Infecciones e infestaciones | |
|
Raras: |
Infecciones oportunistas, incluyendo PCP |
|
Trastornos de la sangre y del sistema linfático | |
|
Muy frecuentes: |
Neutropenia o linfopenia (grado 3-4), trombocitopenia (grado 3-4) |
|
Poco frecuentes: |
Pancitopenia, anemia (grado 3-4), leucopenia |
|
Trastornos del metabolismo y de la nutrición | |
|
Muy frecuentes: |
Anorexia |
|
Frecuentes: |
Pérdida de peso |
|
Trastornos del sistema nervioso | |
|
Muy frecuentes: |
Cefalea |
|
Frecuentes: |
Somnolencia, mareo, parestesia |
|
Trastornos respiratorios, torácicos y mediastínicos | |
|
Frecuentes: |
Disnea |
|
Trastornos gastrointestinales | |
|
Muy frecuentes: |
Vómitos, náuseas, estreñimiento |
|
Frecuentes: |
Diarrea, dolor abdominal, dispepsia |
|
Trastornos de la piel y del tejido subcutáneo | |
|
Frecuentes: |
Sarpullido, prurito, alopecia |
|
Muy raros: |
Eritema multiforme, eritrodermia, urticaria, exantema |
|
Trastornos generales y alteraciones en el lugar de administración | |
|
Muy frecuentes: |
Fatiga |
|
Frecuentes: |
Fiebre, astenia, escalofríos, malestar general, dolor, alteraciones en el gusto |
|
Muy raras: |
Reacciones alérgicas, incluyendo anafilaxia, angioedema |
Resultados de laboratorio
Se produjeron trombocitopenia y neutropenia de Grados 3 ó 4 en el 19 % y 17 %, respectivamente, de los pacientes tratados por glioma maligno. Esto provocó la hospitalización y/o interrupción del tratamiento con TMZ en el 8 % y 4 %, respectivamente. La mielosupresión fue previsible (normalmente dentro de los primeros ciclos, con el valor más bajo de parámetros hematológicos (nadir) entre el Día 21 y el Día 28), y la recuperación fue rápida, generalmente en 1-2 semanas. No se observó evidencia de una mielosupresión de tipo acumulativo. La presencia de trombocitopenia puede incrementar el riesgo de hemorragia, y la presencia de neutropenia o leucopenia puede incrementar el riesgo de infección.
Género
En un análisis de farmacocinética basada en la población sobre la experiencia en ensayos clínicos se disponía de los datos del nadir de los recuentos de neutrófilos para 101 mujeres y 169 hombres, y del nadir de plaquetas para 110 mujeres y 174 hombres. En el primer ciclo de terapia hubo tasas más altas de neutropenia de Grado 4 (RAN < 0,5 x 109/l), 12 % frente al 5 %, y trombocitopenia (< 20 x 109/l),
9 % frente al 3 %, en mujeres que en hombres. En una serie de datos de 400 pacientes con glioma recurrente, tras el primer ciclo de terapia, se produjo neutropenia de Grado 4 en el 8 % de las mujeres frente al 4 % de los hombres, y trombocitopenia de Grado 4 en el 8 % de las mujeres frente al 3 % de los hombres. En un ensayo con 288 pacientes con glioblastoma multiforme de nuevo diagnóstico, se produjo, en el primer ciclo de terapia, neutropenia de Grado 4 en el 3 % de las mujeres frente al 0 % de los hombres, y trombocitopenia de Grado 4 en el 1 % de las mujeres frente al 0 % de los hombres.
Población pediátrica
Se ha estudiado TMZ por vía oral en pacientes pediátricos (edad 3-18 años) con glioma recurrente del tronco encefálico o astrocitoma de alto grado recurrente, en un régimen de administración diaria durante 5 días cada 28 días. Aunque los datos son limitados, cabe esperar que la tolerancia en niños sea similar a la de los adultos. No se ha determinado la seguridad de TMZ en niños menores de 3 años.
Experiencia postcomercialización
Se han identificado las siguientes reacciones adversas graves durante la exposición postcomercialización:
|
Tabla 6. Resumen de los acontecimientos notificados con temozolomida en la postcomercialización | |
|
Infecciones e infestaciones* | |
|
Poco frecuentes: |
infección por citomegalovirus, reactivación de infección de tipo citomegalovirus, virus hepatitis B1 |
|
Trastornos de la sangre y del sistema linfático | |
|
Muy raras: |
pancitopenia prolongada, anemia aplásica1 |
|
Neoplasias benignas, malignas y no especificadas | |
|
Muy raras: |
síndrome mielodisplásico, tumores malignos secundarios, incluyendo leucemia mieloide |
|
Trastornos endocrinos* | |
|
Poco frecuentes: |
diabetes insípida |
|
Trastornos respiratorios, torácicos y mediastínicos | |
|
Muy raras: |
neumonitis intersticial/neumonitis, fibrosis pulmonar, insuficiencia respiratoria1 |
|
Trastornos hepatobiliares* | |
|
Frecuentes: |
enzimas hepáticas aumentadas |
|
Poco frecuentes: |
hiperbilirrubinemia, colestasis, hepatitis, lesión hepática, insuficiencia hepática1 |
|
Trastornos de la piel y del tejido subcutáneo | |
|
Muy raras: |
necrolisis epidérmica tóxica, syndrome de Stevens-Johnson |
1 Incluyendo casos con desenlace mortal Frecuencias estimadas a partir de los ensayos clínicos pertinentes.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Anexo V.
4.9 Sobredosis
Se han evaluado clínicamente en pacientes dosis de 500, 750, 1.000 y 1.250 mg/m2 (dosis total por ciclo de 5 días). La toxicidad limitante de dosis fue hematológica y se notificó con todas las dosis, pero se espera que sea más grave a dosis más altas. Un paciente recibió una sobredosis de 10.000 mg (dosis total por ciclo de 5 días) y las reacciones adversas que se notificaron fueron pancitopenia, pirexia, fracaso multiorgánico y muerte. Se han notificado casos de pacientes que han tomado la dosis recomendada durante más de 5 días de tratamiento (hasta 64 días) notificándose reacciones adversas como supresión de médula ósea, con o sin infección, en algunos casos grave y prolongada, con resultado de muerte. En caso de sobredosis, es necesaria una evaluación hematológica. Se deben tomar medidas generales de soporte si fuera necesario.
PROPIEDADES FARMACOLÓGICAS
5.
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Agentes antineoplásicos - Otros agentes alquilantes, código ATC: L01A X03.
Mecanismo de acción
La temozolomida es un triazeno, que a pH fisiológico sufre una rápida conversión química a la monometil tiazenoimidazol carboxamida activa (MTIC). Se considera que la citotoxicidad del MTIC es consecuencia, fundamentalmente, de una alquilación en la posición O6 de la guanina, con una alquilación adicional que se produce en la posición N7. Se considera que las lesiones citotóxicas que se desarrollan posteriormente conllevan una reparación aberrante del metilo añadido.
Eficacia clínica y seguridad
Glioblastoma multiforme de nuevo diagnóstico
Se aleatorizaron un total de 573 pacientes para recibir o TMZ + RT (n=287) o RT sola (n=286). Los pacientes del brazo de TMZ + RT recibieron TMZ concomitante (75 mg/m2) una vez al día, empezando el primer día de RT hasta el último día de RT, durante 42 días (hasta un máximo de 49 días). Este tratamiento iba seguido de TMZ en monoterapia (150 - 200 mg/m2) en los Días 1 - 5 de cada ciclo de 28 días, hasta 6 ciclos, empezando 4 semanas después de la finalización de la RT. Los pacientes del brazo control sólo recibieron RT. Se necesitó profilaxis frente a neumonía por Pneumocystis jirovecii (PCP) durante la RT y la terapia combinada con TMZ.
En la fase de seguimiento se administró TMZ como terapia de rescate en 161 pacientes de los 282 (57 %) del brazo de RT sola, y en 62 pacientes de los 277 (22 %) del brazo de TMZ + RT.
El hazard ratio (HR) para la supervivencia global fue de 1,59 (95 % IC para HR=1,33 -1,91) con un rango logarítmico de p < 0,0001 a favor del brazo de TMZ. La probabilidad estimada de sobrevivir 2 o más años (26 % frente a 10 %) es mayor para el brazo de RT + TMZ. La adición de TMZ concomitante a la RT, seguida de TMZ en monoterapia en el tratamiento de pacientes con glioblastoma multiforme de nuevo diagnóstico, demostró una mejoría en la supervivencia global (SG) estadísticamente significativa en comparación con la RT sola (Figura 1).

Figura 1 Curvas de Kaplan-Meier para la supervivencia global (población por intención de
tratar)
Los resultados del ensayo no fueron coherentes en el subgrupo de pacientes con un estado funcional bajo (Performance Status OMS PS =2, n=70), en el que la supervivencia global y el tiempo hasta la progresión fueron similares en ambos brazos. No obstante, este grupo de pacientes no parece presentar riesgos inaceptables.
Glioma maligno recurrente o _progresivo
Los datos sobre eficacia clínica en pacientes con glioblastoma multiforme (índice de estado funcional de Karnofsky [KPS] > 70), progresivo o recurrente, después de cirugía y RT se basaron en dos ensayos clínicos con TMZ oral. Uno fue un ensayo no comparativo sobre 138 pacientes (el 29 % recibió quimioterapia previa), y el otro fue un ensayo aleatorizado con brazo control activo de TMZ frente a procarbazina sobre un total de 225 pacientes (el 67 % recibió tratamiento previo con quimioterapia basada en nitrosourea). En ambos ensayos, la variable principal de valoración fue la supervivencia libre de progresión (SLP) definida por los escáneres de IRM o empeoramiento neurológico. En el ensayo no comparativo, la SLP a los 6 meses fue del 19 %, la mediana de la SLP fue de 2,1 meses, y la mediana de la supervivencia global de 5,4 meses. La tasa de respuesta objetiva (ORR) en base a las IRM fue del 8 %.
En el ensayo aleatorizado de brazo control activo, la SLP a los 6 meses fue significativamente mayor para TMZ que para la procarbazina (21 % frente al 8 %, respectivamente - prueba de chi-cuadrado p= 0,008) con una mediana de la SLP de 2,89 y 1,88 meses respectivamente (Test de rango logarítmico, p = 0,0063). La mediana de la supervivencia fue de 7,34 y 5,66 meses para TMZ y procarbazina, respectivamente (rango logarítmico de p = 0,33). A los 6 meses la fracción de pacientes que sobrevivieron fue significativamente superior en el brazo de TMZ (60 %) en comparación con el brazo de procarbazina (44 %) (prueba de chi-cuadrado p = 0,019). En los pacientes que recibieron quimioterapia previa se observó un beneficio en aquellos con un KPS > 80.
Los datos sobre el tiempo hasta el empeoramiento del estado neurológico favorecieron a TMZ sobre la procarbazina, al igual que los datos sobre el tiempo hasta el empeoramiento del estado funcional (decrece hasta KPS de < 70 o decrece al menos 30 puntos). En estas variables de valoración la mediana del tiempo hasta progresión osciló entre los 0,7 y 2,1 meses más para TMZ que para la procarbazina (Test de rango logarítmico, p = < 0,01 a 0,03).
Astrocitoma anaplásico recurrente
En un ensayo de fase II, multicéntrico y prospectivo, dirigido a evaluar la seguridad y la eficacia de la TMZ oral en el tratamiento de pacientes con un astrocitoma anaplásico en su primera recaída, la SLP a los 6 meses fue del 46 %. La mediana de la SLP fue de 5,4 meses. La mediana de la supervivencia global fue de 14,6 meses. La tasa de respuesta, basada en la evaluación practicada por un revisor central, fue del 35 % (13 RC y 43 RP) en la población analizada por intención de tratar (ITT) n=162.
Se comunicó enfermedad estable en 43 pacientes. La supervivencia libre de episodios a los 6 meses en la población analizada por ITT fue del 44 %, con una mediana de la supervivencia libre de episodios de 4,6 meses, cifra que fue similar a la hallada en la supervivencia libre de progresión de la enfermedad. En la población elegible desde el punto de vista de la histología, los resultados de eficacia fueron similares. El alcance de una respuesta objetiva radiológica o el mantenimiento del estado libre de progresión de la enfermedad se asoció firmemente al mantenimiento o la mejoría de la calidad de vida.
Población pediátrica
Se ha estudiado TMZ por vía oral en pacientes pediátricos (edad 3-18 años) con glioma recurrente del tronco encefálico o astrocitoma de alto grado recurrente, en un régimen de administración diaria durante 5 días cada 28 días. La tolerancia a TMZ es similar a la de los adultos.
5.2 Propiedades farmacocinéticas
TMZ se hidroliza espontáneamente a pH fisiológico principalmente a los metabolitos activos, 3-metü(triazeno-1-ü)imidazol-4-carboxamida (MTIC). MTIC se hidroliza espontáneamente a 5-amino-imidazol-4-carboxamida (AIC), un conocido intermediario en la biosíntesis de purinas y ácidos nucleicos, y a metilhidrazina, que se cree que es el metabolito alquilante activo. Se cree que la citotoxicidad de MTIC se debe fundamentalmente a la alquilación del ADN principalmente en las posiciones O6 y N7 de la guanina. En relación al AUC de temozolomida, la exposición a MTIC y AIC es ~ 2,4 % y 23 %, respectivamente. In vivo, el ti/2 de MTIC fue similar a la de TMZ, 1,8 h..
Absorción
Tras la administración oral a pacientes adultos, TMZ se absorbió rápidamente, con concentraciones máximas alcanzadas tan solo 20 minutos después de la administración (tiempo promedio entre 0,5 y
1,5 horas). Tras la administración oral de TMZ marcada con 14C, la excreción fecal promedio de 14C durante los siguientes 7 días después de la dosis fue de 0,8 % indicando la absorción completa.
Distribución
TMZ demuestra baja unión a proteínas (10 % a 20 %), y por lo tanto, no se espera que interactúe con sustancias de alta afinidad por proteínas.
Los estudios de tomografía por emisión de positrones (TEP) en seres humanos y los datos preclínicos sugieren que TMZ cruza la barrera hematoencefálica rápidamente y está presente en el LCR. La penetración del LCR se confirmó en un paciente, la exposición del LCR basada en el AUC de TMZ fue aproximadamente de un 30 % de éste en el plasma, lo que es coherente con los datos en animales.
Eliminación
La vida media en el plasma (t1/2) es aproximadamente de 1,8 horas. La ruta principal de eliminación del 14C es la renal. Tras la administración oral, aproximadamente el 5 % al 10 % de la dosis se recupera sin cambios en la orina durante 24 horas, y el resto se excreta como temozolomida ácida, 5-aminoimidazol-4-carboxamida (AIC) o metabolitos polares sin identificar.
Las concentraciones en plasma aumentan de manera relacionada con la dosis. El aclaramiento del plasma, el volumen de distribución y la vida media son independientes de la dosis.
Poblaciones especiales
El análisis de la farmacocinética basada en la población de TMZ reveló que el aclaramiento de TMZ en el plasma fue independiente de la edad, función renal o consumo de tabaco. En un estudio farmacocinético diferente, los perfiles farmacocinéticos del plasma en pacientes con disfunción hepática leve a moderada fueron similares a los observados en pacientes con función hepática normal.
Los pacientes pediátricos presentaron un AUC mayor que los pacientes adultos; no obstante, la dosis máxima tolerada (DMT) fue de 1.000 mg/m2 por ciclo en niños y en adultos.
5.3 Datos preclínicos sobre seguridad
Se llevaron a cabo estudios de toxicidad tras un solo ciclo (administración durante 5 días, 23 días sin tratamiento), 3 ciclos y 6 ciclos en ratas y perros. Las dianas principales de la toxicidad fueron la médula ósea, el sistema linforreticular, los testículos, el tracto gastrointestinal, y, a dosis superiores, que fueron letales para del 60 % al 100 % de las ratas y perros tratados, se produjo la degeneración de la retina. La mayoría de la toxicidad mostró evidencia de reversibilidad, excepto las reacciones adversas sobre el sistema reproductor masculino y la degeneración de la retina. No obstante, dado que las dosis implicadas en la degeneración de la retina se encontraban en el intervalo de dosis letal y no se ha observado un efecto comparable en los estudios clínicos, no se consideró que este resultado tuviera relevancia clínica.
TMZ es un agente alquilante embriotóxico, teratogénico y genotóxico. TMZ es más tóxica en la rata y el perro que en los seres humanos, y la dosis clínica se acerca a la dosis letal mínima en ratas y perros. Las reducciones, relacionadas con la dosis, en los leucocitos y las plaquetas parecen ser unos indicadores sensibles de toxicidad. En el estudio de administración a ratas durante 6 ciclos, se observaron varias neoplasias, incluyendo carcinoma de mama, queratoacantoma y adenoma de células basales mientras que en los estudios en perros no se observaron tumores o alteraciones preneoplásicas. La rata parece ser particularmente sensible a los efectos oncogénicos de TMZ, con la aparición de los primeros tumores dentro de los 3 meses del inicio del tratamiento. Este periodo de latencia es muy corto incluso para un agente alquilante.
Los resultados de los test de Ames/salmonella y de aberración cromosómica en Linfocitos de Sangre Periférica Humana (HPBL) mostraron una respuesta positiva de mutagenicidad.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Contenido de la cápsula:
lactosa anhidra,
sílice anhidra coloidal,
glicolato sódico de almidón tipo A,
ácido tartárico,
ácido esteárico.
Cuerpos de las cápsulas: gelatina,
dióxido de titanio (E 171), lauril sulfato sódico, óxido amarillo de hierro (E 172), óxido rojo de hierro (E 172).
Impresión:
goma laca,
propilenglicol,
agua purificada,
hidróxido amónico,
hidróxido de potasio,
óxido negro de hierro (E 172).
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
3 años
6.4 Precauciones especiales de conservación
Presentación en frascos
No conservar a temperatura superior a 30°C.
Conservar en el frasco original para protegerlo de la humedad. Mantener el frasco perfectamente cerrado.
Presentación en sobres
No conservar a temperatura superior a 30°C.
6.5 Naturaleza y contenido del envase
Presentación en frascos
Frascos de vidrio ámbar de tipo I con cierre de polipropileno a prueba de niños, que contienen 5 ó 20 cápsulas duras.
El envase de cartón contiene 1 frasco.
Presentación en sobres
Los sobres están compuestos por polietileno de baja densidad lineal (capa más interna), aluminio y tereftalato de polietileno.
Cada sobre contiene 1 cápsula dura y se dispensa en envase de cartón.
El envase de cartón contiene 5 ó 20 cápsulas duras, selladas en sobres individualmente.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Las cápsulas no se deben abrir. Si una cápsula se rompiera, se debe evitar el contacto del contenido en polvo con la piel o membranas mucosas. Si Temodal entra en contacto con la piel o mucosas, debe lavarse inmediata y concienzudamente con jabón y agua.
Se debe informar a los pacientes para que mantengan las cápsulas fuera de la vista y del alcance de los niños, preferiblemente en un armario cerrado con llave. La ingestión accidental puede ser mortal en niños.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU Reino Unido
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/98/096/011
EU/1/98/096/012
EU/1/98/096/019
EU/1/98/096/020
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 26/enero/1999 Fecha de la última renovación: 26/enero/2009
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
1. NOMBRE DEL MEDICAMENTO
Temodal 250 mg cápsulas duras
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada cápsula dura contiene 250 mg de temozolomida (temozolomide).
Excipiente con efecto conocido:
Cada cápsula dura contiene 154,3 mg de lactosa anhidra.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Cápsula dura (cápsula).
Las cápsulas duras tienen un cuerpo y una tapa blancos opacos y están impresas con tinta negra. La tapa lleva impreso “Temodal”. El cuerpo lleva impreso “250 mg”, el logo de Schering-Plough y dos rayas.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Temodal está indicado en el tratamiento de:
- pacientes adultos con glioblastoma multiforme de nuevo diagnóstico concomitante con radioterapia (RT) y posteriormente como tratamiento en monoterapia.
- niños a partir de tres años de edad, adolescentes y pacientes adultos con glioma maligno, tal como glioblastoma multiforme o astrocitoma anaplásico, que presentan recurrencia o progresión después de terapia estándar.
4.2 Posología y forma de administración
Temodal sólo debe ser prescrito por médicos con experiencia en el tratamiento oncológico de tumores cerebrales.
Puede administrarse terapia antiemética (ver sección 4.4).
Posología
Pacientes adultos con glioblastoma multiforme de nuevo diagnóstico
Temodal se administra en combinación con radioterapia focal (fase concomitante) seguido de hasta 6 ciclos de monoterapia con temozolomida (TMZ) (fase de monoterapia).
Fase concomitante
Se administra TMZ a una dosis de 75 mg/m2 al día por vía oral durante 42 días como tratamiento concomitante a la radioterapia focal (60 Gy administrados en 30 fracciones). No se recomiendan reducciones de dosis, pero se decidirá semanalmente el retraso o la suspensión de la administración de TMZ de acuerdo a los criterios de toxicidad hematológica y no hematológica. La administración de TMZ se puede continuar durante todo el periodo concomitante de 42 días (hasta 49 días) si se cumplen todas y cada una de las siguientes condiciones:
- recuento absoluto de neutrófilos (RAN) > 1,5 x 109/l
- recuento de trombocitos > 100 x 109/l
- toxicidad no hematológica según los criterios de toxicidad común (CTC) < Grado 1 (excepto para alopecia, náuseas y vómitos).
Durante el tratamiento se deberá realizar semanalmente un hemograma completo. La administración de TMZ se deberá interrumpir o suspender permanentemente durante la fase concomitante de acuerdo a los criterios de toxicidad hematológica y no hematológica según la Tabla 1.
|
Tabla 1. Interrupción o suspensión de la dosificación con TMZ durante el tratamiento concomitante de radioterapia y TMZ | ||
|
Toxicidad |
Interrupción de TMZa |
Suspensión de TMZ |
|
Recuento Absoluto de Neutrófilos |
> 0,5 y < 1,5 x 109/l |
< 0,5 x 109/l |
|
Recuento de Trombocitos |
> 10 y < 100 x 109/l |
< 10 x 109/l |
|
Toxicidad no hematológica según CTC (excepto para alopecia, náuseas y vómitos) |
Grado 2 según CTC |
Grado 3 ó 4 según CTC |
a: El tratamiento con TMZ concomitante se puede continuar si se cumplen todas y cada una de las siguientes condiciones: recuento absoluto de neutrófilos > 1,5 x 109/l, recuento de trombocitos > 100 x 109/l, toxicidad no hematológica según CTC < Grado 1 (excepto para alopecia, náuseas y vómitos).
Fase de monoterapia
Cuatro semanas después de completar la fase concomitante de TMZ + RT, se administran hasta 6 ciclos de TMZ en monoterapia. La dosis en el Ciclo 1 (monoterapia) es de 150 mg/m2 una vez al día, durante 5 días, seguido de 23 días sin tratamiento. Al principio del Ciclo 2, la dosis se aumenta a 200 mg/m2 si la toxicidad no hematológica según CTC en el Ciclo 1 es de Grado < 2 (excepto para alopecia, náuseas y vómitos), el recuento absoluto de neutrófilos (RAN) es > 1,5 x 109/l y el recuento de trombocitos > 100 x 109/l. Si la dosis no se aumentó en el Ciclo 2, no se deberá aumentar la dosis en los ciclos posteriores. Si se aumentó la dosis, se mantiene a 200 mg/m2 al día durante los primeros 5 días de cada ciclo posterior, excepto si se produce toxicidad. Las reducciones y suspensiones de dosis durante la fase de monoterapia se deberán realizar de acuerdo a las Tablas 2 y 3.
Durante el tratamiento se deberá realizar un hemograma completo en el Día 22 (21 días después de la primera dosis de TMZ). La dosis se reducirá o se suspenderá la administración de acuerdo a la Tabla 3.
|
Tabla 2. Niveles de dosis de TMZ para el tratamiento en monoterapia | ||
|
Nivel de dosis |
Dosis de TMZ (mg/m2/día) |
Observaciones |
|
-1 |
100 |
Reducción por toxicidad previa |
|
0 |
150 |
Dosis durante el Ciclo 1 |
|
1 |
200 |
Dosis durante los Ciclos 2-6 en ausencia de toxicidad |
|
Tabla 3. Reducción o suspensión de la dosis de TMZ durante el tratamiento en monoterapia | ||
|
Toxicidad |
Reducir TMZ 1 nivel de dosisa |
Suspender TMZ |
|
Recuento absoluto de neutrófilos |
< 1,0 x 109/l |
Ver nota b |
|
Recuento de trombocitos |
< 50 x 109/l |
Ver nota b |
|
Toxicidad no hematológica según CTC (excepto para alopecia, náuseas y vómitos) |
Grado 3 según CTC |
Grado 4b según CTC |
a: Los niveles de dosis de TMZ aparecen en la Tabla 2. b: Se suspende TMZ si:
• El nivel de dosis -1 (100 mg/m2) todavía provoca toxicidad inaceptable
• La misma toxicidad no hematológica de Grado 3 (excepto para alopecia, náuseas, vómitos) vuelve a aparecer tras la reducción de dosis.
Pacientes adultos y _pediátricos de 3 años de edad o mayores con glioma maligno recurrente o progresivo:
Un ciclo de tratamiento es de 28 días. En pacientes no tratados previamente con quimioterapia, TMZ se administra por vía oral a la dosis de 200 mg/m2 una vez al día durante los primeros 5 días seguido de una interrupción del tratamiento de 23 días (un total de 28 días). En los pacientes tratados previamente con quimioterapia, la dosis inicial es de 150 mg/m2 una vez al día, que debe incrementarse en el segundo ciclo a 200 mg/m2 una vez al día, durante 5 días si no apareciera toxicidad hematológica (ver sección 4.4).
Poblaciones especiales
Población pediátrica
En pacientes de edad igual o superior a 3 años, sólo debe usarse TMZ en glioma maligno recurrente o progresivo. La experiencia en estos niños es muy limitada (ver secciones 4.4 y 5.1). No se ha establecido la seguridad y la eficacia de TMZ en niños menores de 3 años. No se dispone de datos.
Pacientes con disfunción hepática o renal
La farmacocinética de la TMZ fue comparable en pacientes con función hepática normal y en aquellos con disfunción hepática leve o moderada. No hay datos disponibles sobre la administración de TMZ a pacientes con disfunción hepática grave (Clase C de Child) o con disfunción renal. En base a las propiedades farmacocinéticas de la TMZ, es improbable que se requieran reducciones de dosis en pacientes con disfunción hepática grave o cualquier grado de disfunción renal. Sin embargo, se debe tener precaución al administrar TMZ a estos pacientes.
Pacientes de edad avanzada
En base al análisis farmacocinético en pacientes de 19-78 años de edad, el aclaramiento de TMZ no se ve afectado por la edad. Sin embargo, los pacientes de edad avanzada (> 70 años de edad) parecen tener un aumento en el riesgo de neutropenia y trombocitopenia (ver sección 4.4).
Forma de administración
Temodal cápsulas duras debe administrarse en estado de ayuno.
Las cápsulas deben tragarse enteras con un vaso de agua y no deben abrirse o masticarse.
Si después de la administración de la dosis se produce vómito, no debe administrarse una segunda dosis ese día.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a algunos de los excipientes incluidos en la sección 6.1. Hipersensibilidad a la dacarbazina (DTIC).
Mielosupresión severa (ver sección 4.4).
4.4 Advertencias y precauciones especiales de empleo
Infecciones oportunistas y reactivación de infecciones
Durante el tratamiento con TMZ, se han observado infecciones oportunistas (como neumonía por Pneumocystis jirovecii) y reactivación de infecciones (como VHB, CMV) (ver sección 4.8).
Los pacientes que recibieron concomitantemente TMZ y RT en un ensayo piloto durante el régimen prolongado de 42 días presentaron un especial riesgo de desarrollar neumonía por Pneumocystis jirovecii (PCP). Por lo tanto, se requiere profilaxis frente a PCP en todos los pacientes que reciban concomitantemente TMZ y RT durante el régimen de 42 días (hasta un máximo de 49 días) con independencia del recuento de linfocitos. Si se produce linfopenia, deben continuar con la profilaxis hasta que la recuperación de la linfopenia sea de un grado < 1.
Puede haber una mayor incidencia de PCP cuando se administra TMZ durante un régimen de dosificación más largo. No obstante, todos los pacientes que reciban TMZ, en especial los pacientes que reciban esteroides, deberán ser vigilados estrechamente en cuanto al desarrollo de PCP con independencia del régimen. Se han notificado casos de insuficiencia respiratoria mortal en pacientes en tratamiento con TMZ, en particular en combinación con dexametasona u otros esteroides.
VHB
Se ha notificado hepatitis debida a una reactivación del virus de la hepatitis B (VHB), resultando en algunos casos mortal. Se debe consultar a los expertos en enfermedades hepáticas antes de iniciar el tratamiento en pacientes con serología para la hepatitis B positiva (incluyendo aquellos pacientes con la enfermedad activa). Durante el tratamiento, los pacientes deben ser controlados y tratados como corresponda.
Hepatotoxicidad
Se han notificado lesiones hepáticas incluyendo insuficiencia hepática mortal en pacientes tratados con TMZ (ver sección 4.8). Se deben determinar los valores basales de la función hepática antes de iniciar el tratamiento. Si fueran anómalos, el médico debe evaluar el beneficio/riesgo antes de iniciar el tratamiento con temozolamida, incluyendo el riesgo potencial de insuficiencia hepática mortal. En pacientes en un ciclo de tratamiento de 42 días, las pruebas se deben repetir en mitad del ciclo. En todos los pacientes, las pruebas de la función hepática se deben repetir después de cada ciclo de tratamiento. El médico debe evaluar el beneficio/riesgo de continuar el tratamiento en pacientes con anomalías significativas de la función hepática. La toxicidad hepática puede aparecer varias semanas o más, después del último tratamiento con temozolomida.
Neoplasias malignas
También se han observado casos muy raros de síndrome mielodisplásico y neoplasias secundarias, incluyendo leucemia mieloide (ver sección 4.8).
Terapia antiemética
Las náuseas y los vómitos se asocian muy frecuentemente con TMZ.
Se puede administrar la terapia antiemética antes o después de la administración de TMZ.
Pacientes adultos con glioblastoma multiforme de nuevo diagnóstico
Se recomienda profilaxis antiemética antes de la dosis inicial de la fase concomitante, y se recomienda encarecidamente durante la fase de monoterapia.
Pacientes con glioma maligno recurrente o progresivo
Los pacientes que hayan experimentado fuertes vómitos (Grado 3 ó 4) en ciclos de tratamiento previos pueden precisar tratamiento antiemético.
Parámetros de laboratorio
Los pacientes en tratamiento con TMZ pueden presentar mielosupresión, incluyendo pancitopenia prolongada, que puede derivar en anemia aplásica que, en ciertos casos, puede terminar en fallecimiento. En algunos casos, la exposición a medicamentos concomitantes asociados a la anemia aplásica, tales como carbamazepina, fenitoína y sulfametoxazol/trimetoprima complica la valoración. Antes de la administración, deberán cumplirse los siguientes parámetros de laboratorio: RAN > 1,5 x 109/1 y recuento de plaquetas > 100 x 109/l. Deberá practicarse un hemograma completo el Día 22 (21 días después de la primera dosis) o dentro de las 48 horas de dicho día, y una vez a la semana hasta que el RAN sea > 1,5 x 109/l y el recuento de plaquetas sea > 100 x 109/l. Si el RAN disminuyera a < 1,0 x 109/l o el recuento de plaquetas fuera < 50 x 109/l durante cualquier ciclo, se disminuirá un nivel de dosis en el siguiente ciclo (ver sección 4.2). Los niveles de dosis son de 100 mg/m2, 150 mg/m2 y 200 mg/m2. La dosis más baja recomendada es de 100 mg/m2.
Población pediátrica
No hay experiencia clínica sobre el empleo de TMZ en niños menores de 3 años de edad. La experiencia en niños mayores y adolescentes es muy limitada (ver sección 4.2 y 5.1).
Pacientes de edad avanzada (> 70 años de edad)
Los pacientes de edad avanzada parecen presentar un mayor riesgo de neutropenia y trombocitopenia que los pacientes más jóvenes. Por lo tanto, se debe tener precaución especial cuando se administre TMZ a pacientes de edad avanzada.
Pacientes varones
Debe advertirse a los hombres que vayan a ser tratados con TMZ que eviten dejar embarazada a su pareja durante los 6 meses posteriores al tratamiento y que busquen asesoramiento sobre crioconservación del esperma antes del tratamiento (ver sección 4.6).
Lactosa
Este medicamento contiene lactosa. Los pacientes con intolerancia hereditaria a galactosa, insuficiencia de lactasa de Lapp o malabsorción de glucosa o galactosa no deben tomar este medicamento.
4.5 Interacción con otros medicamentos y otras formas de interacción
En otro estudio en fase I, la administración de TMZ con ranitidina no provocó modificaciones del grado de absorción de la temozolomida o de la exposición a su metabolito activo monometil triazenoimidazol carboxamida (MTIC).
La administración de TMZ con los alimentos resultó en una disminución del 33 % de la Cmax y en una disminución del 9 % del área bajo la curva (AUC).
Como no se puede excluir que el cambio en la Cmax sea clínicamente importante, Temodal no debe administrarse junto a alimentos.
En base a un análisis de la farmacocinética de población observado en ensayos en fase II, la coadministración de dexametasona, proclorperazina, fenitoína, carbamazepina, ondansetrón, antagonistas de los receptores H2 o fenobarbital no modificó la eliminación de la TMZ. Se asoció la coadministración de ácido valproico con una pequeña pero estadísticamente significativa disminución del aclaramiento de TMZ.
No se han llevado a cabo estudios para determinar el efecto de TMZ sobre el metabolismo o eliminación de otros fármacos. No obstante, dado que TMZ no experimenta metabolismo hepático y muestra una baja unión a proteínas, es improbable que afecte a la farmacocinética de otros medicamentos (ver sección 5.2).
El empleo de TMZ en combinación con otros agentes mielosupresores puede aumentar la probabilidad de mielosupresión.
Población pediátrica
Los estudios de interacciones se han realizado sólo en adultos.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No hay datos en mujeres embarazadas. En los estudios preclínicos en ratas y conejos tratados con 150 mg/m2 de TMZ se observó teratogenia y/o toxicidad fetal (ver sección 5.3).
Temodal no debe administrarse a mujeres embarazadas. Si se debe considerar su uso durante el embarazo, la paciente debe ser informada del riesgo potencial para el feto.
Lactancia
Se desconoce si TMZ se excreta en la leche materna; por tanto, se debe interrumpir la lactancia durante el tratamiento con TMZ.
Mujeres en edad fértil
Se debe aconsejar a las mujeres en edad fértil el uso de un método anticonceptivo eficaz para evitar el embarazo mientras estén en tratamiento con TMZ.
Fertilidad masculina
TMZ puede tener efectos genotóxicos. Por lo tanto, se advierte a los hombres que vayan a ser tratados con ella que eviten dejar embarazada a su pareja hasta que hayan transcurrido 6 meses desde la última dosis y que busquen asesoramiento sobre crioconservación del esperma antes del tratamiento dada la posibilidad de infertilidad irreversible debido a la terapia con TMZ.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
TMZ tiene una influencia baja sobre la capacidad para conducir y utilizar máquinas debido a la fatiga y somnolencia (ver sección 4.8).
4.8 Reacciones adversas
Experiencia de ensayos clínicos
En pacientes tratados con TMZ, ya sea en combinación con RT o como monoterapia tras RT para glioblastoma multiforme de nuevo diagnóstico o como monoterapia en pacientes con glioma recurrente o progresivo, las reacciones adversas muy frecuentes notificadas fueron similares: náuseas, vómitos, estreñimiento, anorexia, cefalea y fatiga. Se notificaron de manera muy frecuente convulsiones en pacientes con glioblastoma multiforme de nuevo diagnóstico que recibieron monoterapia, y se notificó sarpullido muy frecuentemente en pacientes con glioblastoma multiforme de nuevo diagnóstico que recibieron TMZ en combinación con RT y también en monoterapia, y se notificó frecuentemente en glioma recurrente. La mayoría de las alteraciones de parámetros hematológicos se notificaron, según lo esperado, como frecuentes o muy frecuentes en ambas indicaciones (Tablas 4 y 5); después de cada tabla se recogen las frecuencias relativas a los parámetros de laboratorio de grados 3 y 4.
En las tablas, los efectos adversos se clasifican según la clasificación por órganos y sistemas y la frecuencia. Los grupos de frecuencia se definen según la siguiente convención: Muy frecuentes (> 1/10); Frecuentes (> 1/100 a < 1/10); Poco frecuentes (> 1/1.000 a < 1/100); Raras (> 1/10.000 a < 1/1.000); Muy raras (< 1/10.000). Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
Glioblastoma multiforme de nuevo diagnóstico
La Tabla 4 incluye reacciones adversas derivadas del tratamiento en pacientes con glioblastoma multiforme de nuevo diagnóstico durante las fases de tratamiento concomitante y en monoterapia.
|
Tabla 4. Acontecimientos derivados del tratamiento durante las fases de tratamiento concomitante y en monoterapia en pacientes con glioblastoma multiforme de nuevo diagnóstico | ||
|
Clasificación por órganos y sistemas |
TMZ + radioterapia concomitante n=288* |
TMZ en monoterapia n=224 |
|
Infecciones e infestaciones | ||
|
Frecuentes: |
Infección, herpes simple, infección de una herida, faringitis, candidiasis oral |
Infección, candidiasis oral |
|
Poco frecuentes: |
Herpes simple, herpes zoster, síntomas pseudogripales | |
|
Trastornos de la sangre y del sistema linfático | ||
|
Frecuentes: |
Neutropenia, trombocitopenia, linfopenia, leucopenia |
Neutropenia febril, trombocitopenia, anemia, leucopenia |
|
Poco frecuentes: |
Neutropenia febril, anemia |
Linfopenia, petequia |
|
Trastornos endocrinos | ||
|
Poco frecuentes: |
Cushingoide |
Cushingoide |
|
Trastornos del metabolismo y de la nutrición | ||
|
Muy frecuentes: |
Anorexia |
Anorexia |
|
Frecuentes: |
Hiperglucemia, pérdida de peso |
Pérdida de peso |
|
Poco frecuentes: |
Hipopotasemia, aumento de la fosfatasa alcalina, aumento de peso |
Hiperglucemia, aumento de peso |
|
Trastornos psiquiátricos | ||
|
Frecuentes: |
Ansiedad, labilidad emocional, insomnio |
Ansiedad, depresión, labilidad emocional, insomnio |
|
Poco frecuentes: |
Agitación, apatía, alteración del comportamiento, depresión, alucinaciones |
Alucinaciones, amnesia |
|
Trastornos del sistema nervioso | ||
|
Muy frecuentes: |
Cefalea |
Convulsiones, cefalea |
|
Frecuentes: |
Convulsiones, pérdida de conocimiento, somnolencia, afasia, alteración del equilibrio, mareo, confusión, pérdida de memoria, disminución de la concentración, neuropatía, parestesia, trastorno en el habla, temblor |
Hemiparesia, afasia, alteración del equilibrio, somnolencia, confusión, mareo, pérdida de memoria, disminución de la concentración, disfasia, trastorno neurológico (NOS), neuropatía, neuropatía periférica, parestesia, trastorno en el habla, temblor |
|
Poco frecuentes: |
Status epilepticus, trastorno extrapiramidal, hemiparesia, ataxia, trastorno cognitivo, disfasia, trastorno de la marcha, hiperestesia, hipoestesia, trastorno neurológico (NOS), neuropatía periférica |
Hemiplejía, ataxia, alteración en la coordinación, trastorno de la marcha, hiperestesia, trastorno sensorial |
|
Trastornos oculares | ||
|
Frecuentes: |
Visión borrosa |
Defecto en el campo visual, visión borrosa, diplopía |
|
Poco frecuentes: |
Hemianopsia, disminución de la agudeza visual, trastorno en la visión, defecto en el campo visual, dolor ocular |
Disminución de la agudeza visual, dolor ocular, sequedad ocular |
|
Trastornos del oído y del laberinto | ||
|
Frecuentes: |
Trastorno en la audición |
Trastorno en la audición, tinnitus |
|
Poco frecuentes: |
Otitis media, tinnitus, hiperacusia, otalgia |
Sordera, vértigo, otalgia |
|
Trastornos cardiacos | ||
|
Poco frecuentes: |
Palpitaciones | |
|
Trastornos vasculares | ||
|
Frecuentes: |
Hemorragia, edema, edema de piernas |
Hemorragia, trombosis venosa profunda, edema de piernas |
|
Poco frecuentes: |
Hemorragia cerebral, hipertensión |
Embolismo pulmonar, edema, edema periférico |
|
Trastornos respiratorios, torácicos y mediastínicos | ||
|
Frecuentes: |
Disnea, tos |
Disnea, tos |
|
Poco frecuentes: |
Neumonía, infección respiratoria superior, congestión nasal |
Neumonía, sinusitis, infección respiratoria superior, bronquitis |
|
Trastornos gastrointestinales | ||
|
Muy frecuentes: |
Estreñimiento, náuseas, vómitos |
Estreñimiento, náuseas, vómitos |
|
Frecuentes: |
Estomatitis, diarrea, dolor abdominal, dispepsia, disfagia |
Estomatitis, diarrea, dispepsia, disfagia, sequedad de boca |
|
Poco frecuentes: |
Distensión abdominal, incontinencia fecal, trastorno gastrointestinal (NOS), gastroenteritis, hemorroides | |
|
Trastornos de la piel y del tejido subcutáneo | ||
|
Muy frecuentes: |
Sarpullido, alopecia |
Sarpullido, alopecia |
|
Frecuentes: |
Dermatitis, sequedad cutánea, eritema, prurito |
Sequedad cutánea, prurito |
|
Poco frecuentes: |
Exfoliación cutánea, reacción de fotosensibilidad, alteración en la pigmentación |
Eritema, alteración en la pigmentación, aumento de la sudoración |
|
Trastornos musculoesqueléticos y del tejido conjuntivo | ||
|
Frecuentes: |
Debilidad muscular, artralgia |
Debilidad muscular, artralgia, dolor musculoesquelético, mialgia |
|
Poco frecuentes: |
Miopatía, dolor de espalda, dolor musculoesquelético, mialgia |
Miopatía, dolor de espalda |
|
Trastornos renales y urinarios | ||
|
Frecuentes: |
Polaquiuria, incontinencia urinaria |
Incontinencia urinaria |
|
Poco frecuentes: |
Disuria | |
|
Trastornos del aparato reproductor y de la mama | ||
|
Poco frecuentes: |
Impotencia |
Hemorragia vaginal, menorragia, amenorrea, vaginitis, dolor de mama |
|
Trastornos generales y alteraciones en el lugar de administración | ||
|
Muy frecuentes: |
Fatiga |
Fatiga |
|
Frecuentes: |
Reacción alérgica, fiebre, lesión por radiación, edema facial, dolor, alteración del gusto |
Reacción alérgica, fiebre, lesión por radiación, dolor, alteración del gusto |
|
Poco frecuentes: |
Astenia, rubor, sofocos, empeoramiento de una enfermedad, escalofríos, cambio de color de la lengua, parosmia, sed |
Astenia, edema facial, dolor, empeoramiento de una enfermedad, escalofríos, trastorno dental |
|
Exploraciones complementarias | ||
|
Frecuentes: |
Aumento de ALT |
Aumento de ALT |
|
Poco frecuentes: |
Aumento de enzimas hepáticas, aumento de Gamma GT, aumento de AST | |
*Un paciente que se aleatorizó al brazo de RT únicamente, recibió TMZ + RT.
Resultados de laboratorio
Se observó mielosupresión (neutropenia y trombocitopenia), que es toxicidad limitante de dosis conocida para la mayoría de los agentes citotóxicos, incluido TMZ. Cuando las alteraciones en las pruebas de laboratorio y las reacciones adversas se sumaron entre las fases de tratamiento concomitante y en monoterapia, se observaron alteraciones en neutrófilos de Grado 3 o de Grado 4, incluyendo acontecimientos neutropénicos, en el 8 % de los pacientes. Se observaron alteraciones en los trombocitos de Grado 3 o Grado 4, incluyendo acontecimientos trombocitopénicos en el 14 % de los pacientes que recibieron TMZ.
Glioma maligno recurrente o progresivo
En los ensayos clínicos, las reacciones adversas que se produjeron más frecuentemente relacionadas con el tratamiento fueron los trastornos gastrointestinales, concretamente náuseas (43 %) y vómitos (36 %). Estas reacciones fueron normalmente de Grado 1 ó 2 (0-5 episodios de vómitos en 24 horas) y se autolimitaron o controlaron rápidamente con tratamiento antiemético estándar. La incidencia de náuseas y vómitos intensos fue del 4 %.
La Tabla 5 incluye reacciones adversas notificadas durante ensayos clínicos en glioma maligno recurrente o progresivo y después de la comercialización de Temodal.
_Tabla 5. Reacciones adversas en pacientes con glioma maligno recurrente o progresivo
Infecciones e infestaciones
Raras:
Infecciones oportunistas, incluyendo PCP
|
Trastornos de la sangre y del sistema linfático | |
|
Muy frecuentes: |
Neutropenia o linfopenia (grado 3-4), trombocitopenia (grado 3-4) |
|
Poco frecuentes: |
Pancitopenia, anemia (grado 3-4), leucopenia |
|
Trastornos del metabolismo y de la nutrición | |
|
Muy frecuentes: |
Anorexia |
|
Frecuentes: |
Pérdida de peso |
|
Trastornos del sistema nervioso | |
|
Muy frecuentes: |
Cefalea |
|
Frecuentes: |
Somnolencia, mareo, parestesia |
|
Trastornos respiratorios, torácicos y mediastínicos | |
|
Frecuentes: |
Disnea |
|
Trastornos gastrointestinales | |
|
Muy frecuentes: |
Vómitos, náuseas, estreñimiento |
|
Frecuentes: |
Diarrea, dolor abdominal, dispepsia |
|
Trastornos de la piel y del tejido subcutáneo | |
|
Frecuentes: |
Sarpullido, prurito, alopecia |
|
Muy raros: |
Eritema multiforme, eritrodermia, urticaria, exantema |
|
Trastornos generales y alteraciones en el lugar de administración | |
|
Muy frecuentes: |
Fatiga |
|
Frecuentes: |
Fiebre, astenia, escalofríos, malestar general, dolor, alteraciones en el gusto |
|
Muy raras: |
Reacciones alérgicas, incluyendo anafilaxia, angioedema |
Resultados de laboratorio
Se produjeron trombocitopenia y neutropenia de Grados 3 ó 4 en el 19 % y 17 %, respectivamente, de los pacientes tratados por glioma maligno. Esto provocó la hospitalización y/o interrupción del tratamiento con TMZ en el 8 % y 4 %, respectivamente. La mielosupresión fue previsible (normalmente dentro de los primeros ciclos, con el valor más bajo de parámetros hematológicos (nadir) entre el Día 21 y el Día 28), y la recuperación fue rápida, generalmente en 1-2 semanas. No se observó evidencia de una mielosupresión de tipo acumulativo. La presencia de trombocitopenia puede incrementar el riesgo de hemorragia, y la presencia de neutropenia o leucopenia puede incrementar el riesgo de infección.
Género
En un análisis de farmacocinética basada en la población sobre la experiencia en ensayos clínicos se disponía de los datos del nadir de los recuentos de neutrófilos para 101 mujeres y 169 hombres, y del nadir de plaquetas para 110 mujeres y 174 hombres. En el primer ciclo de terapia hubo tasas más altas de neutropenia de Grado 4 (RAN < 0,5 x 109/l), 12 % frente al 5 %, y trombocitopenia (< 20 x 109/l),
9 % frente al 3 %, en mujeres que en hombres. En una serie de datos de 400 pacientes con glioma recurrente, tras el primer ciclo de terapia, se produjo neutropenia de Grado 4 en el 8 % de las mujeres frente al 4 % de los hombres, y trombocitopenia de Grado 4 en el 8 % de las mujeres frente al 3 % de los hombres. En un ensayo con 288 pacientes con glioblastoma multiforme de nuevo diagnóstico, se produjo, en el primer ciclo de terapia, neutropenia de Grado 4 en el 3 % de las mujeres frente al 0 % de los hombres, y trombocitopenia de Grado 4 en el 1 % de las mujeres frente al 0 % de los hombres.
Población pediátrica
Se ha estudiado TMZ por vía oral en pacientes pediátricos (edad 3-18 años) con glioma recurrente del tronco encefálico o astrocitoma de alto grado recurrente, en un régimen de administración diaria durante 5 días cada 28 días. Aunque los datos son limitados, cabe esperar que la tolerancia en niños sea similar a la de los adultos. No se ha determinado la seguridad de TMZ en niños menores de 3 años.
Experiencia postcomercialización
Se han identificado las siguientes reacciones adversas graves durante la exposición postcomercialización:
|
Tabla 6. Resumen de los acontecimientos notificados con temozolomida en la postcomercialización | |
|
Infecciones e infestaciones* | |
|
Poco frecuentes: |
infección por citomegalovirus, reactivación de infección de tipo citomegalovirus, virus hepatitis B1 |
|
Trastornos de la sangre y del sistema linfático | |
|
Muy raras: |
pancitopenia prolongada, anemia aplásica1 |
|
Neoplasias benignas, malignas y no especificadas | |
|
Muy raras: |
síndrome mielodisplásico, tumores malignos secundarios, incluyendo leucemia mieloide |
|
Trastornos endocrinos* | |
|
Poco frecuentes: |
diabetes insípida |
|
Trastornos respiratorios, torácicos y mediastínicos | |
|
Muy raras: |
neumonitis intersticial/neumonitis, fibrosis pulmonar, insuficiencia respiratoria1 |
|
Trastornos hepatobiliares* | |
|
Frecuentes: |
enzimas hepáticas aumentadas |
|
Poco frecuentes: |
hiperbilirrubinemia, colestasis, hepatitis, lesión hepática, insuficiencia hepática1 |
|
Trastornos de la piel y del tejido subcutáneo | |
|
Muy raras: |
necrolisis epidérmica tóxica, syndrome de Stevens-Johnson |
1 Incluyendo casos con desenlace mortal Frecuencias estimadas a partir de los ensayos clínicos pertinentes.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Anexo V.
4.9 Sobredosis
Se han evaluado clínicamente en pacientes dosis de 500, 750, 1.000 y 1.250 mg/m2 (dosis total por ciclo de 5 días). La toxicidad limitante de dosis fue hematológica y se notificó con todas las dosis, pero se espera que sea más grave a dosis más altas. Un paciente recibió una sobredosis de 10.000 mg (dosis total por ciclo de 5 días) y las reacciones adversas que se notificaron fueron pancitopenia, pirexia, fracaso multiorgánico y muerte. Se han notificado casos de pacientes que han tomado la dosis recomendada durante más de 5 días de tratamiento (hasta 64 días) notificándose reacciones adversas como supresión de médula ósea, con o sin infección, en algunos casos grave y prolongada, con resultado de muerte. En caso de sobredosis, es necesaria una evaluación hematológica. Se deben tomar medidas generales de soporte si fuera necesario.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Agentes antineoplásicos - Otros agentes alquilantes, código ATC: L01A X03.
Mecanismo de acción
La temozolomida es un triazeno, que a pH fisiológico sufre una rápida conversión química a la monometil tiazenoimidazol carboxamida activa (MTIC). Se considera que la citotoxicidad del MTIC es consecuencia, fundamentalmente, de una alquilación en la posición O6 de la guanina, con una alquilación adicional que se produce en la posición N7. Se considera que las lesiones citotóxicas que se desarrollan posteriormente conllevan una reparación aberrante del metilo añadido.
Eficacia clínica y seguridad
Glioblastoma multiforme de nuevo diagnóstico
Se aleatorizaron un total de 573 pacientes para recibir o TMZ + RT (n=287) o RT sola (n=286). Los pacientes del brazo de TMZ + RT recibieron TMZ concomitante (75 mg/m2) una vez al día, empezando el primer día de RT hasta el último día de RT, durante 42 días (hasta un máximo de 49 días). Este tratamiento iba seguido de TMZ en monoterapia (150 - 200 mg/m2) en los Días 1 - 5 de cada ciclo de 28 días, hasta 6 ciclos, empezando 4 semanas después de la finalización de la RT. Los pacientes del brazo control sólo recibieron RT. Se necesitó profilaxis frente a neumonía por Pneumocystis jirovecii (PCP) durante la RT y la terapia combinada con TMZ.
En la fase de seguimiento se administró TMZ como terapia de rescate en 161 pacientes de los 282 (57 %) del brazo de RT sola, y en 62 pacientes de los 277 (22 %) del brazo de TMZ + RT.
El hazard ratio (HR) para la supervivencia global fue de 1,59 (95 % IC para HR=1,33 -1,91) con un rango logarítmico de p < 0,0001 a favor del brazo de TMZ. La probabilidad estimada de sobrevivir 2 o más años (26 % frente a 10 %) es mayor para el brazo de RT + TMZ. La adición de TMZ concomitante a la RT, seguida de TMZ en monoterapia en el tratamiento de pacientes con glioblastoma multiforme de nuevo diagnóstico, demostró una mejoría en la supervivencia global (SG) estadísticamente significativa en comparación con la RT sola (Figura 1).

Figura 1 Curvas de Kaplan-Meier para la supervivencia global (población por intención de
tratar)
Los resultados del ensayo no fueron coherentes en el subgrupo de pacientes con un estado funcional bajo (Performance Status OMS PS =2, n=70), en el que la supervivencia global y el tiempo hasta la progresión fueron similares en ambos brazos. No obstante, este grupo de pacientes no parece presentar riesgos inaceptables.
Los datos sobre eficacia clínica en pacientes con glioblastoma multiforme (índice de estado funcional de Karnofsky [KPS] > 70), progresivo o recurrente, después de cirugía y RT se basaron en dos ensayos clínicos con TMZ oral. Uno fue un ensayo no comparativo sobre 138 pacientes (el 29 % recibió quimioterapia previa), y el otro fue un ensayo aleatorizado con brazo control activo de TMZ frente a procarbazina sobre un total de 225 pacientes (el 67 % recibió tratamiento previo con quimioterapia basada en nitrosourea). En ambos ensayos, la variable principal de valoración fue la supervivencia libre de progresión (SLP) definida por los escáneres de IRM o empeoramiento neurológico. En el ensayo no comparativo, la SLP a los 6 meses fue del 19 %, la mediana de la SLP fue de 2,1 meses, y la mediana de la supervivencia global de 5,4 meses. La tasa de respuesta objetiva (ORR) en base a las IRM fue del 8 %.
En el ensayo aleatorizado de brazo control activo, la SLP a los 6 meses fue significativamente mayor para TMZ que para la procarbazina (21 % frente al 8 %, respectivamente - prueba de chi-cuadrado p= 0,008) con una mediana de la SLP de 2,89 y 1,88 meses respectivamente (Test de rango logarítmico, p = 0,0063). La mediana de la supervivencia fue de 7,34 y 5,66 meses para TMZ y procarbazina, respectivamente (rango logarítmico de p = 0,33). A los 6 meses la fracción de pacientes que sobrevivieron fue significativamente superior en el brazo de TMZ (60 %) en comparación con el brazo de procarbazina (44 %) (prueba de chi-cuadrado p = 0,019). En los pacientes que recibieron quimioterapia previa se observó un beneficio en aquellos con un KPS > 80.
Los datos sobre el tiempo hasta el empeoramiento del estado neurológico favorecieron a TMZ sobre la procarbazina, al igual que los datos sobre el tiempo hasta el empeoramiento del estado funcional (decrece hasta KPS de < 70 o decrece al menos 30 puntos). En estas variables de valoración la mediana del tiempo hasta progresión osciló entre los 0,7 y 2,1 meses más para TMZ que para la procarbazina (Test de rango logarítmico, p = < 0,01 a 0,03).
Astrocitoma anaplásico recurrente
En un ensayo de fase II, multicéntrico y prospectivo, dirigido a evaluar la seguridad y la eficacia de la TMZ oral en el tratamiento de pacientes con un astrocitoma anaplásico en su primera recaída, la SLP a los 6 meses fue del 46 %. La mediana de la SLP fue de 5,4 meses. La mediana de la supervivencia global fue de 14,6 meses. La tasa de respuesta, basada en la evaluación practicada por un revisor central, fue del 35 % (13 RC y 43 RP) en la población analizada por intención de tratar (ITT) n=162.
Se comunicó enfermedad estable en 43 pacientes. La supervivencia libre de episodios a los 6 meses en la población analizada por ITT fue del 44 %, con una mediana de la supervivencia libre de episodios de 4,6 meses, cifra que fue similar a la hallada en la supervivencia libre de progresión de la enfermedad. En la población elegible desde el punto de vista de la histología, los resultados de eficacia fueron similares. El alcance de una respuesta objetiva radiológica o el mantenimiento del estado libre de progresión de la enfermedad se asoció firmemente al mantenimiento o la mejoría de la calidad de vida.
Población pediátrica
Se ha estudiado TMZ por vía oral en pacientes pediátricos (edad 3-18 años) con glioma recurrente del tronco encefálico o astrocitoma de alto grado recurrente, en un régimen de administración diaria durante 5 días cada 28 días. La tolerancia a TMZ es similar a la de los adultos.
5.2 Propiedades farmacocinéticas
TMZ se hidroliza espontáneamente a pH fisiológico principalmente a los metabolitos activos, 3-metil(triazeno-1-il)imidazol-4-carboxamida (MTIC). MTIC se hidroliza espontáneamente a 5-amino-imidazol-4-carboxamida (AIC), un conocido intermediario en la biosíntesis de purinas y ácidos nucleicos, y a metilhidrazina, que se cree que es el metabolito alquilante activo. Se cree que la citotoxicidad de MTIC se debe fundamentalmente a la alquilación del ADN principalmente en las
posiciones O6 y N7 de la guanina. En relación al AUC de temozolomida, la exposición a MTIC y AIC es ~ 2,4 % y 23 %, respectivamente. In vivo, el t1/2 de MTIC fue similar a la de TMZ, 1,8 h..
Absorción
Tras la administración oral a pacientes adultos, TMZ se absorbió rápidamente, con concentraciones máximas alcanzadas tan solo 20 minutos después de la administración (tiempo promedio entre 0,5 y
1,5 horas). Tras la administración oral de TMZ marcada con 14C, la excreción fecal promedio de 14C durante los siguientes 7 días después de la dosis fue de 0,8 % indicando la absorción completa.
Distribución
TMZ demuestra baja unión a proteínas (10 % a 20 %), y por lo tanto, no se espera que interactúe con sustancias de alta afinidad por proteínas.
Los estudios de tomografía por emisión de positrones (TEP) en seres humanos y los datos preclínicos sugieren que TMZ cruza la barrera hematoencefálica rápidamente y está presente en el LCR. La penetración del LCR se confirmó en un paciente, la exposición del LCR basada en el AUC de TMZ fue aproximadamente de un 30 % de éste en el plasma, lo que es coherente con los datos en animales.
Eliminación
La vida media en el plasma (t1/2) es aproximadamente de 1,8 horas. La ruta principal de eliminación del 14C es la renal. Tras la administración oral, aproximadamente el 5 % al 10 % de la dosis se recupera sin cambios en la orina durante 24 horas, y el resto se excreta como temozolomida ácida, 5-aminoimidazol-4-carboxamida (AIC) o metabolitos polares sin identificar.
Las concentraciones en plasma aumentan de manera relacionada con la dosis. El aclaramiento del plasma, el volumen de distribución y la vida media son independientes de la dosis.
Poblaciones especiales
El análisis de la farmacocinética basada en la población de TMZ reveló que el aclaramiento de TMZ en el plasma fue independiente de la edad, función renal o consumo de tabaco. En un estudio farmacocinético diferente, los perfiles farmacocinéticos del plasma en pacientes con disfunción hepática leve a moderada fueron similares a los observados en pacientes con función hepática normal.
Los pacientes pediátricos presentaron un AUC mayor que los pacientes adultos; no obstante, la dosis máxima tolerada (DMT) fue de 1.000 mg/m2 por ciclo en niños y en adultos.
5.3 Datos preclínicos sobre seguridad
Se llevaron a cabo estudios de toxicidad tras un solo ciclo (administración durante 5 días, 23 días sin tratamiento), 3 ciclos y 6 ciclos en ratas y perros. Las dianas principales de la toxicidad fueron la médula ósea, el sistema linforreticular, los testículos, el tracto gastrointestinal, y, a dosis superiores, que fueron letales para del 60 % al 100 % de las ratas y perros tratados, se produjo la degeneración de la retina. La mayoría de la toxicidad mostró evidencia de reversibilidad, excepto las reacciones adversas sobre el sistema reproductor masculino y la degeneración de la retina. No obstante, dado que las dosis implicadas en la degeneración de la retina se encontraban en el intervalo de dosis letal y no se ha observado un efecto comparable en los estudios clínicos, no se consideró que este resultado tuviera relevancia clínica.
TMZ es un agente alquilante embriotóxico, teratogénico y genotóxico. TMZ es más tóxica en la rata y el perro que en los seres humanos, y la dosis clínica se acerca a la dosis letal mínima en ratas y perros. Las reducciones, relacionadas con la dosis, en los leucocitos y las plaquetas parecen ser unos indicadores sensibles de toxicidad. En el estudio de administración a ratas durante 6 ciclos, se observaron varias neoplasias, incluyendo carcinoma de mama, queratoacantoma y adenoma de células basales mientras que en los estudios en perros no se obse rvaron tumores o alteraciones preneoplásicas. La rata parece ser particularmente sensible a los efectos oncogénicos de TMZ, con la aparición de los primeros tumores dentro de los 3 meses del inicio del tratamiento. Este periodo de latencia es muy corto incluso para un agente alquilante.
Los resultados de los test de Ames/salmonella y de aberración cromosómica en Linfocitos de Sangre Periférica Humana (HPBL) mostraron una respuesta positiva de mutagenicidad.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Contenido de la cápsula:
lactosa anhidra,
sílice anhidra coloidal,
glicolato sódico de almidón tipo A,
ácido tartárico,
ácido esteárico.
Cuerpos de las cápsulas: gelatina,
dióxido de titanio (E 171), lauril sulfato sódico.
Impresión:
goma laca,
propilenglicol,
agua purificada,
hidróxido amónico,
hidróxido de potasio,
óxido negro de hierro (E 172).
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
3 años
6.4 Precauciones especiales de conservación
Presentación en frascos
No conservar a temperatura superior a 30°C.
Conservar en el frasco original para protegerlo de la humedad. Mantener el frasco perfectamente cerrado.
Presentación en sobres
No conservar a temperatura superior a 30°C.
6.5 Naturaleza y contenido del envase
Presentación en frascos
Frascos de vidrio ámbar de tipo I con cierre de polipropileno a prueba de niños, que contienen 5 ó 20 cápsulas duras.
El envase de cartón contiene 1 frasco.
Presentación en sobres
Los sobres están compuestos por polietileno de baja densidad lineal (capa más interna), aluminio y tereftalato de polietileno.
Cada sobre contiene 1 cápsula dura y se dispensa en envase de cartón.
El envase de cartón contiene 5 ó 20 cápsulas duras, selladas en sobres individualmente.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Las cápsulas no se deben abrir. Si una cápsula se rompiera, se debe evitar el contacto del contenido en polvo con la piel o membranas mucosas. Si Temodal entra en contacto con la piel o mucosas, debe lavarse inmediata y concienzudamente con jabón y agua.
Se debe informar a los pacientes para que mantengan las cápsulas fuera de la vista y del alcance de los niños, preferiblemente en un armario cerrado con llave. La ingestión accidental puede ser mortal en niños.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU Reino Unido
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/98/096/007
EU/1/98/096/008
EU/1/98/096/021
EU/1/98/096/022
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 26/enero/1999 Fecha de la última renovación: 26/enero/2009
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
Temodal 2,5 mg/ml polvo para solución para perfusión
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada vial contiene 100 mg de temozolomida.
Tras la reconstitución, 1 ml de solución para perfusión contiene 2,5 mg de temozolomida.
Excipiente con efecto conocido:
Cada vial contiene 2,4 mmol de sodio.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Polvo para solución para perfusión. Polvo blanco.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Temodal está indicado para el tratamiento de:
- pacientes adultos con glioblastoma multiforme de nuevo diagnóstico concomitante con radioterapia (RT) y posteriormente como tratamiento de monoterapia
- niños a partir de tres años de edad, adolescentes y pacientes adultos con glioma maligno, tal como glioblastoma multiforme o astrocitoma anaplásico, que presentan recurrencia o progresión después de terapia estándar.
4.2 Posología y forma de administración
Temodal sólo debe ser prescrito por médicos con experiencia en el tratamiento oncológico de tumores cerebrales.
Puede administrarse terapia antiemética (ver sección 4.4).
Posología
Pacientes adultos con glioblastoma multiforme de nuevo diagnóstico
Temodal se administra en combinación con radioterapia focal (fase concomitante) seguido de hasta 6 ciclos de monoterapia con temozolomida (TMZ) (fase de monoterapia).
Fase concomitante
Se administra TMZ a una dosis de 75 mg/m2 al día durante 42 días como tratamiento concomitante a la radioterapia focal (60 Gy administrados en 30 fracciones). No se recomiendan reducciones de dosis, pero se decidirá semanalmente el retraso o la suspensión de la administración de TMZ de acuerdo a los criterios de toxicidad hematológica y no hematológica.
La administración de TMZ se puede continuar durante todo el periodo concomitante de 42 días (hasta 49 días) si se cumplen todas y cada una de las siguientes condiciones:
- recuento absoluto de neutrófilos (RAN) > 1,5 x 109/l
- recuento de trombocitos > 100 x 109/l
- toxicidad no hematológica según los criterios de toxicidad común (CTC) < Grado 1 (excepto para alopecia, náuseas y vómitos).
Durante el tratamiento se deberá realizar semanalmente un hemograma completo. La administración de TMZ se deberá interrumpir o suspender permanentemente durante la fase concomitante de acuerdo a los criterios de toxicidad hematológica y no hematológica según la Tabla 1.
|
Tabla 1. Interrupción o suspensión de la dosificación con TMZ durante el tratamiento concomitante de radioterapia y TMZ | ||
|
Toxicidad |
Interrupción de TMZa |
Suspensión de TMZ |
|
Recuento Absoluto de Neutrófilos |
> 0,5 y < 1,5 x 109/l |
< 0,5 x 109/l |
|
Recuento de Trombocitos |
> 10 y < 100 x 109/l |
< 10 x 109/l |
|
Toxicidad no hematológica según CTC (excepto para alopecia, náuseas y vómitos) |
Grado 2 según CTC |
Grado 3 ó 4 según CTC |
a: El tratamiento con TMZ concomitante se puede continuar si se cumplen todas y cada una de las siguientes condiciones: recuento absoluto de neutrófilos > 1,5 x 109/l; recuento de trombocitos > 100 x 109/l; toxicidad no hematológica según CTC < Grado 1 (excepto para alopecia, náuseas y vómitos).
Fase de monoterapia
Cuatro semanas después de completar la fase concomitante de TMZ + RT, se administran hasta 6 ciclos de TMZ en monoterapia. La dosis en el Ciclo 1 (monoterapia) es de 150 mg/m2 una vez al día, durante 5 días, seguido de 23 días sin tratamiento. Al principio del Ciclo 2, la dosis se aumenta a 200 mg/m2 si la toxicidad no hematológica según CTC en el Ciclo 1 es de Grado < 2 (excepto para alopecia, náuseas y vómitos), el recuento absoluto de neutrófilos (RAN) es > 1,5 x 109/l y el recuento de trombocitos > 100 x 109/l. Si la dosis no se aumentó en el Ciclo 2, no se deberá aumentar la dosis en los ciclos posteriores. Si se aumentó la dosis, se mantiene a 200 mg/m2 al día durante los primeros 5 días de cada ciclo posterior, excepto si se produce toxicidad. Las reducciones y suspensiones de dosis durante la fase de monoterapia se deberán realizar de acuerdo a las Tablas 2 y 3.
Durante el tratamiento se deberá realizar un hemograma completo en el Día 22 (21 días después de la primera dosis de TMZ). La dosis se reducirá o se suspenderá la administración de acuerdo a la Tabla 3.
|
Tabla 2. Niveles de dosis de TMZ para el tratamiento en monoterapia | ||
|
Nivel de dosis |
Dosis de TMZ (mg/m2/día) |
Observaciones |
|
-1 |
100 |
Reducción por toxicidad previa |
|
0 |
150 |
Dosis durante el Ciclo 1 |
|
1 |
200 |
Dosis durante los Ciclos 2-6 en ausencia de toxicidad |
|
Tabla 3. Reducción o suspensión de la dosis de TMZ durante el tratamiento en monoterapia | ||
|
Toxicidad |
Reducir TMZ 1 nivel de dosisa |
Suspender TMZ |
|
Recuento absoluto de neutrófilos |
< 1,0 x 109/l |
Ver nota b |
|
Recuento de trombocitos |
< 50 x 109/l |
Ver nota b |
|
Toxicidad no hematológica según CTC (excepto para alopecia, náuseas y vómitos) |
Grado 3 según CTC |
Grado 4b según CTC |
a: Los niveles de dosis de TMZ aparecen en la Tabla 2. b: Se suspende TMZ si:
• El nivel de dosis -1 (100 mg/m2) todavía provoca toxicidad inaceptable
• La misma toxicidad no hematológica de Grado 3 (excepto para alopecia, náuseas, vómitos) vuelve a aparecer tras la reducción de dosis.
Pacientes adultos y _pediátricos de 3 años de edad o mayores con glioma maligno recurrente o progresivo:
Un ciclo de tratamiento es de 28 días. En pacientes no tratados previamente con quimioterapia, TMZ se administra a la dosis de 200 mg/m2 una vez al día durante los primeros 5 días seguido de una interrupción del tratamiento de 23 días (un total de 28 días). En los pacientes tratados previamente con quimioterapia, la dosis inicial es de 150 mg/m2 una vez al día, que debe incrementarse en el segundo ciclo a 200 mg/m2 una vez al día, durante 5 días si no apareciera toxicidad hematológica (ver sección 4.4).
Poblaciones especiales
Población pediátrica
En pacientes de edad igual o superior a 3 años, sólo debe usarse TMZ en glioma maligno recurrente o progresivo. La experiencia en estos niños es muy limitada (ver secciones 4.4 y 5.1). No se ha establecido la seguridad y la eficacia de TMZ en niños menores de 3 años. No se dispone de datos.
Pacientes con disfunción hepática o renal
La farmacocinética de la TMZ fue comparable en pacientes con función hepática normal y en aquellos con disfunción hepática leve o moderada. No hay datos disponibles sobre la administración de TMZ a pacientes con disfunción hepática grave (Clase C de Child) o con disfunción renal. En base a las propiedades farmacocinéticas de la TMZ, es improbable que se requieran reducciones de dosis en pacientes con disfunción hepática grave o cualquier grado de disfunción renal. Sin embargo, se debe tener precaución al administrar TMZ a estos pacientes.
Pacientes de edad avanzada
En base al análisis farmacocinético en pacientes de 19-78 años de edad, el aclaramiento de TMZ no se ve afectado por la edad. Sin embargo, los pacientes de edad avanzada (> 70 años de edad) parecen tener un aumento en el riesgo de neutropenia y trombocitopenia (ver sección 4.4).
Forma de administración
Temodal 2,5 mg/ml polvo para solución para perfusión debe administrarse sólo mediante perfusión intravenosa. No debe proporcionarse mediante otras vías de administración, tales como por vía intratecal, intramuscular, o subcutánea. Temodal 2,5 mg/ml polvo para solución para perfusión puede administrarse a través de la misma vía intravenosa con cloruro de sodio 0,9 %. Es incompatible con soluciones de dextrosa.
La dosis apropiada de TMZ debe infundirse por vía intravenosa usando una bomba durante un período de 90 minutos.
Así como con otros agentes antineoplásicos similares, se recomienda precaución para evitar la extravasación. Se informó de reacciones adversas en el lugar de la inyección, la mayor parte fueron leves y de corta duración en pacientes que recibieron Temodal 2,5 mg/ml polvo para solución para perfusión. Los estudios preclínicos no mostraron daño tisular permanente (ver secciones 4.8 y 5.3).
Temodal está también disponible como formulación en cápsula dura (uso oral). Temodal 2,5 mg/ml polvo para solución para perfusión, administrado como perfusión intravenosa durante 90 minutos, es bioequivalente a la formulación en cápsula dura (ver sección 5.2).
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a algunos de los excipientes incluidos en la sección 6.1. Hipersensibilidad a la dacarbazina (DTIC).
Mielosupresión severa (ver sección 4.4).
4.4 Advertencias y precauciones especiales de empleo
Infecciones oportunistas y reactivación de infecciones
Durante el tratamiento con TMZ, se han observado infecciones oportunistas (como neumonía por Pneumocystis jirovecii) y reactivación de infecciones (como VHB, CMV) (ver sección 4.8).
Neumonía _ por Pneumocystis _ jirovecii
Los pacientes que recibieron concomitantemente TMZ y RT en un ensayo piloto durante el régimen prolongado de 42 días presentaron un especial riesgo de desarrollar neumonía por Pneumocystis jirovecii (PCP). Por lo tanto, se requiere profilaxis frente a PCP en todos los pacientes que reciban concomitantemente TMZ y RT durante el régimen de 42 días (hasta un máximo de 49 días) con independencia del recuento de linfocitos. Si se produce linfopenia, deben continuar con la profilaxis hasta que la recuperación de la linfopenia sea de un grado < 1.
Puede haber una mayor incidencia de PCP cuando se administra TMZ durante un régimen de dosificación más largo. No obstante, todos los pacientes que reciban TMZ, en especial los pacientes que reciban esteroides, deberán ser vigilados estrechamente en cuanto al desarrollo de PCP con independencia del régimen. Se han notificado casos de insuficiencia respiratoria mortal en pacientes en tratamiento con TMZ, en particular en combinación con dexametasona u otros esteroides.
VHB
Se ha notificado hepatitis debida a una reactivación del virus de la hepatitis B (VHB), resultando en algunos casos mortal. Se debe consultar a los expertos en enfermedades hepáticas antes de iniciar el tratamiento en pacientes con serología para la hepatitis B positiva (incluyendo aquellos pacientes con la enfermedad activa). Durante el tratamiento, los pacientes deben ser controlados y tratados como corresponda.
Hepatotoxicidad
Se han notificado lesiones hepáticas incluyendo insuficiencia hepática mortal en pacientes tratados con TMZ (ver sección 4.8). Se deben determinar los valores basales de la función hepática antes de iniciar el tratamiento. Si fueran anómalos, el médico debe evaluar el beneficio/riesgo antes de iniciar el tratamiento con temozolamida, incluyendo el riesgo potencial de insuficiencia hepática mortal. En pacientes en un ciclo de tratamiento de 42 días, las pruebas se deben repetir en mitad del ciclo. En todos los pacientes, las pruebas de la función hepática se deben repetir después de cada ciclo de tratamiento. El médico debe evaluar el beneficio/riesgo de continuar el tratamiento en pacientes con anomalías significativas de la función hepática. La toxicidad hepática puede aparecer varias semanas o más, después del último tratamiento con temozolomida.
Neoplasias malignas
También se han observado casos muy raros de síndrome mielodisplásico y neoplasias secundarias, incluyendo leucemia mieloide (ver sección 4.8).
Terapia antiemética
Las náuseas y los vómitos se asocian muy frecuentemente con TMZ.
Se puede administrar la terapia antiemética antes o después de la administración de TMZ.
Pacientes adultos con glioblastoma multiforme de nuevo diagnóstico
Se recomienda profilaxis antiemética antes de la dosis inicial de la fase concomitante, y se recomienda encarecidamente durante la fase de monoterapia.
Los pacientes que hayan experimentado fuertes vómitos (Grado 3 ó 4) en ciclos de tratamiento previos pueden precisar tratamiento antiemético.
Parámetros de laboratorio
Los pacientes en tratamiento con TMZ pueden presentar mielosupresión, incluyendo pancitopenia prolongada, que puede derivar en anemia aplásica que, en ciertos casos, puede terminar en fallecimiento. En algunos casos, la exposición a medicamentos concomitantes asociados a la anemia aplásica, tales como carbamazepina, fenitoína y sulfametoxazol/trimetoprima complica la valoración. Antes de la administración, deberán cumplirse los siguientes parámetros de laboratorio: RAN > 1,5 x 109/1 y recuento de plaquetas > 100 x 109/l. Deberá practicarse un hemograma completo el Día 22 (21 días después de la primera dosis) o dentro de las 48 horas de dicho día, y una vez a la semana hasta que el RAN sea > 1,5 x 109/l y el recuento de plaquetas sea > 100 x 109/l. Si el RAN disminuyera a < 1,0 x 109/l o el recuento de plaquetas fuera < 50 x 109/l durante cualquier ciclo, se disminuirá un nivel de dosis en el siguiente ciclo (ver sección 4.2). Los niveles de dosis son de 100 mg/m2, 150 mg/m2 y 200 mg/m2. La dosis más baja recomendada es de 100 mg/m2.
Población pediátrica
No hay experiencia clínica sobre el empleo de TMZ en niños menores de 3 años de edad. La experiencia en niños mayores y adolescentes es muy limitada (ver secciones 4.2 y 5.1).
Pacientes de edad avanzada (> 70 años de edad)
Los pacientes de edad avanzada parecen presentar un mayor riesgo de neutropenia y trombocitopenia que los pacientes más jóvenes. Por lo tanto, se debe tener precaución especial cuando se administre TMZ a pacientes de edad avanzada.
Pacientes varones
Debe advertirse a los hombres que vayan a ser tratados con TMZ que eviten dejar embarazada a su pareja durante los 6 meses posteriores al tratamiento y que busquen asesoramiento sobre crioconservación del esperma antes del tratamiento (ver sección 4.6).
Sodio
Este medicamento contiene 2,4 mmol de sodio por vial. Esto debe tenerse en cuenta por los pacientes en dieta baja en sodio.
4.5 Interacción con otros medicamentos y otras formas de interacción
En otro estudio en fase I, la administración de TMZ con ranitidina no provocó modificaciones del grado de absorción de la temozolomida o de la exposición a su metabolito activo monometil triazenoimidazol carboxamida (MTIC).
En base a un análisis de la farmacocinética de población observado en ensayos en fase II, la coadministración de dexametasona, proclorperazina, fenitoína, carbamazepina, ondansetrón, antagonistas de los receptores H2 o fenobarbital no modificó la eliminación de TMZ. Se asoció la coadministración de ácido valproico con una pequeña pero estadísticamente significativa disminución del aclaramiento de TMZ.
No se han llevado a cabo estudios para determinar el efecto de TMZ sobre el metabolismo o eliminación de otros fármacos. No obstante, dado que TMZ no experimenta metabolismo hepático y muestra una baja unión a proteínas, es improbable que afecte a la farmacocinética de otros medicamentos (ver sección 5.2).
El empleo de TMZ en combinación con otros agentes mielosupresores puede aumentar la probabilidad de mielosupresión.
Población pediátrica
Los estudios de interacciones se han realizado sólo en adultos.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No hay datos en mujeres embarazadas. En los estudios preclínicos en ratas y conejos tratados con 150 mg/m2 de TMZ se observó teratogenia y/o toxicidad fetal (ver sección 5.3).
Temodal no debe administrarse a mujeres embarazadas. Si se debe considerar su uso durante el embarazo, la paciente debe ser informada del riesgo potencial para el feto.
Lactancia
Se desconoce si TMZ se excreta en la leche materna; por tanto, se debe interrumpir la lactancia durante el tratamiento con TMZ.
Mujeres en edad fértil
Se debe aconsejar a las mujeres en edad fértil el uso de un método anticonceptivo eficaz para evitar el embarazo mientras estén en tratamiento con TMZ.
Fertilidad masculina
TMZ puede tener efectos genotóxicos. Por lo tanto, se advierte a los hombres que vayan a ser tratados con ella que eviten dejar embarazada a su pareja hasta que hayan transcurrido 6 meses desde la última dosis y que busquen asesoramiento sobre crioconservación del esperma antes del tratamiento dada la posibilidad de infertilidad irreversible debido a la terapia con TMZ.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
TMZ tiene una influencia baja sobre la capacidad para conducir y utilizar máquinas debido a la fatiga y somnolencia (ver sección 4.8).
4.8 Reacciones adversas
Experiencia de ensayos clínicos con cápsulas
En pacientes tratados con TMZ, ya sea en combinación con RT o como monoterapia tras RT para glioblastoma multiforme de nuevo diagnóstico o como monoterapia en pacientes con glioma recurrente o progresivo, las reacciones adversas muy frecuentes notificadas fueron similares: náuseas, vómitos, estreñimiento, anorexia, cefalea y fatiga. Se notificaron de manera muy frecuente convulsiones en pacientes con glioblastoma multiforme de nuevo diagnóstico que recibieron monoterapia, y se notificó sarpullido muy frecuentemente en pacientes con glioblastoma multiforme de nuevo diagnóstico que recibieron TMZ en combinación con RT y también en monoterapia, y se notificó frecuentemente en glioma recurrente. La mayoría de las alteraciones de parámetros hematológicos se notificaron, según lo esperado, como frecuentes o muy frecuentes en ambas indicaciones (Tablas 4 y 5); después de cada tabla se recogen las frecuencias relativas a los parámetros de laboratorio de grados 3 y 4.
En las tablas, los efectos adversos se clasifican según la clasificación por órganos y sistemas y la frecuencia. Los grupos de frecuencia se definen según la siguiente convención: Muy frecuentes
(> 1/10); Frecuentes (> 1/100 a < 1/10); Poco frecuentes (> 1/1.000 a < 1/100); Raras (> 1/10.000 a < 1/1.000); Muy raras (< 1/10.000). Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
Glioblastoma multiforme de nuevo diagnóstico
La Tabla 4 incluye reacciones adversas derivadas del tratamiento en pacientes con glioblastoma multiforme de nuevo diagnóstico durante las fases de tratamiento concomitante y en monoterapia.
|
Tabla 4. Acontecimientos derivados del tratamiento durante las fases de tratamiento concomitante y en monoterapia en pacientes con glioblastoma multiforme de nuevo diagnóstico | ||
|
Clasificación por órganos y sistemas |
TMZ + radioterapia concomitante n=288* |
TMZ en monoterapia n=224 |
|
Infecciones e infestaciones | ||
|
Frecuentes: |
Infección, herpes simple, infección de una herida, faringitis, candidiasis oral |
Infección, candidiasis oral |
|
Poco frecuentes: |
Herpes simple, herpes zoster, síntomas pseudogripales | |
|
Trastornos de la sangre y del sistema linfático | ||
|
Frecuentes: |
Neutropenia, trombocitopenia, linfopenia, leucopenia |
Neutropenia febril, trombocitopenia, anemia, leucopenia |
|
Poco frecuentes: |
Neutropenia febril, anemia |
Linfopenia, petequia |
|
Trastornos endocrinos | ||
|
Poco frecuentes: |
Cushingoide |
Cushingoide |
|
Trastornos del metabolismo y de la nutrición | ||
|
Muy frecuentes: |
Anorexia |
Anorexia |
|
Frecuentes: |
Hiperglucemia, pérdida de peso |
Pérdida de peso |
|
Poco frecuentes: |
Hipopotasemia, aumento de la fosfatasa alcalina, aumento de peso |
Hiperglucemia, aumento de peso |
|
Trastornos psiquiátricos | ||
|
Frecuentes: |
Ansiedad, labilidad emocional, insomnio |
Ansiedad, depresión, labilidad emocional, insomnio |
|
Poco frecuentes: |
Agitación, apatía, alteración del comportamiento, depresión, alucinaciones |
Alucinaciones, amnesia |
|
Trastornos del sistema nervioso | ||
|
Muy frecuentes: |
Cefalea |
Convulsiones, cefalea |
|
Frecuentes: |
Convulsiones, pérdida de conocimiento, somnolencia, afasia, alteración del equilibrio, mareo, confusión, pérdida de memoria, disminución de la concentración, neuropatía, parestesia, trastorno en el habla, temblor |
Hemiparesia, afasia, alteración del equilibrio, somnolencia, confusión, mareo, pérdida de memoria, disminución de la concentración, disfasia, trastorno neurológico (NOS), neuropatía, neuropatía periférica, parestesia, trastorno en el habla, temblor |
|
Poco frecuentes: |
Status epilepticus, trastorno extrapiramidal, hemiparesia, ataxia, trastorno cognitivo, disfasia, trastorno de la marcha, hiperestesia, hipoestesia, trastorno neurológico (NOS), neuropatía periférica |
Hemiplejía, ataxia, alteración en la coordinación, trastorno de la marcha, hiperestesia, trastorno sensorial |
|
Trastornos oculares | ||
|
Frecuentes: |
Visión borrosa |
Defecto en el campo visual, visión borrosa, diplopía |
|
Poco frecuentes: |
Hemianopsia, disminución de la agudeza visual, trastorno en la visión, defecto en el campo visual, dolor ocular |
Disminución de la agudeza visual, dolor ocular, sequedad ocular |
|
Trastornos del oído y del laberinto | ||
|
Frecuentes: |
Trastorno en la audición |
Trastorno en la audición, tinnitus |
|
Poco frecuentes: |
Otitis media, tinnitus, hiperacusia, otalgia |
Sordera, vértigo, otalgia |
|
Trastornos cardiacos | ||
|
Poco frecuentes: |
Palpitaciones | |
|
Trastornos vasculares | ||
|
Frecuentes: |
Hemorragia, edema, edema de piernas |
Hemorragia, trombosis venosa profunda, edema de piernas |
|
Poco frecuentes: |
Hemorragia cerebral, hipertensión |
Embolismo pulmonar, edema, edema periférico |
|
Trastornos respiratorios, torácicos y mediastínicos | ||
|
Frecuentes: |
Disnea, tos |
Disnea, tos |
|
Poco frecuentes: |
Neumonía, infección respiratoria superior, congestión nasal |
Neumonía, sinusitis, infección respiratoria superior, bronquitis |
|
Trastornos gastrointestinales | ||
|
Muy frecuentes: |
Estreñimiento, náuseas, vómitos |
Estreñimiento, náuseas, vómitos |
|
Frecuentes: |
Estomatitis, diarrea, dolor abdominal, dispepsia, disfagia |
Estomatitis, diarrea, dispepsia, disfagia, sequedad de boca |
|
Poco frecuentes: |
Distensión abdominal, incontinencia fecal, trastorno gastrointestinal (NOS), gastroenteritis, hemorroides | |
|
Trastornos de la piel y del tejido subcutáneo | ||
|
Muy frecuentes: |
Sarpullido, alopecia |
Sarpullido, alopecia |
|
Frecuentes: |
Dermatitis, sequedad cutánea, eritema, prurito |
Sequedad cutánea, prurito |
|
Poco frecuentes: |
Exfoliación cutánea, reacción de fotosensibilidad, alteración en la pigmentación |
Eritema, alteración en la pigmentación, aumento de la sudoración |
|
Trastornos musculoesqueléticos y del tejido conjuntivo | ||
|
Frecuentes: |
Debilidad muscular, artralgia |
Debilidad muscular, artralgia, dolor musculoesquelético, mialgia |
|
Poco frecuentes: |
Miopatía, dolor de espalda, dolor musculoesquelético, mialgia |
Miopatía, dolor de espalda |
|
Trastornos renales y urinarios | ||
|
Frecuentes: |
Polaquiuria, incontinencia urinaria |
Incontinencia urinaria |
|
Poco frecuentes: |
Disuria | |
|
Trastornos del aparato reproductor y de la mama | ||
|
Poco frecuentes: |
Impotencia |
Hemorragia vaginal, menorragia, amenorrea, vaginitis, dolor de mama |
|
Trastornos generales y alteraciones en el lugar de administración | ||
|
Muy frecuentes: |
Fatiga |
Fatiga |
|
Frecuentes: |
Reacción alérgica, fiebre, lesión por radiación, edema facial, dolor, alteración del gusto |
Reacción alérgica, fiebre, lesión por radiación, dolor, alteración del gusto |
|
Poco frecuentes: |
Astenia, rubor, sofocos, empeoramiento de una enfermedad, escalofríos, cambio de color de la lengua, parosmia, sed |
Astenia, edema facial, dolor, empeoramiento de una enfermedad, escalofríos, trastorno dental |
|
Exploraciones complementarias | ||
|
Frecuentes: |
Aumento de ALT |
Aumento de ALT |
|
Poco frecuentes: |
Aumento de enzimas hepáticas, aumento de Gamma GT, aumento de AST | |
*Un paciente que se aleatorizó al brazo de RT únicamente, recibió TMZ + RT.
Resultados de laboratorio
Se observó mielosupresión (neutropenia y trombocitopenia), que es toxicidad limitante de dosis conocida para la mayoría de los agentes citotóxicos, incluido TMZ. Cuando las alteraciones en las pruebas de laboratorio y las reacciones adversas se sumaron entre las fases de tratamiento concomitante y en monoterapia, se observaron alteraciones en neutrófilos de Grado 3 o de Grado 4, incluyendo acontecimientos neutropénicos, en el 8 % de los pacientes. Se observaron alteraciones en los trombocitos de Grado 3 o Grado 4, incluyendo acontecimientos trombocitopénicos en el 14 % de los pacientes que recibieron TMZ.
Glioma maligno recurrente o progresivo
En los ensayos clínicos, las reacciones adversas que se produjeron más frecuentemente relacionadas con el tratamiento fueron los trastornos gastrointestinales, concretamente náuseas (43 %) y vómitos (36 %). Estas reacciones fueron normalmente de Grado 1 ó 2 (0-5 episodios de vómitos en 24 horas) y se autolimitaron o controlaron rápidamente con tratamiento antiemético estándar. La incidencia de náuseas y vómitos intensos fue del 4 %.
La Tabla 5 incluye las reacciones adversas notificadas durante los ensayos clínicos en glioma maligno recurrente o progresivo y después de la comercialización de Temodal.
_Tabla 5. Reacciones adversas en pacientes con glioma maligno recurrente o progresivo
Infecciones e infestaciones
Raras:
Infecciones oportunistas, incluyendo PCP
|
Trastornos de la sangre y del sistema linfático | |
|
Muy frecuentes: |
Neutropenia o linfopenia (grado 3-4), trombocitopenia (grado 3-4) |
|
Poco frecuentes: |
Pancitopenia, anemia (grado 3-4), leucopenia |
|
Trastornos del metabolismo y de la nutrición | |
|
Muy frecuentes: |
Anorexia |
|
Frecuentes: |
Pérdida de peso |
|
Trastornos del sistema nervioso | |
|
Muy frecuentes: |
Cefalea |
|
Frecuentes: |
Somnolencia, mareo, parestesia |
|
Trastornos respiratorios, torácicos y mediastínicos | |
|
Frecuentes: |
Disnea |
|
Trastornos gastrointestinales | |
|
Muy frecuentes: |
Vómitos, náuseas, estreñimiento |
|
Frecuentes: |
Diarrea, dolor abdominal, dispepsia |
|
Trastornos de la piel y del tejido subcutáneo | |
|
Frecuentes: |
Sarpullido, prurito, alopecia |
|
Muy raros: |
Eritema multiforme, eritrodermia, urticaria, exantema |
|
Trastornos generales y alteraciones en el lugar de administración | |
|
Muy frecuentes: |
Fatiga |
|
Frecuentes: |
Fiebre, astenia, escalofríos, malestar general, dolor, alteraciones en el gusto |
|
Muy raras: |
Reacciones alérgicas, incluyendo anafilaxia, angioedema |
Resultados de laboratorio
Se produjeron trombocitopenia y neutropenia de Grados 3 ó 4 en el 19 % y 17 %, respectivamente, de los pacientes tratados por glioma maligno. Esto provocó la hospitalización y/o interrupción del tratamiento con TMZ en el 8 % y 4 %, respectivamente. La mielosupresión fue previsible (normalmente dentro de los primeros ciclos, con el valor más bajo de parámetros hematológicos (nadir) entre el Día 21 y el Día 28), y la recuperación fue rápida, generalmente en 1-2 semanas. No se observó evidencia de una mielosupresión de tipo acumulativo. La presencia de trombocitopenia puede incrementar el riesgo de hemorragia, y la presencia de neutropenia o leucopenia puede incrementar el riesgo de infección.
Género
En un análisis de farmacocinética basada en la población sobre la experiencia en ensayos clínicos se disponía de los datos del nadir de los recuentos de neutrófilos para 101 mujeres y 169 hombres, y del nadir de plaquetas para 110 mujeres y 174 hombres. En el primer ciclo de terapia hubo tasas más altas de neutropenia de Grado 4 (RAN < 0,5 x 109/l), 12 % frente al 5 %, y trombocitopenia (< 20 x 109/l),
9 % frente al 3 %, en mujeres que en hombres. En una serie de datos de 400 pacientes con glioma recurrente, tras el primer ciclo de terapia, se produjo neutropenia de Grado 4 en el 8 % de las mujeres frente al 4 % de los hombres, y trombocitopenia de Grado 4 en el 8 % de las mujeres frente al 3 % de los hombres. En un ensayo con 288 pacientes con glioblastoma multiforme de nuevo diagnóstico, se produjo, en el primer ciclo de terapia, neutropenia de Grado 4 en el 3 % de las mujeres frente al 0 % de los hombres, y trombocitopenia de Grado 4 en el 1 % de las mujeres frente al 0 % de los hombres.
Población pediátrica
Se ha estudiado TMZ por vía oral en pacientes pediátricos (edad 3-18 años) con glioma recurrente del tronco encefálico o astrocitoma de alto grado recurrente, en un régimen de administración diaria durante 5 días cada 28 días. Aunque los datos son limitados, cabe esperar que la tolerancia en niños sea similar a la de los adultos. No se ha determinado la seguridad de TMZ en niños menores de 3 años.
Experiencia de ensayos clínicos con vía intravenosa
Temodal 2,5 mg/ml polvo para solución para perfusión proporciona una dosis equivalente de TMZ y la exposición a TMZ y su metabolito activo MTIC como las correspondientes cápsulas duras de Temodal (ver sección 5.2). Se registraron reacciones adversas durante los dos estudios con la formulación intravenosa (n=35), que no aparecían en los estudios que utilizaron cápsulas duras, fueron reacciones en el lugar de perfusión: dolor, irritación, prurito, calor, edema y eritema, así como hematoma.
Experiencia postcomercialización
Se han identificado las siguientes reacciones adversas graves durante la exposición postcomercialización:
|
Tabla 6. Resumen de los acontecimientos notificados con temozolomida en la postcomercialización | |
|
Infecciones e infestaciones* | |
|
Poco frecuentes: |
infección por citomegalovirus, reactivación de infección de tipo citomegalovirus, virus hepatitis B1 |
|
Trastornos de la sangre y del sistema linfático | |
|
Muy raras: |
pancitopenia prolongada, anemia aplásica1 |
|
Neoplasias benignas, malignas y no especificadas | |
|
Muy raras: |
síndrome mielodisplásico, tumores malignos secundarios, incluyendo leucemia mieloide |
|
Trastornos endocrinos* | |
|
Poco frecuentes: |
diabetes insípida |
|
Trastornos respiratorios, torácicos y mediastínicos | |
|
Muy raras: |
neumonitis intersticial/neumonitis, fibrosis pulmonar, insuficiencia respiratoria1 |
|
Trastornos hepatobiliares* | |
|
Frecuentes: |
enzimas hepáticas aumentadas |
|
Poco frecuentes: |
hiperbilirrubinemia, colestasis, hepatitis, lesión hepática, insuficiencia hepática1 |
|
Trastornos de la piel y del tejido subcutáneo | |
|
Muy raras: |
necrolisis epidérmica tóxica, syndrome de Stevens-Johnson |
1 Incluyendo casos con desenlace mortal Frecuencias estimadas a partir de los ensayos clínicos pertinentes.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Anexo V.
4.9 Sobredosis
Se han evaluado clínicamente en pacientes dosis de 500, 750, 1.000 y 1.250 mg/m2 (dosis total por ciclo de 5 días). La toxicidad limitante de dosis fue hematológica y se notificó con todas las dosis, pero se espera que sea más grave a dosis más altas. Un paciente recibió una sobredosis de 10.000 mg (dosis total por ciclo de 5 días) y las reacciones adversas que se notificaron fueron pancitopenia, pirexia, fracaso multiorgánico y muerte. Se han notificado casos de pacientes que han tomado la dosis recomendada durante más de 5 días de tratamiento (hasta 64 días) notificándose reacciones adversas como supresión de médula ósea, con o sin infección, en algunos casos grave y prolongada, con resultado de muerte. En caso de sobredosis, es necesaria una evaluación hematológica. Se deben tomar medidas generales de soporte si fuera necesario.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Agentes antineoplásicos - Otros agentes alquilantes, código ATC: L01A X03.
Mecanismo de acción
La temozolomida es un triazeno, que a pH fisiológico sufre una rápida conversión química a la monometil tiazenoimidazol carboxamida activa (MTIC). Se considera que la citotoxicidad del MTIC es consecuencia, fundamentalmente, de una alquilación en la posición O6 de la guanina, con una alquilación adicional que se produce en la posición N7. Se considera que las lesiones citotóxicas que se desarrollan posteriormente conllevan una reparación aberrante del metilo añadido.
Eficacia clínica y seguridad
Glioblastoma multiforme de nuevo diagnóstico
Se aleatorizaron un total de 573 pacientes para recibir o TMZ + RT (n=287) o RT sola (n=286). Los pacientes del brazo de TMZ + RT recibieron TMZ concomitante (75 mg/m2) una vez al día, empezando el primer día de RT hasta el último día de RT, durante 42 días (hasta un máximo de 49 días). Este tratamiento iba seguido de TMZ en monoterapia (150 - 200 mg/m2) en los Días 1 - 5 de cada ciclo de 28 días, hasta 6 ciclos, empezando 4 semanas después de la finalización de la RT. Los pacientes del brazo control sólo recibieron RT. Se necesitó profilaxis frente a neumonía por Pneumocystis jirovecii (PCP) durante la RT y la terapia combinada con TMZ.
En la fase de seguimiento se administró TMZ como terapia de rescate en 161 pacientes de los 282 (57 %) del brazo de RT sola, y en 62 pacientes de los 277 (22 %) del brazo de TMZ + RT.
El hazard ratio (HR) para la supervivencia global fue de 1,59 (95 % IC para HR=1,33 -1,91) con un rango logarítmico de p < 0,0001 a favor del brazo de TMZ. La probabilidad estimada de sobrevivir 2 o más años (26 % frente a 10 %) es mayor para el brazo de RT + TMZ. La adición de TMZ concomitante a la RT, seguida de TMZ en monoterapia en el tratamiento de pacientes con glioblastoma multiforme de nuevo diagnóstico, demostró una mejoría en la supervivencia global (SG) estadísticamente significativa en comparación con la RT sola (Figura 1).

tratar)
Los resultados del ensayo no fueron coherentes en el subgrupo de pacientes con un estado funcional bajo (Performance Status OMS PS=2, n=70), en el que la supervivencia global y el tiempo hasta la progresión fueron similares en ambos brazos. No obstante, este grupo de pacientes no parece presentar riesgos inaceptables.
Glioma maligno recurrente o _progresivo
Los datos sobre eficacia clínica en pacientes con glioblastoma multiforme (índice de estado funcional de Karnofsky [KPS] > 70), progresivo o recurrente, después de cirugía y RT se basaron en dos ensayos clínicos con TMZ oral. Uno fue un ensayo no comparativo sobre 138 pacientes (el 29 % recibió quimioterapia previa), y el otro fue un ensayo aleatorizado con brazo control activo de TMZ frente a procarbazina sobre un total de 225 pacientes (el 67 % recibió tratamiento previo con quimioterapia basada en nitrosourea). En ambos ensayos, la variable principal de valoración fue la supervivencia libre de progresión (SLP) definida por los escáneres de IRM o empeoramiento neurológico. En el ensayo no comparativo, la SLP a los 6 meses fue del 19 %, la mediana de la SLP fue de 2,1 meses, y la mediana de la supervivencia global de 5,4 meses. La tasa de respuesta objetiva (ORR) en base a las IRM fue del 8 %.
En el ensayo aleatorizado de brazo control activo, la SLP a los 6 meses fue significativamente mayor para TMZ que para la procarbazina (21 % frente al 8 %, respectivamente - prueba de chi-cuadrado p= 0,008) con una mediana de la SLP de 2,89 y 1,88 meses respectivamente (Test de rango logarítmico, p = 0,0063). La mediana de la supervivencia fue de 7,34 y 5,66 meses para TMZ y procarbazina, respectivamente (rango logarítmico de p = 0,33). A los 6 meses la fracción de pacientes que sobrevivieron fue significativamente superior en el brazo de TMZ (60 %) en comparación con el brazo de procarbazina (44 %) (prueba de chi-cuadrado p = 0,019). En los pacientes que recibieron quimioterapia previa se observó un beneficio en aquellos con un KPS > 80.
Los datos sobre el tiempo hasta el empeoramiento del estado neurológico favorecieron a TMZ sobre la procarbazina, al igual que los datos sobre el tiempo hasta el empeoramiento del estado funcional (decrece hasta KPS de < 70 o decrece al menos 30 puntos). En estas variables de valoración la mediana del tiempo hasta progresión osciló entre los 0,7 y 2,1 meses más para TMZ que para la procarbazina (Test de rango logarítmico, p = < 0,01 a 0,03).
Astrocitoma anaplásico recurrente
En un ensayo de fase II, multicéntrico y prospectivo, dirigido a evaluar la seguridad y la eficacia de la TMZ oral en el tratamiento de pacientes con un astrocitoma anaplásico en su primera recaída, la SLP a los 6 meses fue del 46 %. La mediana de la SLP fue de 5,4 meses. La mediana de la supervivencia global fue de 14,6 meses. La tasa de respuesta, basada en la evaluación practicada por un revisor central, fue del 35 % (13 RC y 43 RP) en la población analizada por intención de tratar (ITT) n=162.
Se comunicó enfermedad estable en 43 pacientes. La supervivencia libre de episodios a los 6 meses en la población analizada por ITT fue del 44 %, con una mediana de la supervivencia libre de episodios de 4,6 meses, cifra que fue similar a la hallada en la supervivencia libre de progresión de la enfermedad. En la población elegible desde el punto de vista de la histología, los resultados de eficacia fueron similares. El alcance de una respuesta objetiva radiológica o el mantenimiento del estado libre de progresión de la enfermedad se asoció firmemente al mantenimiento o la mejoría de la calidad de vida.
Población pediátrica
Se ha estudiado TMZ por vía oral en pacientes pediátricos (edad 3-18 años) con glioma recurrente del tronco encefálico o astrocitoma de alto grado recurrente, en un régimen de administración diaria durante 5 días cada 28 días. La tolerancia a TMZ es similar a la de los adultos.
5.2 Propiedades farmacocinéticas
TMZ se hidroliza espontáneamente a pH fisiológico principalmente a los metabolitos activos, 3-metil(triazeno-1-il)imidazol-4-carboxamida (MTIC). MTIC se hidroliza espontáneamente a 5-amino-imidazol-4-carboxamida (AIC), un conocido intermediario en la biosíntesis de purinas y ácidos nucleicos, y a metilhidrazina, que se cree que es el metabolito alquilante activo. Se cree que la citotoxicidad de MTIC se debe fundamentalmente a la alquilación del ADN principalmente en las posiciones O6 y N7 de la guanina. En relación al AUC de temozolomida, la exposición a MTIC y AIC es ~ 2,4 % y 23 %, respectivamente. In vivo, el ti/2 de MTIC fue similar a la de TMZ, 1,8 h.
En un estudio abierto de bioequivalencia con grupos cruzados de la farmacocinética de TMZ oral e intravenoso en pacientes con tumores malignos primarios en el SNC, se encontró que Temodal en
2,5 mg/ml polvo para solución para perfusión administrados durante 90 minutos era bioequivalente en cuanto a Cmax y al AUC para TMZ y MTIC, en comparación con Temodal cápsulas duras, tras la administración de una dosis de 150 mg/m2. Los valores promedio de la Cmax para TMZ y MTIC fueron de 7,4 ^g/ml y 320 ng/ml, respectivamente, tras 90 minutos de perfusión intravenosa. Los valores promedio del AUC (0 ^ <x>) para TMZ y MTIC fueron de 25 ^g^h/ml y 1.004 ng^h/ml, respectivamente.
Absorción
Tras la administración oral a pacientes adultos, TMZ se absorbió rápidamente, con concentraciones máximas alcanzadas tan solo 20 minutos después de la administración (tiempo promedio entre 0,5 y
1,5 horas). Tras la administración oral de TMZ marcada con 14C, la excreción fecal promedio de 14C durante los siguientes 7 días después de la dosis fue de 0,8 % indicando la absorción completa.
Distribución
TMZ demuestra baja unión a proteínas (10 % a 20 %), y por lo tanto, no se espera que interactúe con sustancias de alta afinidad por proteínas.
Los estudios de tomografía por emisión de positrones (TEP) en seres humanos y los datos preclínicos sugieren que TMZ cruza la barrera hematoencefálica rápidamente y está presente en el LCR. La penetración del LCR se confirmó en un paciente, la exposición del LCR basada en el AUC de TMZ fue aproximadamente de un 30 % de éste en el plasma, lo que es coherente con los datos en animales.
Eliminación
La vida media en el plasma (tJ/2) es aproximadamente de 1,8 horas. La ruta principal de eliminación del 14C es la renal. Tras la administración oral, aproximadamente el 5 % al 10 % de la dosis se recupera sin cambios en la orina durante 24 horas, y el resto se excreta como temozolomida árida, 5-aminoimidazol-4-carboxamida (AIC) o metabolitos polares sin identificar.
Las concentraciones en plasma aumentan de manera relacionada con la dosis. El aclaramiento del plasma, el volumen de distribución y la vida media son independientes de la dosis.
Poblaciones especiales
El análisis de la farmacocinética basada en la población de TMZ reveló que el aclaramiento de TMZ en el plasma fue independiente de la edad, función renal o consumo de tabaco. En un estudio farmacocinético diferente, los perfiles farmacocinéticos del plasma en pacientes con disfunción hepática leve a moderada fueron similares a los observados en pacientes con función hepática normal.
Los pacientes pediátricos presentaron un AUC mayor que los pacientes adultos; no obstante, la dosis máxima tolerada (DMT) fue de 1.000 mg/m2 por ciclo en niños y en adultos.
5.3 Datos preclínicos sobre seguridad
Se llevaron a cabo estudios de toxicidad tras un solo ciclo (administración durante 5 días, 23 días sin tratamiento), 3 ciclos y 6 ciclos en ratas y perros. Las dianas principales de la toxicidad fueron la médula ósea, el sistema linforreticular, los testículos, el tracto gastrointestinal, y, a dosis superiores, que fueron letales para del 60 % al 100 % de las ratas y perros tratados, se produjo la degeneración de la retina. La mayoría de la toxicidad mostró evidencia de reversibilidad, excepto las reacciones adversas sobre el sistema reproductor masculino y la degeneración de la retina. No obstante, dado que las dosis implicadas en la degeneración de la retina se encontraban en el intervalo de dosis letal y no se ha observado un efecto comparable en los estudios clínicos, no se consideró que este resultado tuviera relevancia clínica.
TMZ es un agente alquilante embriotóxico, teratogénico y genotóxico. TMZ es más tóxica en la rata y el perro que en los seres humanos, y la dosis clínica se acerca a la dosis letal mínima en ratas y perros. Las reducciones, relacionadas con la dosis, en los leucocitos y las plaquetas parecen ser unos indicadores sensibles de toxicidad. En el estudio de administración a ratas durante seis ciclos, se observaron varias neoplasias, incluyendo carcinoma de mama, queratoacantoma y adenoma de células basales mientras que en los estudios en perros no se observaron tumores o alteraciones preneoplásicas. La rata parece ser particularmente sensible a los efectos oncogénicos de TMZ, con la aparición de los primeros tumores dentro de los tres meses del inicio del tratamiento. Este periodo de latencia es muy corto incluso para un agente alquilante.
Los resultados de los test de Ames/salmonella y de aberración cromosómica en Linfocitos de Sangre Periférica Humana (HPBL) mostraron una respuesta positiva de mutagenicidad.
La formulación intravenosa produjo irritación local en el lugar de la inyección en conejos y ratas. La irritación fue transitoria y no se asoció con un daño tisular duradero.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Manitol (E 421)
Treonina Polisorbato 80
Citrato de sodio (para ajuste del pH)
Ácido clorhídrico concentrado (para ajuste del pH)
6.2 Incompatibilidades
En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros.
6.3 Periodo de validez Vial sin abrir: 4 años
Solución reconstituida: Tras la reconstitución se ha demostrado la estabilidad química y física en uso durante 14 horas a 25°C, incluyendo el tiempo de perfusión.
Desde un punto de vista microbiológico, el producto debería usarse inmediatamente, si no se usa inmediatamente, los tiempos de almacenamiento en uso y las condiciones antes del uso son responsabilidad del usuario y normalmente deberían no ser superiores a 24 horas a 2 a 8°C, a no ser que la reconstitución haya tenido lugar en condiciones asépticas controladas y validadas.
6.4 Precauciones especiales de conservación
Conservar en nevera (2°C - 8°C).
Para las condiciones de conservación tras la reconstitución del medicamento, ver sección 6.3.
6.5 Naturaleza y contenido del envase
Vial de vidrio transparente de tipo I sellado con tapón de caucho de bromobutilo y precinto de aluminio con cubierta de fácil apertura de color melocotón. Cada vial contiene 100 mg de TMZ.
Temodal 2,5 mg/ml se suministra como un pack de 1 vial.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Debe tenerse cuidado en la manipulación de Temodal 2,5 mg/ml polvo para solución para perfusión. Se requiere el uso de guantes y técnica aséptica. Si Temodal 2,5 mg/ml entra en contacto con la piel o mucosas, debe lavarse ésta inmediata y concienzudamente con agua y jabón.
Debe reconstituirse cada vial con 41 ml de agua esterilizada para inyecciones. La solución resultante contiene 2,5 mg/ml de TMZ. Estos viales deben rotarse suavemente y no agitarse. Debe examinarse la solución, y cualquier vial que contenga material particulado visible no debe usarse. Debe extraerse un volumen de hasta 40 ml de solución reconstituida, según la dosis total prescrita y transferirse a una bolsa de perfusión (de PVC o poliolefina) de 250 ml vacía. Debe unirse el conducto de la bomba a la bolsa, purgarse el conducto y a continuación taparse. Temodal 2,5 mg/ml debe administrarse mediante perfusión intravenosa sólo durante un período de 90 minutos.
Temodal 2,5 mg/ml polvo para solución para perfusión puede administrarse a través de la misma vía intravenosa con cloruro de sodio 0,9 %. Es incompatible con soluciones de dextrosa.
En ausencia de datos adicionales, este medicamento no debe mezclarse con otros medicamentos o infundirse simultáneamente a través de la misma vía intravenosa.
Este medicamento es sólo para uso único. La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU Reino Unido
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/98/096/023
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 26/enero/1999 Fecha de la última renovación: 26/enero/2009
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
A. FABRICANTE(S) RESPONSABLE(S) DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
A. FABRICANTE(S) RESPONSABLE(S) DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección del fabricante responsable de la liberación de los lotes
SP Labo N.V. Industriepark 30 2220 Heist op den Berg Bélgica
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica restringida (Ver Anexo I: Ficha Técnica o Resumen de las Características del Producto, sección 4.2).
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
El Titular de la Autorización de Comercialización (TAC) presentará los informes periódicos de seguridad para este medicamento de conformidad con las exigencias establecidas en la lista de fechas de referencia de la Unión (lista EURD), prevista en el artículo 107ter, párrafo 7, de la Directiva 2001/83/CE y publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado en la versión del PGR incluido en el Módulo 1.8.2. de la Autorización de Comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
Si coincide la presentación de un IPS con la actualización del PGR, ambos documentos se pueden presentar conjuntamente.
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
Temodal 5 mg cápsulas duras temozolomida
Cada cápsula dura contiene 5 mg de temozolomida
Contiene lactosa. Para mayor información consultar el prospecto.
5 cápsulas duras 20 cápsulas duras
Leer el prospecto antes de utilizar este medicamento. Vía oral
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños, preferiblemente en un armario cerrado con llave. La ingestión accidental puede ser mortal en niños.
Citotóxico
No abrir, aplastar o morder las cápsulas, deben tragarse enteras. Si se rompiera una cápsula, evite el contacto con su piel, ojos o nariz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
Todo medicamento sin usar o material residual debe eliminarse según la normativa local.
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU Reino Unido
EU/1/98/096/001 (5 cápsulas duras) EU/1/98/096/002 (20 cápsulas duras)
Lot
Medicamento sujeto a prescripción médica.
Temodal 5 mg
Temodal 20 mg cápsulas duras temozolomida
Cada cápsula dura contiene 20 mg de temozolomida.
Contiene lactosa. Para mayor información consultar el prospecto.
5 cápsulas duras 20 cápsulas duras
Leer el prospecto antes de utilizar este medicamento. Vía oral
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños, preferiblemente en un armario cerrado con llave. La ingestión accidental puede ser mortal en niños.
Citotóxico
No abrir, aplastar o morder las cápsulas, deben tragarse enteras. Si se rompiera una cápsula, evite el contacto con su piel, ojos o nariz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
Todo medicamento sin usar o material residual debe eliminarse según la normativa local.
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU Reino Unido
EU/1/98/096/003 (5 cápsulas duras) EU/1/98/096/004 (20 cápsulas duras)
Lot
Medicamento sujeto a prescripción médica.
Temodal 20 mg
Temodal 100 mg cápsulas duras temozolomida
Cada cápsula dura contiene 100 mg de temozolomida.
Contiene lactosa. Para mayor información consultar el prospecto.
5 cápsulas duras 20 cápsulas duras
Leer el prospecto antes de utilizar este medicamento. Vía oral
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños, preferiblemente en un armario cerrado con llave. La ingestión accidental puede ser mortal en niños.
Citotóxico
No abrir, aplastar o morder las cápsulas, deben tragarse enteras. Si se rompiera una cápsula, evite el contacto con su piel, ojos o nariz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
Todo medicamento sin usar o material residual debe eliminarse según la normativa local.
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU Reino Unido
EU/1/98/096/005 (5 cápsulas duras) EU/1/98/096/006 (20 cápsulas duras)
Lot
Medicamento sujeto a prescripción médica.
Temodal 100 mg
Temodal 140 mg cápsulas duras temozolomida
Cada cápsula dura contiene 140 mg de temozolomida.
Contiene lactosa. Para mayor información consultar el prospecto.
5 cápsulas duras 20 cápsulas duras
Leer el prospecto antes de utilizar este medicamento. Vía oral
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños, preferiblemente en un armario cerrado con llave. La ingestión accidental puede ser mortal en niños.
Citotóxico
No abrir, aplastar o morder las cápsulas, deben tragarse enteras. Si se rompiera una cápsula, evite el contacto con su piel, ojos o nariz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
Todo medicamento sin usar o material residual debe eliminarse según la normativa local.
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU Reino Unido
EU/1/98/096/009 (5 cápsulas duras) EU/1/98/096/010 (20 cápsulas duras)
Lot
Medicamento sujeto a prescripción médica.
Temodal 140 mg
Temodal 180 mg cápsulas duras temozolomida
Cada cápsula dura contiene 180 mg de temozolomida.
Contiene lactosa. Para mayor información consultar el prospecto.
5 cápsulas duras 20 cápsulas duras
Leer el prospecto antes de utilizar este medicamento. Vía oral
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños, preferiblemente en un armario cerrado con llave. La ingestión accidental puede ser mortal en niños.
Citotóxico
No abrir, aplastar o morder las cápsulas, deben tragarse enteras. Si se rompiera una cápsula, evite el contacto con su piel, ojos o nariz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
Todo medicamento sin usar o material residual debe eliminarse según la normativa local.
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU Reino Unido
EU/1/98/096/011 (5 cápsulas duras) EU/1/98/096/012 (20 cápsulas duras)
Lot
Medicamento sujeto a prescripción médica.
Temodal 180 mg
Temodal 250 mg cápsulas duras temozolomida
Cada cápsula dura contiene 250 mg de temozolomida.
Contiene lactosa. Para mayor información consultar el prospecto.
5 cápsulas duras 20 cápsulas duras
Leer el prospecto antes de utilizar este medicamento. Vía oral
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños, preferiblemente en un armario cerrado con llave. La ingestión accidental puede ser mortal en niños.
Citotóxico
No abrir, aplastar o morder las cápsulas, deben tragarse enteras. Si se rompiera una cápsula, evite el contacto con su piel, ojos o nariz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
Todo medicamento sin usar o material residual debe eliminarse según la normativa local.
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU Reino Unido
EU/1/98/096/007 (5 cápsulas duras) EU/1/98/096/008 (20 cápsulas duras)
Lot
Medicamento sujeto a prescripción médica.
Temodal 250 mg
ETIQUETA PARA FRASCOS QUE CONTIENEN 5 O 20 CAPSULAS DURAS DE TEMODAL 5mg
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Temodal 5 mg cápsulas duras
temozolomida
Vía oral
2. FORMA DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento.
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lot
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
5 cápsulas duras 20 cápsulas duras
6. OTROS
ETIQUETA PARA FRASCOS QUE CONTIENEN 5 O 20 CAPSULAS DURAS DE TEMODAL 20 mg_
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Temodal 20 mg cápsulas duras
temozolomida
Vía oral
2. FORMA DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento.
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lot
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
5 cápsulas duras 20 cápsulas duras
6. OTROS
ETIQUETA PARA FRASCOS QUE CONTIENEN 5 O 20 CAPSULAS DURAS DE TEMODAL 100 mg_
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Temodal 100 mg cápsulas duras
temozolomida
Vía oral
2. FORMA DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento.
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lot
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
5 cápsulas duras 20 cápsulas duras
6. OTROS
ETIQUETA PARA FRASCOS QUE CONTIENEN 5 O 20 CAPSULAS DURAS DE TEMODAL 140 mg_
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Temodal 140 mg cápsulas duras
temozolomida
Vía oral
2. FORMA DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento.
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lot
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
5 cápsulas duras 20 cápsulas duras
6. OTROS
ETIQUETA PARA FRASCOS QUE CONTIENEN 5 O 20 CAPSULAS DURAS DE TEMODAL 180 mg_
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Temodal 180 mg cápsulas duras
temozolomida
Vía oral
2. FORMA DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento.
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lot
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
5 cápsulas duras 20 cápsulas duras
6. OTROS
ETIQUETA PARA FRASCOS QUE CONTIENEN 5 O 20 CAPSULAS DURAS DE TEMODAL 250 mg_
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Temodal 250 mg cápsulas duras
temozolomida
Vía oral
2. FORMA DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento.
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lot
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
5 cápsulas duras 20 cápsulas duras
6. OTROS
Temodal 5 mg cápsulas duras temozolomida
Cada cápsula dura contiene 5 mg de temozolomida.
Contiene lactosa. Para mayor información consultar el prospecto.
5 cápsulas duras en sobres 20 cápsulas duras en sobres
Leer el prospecto antes de utilizar este medicamento. Vía oral
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños, preferiblemente en un armario cerrado con llave. La ingestión accidental puede ser mortal en niños.
Citotóxico
No abrir, aplastar o morder las cápsulas, deben tragarse enteras. Si se rompiera una cápsula, evite el contacto con su piel, ojos o nariz.
No conservar a temperatura superior a 30°C.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
Todo medicamento sin usar o material residual debe eliminarse según la normativa local.
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/98/096/024 (5 cápsulas duras) EU/1/98/096/025 (20 cápsulas duras)
13. NÚMERO DE LOTE
Lot
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Temodal 5 mg
Temodal 20 mg cápsulas duras temozolomida
Cada cápsula dura contiene 20 mg de temozolomida.
Contiene lactosa. Para mayor información consultar el prospecto.
5 cápsulas duras en sobres 20 cápsulas duras en sobres
Leer el prospecto antes de utilizar este medicamento. Vía oral
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños, preferiblemente en un armario cerrado con llave. La ingestión accidental puede ser mortal en niños.
Citotóxico
No abrir, aplastar o morder las cápsulas, deben tragarse enteras. Si se rompiera una cápsula, evite el contacto con su piel, ojos o nariz.
No conservar a temperatura superior a 30°C.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
Todo medicamento sin usar o material residual debe eliminarse según la normativa local.
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/98/096/013 (5 cápsulas duras) EU/1/98/096/014 (20 cápsulas duras)
13. NÚMERO DE LOTE
Lot
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Temodal 20 mg
Temodal 100 mg cápsulas duras temozolomida
Cada cápsula dura contiene 100 mg de temozolomida.
Contiene lactosa. Para mayor información consultar el prospecto.
5 cápsulas duras en sobres 20 cápsulas duras en sobres
Leer el prospecto antes de utilizar este medicamento. Vía oral
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños, preferiblemente en un armario cerrado con llave. La ingestión accidental puede ser mortal en niños.
Citotóxico
No abrir, aplastar o morder las cápsulas, deben tragarse enteras. Si se rompiera una cápsula, evite el contacto con su piel, ojos o nariz.
No conservar a temperatura superior a 30°C.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
Todo medicamento sin usar o material residual debe eliminarse según la normativa local.
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/98/096/015 (5 cápsulas duras) EU/1/98/096/016 (20 cápsulas duras)
13. NÚMERO DE LOTE
Lot
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Temodal 100 mg
Temodal 140 mg cápsulas duras temozolomida
Cada cápsula dura contiene 140 mg de temozolomida.
Contiene lactosa. Para mayor información consultar el prospecto.
5 cápsulas duras en sobres 20 cápsulas duras en sobres
Leer el prospecto antes de utilizar este medicamento. Vía oral
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños, preferiblemente en un armario cerrado con llave. La ingestión accidental puede ser mortal en niños.
Citotóxico
No abrir, aplastar o morder las cápsulas, deben tragarse enteras. Si se rompiera una cápsula, evite el contacto con su piel, ojos o nariz.
No conservar a temperatura superior a 30°C.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
Todo medicamento sin usar o material residual debe eliminarse según la normativa local.
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/98/096/017 (5 cápsulas duras) EU/1/98/096/018 (20 cápsulas duras)
13. NÚMERO DE LOTE
Lot
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Temodal 140 mg
Temodal 180 mg cápsulas duras temozolomida
Cada cápsula dura contiene 180 mg de temozolomida.
Contiene lactosa. Para mayor información consultar el prospecto.
5 cápsulas duras en sobres 20 cápsulas duras en sobres
Leer el prospecto antes de utilizar este medicamento. Vía oral
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños, preferiblemente en un armario cerrado con llave. La ingestión accidental puede ser mortal en niños.
Citotóxico
No abrir, aplastar o morder las cápsulas, deben tragarse enteras. Si se rompiera una cápsula, evite el contacto con su piel, ojos o nariz.
No conservar a temperatura superior a 30°C.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
Todo medicamento sin usar o material residual debe eliminarse según la normativa local.
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/98/096/019 (5 cápsulas duras) EU/1/98/096/020 (20 cápsulas duras)
13. NÚMERO DE LOTE
Lot
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Temodal 180 mg
Temodal 250 mg cápsulas duras temozolomida
Cada cápsula dura contiene 250 mg de temozolomida.
Contiene lactosa. Para mayor información consultar el prospecto.
5 cápsulas duras en sobres 20 cápsulas duras en sobres
Leer el prospecto antes de utilizar este medicamento. Vía oral
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños, preferiblemente en un armario cerrado con llave. La ingestión accidental puede ser mortal en niños.
Citotóxico
No abrir, aplastar o morder las cápsulas, deben tragarse enteras. Si se rompiera una cápsula, evite el contacto con su piel, ojos o nariz.
No conservar a temperatura superior a 30°C.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
Todo medicamento sin usar o material residual debe eliminarse según la normativa local.
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/98/096/021 (5 cápsulas duras) EU/1/98/096/022 (20 cápsulas duras)
13. NÚMERO DE LOTE
Lot
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Temodal 250 mg
SOBRE QUE CONTIENE 1 CAPSULA DURA DE TEMODAL 5 mg
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Temodal 5 mg cápsulas
temozolomide
Vía oral
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE
Lot
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
1 cápsula
6. OTROS
SOBRE QUE CONTIENE 1 CAPSULA DURA DE TEMODAL 20 mg
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Temodal 20 mg cápsulas
temozolomide
Vía oral
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE
Lot
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
1 cápsula
6. OTROS
SOBRE QUE CONTIENE 1 CAPSULA DURA DE TEMODAL 100 mg
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Temodal 100 mg cápsulas
temozolomide
Vía oral
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE
Lot
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
1 cápsula
6. OTROS
SOBRE QUE CONTIENE 1 CAPSULA DURA DE TEMODAL 140 mg
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Temodal 140 mg cápsulas
temozolomide
Vía oral
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE
Lot
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
1 cápsula
6. OTROS
SOBRE QUE CONTIENE 1 CAPSULA DURA DE TEMODAL 180 mg
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Temodal 180 mg cápsulas
temozolomide
Vía oral
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE
Lot
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
1 cápsula
6. OTROS
SOBRE QUE CONTIENE 1 CAPSULA DURA DE TEMODAL 250 mg
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Temodal 250 mg cápsulas
temozolomide
Vía oral
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE
Lot
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
1 cápsula
6. OTROS
Temodal 2,5 mg/ml polvo para solución para perfusión temozolomida
Cada vial contiene 100 mg de temozolomida.
Tras la reconstitución, 1 ml de solución para perfusión contiene 2,5 mg de temozolomida.
Excipientes: manitol (E 421), treonina, polisorbato 80, citrato de sodio y ácido clorhídrico concentrado para ajuste del pH.
Sodio: Para mayor información consultar el prospecto.
Polvo para solución para perfusión 1 vial de 100 mg
Sólo uso intravenoso.
Sólo para uso único.
Leer el prospecto antes de utilizar este medicamento.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
Conservar en nevera.
Tras la reconstitución: usar la solución en 14 horas a 25°C, incluyendo el tiempo de perfusión.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
Todo medicamento sin usar o material residual debe eliminarse según la normativa local.
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU Reino Unido
EU/1/98/096/023
Medicamento sujeto a prescripción médica.
Se acepta la justificación para no incluir la información en Braille
Temodal 2,5 mg/ml polvo para solución para perfusión temozolomida
Cada vial contiene 100 mg de temozolomida.
Tras la reconstitución, 1 ml de solución para perfusión contiene 2,5 mg
Manitol (E421), treonina, polisorbato 80, citrato de sodio y ácido clorhídrico. Sodio: Para mayor información consultar el prospecto.
Polvo para solución para perfusión 100 mg
Uso intravenoso, un solo uso.
Leer el prospecto antes de utilizar este medicamento.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
Conservar en nevera.
Tras la reconstitución: 14 horas a 25°C, incluyendo el tiempo de perfusión.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
Eliminar según la normativa local.
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Merck Sharp & Dohme Limited Hertford Road, Hoddesdon Hertfordshire EN11 9BU Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/98/096/023
13. NÚMERO DE LOTE
Lot
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
B. PROSPECTO
Prospecto: información para el usuario
Temodal 5 mg cápsulas duras Temodal 20 mg cápsulas duras Temodal 100 mg cápsulas duras Temodal 140 mg cápsulas duras Temodal 180 mg cápsulas duras Temodal 250 mg cápsulas duras Temozolomida (Temozolomide)
Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque
contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico, farmacéutico o enfermero.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico, farmacéutico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4
Contenido del prospecto
1. Qué es Temodal y para qué se utiliza
2. Qué necesita saber antes de empezar a tomar Temodal
3. Cómo tomar Temodal
4. Posibles efectos adversos
5. Conservación de Temodal
6. Contenido del envase e información adicional
1. Qué es Temodal y para qué se utiliza
Temodal contiene un medicamento llamado temozolomida. Este medicamento es un agente
antitumoral.
Temodal está indicado en el tratamiento de formas específicas de tumores cerebrales:
- en adultos con glioblastoma multiforme de nuevo diagnóstico. Temodal se usa inicialmente en combinación con radioterapia (fase concomitante del tratamiento) y posteriormente en solitario (fase de monoterapia del tratamiento).
- en niños de 3 años y mayores y adultos con glioma maligno, tal como glioblastoma multiforme o astrocitoma anaplásico. Temodal está indicado en estos tumores si reaparecen o empeoran después de tratamiento estándar.
2. Qué necesita saber antes de empezar a tomar Temodal
No tome Temodal:
- si es alérgico a temozolomida o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
- si ha presentado una reacción alérgica a la dacarbazina (un fármaco anticanceroso, a veces denominado DTIC). Entre los signos de reacción alérgica se incluyen picor, sensación de falta de aire o silbidos, hinchazón del rostro, labios, lengua o garganta.
- si se reducen de forma importante ciertos tipos de células sanguíneas (mielosupresión), así como el recuento de leucocitos y recuento de plaquetas. Estas células sanguíneas son importantes en la lucha contra las infecciones y para una correcta coagulación de la sangre. Su médico le pedirá análisis de sangre para comprobar que tiene un número suficiente de estas células antes de iniciar el tratamiento.
Advertencias y precauciones
Consulte a su médico, farmacéutico o enfermero antes de empezar a tomar Temodal.
- ya que debe ser vigilado estrechamente para comprobar el posible desarrollo de una forma grave de infección respiratoria llamada neumonía por Pneumocystis jirovecii (PCP). Si usted es un paciente recientemente diagnosticado (glioblastoma multiforme) puede estar recibiendo Temodal en el régimen de 42 días, en combinación con radioterapia. En este caso, su médico también le recetará un medicamento que le ayude a evitar este tipo de neumonía (PCP).
- si ha tenido alguna vez o puede que tenga ahora infección por hepatitis B, ya que Temodal podría activar otra vez la hepatitis B, que en algunos casos puede ser mortal. Antes de iniciar el tratamiento, el médico examinará minuciosamente a los pacientes en busca de signos de esta infección.
- si presenta recuentos bajos de glóbulos rojos (anemia), glóbulos blancos y plaquetas, o problemas de coagulación de la sangre antes del tratamiento, o los presenta durante el tratamiento. Es posible que su médico le reduzca la dosis del medicamento o que lo interrumpa, o puede también que precise usted otro tratamiento. En algunos casos, podrá ser necesario suspender el tratamiento con Temodal. Será sometido con frecuencia a análisis de sangre para vigilar los efectos secundarios de Temodal sobre sus células sanguíneas.
- ya que puede presentar un riesgo bajo de otras alteraciones en las células sanguíneas, incluyendo leucemia.
- si tiene náuseas (ganas de vomitar) y/o vómitos, que son efectos adversos muy frecuentes con Temodal (ver sección 4), su médico puede prescribirle un medicamento para la prevención del vómito (antiemético).
Si vomita frecuentemente antes o durante el tratamiento, pregunte a su médico sobre el mejor momento para tomar Temodal hasta que el vómito esté bajo control. Si vomita después de tomar su dosis, no tome una segunda dosis en el mismo día.
- si presenta fiebre o síntomas de una infección, póngase en contacto con su médico inmediatamente.
- si es mayor de 70 años de edad, puede aumentar la susceptibilidad a la infección y ser más propenso a las infecciones, moratones y sangrado.
- si tiene problemas de hígado o riñón, se ajustará su dosis de Temodal.
Niños y adolescentes
No de este medicamento a niños menores de 3 años, ya que su efecto en esta edad no ha sido estudiado. Se dispone de información limitada en pacientes mayores de 3 años que han tomado Temodal.
Toma de Temodal con otros medicamentos
Informe a su médico o farmacéutico si está tomando, ha tomado recientemente o podría tener que tomar cualquier otro medicamento.
Embarazo, lactancia y fertilidad
Si está embarazada, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento, ya que no debe ser tratada con Temodal durante el embarazo a menos que sea claramente indicado por su médico.
Se recomiendan medidas anticonceptivas eficaces tanto en los pacientes varones como en las mujeres que se encuentren en tratamiento con Temodal (ver también "Fertilidad masculina" más abajo).
Debe suspender la lactancia materna mientras dure el tratamiento con Temodal.
Fertilidad masculina
Temodal puede causar infertilidad permanente. Los pacientes varones deben usar métodos anticonceptivos eficaces y no dejar embarazada a su pareja hasta 6 meses después de finalizar el tratamiento. Se recomienda consultar acerca de la conservación del esperma antes del tratamiento.
Conducción y uso de máquinas
Temodal puede hacerle sentir cansado o con sueño. En este caso, no conduzca ni maneje herramientas o máquinas, ni monte en bicicleta hasta ver cómo le afecta a usted este medicamento (ver sección 4).
Temodal contiene lactosa
Temodal contiene lactosa (un tipo de azúcar). Si su médico le ha indicado que padece una intolerancia a ciertos azúcares, consulte con él antes de tomar este medicamento.
3. Cómo tomar Temodal
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico o farmacéutico. En caso de duda, consulte de nuevo a su médico o farmacéutico.
Dosis y duración del tratamiento
Su médico determinará cuál es su dosis correcta de Temodal. Basándose en su complexión (altura y peso), si tiene un tumor recurrente y si ha sido sometido previamente a tratamiento con quimioterapia. Es posible que se le prescriba otro medicamento (antiemético) para tomar antes y/o tras tomar Temodal para prevenir o controlar las náuseas y el vómito.
Pacientes con glioblastoma multiforme de nuevo diagnóstico:
Si es un paciente de nuevo diagnóstico, el tratamiento se realizará en dos fases:
- en primer lugar, tratamiento conjunto con radioterapia (fase concomitante)
- seguida de tratamiento solamente con Temodal (fase de monoterapia).
Durante la fase concomitante, su médico comenzará con Temodal a una dosis de 75 mg/m2 (dosis normal). Se tomará esta dosis cada día durante 42 días (hasta como máximo 49 días) en combinación con radioterapia. La dosis de Temodal puede retrasarse o interrumpirse, dependiendo de sus recuentos sanguíneos y de cómo tolere la medicación durante la fase concomitante.
Un vez que la radioterapia se complete, interrumpirá el tratamiento durante 4 semanas para darle a su organismo la oportunidad de recuperarse.
Después, empezará la fase de monoterapia.
Durante la fase de monoterapia, la dosis y la forma en que tome Temodal serán diferentes. Su médico le indicará la dosis exacta.
Pueden ser hasta 6 periodos (ciclos) de tratamiento. Cada uno dura 28 días.
Tomará su nueva dosis de Temodal solo una vez al día durante los primeros 5 días de cada ciclo (“días de dosificación”). La primera dosis será de 150 mg/m2. Después serán 23 días sin Temodal. Esto suma en total un ciclo de tratamiento de 28 días.
Después del día 28, comenzará el siguiente ciclo. Tomará de nuevo Temodal una vez al día durante 5 días seguido de 23 días sin Temodal. La dosis de Temodal se puede ajustar, retrasar o suprimir, dependiendo de su analítica sanguínea y de cómo tolere su medicamento durante cada ciclo de tratamiento.
Pacientes con tumores en recurrencia o _progresión (glioma maligno, tal como glioblastoma multiforme o astrocitoma anaplásico) que toman solamente Temodal:
Un ciclo de tratamiento con Temodal es de 28 días.
Tomará Temodal solo una vez al día durante los primeros 5 días. Esta dosis diaria dependerá de si usted ha sido tratado previamente con quimioterapia o no.
Si no ha sido tratado previamente con quimioterapia, su primera dosis de Temodal será de 200 mg/m2 una vez al día durante los primeros 5 días. Si ha sido previamente tratado con quimioterapia, su primera dosis de Temodal será de 150 mg/m2 una vez al día durante los primeros 5 días.
Después serán 23 días sin Temodal. Esto suma en total un ciclo de tratamiento de 28 días.
Tras el día 28, iniciará un nuevo ciclo. Recibirá de nuevo Temodal una vez al día durante 5 días, seguido de 23 días sin Temodal.
Cada vez que comience un nuevo ciclo de tratamiento, se analizará su sangre para verificar si se debe ajustar su dosis de Temodal. Dependiendo de los resultados, su médico puede ajustarle su medicación para el próximo ciclo.
Cómo tomar Temodal
Tome su dosis prescrita de Temodal una vez al día, preferiblemente a la misma hora cada día.
Tome las cápsulas con el estómago vacío; por ejemplo, al menos una hora antes de que tenga planeado desayunar. Trague la(s) cápsula(s) entera(s) con un vaso de agua. No abra, aplaste, ni mastique las cápsulas. Si la cápsula se estropea, evite el contacto del polvo con la piel, los ojos o la nariz. Si accidentalmente le entra en los ojos o en la nariz, lave la zona con agua.
Según la dosis prescrita, puede tener que tomar más de una cápsula a la vez, con diferentes concentraciones (contenido de principio activo, en mg). El color de la tapa de la cápsula es diferente para cada concentración (ver en la tabla debajo).
|
Dosis |
Color de la tapa |
|
Temodal 5 mg cápsulas duras |
verde |
|
Temodal 20 mg cápsulas duras |
amarillo |
|
Temodal 100 mg cápsulas duras |
rosa |
|
Temodal 140 mg cápsulas duras |
azul |
|
Temodal 180 mg cápsulas duras |
naranja |
|
Temodal 250 mg cápsulas duras |
blanco |
Debe estar seguro de que comprende muy bien y recuerda lo siguiente:
• cuántas cápsulas necesita tomar cada día de dosificación. Diga a su médico o farmacéutico que se lo anote (incluyendo el color).
• Cuáles son sus días de dosificación.
Repase la dosis con su médico cada vez que comience un nuevo ciclo, ya que puede ser diferente del pasado ciclo.
Siga exactamente las instrucciones de administración de Temodal indicadas por su médico. Consulte a su médico o farmacéutico si tiene dudas. Los errores del modo de tomar este medicamento pueden tener graves consecuencias para la salud.
Si toma más Temodal del que debe
Si accidentalmente tomara más Temodal cápsulas del que le dijeron, contacte con su médico o farmacéutico o enfermero inmediatamente.
Si olvidó tomar Temodal
Tome la dosis que ha olvidado lo antes posible durante el mismo día. Si ha transcurrido un día entero, consulte con su médico. No tome una dosis doble para compensar la dosis olvidada, a menos que su médico le indique hacerlo así.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico, farmacéutico o enfermero.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Contacte inmediatamente con su médico si tiene cualquiera de lo siguiente:
- una reacción alérgica (hipersensible) grave (urticaria, respiración sibilante u otra dificultad respiratoria),
- hemorragia incontrolada,
- convulsiones,
- fiebre,
- dolor de cabeza intenso que no desaparece.
El tratamiento con Temodal puede provocar una reducción de ciertos tipos de células sanguíneas. Esto puede hacer que aumente la probabilidad de que presente hematomas o hemorragia, anemia (reducción del número de glóbulos rojos), fiebre y disminución de la resistencia a las infecciones. La reducción del recuento de células sanguíneas es generalmente pasajera. En algunos casos se puede prolongar y puede producir una forma muy severa de anemia (anemia aplásica). Su médico le someterá con frecuencia a exámenes de sangre para detectar los eventuales cambios producidos, y decidirá si necesita un tratamiento específico. En algunos casos, se reducirá la dosis de Temodal o se suspenderá.
Efectos adversos vistos en los estudios clínicos:
Temodal en combinación con radioterapia en pacientes con slioblastoma de nuevo diagnóstico Los pacientes que reciben Temodal en combinación con radioterapia pueden experimentar reacciones adversas diferentes de las que experimentan los pacientes que reciben Temodal solo. Se pueden producir los siguientes efectos adversos, y pueden requerir atención médica.
Muy frecuentes (pueden afectar a más de 1 de cada 10 personas): pérdida de apetito, dolor de cabeza, estreñimiento (dificultad de evacuación de heces), náuseas (ganas de vomitar), vómitos, erupción cutánea, pérdida de pelo, cansancio.
Frecuentes (pueden afectar hasta 1 de cada 10 personas): infecciones orales, infección de heridas, número de células sanguíneas reducido (neutropenia, trombocitopenia, linfopenia, leucopenia), aumento de azúcar en sangre, pérdida de peso, cambios en el estado mental o en el estado de alerta, ansiedad/depresión, somnolencia, dificultad para hablar, alteración del equilibrio, mareos, confusión, alteraciones de la memoria, dificultad para concentrarse, incapacidad para dormir o permanecer dormido, sensación de hormigueo, moratones, agitación, visión anormal o borrosa, visión doble, pérdida de audición, dificultad para respirar, tos, trombosis en las piernas, retención de líquidos, piernas hinchadas, diarrea, dolor abdominal o de estómago, ardor de estómago, molestias gástricas, dificultad para tragar, sequedad de boca, irritación o enrojecimiento de la piel, sequedad cutánea, picor, debilidad muscular, dolor en las articulaciones, dolores musculares, micción frecuente, dificultad para controlar la orina, reacción alérgica, fiebre, lesión por radiación, hinchazón de la cara, dolor, alteración del gusto, alteración en las pruebas de la función hepática.
Poco frecuentes (pueden afectar hasta 1 de cada 100 personas): síntomas pseudogripales, manchas rojas debajo de la piel, nivel bajo de potasio en sangre, aumento de peso, cambios de humor, alucinaciones y pérdida de memoria, parálisis parcial, fallo en la coordinación, disminución en la sensibilidad, pérdida parcial de visión, ojos secos o doloridos, sordera, infección del oído medio, pitidos, dolor de oídos, palpitaciones (cuando se puede sentir como late el corazón), trombosis pulmonar, presión sanguínea elevada, neumonía, inflamación de las fosas nasales, bronquitis, resfriado o gripe, distensión estomacal, dificultad para controlar los movimientos del intestino, hemorroides, exfoliación de la piel, aumento de la sensibilidad cutánea a la luz solar, cambio en el color de la piel, aumento de la sudoración, daño muscular, dolor de espalda, dificultad en la micción, sangrado vaginal, impotencia sexual, periodos menstruales abundantes o ausentes, irritación vaginal, dolor de mamas, sofocos, escalofríos, cambio de color de la lengua, cambio en el sentido del olfato, sed, alteraciones dentales.
Monoterapia con Temodal en glioma cerebral recurrente o _progresivo
Las siguientes reacciones adversas pueden presentarse y puede requerirse atención médica.
Muy frecuentes (pueden afectar a más de 1 de cada 10 personas): reducción del número de células sanguíneas (neutropenia o linfopenia, trombocitopenia), pérdida de apetito, dolor de cabeza, vómitos, náuseas (ganas de vomitar), estreñimiento (dificultad de evacuación de heces), cansancio.
Frecuentes (pueden afectar hasta 1 de cada 10 personas): pérdida de peso, tendencia al sueño, mareos, sensación de hormigueo, dificultad para respirar, diarrea, dolor abdominal, molestias gástricas, erupción cutánea, picor, pérdida de pelo, fiebre, debilidad, escalofríos, sensación de malestar, dolor, alteración del gusto.
Poco frecuentes (pueden afectar hasta 1 de cada 100 personas): reducción del número de células sanguíneas (pancitopenia, anemia, leucopenia).
Raras (pueden afectar hasta 1 de cada 1.000 personas): tos, infecciones como neumonía.
Muy raras (pueden afectar hasta 1 de cada 10.000 personas): enrojecimiento de la piel, urticaria, erupción cutánea, reacciones alérgicas.
Otros efectos adversos:
Se han comunicado frecuentemente casos de enzimas hepáticas elevadas. Se han comunicado poco frecuentemente casos de aumento de la bilirrubina, problemas con el flujo de la bilis (colestasis), hepatitis, lesiones en el hígado, incluyendo insuficiencia hepática mortal.
Se han observado casos muy raros de erupción grave con hinchazón cutánea, incluyendo las palmas de las manos y las plantas de los pies, o enrojecimiento de la piel con dolor y/o ampollas en el cuerpo o en la boca. Si esto ocurre, hágalo saber a su médico inmediatamente.
Se han observado casos muy raros de efectos adversos en el pulmón con Temodal. Los pacientes normalmente presentan dificultad para respirar y tos. Informe a su médico si nota alguno de estos síntomas.
Muy raramente, los pacientes que toman Temodal y medicamentos similares pueden tener un pequeño riesgo de desarrollar cánceres secundarios, incluyendo leucemia.
Se han comunicado casos poco frecuentes de infecciones nuevas o recurrentes (reactivaciones) por citomegalovirus y de infecciones reactivadas por virus de la hepatitis B.
Se han comunicado casos poco frecuentes de diabetes insípida. Los síntomas de la diabetes insípida incluyen orinar con mucha frecuencia y tener sed.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Anexo V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Temodal
Mantener este medicamento fuera de la vista y del alcance de los niños, preferiblemente en un armario cerrado con llave. La ingestión accidental puede ser mortal en niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la etiqueta y el embalaje exterior. La fecha de caducidad es el último día del mes que se indica.
Presentación en frascos
No conservar a temperatura superior a 30°C.
Conservar en el frasco original para protegerlo de la humedad.
Mantener el frasco perfectamente cerrado.
Presentación en sobres
No conservar a temperatura superior a 30°C.
Consulte con su farmacéutico si observa algún cambio en el aspecto de las cápsulas.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de Temodal
El principio activo es temozolomida.
Temodal 5 mg cápsulas duras: Cada cápsula contiene 5 mg de temozolomida.
Temodal 20 mg cápsulas duras: Cada cápsula contiene 20 mg de temozolomida.
Temodal 100 mg cápsulas duras: Cada cápsula contiene 100 mg de temozolomida.
Temodal 140 mg cápsulas duras: Cada cápsula contiene 140 mg de temozolomida.
Temodal 180 mg cápsulas duras: Cada cápsula contiene 180 mg de temozolomida.
Temodal 250 mg cápsulas duras: Cada cápsula contiene 250 mg de temozolomida.
Los demás componentes son:
Contenido de la cápsula:
lactosa anhidra, sílice anhidra coloidal, glicolato sódico de almidón tipo A, ácido tartárico, ácido esteárico (ver sección 2 "Temodal contiene lactosa").
Cuerpo de la cápsula:
Temodal 5 mg cápsulas duras: gelatina, dióxido de titanio (E 171), lauril sulfato sódico, óxido amarillo de hierro (E 172), carmín de índigo (E 132),
Temodal 20 mg cápsulas duras: gelatina, dióxido de titanio (E 171), lauril sulfato sódico, óxido amarillo de hierro (E 172),
(E 171), lauril sulfato sódico, óxido rojo (E 171), lauril sulfato sódico, carmín de (E 171), lauril sulfato sódico, óxido (E 171), lauril sulfato sódico.
Temodal 100 mg cápsulas duras: gelatina, dióxido de titanio de hierro (E 172),
Temodal 140 mg cápsulas duras: gelatina, dióxido de titanio índigo (E 132),
Temodal 180 mg cápsulas duras: gelatina, dióxido de titanio amarillo de hierro (E 172) y óxido rojo de hierro (E 172),
Temodal 250 mg cápsulas duras: gelatina, dióxido de titanio Tinta de impresión:
goma laca, propilenglicol, agua purificada, hidróxido amónico, hidróxido de potasio y óxido negro de hierro (E 172).
Aspecto del producto y contenido del envase
Temodal 5 mg cápsulas duras tienen un cuerpo blanco opaco, una tapa verde opaca y están impresas con tinta negra.
Temodal 20 mg cápsulas duras tienen un cuerpo blanco opaco, una tapa amarilla opaca y están impresas con tinta negra.
Temodal 100 mg cápsulas duras tienen un cuerpo blanco opaco, una tapa rosa opaca y están impresas con tinta negra.
Temodal 140 mg cápsulas duras tienen un cuerpo blanco opaco, una tapa azul y están impresas con tinta negra.
Temodal 180 mg cápsulas duras tienen un cuerpo blanco opaco, una tapa naranja opaca y están impresas con tinta negra.
Temodal 250 mg cápsulas duras tienen un cuerpo y una tapa blancos opacos y están impresas con tinta negra.
Presentación en frascos
Las cápsulas duras para administración oral se presentan en frascos de vidrio ámbar que contienen 5 ó 20 cápsulas.
El envase de cartón contiene un frasco.
Presentación en sobres
Las cápsulas duras (cápsulas) para administración oral están selladas individualmente en sobres y se dispensan en cajas que contienen 5 o 20 cápsulas duras.
Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización y responsable de la fabricación
Titular de la autorización de comercialización: Merck Sharp & Dohme Limited, Hertford Road, Hoddesdon, Hertfordshire EN11 9BU, Reino Unido
Responsable de la fabricación: SP Labo N.V., Industriepark 30, B-2220 Heist-op-den-Berg, Bélgica
medicamento dirigiéndose al representante local del
Pueden solicitar más información respecto a este titular de la autorización de comercialización:
Belgie/Belgique/Belgien
MSD Belgium BVBA/SPRL
Tél/Tel: 0800 38 693 (+32 (0)2 776 62 11)
Etarapna
MepK fflapn h floyM Etarapna EOOfl Tea.: +359 2 819 3737 info-msdbg@merck.com
Ceská republika
Merck Sharp & Dohme s.r.o.
Tel: +420 233 010 111 dpoc_czechslovak@merck.com
Danmark
MSD Danmark ApS Tlf: +45 4482 4000 dkmail@merck.com
Deutschland
MSD SHARP & DOHME GMBH
Tel.: 0800 673 673 673 (+49 (0)89 4561 2612)
Lietuva
UAB Merck Sharp & Dohme Tel.:+370 5 278 02 47 msd_lietuva@merck.com
Luxembourg/Luxemburg
MSD Belgium BVBA/SPRL
Tél/Tel: 0800 38 693 (+32 (0)2 776 62 11)
Magyarország
MSD Pharma Hungary Kft.
Tel.: +36 1 888 5300 hungary_msd@merck.com
Malta
Merck Sharp & Dohme Cyprus Limited Tel: 8007 4433 (+356 99917558) malta_info@merck.com
Nederland
Merck Sharp & Dohme BV
Tel: 0800 9999000 (+31 23 5153153)
|
Eesti Merck Sharp & Dohme OÜ Tel: +372 6144200 msdeesti@merck.com |
Norge MSD (Norge) AS Tlf: +47 32 20 73 00 msdnorge@msd.no |
|
EkXáSa MSD A.O.B.E.E. Tn^: +30 210 98 97 300 dpoc_greece@merck.com |
Osterreich Merck Sharp & Dohme Ges.m.b.H. Tel.: +43 (0) 1 26 044 msd-medizin@merck.com |
|
España Merck Sharp & Dohme de España, S.A. Tel: +34 91 321 06 00 msd info@merck.com |
Polska MSD Polska Sp. z o.o. Tel: +48 22 549 51 00 msdpolska@merck.com |
|
France MSD France Tél: +33 (0) 1 80 46 40 40 |
Portugal Merck Sharp & Dohme, Lda Tel: +351 21 446 57 00 clic@merck.com |
|
Hrvatska Merck Sharp & Dohme d.o.o. Tel: + 385 1 6611 333 croatia info@merck.com |
Romania Merck Sharp & Dohme Romania S.R.L. Tel.: + 4021 529 29 00 msdromania@merck.com |
|
Ireland Merck Sharp & Dohme Ireland (Human Health) Limited Tel: +353 (0)1 2998700 medinfo ireland@merck.com |
Slovenija Merck Sharp & Dohme, inovativna zdravila d.o.o Tel: +386 1 5204 201 msd.slovenia@merck.com |
|
Ísland Vistor hf. Sími: +354 535 7000 |
Slovenská republika Merck Sharp & Dohme, s. r. o. Tel: +421 2 58282010 dpoc_czechslovak@merck.com |
|
Italia MSD Italia S.r.l. Tel: +39 06 361911 medicalinformation.it@merck.com |
Suomi/Finland MSD Finland Oy Puh/Tel: +358 (0)9 804 650 info@msd.fi |
|
Kúrcpog Merck Sharp & Dohme Cyprus Limited TnV: 800 00 673 (+357 22866700) cyprus info@merck.com |
Sverige Merck Sharp & Dohme (Sweden) AB Tel: +46 77 5700488 medicinskinfo@merck.com |
|
Latvija SIA Merck Sharp & Dohme Latvija Tel: +371 67364224 msd lv@merck.com |
United Kingdom Merck Sharp & Dohme Limited Tel: +44 (0) 1992 467272 medicalinformationuk@merck.com |
|
Fecha de la última revisión de este prospecto: |
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos; http://www.ema.europa.eu.
Temodal 2,5 mg/ml polvo para solución para perfusión
Temozolomida
Lea todo el prospecto detenidamente antes de empezar a utilizar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico, farmacéutico o enfermero.
- Si experimenta efectos adversos, consulte a su médico, farmacéutico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4
Contenido del prospecto
1. Qué es Temodal y para qué se utiliza
2. Qué necesita saber antes de empezar a usar Temodal
3. Cómo usar Temodal
4. Posibles efectos adversos
5. Conservación de Temodal
6. Contenido del envase e información adicional
1. Qué es Temodal y para qué se utiliza
Temodal contiene un medicamento llamado temozolomida. Este medicamento es un agente
antitumoral.
Temodal está indicado en el tratamiento de formas específicas de tumores cerebrales:
- en adultos con glioblastoma multiforme de nuevo diagnóstico. Temodal se usa inicialmente en combinación con radioterapia (fase concomitante del tratamiento) y posteriormente en solitario (fase de monoterapia del tratamiento).
- en niños de 3 años y mayores y adultos con glioma maligno, tal como glioblastoma multiforme o astrocitoma anaplásico, Temodal está indicado en estos tumores si reaparecen o empeoran después de tratamiento estándar.
2. Qué necesita saber antes de empezar a usar Temodal
No use Temodal
- si es alérgico a temozolomida o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
- si ha presentado una reacción alérgica a la dacarbazina (un fármaco anticanceroso, a veces denominado DTIC). Entre los signos de reacción alérgica se incluyen picor, sensación de falta de aire o silbidos, hinchazón del rostro, labios, lengua o garganta.
- si se reducen de forma importante ciertos tipos de células sanguíneas (mielosupresión), así como el recuento de leucocitos y recuento de plaquetas. Estas células sanguíneas son importantes en la lucha contra las infecciones y para una correcta coagulación de la sangre. Su médico le pedirá análisis de sangre para comprobar que tiene un número suficiente de estas células antes de iniciar el tratamiento.
Advertencias y precauciones
Consulte a su médico, farmacéutico o enfermero antes de empezar a tomar Temodal.
- ya que debe ser vigilado estrechamente para comprobar el posible desarrollo de una forma grave de infección respiratoria llamada neumonía por Pneumocystis jirovecii (PCP). Si usted es un paciente recientemente diagnosticado (glioblastoma multiforme) puede estar recibiendo Temodal en el régimen de 42 días, en combinación con radioterapia. En este caso, su médico también le recetará un medicamento que le ayude a evitar este tipo de neumonía (PCP).
- si ha tenido alguna vez o puede que tenga ahora infección por hepatitis B, ya que Temodal podría activar otra vez la hepatitis B, que en algunos casos puede ser mortal. Antes de iniciar el tratamiento, el médico examinará minuciosamente a los pacientes en busca de signos de esta infección.
- si presenta recuentos bajos de glóbulos rojos (anemia), glóbulos blancos y plaquetas, o problemas de coagulación de la sangre antes del tratamiento, o los presenta durante el tratamiento. Es posible que su médico le reduzca la dosis del medicamento o que lo interrumpa, o puede también que precise usted otro tratamiento. En algunos casos, podrá ser necesario suspender el tratamiento con Temodal. Será sometido con frecuencia a análisis de sangre para vigilar los efectos secundarios de Temodal sobre sus células sanguíneas.
- ya que puede presentar un riesgo bajo de otras alteraciones en las células sanguíneas, incluyendo leucemia.
- si tiene náuseas (ganas de vomitar) y/o vómitos, que son efectos adversos muy frecuentes con Temodal (ver sección 4), su médico puede prescribirle un medicamento para la prevención del vómito (antiemético).
- si presenta fiebre o síntomas de una infección póngase en contacto con su médico inmediatamente.
- si es mayor de 70 años de edad, puede aumentar la susceptibilidad a la infección y ser más propenso a las infecciones, moratones y sangrado.
- si tiene problemas de hígado o riñón, se ajustará su dosis de Temodal.
Niños y adolescentes
No de este medicamento a niños menores de 3 años, ya que su efecto en esta edad no ha sido estudiado. Se dispone de información limitada en pacientes mayores de 3 años que han usado Temodal.
Uso de Temodal con otros medicamentos
Informe a su médico o farmacéutico si está tomando, ha tomado recientemente o podría tener que tomar cualquier otro medicamento.
Embarazo, lactancia y fertilidad
Si está embarazada, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento, ya que Temodal no debe utilizarse en mujeres embarazadas salvo que esté específicamente indicado por su médico.
Se recomiendan medidas anticonceptivas eficaces tanto en los pacientes varones como en las mujeres que se encuentren en tratamiento con Temodal (ver también “Fertilidad masculina” más abajo).
Debe suspender la lactancia materna mientras dure el tratamiento con Temodal.
Fertilidad masculina
Temodal puede causar infertilidad permanente. Los pacientes varones deben usar métodos anticonceptivos eficaces y no dejar embarazada a su pareja hasta 6 meses después de finalizar el tratamiento. Se recomienda consultar acerca de la conservación del esperma antes del tratamiento.
Conducción y uso de máquinas
Temodal puede hacerle sentir cansado o con sueño. En este caso, no conduzca ni maneje herramientas o máquinas, ni monte en bicicleta hasta ver cómo le afecta a usted este medicamento (ver sección 4).
Temodal contiene sodio
Este medicamento contiene 2,4 mmol de sodio por vial. Los pacientes con una dieta pobre en sodio deben tener esto en cuenta.
3. Cómo usar Temodal
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico o farmacéutico. En caso de duda, consulte de nuevo a su médico o farmacéutico.
Su médico determinará cuál es su dosis correcta de Temodal. Basándose en su complexión (altura y peso), si tiene un tumor recurrente y si ha sido sometido previamente a tratamiento con quimioterapia. Es posible que se le prescriba otro medicamento (antiemético) para tomar antes y/o tras Temodal para prevenir o controlar las náuseas y el vómito.
Pacientes con glioblastoma multiforme de nuevo diagnóstico:
Si es un paciente de nuevo diagnóstico, el tratamiento se realizará en dos fases:
- en primer lugar, tratamiento conjunto con radioterapia (fase concomitante)
- seguida de tratamiento solamente con Temodal (fase de monoterapia).
Durante la fase concomitante, su médico comenzará con Temodal a una dosis de 75 mg/m2 (dosis normal). Recibirá dosis cada día durante 42 días (hasta como máximo 49 días) en combinación con radioterapia. La dosis de Temodal puede retrasarse o interrumpirse, dependiendo de sus recuentos sanguíneos y de cómo tolere la medicación durante la fase concomitante.
Un vez que la radioterapia se complete, interrumpirá el tratamiento durante 4 semanas para darle a su organismo la oportunidad de recuperarse.
Después, empezará la fase de monoterapia.
Durante la fase de monoterapia, la dosis y la forma en que reciba Temodal diferirán en esta fase. Su médico le indicará la dosis exacta.
Pueden ser hasta 6 ciclos de tratamiento. Cada uno dura 28 días.
Inicialmente, recibirá su nueva dosis de Temodal solo una vez al día durante los primeros cinco días de cada ciclo. La primera dosis será de 150 mg/ml. Después serán 23 días sin Temodal. Esto suma en total un ciclo de tratamiento de 28 días.
Después del día 28, comenzará el siguiente ciclo. Recibirá de nuevo Temodal una vez al día durante cinco días seguido de 23 días sin Temodal.
La dosis de Temodal se puede ajustar, retrasar o suprimir dependiendo de su analítica sanguínea y de cómo tolere su medicamento durante cada ciclo de tratamiento.
Pacientes con tumores en recurrencia o _progresión (glioma maligno, tal como glioblastoma multiforme o astrocitoma anaplásico) que reciben solamente Temodal:
Un ciclo de tratamiento con Temodal es de 28 días.
Recibirá Temodal solo una vez al día durante los primeros cinco días. Esta dosis diaria dependerá de si usted ha sido tratado previamente con quimioterapia o no.
Si no ha sido tratado previamente con quimioterapia, su primera dosis de Temodal 200 mg/m2 será de una vez al día durante los primeros cinco días. Si ha sido previamente tratado con quimioterapia, su primera dosis de Temodal 150 mg/m2 será de una vez al día durante los primeros cinco días.
Después serán 23 días sin Temodal. Esto suma en total un ciclo de tratamiento de 28 días.
Tras el día 28, iniciará un nuevo ciclo. Recibirá de nuevo Temodal una vez al día durante cinco días, seguido de 23 días sin Temodal.
Cada vez que comience un nuevo ciclo de tratamiento, se analizará su sangre para verificar si se debe ajustar su dosis de Temodal. Dependiendo de los resultados, su médico puede ajustarle su dosis para el próximo ciclo.
Cómo se administra Temodal
Su médico le administrará Temodal en un catéter insertado en una vena (perfusión intravenosa), sólo durante aproximadamente 90 minutos. No se puede administrar en un lugar de perfusión que no sea una vena.
Si recibe más Temodal del que debe
Un profesional sanitario le administrará Temodal. Es por tanto improbable que reciba más Temodal del que debiera. Sin embargo, si lo hace, el médico o enfermera le tratarán de forma adecuada.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico, farmacéutico o enfermero.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Contacte inmediatamente con su médico si tiene cualquiera de lo siguiente:
- una reacción alérgica (hipersensible) grave (urticaria, respiración sibilante u otra dificultad respiratoria),
- hemorragia incontrolada,
- convulsiones,
- fiebre,
- dolor de cabeza intenso que no desaparece.
El tratamiento con Temodal puede provocar una reducción de ciertos tipos de células sanguíneas. Esto puede hacer que aumente la probabilidad de que presente hematomas o hemorragia, anemia (reducción del número de glóbulos rojos), fiebre y disminución de la resistencia a las infecciones. La reducción del recuento de células sanguíneas es generalmente pasajera. En algunos casos, se puede prolongar y puede producir una forma muy severa de anemia (anemia aplásica). Su médico le someterá con frecuencia a exámenes de sangre para detectar los eventuales cambios producidos, y decidirá si necesita un tratamiento específico. En algunos casos, se reducirá la dosis de Temodal o se suspenderá.
Efectos adversos vistos en los estudios clínicos:
Temodal polvo para solución para perfusión
Además de los efectos adversos relacionados anteriormente, se pueden producir también los siguientes con el uso de Temodal polvo para solución para perfusión: dolor, irritación, picor, sofocos, sensación de calor, hinchazón o enrojecimiento del punto de inyección; también la aparición de moratones (hematomas).
Temodal en combinación con radioterapia en _pacientes con glioblastoma de nuevo diagnóstico Los pacientes que reciben Temodal en combinación con radioterapia pueden experimentar reacciones adversas diferentes de las que experimentan los pacientes que reciben Temodal solo. Se pueden producir los siguientes efectos adversos, y pueden requerir atención médica.
Muy frecuentes (puede afectar a más de 1 de cada 10 personas): pérdida de apetito, dolor de cabeza, estreñimiento (dificultad de evacuación de heces), náuseas (ganas de vomitar), vómitos, erupción cutánea, pérdida de pelo, cansancio.
Frecuentes (pueden afectar hasta 1 de cada 10 personas):: infecciones orales, infección de heridas, número de células sanguíneas reducido (neutropenia, trombocitopenia, linfopenia, leucopenia), aumento de azúcar en sangre, pérdida de peso, cambios en el estado mental o en el estado de alerta, ansiedad/depresión, somnolencia, dificultad para hablar, alteración del equilibrio, mareos, confusión, alteraciones de la memoria, dificultad para concentrarse, incapacidad para dormir o permanecer dormido, sensación de hormigueo, moratones, agitación, visión anormal o borrosa, visión doble, pérdida de audición, dificultad para respirar, tos, trombosis en las piernas, retención de líquidos, piernas hinchadas, diarrea, dolor abdominal o de estómago, ardor de estómago, molestias gástricas, dificultad para tragar, sequedad de boca, irritación o enrojecimiento de la piel, sequedad cutánea, picor, debilidad muscular, dolor en las articulaciones, dolores musculares, micción frecuente, dificultad para controlar la orina, reacción alérgica, fiebre, lesión por radiación, hinchazón de la cara, dolor, alteración del gusto, alteración en las pruebas de la función hepática.
Poco frecuentes (pueden afectar hasta 1 de cada 100 personas: síntomas pseudogripales, manchas rojas debajo de la piel, nivel bajo de potasio en sangre, aumento de peso, cambios de humor, alucinaciones y pérdida de memoria, parálisis parcial, fallo en la coordinación, disminución en la sensibilidad, pérdida parcial de visión, ojos secos o doloridos, sordera, infección del oído medio, pitidos, dolor de oídos, palpitaciones (cuando se puede sentir como late el corazón), trombosis pulmonar, presión sanguínea elevada, neumonía, inflamación de las fosas nasales, bronquitis, resfriado o gripe, distensión estomacal, dificultad para controlar los movimientos del intestino, hemorroides, exfoliación de la piel, aumento de la sensibilidad cutánea a la luz solar, cambio en el color de la piel, aumento de la sudoración, daño muscular, dolor de espalda, dificultad en la micción, sangrado vaginal, impotencia sexual, periodos menstruales abundantes o ausentes, irritación vaginal, dolor de mamas, sofocos, escalofríos, cambio de color de la lengua, cambio en el sentido del olfato, sed, alteraciones dentales.
Monoterapia con Temodal en glioma cerebral recurrente o progresivo
Las siguientes reacciones adversas pueden presentarse y puede requerirse atención médica.
Muy frecuentes (pueden afectar a más de 1 de cada 10 personas): reducción del número de células sanguíneas (neutropenia o linfopenia, trombocitopenia), pérdida de apetito, dolor de cabeza, vómitos, náuseas (ganas de vomitar), estreñimiento (dificultad de evacuación de heces), cansancio.
Frecuentes (pueden afectar hasta 1 de cada 10 personas): pérdida de peso, tendencia al sueño, mareos, sensación de hormigueo, dificultad para respirar, diarrea, dolor abdominal, molestias gástricas, erupción cutánea, picor, pérdida de pelo, fiebre, debilidad, escalofríos, sensación de malestar, dolor, alteración del gusto.
Poco frecuentes (pueden afectar hasta 1 de cada 100 personas): reducción del número de células sanguíneas (pancitopenia, anemia, leucopenia).
Raras (pueden afectar hasta 1 de cada 1.000 personas): tos, infecciones como neumonía.
Muy raras (pueden afectar hasta 1 de cada 10.000 personas): enrojecimiento de la piel, urticaria, erupción cutánea, reacciones alérgicas.
Otros efectos adversos:
Se han comunicado frecuentemente casos de enzimas hepáticas elevadas. Se han comunicado poco frecuentemente casos de aumento de la bilirrubina, problemas con el flujo de la bilis (colestasis), hepatitis, lesiones en el hígado, incluyendo insuficiencia hepática mortal.
Se han observado casos muy raros de erupción grave con hinchazón cutánea, incluyendo las palmas de las manos y las plantas de los pies, o enrojecimiento de la piel con dolor y/o ampollas en el cuerpo o en la boca. Si esto ocurre, hágalo saber a su médico inmediatamente.
Se han observado casos muy raros de efectos adversos en el pulmón con Temodal. Los pacientes normalmente presentan dificultad para respirar y tos. Informe a su médico si nota alguno de estos síntomas.
Muy raramente, los pacientes que reciben Temodal y medicamentos similares pueden tener un pequeño riesgo de desarrollar cánceres secundarios, incluyendo leucemia.
Se han comunicado casos poco frecuentes de infecciones nuevas o recurrentes (reactivaciones) por citomegalovirus y de infecciones reactivadas por virus de la hepatitis B.
Se han comunicado casos poco frecuentes de diabetes insípida. Los síntomas de la diabetes insípida incluyen orinar con mucha frecuencia y tener sed.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Anexo V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Temodal
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la etiqueta y el embalaje exterior. La fecha de caducidad es el último día del mes que se indica.
Conservar en nevera (2°C - 8°C).
Una vez se ha preparado su medicamento para perfusión (se ha reconstituido) la solución debe almacenarse a temperatura ambiente (25°C) hasta un máximo de 14 horas, incluyendo el tiempo de perfusión.
La solución reconstituida no debería usarse si se observa decoloración o presencia de partículas.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de Temodal
El principio activo es temozolomida. Cada vial contiene 100 mg de temozolomida. Tras la reconstitución, cada ml de solución para perfusión contiene 2,5 mg de temozolomida.
Los demás componentes son manitol (E421), treonina, polisorbato 80, citrato sódico (para ajustar el pH) y ácido clorhídrico concentrado (para ajustar el pH) (ver sección 2).
Aspecto del producto y contenido del envase
El polvo para solución para perfusión es un polvo blanco. Temodal está disponible en un vial de vidrio, con un tapón de caucho de butilo y una cápsula de aluminio con precinto fácil de quitar.
Cada envase contiene 1 vial de 100 mg de temozolomida.
Titular de la autorización de comercialización y responsable de la fabricación
Titular de la autorización de comercialización: Merck Sharp & Dohme Limited, Hertford Road, Hoddesdon, Hertfordshire EN11 9BU, Reino Unido
Responsable de la fabricación: SP Labo N.V., Industriepark 30, B-2220 Heist-op-den-Berg, Bélgica
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
|
Belgie/Belgique/Belgien MSD Belgium BVBA/SPRL Tél/Tel: 0800 38 693 (+32 (0)2 776 62 11) |
Lietuva UAB Merck Sharp & Dohme Tel.: +370 5 278 02 47 msd_lietuva@merck.com |
|
Etnrapun MepK fflapn h floyM Etnrapna EOOfl Ten.: +359 2 819 3737 info-msdbg@merck.com |
Luxembourg/Luxemburg MSD Belgium BVBA/SPRL Tél/Tel: 0800 38 693 (+32 (0)2 776 62 11) |
|
Ceská republika Merck Sharp & Dohme s.r.o. Tel: +420 233 010 111 dpoc_czechslovak@merck.com |
Magyarország MSD Pharma Hungary Kft. Tel.: +36 1 888 5300 hungary_msd@merck.com |
|
Danmark MSD Danmark ApS Tlf: +45 4482 4000 dkmail@merck.com |
Malta Merck Sharp & Dohme Cyprus Limited Tel: 8007 4433 (+356 99917558) malta info@merck.com |
|
Deutschland MSD SHARP & DOHME GMBH Tel.: 0800 673 673 673 (+49 (0)89 4561 2612) |
Nederland Merck Sharp & Dohme BV Tel: 0800 9999000 (+31 23 5153153) |
|
Eesti Merck Sharp & Dohme OÜ Tel: +372 6144200 msdeesti@merck.com |
Norge MSD (Norge) AS Tlf: +47 32 20 73 00 msdnorge@msd.no |
|
ELXáSa MSD A.O.B.E.E. Tpk: +30 210 98 97 300 dpoc_greece@merck.com |
Osterreich Merck Sharp & Dohme Ges.m.b.H. Tel.: +43 (0) 1 26 044 msd-medizin@merck.com |
|
España Merck Sharp & Dohme de España, S.A. Tel: +34 91 321 06 00 msd_info@merck.com |
Polska MSD Polska Sp. z o.o. Tel: +48 22 549 51 00 msdpolska@merck.com |
|
France MSD France Tél: +33 (0) 1 80 46 40 40 |
Portugal Merck Sharp & Dohme, Lda Tel: +351 21 446 57 00 clic@merck.com |
|
Hrvatska Merck Sharp & Dohme d.o.o. Tel: + 385 1 6611 333 croatia info@merck.com |
Romania Merck Sharp & Dohme Romania S.R.L. Tel.: + 4021 529 29 00 msdromania@merck.com |
|
Ireland Merck Sharp & Dohme Ireland (Human Health) Limited Tel: +353 (0) 1 2998700 medinfo ireland@merck.com |
Slovenija Merck Sharp & Dohme, inovativna zdravila d.o.o Tel: +386 1 5204 201 msd.slovenia@merck.com |
Ísland
Vistor hf.
Sími: +354 535 7000
Italia
MSD Italia S.r.l.
Tel: +39 06 361911 medicalinformation.it@merck.com
Kúrcpog
Merck Sharp & Dohme Cyprus Limited TnV: 800 00 673 (+357 22866700) cyprus_info@merck.com
Latvija
SIA Merck Sharp & Dohme Latvija Tel: +371 67364224 msd_lv@merck.com
Slovenská republika
Merck Sharp & Dohme, s. r. o.
Tel: +421 2 58282010 dpoc_czechslovak@merck.com
Suomi/Finland
MSD Finland Oy Puh/Tel: +358 (0)9 804 650 info@msd.fi
Sverige
Merck Sharp & Dohme (Sweden) AB Tel: +46 77 5700488 medicinskinfo@merck.com
United Kingdom
Merck Sharp & Dohme Limited Tel: +44 (0) 1992 467272 medicalinformationuk@merck.com
Fecha de la última revisión de este prospecto:
Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
Se pretende que la siguiente información sea únicamente para uso de médico o de los profesionales de la salud:
Debe tenerse cuidado en la manipulación de Temodal 2,5 mg/ml polvo para solución para perfusión. Se requiere el uso de guantes y técnica aséptica. Si Temodal 2,5 mg/ml entra en contacto con la piel o mucosa, debe lavarse ésta inmediata y completamente con agua y jabón.
Debe reconstituirse cada vial con 41 ml de agua esterilizada para inyecciones. La solución resultante contiene 2,5 mg/ml de TMZ. Estos viales deben rotarse suavemente y no agitarse. Debe examinarse la solución, y cualquier vial que contenga material particulado visible no debe usarse. El producto reconstituido debe utilizarse antes de 14 horas, incluyendo el tiempo de perfusión.
Debe extraerse un volumen de hasta 40 ml de solución reconstituida, según la dosis total prescrita y transferirse a una bolsa de perfusión (de PVC o poliolefina) de 250 ml vacía. Debe unirse el conducto de la bomba a la bolsa, purgarse el conducto y a continuación taparse. Temodal 2,5 mg/ml debe administrarse mediante perfusión intravenosa sólo durante un período de 90 minutos.
Temodal 2,5 mg/ml polvo para solución para perfusión puede administrarse a través de la misma vía intravenosa con cloruro de sodio 0,9 %. Es incompatible con soluciones de dextrosa.
En ausencia de datos adicionales, este medicamento no debe mezclarse con otros medicamentos o infundirse simultáneamente a través de la misma vía intravenosa.
Este medicamento es sólo para uso único. La eliminación del medicamento no utilizado y de todos los materiales que hayan entrado en contacto con él se realizará de acuerdo con la normativa local.
ANEXO IV
CONCLUSIONES CIENTÍFICAS Y MOTIVOS POR LOS QUE SE RECOMIENDA LA MODIFICACIÓN DE LAS CONDICIONES DE LAS AUTORIZACIONES DE COMERCIALIZACIÓN
Conclusiones científicas
Teniendo en cuenta lo dispuesto en el Informe de Evaluación del Comité para la Evaluación de Riesgos en Farmacovigilancia (PRAC) sobre los informes periódicos de seguridad (IPSs) para temozolomida, las conclusiones científicas del Comité de Medicamentos de Uso Humano (CHMP) son las siguientes:
La revisión de los datos acumulados de infección por citomegalovirus, hepatitis B, herpes simplex, herpes zoster y tuberculosis, ha revelado casos de reactivación de infección por citomegalovirus y hepatitis B. La evaluación de posteriores notificaciones de seguridad de infección por citomegalovirus reveló que además de las reactivaciones de las infecciones por citomegalovirus, no se puede descartar la infección primaria. Además, se obtuvieron de la base de datos tres casos adicionales de muerte por reactivación de la hepatitis B. Por lo tanto, se debe incluir información actualizada sobre la reactivación de la hepatitis B, incluyendo el desenlace mortal, en la información de producto de temozolamida.
Además, tras una revisión de señales de diabetes insípida, cuatro de cada cinco notificaciones bibliográficas llevaban a una posible asociación con el tratamiento con temozolamida, por lo tanto, la información de producto se debe actualizar consecuentemente.
Por lo tanto, en vista de los datos disponibles en relación a temozolamida, el PRAC considera que los cambios en la información de producto están justificados.
El CHMP está de acuerdo con las conclusiones científicas del PRAC.
Motivos por los que se recomienda la modificación de las condiciones de la Autorización de Comercialización
De acuerdo con las conclusiones científicas para temozolomida, el CHMP considera que el balance beneficio-riesgo del medicamento o medicamentos que contiene(n) temozolomida es favorable sujeto a los cambios propuestos en la información del producto.
El CHMP recomienda que se modifiquen las condiciones de la(s) Autorización(es) de Comercialización.
186