Synflorix Suspension Inyectable En Jeringa Precargada
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
1. NOMBRE DEL MEDICAMENTO
Synflorix suspensión inyectable en jeringa precargada
Synflorix suspensión inyectable
Synflorix suspensión inyectable en envase multidosis
Vacuna conjugada antineumocócica de polisacáridos (adsorbida)
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
1 dosis (0,5 ml) contiene:
|
Polisacárido del serotipo neumocócico 11,2 |
1 microgramo |
|
Polisacárido del serotipo neumocócico 41,2 |
3 microgramos |
|
Polisacárido del serotipo neumocócico 51,2 |
1 microgramo |
|
Polisacárido del serotipo neumocócico 6B1,2 |
1 microgramo |
|
Polisacárido del serotipo neumocócico 7F1,2 |
1 microgramo |
|
Polisacárido del serotipo neumocócico 9V1,2 |
1 microgramo |
|
Polisacárido del serotipo neumocócico 141,2 |
1 microgramo |
|
Polisacárido del serotipo neumocócico 18C1,3 |
3 microgramos |
|
Polisacárido del serotipo neumocócico 19F1,4 |
3 microgramos |
|
Polisacárido del serotipo neumocócico 23F1,2 |
1 microgramo |
|
1 adsorbido en fosfato de aluminio |
0,5 miligramos de Al3+ |
|
2 conjugado con proteína D (derivada de Haemophilus influenzae |
no tipable) como proteína |
|
transportadora |
9-16 microgramos |
|
3 conjugado con toxoide tetánico como proteína transportadora |
5-10 microgramos |
|
4 conjugado con toxoide diftérico como proteína transportadora Para consultar la lista completa de excipientes, ver sección 6.1. |
3-6 microgramos |
3. FORMA FARMACÉUTICA
Suspensión inyectable (inyectable).
La vacuna es una suspensión turbia de color blanco.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Inmunización activa frente a enfermedad invasora, neumonía y otitis media aguda causada por Streptococcus pneumoniae en lactantes y niños a partir de las 6 semanas hasta los 5 años de edad. Ver secciones 4.4 y 5.1 para información acerca de la protección frente a serotipos neumocócicos específícos.
El empleo de Synflorix se debe determinar de acuerdo con las recomendaciones oficiales, teniendo en cuenta el impacto sobre las enfermedades neumocócicas en los diferentes grupos de edad así como la variabilidad epidemiológica en las diferentes áreas geográficas.
4.2 Posología y forma de administración
Posología
Las pautas de inmunización con Synflorix deben basarse en las recomendaciones oficiales.
Lactantes de 6 semanas a 6 meses de edad Pauta de primovacunación de tres dosis
La pauta de inmunización recomendada para asegurar una protección óptima consiste en cuatro dosis, cada una de 0,5 ml. La pauta de primovacunación en lactantes consiste en tres dosis, siendo la primera dosis administrada habitualmente a los 2 meses de edad con un intervalo de al menos 1 mes entre las dosis. La primera dosis se puede administrar a partir de las seis semanas de edad. Se recomienda una dosis de recuerdo (cuarta) al menos seis meses después de la última dosis de primovacunación y preferiblemente entre los 12 y los 15 meses de edad (ver secciones 4.4 y 5.1).
Pauta de primovacunación de dos dosis
En cambio, cuando Synflorix se administra como parte de un programa rutinario de inmunización infantil, se puede seguir una pauta de inmunización de tres dosis, cada una de 0,5 ml. La primera dosis se puede administrar a partir de los dos meses de edad y la segunda dosis dos meses más tarde. Se recomienda una dosis de recuerdo (tercera) al menos seis meses después de la última dosis de primovacunación (ver sección 5.1).
Recién nacidos prematuros (nacidos entre las semanas 27-36 de gestación)
En lactantes prematuros nacidos después de al menos 27 semanas de gestación, la pauta de inmunización recomendada consiste en cuatro dosis, cada una de 0,5 ml. La pauta de primovacunación en lactantes consiste en tres dosis. La primera dosis se administra a los dos meses de edad con un intervalo de al menos un mes entre las dosis. Se recomienda una dosis de recuerdo (cuarta) al menos seis meses después de la última dosis de primovacunación (ver secciones 4.4 y 5.1).
Lactantes y niños > 7 meses de edad no vacunados
- Lactantes de 7-11 meses de edad: la pauta de vacunación consiste en dos dosis primarias de 0,5 ml con un intervalo de al menos 1 mes entre las dosis. Se recomienda una dosis de recuerdo (tercera) en el segundo año de vida con un intervalo de al menos 2 meses después de la última dosis primaria.
- Niños de 12 meses -5 años de edad: la pauta de vacunación consiste en dos dosis de 0,5 ml con un intervalo de al menos 2 meses entre las dosis.
Se recomienda que los sujetos que hayan recibido una primera dosis de Synflorix completen el ciclo completo de vacunación con Synflorix.
Población pediátrica
No se han establecido la seguridad y eficacia de Synflorix en niños a partir de 5 años.
Forma de administración
La vacuna se debe administrar por vía intramuscular. Las zonas preferidas para la administración son la cara anterolateral del muslo en lactantes o el músculo deltoides en la parte superior del brazo en niños pequeños.
4.3 Contraindicaciones
Hipersensibilidad a los principios activos o a alguno de los excipientes incluidos en la sección 6.1 o a alguna de las proteínas transportadoras.
Como con otras vacunas, se debe posponer la administración de Synflorix en sujetos que padezcan enfermedades febriles agudas. Sin embargo, la presencia de una infección leve, como un resfriado, no debe provocar el retraso de la vacunación.
4.4 Advertencias y precauciones especiales de empleo
Como con todas las vacunas inyectables, se debe disponer en todo momento del tratamiento y supervisión médica adecuados, para el caso poco frecuente de aparición de una reacción anafiláctica tras la administración de la vacuna.
Cuando se administre la serie de inmunización primaria en niños prematuros de < 28 semanas de gestación y especialmente en aquellos con un historial previo de inmadurez respiratoria, se debe considerar tanto el riesgo potencial de apnea como la necesidad de monitorización respiratoria durante 48-72 horas. Como el beneficio de la vacunación es alto en este grupo de niños, la vacunación no se debe impedir ni retrasar.
Synflorix no debe, bajo ninguna circunstancia, administrarse por vía intravascular o intradérmica. No se dispone de datos sobre la administración de Synflorix por vía subcutánea.
En niños a partir de 2 años de edad, después de cualquier vacunación, o incluso antes, se puede producir un síncope (desfallecimiento) como una reacción psicógena a la inyección de la aguja. Es importante que se disponga de procedimientos para evitar daños causados por las pérdidas de conocimiento.
Al igual que con otras vacunas administradas por vía intramuscular, Synflorix se debe administrar con precaución en personas con trombocitopenia o con trastornos hemorrágicos, ya que en estos pacientes puede producirse hemorragia tras la administración intramuscular.
También se deben seguir las recomendaciones oficiales para la inmunización frente a difteria, tétanos
y Haemophilus influenzae tipo b.
No hay evidencia suficiente de que Synflorix proporcione protección frente a serotipos neumocócicos no contenidos en la vacuna excepto frente al serotipo 19A de reacción cruzada (ver sección 5.1) o frente a Haemophilus influenzae no tipable. Synflorix no proporciona protección frente a otros microorganismos.
Como con cualquier vacuna, es posible que Synflorix no proteja a todos los individuos vacunados frente a la enfermedad neumocócica invasora, la neumonía o la otitis media causada por los serotipos neumocócicos de la vacuna y el serotipo 19A de reacción cruzada. Además, como la otitis media y la neumonía están causadas por muchos microorganismos diferentes a los serotipos de Streptococcus pneumoniae presentes en la vacuna, se espera que la respuesta global frente a estas enfermedades sea limitada y sustancialmente más baja que la protección frente a la enfermedad invasora causada por los serotipos vacunales y el serotipo 19A (ver sección 5.1).
En los ensayos clínicos Synflorix indujo una respuesta inmune frente a los diez serotipos incluidos en la vacuna, pero la magnitud de las respuestas fue variable entre los serotipos. La respuesta inmune funcional frente a los serotipos 1 y 5 fue más baja en magnitud que la respuesta frente a los otros serotipos vacunales. Se desconoce si esta respuesta inmune funcional más baja frente a los serotipos 1 y 5 tendrá como resultado una eficacia protectora menor frente a la enfermedad invasora, la neumonía o la otitis media causada por estos serotipos (ver sección 5.1).
Synflorix está indicada para su administración en niños a partir de las 6 semanas hasta los 5 años de edad. Los niños deberían recibir la pauta posológica de Synflorix adecuada para su edad cuando comiencen la pauta de vacunación (ver sección 4.2). Aún no están disponibles los datos de seguridad e inmunogenicidad en niños mayores de 5 años.
Los niños con una respuesta inmune deficitaria, ya sea debida al uso de una terapia inmunosupresora, a un defecto genético, a infección por VIH o a otras causas, pueden desarrollar una menor respuesta de anticuerpos a la vacunación.
No se dispone todavía de datos de seguridad ni de inmunogenicidad de Synflorix en niños con mayor riesgo de padecer infecciones neumocócicas (por ejemplo anemia de células falciformes, disfunción esplénica adquirida y congénita, infección por VIH, cáncer, síndrome nefrótico). La vacunación en grupos de alto riesgo se debe considerar caso por caso (ver sección 4.2).
Los niños menores de 2 años de edad deben recibir las pautas de vacunación de Synflorix adecuadas para la edad (ver sección 4.2). El uso de la vacuna conjugada antineumocócica no reemplaza el uso de las vacunas antineumocócicas polisacáridas 23-valentes en niños > 2 años de edad con enfermedades (tales como anemia de células falciformes, asplenia, infección por VIH, enfermedad crónica o aquellos que estén inmunocomprometidos) que los exponen a un mayor riesgo de enfermedad invasora por Streptococcus pneumoniae. Siempre que esté recomendado, los niños en riesgo de > 24 meses de edad y que ya hayan sido primovacunados con Synflorix deben recibir la vacuna antineumocócica polisacárida 23-valente.
El intervalo entre la vacuna conjugada antineumocócica (Synflorix) y la vacuna polisacárida antineumocócica 23-valente no debe ser menor de 8 semanas. No hay datos disponibles que indiquen si la administración de la vacuna polisacárida antineumocócica a niños primovacunados con Synflorix puede dar lugar a hiporreactividad a dosis posteriores de polisacaricárido neumocócico o a la vacuna antineumocócica conjugada.
La administración profiláctica de antipiréticos antes o inmediatamente después de la administración de la vacuna puede reducir la incidencia y la intensidad de las reacciones febriles postvacunación. Los datos clínicos generados con paracetamol e ibuprofeno sugieren que el uso profiláctico de paracetamol podría reducir la tasa de fiebre, mientras que el uso profiláctico de ibuprofeno mostró un efecto limitado en la reducción de la tasa de fiebre. Los datos clínicos sugieren que el paracetamol podría reducir la respuesta inmune frente a Synflorix. Sin embargo, se desconoce la relevancia clínica de esta observación.
Se recomienda la administración profiláctica de antipiréticos :
- a todos los niños a los que se administre Synflorix simultáneamente con vacunas de tos ferina de células enteras debido a una tasa superior de reacciones febriles (ver sección 4.8).
- a niños con convulsiones o con una historia previa de convulsiones febriles.
Debe iniciarse tratamiento antipirético de acuerdo con las guías terapéuticas locales.
4.5 Interacción con otros medicamentos y otras formas de interacción
Uso con otras vacunas
Synflorix puede administrarse de forma simultánea con cualquiera de las siguientes vacunas monovalentes o combinadas [incluyendo DTPa-VHB-IPV/Hib y DTPe-VHB/Hib]: vacuna antidiftérica, antitetánica y antipertussis acelular (DTPa), vacuna antihepatitis B (VHB), vacuna antipoliomielítica inactivada (IPV), vacuna antiHaemophilus influenzae tipo b (Hib), vacuna antidiftérica, antitetánica y antipertussis de célula entera (DTPe), vacuna de virus de sarampión, parotiditis y rubéola (MMR), vacuna antivaricela (V), vacuna conjugada frente a meningococo del serogrupo C (conjugados con CRM197 y TT), vacuna conjugada frente a meningococo de los serogrupos A, C, W-135 e Y (conjugado con TT), vacuna antipoliomielítica oral (OPV) y vacuna antirrotavirus oral. Las diferentes vacunas inyectables, deben administrarse siempre en diferentes lugares de inyección.
Los ensayos clínicos han demostrado que la respuesta inmune y los perfiles de seguridad de las vacunas coadministradas no se vieron afectados, con la excepción de la respuesta al virus de la polio inactivado tipo 2, para el que se observaron resultados inconsistentes en los diferentes estudios (rangos de seroprotección del 78% al 100%). Además, cuando la vacuna conjugada frente a meningococo de los serogrupos A, C, W-135 e Y (conjugado con TT) se coadministró con una dosis de recuerdo de Synflorix durante el segundo año de vida a niños primovacunados con 3 dosis de Synflorix, se observaron una media geométrica de la concentración de anticuerpos (GMC) y una media geométrica del título de anticuerpos con el ensayo de opsonofagocitosis (GMT de OPA) más bajos para un serotipo neumocócico (18 C). La coadministración no tuvo impacto en los otros nueve serotipos neumocócicos. Se observó un aumento en la respuesta de anticuerpos al conjugado Hib-TT, y a los antígenos diftérico y tetánico. Se desconoce la relevancia clínica de las observaciones anteriores.
Uso de medicamentos inmunosupresores sistémicos
Como con otras vacunas, cabe esperar que en pacientes que reciben terapia inmunosupresora pueda no alcanzarse una respuesta adecuada.
Uso profiláctico de antipiréticos
Ver sección 4.4.
4.6 Fertilidad, embarazo y lactancia
Synflorix no está destinada para su administración en adultos. No hay datos disponibles de su administración durante el embarazo o la lactancia en humanos, ni de estudios de reproducción en animales.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No procede.
4.8 Reacciones adversas Resumen del perfil de seguridad
La evaluación de la seguridad de Synflorix se basó en ensayos clínicos que incluyeron la administración de 63.905 dosis de Synflorix a 22.429 niños sanos y a 137 lactantes prematuros como vacunación primaria. Además, 19.466 niños y 116 lactantes prematuros recibieron una dosis de recuerdo de Synflorix en el segundo año de vida.
También se evaluó la seguridad en 435 niños de 2 a 5 años no vacunados anteriormente, de los cuales 285 sujetos recibieron 2 dosis de Synflorix.
En todos los ensayos clínicos, Synflorix se administró al mismo tiempo que las vacunas recomendadas en la infancia.
Las reacciones adversas más frecuentemente observadas en lactantes después de la vacunación primaria fueron enrojecimiento en el lugar de la inyección e irritabilidad, que ocurrieron aproximadamente después del 41% y 55% de todas las dosis, respectivamente. Después de la vacunación de recuerdo, las reacciones adversas más frecuentes fueron dolor en el lugar de la inyección e irritabilidad, que ocurrieron aproximadamente en el 51% y 53% respectivamente. La mayor parte de estas reacciones fueron de gravedad leve a moderada y no fueron duraderas.
No se observó un incremento en la incidencia o en la gravedad de estas reacciones adversas con las dosis sucesivas de la serie primaria de vacunación.
La reactogenicidad local de la pauta de vacunación primaria fue similar en lactantes menores de 12 meses y en niños mayores de 12 meses de edad, con la excepción del dolor en el lugar de la inyección, cuya incidencia se incrementó con la edad: el dolor se notificó en más de un 39% de los lactantes menores de 12 meses y en más de un 58% en los niños mayores de 12 meses de edad.
Después de la vacunación de recuerdo, los niños mayores de 12 meses son más propensos a experimentar reacciones en el lugar de la inyección en comparación con las tasas observadas en lactantes durante la primovacunación con Synflorix.
Después de la vacunación de rescate (catch-up) en niños de 12 a 23 meses de edad, la urticaria sé notificó con mayor frecuencia (poco frecuente) en comparación con las tasas observadas en lactantes durante la vacunación primaria y de recuerdo.
La reactogenicidad fue mayor en niños que recibieron vacunas antipertussis de célula entera de forma concomitante. En un estudio clínico los niños recibieron bien Synflorix (N=603) o bien Prevenar 7-valente (N=203) de forma simultánea con una vacuna que contuviera DTPe. Después del ciclo de vacunación primaria se notificó fiebre >38 °C y >39 °C en el 86,1% y el 14,7% de los niños que recibieron Synflorix y en el 82,9% y 11,6% de los niños vacunados con Prevenar 7-valente, respectivamente.
En ensayos clínicos comparativos la incidencia de las reacciones adversas locales y generales notificadas dentro de los 4 días siguientes a cada vacunación fueron de la misma magnitud que las observadas después de la vacunación con Prevenar 7-valente.
Tabla de reacciones adversas
Las reacciones adversas (para todos los grupos de edad) consideradas como al menos posiblemente relacionadas con la vacunación se han clasificado por frecuencias.
Las frecuencias se definen como sigue:
Muy frecuentes: Frecuentes:
Poco frecuentes: Raras:
Muy raras:
(>1/10)
(>1/100 a <1/10) (>1/1.000 a <1/100) (>1/10.000 a <1/1.000) (<1/10.000)
|
Sistema de clasificación de órganos |
Frecuencia |
Reacciones adversas |
|
Ensayos clínicos | ||
|
Trastornos del sistema inmunológico |
Raras |
Reacciones alérgicas (tales como dermatitis alérgica, dermatitis atópica, eczema) |
|
Muy raras |
Angioedema | |
|
Trastornos del metabolismo y de la nutrición |
Muy frecuentes |
Pérdida de apetito |
|
Trastornos psiquiátricos |
Muy frecuentes |
Irritabilidad |
|
Poco frecuentes |
Llanto anormal | |
|
Trastornos del sistema nervioso |
Muy frecuentes |
Somnolencia |
|
Raras |
Convulsiones (incluyendo convulsiones febriles) | |
|
Trastornos vasculares |
Muy raras |
Enfermedad de Kawasaki |
|
Trastornos respiratorios, torácicos y mediastínicos |
Poco frecuentes |
Apnea en niños prematuros de < 28 semanas de gestación (ver sección 4.4) |
|
Trastornos gastrointestinales |
Poco frecuentes |
Diarrea, vómitos |
|
Trastornos de la piel y del tejido subcutáneo |
Poco frecuentes |
Erupción cutánea |
|
Raras |
Urticaria | |
|
Trastornos generales y alteraciones en el lugar de administración |
Muy frecuentes |
Dolor, enrojecimiento, hinchazón en el lugar de la inyección, fiebre > 38°C rectal (en niños menores de 2 años) |
|
Frecuentes |
Reacciones en el lugar de la inyección, tal como induración, fiebre > 39°C rectal (en niños menores de 2 años) | |
|
Poco frecuentes |
Reacciones en el lugar de la inyección, tales como hematoma, hemorragia y nódulo | |
|
Reacciones adversas notificadas adicionalmente después de la vacunación de recuerdo de la pauta de primovacunación y/o la vacunación de rescate (catch-up): | ||
|
Trastornos del sistema nervioso |
Poco frecuentes |
Cefalea (entre 2 y 5 años de edad) |
|
Trastornos gastrointestinales |
Poco frecuentes |
Náuseas (entre 2 y 5 años de edad) |
|
Trastornos generales y alteraciones en el lugar de administración |
Frecuentes |
Fiebre >38°C rectal (entre 2 y 5 años de edad) |
|
Poco frecuentes |
Reacciones en el lugar de la inyección, tal como prurito, fiebre > 40°C rectal (en niños menores de 2 años), fiebre >39°C rectal (entre 2 y 5 años de edad), hinchazón difusa del miembro inyectado, extendiéndose a veces a la articulación adyacente | |
|
Experiencia poscomercialización | ||
|
Trastornos del sistema inmunológico |
Muy raras |
Anafilaxia |
|
Trastornos del sistema nervioso |
Raras |
Episodio de hipotonía-hiporrespuesta |
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Anexo V. 1 2 3
vacunación infantil [primovacunación con 2 dosis (3, 5 meses de edad) ó con 3 dosis (3, 4, 5 meses de edad) seguida de una dosis de recuerdo a los 11 meses de edad] que recibieron Synflorix (2/3 de los grupos) o las vacunas de hepatitis como control (1/3 de los grupos). En las cohortes de rescate (catch-up), los niños entre 7 y 11 meses de edad en el momento de recibir la primera dosis de la vacuna, recibieron Synflorix o la vacuna de la hepatitis B como control de acuerdo con una pauta de primovacunación de 2 dosis seguida de una dosis de recuerdo, y los niños entre 12 y 18 meses de edad en el momento de recibir la primera dosis de la vacuna, recibieron 2 dosis de Synflorix o de la vacuna de la hepatitis A como control. El seguimiento medio a partir de la primera vacunación fue de 24 a 28 meses para la enfermedad invasora y la neumonía diagnosticada en el ámbito hospitalario. En un estudio insertado, a los lactantes se les hizo un seguimiento hasta los 21 meses de edad, aproximadamente, para evaluar el impacto sobre el estado de portador nasofaríngeo y la OMA notificada por los padres y diagnosticada por el médico.
En un ensayo clínico a gran escala de fase III, aleatorizado, doble ciego (Estudio de Neumonía y Otitis Media Clínica - COMPAS) realizado en Argentina, Panamá y Colombia, los lactantes sanos entre 6 y 16 semanas de edad recibieron Synflorix o la vacuna frente a la hepatitis B como control a los 2, 4 y 6 meses de edad seguida, respectivamente, de Synflorix o la vacuna frente a la hepatitis A como control entre los 15 y los 18 meses de edad.
2.1. Enfermedad Neumocócica Invasora (que incluye sepsis, meningitis, neumonía bacteriémica y bacteriemia)
Efectividad/eficacia en la cohorte de lactantes de menos de 7 meses de edad al inicio del ensayo
Se demostró la efectividad o eficacia vacunal (EV) en la prevención de la ENI confirmada por cultivo causada por los serotipos vacunales de neumococo al administrar Synflorix a lactantes, ya sea con las pautas 2+1 ó 3+1 en el FinIP o con la pauta 3+1 en el COMPAS (ver Tabla 1).
Tabla 1: Número de casos de ENI causados por serotipos vacunales y efectividad (FinIP) o eficacia vacunal (COMPAS) en lactantes menores de 7 meses de edad al inicio del ensayo que recibieron ^ al menos una dosis de vacuna (cohorte total de los lactantes vacunados)._
|
Tipo de ENI |
FinIP |
COMPAS | ||||||
|
N° de casos de ENI |
EV (IC 95%) |
N° de casos de ENI |
EV (IC 95%) | |||||
|
Synflorix pauta 3+1 |
Synflorix pauta 2+1 |
Control1'2'1 |
Pauta 3+1 |
Pauta 2+1 |
Synflorix pauta 3+1 |
Control |
Pauta 3+1 | |
|
N 10.273 |
N 10.054 |
N 10.200 |
N 11.798 |
N 11.799 | ||||
|
ENI2 por serotipos vacunales |
0 |
1 |
12 |
100%(3) (82,8; 100) |
91,8%(4) (58,3; 99,6) |
0 |
18 |
100%(5) (77,3; 100) |
|
ENI por serotipo 6B |
0 |
0 |
5 |
100% (54,9; 100) |
100% (54,5; 100) |
0 |
2 |
- |
|
ENI por serotipo 14 |
0 |
0 |
4 |
100% (39,6; 100) |
100% (43,3; 100) |
0 |
9 |
100% (49,5; 100) |
ENI Enfermedad Neumocócica Invasora EV Efectividad (FinIP) o eficacia vacunal (COMPAS)
N Número de sujetos por grupo
IC Intervalo de Confianza
(1) En el FinIP, a parte de los serotipos 6B y 14, los casos de ENI confirmados por cultivo por los serotipos vacunales incluyeron: el 7F (1 caso en los grupos de Synflorix 2+1), el 18C, el 19F y el 23F (1 caso de cada uno de los grupos de control). En el COMPAS, los serotipos 5 (2 casos), el 18C (4 casos) y 23F (1 caso) fueron detectados en el grupo control, además de los serotipos 6B y 14.
(2) Los 2 grupos de control de los lactantes fueron agrupados.
(3) Valor p<0,0001
(4) Valor p=0,0009
(5) En la cohorte PP la EV fue del 100% (IC 95%: 74,3-100; 0 frente a 16 casos)
En el FinIP la EV global observada, frente a ENI confirmada por cultivo fue del 100% (IC 95%: 85,6100; 0 frente a 14 casos) para la pauta 3+1, el 85,8% (IC 95%: 49,1-97,8; 2 frente a 14 casos) para la pauta 2+1 y 93,0% (IC 95%: 74,9-98,9, 2 frente a 14 casos) independientemente de la pauta de primovacunación. En el COMPAS fue del 66,7% (IC 95%: 21,8-85,9; 7 frente a 21 casos).
Efectividad después de la inmunización de rescate (catch-up)
Entre los 15.447 niños de las cohortes de la vacunación de rescate (catch-up), no hubo casos de ENI confirmados por cultivo en los grupos de Synflorix, mientras que sí se observaron cinco casos de ENI por serotipos vacunales en los grupos control (serotipos 4, 6B, 7F, 14 y 19F).
2.2. Neumonía
La eficacia frente a la neumonía se evaluó en el COMPAS. La duración media del seguimiento a partir de la segunda semana tras la 3a dosis en la cohorte PP fue de 23 meses (rango de 0 a 34 meses) para el análisis intermedio (AI) y de 30 meses (rango de 0 a 44 meses) para el análisis al final del estudio. Al finalizar el periodo de seguimiento en la cohorte PP para el AI o para el análisis al final del estudio, la edad media fue de 29 meses (rango de 4 a 41 meses) y de 36 meses (rango de 4 a 50 meses), respectivamente. La proporción de sujetos que recibieron la dosis de recuerdo en la cohorte PP fue del 92,3% en ambos análisis.
La eficacia de Synflorix frente al primer episodio de probable neumonía bacteriana adquirida en la comunidad (NAC) acaecida a partir de la segunda semana siguiente a la administración de la 3a dosis fue demostrada en la cohorte PP (valor P< 0,002) en el análisis intermedio (dirigido por eventos; objetivo primario).
La probable NAC bacteriana (NAC-B) se define como NAC confirma radiológicamente con consolidación alveolar/derrame pleural en la radiografía de tórax o con infiltrados no alveolares pero con proteina C reactiva (PCR) > 40 mg/L.
Se presenta a continuación (tabla 2) la eficacia vacunal frente a la NAC-B observada en el análisis intermedio.
|
Synflorix |
Vacuna control | |||
|
N= |
10.295 |
N= |
10.201 |
Eficacia vacunal |
|
n |
% (n/N) |
n |
% (n/N) | |
|
240 |
2,3% |
304 |
3,0% |
22,0% (IC 95%: 7,7; 34,2) |
N número de sujetos por grupo
n/% número/porcentaje de sujetos que notificaron un primer episodio de NAC-B en cualquier
Tabla 2: Número y porcentaje de sujetos con un primer episodio de NAC-B sucedido a partir de la segunda semana siguiente a la administración de la 3a dosis de Synflorix o de la vacuna control y eficacia vacunal (cohorte PP).__
momento a partir de la segunda semana siguiente a la administración de la 3° dosis IC Intervalo de Confianza
En el análisis intermedio (cohorte PP), la eficacia de la vacuna fue del 25,7% (IC 95%: 8,4; 39,6) frente al primer episodio de NAC con consolidación alveolar o derrame pleural (NAC-C, definición de la OMS) y del 6,7 % (IC 95%: 0,7; 12,3) frente al primer episodio de NAC sospechada clínicamente y remitida a radiología.
En el análisis al final del estudio (cohorte PP), la eficacia vacunal fue del 18,2% (IC 95%: 4,1; 30,3) frente a la NAC-B (primer episodio), del 22,4% (IC 95%: 5,7; 36,1) frente a la NAC-C y del 7,3% (IC 95% 1,6; 12,6) frente a la NAC sospechada clínicamente y remitida a radiología. La eficacia fue del 100% (IC 95%: 41,9; 100) frente a la neumonía neumocócica bacteriémica o empiema debido a los serotipos vacunales. La protección frente a la NAC-B fue del 13,6% (IC 95%: -11,3; 33,0) antes de la dosis de recuerdo, y del 21,7% (IC 95%: 3,4; 36,5) en el momento o después de la dosis de recuerdo. Para NAC-C, la protección fue del 15,1% (IC 95%: -15,5; 37,6) antes de la dosis de recuerdo y del 26,3% (IC 95%: 4,4; 43,2) en el momento o después de la dosis de recuerdo.
La reducción de casos para la NAC-B y NAC-C fue mayor en niños < 36 meses de edad (eficacia vacunal del 20,6% (IC 95%; 6,5; 32,6) y del 24,2% (IC 95%: 7,4; 38,0) respectivamente). Los resultados de eficacia vacunal en niños > 36 meses de edad sugieren una disminución de la protección. En la actualidad no se ha establecido la duración de la protección frente a la NAC-B y la NAC-C en los niños mayores de 36 meses de edad.
Los resultados del estudio COMPAS, realizado en América Latina, deben interpretarse con cautela debido a las posibles diferencias en la epidemiologia de la neumonía en las diferentes regiones geográficas.
En el estudio FinIP, la efectividad de la vacuna en la reducción de los casos de neumonía diagnosticada en el ámbito hospitalario (identificados en base a los códigos ICD 10 para la neumonía) fue del 26,7% (IC 95%: 4,9; 43,5) con la pauta infantil de 3+1 y del 29,3% (IC 95%: 7,5; 46,3) con la pauta infantil de 2+1. Para la vacunación de rescate (catch-up), la efectividad de la vacuna fue del 33,2% (IC 95%: 3,0; 53,4) en la cohorte de 7-11 meses y del 22,4% (IC 95%: -8,7; 44,8) en la cohorte de 12-18 meses.
2.3. Otitis Media Aguda (OMA)
Se llevaron a cabo dos estudios de eficacia, COMPAS y POET (Ensayo clínico de eficacia frente a la Otitis Media Neumocócica), con vacunas neumocócicas conjugadas que contienen proteína D: Synflorix y una vacuna conjugada 11-valente en investigación (que además contenía el serotipo 3), respectivamente.
En el COMPAS, se incluyeron 7.214 sujetos (Cohorte Total Vacunada (CTV)) para el análisis de eficacia para la OMA, de los cuales 5.989 sujetos formaban parte de la cohorte PP (Tabla 3).
Tabla 3: Eficacia vacunal frente a la OMA(1) en el COMPAS
|
Tipo o causa de OMA |
Eficacia Vacunal (IC 95%) |
|
PP(2) | |
|
OMA Clínica |
16,1% (-1,1; 30,4)(3) |
|
Cualquier serotipo neumocócico |
56,1% (13,4; 77,8) |
|
10 serotipos vacunales neumocócicos |
67,1% (17,0; 86,9) |
|
Haemophilus influenzae no tipable (NTHi) |
15,0%(4) (-83,8; 60,7) |
CI Intervalo de Confianza
(1) Primer episodio
(2) Periodo de seguimiento hasta un máximo de 40 meses a partir de las 2 semanas tras la administración de la tercera dosis de primovacunación.
(3) No estadísticamente significativo en base a criterios predefinidos (p=0,032 unilateral). Sin embargo, en la CTV, la eficacia de la vacuna frente al primer episodio clínico de OMA fue del 19% (IC 95%: 4,4; 31,4).
(4) No estadísticamente significativo.
En otro amplio ensayo clínico, aleatorizado, doble ciego (POET), llevado a cabo en la República Checa y en Eslovaquia, 4.907 lactantes (cohorte PP) recibieron la vacuna 11-valente en investigación (11-Pn-PD) que contenía los 10 serotipos de Synflorix (junto con el serotipo 3 para el que no se demostró eficacia) o una vacuna control (vacuna antihepatitis A) de acuerdo con una pauta de vacunación a los 3, 4, 5 y 12-15 meses.
La eficacia de la vacuna 11 Pn-PD frente a la aparición de un primer episodio de OMA relacionado con serotipos vacunales fue del 52,6% (IC 95%: 35,0; 65,5). Se demostró eficacia tipoespecífica frente al primer episodio de OMA para los serotipos 6B (86,5%, IC 95%: 54,9; 96,0), 14 (94,8%, IC 95%: 61,0; 99,3), 19F (43,3%, IC 95%: 6,3; 65,4) y 23F (70,8%, IC 95%: 20,8; 89,2). Para el resto de los serotipos vacunales, el número de casos de OMA fue demasiado limitado como para permitir sacar conclusión alguna sobre la eficacia. La eficacia frente a cualquier episodio de OMA debido a cualquier serotipo neumocócico fue del 51,5% (IC 95%: 36,8; 62,9). La eficacia vacunal frente al primer episodio de OMA por NTHi fue del 31,1% [(IC 95%: -3,7; 54,2 no significativo)]. La eficacia frente a cualquier episodio de OMA por NTHi fue del 35,3% (IC 95%: 1,8; 57,4). La eficacia estimada de la vacuna frente a cualquier episodio clínico de otitis media independientemente de la etiología fue del 33,6% (IC 95%: 20,8-44,3).
Basándose en la inmunogenicidad puente entre Synflorix y la formulación 11-valente empleada en el estudio POET por lo que a la respuesta funcional (OPA) se refiere, se espera que Synflorix proporcione una eficacia protectora similar frente a OMA neumocócica.
No se observó un aumento en la incidencia de OMA debida a otros patógenos bacterianos o a otros serotipos no contenidos en la vacuna/serotipos no relacionados con la vacuna, ni en el estudio COMPAS (basado en los pocos casos notificados) ni en el POET.
La efectividad frente a la OMA notificada por los padres y diagnosticada por el médico fue evaluada en el estudio insertado dentro del ensayo clínico FinIP. La efectividad vacunal fue del 6,1% (IC 95%: -2,7; 14,1) con la pauta 3+1 y del 7,4% (IC 95% -2,8; 16,6) con la pauta 2+1 para esta variable en la cohorte vacunada infantil.
2.4. Impacto en el estado de portador nasofaríngeo
El efecto de Synflorix en el estado de portador nasofaríngeo fue estudiado en 2 ensayos clínicos, doble ciego, aleatorizados que utilizaron un control inactivo: el estudio insertado de FinIP en Finlandia (5.023 sujetos) y el COMPAS (1.700 sujetos).
Tanto en el estudio COMPAS como en el estudio insertado finlandés, Synflorix redujo los serotipos vacunales en los portadores nasofaríngeos, con un aparente incremento de serotipos no vacunales (excluyendo los relacionados con la vacuna) tras el recuerdo. Los resultados no fueron estadísticamente significativos en todos los análisis en el COMPAS. Sin embargo, en conjunto, hubo una tendencia a la disminución del número de portadores de neumococos en total.
En ambos estudios se produjo una reducción significativa de los serotipos individuales 6B y 19F. En el estudio insertado finlandés, también se observó una reducción significativa de los serotipos individuales 14, 23F y, con la pauta de primovacunación de 3 dosis, del serotipo 19A de reacción cruzada.
3. Efectividad en la vigilancia post-comercialización
En Brasil, Synflorix se introdujo en el programa de vacunación nacional (PVN) usando una pauta de 3+1 en lactantes (2, 4, 6 meses de edad y una dosis de recuerdo a los 12 meses) con una campaña de inmunización de rescate (catch-up) en niños hasta los 2 años de edad. De acuerdo a casi 3 años de vigilancia tras la introducción de Synflorix, un estudio pareado de casos y controles evidenció una disminución significativa de ENI confirmada por cultivo o PCR debida a cualquier serotipo vacunal, y ENI debida a los serotipos individuales 6B, 14 y 19A.
Tabla 4: Resumen de la efectividad de Synflorix frente a ENI en Brasil
|
Tipos de ENI(1) |
Efectividad ajustada(2) % (IC 95%) |
|
ENI debido a cualquier serotipo vacunal(3) - Neumonía invasiva o bacteriemia - Meningitis |
83,8% (65,9; 92,3) 81,3% (46,9; 93,4) 87,7% (61,4; 96,1) |
|
ENI debido a serotipos individuales1-4-1 - 6B - 14 - 19A |
82,8% (23,8; 96,1) 87,7% (60,8; 96,1) 82,2% (10,7; 96,4) |
(1) ENI confirmada por cultivo o PCR
(2) La efectividad ajustada representa el porcentaje de reducción de ENI en el grupo de vacunados con Synflorix comparado con el grupo de no vacunados, controlando los factores de confusión.
(3) Los casos confirmados por cultivo o PCR para los serotipos 4, 6B, 7F, 9V, 14, 18C, 19F y 23F contribuyeron al análisis.
(4) Serotipos individuales para los cuales la significación estadística se alcanzó en el análisis de efectividad controlando los factores de confusión (no se realizó ningún ajuste para la multiplicidad).
En Finlandia, Synflorix se introdujo en el PVN con una pauta de 2+1 en lactantes (3, 5 meses de edad y una dosis de recuerdo a los 12 meses) sin campaña de inmunización de rescate (catch-up). La comparación entre antes y después del PVN sugiere una disminución significativa en la incidencia de ENI confirmada por cualquier cultivo, ENI debida a cualquier serotipo vacunal y ENI debida al serotipo 19A.
Tabla 5: Tasas de ENI y las correspondientes reducciones de las tasas^ en Finlandia
|
ENI |
Incidencia por 100.000 personas - año |
Reducción relativa de la tasa(1) % (IC 95%) | |
|
Antes del PVN |
Después del PVN | ||
|
Confirmada por cualquier cultivo |
62,9 |
12,9 |
80% (72; 85) |
|
Cualquier serotipo vacunal(2) |
49,1 |
4,2 |
92% (86; 95) |
|
Serotipo 19A |
5,5 |
2,1 |
62% (20; 85) |
(1) La reducción relativa de la tasa indica cuanto se redujo la incidencia de ENI en niños <5 años de edad en la cohorte de Synflorix (monitorizada durante 3 años después de la introducción en el PVN) en comparación con las cohortes históricas de no vacunados pareados por edad y temporada (cada una seguida durante periodos de 3 años antes de la introducción de Synflorix en el PVN).
(2) Los casos confirmados por cultivo para los serotipos 1, 4, 6B, 7F, 9V, 14, 18C, 19F y 23F contribuyeron al análisis.
En Quebec, Canadá, Synflorix se introdujo en el programa de vacunación infantil (2 dosis de primovacunación en lactantes menores de 6 meses de edad y una dosis de recuerdo a los 12 meses) después de 4, 5 años de uso de Prevenar 7-valente. Basado en 1,5 años de vigilancia tras la introducción de Synflorix, con una cobertura mayor del 90% en el grupo de edad elegido para recibir la vacuna, se observó una disminución en la incidencia de ENI debido a los serotipos vacunales (en gran parte debido a los cambios en la enfermedad por serotipo 7F) sin aumento concomitante en la incidencia de ENI por los serotipos no vacunales. En general, la incidencia de ENI fue de 35/100.000 personas-año en las cohortes expuestas a Synflorix, y de 64/100.000 personas-año en las expuestas a Prevenar 7-valente, lo que representa una diferencia estadísticamente significativa (p=0,03). No se puede inferir una causa-efecto directo de estudios observacionales de este tipo.
4. Datos de inmunogenicidad
4.1. No inferioridad inmunológica frente a Prevenar 7-valente
La evaluación de la eficacia potencial frente a ENI antes de la autorización se basó en la comparación de las respuestas inmunes frente a los siete serotipos comunes entre Synflorix y otra vacuna antineumocócica conjugada para la que previamente se evaluó la eficacia (es decir, Prevenar 7-valente), tal y como recomienda la OMS. También se midieron las respuestas inmunes frente a los tres serotipos adicionales de Synflorix.
En un ensayo clínico comparativo directo con Prevenar 7-valente, se demostró la no inferioridad de la respuesta inmune de Syflorix medida por ELISA para todos los serotipos, excepto para el 6B y 23F (límite superior del IC del 96,5% de la diferencia entre grupos >10%) (Tabla 6). Para los serotipos 6B y 23F, respectivamente un 65,9% y un 81,4% de los niños vacunados a los 2, 3 y 4 meses, alcanzaron el umbral de anticuerpos (es decir, 0,20 pg/ml) un mes después de la tercera dosis de Synflorix, frente a un 79,0% y un 94,1% respectivamente, después tres dosis de Prevenar 7-valente. La relevancia clinica de estas diferencias no está clara, debido a que se observó que Synflorix es eficaz frente a ENI causada por el serotipo 6B en un estudio clínico doble ciego, aleatorizado por grupos (ver Tabla 1).
El porcentaje de vacunados que alcanzaron el umbral para los tres serotipos adicionales de Synflorix (1, 5 y 7F) fue 97,3%, 99% y 99,5%, respectivamente, siendo la respuesta al menos tan buena como la respuesta conjunta de Prevenar 7-valente frente a los 7 serotipos comunes (95,8%).
Tabla 6: Análisis comparativo entre Prevenar 7-valente y Synflorix del porcentaje de sujetos con concentraciones de anticuerpos > 0,20 pg/ml un mes después de la dosis 3_
|
Anticuerpo |
Synflorix |
Prevenar 7-valente |
Diferencia en % > 0,20pg/ml (Prevenar 7-valente menos Synflorix) | ||||
|
N |
% |
N |
% |
% |
IC 96,5% | ||
|
Anti-4 |
1106 |
97,1 |
373 |
100 |
2,89 |
1,71 |
4,16 |
|
Anti-6B |
1100 |
65,9 |
372 |
79,0 |
13,12 |
7,53 |
18,28 |
|
Anti-9V |
1103 |
98,1 |
374 |
99,5 |
1,37 |
-0,28 |
2,56 |
|
Anti-14 |
1100 |
99,5 |
374 |
99,5 |
-0,08 |
-1,66 |
0,71 |
|
Anti-18C |
1102 |
96,0 |
374 |
98,9 |
2,92 |
0,88 |
4,57 |
|
Anti-19F |
1104 |
95,4 |
375 |
99,2 |
3,83 |
1,87 |
5,50 |
|
Anti-23F |
1102 |
81,4 |
374 |
94,1 |
12,72 |
8,89 |
16,13 |
Las medias geométricas de las concentraciones de anticuerpos (GMCs) después de la vacunación primaria con Synflorix frente a los siete serotipos comunes fueron más bajas que las inducidas con Prevenar 7-valente. Las GMCs antes de la vacunación de recuerdo (8 a 12 meses después de la última dosis de la serie de primovacunación) fueron, en general, similares para las dos vacunas.
Después de la dosis de recuerdo, las GMCs obtenidas con Synflorix fueron menores para la mayoría de los serotipos comunes con Prevenar 7-valente.
En el mismo estudio, Synflorix demostró inducir anticuerpos funcionales para todos los serotipos de la vacuna. Para cada uno de los siete serotipos comunes, entre el 87,7% y el 100% de los vacunados con Synflorix y entre el 92,1% y el 100% de los vacunados con Prevenar 7-valente alcanzaron un título OPA > 8 un mes después de la tercera dosis. La diferencia entre ambas vacunas en términos de porcentaje de sujetos con el título OPA > 8 fue <5% para todos los serotipos comunes, incluyendo 6B y 23F. La media geométrica de los títulos (GMTs) de anticuerpos OPA inducidos con Synflorix fueron más bajos que los inducidos con Prevenar 7-valente para los siete serotipos comunes, excepto para el serotipo 19F.
Para los serotipos 1, 5 y 7F, los porcentajes de vacunados con Synflorix que alcanzaron un título OPA >8 fueron respectivamente 65,7%, 90,9% y 99,6% después del ciclo vacunación primaria y 91,0%, 96,3% y 100% después de la dosis de recuerdo. La respuesta OPA para los serotipos 1 y 5 fue más baja en magnitud que la respuesta para cada uno de los otros serotipos. Se desconocen las implicaciones sobre la eficacia protectora de estos hallazgos. La respuesta frente al serotipo 7F fue de la misma magnitud que las respuestas para los siete serotipos comunes entre las dos vacunas.
También se ha demostrado que Synflorix induce una respuesta inmune frente al serotipo 19A de reacción cruzada con un 48,8% (IC 95%: 42,9; 54,7) de los vacunados alcanzando un título de OPA > 8 un mes después de la dosis de recuerdo.
La administración de una cuarta dosis (dosis de recuerdo) en el segundo año de vida indujo una respuesta anamnésica de anticuerpos, medida por ELISA y OPA, para los serotipos vacunales y el serotipo 19A de reacción cruzada, demostrando la inducción de memoria inmunológica después de la tercera dosis de la serie de primovacunación.
4.2. Datos adicionales de inmunogenicidad
Lactantes de seis semanas a seis meses de edad
Pauta de primovacunación de tres dosis
Un total de ocho estudios, llevados a cabo en Europa, en Chile y en Filipinas, han evaluado la inmunogenicidad de Synflorix después de una serie primaria de 3 dosis (N=3.089) de acuerdo con diferentes pautas de vacunación (6-10-14 semanas, 2-3-4, 3-4-5 ó 2-4-6 meses de edad). Una cuarta dosis (de recuerdo) se administró en seis estudios clínicos a 1.976 sujetos. En general, las respuestas a la vacuna observadas fueron comparables en los diferentes esquemas posológicos, aunque se observó una respuesta inmune ligeramente superior con la pauta 2-4-6 meses.
Pauta de primovacunación de dos dosis
La inmunogenicidad de Synflorix tras la administración de una pauta de primovacunación de 2 dosis o 3 dosis en sujetos menores de 6 meses de edad fue evaluada en un ensayo clínico.
A pesar de que no hubo una diferencia significativa entre los dos grupos en el porcentaje de sujetos con concentración de anticuerpos > 0,20 pg/ml (ELISA), el porcentaje de sujetos para los serotipos 6B y 23F fue menor que para el resto de serotipos vacunales (Tabla 7 y Tabla 8). El porcentaje de sujetos con títulos OPA > 8 en sujetos primovacunados con dos dosis, en comparación con los sujetos primovacunados con tres dosis, fue menor para los serotipos 6B, 18C y 23F (74,4%, 82,8%, 86,3% respectivamente para la pauta de dos dosis y 88,9%, 96,2%, 97,7% respectivamente para la pauta de tres dosis). Globalmente, la persistencia de la respuesta inmune antes de la dosis de recuerdo a los 11 meses de edad fue menor en los sujetos primovacunados con dos dosis. En ambas pautas, se observó una respuesta a la dosis de recuerdo indicativa de sensibilización inmunológica para cada serotipo vacunal (Tabla 7 y Tabla 8). Tras la dosis de recuerdo, el porcentaje de sujetos con títulos OPA > 8 fue más bajo en la pauta de 2 dosis para los serotipos 5 (87,2% frente a un 97,5% para los sujetos primovacunados con tres dosis) y 6B (81,1% frente a un 90,3%). Las demás respuestas fueron comparables.
Tabla 7: Porcentaje de sujetos primovacunados con dos dosis con concentraciones de anticuerpos > 0,20 pg/ml un mes después de la pauta de primovacunación y un mes después de la dosis de recuerdo.
|
Anticuerpos |
> 0,2pg/m |
L (ELISA) | ||||
|
Post pauta de primovacunación |
Post vacunación de recuerdo | |||||
|
% |
IC 95% |
% |
IC 95% | |||
|
Anti-1 |
97,4 |
93,4 |
99,3 |
99,4 |
96,5 |
100 |
|
Anti-4 |
98,0 |
94,4 |
99,6 |
100 |
97,6 |
100 |
|
Anti-5 |
96,1 |
91,6 |
98,5 |
100 |
97,6 |
100 |
|
Anti-6B |
55,7 |
47,3 |
63,8 |
88,5 |
82,4 |
93,0 |
|
Anti-7F |
96,7 |
92,5 |
98,9 |
100 |
97,7 |
100 |
|
Anti-9V |
93,4 |
88,2 |
96,8 |
99,4 |
96,5 |
100 |
|
Anti-14 |
96,1 |
91,6 |
98,5 |
99,4 |
96,5 |
100 |
|
Anti-18C |
96,1 |
91,6 |
98,5 |
100 |
97,7 |
100 |
|
Anti-19F |
92,8 |
87,4 |
96,3 |
96,2 |
91,8 |
98,6 |
|
Anti-23F |
69,3 |
61,3 |
76,5 |
96,1 |
91,7 |
98,6 |
Tabla 8: Porcentaje de sujetos primovacunados con tres dosis con concentraciones de anticuerpos > 0,20 pg/ml un mes después de la pauta de primovacunación y un mes después de la dosis de recuerdo.
|
Anticuerpos |
> 0,2pg/m |
L (ELISA) | ||||
|
Post pauta de primovacunación |
Post vacunación de recuerdo | |||||
|
% |
IC 95% |
% |
IC 95% | |||
|
Anti-1 |
98,7 |
95,3 |
99,8 |
100 |
97,5 |
100 |
|
Anti-4 |
99,3 |
96,4 |
100 |
100 |
97,5 |
100 |
|
Anti-5 |
100 |
97,6 |
100 |
100 |
97,5 |
100 |
|
Anti-6B |
63,1 |
54,8 |
70,8 |
96,6 |
92,2 |
98,9 |
|
Anti-7F |
99,3 |
96,4 |
100 |
100 |
97,5 |
100 |
|
Anti-9V |
99,3 |
96,4 |
100 |
100 |
97,5 |
100 |
|
Anti-14 |
100 |
97,6 |
100 |
98,6 |
95,2 |
99,8 |
|
Anti-18C |
99,3 |
96,4 |
100 |
99,3 |
96,3 |
100 |
|
Anti-19F |
96,1 |
91,6 |
98,5 |
98,0 |
94,2 |
99,6 |
|
Anti-23F |
77,6 |
70,2 |
84,0 |
95,9 |
91,3 |
98,5 |
Para el serotipo 19A de reacción cruzada, se observaron GMCs de anticuerpos ELISA similares tras la primovacunación y tras el recuerdo para la pauta de 2 dosis (0,14 pg/ml (IC 95%: 0,12; 0,17) y 0,73 pg/ml (IC 95%: 0,58; 0,92)) y la pauta de 3 dosis (0,19 pg/ml (IC 95%: 0,16; 0,24) y 0,87 pg/ml (IC 95%: 0,69; 1,11)). Se observó que el porcentaje de sujetos con títulos OPA > 8 y GMTs tras la primovacunación y tras el recuerdo fue menor en la pauta de 2 dosis que en la pauta de 3 dosis. En ambas pautas, se observó un refuerzo de la respuesta indicativo de primado inmunológico.
Se desconocen las consecuencias clínicas de la inferioridad de las respuestas inmunes posteriores a la primovacunación y a la vacunación de recuerdo al administrar la pauta de primovacunación de dos dosis.
Memoria inmune
En el seguimiento del estudio que evalua las pautas de primovacunación de 2 dosis y 3 dosis, la persistencia de anticuerpos a los 36 a 46 meses de edad se demostró en sujetos que habían recibido una pauta de primovacunación de dos dosis seguida de una dosis de recuerdo, con al menos un 83,7% de los sujetos que continuaron siendo seropositivos para los serotipos vacunales y el serotipo 19A de reacción cruzada. En sujetos que habían recibido una pauta de primovacunación de tres dosis seguida de una dosis de recuerdo, al menos un 96,5% de los sujetos continuaron siendo seropositivos para los serotipos vacunales y el 86,4% para el serotipo 19A. Tras una única dosis de Synflorix, administrada durante el cuarto año de vida, como una dosis de exposición, el aumento de las GMCs de anticuerpos ELISA y de las GMTs de OPA experimentado tras la vacunación, en comparación con antes de la vacunación, en los sujetos primovacunados con dos dosis fue similar al de los sujetos primovacunados con tres dosis. Estos resultados indican la existencia de memoria inmunológica en los sujetos primovacunados para todos los serotipos vacunales y para el serotipo 19A de reacción cruzada.
Lactantes y niños > 7 meses de edad no vacunados
Las respuestas inmunes inducidas por Synflorix en niños mayores no vacunados anteriormente se evaluaron en tres ensayos clínicos.
El primer ensayo clínico evaluó las respuestas inmunes para los serotipos vacunales y para el serotipo 19A de reacción cruzada en niños de 7-11 meses, de 12-23 meses y de 2 a 5 años:
• Niños de 7-11 meses de edad que recibieron 2 dosis de vacunación primaria seguidas de una dosis de recuerdo durante el segundo año de vida. Las respuestas inmunes después de la dosis de recuerdo en este grupo de edad fueron, en general, similares a las observadas después de la dosis de recuerdo en niños que habían sido vacunados con 3 dosis antes de los 6 meses de edad.
• En niños de 12-23 meses de edad las respuestas inmunes obtenidas después de dos dosis fueron comparables a las respuestas después de tres dosis en lactantes menores de 6 meses de edad, excepto para los serotipos vacunales 18C y 19F así como también para el serotipo 19A, para los que las respuestas fueron mayores en los niños de 12-23 meses.
• En niños de 2 a 5 años de edad, que recibieron 1 dosis, las GMCs de anticuerpos ELISA fueron similares para 6 serotipos vacunales así como también para el serotipo 19A a las alcanzadas después de una pauta de vacunación de 3 dosis en lactantes menores de 6 meses de edad, mientras que éstas fueron menores para 4 serotipos vacunales (serotipos 1, 5, 14 y 23F). Las GMTs de OPA fueron similares o mayores tras una única dosis que con una pauta primaria de 3 dosis en lactantes menores de 6 meses de edad, excepto para el serotipo 5.
En el segundo ensayo clínico, la administración de una única dosis cuatro meses después de dos dosis de rescate (catch-up) a los 12-20 meses de edad provocó un aumento marcado de las GMCs de anticuerpos ELISA y de las GMTs de OPA (cuando se comparan las respuestas antes y después de la última dosis), lo que indica que dos dosis de rescate (catch-up) proporcionan una inmunización primaria adecuada.
El tercer ensayo clínico mostró que la administración de 2 dosis con un intervalo de 2 meses empezando a los 36-46 meses, producía mayores GMCs de anticuerpos ELISA y GMTs de OPA para cada serotipo vacunal y para el serotipo 19A de reacción cruzada que las observadas un mes después de una pauta primaria de vacunación de 3 dosis. La proporción de sujetos con una concentración de anticuerpos ELISA > 0,20 pg/ml o un título OPA > 8 para cada serotipo vacunal fue comparable o mayor en el grupo catch-up que en los lactantes primovacunados con 3 dosis.
No se ha investigado la persistencia a largo plazo de anticuerpos después de la administración de una serie de primovacunación en lactantes y una dosis de recuerdo o después de la primovacunación con dos dosis en niños más mayores.
En un ensayo clínico, se ha demostrado que Synflorix se puede administrar de forma segura como dosis de recuerdo en el segundo año de vida a niños que hayan recibido 3 dosis de primovacunación con Prevenar 7-valente. Este ensayo ha demostrado que las respuestas inmunes frente a los 7 serotipos comunes eran comparables a aquellas obtenidas con la dosis de recuerdo de Prevenar 7-valente. Sin embargo, los niños que hayan recibido Prevenar 7-valente durante la primovacunación no quedarán inmunizados frente a los serotipos adicionales contenidos en Synflorix (1, 5, 7F). Por lo tanto, no se puede predecir el grado y la duración de la protección frente a la enfermedad neumocócica invasora y otitis media debida a estos tres serotipos en niños de este grupo de edad después de una dosis única de Synflorix.
4.3. Datos de inmunogenicidad en lactantes prematuros
Se evaluó la inmunogenicidad de Synflorix en lactantes muy prematuros (periodo gestacional entre 27 y 30 semanas) (N=42), lactantes prematuros (periodo gestacional entre 31 y 36 semanas) (N=82) y recién nacidos a término (periodo gestacional > 36 semanas) (N=132) tras una pauta de primovacunación de tres dosis a los 2, 4 y 6 meses de edad. Se evaluó la inmunogenicidad tras una cuarta dosis (dosis de recuerdo) administrada entre los 15 y 18 meses de edad en 44 lactantes muy prematuros, 69 lactantes prematuros y 127 recién nacidos a término.
Un mes después de la primovacunación (es decir, después de la tercera dosis), para cada serotipo vacunal al menos el 92,7% de los sujetos alcanzó concentraciones de anticuerpos > 0,2 pg/ml (ELISA) y al menos el 81,7% alcanzó títulos OPA > 8 excepto para el serotipo 1 (al menos el 58,8% de los sujetos alcanzó títulos OPA > 8). Se observaron GMCs de anticuerpos y GMTs de OPA similares en todos los lactantes, excepto GMCs de anticuerpos inferiores para los serotipos 4, 5, 9V y para el serotipo 19A de reacción cruzada en lactantes muy prematuros y para el serotipo 9V en lactantes prematuros y una GMT de OPA inferior para el serotipo 5 en lactantes muy prematuros. Se desconoce la relevancia clínica de estas diferencias.
Un mes después de la administración de la dosis de recuerdo se observaron aumentos de las GMCs de anticuerpos ELISA y de las GMTs de OPA para cada serotipo vacunal y para el serotipo 19A de reacción cruzada, lo que indica la existencia de memoria inmunológica. Se observaron GMCs de anticuerpos y GMTs de OPA similares en todos los lactantes, excepto una GMT de OPA inferior para el serotipo 5 en lactantes muy prematuros. Globalmente, para cada serotipo vacunal al menos el 97,6% de los sujetos alcanzaron concentraciones de anticuerpos > 0,2 pg/ml (ELISA) y al menos el 91,9% alcanzaron títulos OPA > 8.
La Agencia Europea de Medicamentos ha aplazado la obligación de presentar los resultados de los estudios con Synflorix en uno o más subgrupos de población pediátrica sobre enfermedades causadas por Streptococcus pneumoniae y sobre otitis media aguda causada por Haemophilus influenzae (ver sección 4.2 para información acerca del uso pediátrico).
5.2 Propiedades farmacocinéticas
No se requiere evaluación de las propiedades farmacocinéticas para las vacunas.
5.3 Datos preclínicos sobre seguridad
Estudios realizados con una formulación 11-valente representativa de Synflorix revelaron que no existía riesgo especial para los humanos, basándose en estudios convencionales de farmacología de seguridad y estudios de toxicidad a dosis única y dosis repetidas.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Cloruro de sodio
Agua para preparaciones inyectables Para el adsorbente, ver sección 2.
6.2 Incompatibilidades
En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros.
6.3 Periodo de validez 4 años
Vial multidosis
Se recomienda usar inmediatamente después de la primera apertura del vial multidosis. Si no se usa inmediatamente, la vacuna se debe conservar en nevera (entre 2 °C y 8 °C). Si no se usa en las 6 horas siguientes debe desecharse.
6.4 Precauciones especiales de conservación
Conservar en nevera (entre 2 °C y 8 °C).
No congelar.
Conservar en el embalaje original para protegerlo de la luz.
Vial multidosis
Para las condiciones de conservación tras la primera apertura del medicamento, ver sección 6.3.
6.5 Naturaleza y contenido del envase Jeringa precargada
0,5 ml de suspensión inyectable en jeringa precargada (de vidrio tipo I) con tapón (goma butilo) con o sin agujas. Envases de 1, 10 ó 50.
Vial
0,5 ml de suspensión inyectable en un vial (de vidrio tipo I) con tapón (goma butilo). Envases de 1, 10 ó 100.
Vial multidosis
1 ml de suspensión inyectable en vial (de vidrio tipo I) de 2 dosis con tapón (goma butilo). Envase de 100.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Jeringa precargada
Durante el almacenamiento de la jeringa precargada puede observarse un depósito fino de color blanco con un sobrenadante claro transparente. Esto no constituye un signo de deterioro.
Antes de la administración, se debe inspeccionar visualmente el contenido de la jeringa precargada tanto antes como después de agitar para observar si existe alguna sustancia extraña y/o variación de aspecto físico. En caso de que se observe alguna de estas circunstancias, desechar la vacuna.
Se debe dejar que la vacuna alcance la temperatura ambiente antes de su uso.
La vacuna debe agitarse bien antes de su uso.
Instrucciones para la administración de la vacuna
, /
Émbolo de la jeringa
Cuerpo de la jeringa
Tapa de la jeringa
Protector de la aguja
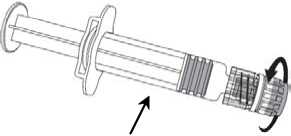
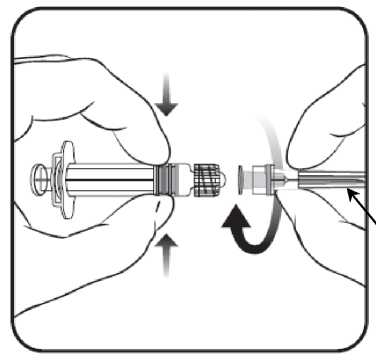
1. Desenrosque la tapa de la jeringa girándola
en sentido contrario a las agujas del reloj sujetando el cuerpo de la jeringa con la otra mano (evite sostener el émbolo de la jeringa).
2. Inserte la aguja en la jeringa
y a continuación, gírela en el sentido de las agujas del reloj hasta que se bloquee.
3. Retire el protector de la aguja; en algunas ocasiones puede resultar un poco difícil.
Vial
Durante el almacenamiento del vial puede observarse un depósito fino de color blanco con un sobrenadante claro transparente. Esto no constituye un signo de deterioro.
Antes de la administración, se debe inspeccionar visualmente el contenido del vial tanto antes como después de agitar para observar si existe alguna sustancia extraña y/o variación de aspecto físico. En caso de que se observe alguna de estas circunstancias, desechar la vacuna.
Se debe dejar que la vacuna alcance la temperatura ambiente antes de su uso.
La vacuna debe agitarse bien antes de su uso.
Vial multidosis
Durante el almacenamiento del vial puede observarse un depósito fino de color blanco con un sobrenadante claro transparente. Esto no constituye un signo de deterioro.
Antes de la administración, se debe inspeccionar visualmente el contenido del vial tanto antes como después de agitar para observar si existe alguna sustancia extraña y/o variación de aspecto físico. En caso de que se observe alguna de estas circunstancias, desechar la vacuna.
Se debe dejar que la vacuna alcance la temperatura ambiente antes de su uso.
La vacuna debe agitarse bien antes de su uso.
Cuando se emplea un vial multidosis, cada dosis de 0,5 ml debe extraerse utilizando una aguja y una jeringa estériles; se deben tomar precauciones para evitar la contaminación de los componentes.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
GlaxoSmithKline Biologicals s.a.
Rue de l'Institut 89 B-1330 Rixensart, Bélgica
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
Jeringa precargada
EU/1/09/508/001
EU/1/09/508/002
EU/1/09/508/003
EU/1/09/508/004
EU/1/09/508/005
EU/1/09/508/010
Vial
EU/1/09/508/006
EU/1/09/508/007
EU/1/09/508/008
Vial multidosis EU/1/09/508/009
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 30/marzo/2009 Fecha de la última renovación: 21/febrero/2014
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu/.
A. FABRICANTES DE LOS PRINCIPIOS ACTIVOS BIOLÓGICOS Y FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
A. FABRICANTES DE LOS PRINCIPIOS ACTIVOS BIOLÓGICOS Y FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección de los fabricantes de los principios activos biológicos
GlaxoSmithKline Biologicals SA
Parc de la Noire Epine
rue Flemming
B-1300 Wavre
Bélgica
GlaxoSmithKline Biologicals S.A.
89, rue de l'Institut BE-1330 Rixensart Bélgica
GlaxoSmithKline Biologicals Kft.
Homoki Nagy István utca 1.
2100 Gódólló Hungría
GlaxoSmithKline Biologicals 10, Tuas South Avenue 8 Singapur 637421 Singapur
Nombre y dirección del fabricante responsable de la liberación de los lotes
GlaxoSmithKline Biologicals S.A.
89, rue de l'Institut BE-1330 Rixensart Bélgica
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica.
• Liberación oficial de lotes
De conformidad con el artículo 114 de la Directiva 2001/83/EC modificada, la liberación oficial de los lotes será realizada por un laboratorio estatal o uno designado a tal efecto.
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
Los requerimientos para la presentación de los informes periódicos de seguridad para este medicamento se establecen en la lista de fechas de referencia de la Unión (lista EURD) prevista en el artículo 107quater, apartado 7, de la Directiva 2001/83/CE y publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado
en la versión del PGR incluido en el Módulo 1.8.2 de la Autorización de Comercialización y en
cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos.
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
1. NOMBRE DEL MEDICAMENTO
Synflorix suspensión inyectable en jeringa precargada Vacuna conjugada antineumocócica de polisacáridos (adsorbida)
2. PRINCIPIOS ACTIVOS
Cada dosis de 0,5 ml contiene 1 microgramo de polisacárido de los serotipos 1, 5, 6B, 7F, 9V, 14 y 23F, y 3 microgramos de los serotipos 4, 18C y 19F.
3. LISTA DE EXCIPIENTES
Cloruro de sodio
Agua para preparaciones inyectables
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Suspensión inyectable en jeringa precargada
1 jeringa precargada 1 dosis (0,5 ml)
10 j eringas precargadas 10 dosis (0,5 ml)
1 jeringa precargada + 1 aguja 1 dosis (0,5 ml)
10 jeringas precargadas + 10 agujas 10 x 1 dosis (0,5 ml)
1 jeringa precargada + 2 agujas 1 dosis (0,5 ml)
50 jeringas precargadas 50 dosis (0,5 ml)
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento Vía intramuscular
Se debe dejar que la vacuna alcance la temperatura ambiente antes de su uso. Agitar bien antes de usar
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRAS ADVERTENCIAS ESPECIALES, SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Conservar en nevera No congelar
Conservar en el embalaje original para protegerlo de la luz
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADO DE SU USO (CUANDO CORRESPONDA)
Eliminación de acuerdo con la normativa local.
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
GlaxoSmithKline Biologicals s.a. Rue de l’Institut 89 B-1330 Rixensart, Bélgica
12. NÚMEROS DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/09/508/001 - envase de 1 sin aguja EU/1/09/508/002 - envase de 10 sin aguja EU/1/09/508/003 - envase de 1 con aguja EU/1/09/508/004 - envase de 10 con 10 agujas EU/1/09/508/005 - envase de 1 con 2 agujas EU/1/09/508/010 - envase de 50 sin aguja
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
MEDICAMENTO SUJETO A PRESCRIPCIÓN MÉDICA.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Se acepta la justificación para no incluir la información en Braille.
ETIQUETA DE LA JERINGA PRECARGADA_
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Synflorix suspensión inyectable en jeringa precargada IM
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
1 dosis (0,5 ml)
6. OTROS
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR VIAL, ENVASE DE 1, 10, 100_
1. NOMBRE DEL MEDICAMENTO
Synflorix suspensión inyectable
Vacuna conjugada antineumocócica de polisacáridos (adsorbida)
2. PRINCIPIOS ACTIVOS
Cada dosis de 0,5 ml contiene 1 microgramo de polisacárido de los serotipos 1, 5, 6B, 7F, 9V, 14 y 23F, y 3 microgramos de los serotipos 4, 18C y 19F.
3. LISTA DE EXCIPIENTES
Cloruro de sodio
Agua para preparaciones inyectables
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Suspensión inyectable 1 vial
1 dosis (0,5 ml)
10 viales
10 x 1 dosis (0,5 ml)
100 viales
100 x 1 dosis (0,5 ml)
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento Vía intramuscular
Se debe dejar que la vacuna alcance la temperatura ambiente antes de su uso. Agitar bien antes de usar
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRAS ADVERTENCIAS ESPECIALES, SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Conservar en nevera No congelar
Conservar en el embalaje original para protegerlo de la luz
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADO DE SU USO (CUANDO CORRESPONDA)_
Eliminación de acuerdo con la normativa local.
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
GlaxoSmithKline Biologicals s.a. Rue de l’Institut 89 B-1330 Rixensart, Bélgica
12. NÚMEROS DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/09/508/006 - envase de 1 EU/1/09/508/007 - envase de 10 EU/1/09/508/008 - envase de 100
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
MEDICAMENTO SUJETO A PRESCRIPCIÓN MÉDICA.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Se acepta la justificación para no incluir la información en Braille.
ETIQUETA DEL VIAL
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Synflorix suspensión inyectable IM
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
1 dosis (0,5 ml)
6. OTROS
1. NOMBRE DEL MEDICAMENTO
Synflorix suspensión inyectable en envase multidosis Vacuna conjugada antineumocócica de polisacáridos (adsorbida)
2. PRINCIPIOS ACTIVOS
Cada dosis de 0,5 ml contiene 1 microgramo de polisacárido de los serotipos 1, 5, 6B, 7F, 9V, 14 y 23F, y 3 microgramos de los serotipos 4, 18C y 19F.
3. LISTA DE EXCIPIENTES
Cloruro de sodio
Agua para preparaciones inyectables
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Suspensión inyectable en envase multidosis
100 viales MULTIDOSIS (2 dosis por vial - 0,5 ml por dosis)
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento Vía intramuscular
Se debe dejar que la vacuna alcance la temperatura ambiente antes de su uso. Agitar bien antes de usar
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRAS ADVERTENCIAS ESPECIALES, SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Conservar en nevera
No congelar
Conservar en el embalaje original para protegerlo de la luz Utilizar en las 6 horas siguientes a la primera apertura del vial
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADO DE SU USO (CUANDO CORRESPONDA)
Eliminación de acuerdo con la normativa local.
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
GlaxoSmithKline Biologicals s.a. Rue de l’Institut 89 B-1330 Rixensart, Bélgica
12. NÚMEROS DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/09/508/009
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
MEDICAMENTO SUJETO A PRESCRIPCIÓN MÉDICA.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Se acepta la justificación para no incluir la información en Braille.
ETIQUETA DEL VIAL MULTIDOSIS (2 DOSIS)_
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Synflorix suspensión inyectable IM
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
2 dosis (0,5 ml por dosis)
6. OTROS
B. PROSPECTO
Prospecto: Información para el usuario
Synflorix suspensión inyectable en jeringa precargada
Vacuna conjugada antineumocócica de polisacáridos (adsorbida)
Lea todo el prospecto detenidamente antes de que su hijo reciba esta vacuna, porque contiene información importante para usted.
• Conserve este prospecto, ya que puede tener que volver a leerlo.
• Si tiene alguna duda, consulte a su médico o farmacéutico.
• Esta vacuna se le ha recetado solamente a su hijo y no debe dársela a otras personas.
• Si su hijo experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto:
1. Qué es Synflorix y para qué se utiliza
2. Qué necesita saber antes de que su hijo reciba Synflorix
3. Cómo se administra Synflorix
4. Posibles efectos adversos
5. Conservación de Synflorix
6. Contenido del envase e información adicional
1. Qué es Synflorix y para qué se utiliza
Synflorix es una vacuna conjugada antineumocócica. Su médico o enfermera inyectará esta vacuna a su hijo.
Se utiliza para ayudar a proteger a su hijo a partir de las 6 semanas hasta los 5 años de edad frente a:
una bacteria llamada “Streptococcus pneumoniae”. Esta bacteria puede causar enfermedades graves incluyendo meningitis, sepsis y bacteriemia (bacterias en el torrente sanguíneo), así como también infección de oído o neumonía.
Cómo funciona Synflorix
Synflorix ayuda a que el organismo genere sus propios anticuerpos. Los anticuerpos forman una parte del sistema inmune que protegerá a su hijo de estas enfermedades.
2. Qué necesita saber antes de que su hijo reciba Synflorix No se debe administrar Synflorix si:
• su hijo ha tenido anteriormente una reacción alérgica (es hipersensible) al principio activo, o a cualquiera de los demás componentes de esta vacuna (enumerados en la Sección 6).
Los signos de una reacción alérgica pueden incluir erupción de la piel con picor, dificultad para respirar e hinchazón de la cara o la lengua.
• su hijo tiene una infección grave con fiebre alta (superior a 38 °C). Si esto le ocurre a su hijo debe retrasarse la vacunación hasta que se sienta mejor. Una infección de poca importancia, como un resfriado no debe ser un problema para la vacunación. No obstante, consúltelo antes con su médico.
No se debe administrar Synflorix si su hijo se encuentra en cualquiera de las circunstancias anteriores. Si no está seguro, consúltelo con su médico o farmacéutico antes de que a su hijo se le administre Synflorix.
Advertencias y precauciones:
Consulte a su médico o farmacéutico antes de empezar a usar esta vacuna si:
• su hijo tiene algún problema de coagulación o se hace cardenales con facilidad.
En niños a partir de 2 años de edad, antes o después de cualquier inyección podría producirse un desmayo, por lo que debe informar a su médico o enfermera si su hijo se ha desmayado en anteriores ocasiones tras la administración de una inyección.
Al igual que todas las vacunas, Synflorix puede no proteger completamente a todos los niños vacunados.
Synflorix sólo protegerá frente a las infecciones causadas por las bacterias para las que se ha desarrollado la vacuna.
Los niños con un sistema inmune debilitado (por ejemplo debido a una infección por el VIH o a una terapia inmunosupresora) podrían no beneficiarse completamente de Synflorix.
Si no está seguro, hable con su médico o farmacéutico antes de usar Synflorix.
Uso de Synflorix con otros medicamentos
Informe a su médico o farmacéutico si su hijo está recibiendo, ha recibido recientemente o podría tener que recibir otros medicamentos, incluso los adquiridos sin receta, o si le han administrado recientemente cualquier otra vacuna. Puede que Synflorix no funcione tan bien si su hijo está tomando medicamentos que afecten al sistema inmune para combatir una infección.
Synflorix se puede administrar al mismo tiempo que otras vacunas infantiles, como vacunas frente a difteria, tétanos, pertussis (tos ferina), Haemophilus influenzae tipo b, polio oral o inactivada, hepatitis B, triple vírica (paperas, rubéola y sarampión), varicela, vacunas orales antirrotavirus y vacunas conjugadas frente al meningococo del serogrupo C y de los serogrupos A, C, W-135 e Y. Se utilizará un lugar de inyección diferente para cada una de las vacunas.
Su médico podría recomendarle que dé a su hijo un medicamento que baje la fiebre (como paracetamol) antes o inmediatamente después de recibir Synflorix. Esto puede ayudar a disminuir alguno de los efectos adversos (reacciones febriles) de Synflorix. Sin embargo, si su hijo ha recibido paracetamol antes o inmediatamente después de recibir Synflorix, los niveles de anticuerpos obtenidos podrían reducirse ligeramente. Se desconoce si la reducción de los niveles de anticuerpos tiene impacto en la protección frente a las enfermedades neumocócicas.
Synflorix contiene sodio
Este medicamento contiene menos de 23 mg (1 mmol) de sodio por dosis, por lo que se considera esencialmente “exento de sodio”.
3. Cómo se administra Synflorix Cómo usar la vacuna
Synflorix se inyecta siempre en un músculo. Generalmente en el muslo o en la parte superior del brazo.
Cuánto se usa
Generalmente su hijo (desde las 6 semanas a los 6 meses de edad) recibirá un ciclo de 4 inyecciones de acuerdo con las recomendaciones oficiales pero el profesional sanitario puede emplear un esquema de vacunación diferente. Es importante seguir las instrucciones del médico o de la enfermera para completar el ciclo de inyecciones.
• Cada inyección se administrará al menos con un mes de diferencia, excepto la última, que se administrará al menos seis meses después de la tercera inyección.
• La primera inyección puede administrarse a partir de las 6 semanas de edad.
• Le informarán de cuándo su hijo debe volver para las próximas inyecciones.
Lactantes prematuros (nacidos después de la semana 27 y antes de la semana 37 de gestación).
Su hijo (desde los 2 meses a los 6 meses de edad) recibirá tres inyecciones con un intervalo de al menos un mes de diferencia entre cada dosis. Su hijo recibirá una inyección adicional (de recuerdo) al menos seis meses después de la última inyección.
Los lactantes de 7 a 11 meses de edad recibirán 2 inyecciones. Cada inyección se administrará con al menos un mes de diferencia. Se administrará una tercera inyección durante el segundo año de vida con al menos dos meses de diferencia.
Los niños de 12 meses a 5 años recibirán 2 inyecciones. Cada inyección se administrará con al menos, dos meses de diferencia.
Si su hijo se pierde una inyección
Si su hijo no recibe una de las inyecciones, es importante que usted pida otra cita. De esta forma usted y su médico podrán hablar acerca de los pasos que han de darse para proteger a su hijo.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran. Los siguientes efectos adversos pueden ocurrir con este medicamento:
Muy frecuentes (pueden ocurrir con más de 1 de cada 10 dosis de la vacuna)
• dolor, enrojecimiento e hinchazón del lugar donde se administra la inyección
• temperatura alta, de 38 °C o superior (fiebre)
• somnolencia
• irritabilidad
• pérdida de apetito
Frecuentes (pueden ocurrir hasta con 1 de cada 10 dosis de la vacuna)
• endurecimiento del lugar donde se administra la inyección
Poco frecuentes (pueden ocurrir hasta con 1 de cada 100 dosis de la vacuna)
• picor, aparición de coágulos sanguíneos, sangrado o pequeños bultos donde se administra la inyección
• náuseas, diarrea o malestar (vómitos)
• llanto no habitual
• paradas temporales de la respiración (apnea) si su hijo ha nacido prematuro (a las 28 semanas de gestación o antes)
• dolor de cabeza
• erupción en la piel
• inflamación difusa en la extremidad inyectada, afectando a veces a la articulación adyacente
• urticaria
Raras (pueden ocurrir hasta con 1 de cada 1.000 dosis de la vacuna)
• convulsiones sin temperatura elevada o debidas a temperatura elevada (fiebre)
• reacciones alérgicas tales como alergias en la piel
• colapso (flacidez muscular repentina), periodos de inconsciencia o pérdida de conocimiento y palidez o cambio de color de la piel a un tono azulado.
Muy raras (pueden ocurrir hasta con 1 de cada 10.000 dosis de la vacuna)
• Reacciones alérgicas graves que se pueden reconocer por:
- erupciones abultadas que pican (habones)
- hinchazón, a veces de la cara o de la boca (angioedema), causando dificultad para respirar
- colapso
Estas reacciones generalmente se producirán antes de salir de la consulta del médico. En cualquier caso, si su hijo tiene alguno de estos síntomas contacte urgentemente con un médico.
• Enfermedad de Kawasaki (algunos de los signos graves de la enfermedad son: fiebre, erupción de la piel, hinchazón de los ganglios linfáticos, inflamación y erupción de las membranas mucosas de la boca y la garganta).
Las dosis de recuerdo de Synflorix pueden aumentar el riesgo de efectos adversos.
Para niños mayores de 12 meses, el riesgo de dolor en el lugar de la inyección puede incrementarse con la edad.
En niños muy prematuros (nacidos a las 28 semanas de gestación o antes) durante los 2-3 días posteriores a la vacunación, los periodos entre respiraciones pueden ser más largos de lo normal.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Anexo V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Synflorix
Mantener este medicamento fuera de la vista y del alcance de los niños.
• No utilice este medicamento después de la fecha de caducidad que aparece en el envase. La fecha de caducidad es el último día del mes que se indica.
• Conservar en nevera (entre 2 °C y 8 °C).
• Conservar en el embalaje original para protegerlo de la luz.
• No congelar.
No tire los medicamentos por los desagües ni a la basura. Pregunte a su farmacéutico dónde tirar los medicamentos que ya no utiliza. De esta forma ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de Synflorix
• Los principios activos son:
Una dosis de 0,5 ml contiene:
Polisacárido del serotipo neumocócico 11,2 Polisacárido del serotipo neumocócico 41,2 Polisacárido del serotipo neumocócico 51,2 Polisacárido del serotipo neumocócico 6B1,2 Polisacárido del serotipo neumocócico 7F1,2 Polisacárido del serotipo neumocócico 9V1,2 Polisacárido del serotipo neumocócico 141,2
1 microgramo 3 microgramos 1 microgramo 1 microgramo 1 microgramo 1 microgramo 1 microgramo
Polisacárido del serotipo neumocócico 18C1,3 3 microgramos
Polisacárido del serotipo neumocócico 19F1,4 3 microgramos
Polisacárido del serotipo neumocócico 23F1,2 1 microgramo
1 adsorbido en fosfato de aluminio 0,5 miligramos de Al3+
2 conjugado con proteína D (derivada de Haemophilus influenzae no tipable) como proteína
transportadora 9-16 microgramos
3 conjugado con toxoide tetánico como proteína transportadora 5-10 microgramos
4 conjugado con toxoide diftérico como proteína transportadora 3-6 microgramos
• Los demás componentes son: cloruro de sodio y agua para preparaciones inyectables Aspecto del producto y contenido del envase
• Suspensión inyectable en jeringa precargada
• Synflorix es una suspensión turbia de color blanco.
• Synflorix está disponible en envases de 1, 10 ó 50 jeringas precargadas con o sin agujas.
• Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización y responsable de la fabricación
GlaxoSmithKline Biologicals s.a.
Rue de l’Institut 89 B-1330 Rixensart Bélgica
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
Etarapna
TaaKCoCMHTKaaHH EOOfl Tea.: + 359 2 953 10 34
Ceská republika
GlaxoSmithKline s.r.o.
Tel: + 420 2 22 00 11 11 cz.info@gsk.com
Danmark
GlaxoSmithKline Pharma A/S Tlf: + 45 36 35 91 00 dk-info@gsk.com
Deutschland
GlaxoSmithKline GmbH & Co. KG Tel: + 49 (0)89 360448701 produkt.info@gsk.com
Eesti
Lietuva
GlaxoSmithKline Lietuva UAB Tel: +370 5 264 90 00 info.lt@gsk.com
Luxembourg/Luxemburg
GlaxoSmithKline Pharmaceuticals s.a./n.v. Tél/Tel: + 32 10 85 52 00
Magyarország
GlaxoSmithKline Kft.
Tel.: + 36-1-2255300
GlaxoSmithKline Eesti OÜ Tel: +372 667 6900 estonia@gsk.com
EXlába
GlaxoSmithKline A.E.B.E T@: + 30 210 68 82 100
España
GlaxoSmithKline, S.A.
Tel: + 34 902 202 700 es-ci@gsk.com
France
Laboratoire GlaxoSmithKline Tél: + 33 (0) 1 39 17 84 44 diam@gsk.com
Hrvatska
GlaxoSmithKline d.o.o.
Tel.: + 385 (0)1 6051999
Ireland
GlaxoSmithKline (Ireland) Ltd Tel: + 353 (0)1 495 5000
Kúrcpog
GlaxoSmithKline (Cyprus) Ltd T@: + 357 22 39 70 00 gskcyprus@gsk.com
Latvija
GlaxoSmithKline Latvia SIA Tel: + 371 67312687 lv-epasts@gsk.com
Fecha de la última revisión de este prospecto: Otras fuentes de información
GlaxoSmithKline AS Tlf: + 47 22 70 20 00 firmapost@gsk.no
Osterreich
GlaxoSmithKline Pharma GmbH. Tel: + 43 1 970 75-0 at.info@gsk.com
Polska
GSK Services Sp. z o.o.
Tel.: + 48 (22) 576 9000
Portugal
GlaxoSmithKline - Produtos Farmacéuticos, Lda.
Tel: + 351 21 412 95 00
Romania
GlaxoSmithKline (GSK) SRL Tel: +40 (0)21 3028 208
Slovenija
GlaxoSmithKline d.o.o.
Tel: + 386 (0) 1 280 25 00 medical.x.si@gsk.com
Slovenská republika
GlaxoSmithKline Slovakia s.r.o.
Tel: + 421 (0)2 48 26 11 11 recepcia.sk@gsk.com
Suomi/Finland
GlaxoSmithKline Oy Puh/Tel: + 358 10 30 30 30 Finland.tuoteinfo@gsk.com
Sverige
GlaxoSmithKline AB Tel: + 46 (0)8 638 93 00 info.produkt@gsk.com
United Kingdom
GlaxoSmithKline UK Tel: +44 (0)800 221 441 customercontactuk@gsk.com
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu/.
En la página web de la Agencia Europea de Medicamentos puede encontrarse este prospecto en todas las lenguas de la Unión Europea/Espacio Económico Europeo.
Esta información está destinada únicamente a profesionales del sector sanitario:
Durante el almacenamiento de la jeringa precargada puede observarse un depósito fino de color blanco con un sobrenadante claro transparente. Esto no constituye un signo de deterioro.
Antes de la administración, se debe inspeccionar visualmente el contenido de la jeringa precargada tanto antes como después de agitar para observar si existe alguna sustancia extraña y/o variación del aspecto físico. En caso de que se observe alguna de estas circunstancias, desechar la vacuna.
Se debe dejar que la vacuna alcance la temperatura ambiente antes de su uso.
La vacuna debe agitarse bien antes de su uso.
La vacuna está destinada únicamente para su administración por vía intramuscular. No administrar por vía intravascular.
Si se administra Synflorix junto con otras vacunas, deben usarse diferentes lugares de inyección. Synflorix no se debe mezclar con otras vacunas.
Instrucciones para la administración de la vacuna que se presenta en una jeringa precargada
/
Émbolo de la jeringa
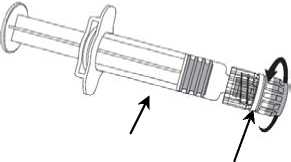
Cuerpo de la jeringa
1.
Desenrosque la tapa de la jeringa girándola en sentido contrario a las agujas del reloj sujetando el cuerpo de la jeringa con la otra mano (evite sostener el émbolo de la jeringa).
Tapa de la jeringa
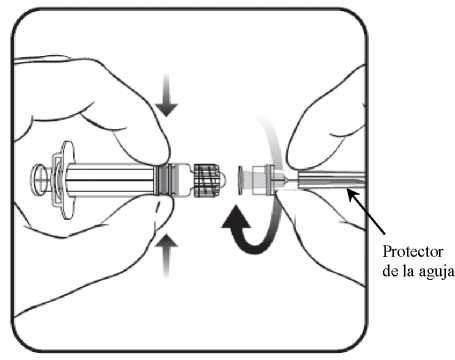
2. Inserte la aguj a en la j eringa
y a continuación, gírela en el sentido de las agujas del reloj hasta que se bloquee.
3. Retire el protector de la aguja; en algunas ocasiones puede resultar un poco difícil.
La eliminación del producto no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
Prospecto: Información para el usuario
Synflorix suspensión inyectable
Vacuna conjugada antineumocócica de polisacáridos (adsorbida)
Lea todo el prospecto detenidamente antes de que su hijo reciba esta vacuna, porque contiene información importante para usted.
• Conserve este prospecto, ya que puede tener que volver a leerlo.
• Si tiene alguna duda, consulte a su médico o farmacéutico.
• Esta vacuna se le ha recetado solamente a su hijo y no debe dársela a otras personas.
• Si su hijo experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto:
1. Qué es Synflorix y para qué se utiliza
2. Qué necesita saber antes de que su hijo reciba Synflorix
3. Cómo se administra Synflorix
4. Posibles efectos adversos
5 Conservación de Synflorix
6. Contenido del envase e información adicional
1. Qué es Synflorix y para qué se utiliza
Synflorix es una vacuna conjugada antineumocócica. Su médico o enfermera inyectarán esta vacuna a su hijo.
Se utiliza para ayudar a proteger a su hijo a partir de las 6 semanas hasta los 5 años de edad frente a:
una bacteria llamada “Streptococcus pneumoniae”. Esta bacteria puede causar enfermedades graves incluyendo meningitis, sepsis y bacteriemia (bacterias en el torrente sanguíneo), así como también infección de oído o neumonía.
Cómo funciona Synflorix
Synflorix ayuda a que el organismo genere sus propios anticuerpos. Los anticuerpos forman una parte del sistema inmune que protegerá a su hijo de estas enfermedades.
2. Qué necesita saber antes de que su hijo reciba Synflorix No se debe administrar Synflorix si:
• su hijo ha tenido anteriormente una reacción alérgica (es hipersensible) al principio activo, o a cualquiera de los demás componentes de esta vacuna (enumerados en la Sección 6).
Los signos de una reacción alérgica pueden incluir erupción de la piel con picor, dificultad para respirar e hinchazón de la cara o la lengua.
• su hijo tiene una infección grave con fiebre alta (superior a 38 °C). Si esto le ocurre a su hijo debe retrasarse la vacunación hasta que se sienta mejor. Una infección de poca importancia, como un resfriado no debe ser un problema para la vacunación. No obstante, consúltelo antes con su médico.
No se debe administrar Synflorix si su hijo se encuentra en cualquiera de las circunstancias anteriores. Si no está seguro, consúltelo con su médico o farmacéutico antes de que a su hijo se le administre Synflorix.
Advertencias y precauciones:
Consulte a su médico o farmacéutico antes de empezar a usar esta vacuna si:
• su hijo tiene algún problema de coagulación o se hace cardenales con facilidad.
En niños a partir de 2 años de edad, antes o después de cualquier inyección podría producirse un desmayo, por lo que debe informar a su médico o enfermera si su hijo se ha desmayado en anteriores ocasiones tras la administración de una inyección.
Al igual que todas las vacunas, Synflorix puede no proteger completamente a todos los niños vacunados.
Synflorix sólo protegerá frente a las infecciones causadas por las bacterias para las que se ha desarrollado la vacuna.
Los niños con un sistema inmune debilitado (por ejemplo debido a una infección por el VIH) o a una terapia inmunosupresora) podrían no beneficiarse completamente de Synflorix.
Si no está seguro, hable con su médico o farmacéutico antes de usar Synflorix.
Uso de Synflorix con otros medicamentos
Informe a su médico o farmacéutico si su hijo está recibiendo, ha recibido recientemente o podría tener que recibir otros medicamentos, incluso los adquiridos sin receta, o si le han administrado recientemente cualquier otra vacuna. Puede que Synflorix no funcione tan bien si su hijo está tomando medicamentos que afecten al sistema inmune para combatir una infección.
Synflorix se puede administrar al mismo tiempo que otras vacunas infantiles, como vacunas frente a difteria, tétanos, pertussis (tos ferina), Haemophilus influenzae tipo b, polio oral o inactivada, hepatitis B, triple vírica (paperas, rubéola y sarampión), varicela, vacunas orales antirrotavirus y vacunas conjugadas frente al meningococo del serogrupo C y de los serogrupos A, C, W-135 e Y. Se utilizará un lugar de inyección diferente para cada una de las vacunas.
Su médico podría recomendarle que dé a su hijo un medicamento que baje la fiebre (como paracetamol) antes o inmediatamente después de recibir Synflorix. Esto puede ayudar a disminuir alguno de los efectos adversos (reacciones febriles) de Synflorix. Sin embargo, si su hijo ha recibido paracetamol antes o inmediatamente después de recibir Synflorix, los niveles de anticuerpos obtenidos podrían reducirse ligeramente. Se desconoce si la reducción de los niveles de anticuerpos tiene impacto en la protección frente a las enfermedades neumocócicas.
Synflorix contiene sodio
Este medicamento contiene menos de 23 mg (1 mmol) de sodio por dosis, por lo que se considera esencialmente “exento de sodio”.
3. Cómo se administra Synflorix Cómo usar la vacuna
Synflorix se inyecta siempre en un músculo. Generalmente en el muslo o en la parte superior del brazo.
Cuánto se usa
Generalmente su hijo (desde las 6 semanas a los 6 meses de edad) recibirá un ciclo de 4 inyecciones de acuerdo con las recomendaciones oficiales pero el profesional sanitario puede emplear un esquema de vacunación diferente. Es importante seguir las instrucciones del médico o de la enfermera para completar el ciclo de inyecciones.
• Cada inyección se administrará al menos con un mes de diferencia, excepto la última, que se administrará al menos seis meses después de la tercera inyección.
• La primera inyección puede administrarse a partir de las 6 semanas de edad.
• Le informarán de cuándo su hijo debe volver para las próximas inyecciones.
Lactantes prematuros (nacidos después de la semana 27 y antes de la semana 37 de gestación).
Su hijo (desde los 2 meses a los 6 meses de edad) recibirá tres inyecciones con un intervalo de al menos un mes de diferencia entre cada dosis. Su hijo recibirá una inyección adicional (de recuerdo) al menos seis meses después de la última inyección.
Los lactantes de 7 a 11 meses de edad recibirán 2 inyecciones. Cada inyección se administrará con al menos un mes de diferencia. Se administrará una tercera inyección durante el segundo año de vida con al menos dos meses de diferencia.
Los niños de 12 meses a 5 años recibirán 2 inyecciones. Cada inyección se administrará con al menos, dos meses de diferencia.
Si su hijo se pierde una inyección
Si su hijo no recibe una de las inyecciones, es importante que usted pida otra cita. De esta forma usted y su médico podrán hablar acerca de los pasos que han de darse para proteger a su hijo.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran. Los siguientes efectos adversos pueden ocurrir con este medicamento:
Muy frecuentes (pueden ocurrir con más de 1 de cada 10 dosis de la vacuna)
• dolor, enrojecimiento e hinchazón del lugar donde se administra la inyección
• temperatura alta, de 38 °C o superior (fiebre)
• somnolencia
• irritabilidad
• pérdida de apetito
Frecuentes (pueden ocurrir hasta con 1 de cada 10 dosis de la vacuna)
• endurecimiento del lugar donde se administra la inyección.
Poco frecuentes (pueden ocurrir hasta con 1 de cada 100 dosis de la vacuna)
• picor, aparición de coágulos sanguíneos, sangrado o pequeños bultos donde se administra la inyección
• náuseas, diarrea o malestar (vómitos)
• llanto no habitual
• paradas temporales de la respiración (apnea) si su hijo ha nacido prematuro (a las 28 semanas de gestación o antes)
• dolor de cabeza
• erupción en la piel
• inflamación difusa en la extremidad inyectada, afectando a veces a la articulación adyacente
• urticaria
Raras (pueden ocurrir hasta con 1 de cada 1.000 dosis de la vacuna)
• convulsiones sin temperatura elevada o debidas a temperatura elevada (fiebre)
• reacciones alérgicas tales como alergias en la piel
• colapso (flacidez muscular repentina), periodos de inconsciencia o pérdida de conocimiento y palidez o cambio de color de la piel a un tono azulado.
Muy raras (pueden ocurrir hasta con 1 de cada 10.000 dosis de la vacuna)
• Reacciones alérgicas graves que se pueden reconocer por:
- erupciones abultadas que pican (habones)
- hinchazón, a veces de la cara o de la boca (angioedema), causando dificultad para respirar
- colapso
Estas reacciones generalmente se producirán antes de salir de la consulta del médico. En cualquier caso, si su hijo tiene alguno de estos síntomas contacte urgentemente con un médico.
• Enfermedad de Kawasaki (algunos de los signos graves de la enfermedad son: fiebre, erupción de la piel, hinchazón de los ganglios linfáticos, inflamación y erupción de las membranas mucosas de la boca y la garganta).
Las dosis de recuerdo de Synflorix pueden aumentar el riesgo de efectos adversos.
Para niños mayores de 2 años, el riesgo de dolor en el lugar de la inyección puede incrementarse con la edad.
En niños muy prematuros (nacidos a las 28 semanas de gestación o antes) durante los 2-3 días posteriores a la vacunación, los periodos entre respiraciones pueden ser más largos de lo normal.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Anexo V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Synflorix
Mantener este medicamento fuera de la vista y del alcance de los niños.
• No utilice este medicamento después de la fecha de caducidad que aparece en el envase. La fecha de caducidad es el último día del mes que se indica.
• Conservar en nevera (entre 2 °C y 8 °C).
• Conservar en el embalaje original para protegerlo de la luz.
• No congelar.
No tire los medicamentos por los desagües ni a la basura. Pregunte a su farmacéutico dónde tirar los medicamentos que ya no utiliza. De esta forma ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de Synflorix
• Los principios activos son:
Una dosis de 0,5 ml contiene:
Polisacárido del serotipo neumocócico 11,2 Polisacárido del serotipo neumocócico 41,2 Polisacárido del serotipo neumocócico 51,2 Polisacárido del serotipo neumocócico 6B1,2 Polisacárido del serotipo neumocócico 7F1,2 Polisacárido del serotipo neumocócico 9V1,2 Polisacárido del serotipo neumocócico 141,2
1 microgramo 3 microgramos 1 microgramo 1 microgramo 1 microgramo 1 microgramo 1 microgramo
Polisacárido del serotipo neumocócico 18C1,3 3 microgramos
Polisacárido del serotipo neumocócico 19F1,4 3 microgramos
Polisacárido del serotipo neumocócico 23F1,2 1 microgramo
1 adsorbido en fosfato de aluminio 0,5 miligramos de Al3+
2 conjugado con proteína D (derivada de Haemophilus influenzae no tipable) como proteína
transportadora 9-16 microgramos
3 conjugado con toxoide tetánico como proteína transportadora 5-10 microgramos
4 conjugado con toxoide diftérico como proteína transportadora 3-6 microgramos
• Los demás componentes son: cloruro de sodio y agua para preparaciones inyectables Aspecto del producto y contenido del envase
• Suspensión inyectable
• Synflorix es una suspensión turbia de color blanco.
• Synflorix está disponible en envases de 1, 10 ó 100 viales.
• Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización y responsable de la fabricación
GlaxoSmithKline Biologicals s.a.
Rue de l’Institut 89 B-1330 Rixensart Bélgica
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
Etarapna
TaaKCoCMHTKaaHH EOOfl Tea.: + 359 2 953 10 34
Ceská republika
GlaxoSmithKline s.r.o.
Tel: + 420 2 22 00 11 11 cz.info@gsk.com
Danmark
GlaxoSmithKline Pharma A/S Tlf: + 45 36 35 91 00 dk-info@gsk.com
Deutschland
GlaxoSmithKline GmbH & Co. KG Tel: + 49 (0)89 360448701 produkt.info@gsk.com
Eesti
Lietuva
GlaxoSmithKline Lietuva UAB Tel: +370 5 264 90 00 info.lt@gsk.com
Luxembourg/Luxemburg
GlaxoSmithKline Pharmaceuticals s.a./n.v. Tél/Tel: + 32 10 85 52 00
Magyarország
GlaxoSmithKline Kft.
Tel.: + 36-1-2255300
GlaxoSmithKline Eesti OÜ Tel: +372 667 6900 estonia@gsk.com
EXlába
GlaxoSmithKline A.E.B.E T@: + 30 210 68 82 100
España
GlaxoSmithKline, S.A.
Tel: + 34 902 202 700 es-ci@gsk.com
France
Laboratoire GlaxoSmithKline Tél: + 33 (0) 1 39 17 84 44 diam@gsk.com
Hrvatska
GlaxoSmithKline d.o.o.
Tel.: + 385 (0)1 6051999
Ireland
GlaxoSmithKline (Ireland) Ltd Tel: + 353 (0)1 495 5000
Kúrcpog
GlaxoSmithKline (Cyprus) Ltd T@: + 357 22 39 70 00 gskcyprus@gsk.com
Latvija
GlaxoSmithKline Latvia SIA Tel: + 371 67312687 lv-epasts@gsk.com
Fecha de la última revisión de este prospecto: Otras fuentes de información
GlaxoSmithKline AS Tlf: + 47 22 70 20 00 firmapost@gsk.no
Osterreich
GlaxoSmithKline Pharma GmbH. Tel: + 43 1 970 75-0 at.info@gsk.com
Polska
GSK Services Sp. z o.o.
Tel.: + 48 (22) 576 9000
Portugal
GlaxoSmithKline - Produtos Farmacéuticos, Lda.
Tel: + 351 21 412 95 00
Romania
GlaxoSmithKline (GSK) SRL Tel: +40 (0)21 3028 208
Slovenija
GlaxoSmithKline d.o.o.
Tel: + 386 (0) 1 280 25 00 medical.x.si@gsk.com
Slovenská republika
GlaxoSmithKline Slovakia s.r.o.
Tel: + 421 (0)2 48 26 11 11 recepcia.sk@gsk.com
Suomi/Finland
GlaxoSmithKline Oy Puh/Tel: + 358 10 30 30 30 Finland.tuoteinfo@gsk.com
Sverige
GlaxoSmithKline AB Tel: + 46 (0)8 638 93 00 info.produkt@gsk.com
United Kingdom
GlaxoSmithKline UK Tel: +44 (0)800 221 441 customercontactuk@gsk.com
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu/
En la página web de la Agencia Europea de Medicamentos puede encontrarse este prospecto en todas las lenguas de la Unión Europea/Espacio Económico Europeo.
Esta información está destinada únicamente a profesionales del sector sanitario:
Durante el almacenamiento del vial puede observarse un depósito fino de color blanco con un sobrenadante claro transparente. Esto no constituye un signo de deterioro.
Antes de la administración, se debe inspeccionar visualmente el contenido del vial tanto antes como después de agitar para observar si existe alguna sustancia extraña y/o variación del aspecto físico. En caso de que se observe alguna de estas circunstancias, desechar la vacuna.
Se debe dejar que la vacuna alcance la temperatura ambiente antes de su uso.
La vacuna debe agitarse bien antes de su uso.
La vacuna está destinada únicamente para su administración por vía intramuscular. No administrar por vía intravascular.
Si se administra Synflorix junto con otras vacunas, deben usarse diferentes lugares de inyección.
Synflorix no se debe mezclar con otras vacunas. En caso de extraerse una dosis de vacuna con una jeringa inyectable, la aguja empleada para la extracción se debe sustituir por una aguja adecuada para su administración intramuscular.
La eliminación del producto no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
Prospecto: Información para el usuario
Synflorix suspensión inyectable en envase multidosis
Vacuna conjugada antineumocócica de polisacáridos (adsorbida)
Lea todo el prospecto detenidamente antes de que su hijo reciba esta vacuna, porque contiene información importante para usted.
• Conserve este prospecto, ya que puede tener que volver a leerlo.
• Si tiene alguna duda, consulte a su médico o farmacéutico.
• Esta vacuna se le ha recetado solamente a su hijo y no debe dársela a otras personas.
• Si su hijo experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto:
1. Qué es Synflorix y para qué se utiliza
2. Qué necesita saber antes de que su hijo reciba Synflorix
3. Cómo se administra Synflorix
4. Posibles efectos adversos
5 Conservación de Synflorix
6. Contenido del envase e información adicional
1. Qué es Synflorix y para qué se utiliza
Synflorix es una vacuna conjugada antineumocócica. Su médico o enfermera inyectarán esta vacuna a su hijo.
Se utiliza para ayudar a proteger a su hijo a partir de las 6 semanas hasta los 5 años de edad frente a:
una bacteria llamada “Streptococcus pneumoniae”. Esta bacteria puede causar enfermedades graves incluyendo meningitis, sepsis y bacteriemia (bacterias en el torrente sanguíneo), así como también infección de oído o neumonía.
Cómo funciona Synflorix
Synflorix ayuda a que el organismo genere sus propios anticuerpos. Los anticuerpos forman una parte del sistema inmune que protegerá a su hijo de estas enfermedades.
2. Qué necesita saber antes de que su hijo reciba Synflorix No se debe administrar Synflorix si:
• su hijo ha tenido anteriormente una reacción alérgica (es hipersensible) al principio activo, o a cualquiera de los demás componentes de esta vacuna (enumerados en la Sección 6).
Los signos de una reacción alérgica pueden incluir erupción de la piel con picor, dificultad para respirar e hinchazón de la cara o lengua.
• su hijo tiene una infección grave con fiebre alta (superior a 38° C). Si esto le ocurre a su hijo debe retrasarse la vacunación hasta que se sienta mejor. Una infección de poca importancia, como un resfriado no debe ser un problema para la vacunación. No obstante, consúltelo antes con su médico.
No se debe administrar Synflorix si su hijo se encuentra en cualquiera de las circunstancias anteriores. Si no está seguro, consúltelo con su médico o farmacéutico antes de que a su hijo se le administre Synflorix.
Advertencias y precauciones:
Consulte a su médico o farmacéutico antes de empezar a usar esta vacuna si:
• su hijo tiene algún problema de coagulación o se hace cardenales con facilidad.
En niños a partir de 2 años de edad, antes o después de cualquier inyección podría producirse un desmayo, por lo que debe informar a su médico o enfermera si su hijo se ha desmayado en anteriores ocasiones tras la administración de una inyección.
Al igual que todas las vacunas, Synflorix puede no proteger completamente a todos los niños vacunados.
Synflorix sólo protegerá frente a las infecciones causadas por las bacterias para las que se ha desarrollado la vacuna.
Los niños con un sistema inmune debilitado (por ejemplo debido a una infección por el VIH) o una terapia inmunosupresora) podrían no beneficiarse completamente de Synflorix.
Si no está seguro, hable con su médico o farmacéutico antes de usar Synflorix.
Uso de Synflorix con otros medicamentos
Informe a su médico o farmacéutico si su hijo está recibiendo, ha recibido recientemente o podría tener que recibir otros medicamentos, incluso los adquiridos sin receta, o si le han administrado recientemente cualquier otra vacuna. Puede que Synflorix no funcione tan bien si su hijo está tomando medicamentos que afecten al sistema inmune para combatir una infección.
Synflorix se puede administrar al mismo tiempo que otras vacunas infantiles, como vacunas frente a difteria, tétanos, pertussis (tos ferina), Haemophilus influenzae tipo b, polio oral o inactivada, hepatitis B, triple vírica (paperas, rubéola y sarampión), varicela, vacunas orales antirrotavirus y vacunas conjugadas frente al meningococo del serogrupo C y de los serogrupos A, C, W-135 e Y. Se utilizará un lugar de inyección diferente para cada una de las vacunas.
Su médico podría recomendarle que dé a su hijo un medicamento que baje la fiebre (como paracetamol) antes o inmediatamente después de recibir Synflorix. Esto puede ayudar a disminuir alguno de los efectos adversos (reacciones febriles) de Synflorix. Sin embargo, si su hijo ha recibido paracetamol antes o inmediatamente después de recibir Synflorix, los niveles de anticuerpos obtenidos podrían reducirse ligeramente. Se desconoce si la reducción de los niveles de anticuerpos tiene impacto en la protección frente a las enfermedades neumocócicas.
Synflorix contiene sodio
Este medicamento contiene menos de 23 mg (1 mmol) de sodio por dosis, por lo que se considera esencialmente “exento de sodio”.
3. Cómo se administra Synflorix Cómo usar la vacuna
Synflorix se inyecta siempre en un músculo. Generalmente en el muslo o en la parte superior del brazo.
Cuánto se usa
Generalmente su hijo (desde las 6 semanas a los 6 meses de edad) recibirá un ciclo de 4 inyecciones de acuerdo con las recomendaciones oficiales pero el profesional sanitario puede emplear un esquema de vacunación diferente. Es importante seguir las instrucciones del médico o de la enfermera para completar el ciclo de inyecciones.
• Cada inyección se administrará al menos con un mes de diferencia, excepto la última, que se administrará al menos seis meses después de la tercera inyección.
• La primera inyección puede administrarse a partir de las 6 semanas de edad.
• Le informarán de cuándo su hijo debe volver para las su próximas inyecciones.
Lactantes prematuros (nacidos después de la semana 27 y antes de la semana 37 de gestación).
Su hijo (desde los 2 meses a los 6 meses de edad) recibirá tres inyecciones con un intervalo de al menos un mes de diferencia entre cada dosis. Su hijo recibirá una inyección adicional (de recuerdo) al menos seis meses después de la última inyección.
Los lactantes de 7 a 11 meses de edad recibirán 2 inyecciones. Cada inyección se administrará con al menos un mes de diferencia. Se administrará una tercera inyección durante el segundo año de vida con al menos dos meses de diferencia.
Los niños de 12 meses a 5 años recibirán 2 inyecciones. Cada inyección se administrará con al menos, dos meses de diferencia.
Si su hijo se pierde una inyección
Si su hijo no recibe una de las inyecciones, es importante que usted pida otra cita. De esta forma usted y su médico podrán hablar acerca de los pasos que han de darse para proteger a su hijo.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran. Los siguientes efectos adversos pueden ocurrir con este medicamento:
Muy frecuentes (pueden ocurrir con más de 1 de cada 10 dosis de la vacuna)
• dolor, enrojecimiento e hinchazón del lugar donde se administra la inyección
• temperatura alta, de 38° C o superior (fiebre)
• somnolencia
• irritabilidad
• pérdida de apetito
Frecuentes (pueden ocurrir hasta con 1 de cada 10 dosis de la vacuna)
• endurecimiento del lugar donde se administra la inyección.
Poco frecuentes (pueden ocurrir hasta con 1 de cada 100 dosis de la vacuna)
• picor, aparición de coágulos sanguíneos, sangrado o pequeños bultos donde se administra la inyección
• náuseas, diarrea o malestar (vómitos)
• llanto no habitual
• paradas temporales de la respiración (apnea) si su hijo ha nacido prematuro (a las 28 semanas de gestación o antes)
• dolor de cabeza
• erupción en la piel
• inflamación difusa en la extremidad inyectada, afectando a veces a la articulación adyacente
• urticaria
Raras (pueden ocurrir hasta con 1 de cada 1.000 dosis de la vacuna)
• convulsiones sin temperatura elevada o debidas a temperatura elevada (fiebre)
• reacciones alérgicas tales como alergias en la piel
• colapso (flacidez muscular repentina), periodos de inconsciencia o pérdida de conocimiento y palidez o cambio de color de la piel a un tono azulado.
Muy raras (pueden ocurrir hasta con 1 de cada 10.000 dosis de la vacuna)
• Reacciones alérgicas graves que se pueden reconocer por:
- erupciones abultadas que pican (habones)
- hinchazón, a veces de la cara o de la boca (angioedema), causando dificultad para respirar
- colapso
Estas reacciones generalmente se producirán antes de salir de la consulta del médico. En cualquier caso, si su hijo tiene alguno de estos síntomas contacte urgentemente con un médico.
• Enfermedad de Kawasaki (algunos de los signos graves de la enfermedad son: fiebre, erupción de la piel, hinchazón de los ganglios linfáticos, inflamación y erupción de las membranas mucosas de la boca y la garganta).
Las dosis de recuerdo de Synflorix pueden aumentar el riesgo de efectos adversos.
Para niños mayores de 2 años, el riesgo de dolor en el lugar de la inyección puede incrementarse con la edad.
En niños muy prematuros (nacidos a las 28 semanas de gestación o antes) durante los 2-3 días posteriores a la vacunación, los periodos entre respiraciones pueden ser más largos de lo normal.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Anexo V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Synflorix
Mantener este medicamento fuera de la vista y del alcance de los niños.
• No utilice este medicamento después de la fecha de caducidad que aparece en el envase. La fecha de caducidad es el último día del mes que se indica.
• Conservar en nevera (entre 2 °C y 8 °C).
• Conservar en el embalaje original para protegerlo de la luz.
• No congelar.
No tire los medicamentos por los desagües ni a la basura. Pregunte a su farmacéutico dónde tirar los medicamentos que ya no utiliza. De esta forma ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de Synflorix
• Los principios activos son:
Una dosis de 0,5 ml contiene:
Polisacárido del serotipo neumocócico 11,2 Polisacárido del serotipo neumocócico 41,2 Polisacárido del serotipo neumocócico 51,2 Polisacárido del serotipo neumocócico 6B1,2 Polisacárido del serotipo neumocócico 7F1,2 Polisacárido del serotipo neumocócico 9V1,2
1 microgramo 3 microgramos 1 microgramo 1 microgramo 1 microgramo 1 microgramo
Polisacárido del serotipo neumocócico 141,2 Polisacárido del serotipo neumocócico 18C1,3 Polisacárido del serotipo neumocócico 19F1,4 Polisacárido del serotipo neumocócico 23F1,2
1 microgramo 3 microgramos 3 microgramos 1 microgramo
1 adsorbido en fosfato de aluminio 0,5 miligramos de Al3+
2 conjugado con proteína D (derivada de Haemophilus influenzae no tipable) como proteína
transportadora 9-16 microgramos
3 conjugado con toxoide tetánico como proteína transportadora 5-10 microgramos
4 conjugado con toxoide diftérico como proteína transportadora 3-6 microgramos
• Los demás componentes son: cloruro de sodio y agua para preparaciones inyectables Aspecto del producto y contenido del envase
• Suspensión inyectable en envase multidosis
• Synflorix es una suspensión turbia de color blanco.
• Synflorix está disponible en viales de 2 dosis en envases de 100.
Titular de la autorización de comercialización y responsable de la fabricación
GlaxoSmithKline Biologicals s.a.
Rue de l’Institut 89 B-1330 Rixensart Bélgica
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
Etarapna
TaaKCoCMHTKaaHH EOOfl Tea.: + 359 2 953 10 34
Ceská republika
GlaxoSmithKline s.r.o.
Tel: + 420 2 22 00 11 11 cz.info@gsk.com
Danmark
GlaxoSmithKline Pharma A/S Tlf: + 45 36 35 91 00 dk-info@gsk.com
Deutschland
GlaxoSmithKline GmbH & Co. KG Tel: + 49 (0)89 360448701 produkt.info@gsk.com
Eesti
GlaxoSmithKline Eesti OÜ
Lietuva
GlaxoSmithKline Lietuva UAB Tel: +370 5 264 90 00 info.lt@gsk.com
Luxembourg/Luxemburg
GlaxoSmithKline Pharmaceuticals s.a./n.v. Tél/Tel: + 32 10 85 52 00
Magyarország
GlaxoSmithKline Kft.
Tel.: + 36-1-2255300
España
GlaxoSmithKline, S.A.
Tel: + 34 902 202 700 es-ci@gsk.com
France
Laboratoire GlaxoSmithKline Tél: + 33 (0) 1 39 17 84 44 diam@gsk.com
Hrvatska
GlaxoSmithKline d.o.o.
Tel.: + 385 (0)1 6051999
Ireland
GlaxoSmithKline (Ireland) Ltd Tel: + 353 (0)1 495 5000
Kúrcpog
GlaxoSmithKline (Cyprus) Ltd T@: + 357 22 39 70 00 gskcyprus@gsk.com
Latvija
GlaxoSmithKline Latvia SIA Tel: + 371 67312687 lv-epasts@gsk.com
Fecha de la última revisión de este prospecto: Otras fuentes de información
Tlf: + 47 22 70 20 00 firmapost@gsk.no
Osterreich
GlaxoSmithKline Pharma GmbH. Tel: + 43 1 970 75-0 at.info@gsk.com
Polska
GSK Services Sp. z o.o.
Tel.: + 48 (22) 576 9000
Portugal
GlaxoSmithKline - Produtos Farmacéuticos, Lda.
Tel: + 351 21 412 95 00
Romania
GlaxoSmithKline (GSK) SRL Tel: +40 (0)21 3028 208
Slovenija
GlaxoSmithKline d.o.o.
Tel: + 386 (0) 1 280 25 00 medical.x.si@gsk.com
Slovenská republika
GlaxoSmithKline Slovakia s.r.o.
Tel: + 421 (0)2 48 26 11 11 recepcia.sk@gsk.com
Suomi/Finland
GlaxoSmithKline Oy Puh/Tel: + 358 10 30 30 30 Finland.tuoteinfo@gsk.com
Sverige
GlaxoSmithKline AB Tel: + 46 (0)8 638 93 00 info.produkt@gsk.com
United Kingdom
GlaxoSmithKline UK Tel: +44 (0)800 221 441 customercontactuk@gsk.com
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu/
En la página web de la Agencia Europea de Medicamentos puede encontrarse este prospecto en todas las lenguas de la Unión Europea/Espacio Económico Europeo.
Esta información está destinada únicamente a profesionales del sector sanitario:
Durante el almacenamiento del vial puede observarse un depósito fino de color blanco con un sobrenadante claro transparente. Esto no constituye un signo de deterioro.
Antes de la administración, se debe inspeccionar visualmente el contenido del vial tanto antes como después de agitar para observar si existe alguna sustancia extraña y/o variación del aspecto físico. En caso de que se observe alguna de estas circunstancias, desechar la vacuna.
Se debe dejar que la vacuna alcance la temperatura ambiente antes de su uso.
La vacuna debe agitarse bien antes de su uso. Se recomienda usar inmediatamente después de la primera apertura del vial multidosis. Si no se usa inmediatamente, la vacuna se debe conservar en nevera (entre 2°C y 8°C). Si no se usa en las 6 horas siguientes debe desecharse.
Cuando se emplea un vial multidosis, cada dosis de 0,5 ml debe extraerse utilizando una aguja y una jeringa estériles; se deben tomar precauciones para evitar la contaminación de los componentes.
La vacuna está destinada únicamente para su administración por vía intramuscular. No administrar por vía intravascular.
Si se administra Synflorix junto con otras vacunas, deben usarse diferentes lugares de inyección.
Synflorix no se debe mezclar con otras vacunas. En caso de extraerse una dosis de vacuna con una jeringa inyectable, la aguja empleada para la extracción se debe sustituir por una aguja adecuada para su administración intramuscular.
La eliminación del producto no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
58
4.9 Sobredosis
No se han notificado casos de sobredosis.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: vacunas antineumocócicas, código ATC: J07AL52
Datos epidemiológicos
Los 10 serotipos neumocócicos incluidos en esta vacuna representan los serotipos que causan la mayoría de las enfermedades en Europa cubriendo aproximadamente entre el 56% y el 90% de la enfermedad neumocócica invasora (ENI) en niños menores de cinco años. En este grupo de edad, los serotipos 1, 5 y 7F representan del 3,3% al 24,1% de las ENI dependiendo del país y del periodo de tiempo estudiado.
La neumonía de diferente etiología es una de las principales causas de morbilidad y mortalidad infantil a nivel mundial. En los estudios prospectivos, se estimó que Streptococcuspneumoniae fue el responsable del 30-50% de los casos de neumonía.
La otitis media aguda (OMA) es una enfermedad frecuente en la infancia con diferentes etiologías. Las bacterias pueden ser responsables del 60-70% de los episodios clínicos de OMA. Las causas más frecuentes de OMA bacteriana en el mundo son Streptococcus pneumoniae y Haemophilus influenzae no tipable (NTHi).
Eficacia y efectividad en ensayos clínicos
En un ensayo clínico a gran escala en Finlandia (FinlP) de fase III/IV, doble ciego, aleatorizado, controlado, los niños fueron divididos de forma aleatoria en 4 grupos de acuerdo con las dos pautas de