Sycrest 10 Mg Comprimidos Sublinguales
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
1. NOMBRE DEL MEDICAMENTO
Sycrest 5 mg comprimidos sublinguales
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada comprimido sublingual contiene 5 mg de asenapina (como maleato). Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Comprimido sublingual
Comprimidos sublinguales redondos, de blanco a blanquecino, con "5" grabado en una de las caras.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Sycrest está indicado para el tratamiento de los episodios maníacos de moderados a graves, asociados con el trastorno bipolar I en adultos.
4.2 Posología y forma de administración
Posología
La dosis de inicio recomendada de Sycrest en monoterapia es de 5 mg dos veces al día. Se debe tomar una dosis por la mañana y otra dosis por la noche. La dosis puede aumentarse a 10 mg dos veces al día según la respuesta clínica y la tolerabilidad individual. Ver sección 5.1. Para terapia de combinación, se recomienda una dosis de inicio de 5 mg dos veces al día. Dependiendo de la respuesta clínica y tolerabilidad de cada paciente individual, la dosis puede aumentarse a 10 mg dos veces al día.
Poblaciones especiales
Pacientes de edad avanzada
Sycrest debe ser usado con cuidado en pacientes de edad avanzada. Se dispone de datos limitados de eficacia en pacientes mayores de 65 años. Los datos farmacocinéticos disponibles se describen en la sección 5.2.
Insuficiencia renal
No se requiere ajuste de dosis en pacientes con insuficiencia renal. No hay experiencia con asenapina en pacientes con insuficiencia renal grave que tienen un aclaramiento de creatinina menor a 15 ml/min.
Insuficiencia hepática
No se requiere ajuste de dosis para pacientes con insuficiencia hepática leve. No puede excluirse la posibilidad de un aumento de los niveles de asenapina en plasma en algunos pacientes con insuficiencia hepática moderada (Clasificación B de Child-Pugh) y se aconseja precaución. En sujetos con insuficiencia hepática grave (Clasificación C de Child-Pugh), la exposición a asenapina aumentó 7 veces. Por lo tanto, Sycrest no se recomienda en pacientes con insuficiencia hepática grave.
Población pediátrica
Se realizó un estudio de farmacocinética y otro estudio a corto plazo de la eficacia y seguridad en una población pediátrica (edades comprendidas entre 10 y 17 años) con episodios maníacos o mixtos
asociados a trastorno bipolar tipo I. La seguridad a largo plazo en esta población se analizó en un estudio de ampliación, no controlado, abierto, de 50 semanas. Los datos disponibles actualmente están descritos en las secciones 4.8, 5.1 y 5.2, pero no se puede hacer una recomendación posológica.
Forma de administración
El comprimido no debe extraerse del blíster hasta el momento de la toma. Siempre manipular el comprimido con las manos secas. No se debe presionar el comprimido contra el blíster, ni tampoco cortar o romper el blíster. Despegar la lengüeta coloreada y extraer el comprimido con cuidado. El comprimido no debe aplastarse.
Para asegurar una óptima absorción, el comprimido sublingual de Sycrest debe situarse bajo la lengua y dejar que se disuelva completamente. El comprimido se disolverá en la saliva en unos segundos. Los comprimidos sublinguales de Sycrest no deben masticarse ni tragarse. Se debe evitar comer y beber 10 minutos después de la administración.
Cuando se administre en combinación con otros medicamentos, Sycrest debe tomarse el último.
No se aconseja el tratamiento con Sycrest en pacientes incapaces de cumplir con esta forma de administración, por la baja biodisponibilidad de asenapina ingerida (< 2 % con una formulación oral en comprimidos).
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
Pacientes de edad avanzada con psicosis asociada a demencia
Los pacientes de edad avanzada con psicosis asociada a demencia, tratados con medicamentos antipsicóticos tienen un mayor riesgo de muerte.
Sycrest no está aprobado para el tratamiento de pacientes con psicosis asociada a demencia y no se recomienda su uso en este particular grupo de pacientes.
Síndrome neuroléptico maligno
Con el uso de antipsicóticos, incluyendo asenapina, se ha notificado síndrome neuroléptico maligno (SNM), caracterizado por hipertermia, rigidez muscular, inestabilidad del sistema nervioso autónomo, conciencia alterada y elevados niveles de creatina fosfoquinasa en suero. Otros signos pueden ser mioglobinuria (rabdomiolisis) y fallo renal agudo.
Si un paciente desarrolla signos y síntomas indicativos de SNM se debe suspender el tratamiento con Sycrest.
Convulsiones
En ensayos clínicos, se notificaron esporádicamente casos de convulsiones durante el tratamiento con asenapina. Por lo tanto, Sycrest debe ser utilizado con precaución en pacientes que tengan antecedentes de trastornos convulsivos o que tengan enfermedades asociadas a convulsiones.
Suicidio
La posibilidad de intento de suicidio es inherente a las enfermedades psicóticas y al trastorno bipolar, por lo que el tratamiento de los pacientes de alto riesgo debe acompañarse de una estrecha supervisión.
Hipotensión ortostática
Asenapina puede inducir hipotensión ortostática y síncope, especialmente al inicio del tratamiento, que refleja probablemente sus propiedades antagonistas a1-adrenérgicas. Los pacientes de edad avanzada tienen especialmente un alto riesgo de sufrir hipotensión ortostática (ver sección 4.8). En ensayos clínicos, durante el tratamiento con Sycrest fueron notificados esporádicamente casos de síncope. Sycrest debe ser utilizado con precaución en pacientes de edad avanzada y en pacientes con enfermedad cardiovascular conocida (por ej., fallo cardíaco, infarto de miocardio o isquemia, defectos en la conducción), enfermedad cerebrovascular o enfermedades que predispongan al paciente a la hipotensión (por ej., deshidratación e hipovolemia).
Discinesia tardía
La inducción a discinesia tardía se ha asociado con medicamentos con propiedades antagonistas de los receptores de dopamina. La discinesia tardía se caracteriza por movimientos rítmicos involuntarios, predominantemente de la lengua y/o la cara. En ensayos clínicos, se notificaron esporádicamente casos de discinesia tardía durante el tratamiento con asenapina. La aparición de síntomas extrapiramidales es un factor de riesgo para la discinesia tardía. Si aparecen los signos y síntomas de la discinesia tardía en un paciente en tratamiento con Sycrest, debe considerarse la interrupción del tratamiento.
Hiperprolactinemia
Se observaron aumentos de los niveles de prolactina en algunos pacientes tratados con Sycrest. En ensayos clínicos, fueron notificadas pocas reacciones adversas relacionadas con niveles anormales de prolactina.
Intervalo QT
La prolongación clínicamente relevante del intervalo QT no parece estar asociada con asenapina. Se debe actuar con precaución cuando Sycrest se prescribe a pacientes con enfermedad cardiovascular conocida o historia familiar de prolongación del intervalo QT, y en uso concomitante con otros medicamentos que pueden prolongar el intervalo QT.
Hiperglucemia y diabetes mellitus
Se ha notificado ocasionalmente hiperglucemia o exacerbación de una diabetes preexistente durante el tratamiento con asenapina. La valoración de la relación entre el uso de antipsicóticos atípicos y niveles anormales de glucosa se complica por la posibilidad de un incremento de base del riesgo de diabetes mellitus en pacientes con esquizofrenia o trastorno bipolar y un aumento de la incidencia de diabetes mellitus en la población general. Se aconseja el seguimiento clínico apropiado en pacientes diabéticos y en pacientes con factores de riesgo para el desarrollo de diabetes mellitus.
Disfagia
Se han asociado dismotilidad esofágica y aspiración con el tratamiento antipsicótico. Se notificaron esporádicamente casos de disfagia en pacientes tratados con Sycrest.
Regulación de la temperatura corporal
Se ha atribuido a los medicamentos antipsicóticos un trastorno de la capacidad del cuerpo para reducir la temperatura corporal. A partir de los ensayos clínicos, se concluye que asenapina no parece asociarse a una alteración clínicamente relevante de la regulación de la temperatura corporal. Cuando se prescriba Sycrest, se aconseja la asistencia adecuada en aquellos pacientes que se encuentren en situaciones que pueden contribuir a un aumento de la temperatura corporal, es decir, hacer ejercicio enérgicamente, exposición a calor extremo, que reciban a la vez medicamentos con actividad anticolinérgica o que sean susceptibles de sufrir deshidratación.
Pacientes con insuficiencia hepática grave
La exposición a asenapina aumenta 7 veces en pacientes con insuficiencia hepática grave (Clasificación C de Child-Pugh). Por lo tanto, Sycrest no está recomendado en tales pacientes.
Enfermedad de Parkinson y demencia con cuerpos de Lewy
Los psiquiatras deben valorar los riesgos frente a los beneficios cuando prescriben Sycrest a pacientes con enfermedad de Parkinson o demencia con cuerpos de Lewy (DCL), ya que en ambos grupos se puede incrementar el riesgo de síndrome neuroléptico maligno, así como presentar una mayor sensibilidad a los antipsicóticos. Este aumento de sensibilidad puede manifestarse como confusión, embotamiento, inestabilidad postural con caídas frecuentes, además de síntomas extrapiramidales.
4.5 Interacción con otros medicamentos y otras formas de interacción
Dados los efectos principales de asenapina en el sistema nervioso central (SNC) (ver sección 4.8), se debe utilizar con precaución cuando se toma en combinación con otros medicamentos que actúan a nivel central. Se debe avisar a los pacientes que eviten el alcohol mientras estén tomando Sycrest.
Potencial de que otros medicamentos afecten a Sycrest
Asenapina se elimina fundamentalmente mediante glucuronidación directa por UGT1A4 y metabolismo oxidativo a través las isoenzimas del citocromo P450 (predominantemente CYP1A2). Se estudiaron los efectos potenciales de los inhibidores y un inductor de varias de estas rutas enzimáticas sobre la farmacocinética de asenapina, concretamente fluvoxamina (inhibidor del CYP1A2), paroxetina (inhibidor del CYP2D6), imipramina (inhibidor del CYP1A2/2C19/3A4), cimetidina (inhibidor del CYP3A4/2D6/1A2), carbamacepina (inductor del CYP3A4/1A2) y valproato (inhibidor de las UGT).
Excepto para fluvoxamina, ninguno de los medicamentos que interaccionan causó alteraciones clínicamente relevantes en la farmacocinética de asenapina.
Durante la administración combinada con una dosis única de asenapina 5 mg y fluvoxamina 25 mg dos veces al día se produjo un aumento del 29 % en el área bajo la curva de asenapina. Es de esperar que la dosis terapéutica completa de fluvoxamina produzca un aumento mayor en las concentraciones de asenapina en plasma. Por lo tanto, la administración concomitante de asenapina y fluvoxamina debe abordarse con precaución.
Potencial de que Sycrest afecte a otros medicamentos
Sycrest puede aumentar los efectos de ciertos agentes antihipertensivos a causa de su antagonismo a1-adrenérgico, con posibilidad de inducir hipotensión ortostática (ver sección 4.4).
Asenapina puede antagonizar el efecto de levodopa y de agonistas dopaminérgicos. Si esta combinación se considera necesaria, debe prescribirse la menor dosis eficaz de cada tratamiento.
Estudios in vitro indican que asenapina inhibe débilmente el CYP2D6. Se obtuvieron los siguientes resultados de estudios clínicos de interacciones de medicamentos, que investigaron los efectos de la inhibición del CYP2D6 por asenapina:
- Tras la administración concomitante de dextrometorfano y asenapina en individuos sanos, se midió la proporción de dextrorfano/dextrometorfano (DX/DM) como indicador la actividad del CYP2D6. El tratamiento con asenapina 5 mg dos veces al día resultó en una disminución mínima de la proporción DX/DM a 0,43, lo que es indicativo de la inhibición del CYP2D6. En el mismo estudio, el tratamiento con paroxetina 20 mg al día disminuyó la proporción DX/DM a 0,032.
- En otro estudio, la administración conjunta de una dosis única de 75 mg de imipramina con una dosis única de 5 mg de asenapina no afectó las concentraciones plasmáticas del metabolito desipramina (un sustrato del CYP2D6).
- La administración conjunta de una dosis única de 20 mg de paroxetina (sustrato e inhibidor del CYP2D6) durante el tratamiento con 5 mg de asenapina dos veces al día en 15 individuos varones sanos causó un aumento en la exposición a paroxetina de casi 2 veces.
In vivo, asenapina parece ser como máximo un inhibidor débil del CYP2D6. Sin embargo, la asenapina puede aumentar los efectos inhibitorios de la paroxetina sobre su propio metabolismo.
Por lo tanto, Sycrest en asociación debe administrarse con precaución con medicamentos que sean sustratos e inhibidores del CYP2D6.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No hay suficientes datos sobre el uso de Sycrest en mujeres embarazadas. Asenapina no fue teratogénico en estudios en animales. Se encontraron efectos tóxicos embrionarios y maternales en estudios con animales (ver sección 5.3).
Los recién nacidos expuestos a antipsicóticos (como Sycrest) durante el tercer trimestre de embarazo están en peligro de sufrir reacciones adversas como síntomas extrapiramidales y/o síndromes de abstinencia que pueden variar en gravedad y duración tras la exposición. Se han notificado casos de síntomas de agitación, hipertonía, hipotonía, temblor, somnolencia, dificultad respiratoria o alteraciones alimenticias en recién nacidos. Por consiguiente, se debe vigilar estrechamente a los recién nacidos.
Sycrest no debe usarse durante el embarazo a menos que la situación clínica de la mujer requiera tratamiento con asenapina y solo si el beneficio potencial es mayor que el posible riesgo para el feto.
Lactancia
Asenapina se excretó en la leche de las ratas durante la lactancia. Se desconoce si asenapina o sus metabolitos se excretan en la leche materna. La lactancia debe ser interrumpida durante el tratamiento con Sycrest.
Fertilidad
No se han observado alteraciones de la fertilidad en ensayos preclínicos (ver sección 5.3)
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
Asenapina puede causar somnolencia y sedación. Por la tanto, los pacientes deben ser prevenidos sobre la conducción y el uso de máquinas hasta que estén razonablemente seguros de que Sycrest no les afecta de forma negativa.
4.8 Reacciones adversas
Resumen del perfil de seguridad
Las reacciones adversas al medicamento (RAMs) asociadas al uso de asenapina notificadas con mayor frecuencia en ensayos clínicos fueron somnolencia y ansiedad. Se han notificado reacciones de hipersensibilidad graves. Otras RAMs graves se explican con más detalle en la sección 4.4.
Lista tabulada de reacciones adversas
Las incidencias de RAMs asociadas al tratamiento con asenapina se tabulan a continuación. La tabla se basa en reacciones adversas notificadas durante ensayos clínicos y/o uso post-comercialización. Todas las RAMs se enumeran según el Sistema de Clasificación de Órganos y por frecuencia; muy frecuentes (> 1/10), frecuentes (> 1/100 a < 1/10), poco frecuentes (> 1/1.000 a < 1/100), raras (> 1/10.000 a < 1/1.000) y frecuencia no conocida (no puede estimarse a partir de los datos disponibles). En cada grupo de frecuencia, las RAMs se presentan en orden decreciente de gravedad.
|
Sistema de Clasificación de Órganos |
Muy frecuentes |
Frecuentes |
Poco frecuentes |
Raras |
Frecuencia no conocida |
|
Trastornos de la sangre y del sistema linfático |
Neutropenia | ||||
|
Trastornos del sistema inmunológico |
Reacciones alérgicas |
|
Sistema de Clasificación de Órganos |
Muy frecuentes |
Frecuentes |
Poco frecuentes |
Raras |
Frecuencia no conocida |
|
Trastornos del metabolismo y de la nutrición |
Peso aumentado Apetito aumentado |
Hiperglucemia | |||
|
Trastornos psiquiátricos |
Ansiedad | ||||
|
Trastornos del sistema nervioso |
Somnolencia |
Distonía Acatisia Discinesia Parkinsonismo Sedación Mareo Disgeusia |
Síncope Crisis Trastorno extrapiramidal Disartria Síndrome de la pierna inquieta |
Síndrome neuroléptico maligno | |
|
Trastornos oculares |
Trastorno de la acomodación | ||||
|
Trastornos cardíacos |
Bradicardia sinusal Bloqueo de rama Intervalo QT del electrocardio grama prolongado Taquicardia sinusal | ||||
|
Trastornos vasculares |
Hipotensión ortostática Hipotensión | ||||
|
Trastornos respiratorios, torácicos y mediastínicos |
Embolia pulmonar | ||||
|
Trastornos gastrointestinal es |
Hipoestesia oral Náuseas Hipersecreción salival |
Lengua hinchada Disfagia Glosodinia Parestesia oral Lesiones de la mucosa oral (ulceraciones, vesiculación e inflamación) | |||
|
Trastornos hepatobiliares |
Alanina aminotransferasa elevada | ||||
|
Trastornos músculo esqueléticos y del tejido conjuntivo |
Rigidez muscular |
Rabdomiolisis |
|
Sistema de Clasificación de Órganos |
Muy frecuentes |
Frecuentes |
Poco frecuentes |
Raras |
Frecuencia no conocida |
|
Embarazo, puerperio y enfermedades perinatales |
Síndrome de abstinencia neonatal (ver 4.6) | ||||
|
Trastornos del aparato reproductor y de la mama |
Disfunción sexual Amenorrea |
Ginecomastia Galactorrea | |||
|
Trastornos generales y alteraciones en el lugar de administración |
Fatiga |
Descripción de reacciones adversas seleccionadas
Síntomas extrapiramidales (SEP)
En ensayos clínicos, la incidencia de síntomas extrapiramidales en pacientes tratados con asenapina fue mayor que con placebo (15,4 % frente a 11,0%).
A partir de los ensayos de esquizofrenia a corto plazo (6 semanas) parece haber una relación dosis-respuesta para la acatisia en pacientes tratados con asenapina, y para el parkinsonismo hubo una tendencia al aumento con dosis altas.
Según un estudio farmacocinético reducido, los pacientes pediátricos parecían ser más sensibles a la distonía con la administración inicial de asenapina cuando no se siguió una pauta de aumento gradual de la dosis (ver sección 5.2). La incidencia de distonía en ensayos clínicos pediátricos, utilizando un aumento gradual de la dosis, fue similar a la observada en ensayos con adultos.
Aumento de peso
En los ensayos combinados a corto y largo plazo de esquizofrenia y trastorno bipolar en adultos, el cambio promedio en el peso corporal fue de 0,8 kg. En los ensayos a corto plazo de esquizofrenia, la proporción de sujetos con aumento de peso clínicamente significativo fue del 5,3 % para asenapina comparado con el 2,3 % para placebo (aumento de peso > 7 % desde el inicio al final del estudio). En los ensayos a corto plazo, a dosis flexibles de manía bipolar, la proporción de sujetos con aumento de peso clínicamente significativo fue del 6,5 % para asenapina comparado con el 0,6 % para placebo (aumento de peso > 7 % desde el inicio al final del estudio).
En un ensayo de seguridad y eficacia de 3 semanas, a dosis fijas, aleatorizado y controlado con placebo en pacientes pediátricos de 10 a 17 años con trastorno bipolar I, el cambio promedio en el peso desde el inicio al final del estudio para placebo y asenapina 2,5 mg, 5 mg, y 10 mg, dos veces al día, fue de 0,48, 1,72, 1,62, y 1,44 kg, respectivamente. La proporción de sujetos con un aumento de peso clínicamente significativo (aumento de peso > 7 % desde el inicio al día 21) fue del 14,1 % para asenapina 2,5 mg dos veces al día, del 8,9 % para asenapina 5 mg dos veces al día, y del 9,2 % para asenapina 10 mg dos veces al día, en comparación al 1,1 % para el placebo. En el ensayo de ampliación a largo plazo (50 semanas), un total del 34,8 % de los sujetos experimentó aumento de peso clínicamente significativo (es decir, aumento en el peso corporal > 7 % al final del estudio). La media global (SD) de aumento de peso al final del estudio fue de 3,5 (5,76) kg.
Hipotensión ortostática
La incidencia de hipotensión ortostática en pacientes de edad avanzada fue del 4,1 % comparado con un 0,3 % en la población combinada de los ensayos fase 2-3.
Encimas hepáticas
Se han visto frecuentemente aumentos transitorios y asintomáticos de transaminasas hepáticas, alanino transferasa (ALT) y aspartato transferasa (AST), especialmente al comienzo del tratamiento.
Otros efectos
Se han notificado eventos cerebrovasculares en pacientes tratados con asenapina, pero no hay evidencia de incidencia por encima de lo esperado en adultos entre 18 y 65 años.
Asenapina tiene propiedades anestésicas. Tras la administración pueden producirse hipoestesia oral y parestesia oral, y normalmente se resuelven en 1 hora.
Tras la comercialización se han notificado reacciones graves de hipersensibilidad en pacientes tratados con asenapina, incluyendo reacciones anafilácticas/anafilactoides, angioedema, lengua hinchada e hinchazón de garganta (edema faríngeo).
Población pediátrica
La asenapina no está indicada para el tratamiento de niños y adolescentes menores de 18 años (ver sección 4.2).
Las experiencias adversas clínicamente relevantes identificadas en los ensayos de esquizofrenia y bipolares en pacientes pediátricos fueron similares a las observadas en los ensayos de esquizofrenia y bipolares en adultos.
Las reacciones adversas más frecuentes (> 5 % y al menos el doble de la tasa con placebo) notificadas en pacientes pediátricos con trastorno bipolar I fueron somnolencia, sedación, mareos, disgeusia, hipoestesia oral, parestesia oral, náuseas, aumento del apetito, fatiga y aumento de peso (ver más arriba Aumento de peso).
Las reacciones adversas más frecuentes (una proporción de pacientes > 5 % y al menos el doble que con el placebo) notificadas en pacientes pediátricos con esquizofrenia fueron somnolencia, sedación, acatisia, mareo e hipoestesia oral. Hubo una mayor incidencia estadísticamente significativa de pacientes con aumento de peso > 7 % (desde el inicio hasta el final del estudio) en comparación con placebo (3,1 %) en el caso de Sycrest 2,5 mg dos veces al día (9,5 %) y Sycrest 5 mg dos veces al día (13,1 %).
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Anexo V.
4.9 Sobredosis
En el programa de asenapina fueron notificados pocos casos de sobredosis. Las dosis estimadas notificadas fueron entre 15 y 400 mg. En la mayoría de los casos no se aclaró si asenapina se tomó sublingual. Las reacciones adversas relacionadas con el tratamiento fueron agitación y confusión, acatisia, distonía orofacial, sedación y datos asintomáticos de ECG (bradicardia, complejos supraventriculares, retraso de la conducción intraventricular).
No hay información específica disponible acerca del tratamiento de la sobredosis con Sycrest, ni un antídoto específico. Debe considerarse la posibilidad de implicación de múltiples medicamentos. Es necesaria la monitorización cardiovascular para detectar posibles arritmias, y el control de la sobredosis debe concentrarse en el tratamiento de apoyo que mantiene una adecuada oxigenación y ventilación así como el control de los síntomas. La hipotensión y el colapso circulatorio deben tratarse con las medidas apropiadas, como fluidos intravenosos y/o agentes simpaticomiméticos (no deben utilizarse epinefrina y dopamina, ya que una estimulación beta puede empeorar la hipotensión en el contexto del bloqueo alfa inducido por Sycrest). En caso de síntomas extrapiramidales graves, se deben administrar medicamentos anticolinérgicos, y continuar con una estrecha supervisión y seguimiento hasta que el paciente se recupere.
PROPIEDADES FARMACOLÓGICAS
5.
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: psicolépticos, antipsicóticos, código ATC: N05AH05 Mecanismo de acción
El mecanismo de acción de asenapina no se conoce completamente. Sin embargo, basándose en su farmacología de receptores se considera que la eficacia de asenapina está mediada por la combinación de la actividad antagonista sobre los receptores D2 y 5-HT2A. Las acciones a nivel de otros receptores como el 5-HT1A, 5-HT1B, 5-HT2C, 5-HT6, 5-HT7, D3 y receptores a2-adrenérgicos, también pueden contribuir a los efectos clínicos de asenapina.
Efectos farmacodinámicos
La asenapina tiene alta afinidad por los receptores de serotonina 5-HT1A, 5-HT1B, 5-HT2A, 5-HT2B, 5-HT2C, 5-HT5, 5-HT6 y 5-HT7, por los receptores de dopamina D2, D3, D4 y D1, por los receptores al y a2-adrenérgicos, y por los receptores de histamina H1, y afinidad moderada por los receptores H2. En ensayos in vitro, la asenapina actúa como un antagonista de estos receptores. La asenapina no tiene afinidad apreciable por los receptores colinérgicos muscarínicos.
Eficacia clínica
Eficacia clínica en el trastorno bipolar tipo I
La eficacia de asenapina en el tratamiento de episodios maníacos o mixtos, con o sin características psicóticas, del trastorno bipolar tipo I del manual diagnóstico y estadístico de los trastornos mentales (DSM-IV), se evaluó en dos ensayos de 3 semanas diseñados de forma similar, aleatorizados, doble ciego, a dosis flexibles, controlados con placebo y fármaco activo en monoterapia (olanzapina), en los que participaron 488 y 489 pacientes respectivamente. Todos los pacientes cumplieron los criterios diagnósticos del trastorno bipolar tipo I, episodio maníaco actual (DSM-IV 296.4x) o episodios mixtos (DSM-IV 296.6x) de la 4a Edición del Manual Diagnóstico y Estadístico de los Trastornos Mentales (DSM-IV), y presentaron un resultado > 20 en la Escala de Young para la Valoración de la Manía (Y-MRS) en la fase de cribado y al inicio. Los pacientes con oscilaciones rápidas fueron excluidos de estos estudios. Asenapina demostró una eficacia superior al placebo en la reducción de los síntomas de la manía en 3 semanas. Los puntos estimados [IC del 95 %] para el cambio desde el inicio hasta el final del estudio en la Escala de Young para la Valoración de la Manía (Y -MRS) usando el análisis LOCF en los dos estudios fue el siguiente:
-11,5 [-13,00; -10,0] para asenapina frente a -7,8 [-10,0; -5,6] para el placebo y -10,8 [-12,3; -9,3] para asenapina frente a -5,5 [-7,5; -3,5] para el placebo.
Desde el día 2 se observó una diferencia estadísticamente significativa entre asenapina y placebo.
Los pacientes de los dos ensayos principales de 3 semanas se estudiaron durante 9 semanas más, en un ensayo de ampliación. En este ensayo se demostró el mantenimiento del efecto durante el episodio tras 12 semanas de tratamiento aleatorizado.
La hipótesis principal de eficacia quedó establecida en un ensayo doble ciego, a dosis fijas, de grupos paralelos, controlado con placebo de 3 semanas, en sujetos con trastorno bipolar tipo I con un episodio maníaco o mixto agudo, en el que participaron 367 pacientes, de los cuales 126 recibieron placebo,
122 recibieron asenapina 5 mg dos veces al día (BID), y 119 recibieron asenapina 10 mg BID. Ambas dosis de asenapina (5 mg BID y 10 mg BID) fueron superiores al placebo y mostraron una mejoría estadísticamente significativa en el cambio, desde el estado basal hasta el día 21 en la puntuación total en la Y-MRS, en comparación con el placebo. De acuerdo a un análisis de LOCF, incluyendo todos los pacientes tratados, la diferencia del cambio promedio en mínimos cuadrados (MC) en la puntuación total en la Y-MRS entre asenapina 5 mg BID y placebo desde el estado basal hasta el día 21 fue -3,1 puntos (IC del 95 % [-5,7, -0,5]; valor p 0,0183). La diferencia del ca^nbio pro^nedio en MC en la puntuación total en la Y-MRS entre asenapina 10 mg BID y el placebo desde el estado basal hasta el día 21 fue -3,0 puntos (IC del 95 % [-5,6, -0,4]; valor p= 0,0244). Desde el día 2 se observó una diferencia estadísticamente significativa entre asenapina y placebo. En este corto plazo, en el ensayo controlado a dosis fijas, no hubo evidencia de beneficio adicional con una dosis de 10 mg dos veces al día en comparación con 5 mg dos veces al día.
En un ensayo de 12 semanas controlado con placebo, en el que participaron 326 pacientes con manía o episodios mixtos de trastorno bipolar I con o sin características psicóticas, parcialmente no-respondedores al tratamiento durante 2 semanas con litio o valproato en monoterapia, con niveles terapéuticos en suero, la adición de asenapina como terapia adyuvante mostró una mayor eficacia que litio o valproato a la semana 3 (estimación de puntos [IC del 95 %] para el cambio desde el inicio hasta el final del estudio en la Y-MRS usando el análisis de LOCF fue -10,3 [-11,9; -8,8] para asenapina y -7,9 [-9,4; -6,4] para placebo) y a la semana 12 (-12,7 [-14,5; -10,9] para asenapina y -9,3 [-11,8; -7,6] para placebo) en la reducción de los síntomas de manía.
Población pediátrica
Asenapina no está indicada para el tratamiento de niños y adolescentes menores de 18 años (ver sección 4.2).
La seguridad y eficacia de Sycrest se evaluó en 403 pacientes pediátricos con trastorno bipolar tipo I que participaron en un único ensayo de 3 semanas, controlado con placebo y doble ciego, de los cuales 302 pacientes recibieron Sycrest a dosis fijas que oscilaban entre 2,5 mg y 10 mg dos veces al día. Los resultados del estudio mostraron una superioridad estadísticamente significativa de las tres dosis de Sycrest en cuanto a la mejoría de la puntuación total en la Escala de Young para la Valoración de la Manía (Y-MRS), medida por el cambio observado desde el estado basal hasta el día 21, en comparación con placebo. La eficacia a largo plazo no se pudo establecer en un ensayo de ampliación, abierto, no controlado, de 50 semanas. Las reacciones adversas clínicamente relevantes identificadas en los ensayos pediátricos fueron en general similares a aquellas observadas en los ensayos con adultos. Sin embargo, las reacciones adversas del tratamiento en el aumento de peso y en el perfil lipídico en plasma, parecen ser mayores que las reacciones observadas en los ensayos con adultos.
La eficacia de Sycrest no fue demostrada en un ensayo de 8 semanas, controlado con placebo, doble ciego, aleatorizado y a dosis fijas en 306 pacientes adolescentes de 12 a 17 años con esquizofrenia a dosis de 2,5 mg y 5 mg dos veces al día.
Los estudios pediátricos con Sycrest se llevaron a cabo utilizando comprimidos sublinguales con sabor añadido. La Agencia Europea de Medicamentos ha concedido al titular un aplazamiento para presentar los resultados de los ensayos realizados con Sycrest en uno o más grupos de la población pediátrica en trastorno bipolar I (ver sección 4.2 para consultar la información sobre el uso en población pediátrica).
5.2 Propiedades farmacocinéticas
Absorción
Tras la administración sublingual, asenapina se absorbe rápidamente con concentraciones plasmáticas máximas entre 0,5 y 1,5 horas. La biodisponibilidad absoluta de 5 mg de asenapina sublingual es del 35 %. La biodisponibilidad absoluta de asenapina cuando se traga es más baja (< 2 % con formulación en comprimido oral). La toma de agua después de varios minutos (2 ó 5) tras la administración de asenapina, causó una disminución de la exposición a asenapina (19 % y 10 % respectivamente). Por lo tanto, se debe evitar comer y beber 10 minutos después de la administración (ver sección 4.2).
Distribución
Asenapina se distribuye rápidamente y tiene un gran volumen de distribución (aproximadamente 20-25 l/kg), que es indicativo de una extensa distribución extravascular. Asenapina tiene una alta unión a proteínas plasmáticas (95 %), como la albúmina y la a1-glicoproteína ácida.
Biotransformación
Asenapina se metaboliza ampliamente en el hígado. Las principales rutas metabólicas de asenapina son la glucuronidación directa (mediada por UGT1A4) y la oxidación y desmetilación mediada por el citocromo P450 (principalmente CYP1A2, con participación del 2D6 y 3A4). En un estudio in vivo en humanos con asenapina marcada-radiactivamente, el metabolito predominante relacionado con el fármaco fue asenapina N+-glucurónido; otros fueron N-desmetilasenapina, N-desmetilasenapina N-carbamoil glucoronido y asenapina inalterada en pequeñas cantidades. La actividad de Sycrest es debida principalmente al compuesto original.
Asenapina es un inhibidor débil del CYP2D6. Asenapina no produce inducción de las actividades metabólicas del CYP1A2 o del CYP3A4 en los cultivos de hepatocitos humanos. La administración concomitante de asenapina con inhibidores, inductores o sustratos conocidos de estas rutas metabólicas, se han estudiado en varios estudios de interacción fármaco-fármaco (ver sección 4.5).
Eliminación
Asenapina es un compuesto de alto aclaramiento, siendo este de 52 l/h tras la administración intravenosa. En un estudio de balance de masas, la mayoría de la dosis radioactiva se recogió en orina (sobre el 50 %) y heces (sobre el 40 %), con solo una pequeña cantidad de compuesto inalterado excretado en heces (5-16 %). Tras una fase inicial de distribución más rápida, la vida media final de asenapina es aproximadamente 24 h.
Linealidad/No linealidad
El aumento de dosis de 5 a 10 mg dos veces al día (aumento del doble) causó un aumento de menos del doble (1,7 veces) en el grado de exposición y la concentración máxima. Con la dosis menor, este aumento inferior al proporcional de Cmax y del área bajo la curva puede atribuirse a limitaciones en la capacidad de absorción a través de la mucosa oral tras la administración sublingual. Tomando una dosis de dos veces al día, el estado estacionario se alcanza en 3 días. En general, la farmacocinética de asenapina en el estado estacionario es similar a la farmacocinética de una dosis única.
Farmacocinética en poblaciones especiales
Insuficiencia hepática
La farmacocinética de asenapina fue similar entre sujetos con una insuficiencia hepática leve (clasificación A de Child-Pugh) o moderada (clasificación B de Child-Pugh) y sujetos con función hepática normal. En sujetos con insuficiencia hepática grave (clasificación C de Child-Pugh) se observó que la exposición a asenapina aumentó 7 veces (ver sección 4.2).
Insuficiencia renal
La farmacocinética de asenapina tras una dosis única de 5 mg de asenapina, fue similar entre sujetos con diversos grados de insuficiencia renal y sujetos con función renal normal.
No hay experiencia con asenapina en pacientes con insuficiencia renal grave con aclaramiento de creatinina menor de 15 ml/min.
Pacientes de edad avanzada
En pacientes de edad avanzada (entre 65 y 85 años), la exposición a asenapina es aproximadamente un 30 % mayor que en adultos más jóvenes.
Población pediátrica (niños y adolescentes)
En un estudio farmacocinético utilizando comprimidos sublinguales sin sabor añadido, a un nivel de dosis de 5 mg dos veces al día, la farmacocinética de asenapina en pacientes adolescentes (de 12 a 17 años, ambos incluidos) es similar a la observada en adultos. En adolescentes, la dosis de 10 mg dos veces al día no causó un aumento de la exposición comparado con 5 mg dos veces al día.
En un segundo estudio farmacocinético utilizando comprimidos sublinguales con sabor añadido, la dosis de 10 mg dos veces al día en una población pediátrica (de 10 a 17 años, ambos incluidos) provocó un aumento de la exposición a asenapina aproximadamente proporcional a la dosis en comparación con 5 mg dos veces al día.
Sexo
Un análisis farmacocinético de población indicó que no hay evidencias de diferencias relacionadas con el sexo en la farmacocinética de asenapina.
Raza
En un análisis farmacocinético de población, no se encontraron efectos clínicos relevantes de la raza en la farmacocinética de asenapina.
Tabaquismo
Un análisis farmacocinético de población indicó que fumar, que induce el CYP1A2, no tiene efecto sobre el aclaramiento de asenapina. En un estudio realizado a tal efecto, no se observó efecto del tabaco durante la administración sublingual de una dosis única de 5 mg en la farmacocinética de asenapina.
5.3 Datos preclínicos sobre seguridad
Los datos de los estudios no clínicos no muestran riesgos especiales para los seres humanos según los estudios convencionales de farmacología de seguridad. Estudios de toxicidad a dosis repetidas en ratas y perros, mostraron los efectos farmacológicos relacionados con la dosis, como la sedación. Además, se observaron efectos en las glándulas mamarias mediados por la prolactina y trastornos en el ciclo estral. Altas dosis orales producen hepatotoxicidad en perros, cosa que no se observó tras la administración crónica intravenosa. Asenapina tiene afinidad por los tejidos que contienen melanina. Sin embargo, cuando se analizó in vitro carecía de fototoxicidad. Además, el examen histopatológico de los ojos de los perros tratados crónicamente con asenapina, no reveló signos de toxicidad ocular, demostrando la ausencia de riesgo de fototoxicidad.
Asenapina no fue genotóxico en una serie de análisis. En estudios de carcinogenicidad subcutánea en ratas y ratones, no se observó aumento en la incidencia de tumores. Se observaron efectos en estudios preclínicos solo a exposiciones consideradas suficientemente excesivas respecto a la exposición máxima en humanos, que indica una relevancia reducida en el uso clínico.
Asenapina no afectó la fertilidad en ratas y no fue teratogénico en ratas ni conejos. Se encontró embriotoxicidad en estudios toxicológicos en la reproducción en ratas y conejos. Asenapina produjo una leve toxicidad materna y un leve retardo en el desarrollo del esqueleto fetal. Tras la administración oral a conejas preñadas durante el periodo de organogénesis, asenapina afectó negativamente el peso corporal a la dosis alta de 15 mg.kg-1 dos veces al día. A esta dosis, el peso fetal disminuyó. Cuando asenapina se administró vía intravenosa a conejas preñadas, no se observaron signos de embriotoxicidad. En ratas se observó toxicidad embriofetal (aumento de las pérdidas postimplantación, disminución del peso fetal y retraso en la osificación) tras la administración oral o intravenosa durante la organogénesis o durante toda la gestación. Se observó aumento de la mortalidad neonatal entre las crías de ratas hembra tratadas durante la gestación y la lactancia. A partir de un estudio de adopción, se concluyó que asenapina indujo las pérdidas peri y post natales causadas por discapacidad de las crías más que por un comportamiento alterado de las madres.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Gelatina Manitol (E-421)
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
3 años
6.4 Precauciones especiales de conservación
Conservar en el embalaje original para protegerlo de la luz y la humedad.
Este medicamento no requiere ninguna temperatura especial de conservación.
6.5 Naturaleza y contenido del envase
Blíster de aluminio/aluminio despegable en envases de 20, 60 ó 100 comprimidos sublinguales por envase.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
N.V. Organon, Kloosterstraat 6, NL-5349 AB Oss, Holanda
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/10/640/001
EU/1/10/640/002
EU/1/10/640/003
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización 01/septiembre/2010 Fecha de la última renovación 05/mayo/2015
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
1. NOMBRE DEL MEDICAMENTO
Sycrest 10 mg comprimidos sublinguales
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada comprimido sublingual contiene 10 mg de asenapina (como maleato). Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Comprimido sublingual
Comprimidos sublinguales redondos, de blanco a blanquecino, con "10" grabado en una de las caras.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Sycrest está indicado para el tratamiento de los episodios maníacos de moderados a graves, asociados con el trastorno bipolar I en adultos.
4.2 Posología y forma de administración
Posología
La dosis de inicio recomendada de Sycrest en monoterapia es de 5 mg dos veces al día. Se debe tomar una dosis por la mañana y otra dosis por la noche. La dosis puede aumentarse a 10 mg dos veces al día según la respuesta clínica y la tolerabilidad individual. Ver sección 5.1. Para terapia de combinación, se recomienda una dosis de inicio de 5 mg dos veces al día. Dependiendo de la respuesta clínica y tolerabilidad de cada paciente individual, la dosis puede aumentarse a 10 mg dos veces al día.
Poblaciones especiales
Pacientes de edad avanzada
Sycrest debe ser usado con cuidado en pacientes de edad avanzada. Se dispone de datos limitados de eficacia en pacientes mayores de 65 años. Los datos farmacocinéticos disponibles se describen en la sección 5.2.
Insuficiencia renal
No se requiere ajuste de dosis en pacientes con insuficiencia renal. No hay experiencia con asenapina en pacientes con insuficiencia renal grave que tienen un aclaramiento de creatinina menor a 15 ml/min.
Insuficiencia hepática
No se requiere ajuste de dosis para pacientes con insuficiencia hepática leve. No puede excluirse la posibilidad de un aumento de los niveles de asenapina en plasma en algunos pacientes con insuficiencia hepática moderada (Clasificación B de Child-Pugh) y se aconseja precaución. En sujetos con insuficiencia hepática grave (Clasificación C de Child-Pugh), la exposición a asenapina aumentó 7 veces. Por lo tanto, Sycrest no se recomienda en pacientes con insuficiencia hepática grave.
Población pediátrica
Se realizó un estudio de farmacocinética y otro estudio a corto plazo de la eficacia y seguridad en una población pediátrica (edades comprendidas entre 10 y 17 años) con episodios maníacos o mixtos asociados a trastorno bipolar tipo I. La seguridad a largo plazo en esta población se analizó en un estudio de ampliación, no controlado, abierto, de 50 semanas. Los datos disponibles actualmente están descritos en las secciones 4.8, 5.1 y 5.2, pero no se puede hacer una recomendación posológica.
Forma de administración
El comprimido no debe extraerse del blíster hasta el momento de la toma. Siempre manipular el comprimido con las manos secas. No se debe presionar el comprimido contra el blíster, ni tampoco cortar o romper el blíster. Despegar la lengüeta coloreada y extraer el comprimido con cuidado. El comprimido no debe aplastarse.
Para asegurar una óptima absorción, el comprimido sublingual de Sycrest debe situarse bajo la lengua y dejar que se disuelva completamente. El comprimido se disolverá en la saliva en unos segundos. Los comprimidos sublinguales de Sycrest no deben masticarse ni tragarse. Se debe evitar comer y beber 10 minutos después de la administración.
Cuando se administre en combinación con otros medicamentos, Sycrest debe tomarse el último.
No se aconseja el tratamiento con Sycrest en pacientes incapaces de cumplir con esta forma de administración, por la baja biodisponibilidad de asenapina ingerida (< 2 % con una formulación oral en comprimidos).
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
Pacientes de edad avanzada con psicosis asociada a demencia
Los pacientes de edad avanzada con psicosis asociada a demencia, tratados con medicamentos antipsicóticos tienen un mayor riesgo de muerte.
Sycrest no está aprobado para el tratamiento de pacientes con psicosis asociada a demencia y no se recomienda su uso en este particular grupo de pacientes.
Síndrome neuroléptico maligno
Con el uso de antipsicóticos, incluyendo asenapina, se ha notificado síndrome neuroléptico maligno (SNM), caracterizado por hipertermia, rigidez muscular, inestabilidad del sistema nervioso autónomo, conciencia alterada y elevados niveles de creatina fosfoquinasa en suero. Otros signos pueden ser mioglobinuria (rabdomiolisis) y fallo renal agudo.
Si un paciente desarrolla signos y síntomas indicativos de SNM se debe suspender el tratamiento con Sycrest.
Convulsiones
En ensayos clínicos, se notificaron esporádicamente casos de convulsiones durante el tratamiento con asenapina. Por lo tanto, Sycrest debe ser utilizado con precaución en pacientes que tengan antecedentes de trastornos convulsivos o que tengan enfermedades asociadas a convulsiones.
Suicidio
La posibilidad de intento de suicidio es inherente a las enfermedades psicóticas y al trastorno bipolar, por lo que el tratamiento de los pacientes de alto riesgo debe acompañarse de una estrecha supervisión.
Hipotensión ortostática
Asenapina puede inducir hipotensión ortostática y síncope, especialmente al inicio del tratamiento, que refleja probablemente sus propiedades antagonistas a1-adrenérgicas. Los pacientes de edad avanzada tienen especialmente un alto riesgo de sufrir hipotensión ortostática (ver sección 4.8). En ensayos clínicos, durante el tratamiento con Sycrest fueron notificados esporádicamente casos de síncope. Sycrest debe ser utilizado con precaución en pacientes de edad avanzada y en pacientes con enfermedad cardiovascular conocida (por ej., fallo cardíaco, infarto de miocardio o isquemia, defectos en la conducción), enfermedad cerebrovascular o enfermedades que predispongan al paciente a la hipotensión (por ej., deshidratación e hipovolemia).
Discinesia tardía
La inducción a discinesia tardía se ha asociado con medicamentos con propiedades antagonistas de los receptores de dopamina. La discinesia tardía se caracteriza por movimientos rítmicos involuntarios, predominantemente de la lengua y/o la cara. En ensayos clínicos, se notificaron esporádicamente casos de discinesia tardía durante el tratamiento con asenapina. La aparición de síntomas extrapiramidales es un factor de riesgo para la discinesia tardía. Si aparecen los signos y síntomas de la discinesia tardía en un paciente en tratamiento con Sycrest, debe considerarse la interrupción del tratamiento.
Hiperprolactinemia
Se observaron aumentos de los niveles de prolactina en algunos pacientes tratados con Sycrest. En ensayos clínicos, fueron notificadas pocas reacciones adversas relacionadas con niveles anormales de prolactina.
Intervalo QT
La prolongación clínicamente relevante del intervalo QT no parece estar asociada con asenapina. Se debe actuar con precaución cuando Sycrest se prescribe a pacientes con enfermedad cardiovascular conocida o historia familiar de prolongación del intervalo QT, y en uso concomitante con otros medicamentos que pueden prolongar el intervalo QT.
Hiperglucemia y diabetes mellitus
Se ha notificado ocasionalmente hiperglucemia o exacerbación de una diabetes preexistente durante el tratamiento con asenapina. La valoración de la relación entre el uso de antipsicóticos atípicos y niveles anormales de glucosa se complica por la posibilidad de un incremento de base del riesgo de diabetes mellitus en pacientes con esquizofrenia o trastorno bipolar y un aumento de la incidencia de diabetes mellitus en la población general. Se aconseja el seguimiento clínico apropiado en pacientes diabéticos y en pacientes con factores de riesgo para el desarrollo de diabetes mellitus.
Disfagia
Se han asociado dismotilidad esofágica y aspiración con el tratamiento antipsicótico. Se notificaron esporádicamente casos de disfagia en pacientes tratados con Sycrest.
Regulación de la temperatura corporal
Se ha atribuido a los medicamentos antipsicóticos un trastorno de la capacidad del cuerpo para reducir la temperatura corporal. A partir de los ensayos clínicos, se concluye que asenapina no parece asociarse a una alteración clínicamente relevante de la regulación de la temperatura corporal. Cuando se prescriba Sycrest, se aconseja la asistencia adecuada en aquellos pacientes que se encuentren en situaciones que pueden contribuir a un aumento de la temperatura corporal, es decir, hacer ejercicio enérgicamente, exposición a calor extremo, que reciban a la vez medicamentos con actividad anticolinérgica o que sean susceptibles de sufrir deshidratación.
Pacientes con insuficiencia hepática grave
La exposición a asenapina aumenta 7 veces en pacientes con insuficiencia hepática grave (Clasificación C de Child-Pugh). Por lo tanto, Sycrest no está recomendado en tales pacientes.
Enfermedad de Parkinson y demencia con cuerpos de Lewy
Los psiquiatras deben valorar los riesgos frente a los beneficios cuando prescriben Sycrest a pacientes con enfermedad de Parkinson o demencia con cuerpos de Lewy (DCL), ya que en ambos grupos se puede incrementar el riesgo de síndrome neuroléptico maligno, así como presentar una mayor sensibilidad a los antipsicóticos. Este aumento de sensibilidad puede manifestarse como confusión, embotamiento, inestabilidad postural con caídas frecuentes, además de síntomas extrapiramidales.
4.5 Interacción con otros medicamentos y otras formas de interacción
Dados los efectos principales de asenapina en el sistema nervioso central (SNC) (ver sección 4.8), se debe utilizar con precaución cuando se toma en combinación con otros medicamentos que actúan a nivel central. Se debe avisar a los pacientes que eviten el alcohol mientras estén tomando Sycrest.
Potencial de que otros medicamentos afecten a Sycrest
Asenapina se elimina fundamentalmente mediante glucuronidación directa por UGT1A4 y metabolismo oxidativo a través las isoenzimas del citocromo P450 (predominantemente CYP1A2). Se estudiaron los efectos potenciales de los inhibidores y un inductor de varias de estas rutas enzimáticas sobre la farmacocinética de asenapina, concretamente fluvoxamina (inhibidor del CYP1A2), paroxetina (inhibidor del CYP2D6), imipramina (inhibidor del CYP1A2/2C19/3A4), cimetidina (inhibidor del CYP3A4/2D6/1A2), carbamacepina (inductor del CYP3A4/1A2) y valproato (inhibidor de las UGT).
Excepto para fluvoxamina, ninguno de los medicamentos que interaccionan causó alteraciones clínicamente relevantes en la farmacocinética de asenapina.
Durante la administración combinada con una dosis única de asenapina 5 mg y fluvoxamina 25 mg dos veces al día se produjo un aumento del 29 % en el área bajo la curva de asenapina. Es de esperar que la dosis terapéutica completa de fluvoxamina produzca un aumento mayor en las concentraciones de asenapina en plasma. Por lo tanto, la administración concomitante de asenapina y fluvoxamina debe abordarse con precaución.
Potencial de que Sycrest afecte a otros medicamentos
Sycrest puede aumentar los efectos de ciertos agentes antihipertensivos a causa de su antagonismo a1-adrenérgico, con posibilidad de inducir hipotensión ortostática (ver sección 4.4).
Asenapina puede antagonizar el efecto de levodopa y de agonistas dopaminérgicos. Si esta combinación se considera necesaria, debe prescribirse la menor dosis eficaz de cada tratamiento.
Estudios in vitro indican que asenapina inhibe débilmente el CYP2D6. Se obtuvieron los siguientes resultados de estudios clínicos de interacciones de medicamentos, que investigaron los efectos de la inhibición del CYP2D6 por asenapina:
- Tras la administración concomitante de dextrometorfano y asenapina en individuos sanos, se midió la proporción de dextrorfano/dextrometorfano (DX/DM) como indicador la actividad del CYP2D6. El tratamiento con asenapina 5 mg dos veces al día resultó en una disminución mínima de la proporción DX/DM a 0,43, lo que es indicativo de la inhibición del CYP2D6. En el mismo estudio, el tratamiento con paroxetina 20 mg al día disminuyó la proporción DX/DM a 0,032.
- En otro estudio, la administración conjunta de una dosis única de 75 mg de imipramina con una dosis única de 5 mg de asenapina no afectó las concentraciones plasmáticas del metabolito desipramina (un sustrato del CYP2D6).
- La administración conjunta de una dosis única de 20 mg de paroxetina (sustrato e inhibidor del CYP2D6) durante el tratamiento con 5 mg de asenapina dos veces al día en 15 individuos varones sanos causó un aumento en la exposición a paroxetina de casi 2 veces.
In vivo, asenapina parece ser como máximo un inhibidor débil del CYP2D6. Sin embargo, la asenapina puede aumentar los efectos inhibitorios de la paroxetina sobre su propio metabolismo.
Por lo tanto, Sycrest en asociación debe administrarse con precaución con medicamentos que sean sustratos e inhibidores del CYP2D6.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No hay suficientes datos sobre el uso de Sycrest en mujeres embarazadas. Asenapina no fue teratogénico en estudios en animales. Se encontraron efectos tóxicos embrionarios y maternales en estudios con animales (ver sección 5.3).
Los recién nacidos expuestos a antipsicóticos (como Sycrest) durante el tercer trimestre de embarazo están en peligro de sufrir reacciones adversas como síntomas extrapiramidales y/o síndromes de abstinencia que pueden variar en gravedad y duración tras la exposición. Se han notificado casos de síntomas de agitación, hipertonía, hipotonía, temblor, somnolencia, dificultad respiratoria o alteraciones alimenticias en recién nacidos. Por consiguiente, se debe vigilar estrechamente a los recién nacidos.
Sycrest no debe usarse durante el embarazo a menos que la situación clínica de la mujer requiera tratamiento con asenapina y solo si el beneficio potencial es mayor que el posible riesgo para el feto.
Lactancia
Asenapina se excretó en la leche de las ratas durante la lactancia. Se desconoce si asenapina o sus metabolitos se excretan en la leche materna. La lactancia debe ser interrumpida durante el tratamiento con Sycrest.
Fertilidad
No se han observado alteraciones de la fertilidad en ensayos preclínicos (ver sección 5.3)
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
Asenapina puede causar somnolencia y sedación. Por la tanto, los pacientes deben ser prevenidos sobre la conducción y el uso de máquinas hasta que estén razonablemente seguros de que Sycrest no les afecta de forma negativa.
4.8 Reacciones adversas
Resumen del perfil de seguridad
Las reacciones adversas al medicamento (RAMs) asociadas al uso de asenapina notificadas con mayor frecuencia en ensayos clínicos fueron somnolencia y ansiedad. Se han notificado reacciones de hipersensibilidad graves. Otras RAMs graves se explican con más detalle en la sección 4.4.
Lista tabulada de reacciones adversas
Las incidencias de RAMs asociadas al tratamiento con asenapina se tabulan a continuación. La tabla se basa en reacciones adversas notificadas durante ensayos clínicos y/o uso post-comercialización. Todas las RAMs se enumeran según el Sistema de Clasificación de Órganos y por frecuencia; muy frecuentes (> 1/10), frecuentes (> 1/100 a < 1/10), poco frecuentes (> 1/1.000 a < 1/100), raras (> 1/10.000 a < 1/1.000) y frecuencia no conocida (no puede estimarse a partir de los datos disponibles). En cada grupo de frecuencia, las RAMs se presentan en orden decreciente de gravedad.
|
Sistema de Clasificación de Órganos |
Muy frecuentes |
Frecuentes |
Poco frecuentes |
Raras |
Frecuencia no conocida |
|
Trastornos de la sangre y del sistema linfático |
Neutropenia | ||||
|
Trastornos del sistema inmunológico |
Reacciones alérgicas |
|
Sistema de Clasificación de Órganos |
Muy frecuentes |
Frecuentes |
Poco frecuentes |
Raras |
Frecuencia no conocida |
|
Trastornos del metabolismo y de la nutrición |
Peso aumentado Apetito aumentado |
Hiperglucemi a | |||
|
Trastornos psiquiátricos |
Ansiedad | ||||
|
Trastornos del sistema nervioso |
Somnolencia |
Distonía Acatisia Discinesia Parkinsonismo Sedación Mareo Disgeusia |
Síncope Crisis Trastorno extrapiramida l Disartria Síndrome de la pierna inquieta |
Síndrome neuroléptico maligno | |
|
Trastornos oculares |
Trastorno de la acomodación | ||||
|
Trastornos cardíacos |
Bradicardia sinusal Bloqueo de rama Intervalo QT del electrocardio grama prolongado Taquicardia sinusal | ||||
|
Trastornos vasculares |
Hipotensión ortostática Hipotensión | ||||
|
Trastornos respiratorios, torácicos y mediastínicos |
Embolia pulmonar | ||||
|
Trastornos gastrointestinal es |
Hipoestesia oral Náuseas Hipersecreción salival |
Lengua hinchada Disfagia Glosodinia Parestesia oral Lesiones de la mucosa oral (ulceraciones, vesiculación e inflamación) | |||
|
Trastornos hepatobiliares |
Alanina aminotransferasa elevada |
|
Sistema de Clasificación de Órganos |
Muy frecuentes |
Frecuentes |
Poco frecuentes |
Raras |
Frecuencia no conocida |
|
Trastornos músculo esqueléticos y del tejido conjuntivo |
Rigidez muscular |
Rabdomiolisis | |||
|
Embarazo, puerperio y enfermedades perinatales |
Síndrome de abstinencia neonatal (ver 4.6) | ||||
|
Trastornos del aparato reproductor y de la mama |
Disfunción sexual Amenorrea |
Ginecomastia Galactorrea | |||
|
Trastornos generales y alteraciones en el lugar de administración |
Fatiga |
Descripción de reacciones adversas seleccionadas
Síntomas extrapiramidales (SEP)
En ensayos clínicos, la incidencia de síntomas extrapiramidales en pacientes tratados con asenapina fue mayor que con placebo (15,4 % frente a 11,0%).
A partir de los ensayos de esquizofrenia a corto plazo (6 semanas) parece haber una relación dosis-respuesta para la acatisia en pacientes tratados con asenapina, y para el parkinsonismo hubo una tendencia al aumento con dosis altas.
Según un estudio farmacocinético reducido, los pacientes pediátricos parecían ser más sensibles a la distonía con la administración inicial de asenapina cuando no se siguió una pauta de aumento gradual de la dosis (ver sección 5.2). La incidencia de distonía en ensayos clínicos pediátricos, utilizando un aumento gradual de la dosis, fue similar a la observada en ensayos con adultos.
Aumento de peso
En los ensayos combinados a corto y largo plazo de esquizofrenia y trastorno bipolar en adultos, el cambio promedio en el peso corporal fue de 0,8 kg. En los ensayos a corto plazo de esquizofrenia, la proporción de sujetos con aumento de peso clínicamente significativo fue del 5,3 % para asenapina comparado con el 2,3 % para placebo (aumento de peso > 7 % desde el inicio al final del estudio). En los ensayos a corto plazo, a dosis flexibles de manía bipolar, la proporción de sujetos con aumento de peso clínicamente significativo fue del 6,5 % para asenapina comparado con el 0,6 % para placebo (aumento de peso > 7 % desde el inicio al final del estudio).
En un ensayo de seguridad y eficacia de 3 semanas, a dosis fijas, aleatorizado y controlado con placebo en pacientes pediátricos de 10 a 17 años con trastorno bipolar I, el cambio promedio en el peso desde el inicio al final del estudio para placebo y asenapina 2,5 mg, 5 mg, y 10 mg, dos veces al día, fue de 0,48, 1,72, 1,62, y 1,44 kg, respectivamente. La proporción de sujetos con un aumento de peso clínicamente significativo (aumento de peso > 7 % desde el inicio al día 21) fue del 14,1 % para asenapina 2,5 mg dos veces al día, del 8,9 % para asenapina 5 mg dos veces al día, y del 9,2 % para asenapina 10 mg dos veces al día, en comparación al 1,1 % para el placebo. En el ensayo de ampliación a largo plazo (50 semanas), un total del 34,8 % de los sujetos experimentó aumento de peso clínicamente significativo (es decir, aumento en el peso corporal > 7 % al final del estudio). La media global (SD) de aumento de peso al final del estudio fue de 3,5 (5,76) kg.
Hipotensión ortostática
La incidencia de hipotensión ortostática en pacientes de edad avanzada fue del 4,1 % comparado con un 0,3 % en la población combinada de los ensayos fase 2-3.
Encimas hepáticas
Se han visto frecuentemente aumentos transitorios y asintomáticos de transaminasas hepáticas, alanino transferasa (ALT) y aspartato transferasa (AST), especialmente al comienzo del tratamiento.
Otros efectos
Se han notificado eventos cerebrovasculares en pacientes tratados con asenapina, pero no hay evidencia de incidencia por encima de lo esperado en adultos entre 18 y 65 años.
Asenapina tiene propiedades anestésicas. Tras la administración pueden producirse hipoestesia oral y parestesia oral, y normalmente se resuelven en 1 hora.
Tras la comercialización se han notificado reacciones graves de hipersensibilidad en pacientes tratados con asenapina, incluyendo reacciones anafilácticas/anafilactoides, angioedema, lengua hinchada e hinchazón de garganta (edema faríngeo).
Población pediátrica
La asenapina no está indicada para el tratamiento de niños y adolescentes menores de 18 años (ver sección 4.2).
Las experiencias adversas clínicamente relevantes identificadas en los ensayos de esquizofrenia y bipolares en pacientes pediátricos fueron similares a las observadas en los ensayos de esquizofrenia y bipolares en adultos.
Las reacciones adversas más frecuentes (> 5 % y al menos el doble de la tasa con placebo) notificadas en pacientes pediátricos con trastorno bipolar I fueron somnolencia, sedación, mareos, disgeusia, hipoestesia oral, parestesia oral, náuseas, aumento del apetito, fatiga y aumento de peso (ver más arriba Aumento de peso).
Las reacciones adversas más frecuentes (una proporción de pacientes > 5 % y al menos el doble que con el placebo) notificadas en pacientes pediátricos con esquizofrenia fueron somnolencia, sedación, acatisia, mareo e hipoestesia oral. Hubo una mayor incidencia estadísticamente significativa de pacientes con aumento de peso > 7 % (desde el inicio hasta el final del estudio) en comparación con placebo (3,1 %) en el caso de Sycrest 2,5 mg dos veces al día (9,5 %) y Sycrest 5 mg dos veces al día (13,1 %).
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Anexo V.
4.9 Sobredosis
En el programa de asenapina fueron notificados pocos casos de sobredosis. Las dosis estimadas notificadas fueron entre 15 y 400 mg. En la mayoría de los casos no se aclaró si asenapina se tomó sublingual. Las reacciones adversas relacionadas con el tratamiento fueron agitación y confusión, acatisia, distonía orofacial, sedación y datos asintomáticos de ECG (bradicardia, complejos supraventriculares, retraso de la conducción intraventricular).
No hay información específica disponible acerca del tratamiento de la sobredosis con Sycrest, ni un antídoto específico. Debe considerarse la posibilidad de implicación de múltiples medicamentos. Es necesaria la monitorización cardiovascular para detectar posibles arritmias, y el control de la sobredosis debe concentrarse en el tratamiento de apoyo que mantiene una adecuada oxigenación y ventilación así como el control de los síntomas. La hipotensión y el colapso circulatorio deben tratarse con las medidas apropiadas, como fluidos intravenosos y/o agentes simpaticomiméticos (no deben utilizarse epinefrina y dopamina, ya que una estimulación beta puede empeorar la hipotensión en el contexto del bloqueo alfa inducido por Sycrest). En caso de síntomas extrapiramidales graves, se deben administrar medicamentos anticolinérgicos, y continuar con una estrecha supervisión y seguimiento hasta que el paciente se recupere.
PROPIEDADES FARMACOLÓGICAS
5.
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: psicolépticos, antipsicóticos, código ATC: N05AH05 Mecanismo de acción
El mecanismo de acción de asenapina no se conoce completamente. Sin embargo, basándose en su farmacología de receptores se considera que la eficacia de asenapina está mediada por la combinación de la actividad antagonista sobre los receptores D2 y 5-HT2A. Las acciones a nivel de otros receptores como el 5-HT1A, 5-HT1B, 5-HT2C, 5-HT6, 5-HT7, D3 y receptores a2-adrenérgicos, también pueden contribuir a los efectos clínicos de asenapina.
Efectos farmacodinámicos
La asenapina tiene alta afinidad por los receptores de serotonina 5-HT1A, 5-HT1B, 5-HT2A, 5-HT2B, 5-HT2C, 5-HT5, 5-HT6 y 5-HT7, por los receptores de dopamina D2, D3, D4 y D1, por los receptores al y a2-adrenérgicos, y por los receptores de histamina H1, y afinidad moderada por los receptores H2. En ensayos in vitro, la asenapina actúa como un antagonista de estos receptores. La asenapina no tiene afinidad apreciable por los receptores colinérgicos muscarínicos.
Eficacia clínica
Eficacia clínica en el trastorno bipolar tipo I
La eficacia de asenapina en el tratamiento de episodios maníacos o mixtos, con o sin características psicóticas, del trastorno bipolar tipo I del manual diagnóstico y estadístico de los trastornos mentales (DSM-IV), se evaluó en dos ensayos de 3 semanas diseñados de forma similar, aleatorizados, doble ciego, a dosis flexibles, controlados con placebo y fármaco activo en monoterapia (olanzapina), en los que participaron 488 y 489 pacientes respectivamente. Todos los pacientes cumplieron los criterios diagnósticos del trastorno bipolar tipo I, episodio maníaco actual (DSM-IV 296.4x) o episodios mixtos (DSM-IV 296.6x) de la 4a Edición del Manual Diagnóstico y Estadístico de los Trastornos Mentales (DSM-IV), y presentaron un resultado > 20 en la Escala de Young para la Valoración de la Manía (Y-MRS) en la fase de cribado y al inicio. Los pacientes con oscilaciones rápidas fueron excluidos de estos estudios. Asenapina demostró una eficacia superior al placebo en la reducción de los síntomas de la manía en 3 semanas. Los puntos estimados [IC del 95 %] para el cambio desde el inicio hasta el final del estudio en la Escala de Young para la Valoración de la Manía (Y -MRS) usando el análisis LOCF en los dos estudios fue el siguiente:
-11,5 [-13,00; -10,0] para asenapina frente a -7,8 [-10,0; -5,6] para el placebo y -10,8 [-12,3; -9,3] para asenapina frente a -5,5 [-7,5; -3,5] para el placebo.
Desde el día 2 se observó una diferencia estadísticamente significativa entre asenapina y placebo.
Los pacientes de los dos ensayos principales de 3 semanas se estudiaron durante 9 semanas más, en un ensayo de ampliación. En este ensayo se demostró el mantenimiento del efecto durante el episodio tras 12 semanas de tratamiento aleatorizado.
La hipótesis principal de eficacia quedó establecida en un ensayo doble ciego, a dosis fijas, de grupos paralelos, controlado con placebo de 3 semanas, en sujetos con trastorno bipolar tipo I con un episodio maníaco o mixto agudo, en el que participaron 367 pacientes, de los cuales 126 recibieron placebo,
122 recibieron asenapina 5 mg dos veces al día (BID), y 119 recibieron asenapina 10 mg BID. Ambas dosis de asenapina (5 mg BID y 10 mg BID) fueron superiores al placebo y mostraron una mejoría estadísticamente significativa en el cambio, desde el estado basal hasta el día 21 en la puntuación total en la Y-MRS, en comparación con el placebo. De acuerdo a un análisis de LOCF, incluyendo todos los pacientes tratados, la diferencia del cambio promedio en mínimos cuadrados (MC) en la puntuación total en la Y-MRS entre asenapina 5 mg BID y placebo desde el estado basal hasta el día 21 fue -3,1 puntos (IC del 95 % [-5,7, -0,5]; valor p 0,0183). La diferencia del ca^nbio pro^nedio en MC en la puntuación total en la Y-MRS entre asenapina 10 mg BID y el placebo desde el estado basal hasta el día 21 fue -3,0 puntos (IC del 95 % [-5,6, -0,4]; valor p= 0,0244). Desde el día 2 se observó una diferencia estadísticamente significativa entre asenapina y placebo. En este corto plazo, en el ensayo controlado a dosis fijas, no hubo evidencia de beneficio adicional con una dosis de 10 mg dos veces al día en comparación con 5 mg dos veces al día.
En un ensayo de 12 semanas controlado con placebo, en el que participaron 326 pacientes con manía o episodios mixtos de trastorno bipolar I con o sin características psicóticas, parcialmente no-respondedores al tratamiento durante 2 semanas con litio o valproato en monoterapia, con niveles terapéuticos en suero, la adición de asenapina como terapia adyuvante mostró una mayor eficacia que litio o valproato a la semana 3 (estimación de puntos [IC del 95 %] para el cambio desde el inicio hasta el final del estudio en la Y-MRS usando el análisis de LOCF fue -10,3 [-11,9; -8,8] para asenapina y -7,9 [-9,4; -6,4] para placebo) y a la semana 12 (-12,7 [-14,5; -10,9] para asenapina y -9,3 [-11,8; -7,6] para placebo) en la reducción de los síntomas de manía.
Población pediátrica
Asenapina no está indicada para el tratamiento de niños y adolescentes menores de 18 años (ver sección 4.2).
La seguridad y eficacia de Sycrest se evaluó en 403 pacientes pediátricos con trastorno bipolar tipo I que participaron en un único ensayo de 3 semanas, controlado con placebo y doble ciego, de los cuales 302 pacientes recibieron Sycrest a dosis fijas que oscilaban entre 2,5 mg y 10 mg dos veces al día. Los resultados del estudio mostraron una superioridad estadísticamente significativa de las tres dosis de Sycrest en cuanto a la mejoría de la puntuación total en la Escala de Young para la Valoración de la Manía (Y-MRS), medida por el cambio observado desde el estado basal hasta el día 21, en comparación con placebo. La eficacia a largo plazo no se pudo establecer en un ensayo de ampliación, abierto, no controlado, de 50 semanas. Las reacciones adversas clínicamente relevantes identificadas en los ensayos pediátricos fueron en general similares a aquellas observadas en los ensayos con adultos. Sin embargo, las reacciones adversas del tratamiento en el aumento de peso y en el perfil lipídico en plasma, parecen ser mayores que las reacciones observadas en los ensayos con adultos.
La eficacia de Sycrest no fue demostrada en un ensayo de 8 semanas, controlado con placebo, doble ciego, aleatorizado y a dosis fijas en 306 pacientes adolescentes de 12 a 17 años con esquizofrenia a dosis de 2,5 mg y 5 mg dos veces al día.
Los estudios pediátricos con Sycrest se llevaron a cabo utilizando comprimidos sublinguales con sabor añadido. La Agencia Europea de Medicamentos ha concedido al titular un aplazamiento para presentar los resultados de los ensayos realizados con Sycrest en uno o más grupos de la población pediátrica en trastorno bipolar I (ver sección 4.2 para consultar la información sobre el uso en población pediátrica).
5.2 Propiedades farmacocinéticas
Absorción
Tras la administración sublingual, asenapina se absorbe rápidamente con concentraciones plasmáticas máximas entre 0,5 y 1,5 horas. La biodisponibilidad absoluta de 5 mg de asenapina sublingual es del 35 %. La biodisponibilidad absoluta de asenapina cuando se traga es más baja (< 2 % con formulación en comprimido oral). La toma de agua después de varios minutos (2 ó 5) tras la administración de asenapina, causó una disminución de la exposición a asenapina (19 % y 10 % respectivamente). Por lo tanto, se debe evitar comer y beber 10 minutos después de la administración (ver sección 4.2).
Distribución
Asenapina se distribuye rápidamente y tiene un gran volumen de distribución (aproximadamente 20-25 l/kg), que es indicativo de una extensa distribución extravascular. Asenapina tiene una alta unión a proteínas plasmáticas (95 %), como la albúmina y la a1-glicoproteína ácida.
Biotransformación
Asenapina se metaboliza ampliamente en el hígado. Las principales rutas metabólicas de asenapina son la glucuronidación directa (mediada por UGT1A4) y la oxidación y desmetilación mediada por el citocromo P450 (principalmente CYP1A2, con participación del 2D6 y 3A4). En un estudio in vivo en humanos con asenapina marcada-radiactivamente, el metabolito predominante relacionado con el fárm aco fue asenapina N+-glucurónido; otros fueron N-desmetilasenapina, N-desmetilasenapina N-carbamoil glucoronido y asenapina inalterada en pequeñas cantidades. La actividad de Sycrest es debida principalmente al compuesto original.
Asenapina es un inhibidor débil del CYP2D6. Asenapina no produce inducción de las actividades metabólicas del CYP1A2 o del CYP3A4 en los cultivos de hepatocitos humanos. La administración concomitante de asenapina con inhibidores, inductores o sustratos conocidos de estas rutas metabólicas, se han estudiado en varios estudios de interacción fármaco-fármaco (ver sección 4.5).
Eliminación
Asenapina es un compuesto de alto aclaramiento, siendo este de 52 l/h tras la administración intravenosa. En un estudio de balance de masas, la mayoría de la dosis radioactiva se recogió en orina (sobre el 50 %) y heces (sobre el 40 %), con solo una pequeña cantidad de compuesto inalterado excretado en heces (5-16 %). Tras una fase inicial de distribución más rápida, la vida media final de asenapina es aproximadamente 24 h.
Linealidad/No linealidad
El aumento de dosis de 5 a 10 mg dos veces al día (aumento del doble) causó un aumento de menos del doble (1,7 veces) en el grado de exposición y la concentración máxima. Con la dosis menor, este aumento inferior al proporcional de Cmax y del área bajo la curva puede atribuirse a limitaciones en la capacidad de absorción a través de la mucosa oral tras la administración sublingual. Tomando una dosis de dos veces al día, el estado estacionario se alcanza en 3 días. En general, la farmacocinética de asenapina en el estado estacionario es similar a la farmacocinética de una dosis única.
Farmacocinética en poblaciones especiales
Insuficiencia hepática
La farmacocinética de asenapina fue similar entre sujetos con una insuficiencia hepática leve (clasificación A de Child-Pugh) o moderada (clasificación B de Child-Pugh) y sujetos con función hepática normal. En sujetos con insuficiencia hepática grave (clasificación C de Child-Pugh) se observó que la exposición a asenapina aumentó 7 veces (ver sección 4.2).
Insuficiencia renal
La farmacocinética de asenapina tras una dosis única de 5 mg de asenapina, fue similar entre sujetos con diversos grados de insuficiencia renal y sujetos con función renal normal.
No hay experiencia con asenapina en pacientes con insuficiencia renal grave con aclaramiento de creatinina menor de 15 ml/min.
Pacientes de edad avanzada
En pacientes de edad avanzada (entre 65 y 85 años), la exposición a asenapina es aproximadamente un 30 % mayor que en adultos más jóvenes.
Población pediátrica (niños y adolescentes)
En un estudio farmacocinético utilizando comprimidos sublinguales sin sabor añadido, a un nivel de dosis de 5 mg dos veces al día, la farmacocinética de asenapina en pacientes adolescentes (de 12 a 17 años, ambos incluidos) es similar a la observada en adultos. En adolescentes, la dosis de 10 mg dos veces al día no causó un aumento de la exposición comparado con 5 mg dos veces al día.
En un segundo estudio farmacocinético utilizando comprimidos sublinguales con sabor añadido, la dosis de 10 mg dos veces al día en una población pediátrica (de 10 a 17 años, ambos incluidos) provocó un aumento de la exposición a asenapina aproximadamente proporcional a la dosis en comparación con 5 mg dos veces al día.
Sexo
Un análisis farmacocinético de población indicó que no hay evidencias de diferencias relacionadas con el sexo en la farmacocinética de asenapina.
Raza
En un análisis farmacocinético de población, no se encontraron efectos clínicos relevantes de la raza en la farmacocinética de asenapina.
Tabaquismo
Un análisis farmacocinético de población indicó que fumar, que induce el CYP1A2, no tiene efecto sobre el aclaramiento de asenapina. En un estudio realizado a tal efecto, no se observó efecto del tabaco durante la administración sublingual de una dosis única de 5 mg en la farmacocinética de asenapina.
5.3 Datos preclínicos sobre seguridad
Los datos de los estudios no clínicos no muestran riesgos especiales para los seres humanos según los estudios convencionales de farmacología de seguridad. Estudios de toxicidad a dosis repetidas en ratas y perros, mostraron los efectos farmacológicos relacionados con la dosis, como la sedación. Además, se observaron efectos en las glándulas mamarias mediados por la prolactina y trastornos en el ciclo estral. Altas dosis orales producen hepatotoxicidad en perros, cosa que no se observó tras la administración crónica intravenosa. Asenapina tiene afinidad por los tejidos que contienen melanina. Sin embargo, cuando se analizó in vitro carecía de fototoxicidad. Además, el examen histopatológico de los ojos de los perros tratados crónicamente con asenapina, no reveló signos de toxicidad ocular, demostrando la ausencia de riesgo de fototoxicidad.
Asenapina no fue genotóxico en una serie de análisis. En estudios de carcinogenicidad subcutánea en ratas y ratones, no se observó aumento en la incidencia de tumores. Se observaron efectos en estudios preclínicos solo a exposiciones consideradas suficientemente excesivas respecto a la exposición máxima en humanos, que indica una relevancia reducida en el uso clínico.
Asenapina no afectó la fertilidad en ratas y no fue teratogénico en ratas ni conejos. Se encontró embriotoxicidad en estudios toxicológicos en la reproducción en ratas y conejos. Asenapina produjo una leve toxicidad materna y un leve retardo en el desarrollo del esqueleto fetal. Tras la administración oral a conejas preñadas durante el periodo de organogénesis, asenapina afectó negativamente el peso corporal a la dosis alta de 15 mg.kg-1 dos veces al día. A esta dosis, el peso fetal disminuyó. Cuando asenapina se administró vía intravenosa a conejas preñadas, no se observaron signos de embriotoxicidad. En ratas se observó toxicidad embriofetal (aumento de las pérdidas postimplantación, disminución del peso fetal y retraso en la osificación) tras la administración oral o intravenosa durante la organogénesis o durante toda la gestación. Se observó aumento de la mortalidad neonatal entre las crías de ratas hembra tratadas durante la gestación y la lactancia. A partir de un estudio de adopción, se concluyó que asenapina indujo las pérdidas peri y post natales causadas por discapacidad de las crías más que por un comportamiento alterado de las madres.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Gelatina Manitol (E-421)
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
3 años
6.4 Precauciones especiales de conservación
Conservar en el embalaje original para protegerlo de la luz y la humedad.
Este medicamento no requiere ninguna temperatura especial de conservación.
6.5 Naturaleza y contenido del envase
Blíster de aluminio/aluminio despegable en envases de 20, 60 ó 100 comprimidos sublinguales por envase.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
N.V. Organon, Kloosterstraat 6, NL-5349 AB Oss, Holanda
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/10/640/004
EU/1/10/640/005
EU/1/10/640/006
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización 01/septiembre/2010 Fecha de la última renovación 05/mayo/2015
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
A. FABRICANTE(S) RESPONSABLE(S) DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
A. FABRICANTE(S) RESPONSABLE(S) DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección de los fabricantes responsables de la liberación de los lotes
Organon (Ireland) Ltd.
Drynam Road, Swords, Co. Dublin Irlanda
Schering-Plough Labo N.V.
Industriepark 30
B-2220 Heist-op-den-Berg, Bélgica
El prospecto impreso del medicamento debe especificar el nombre y dirección del fabricante responsable de la liberación del lote en cuestión.
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica.
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
El Titular de la Autorización de Comercialización (TAC) presentará los informes periódicos de seguridad para este medicamento de conformidad con las exigencias establecidas en la lista de fechas de referencia de la Unión (lista EURD), prevista en el artículo 107 ter, párrafo 7, de la Directiva 2001/83/CE y publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado en la versión del PGR incluido en el Módulo 1.8.2 de la Autorización de Comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos.
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
Si coincide la presentación de un IPS con la actualización del PGR, ambos documentos se pueden
presentar conjuntamente.
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
1. NOMBRE DEL MEDICAMENTO
Sycrest 5 mg comprimidos sublinguales asenapina
2. PRINCIPIO(S) ACTIVO(S)
Cada comprimido sublingual contiene 5 mg de asenapina (como maleato).
3. LISTA DE EXCIPIENTES
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
20 comprimidos sublinguales 60 comprimidos sublinguales 100 comprimidos sublinguales
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento.
Vía sublingual.
Blíster despegable. No triturar, masticar ni tragar.
Mantener el comprimido bajo la lengua hasta que se disuelva.
No comer ni beber durante 10 minutos después de tomar el comprimido.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Conservar en el envase original para protegerlo de la luz y la humedad.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
N.V. Organon Kloosterstraat 6 NL- 5349 AB Oss Holanda
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/10/640/001 20 comprimidos sublinguales EU/1/10/640/002 60 comprimidos sublinguales EU/1/10/640/003 100 comprimidos sublinguales
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
sycrest 5 mg
INFORMACIÓN MÍNIMA A INCLUIR EN BLÍSTERS O TIRAS BLÍSTER (5 mg)_
|
1. |
NOMBRE DEL MEDICAMENTO |
Sycrest 5 mg comprimidos sublinguales asenapina
2. NOMBRE DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
N.V. Organon
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE
Lot
5. OTROS
1. NOMBRE DEL MEDICAMENTO
Sycrest 10 mg comprimidos sublinguales asenapina
2. PRINCIPIO(S) ACTIVO(S)
Cada comprimido sublingual contiene 10 mg de asenapina (como maleato).
3. LISTA DE EXCIPIENTES
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
20 comprimidos sublinguales 60 comprimidos sublinguales 100 comprimidos sublinguales
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento.
Vía sublingual.
Blíster despegable. No triturar, masticar ni tragar.
Mantener el comprimido bajo la lengua hasta que se disuelva.
No comer ni beber durante 10 minutos después de tomar el comprimido.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Conservar en el envase original para protegerlo de la luz y la humedad.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
N.V. Organon Kloosterstraat 6 NL- 5349 AB Oss Holanda
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/10/640/004 20 comprimidos sublinguales EU/1/10/640/005 60 comprimidos sublinguales EU/1/10/640/006 100 comprimidos sublinguales
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
sycrest 10 mg
INFORMACIÓN MÍNIMA A INCLUIR EN BLÍSTERS O TIRAS BLÍSTER (10 mg)_
|
1. |
NOMBRE DEL MEDICAMENTO |
Sycrest 10 mg comprimidos sublinguales asenapina
2. NOMBRE DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
N.V. Organon
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE
Lot
5. OTROS
B. PROSPECTO
Prospecto: información para el paciente
Sycrest 5 mg comprimidos sublinguales Sycrest 10 mg comprimidos sublinguales
asenapina
Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico, farmacéutico o enfermero.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico, farmacéutico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es Sycrest y para qué se utiliza
2. Qué necesita saber antes de empezar a tomar Sycrest
3. Cómo tomar Sycrest
4. Posibles efectos adversos
5. Conservación de Sycrest
6. Contenido del envase e información adicional
1. Qué es Sycrest y para qué se utiliza
Sycrest contiene el principio activo asenapina. Este medicamento pertenece al grupo de medicamentos denominados antipsicóticos. Sycrest se utiliza para tratar los episodios maníacos de moderados a graves asociados con el trastorno bipolar I en adultos. Los medicamentos antipsicóticos afectan las sustancias químicas que permiten la comunicación entre las células nerviosas (neurotransmisores). Las enfermedades que afectan al cerebro, como el trastorno bipolar I, pueden deberse al desequilibrio de ciertas sustancias químicas del cerebro, como dopamina y serotonina, y estos desequilibrios pueden causar algunos de los síntomas que está experimentando. No se conoce exactamente cómo actúa este medicamento, sin embargo se cree que ajusta el equilibrio de estas sustancias químicas.
Los episodios maníacos asociados con el trastorno bipolar I son una enfermedad con síntomas tales como sentirse bien, tener una energía exagerada, necesidad de dormir mucho menos de lo habitual, hablar muy deprisa con multitud de ideas y a veces gran irritabilidad.
2. Qué necesita saber antes de empezar a tomar Sycrest No tome Sycrest
Si es alérgico a asenapina o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
Advertencias y precauciones
Consulte a su médico, farmacéutico o enfermero antes de empezar a tomar Sycrest.
Sycrest no se ha estudiado en pacientes de edad avanzada con demencia. Sin embargo, estos pacientes que están tratándose con otros tipos de medicamentos similares, pueden tener un mayor riesgo de accidente cerebrovascular (ictus) o muerte. Sycrest no ha sido aprobado para el tratamiento de pacientes de edad avanzada con demencia y no está recomendado para su uso en este grupo particular de pacientes.
Sycrest puede causar una bajada de la presión sanguínea. En las primeras etapas del tratamiento, algunas personas pueden desmayarse, sobre todo si se incorporan después de estar tumbados o sentados. Normalmente desaparece por sí mismo, pero si no es así, dígaselo a su médico, ya que puede nece sitar un ajuste en su dosis.
Informe a su médico inmediatamente si experimenta
- movimientos rítmicos involuntarios de la lengua, boca y cara. Puede ser necesario suspender el tratamiento con Sycrest.
- fiebre, agarrotamiento muscular intenso, sudoración o disminución del nivel de consciencia (un trastorno llamado "síndrome neuroléptico maligno"). Puede necesitar tratamiento médico inmediato.
Antes de tomar Sycrest, compruebe con su médico o farmacéutico:
- si alguna vez le han diagnosticado una enfermedad cuyos síntomas son alta temperatura corporal y rigidez muscular (también conocido como síndrome neuroléptico maligno).
- si alguna vez ha experimentado movimientos anormales de la lengua o de la cara (discinesia tardía).
Debe estar atento ya que ambas enfermedades pueden ser causadas por este tipo de medicamento.
- si padece una enfermedad del corazón o está en tratamiento de una enfermedad del corazón que pueda hacerle propenso a tener la presión baja
- si padece diabetes o es propenso a la diabetes
- si padece enfermedad de Parkinson o demencia
- si tiene epilepsia (convulsiones)
- si experimenta dificultad al tragar (disfagia)
- si tiene problemas graves del hígado. Si los tiene, no debe tomar Sycrest
- si tiene problema de control de la temperatura corporal
- si tiene pensamientos de suicidio
- si tiene niveles anormalmente altos de prolactina en la sangre (hiperprolactinemia)
Asegúrese de contarle a su médico si se encuentra en cualquiera de estas circunstancias para que él/ella pueda ajustar su dosis o hacerle seguimiento durante algún tiempo. También consulte a su médico inmediatamente si desarrolla cualquiera de estas dolencias o empeoran mientras está usando Sycrest.
Niños y adolescentes
No se recomienda el uso de Sycrest en pacientes menores de 18 años.
Toma de Sycrest con otros medicamentos
Informe a su médico o farmacéutico si está tomando, ha tomado recientemente o podría tener que tomar cualquier otro medicamento. Algunos medicamentos pueden reducir o aumentar el efecto de Sycrest.
Si está tomando otros medicamentos, Sycrest debe tomarse el último.
Debe contarle a su médico si está tomando medicamentos antidepresivos (en concreto fluvoxamina, paroxetina o fluoxetina), ya que puede ser necesario cambiar su dosis de Sycrest o su dosis de antidepresivo.
Debe contarle a su médico si está tomando medicamentos para la enfermedad de Parkinson (como levodopa), ya que este medicamento puede hacerlos menos efectivos.
Sycrest actúa principalmente en el cerebro, por lo que puede haber interferencia con otros medicamentos (o con alcohol) que también actúan en el cerebro debido a una suma de efectos en la función cerebral.
Sycrest puede disminuir la presión sanguínea por lo que se debe tener cuidado cuando Sycrest se toma junto con otros medicamentos que disminuyen la presión sanguínea.
Toma de Sycrest con alimentos, bebidas y alcohol
No comer ni beber durante 10 minutos después de tomar este medicamento.
Debe evitar beber alcohol cuando está tomando este medicamento.
Embarazo y lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento.
No tome Sycrest mientras esté embarazada, a menos que su médico se lo indique. Si está tomando este medicamento y se queda embarazada o planea quedarse embarazada, consulte a su médico lo antes posible para saber si puede continuar tomando Sycrest.
Se pueden producir los siguientes síntomas en bebés recién nacidos, de madres que han sido tratadas con Sycrest en el último trimestre de embarazo (últimos tres meses de su embarazo): temblor, rigidez y/o debilidad muscular, somnolencia, agitación, problemas al respirar, y dificultad en la alimentación. Si su bebé desarrolla cualquiera de estos síntomas se debe poner en contacto con su médico.
No dé el pecho a su bebé mientras esté tomando Sycrest.
Conducción y uso de máquinas
Sycrest puede producir somnolencia o sedación. Por lo tanto, asegúrese de que su concentración y estado de alerta no están afectados antes de conducir o utilizar máquinas.
3. Cómo tomar Sycrest
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico o farmacéutico. En caso de duda, consulte de nuevo a su médico o farmacéutico.
La dosis recomendada es un comprimido sublingual de 5 ó 10 mg dos veces al día. Una dosis debe tomarse por la mañana y otra dosis debe tomarse por la noche.
Instrucciones de uso
Sycrest es para uso sublingual.
No se recomienda Sycrest si no es capaz de tomar el comprimido como se describe a continuación. Si no es capaz de tomar este medicamento como se describe a continuación, el tratamiento puede que no sea efectivo para usted.
- No sacar el comprimido sublingual del blíster hasta el momento de tomarlo.
- Tener las manos secas cuando toque el comprimido.
- No presionar el comprimido sobre el blíster. No cortar ni romper el blíster.
- Despegar la lengüeta coloreada (Figura 1).
- Sacar con cuidado el comprimido (Figura 2). No aplastar el comprimido.
- Para asegurar una óptima absorción, colocar el comprimido bajo la lengua y esperar hasta que se disuelva completamente (Figura 3). El comprimido se disolverá en la saliva en unos segundos.
- No tragar ni masticar el comprimido.
- No comer ni beber durante 10 minutos después de tomar el comprimido.
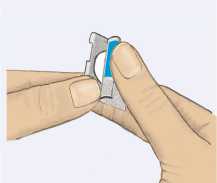
Figura 1
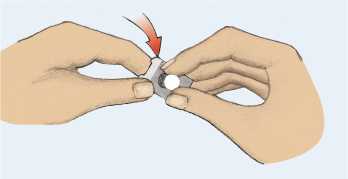
Figura 2
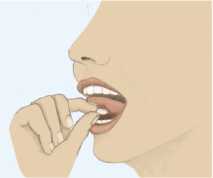
Figura 3
Si toma más Sycrest del que debe
Si toma demasiado Sycrest, contacte con un médico inmediatamente. Lleve el medicamento con usted. En caso de sobredosis puede sentirse somnoliento o cansado, tener movimientos corporales anormales, problemas al estar de pie o caminando, sentirse mareado debido a una bajada de la tensión arterial y sentirse agitado y confundido.
Si olvidó tomar Sycrest
No tome una dosis doble para compensar las dosis olvidadas. Si olvidó tomar una dosis, tome su siguiente dosis como siempre. Si olvidó tomar dos o más dosis, consulte con su médico o farmacéutico.
Si interrumpe el tratamiento con Sycrest
Si interrumpe el tratamiento con Sycrest, perderá los efectos de este medicamento. No debe interrumpir el tratamiento con este medicamento, a menos que su médico se lo indique, ya que sus síntomas pueden reaparecer.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Se han comunicado efectos adversos graves con este medicamento. Solicite atención médica de inmediato si tiene cualquiera de los siguientes síntomas:
- reacciones alérgicas (suelen implicar una combinación de efectos tales como dificultad para respirar o tragar, hinchazón de la cara, labios, lengua o de la garganta, erupción cutánea, picazón y aumento de la frecuencia cardíaca.)
- aumento repentino de la temperatura corporal, con sudoración, pulso acelerado, rigidez muscular grave, confusión y presión arterial variable, que puede llevar al coma
- convulsiones, ataques o crisis
- desmayo
Comunique a su médico de inmediato si tiene:
- signos de aumento de los niveles de azúcar en sangre como sed, hambre u orina excesiva, debilidad o aparición de un empeoramiento de la diabetes
- movimientos serpenteantes de la lengua, u otros movimientos incontrolados de la lengua, boca, mejillas, mandíbula que puede progresar a los brazos y a las piernas
Otros efectos adversos comunicados con este medicamento son:
Efectos adversos muy frecuentes (pueden afectar a más de 1 de cada 10 personas)
- ansiedad
- somnolencia
Efectos adversos frecuentes (pueden afectar hasta 1 de cada 10 personas)
- aumento de peso
- aumento del apetito
- contracciones musculares lentas o sostenidas
- inquietud
- contracciones musculares involuntarias
- movimientos lentos, temblor
- sedación
- mareo
- náuseas
- cambio en el gusto
- sensación de entumecimiento en la lengua o en la boca
- saliva aumentada (babeo)
- tirantez muscular
- fatiga
- aumento del nivel de proteínas del hígado
Efectos adversos poco frecuentes (pueden afectar hasta 1 de cada 100 personas)
- movimientos anormales de los músculos: conjunto de síntomas conocidos como síntomas extrapiramidales, que pueden incluir uno o más de los siguientes: movimientos anormales de los músculos, lengua o mandíbula, contracciones musculares lentas o sostenidas, espasmos musculares, temblor (agitación), movimientos anormales de los ojos, contracciones musculares involuntarias, movimientos lentos o inquietud
- sensación desagradable en las piernas (también conocido como síndrome de la pierna inquieta)
- dificultades al hablar
- latido anormalmente lento o rápido
- bloqueo central del corazón
- electrocardiograma anormal (prolongación del intervalo QT)
- bajada de la presión sanguínea al ponerse de pie
- presión arterial baja
- cosquilleo en la lengua o en la boca
- lengua hinchada o dolorosa
- dificultad al tragar
- úlceras, dolor, enrojecimiento, hinchazón y ampollas dentro de la boca
- disfunción sexual
- ausencia de periodos menstruales regulares
Efectos adversos raros (pueden afectar hasta 1 de cada 1.000 personas)
- alteración de los niveles de células blancas de la sangre (leucocitos)
- dificultad para enfocar la vista
- coágulos sanguíneos en vasos sanguíneos hacia los pulmones, que causan dolor de pecho y dificultad para respirar
- enfermedad muscular que se manifiesta con dolores inexplicables
- aumento del pecho en el hombre
- extravasación de leche o fluidos de la mama
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Anexo V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Sycrest
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en el blíster y en el envase. La fecha de caducidad es el último día del mes que se indica.
Conservar este medicamento en el embalaje original para protegerlo de la luz y de la humedad.
Este medicamento no requiere ninguna temperatura especial de conservación.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
Contenido del envase e información adicional
6.
Composición de Sycrest
- El principio activo es asenapina.
- Cada comprimido sublingual de Sycrest 5 mg contiene 5 mg de asenapina.
- Cada comprimido sublingual de Sycrest 10 mg contiene 10 mg de asenapina.
- La cantidad exacta se muestra en su envase de Sycrest.
- Los demás componentes son gelatina y manitol (E-421).
Aspecto del producto y contenido del envase
Los comprimidos sublinguales de 5 mg son comprimidos redondos, de blanco a blanquecino, marcados con "5" en una de las caras.
Los comprimidos sublinguales de 10 mg son comprimidos redondos, de blanco a blanquecino, marcados con "10" en una de las caras.
Los comprimidos sublinguales se suministran en blísters despegables que contienen 10 comprimidos cada uno. Los envases contienen 20, 60 ó 100 comprimidos.
Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización
N.V. Organon Kloosterstraat 6 NL-5349 AB Oss Países Bajos
Responsable de la fabricación
Organon (Ireland) Ltd.
Drynam Road, Swords Co. Dublín, Irlanda
Schering-Plough Labo N.V.
Industriepark 30
B-2220 Heist-op-den-Berg, Bélgica
medicamento dirigiéndose al representante local del
Pueden solicitar más información respecto a este titular de la autorización de comercialización:
Lietuva
UAB Lundbeck Lietuva Tel: + 370 5 231 4188
Luxembourg/Luxemburg
Lundbeck N.V./S.A. Tel/Tél: +32 2 535 79 79
Magyarország
Lundbeck Hungária Kft. Tel.: +36 1 436 9980
Belgie/Belgique/Belgien
Lundbeck N.V./S.A.
Tel/Tél: +32 2 535 79 79
Etarapna
Lundbeck Export A/S Representative Office Tea.: +359 2 962 4696
Ceská republika
Lundbeck Ceská republika s.r.o.
Tel: +420 225 275 600
|
Deutschland Lundbeck GmbH Tel: +49 40 23649 0 |
Nederland Lundbeck B.V. Tel: +31 20 697 1901 |
|
Eesti Lundbeck Eesti AS Tel: + 372 605 9350 |
Norge H. Lundbeck AS Tlf: + 47 91 300 800 |
|
EXXáSa Lundbeck Hellas S.A. T^: + 30 210 610 5036 |
Osterreich Lundbeck Austria GmbH Tel: +43 1 266 91 08 |
|
España Lundbeck España S.A. Tel: +34 93 494 9620 |
Polska Lundbeck Poland Sp. z o. o. Tel.: + 48 22 626 93 00 |
|
France Lundbeck SAS Tél: + 33 1 79 41 29 00 |
Portugal Lundbeck Portugal, Lda. Tel: +351 21 00 45 900 |
|
Hrvatska Lundbeck Croatia d.o.o. Tel: +385 1 364 92 10 |
Romania Lundbeck Export A/S Reprezentan^a din Romania Tel: +40 21319 88 26 |
|
Ireland Lundbeck (Ireland) Ltd Tel: +353 1 468 9800 |
Slovenija Lundbeck Pharma d.o.o. Tel.: +386 2 229 4500 |
|
Ísland Vistor hf Sími: +354 535 7000 |
Slovenská republika Lundbeck Slovensko s.r.o. Tel: +421 2 5341 42 18 |
|
Italia Lundbeck Italia S.p.A. Tel: +39 02 677 4171 |
Suomi/Finland Oy H. Lundbeck Ab Puh/Tel: + 358 2 276 5000 |
|
Kúnpoq Lundbeck Hellas A.E TnV: + 357 22490305 |
Sverige H. Lundbeck AB Tel: + 46 40 699 82 00 |
|
Latvija SIA Lundbeck Latvia Tel: + 371 6 7 067 884 |
United Kingdom Lundbeck Limited Tel: +44 (0) 1908 649 966 |
Fecha de la última revisión de este prospecto: {mes/AAAA}.
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
45