Suprefact Depot 6,3 Mg Implante En Jeringa Precargada
an
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
SUPREFACT DEPOT 6,3 MG IMPLANTE EN JERINGA PRECARGADA
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Composición cualitativa y cuantitativa
Cada jeringa precargada contiene un implante compuesto de 2 cilindros idénticos que tiene, como principio activo, 6,6 mg de acetato de buserelina, equivalentes a 6,3 mg de buserelina.
Para consultar la lista completa de excipientes ver sección 6.1.
3. FORMA FARMACÉUTICA
Implante en jeringa precargada
Cada implante está compuesto de 2 cilindros color crema, de aproximadamente 1 cm de longitud y 0,1 mm de diámetro, en una jeringa precargada, lista para administrar.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Suprefact Depot está indicado en adultos en el tratamiento del carcinoma prostático hormono-dependiente avanzado. Sin embargo, Suprefact Depot no está indicado después de orquiectomía bilateral puesto que no se obtendría ninguna reducción ulterior de los niveles de testosterona.
4.2 Posología y forma de administración
Posología
Suprefact Depot está indicado para el tratamiento a largo plazo del carcinoma de próstata avanzado.
Población pediátrica
Suprefact Depot no debe utilizarse en niños. No se ha establecido la seguridad y eficacia de Suprefact Depot en niños.
Forma de administración
Cada 2 meses se inyecta por vía subcutáneael contenido de la jeringa (2 cilindros de implante, equivalentes a 6,3 mg de buserelina) en la pared anterior del abdominal (ver sección 6.6). Sin embargo, el intervalo de 2 meses entre inyecciones puede acortarse o alargarse en unos días.
ÍTTI
Antes de la inyección se puede aplicar un anestésico local.
Se recomienda que la administración de un antiandrógeno como terapia coadyuvante se inicie cinco días antes de comenzar el tratamiento con Suprefact Depot (ver también sección 4.4).
4.3 Contraindicaciones
Hipersensibilidad al principio activo , a los análogos de la LHRH o a cualquiera de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
Se recomienda que la administración de un antiandrógeno como terapia coadyuvante se inicie 5 días antes de comenzar el tratamiento con Suprefact Depot. Esta medicación adicional se debe continuar en paralelo con buserelina durante las 3-4 primeras semanas de tratamiento. Después de este tiempo, los niveles de testosterona generalmente disminuyen hasta los valores deseados en respuesta a la buserelina.
La terapia antiandrogénica coadyuvante es también indispensable en pacientes con metástasis conocidas, por ejemplo de médula espinal, para prevenir las complicaciones iniciales debidas a la activación transitoria del tumor y sus metástasis, como pueden ser compresión medular y parálisis (ver también sección 4.8).
La respuesta al tratamiento puede evaluarse mediante la determinación en suero de los niveles de testosterona y antígeno-prostático-específico (PSA). Los niveles de testosterona aumentan al comienzo del tratamiento y a continuación disminuyen progresivamente, durante un período de dos semanas hasta alcanzar, transcurridas de 2 a 4 semanas, los niveles de castración. La ausencia de mejoría clínica o de cambios en los niveles de PSA frente a una adecuada supresión de testosterona son indicativos de insensibilidad hormonal del tumor.
Los pacientes con metástasis conocidas de columna vertebral o aquellos pacientes con riesgo de complicaciones neurológicas o de obstrucción de las vías urinarias deberán estar sometidos a un estricto control durante las primeras semanas de tratamiento, siempre que al inicio del mismo no se administre simultáneamente un antiandrógeno.
Se han publicado estudios epidemiológicos que sugieren una relación entre el tratamiento con agonistas de las hormonas liberadoras de gonadotrofinas (GnRH) y un aumento del riesgo de enfermedad cardiovascular (tales como infarto de miocardio, muerte súbita cardiaca, e ictus) y diabetes mellitus. Debe evaluarse estos riesgos antes de iniciar el tratamiento y durante el mismo, y debe controlarse y tratarse a los pacientes, en consecuencia.
En los pacientes hipertensos se recomienda controlar regularmente la tensión arterial (riesgo de deterioro del control de la presión arterial).
El tratamiento de deprivación androgénica puede prolongar el intervalo QT
En pacientes con antecedentes o con factores de riesgo de prolongación del intervalo QT y en pacientes en tratamiento concomitante con medicamentos que pueden prolongar el intervalo QT (ver sección 4.5), los profesionales sanitarios deben evaluar el balance beneficio/riesgo incluyendo el riesgo potencial de Torsade de Pointes antes de iniciar el tratamiento con Suprefact Depot.
ÍTTI
En algunos pacientes tratados con agonistas Gn-RH, se observan cambios en la tolerancia a la glucosa (ver sección 4.8). En los pacientes diabéticos se recomienda controlar regularmente la glucemia (riesgo de deterioro del control metabólico).
Debido a la supresión de testosterona, el tratamiento con agonistas GnRH podría incrementar el riesgo de anemia. Debe evaluarse este riesgo en los pacientes y ser controlados en consecuencia.
El uso de agonistas LHRH podría estar asociado con una disminución de la densidad ósea lo que podría conducir a una osteoporosis así como a un aumento del riesgo de fractura ósea (ver sección 4.8). Es necesario tener precaución en pacientes con factores de riesgo adicionales para la osteoporosis (por ej. alcoholismo crónico, fumadores, tratamientos a largo plazo con anticonvulsivantes o corticosteroides o un historial familiar de osteoporosis). Se recomienda controlar periódicamente la densidad mineral ósea (DMO) y usar medidas preventivas durante el tratamiento para prevenir la osteopenia/osteoporosis.
Existe un aumento del riesgo de incidencia de depresión (que podría ser grave) en pacientes en tratamiento con agonistas GnRH, como la buserelina. Debe informarse a los pacientes de forma adecuada y tratar apropiadamente si aparecieran los síntomas. Los pacientes con antecedentes de depresión deben ser estrechamente controlados y tratados si es necesario (riesgo de recurrencia o bien de empeoramiento de la depresión).
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios de interacción específicos.
Durante el tratamiento con buserelina, podría atenuarse el efecto de los agentes antidiabéticos (ver también sección 4.8).
Se debe valorar cuidadosamente el uso concomitante de Suprefact Depot con medicamentos que prolongan el intervalo QT o medicamentos capaces de inducir Torsade de Pointes, tales como antiarrítmicos clase IA (por ejemplo: quinidina, disopiramida) o clase III (por ejemplo: amiodarona, sotalol, dofetilida, ibutilida), metadona, moxifloxacino, antipsicóticos, etc. (ver sección 4.4) ya que el tratamiento de deprivación androgénica también puede prolongar el intervalo QT.
4.6 Fertilidad, embarazo y lactancia
Debido a la indicación, Suprefact Depot no debe administrarse a mujeres.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No se ha realizado ningún estudio de los efectos sobre la capacidad para conducir y utilizar máquinas. Determinados efectos adversos (p.ej. mareos) pueden alterar la capacidad de reacción o de concentración del paciente y, por consiguiente, constituyen un riesgo en situaciones en las que éstas son de especial importancia (como es el caso de la conducción de vehículos, la utilización de maquinaria o en situaciones similares). Por tanto, se debe advertir a los pacientes del efecto potencial de estos eventos sobre la capacidad para conducir y utilizar máquinas.
"I
an
4.8 Reacciones adversas
Al comienzo del tratamiento, por lo general, se produce una elevación transitoria de los niveles séricos de testosterona que puede dar lugar a una activación temporal del tumor con reacciones secundarias como son:
- la aparición o exacerbación del dolor óseo en pacientes con metástasis
- signos de déficit neurológico debidos a la compresión del tumor que se pueden manifestar p. ej. por debilidad muscular en las piernas
- alteraciones en la micción, hidronefrosis o linfostasis
- trombosis con embolia pulmonar
Estas reacciones se pueden evitar en gran medida con la administración concomitante de un antiandrógeno en la fase inicial del tratamiento con buserelina (ver también sección 4.4).
Lista de reacciones adversas
Las frecuencias se definen utilizando la convención MedDRA como: muy frecuentes (> 1/10); frecuentes (>1/100, <1/10); poco frecuentes (>1/1.000, <1/100), raras (>1/10.000, <1/1.000); muy raras (<1/10.000), frecuencia no conocida. (no puede estimarse a partir de los datos disponibles).
Neoplasias benignas, malignas y no especificadas (incluyendo quistes y pólipos)
Muy raras: se han notificado casos de crecimiento de adenomas pituitarios durante el tratamiento con agonistas LH-RH, incluyendo buserelina. Incluso con la administración de un antiandrógeno como terapia coadyuvante, aumento leve y transitorio del dolor tumoral.
Trastornos de la sangre y del sistema linfático: Muy raros: trombocitopenia, leucopenia.
Trastornos del sistema inmunológico:
Poco frecuentes: reacciones de hipersensibilidad tales como enrojecimiento de la piel, picor,
erupciones cutáneas (incluyendo urticaria)
Raros: reacciones graves de hipersensibilidad con broncoespasmo y asma alérgica con disnea que en casos aislados puede llevar a shock anafiláctico/anafilactoide
En el caso de que se produzcan reacciones anafilácticas/anafilactoides podría ser necesario la extracción quirúrgica del implante.
Trastornos del metabolismo y la nutrición:
Muy raros: aumento de la sed, cambios en el apetito, reducción en la tolerancia a la glucosa (que en pacientes diabéticos puede llevar a un deterioro del control metabólico).
Trastornos _ psiquiátricos:
Frecuentes: pérdida de la libido; cambios de humor y depresión (tratamiento a largo plazo)
Poco frecuentes: cambios de humor y depresión (tratamiento a corto plazo)
Raros: nerviosismo, inestabilidad emocional, ansiedad.
.<5
"I
¡m
Trastornos del sistema nervioso:
Frecuentes: dolor de cabeza Poco frecuentes: somnolencia, mareo
Raros: trastornos del sueño, trastornos de la memoria y la concentración
En casos aislados, se ha observado parestesia con otras presentaciones de buserelina.
Trastornos oculares:
Muy raros: trastornos de la visión (p.ej. visión borrosa) y sensación de presión detrás de los ojos.
Trastornos del oído y del laberinto:
Muy raros: tinnitus, trastornos de la audición.
Trastornos cardiacos:
Raros: palpitaciones.
Frecuencia no conocida: en experiencia post-comercialización, prolongación del intervalo QT (ver secciones 4.4 y 4.5).
Trastornos vasculares:
Frecuentes: sofocos
Raros: deterioro de los niveles de presión arterial en pacientes hipertensos.
Trastornos gastrointestinales:
Poco frecuentes: estreñimiento Raros: náuseas, vómitos, diarrea.
Trastornos de la piel y del tejido subcutáneo:
Raros: aumento o disminución del cabello y del vello corporal.
Trastornos músculoesqueléticos y del tejido conjuntivo:
Muy raros: molestias músculo-esqueléticas y dolor.
El uso de agonistas LHRH podría estar asociado con la disminución de la densidad ósea lo que podría conducir a una osteoporosis así como a un aumento del riesgo de fractura ósea. El riesgo de rotura esquelética aumenta con la duración de la terapia.
Trastornos del aparato reproductor y de la mama:
Frecuentes: impotencia, atrofia testicular.
Poco frecuentes: ginecomastia (indolora).
Trastornos generales y alteraciones en el lugar de administración:
Frecuentes: dolor u otras reacciones locales (p.ej., enrojecimiento, hinchazón) en el lugar de inyección Poco frecuentes: edema (leve) alrededor del tobillo y parte inferior de las piernas, cansancio Muy raros: deterioro del bienestar general.
Exploraciones complementarias:
Poco frecuentes: aumento de los niveles séricos de enzimas hepáticos (p.ej., transaminasas), aumento o disminución del peso
Raros: cambios de los niveles de lípidos en sangre, aumento de la bilirrubina sérica.
La mayoría de efectos referidos se hallan directa o indirectamente relacionados con la supresión de testosterona por la buserelina (síntomas de déficit androgénico).
La información farmacoepidemiológica indica que la privación androgénica podría aumentar el riesgo de enfermedad cardiovascular, diabetes mellitus y anemia (frecuencia no conocida) (ver sección 4.4).
Notificación de sospechas de reacciones adversas:
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: https://www.notificaram.es.
4.9 Sobredosis
Síntomas
No se ha observado ningún caso de intoxicación o sobredosis con buserelina. Los efectos potenciales descritos con la sobredosis de buserelina no difieren de los efectos adversos observados durante su utilización normal, tales como astenia, dolor de cabeza, nerviosismo, sofocos, mareo, nauseas, dolor abdominal, edemas en las extremidades inferiores, y mastodinia, así como reacciones locales en el lugar de administración (ver sección 4.8).
Tratamiento
En caso necesario, el tratamiento de la sobredosis será sintomático.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Análogos de hormonas liberadoras de gonadotrofinas Código ATC: L02AE01
Mecanismo de acción
Buserelina es un análogo de la hormona natural liberadora de gonadotropinas (gonadorrelina: GnRH, LHRH) con una marcada actividad biológica. Tras la administración repetida de buserelina, la secreción de gonadotropinas y esteroides gonadales se inhibe significativamente.
El efecto farmacológico se debe a la disminución funcional de los receptores de la LH-RH de la hipófisis.
En el hombre, la eliminación de la liberación de gonadotropinas produce una reducción de la síntesis y secreción de testosterona. En la mujer este efecto produce una inhibición de la secreción de estrógenos.
El efecto supresor de la buserelina, sobre la secreción de esteroides gonadales depende de la dosis diaria, la frecuencia de administración y de la duración del tratamiento.
ÍTTI
Aún cuando los niveles de buserelina estén por debajo del límite detección, se preserva la liberación de gonadotropinas debido a la unión mantenida a los receptores del lóbulo anterior de la glándula hipofisaria, (aproximadamente 3 horas).
Mientras la liberación de gonadotropinas es inhibida durante el tratamiento a largo plazo con buserelina, la secreción de otras hormonas hipofisarias (hormona de crecimiento, prolactina, ACTH, TSH) no está influenciada directamente. Sin embargo se puede producir una deficiencia en la secreción de la hormona de crecimiento y prolactina. La secreción de esteroides adrenales permanece inalterada.
En términos de supresión de la estimulación del tejido tumoral por la testosterona, buserelina es tan eficaz como la orquiectomía, en el tratamiento del carcinoma prostático. Comparado con la orquiectomía, la buserelina ofrece la ventaja de ser reversible y de reducir el estrés psicológico del paciente.
5.2 Propiedades farmacocinéticas
Absorción
La buserelina es hidrosoluble; cuando se administra por inyección subcutánea su absorción es segura. Distribución
La buserelina se acumula preferentemente en hígado y riñón así como en el lóbulo anterior de la hipófisis (órgano biológico diana).
Metabolismo o Biotransformación
La buserelina circula en suero predominantemente como forma activa inalterada, su unión a proteínas es del 15% y su excreción (tanto de buserelina como de sus metabolitos inactivos) se produce por vía renal y biliar. La concentración sérica y la excreción de buserelina en orina muestran la misma duración. Aproximadamente el 50% de la buserelina excretada en orina, en el hombre es de forma inalterada.
Buserelina es metabolizada por peptidasas (piroglutamil peptidasa y endopeptidasas tipo quimotripsina) en hígado y riñones así como en el tracto gastrointestinal y mediante este proceso es inactivada. En la glándula hipófisis el receptor de unión a buserelina es inactivado por enzimas localizadas en la membrana.
Eliminación
La vida media de eliminación de buserelina es aproximadamente de 50 a 80 minutos después de una administración intravenosa, de 80 a 120 minutos después de una administración subcutánea y de 1 a 2 horas tras administración nasal.
Hay una pequeña parte de la dosis de buserelina secretada junto con la leche materna. Según los datos clínicos actuales dicha cantidad no ejerce ningún efecto hormonal sobre el lactante.
.-ítp.
JPa
ÍTTI
5.3 Datos preclínicos sobre seguridad Toxicidad crónica
En estudios a largo plazo, no se detectaron signos de toxicidad ni cambios histopatológicos con perros y monos. Los efectos endocrinos solo se observaron a nivel de las gónadas.
Se observó en ratas, con tratamiento a largo plazo, la aparición de adenomas pituitarios, este fenómeno no se encontró en perros y monos.
Carcinogenicidad
Buserelina no demostró tener efecto carcinogénico en los estudios realizados.
Mutagenicidad
Buserelina no demostró potencial mutagénico en ninguno de los estudios realizados.
Teratogenicidad
Buserelina no demostró embriotoxicidad o teratogenicidad. No se ha observado ningún efecto de toxicidad en la madre o en el feto en los animales estudiados, que fuera relevante para el humano.
Inmunotoxicidad
No hubo formación de anticuerpos, en animales aún tratándose de tratamientos a largo plazo.
Tolerancia local
La tolerancia local de la buserelina después de su inyección o después de la aplicación a la mucosa en soluciones acuosas es excelente. Los implantes de acetato de buserelina han demostrado buena tolerancia local y las reacciones en el punto de inyección son mínimas.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Poli (D, L-láctido-co-glicólido) con un cociente molar para el láctico-glicólido de 75:25.
6.2 Incompatibilidades
No aplicable dado que el producto se presenta en un aplicador especial.
6.3 Periodo de validez
3 años.
6.4 Precauciones especiales de conservación
No conservar a temperatura superior a 30°C.
6.5 Naturaleza y contenido del envase
Jeringa precargada con un implante compuesto de dos cilindros, alojados en un aplicador desechable de propionato de celulosa y acero inoxidable precintado en una bolsa de lámina compuesta de polietileno tereftalato, aluminio y polietileno de baja densidad.
Presentaciones: 1 ó 2 jeringas precargadas por envase.

Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación
Advertencia: Para evitar la caída de los dos cilindros del implante de la aguja de inyección (A), mantener el aplicador en posición vertical hasta inmediatamente antes de la punción, con la aguja apuntando hacia arriba.
Manual de instrucciones
c
a &
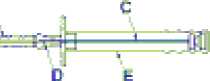
A: Aguja
B: Capuchón protector de la aguja C: Émbolo D: Implante
E: Funda protectora del émbolo
1. Después de abrir el estuche y extraer el aplicador de su envase, comprobar si los dos cilindros del implante se hallan en la ventanilla del mango. En caso necesario, golpear levemente con el dedo el capuchón protector de la jeringa con objeto de recolocarlos en la ventanilla. Una vez abierto el envase, el aplicador debe utilizarse inmediatamente.
2. Desinfectar la zona de la inyección situada en un lado de la pared abdominal. A continuación, después de sacar la funda protectora del émbolo (E), retirar el capuchón de la aguja (B).
3. Elevar un pliegue de la piel e insertar la aguja aproximadamente 3 cm (algo más de una pulgada) en el tejido subcutáneo, manteniendo el aplicador en el momento antes de la punción en posición horizontal o con la punta de la aguja ligeramente orientada hacia arriba. Retirar el aplicador 1 ó 2 cm aproximadamente antes de inyectar los cilindros.
4. Inyectar los dos cilindros del implante en el tejido subcutáneo empujando completamente el émbolo. Comprimir el canal de punción mientras se retira la aguja, de forma que los dos cilindros del implante queden retenidos en el tejido.
5. Para asegurarse que los dos cilindros del implante han sido inyectados, comprobar que el extremo del émbolo sea visible en el extremo de la aguja.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él,
se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
sanofi-aventis, S.A.
Josep Pla, 2
Agencia esparioiaóe medicamentos y oroouctos san-tanos
08019 - Barcelona España
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
60980
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 31 de enero de 1996 Fecha de la última revalidación: 26 de agosto de 2010
10. FECHA DE LA REVISIÓN DEL TEXTO
Febrero 2016
10 de 10