Steozol 4 Mg/5 Ml Concentrado Para Solucion Para Perfusion En Jeringa Precargada
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
STEOZOL 4 mg/5 ml concentrado para solución para perfusión en jeringa precargada
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Una jeringa precargada con 5 ml de concentrado contiene 4 mg de ácido zoledrónico, equivalentes a 4,66 mg de ácido zoledrónico hemipentahidrato.
1 ml de concentrado contiene 0,8 mg de ácido zoledrónico.
Excipientes con efecto conocido: sodio 1,12 mg/ml equivalente a 0,24 mmol.
Para consultar la lista completa de excipientes ver sección 6.1.
3. FORMA FARMACÉUTICA
Concentrado para solución para perfusión en jeringa precargada
Solución transparente libre de partículas visibles, con un pH de 6.0 - 6.8 y osmolalidad de 298-320 mOsm/kg.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
- Prevención de eventos relacionados con el esqueleto (fracturas patológicas, compresión medular, radiación o cirugía ósea, o hipercalcemia inducida por tumor) en pacientes con neoplasias avanzadas con afectación ósea.
- Tratamiento de la hipercalcemia inducida por tumor (TIH).
4.2 Posología y forma de administración
STEOZOL sólo debe ser prescrito y administrado a los pacientes por profesionales sanitarios con experiencia en la administración de bisfosfonatos intravenosos
Posología
Prevención de eventos relacionados con el esqueleto en pacientes con neoplasias avanzadas con afectación ósea.
Adultos y personas de edad avanzada
La dosis recomendada en la prevención de eventos relacionados con el esqueleto en pacientes con neoplasias avanzadas con afectación ósea es de 4 mg de ácido zoledrónico cada 3 ó 4 semanas.
Deberá administrarse a los pacientes diariamente un suplemento oral de calcio de 500 mg y 400 UI de vitamina D.
La decisión de tratar a pacientes con metástasis óseas para la prevención de eventos relacionados con el esqueleto debe tener en cuenta que el inicio del efecto del tratamiento aparece a los 2-3 meses.
Tratamiento de la HIT
Adultos y personas de edad avanzada
La dosis recomendada en hipercalcemia (concentración corregida de calcio sérico respecto a la albúmina > 12,0 mg/dl ó 3,0 mmol/l) es una dosis única de 4 mg de ácido zoledrónico.
Insuficiencia renal TIH:
En los pacientes con HIT que también sufran insuficiencia renal grave el tratamiento con STEOZOL deberá considerarse solamente tras la evaluación de los riesgos y los beneficios del tratamiento. En los ensayos clínicos, se excluyeron a los pacientes con creatinina sérica > 400 pmol/l ó > 4,5 mg/dl. No se
requiere un ajuste de la dosis en los pacientes con HIT con una creatinina sérica < 400 pmol/l ó < 4,5 mg/dl (ver sección 4.4).
Prevención de eventos relacionados con el esqueleto en pacientes con neoplasias avanzadas con afectación ósea:
Cuando se inicia el tratamiento con STEOZOL en pacientes con mieloma múltiple o con lesiones metastásicas óseas de tumores sólidos, se deberá determinar la creatinina sérica y el aclaramiento de creatinina (CLcr). El CLcr se calcula a partir de la creatinina sérica utilizando la fórmula de Cockcroft-Gault. No se recomienda STEOZOL en los pacientes que presenten insuficiencia renal grave, definida para esta población como CLcr < 30 ml/min, antes del inicio del tratamiento. En los ensayos clínicos con ácido zoledrónico, se excluyeron los pacientes con creatinina sérica > 265 pmol/l ó > 3,0 mg/dl.
En pacientes con metástasis óseas que presentaban insuficiencia renal de leve a moderada, definida para esta población como CLcr 30-60 ml/min, antes del inicio de tratamiento se recomienda la siguiente dosis de STEOZOL (ver también sección 4.4):
|
Aclaramiento de creatinina basal (ml/min) |
Dosis recomendada de STEOZOL* |
|
> 60 |
4,0 mg de ácido zoledrónico |
|
50-60 |
3,5 mg* de ácido zoledrónico |
|
40-49 |
3,3 mg* de ácido zoledrónico |
|
30-39 |
3,0 mg* de ácido zoledrónico |
* Las dosis se han calculado asumiendo un AUC objetivo de 0,66 (mg.hr/l) (CLcr = 75 ml/min). Se espera que en los pacientes con insuficiencia renal las dosis reducidas alcancen la misma AUC que la observada en los pacientes con aclaramiento de creatinina de 75 ml/min.
Una vez iniciado el tratamiento deberá medirse la creatinina sérica antes de cada dosis de STEOZOL y el tratamiento deberá interrumpirse si se ha deteriorado la función renal. En los ensayos clínicos, el deterioro renal se definió como se indica a continuación:
- Para pacientes con creatinina sérica basal normal (< 1,4 mg/dl ó < 124 pmol/l), un aumento de 0,5 mg/dl ó 44 pmol/l;
- Para pacientes con creatinina basal anormal (> 1,4 mg/dl, ó > 124 pmol/l), un aumento de 1,0 mg/dl ó 88 pmol/l.
En los ensayos clínicos, el tratamiento con ácido zoledrónico se reanudó únicamente cuando el nivel de creatinina volvió a hallarse dentro de un 10% del valor basal (ver sección 4.4). El tratamiento con Zometa deberá reanudarse a la misma dosis administrada antes de la interrupción del tratamiento.
Población pediátrica
No se ha establecido la seguridad y eficacia del ácido zoledrónico en niños de 1 año a 17 años. Los datos actualmente disponibles se incluyen en las secciones 4.4 y 5.1, sin embargo no se puede hacer una recomendación posológica.
Forma de administración Vía intravenosa.
STEOZOL 4 mg concentrado para solución para perfusión posteriormente diluido en 100 ml (ver sección 6.6) se debe administrar como una perfusión intravenosa única durante, como mínimo, 15 minutos.
En pacientes con insuficiencia renal de leve a moderada, se recomiendan dosis reducidas de STEOZOL (ver la sección anterior “Posología” y la sección 6.3).
Instrucciones para preparar dosis reducidas de STEOZOL:
Retirar un volumen apropiado del concentrado necesario, como se indica a continuación:
- 4,4 ml para una dosis de 3,5 mg
- 4,1 ml para una dosis de 3,3 mg
- 3,8 ml para una dosis de 3,0 mg
La cantidad de concentrado retirada debe diluirse posteriormente en 100 ml de solución estéril de cloruro sódico al 0,9% p/V o en solución de glucosa al 5% p/v. La dosis deberá administrarse como perfusión intravenosa única durante 15 minutos como mínimo.
STEOZOL concentrado no se debe mezclar con otras soluciones para perfusión que contengan calcio u otros cationes divalentes, como la solución de Ringer lactato, y se debe administrar como solución intravenosa única en una vía de perfusión separada.
Los pacientes se deben mantener bien hidratados antes y después de la administración de STEOZOL.
4.3 Contraindicaciones
- Hipersensibilidad al principio activo, a otros bisfosfonatos, o a alguno de los excipientes relacionados en la sección 6.1.
- Lactancia (ver sección 4.6)
4.4 Advertencias y precauciones especiales de empleo
General
Los pacientes deben ser evaluados antes de la administración de STEOZOL para asegurar que están adecuadamente hidratados.
Debe evitarse la sobrehidratación en pacientes con riesgo de insuficiencia cardíaca.
Los parámetros metabólicos habituales relacionados con la hipercalcemia, como las concentraciones séricas de calcio, fosfato y magnesio, deben ser cuidadosamente vigilados después de iniciar la terapia con STEOZOL. Puede ser necesario un tratamiento adicional a corto plazo si se produce hipocalcemia, hipofosfatemia o hipomagnesemia. Los pacientes con hipercalcemia no tratada, presentan generalmente algún grado de alteración de la función renal, por lo tanto, deberá considerarse la monitorización cuidadosa de la función renal.
Los pacientes que están siendo tratados con STEOZOL no deberán recibir tratamiento con otros medicamentos que contengan ácido zoledrónico ni con ningún otro bisfosfonato de forma concomitante, puesto que se desconocen los efectos combinados de estos agentes.
Insuficiencia renal
Deberá evaluarse apropiadamente a los pacientes con HIT y evidencia de deterioro de la función renal, teniendo en consideración si el beneficio potencial del tratamiento con STEOZOL supera el posible riesgo.
La decisión de tratar a pacientes con metástasis óseas para la prevención de eventos relacionados con el esqueleto deberá tener en consideración que el inicio del efecto del tratamiento es de 2-3 meses.
Como con otros bifosfonatos, STEOZOL se ha asociado con descripciones de disfunción renal. Los factores que pueden aumentar el riesgo de deterioro de la función renal incluyen deshidratación, insuficiencia renal preexistente, ciclos múltiples de STEOZOL y otros bisfosfonatos y también el uso de otros medicamentos nefrotóxicos. A pesar de que el riesgo se reduce con una dosis de 4 mg de ácido zoledrónico administrada durante 15 minutos, puede presentarse todavía deterioro de la función renal. Se han notificado casos de deterioro de la función renal con progresión a insuficiencia renal y diálisis después de la administración de la dosis inicial o de una dosis única de 4 mg de STEOZOL. En algunos pacientes con administración crónica de STEOZOL a las dosis recomendadas para prevención de eventos relacionados con el esqueleto también se presentan aumentos de creatinina sérica, aunque con menor frecuencia.
Antes de cada dosis de STEOZOL deberán valorarse los niveles de creatinina sérica de los pacientes. Al inicio del tratamiento de pacientes con metástasis óseas con insuficiencia renal de leve a moderada, se
recomiendan dosis más bajas de STEOZOL. En pacientes que muestren evidencia de deterioro renal durante el tratamiento, deberá interrumpirse la administración de STEOZOL. Solamente deberá reanudarse el tratamiento con STEOZOL cuando la creatinina sérica vuelva a hallarse dentro de un 10% del valor basal. El tratamiento con STEOZOL se debe reanudar a la misma dosis administrada antes de la interrupción del tratamiento.
En vista del impacto potencial de los bifosfonatos, incluyendo STEOZOL, sobre la función renal, la ausencia de datos clínicos de seguridad en pacientes con insuficiencia renal grave (definida en los ensayos clínicos como creatinina sérica > 400 pmol/l o > 4,5 mg/dl para pacientes con HIT y > 265 pmol/l o > 3,0 mg/dl para pacientes con cáncer y metástasis óseas, respectivamente) a nivel basal y los limitados datos de farmacocinética en pacientes con insuficiencia renal grave a nivel basal (aclaramiento de creatinina < 30 ml/min), no se recomienda el uso de STEOZOL en pacientes con insuficiencia renal grave.
Insuficiencia hepática
Dado que sólo se dispone de datos clínicos limitados en pacientes con insuficiencia hepática grave, no pueden darse recomendaciones específicas para esta población de pacientes.
Osteonecrosis de mandíbula
Se ha observado osteonecrosis de mandíbula (ONM) predominantemente en pacientes con cáncer, tratados con bifosfonatos, incluyendo STEOZOL. Muchos de estos pacientes también recibían quimioterapia y corticosteroides. La mayoría de los casos descritos se han asociado con procesos dentales, tales como una extracción dental. Muchos mostraron signos de infección local incluyendo osteomielitis.
En aquellos pacientes con factores de riesgo concomitante (p.ej. cáncer, quimioterapia, corticosteroides, una higiene oral pobre), deberá considerarse un examen dental con una apropiada odontología preventiva, antes de iniciar el tratamiento con bisfosfonatos.
Durante el tratamiento, si es posible, estos pacientes deben evitar procesos dentales invasivos. La cirugía dental puede agravar la situación en pacientes que desarrollen osteonecrosis de mandíbula durante la terapia con bisfosfonatos. No hay datos disponibles que indiquen si la interrupción del tratamiento con bisfosfonatos reduce el riesgo de osteonecrosis de mandíbula en pacientes que precisen procesos dentales. La valoración clínica del médico, debe orientar sobre cómo proceder con cada paciente según la valoración individual de la relación beneficio-riesgo.
Dolor musculoesquelético
En la experiencia post-comercialización, se han notificado casos de dolor óseo, articular y muscular grave y ocasionalmente incapacitante, en pacientes que toman bifosfonatos. Sin embargo, estos informes han sido infrecuentes. Esta categoría de fármacos incluye STEOZOL (ácido zaledrónico). El tiempo hasta la aparición de los síntomas varió desde un día hasta varios meses tras el inicio del tratamiento. La mayor parte de los pacientes mejoró al suspender el tratamiento. Un subgrupo presentó recurrencia de los síntomas al administrar otra vez STEOZOL u otro bisfosfonato.
Fracturas atípicas de fémur
Se han notificado casos de fracturas atípicas subtrocantéricas y diafisarias del fémur asociadas al tratamiento con bisfosfonatos, principalmente en pacientes en tratamiento prolongado para la osteoporosis. Estas fracturas transversales u oblicuas cortas pueden ocurrir en cualquier parte a lo largo del fémur, desde justo debajo del trocánter menor hasta justo por encima de la cresta supracondílea. Estas fracturas se producen después de un traumatismo mínimo o en ausencia de él y algunos pacientes tienen dolor en el muslo o en la ingle, a menudo asociado con imágenes características de fracturas por sobrecarga, semanas a meses antes de que se presente la fractura femoral completa. Las fracturas son generalmente bilaterales; por lo tanto, el fémur del lado opuesto debe ser examinado en los pacientes tratados con bisfosfonatos que hayan tenido una fractura de la diálisis femoral. También se ha notificado un bajo índice de consolidación de estas fracturas. Debe considerarse la interrupción del tratamiento con bisfosfonatos, valorando de forma individualizada el balance beneficio/riesgo, en aquellos pacientes en los que exista sospecha de fractura atípica de fémur pendiente de evaluación.
Durante el tratamiento con bisfosfonatos debe advertirse a los pacientes que notifiquen cualquier dolor en el muslo, cadera o ingle. En cualquier paciente que presente dichos síntomas deberá valorarse si existe una fractura de fémur incompleta.
Este medicamento contiene menos de 1 mmol (23 mg) de sodio por ml, por lo que se considera esencialmente “exento de sodio”
4.5 Interacción con otros medicamentos y otras formas de interacción
En ensayos clínicos, el ácido zaledrónico se ha administrado simultáneamente con agentes anticancerosos, diuréticos, antibióticos y analgésicos utilizados comúnmente sin que ocurrieran interacciones clínicamente evidentes.
In vitro, el ácido zoledrónico no se une considerablemente a proteínas plasmáticas y no inhibe las enzimas humanas del citocromo P450 (ver sección 5.2), aunque no se han realizado estudios clínicos estrictos de interacciones.
Se recomienda precaución cuando se administran bisfosfonatos con aminoglucósidos, dado que ambos agentes pueden ejercer un efecto aditivo, dando como resultado una menor concentración de calcio sérico durante periodos más largos de los necesarios.
Se recomienda precaución cuando se utilice STEOZOL junto con otros medicamentos potencialmente nefrotóxicos. También debe prestarse atención a la posibilidad de que se desarrolle hipomagnesemia durante el tratamiento.
En los pacientes con mieloma múltiple, el riesgo de disfunción renal puede verse aumentado cuando se administre bifosfonatos intravenosos en combinación con talidomida.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No existen datos suficientes sobre la utilización de ácido zoledrónico en mujeres embarazadas. Estudios de reproducción en animales con ácido zoledrónico han mostrado toxicidad reproductiva (ver sección 5.3). Se desconoce el riesgo en seres humanos. STEOZOL no debe utilizarse durante el embarazo.
Lactancia
Se desconoce si el ácido zoledrónico se excreta en la leche materna. STEOZOL está contraindicado en mujeres en periodo de lactancia (ver sección 4.3).
Fertilidad
Se estudió el ácido zoledrónico en ratas para evaluar los potenciales efectos adversos sobre la fertilidad de la generación parental y la F1. Esto provocó unos efectos farmacológicos exagerados que se consideraron relacionados con la inhibición del metabolismo cálcico óseo debida al producto, que dio lugar a hipocalcemia periparturienta, un efecto de clase de los bisfosfonatos, distocia y finalización temprana del estudio. Por lo tanto, estos resultados impiden determinar un efecto claro del ácido zoledrónico sobre la fertilidad en humanos.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
Las reacciones adversas como mareo y somnolencia pueden tener influencia sobre la capacidad para conducir o utilizar máquinas, aunque no se han realizado estudios del ácido zoledrónico sobre este efecto.
4.8 Reacciones adversas
Resumen del perfil de seguridad
En los tres días posteriores a la administración de STEOZOL, se ha notificado de forma frecuente una reacción de fase aguda, con síntomas que incluyen dolor óseo, fiebre, fatiga, artralgia, mialgia y escalofríos; estos síntomas habitualmente se resuelven en pocos días (ver descripción de las reacciones adversas seleccionadas).
Los siguientes riesgos importantes son los que se han identificado con STEOZOL en las indicaciones autorizadas:
Alteración de la función renal, osteonecrosis de la mandíbula, reacción de fase aguda, hipocalcemia, efectos adversos oculares, fibrilación auricular, anafilaxis. En la Tabla 1 se muestran las frecuencias para cada uno de estos riesgos identificados.
Lista tabulada de reacciones adversas
Las siguientes reacciones adversas, relacionadas en la Tabla 1 se han recopilado de los ensayos clínicos y de las notificaciones post-comercialización, principalmente tras el tratamiento crónico con 4 mg de ácido zoledrónico:
Tabla 1
Las reacciones adversas están agrupadas por frecuencias, la más frecuente primero, utilizando la siguiente convención: Muy frecuentes (> 1/10), frecuentes (>1/100 a <1/10), poco frecuentes (>1/1.000 a <1/100), raras (>1/10.000 a <1/1.000), muy raras (<1/10.000), frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
|
Trastornos de la sangre y del sistema linfático Frecuentes: Poco frecuentes: Raras: |
Anemia Trombocitopenia, leucopenia Pancitopenia |
|
Trastornos del sistema inmunológico Poco frecuentes: Raras: |
Reacción de hipersensibilidad Edema angioneurótico |
|
Trastornos psiquiátricos Poco frecuentes: Raras: |
Ansiedad, alteraciones de sueño Confusión |
|
Trastornos del sistema nervioso Frecuentes: Poco frecuentes: |
Cefalea Mareo, parestesia, alteración del gusto, hipoestesia, hiperestesia, temblores, somnolencia |
|
Trastornos oculares Frecuentes: Poco frecuentes: Muy raras: |
Conjuntivitis Visión borrosa, escleritis e inflamación orbital Uveitis, episcleritis |
|
Trastornos cardiacos Poco frecuentes: Raras: |
Hipertensión, hipotensión, fibrilación auricular, hipotensión que provoca síncope o colapso circulatorio Bradicardia |
Trastornos respiratorios, torácicos y mediastínicos
Poco frecuentes:
Disnea, tos, broncoconstricción
|
Trastornos gastrointestinales Frecuentes: Poco frecuentes: |
Náuseas, vómitos, anorexia Diarrea, estreñimiento, dolor abdominal, dispepsia, estomatitis, sequedad de boca |
|
Trastornos de la piel y del tejido subcutáneo | |
|
Poco frecuentes: |
Prurito, erupción (incluyendo erupción |
|
eritematosa y macular), aumento de la | |
|
sudoración | |
|
Trastornos musculoesqueléticos y del tejido conjuntivo | |
|
Frecuentes: |
Dolor óseo, mialgia, artralgia, dolor |
|
generalizado | |
|
Poco frecuentes: |
Calambres musculares, osteonecrosis de la |
|
mandíbula* | |
|
Trastornos renales y urinarios | |
|
Frecuentes: |
Insuficiencia renal |
|
Poco frecuentes: |
Insuficiencia renal aguda, hematuria, |
|
_proteinuria | |
|
Trastornos generales y alteraciones en el lugar de administración | |
|
Frecuentes: |
Fiebre, síndrome similar a la gripe |
|
(incluyendo fatiga, escalofríos, malestar y | |
|
sofocos) | |
|
Poco frecuentes: |
Astenia, edema periférico, reacciones en el |
|
lugar de la inyección (incluyendo dolor, | |
|
irritación, tumefacción, induración), dolor | |
|
torácico, aumento de peso, reacción | |
|
anafiláctica/shock, urticaria | |
|
Exploraciones complementarias | |
|
Muy frecuentes: |
Hipofosfatemia |
|
Frecuentes: |
Aumento de la creatinina y urea sanguíneas, |
|
hipocalcemia | |
|
Poco frecuentes: |
Hipomagnesemia, hipopotasemia |
|
* Basado en ensayos clínicos con adjudicación de posibles casos de osteonecrosis de la | |
|
mandíbula. Puesto que estas notificaciones están sujetas a factores que pueden causar | |
|
confusión, no es posible establecer de forma fiable la relación causal con la exposición | |
|
al medicamento | |
Descripción de las reacciones adversas seleccionadas
Alteración de la función renal
STEOZOL se ha asociado con notificaciones de alteración renal. El potencial deterioro de la función renal puede aumentar por factores que incluyen deshidratación, insuficiencia renal preexistente, ciclos múltiples de Zometa u otros bisfosfonatos, así como un uso concomitante de medicamentos nefrotóxicos o un tiempo de perfusión más corto del actualmente recomendado. Se han notificado casos de deterioro renal, progresión a insuficiencia renal y diálisis en pacientes después de la dosis inicial o de una dosis única de 4 mg de ácido zoledrónico (ver sección 4.4).
Osteonecrosis de la mandíbula
Se han descrito casos de osteonecrosis (especialmente de las mandíbulas) predominantemente en pacientes con cáncer tratados con medicamentos que inhiben la resorción ósea, como STEOZOL. Muchos de estos pacientes presentaron signos de infección local incluyendo osteomielitis, y la mayoría de los informes hacen referencia a pacientes con cáncer tras una extracción dentaria u otras cirugías dentales. La
osteonecrosis de la mandíbula tiene múltiples factores de riesgo documentados, incluyendo cáncer diagnosticado, tratamientos concomitantes (p.ej. quimioterapia, radioterapia, corticosteroides) y situaciones comórbidas (p.ej. anemia, coagulopatías, infección, afección oral preexistente). Aunque no se ha determinado la causalidad, se recomienda evitar la cirugía dental ya que la recuperación puede ser larga (ver sección 4.4).
Fibrilación auricular
En un ensayo clínico controlado, doble ciego, aleatorizado y de 3 años de duración que evaluó la eficacia y la seguridad de 5 mg de ácido zoledrónico administrados una vez al año frente a placebo en el tratamiento de la osteoporosis postmenopáusica (OPM), la incidencia global de fibrilación auricular en pacientes que recibieron 5 mg de ácido zoledrónico y placebo fue de un 2,5% (96 de 3.862) y de un 1,9% (75 de 3.852), respectivamente. La proporción de reacciones adversas graves de fibrilación auricular fue de 1,3% (51 de 3.862) y de 0,6% (22 de 3.852) en pacientes que recibieron 5 mg de ácido zoledrónico y placebo, respectivamente. La diferencia observada en este ensayo no se ha observado en otros ensayos con ácido zoledrónico, incluyendo los ensayos con STEOZOL (ácido zoledrónico) 4 mg, administrado cada 3-4 semanas en pacientes oncológicos. Se desconoce el mecanismo causante del aumento de la incidencia de fibrilación auricular en este ensayo clínico en particular.
Reacción de fase aguda
Esta reacción adversa al fármaco consiste en un grupo de síntomas que incluyen fiebre, mialgia, cefalea, dolor en las extremidades, náuseas, vómitos, diarrea y artralgia. El tiempo de inicio es < 3 días tras la perfusión de STEOZOL, y la reacción también se describe con los términos de síntomas “similares a la gripe” o “post-administración”.
Fracturas atípicas del _ fémur
Durante la experiencia postcomercialización se han notificado las siguientes reacciones adversas (frecuencia rara):
Fracturas atípicas subtrocantéricas y diafisarias del fémur (reacción adversa de clase de los bisfosfonatos).
4.9 Sobredosis
La experiencia clínica sobre la sobredosis con ácido zoledrónico es limitada. Se ha notificado la administración de dosis de hasta 48 mg de ácido zoledrónico por error. Los pacientes que han recibido dosis superiores a las recomendadas (ver sección 4.2) deben someterse a una monitorización estrecha, dado que se han observado alteración de la función renal (incluyendo insuficiencia renal) y valores anómalos de los electrolitos séricos (incluyendo calcio, fósforo y magnesio). Si se produce una hipocalcemia, debe administrarse perfusiones de gluconato cálcico, según criterio clínico.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Fármacos para el tratamiento de enfermedades óseas, bisfosfonatos, código ATC: M05BA08
El ácido zoledrónico pertenece a la clase de los bisfosfonatos y actúa principalmente en el hueso. Es un inhibidor de la resorción ósea osteoclástica.
La acción ósea selectiva de los bisfosfonatos se basa en su gran afinidad por el hueso mineralizado, pero el mecanismo molecular preciso que da lugar a la inhibición de la actividad osteoclástica aún no está claro. En estudios de larga duración en animales, el ácido zoledrónico inhibe la resorción ósea sin perjudicar la formación, mineralización ni las propiedades mecánicas del hueso.
Además de ser un muy potente inhibidor de la resorción ósea, el ácido zoledrónico también posee varias propiedades antitumorales que pueden contribuir a su eficacia general en el tratamiento de la metástasis ósea. Se han demostrado las siguientes propiedades en ensayos preclínicos:
- In vivo: Inhibición de la resorción ósea osteoclástica, lo que altera el microentorno de la médula ósea haciéndolo menos favorable al crecimiento de la célula tumoral, actividad antiangiogénica y actividad analgésica.
- In vi tro: Inhibición de la proliferación osteoblástica, actividad citostática directa y pro-apoptótica sobre las células tumorales, efecto citostático sinérgico con otros fármacos anticancerígenos, actividad antiadhesiva/invasiva.
Resultados de los ensayos clínicos en la prevención de eventos relacionados con el esqueleto en pacientes con neoplasias avanzadas con afectación ósea
El primer estudio aleatorizado, doble ciego, controlado con placebo comparó 4 mg de ácido zoledrónico con placebo para la prevención de eventos relacionados con el esqueleto (ERE) en pacientes con cáncer de próstata. La administración de 4 mg de ácido zoledrónico disminuyó significativamente la proporción de pacientes que experimentaron al menos un evento relacionado con el esqueleto (ERE), retrasó la mediana de tiempo hasta el primer ERE en más de 5 meses y redujo la incidencia anual de eventos por paciente -tasa de morbididad esquelética. El análisis de eventos múltiples mostró una reducción del riesgo del 36% en el desarrollo de ERE en el grupo de 4 mg de ácido zoledrónico en comparación con placebo. Los pacientes que recibieron 4 mg de ácido zoledrónico registraron un menor incremento del dolor que los que recibieron placebo, alcanzando diferencias significativas en los meses 3, 9, 21 y 24. Un menor número de pacientes tratados con 4 mg de ácido zoledrónico sufrió fracturas patológicas. Los efectos del tratamiento fueron menos pronunciados en pacientes con lesiones blásticas. Los resultados de eficacia se muestran en la Tabla 2.
En un segundo estudio, que incluía tumores sólidos diferentes del cáncer de mama y de próstata, ácido zoledrónico redujeron significativamente la proporción de pacientes con un ERE, retrasó la mediana de tiempo hasta el primer ERE en más de 2 meses y redujo la tasa de morbididad esquelética. El análisis de eventos múltiples mostró una reducción del riesgo del 30,7% en el desarrollo de ERE en el grupo de 4 mg de ácido zoledrónico en comparación con placebo. Los resultados de eficacia se muestran en la Tabla 3.
Tabla 2: Resultados de eficacia (pacientes con cáncer de próstata que recibían terapia hormonal)
|
Aluún ERE (+HIT) |
Fracturas* |
Radioterapia en hueso | ||||
|
ácido zoledrónico 4 mg |
Placebo |
ácido zoledrónico 4 mg |
Placebo |
ácido zoledrónico 4 mg |
Placebo | |
|
N |
214 |
208 |
214 |
208 |
214 |
208 |
|
Proporción de pacientes con ERE (%) |
38 |
49 |
17 |
25 |
26 |
33 |
|
Valor p |
0,028 |
0,052 |
0,119 | |||
|
Mediana de tiempo hasta ERE (días) |
488 |
321 |
NA |
NA |
NA |
640 |
|
Valor p |
0,009 |
0,020 |
0,055 | |||
|
Tasa de morbididad esquelética |
0,77 |
1,47 |
0,20 |
0,45 |
0,42 |
0,89 |
|
Valor p |
0,005 |
0,023 |
0,060 | |||
|
Reducción del riesgo de sufrir eventos múltiples** (%) |
36 |
NAp |
NAp |
NAp |
Nap | |
|
Valor p |
0,002 |
NAp |
NAp | |||
Incluye fracturas vertebrales y no vertebrales
¥* Tiene en cuenta todos los eventos esqueléticos, el número total así como el tiempo hasta cada evento durante el ensayo NA No Alcanzado NAp No aplicable
Tabla 3: Resultados de eficacia (tumores sólidos distintos de cáncer de mama o próstata)
|
Algún ERE (+HIT) |
Fracturas* |
Radioterapia en hueso | ||||
|
ácido zoledrónico 4 mg |
Placebo |
ácido zoledrónico 4 mg |
Placebo |
ácido zoledrónico 4 mg |
Placebo | |
|
N |
257 |
250 |
257 |
250 |
257 |
250 |
|
Proporción de pacientes con ERE (%) |
39 |
48 |
16 |
22 |
29 |
34 |
|
Valor p |
0,039 |
0,064 |
0,173 | |||
|
Mediana de tiempo hasta ERE (días) |
236 |
155 |
NA |
NA |
424 |
307 |
|
Valor p |
0,009 |
0,020 |
0,079 | |||
|
Tasa de morbididad esquelética |
1,74 |
2,71 |
0,39 |
0,63 |
1,24 |
1,89 |
|
Valor p |
0,012 |
0,066 |
0,099 | |||
|
Reducción del riesgo de sufrir eventos múltiples** (%) |
30,7 |
NAp |
NAp |
NAp |
NAp | |
|
Valor p |
0,003 |
NAp |
NAp | |||
Incluye fracturas vertebrales y no vertebrales
Tiene en cuenta todos los eventos esqueléticos, el número total así como el tiempo hasta cada
evento durante el ensayo NA No Alcanzado NAp No aplicable
En un tercer ensayo de fase III aleatorizado, doble ciego, se comparó 4 mg de ácido zoledrónico con pamidronato 90 mg cada 3 o 4 semanas en pacientes con mieloma múltiple o cáncer de mama con al menos una lesión ósea. Los resultados demostraron que 4 mg deácido zoledrónico mostraban una eficacia comparable a pamidronato 90 mg en la prevención de ERE. El análisis de eventos múltiples reveló una reducción significativa del riesgo del 16% en pacientes tratados con 4 mg de ácido zoledrónico en comparación con los pacientes que recibieron pamidronato. Los resultados de eficacia se muestran en la Tabla 4.
Tabla 4: Resultados de eficacia (pacientes con cáncer de mama o mieloma múltiple)
|
Alsún ERE (+HIT) |
Fracturas* |
Radioterania en hueso | ||||
|
ácido zoledrónico 4 mg |
Pam 90 mg |
ácido zoledrónico 4 mg |
Pam 90 mg |
ácido zoledrónico 4 mg |
Pam 90 mg | |
|
N |
561 |
555 |
561 |
555 |
561 |
555 |
|
Proporción de pacientes con ERE (%) |
48 |
52 |
37 |
39 |
19 |
24 |
|
Valor p |
0,198 |
0,653 |
0,037 | |||
|
Mediana de tiempo hasta ERE (días) |
376 |
356 |
NA |
714 |
NA |
NA |
|
Valor p |
0,151 |
0,672 |
0,026 | |||
|
Tasa de morbididad esquelética |
1,04 |
1,39 |
0,53 |
0,60 |
0,47 |
0,71 |
|
Valor p |
0,084 |
0,614 |
0,015 | |||
|
Reducción del riesgo de sufrir eventos múltiples** (%) |
16 |
NAp |
NAp |
NAp |
NAp | |
|
Valor p |
0,030 |
NAp |
NAp | |||
Incluye fracturas vertebrales y no vertebrales
Tiene en cuenta todos los eventos esqueléticos, el número total así como el tiempo hasta cada
evento durante el ensayo NA No Alcanzado NAp No aplicable
Se estudiaron también 4 mg de ácido zoledrónico en un ensayo controlado con placebo, randomizado y doble ciego en 228 pacientes con metástasis óseas documentadas a partir de cáncer de mama, para evaluar el efecto de 4 mg de ácido zoledrónico sobre la tasa de eventos relacionados con el esqueleto (ERE), calculada como el número total de eventos ERE (excluyendo hipercalcemia y ajustado para fractura previa), dividido por el periodo total de riesgo. Los pacientes recibieron 4 mg de ácido zoledrónico o placebo cada cuatro semanas durante un año. Los pacientes se distribuyeron a partes iguales entre los grupos tratados con ácido zoledrónico y con placebo.
La tasa de ERE (eventos/persona año) fue 0,628 para ácido zoledrónico y 1,096 para placebo. La proporción de pacientes con al menos un ERE (excluyendo hipercalcemia) fue de 29,8% en el grupo tratado con ácido zoledrónico frente a 49,6% en el grupo con placebo (p=0,003). La mediana de tiempo hasta el inicio del primer ERE no se alcanzó en el brazo de tratamiento con ácido zoledrónico al final del ensayo y fue significativamente prolongada comparado con placebo (p=0,007). En un análisis de evento múltiple 4 mg de ácido zoledrónico redujeron el riesgo de EREs en un 41% (RR=0,59, p=0,019) comparado con placebo.
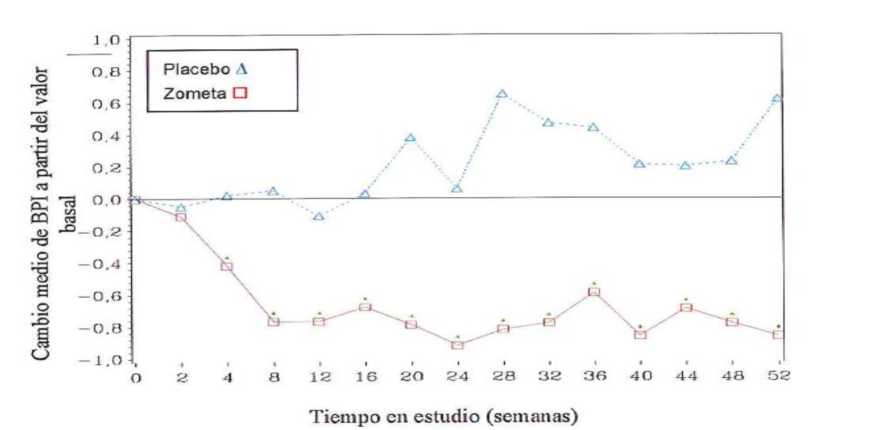
En el grupo tratado con ácido zoledrónico, se observó una mejoría estadísticamente significativa en la puntuación de medida del dolor (utilizando el “Brief Pain Inventory”, BPI) a las 4 semanas y en cada punto de tiempo posterior durante el estudio, en comparación a placebo (Figura 1). La puntuación en la escala de dolor obtenida con ácido zoledrónico fue consistentemente inferior a la basal y la reducción de dolor se acompañó de una tendencia decreciente en las puntuaciones obtenidas en la escala de uso de analgésicos.
Figura 1: Cambios medios en la puntuación de BPI respecto al valor basal. Las diferencias estadísticamente significativas están marcadas (*p<0,05) para las comparaciones entre tratamientos (4 mg de ácido zoledrónico frente a placebo)
ÜE
Resultados de los ensayos clínicos en el tratamiento de la HIT
Los ensayos clínicos en hipercalcemia inducida por tumor (HIT) demostraron que el ácido zoledrónico se caracteriza por disminuir el calcio sérico y la excreción urinaria de calcio. En los estudios de Fase I de búsqueda de dosis en pacientes con hipercalcemia inducida por tumor (HIT) de leve a moderada, las dosis efectivas ensayadas estuvieron en el rango de aproximadamente 1,2-2,5 mg.
Para valorar los efectos de 4 mg de ácido zoledrónico frente a 90 mg de pamidronato, se combinaron los resultados de dos ensayos multicéntricos principales en pacientes con HIT en un análisis previamente planificado. Hubo una normalización más rápida de las concentraciones corregidas de calcio sérico en el día 4 para 8 mg de ácido zoledrónico, y en el día 7 para 4 mg y 8 mg de ácido zoledrónico. Se observaron las proporciones de respuesta siguientes:
Tabla 5: Proporción de individuos con respuesta completa por día en estudios combinados de HIT
|
Día 4 |
Día 7 |
Día 10 | |
|
Ácido zoledrónico 4 mg (N=86) |
45,3% (p=0,104) |
82,6% (p=0,005)* |
88,4% (p=0,002)* |
|
Ácido zoledrónico 8 mg (N=90) |
55,6% (p=0,021)* |
83,3% (p=0,010)* |
86,7% (p=0,015)* |
|
Pamidronato 90 mg (N=99) |
33,3% |
63,6% |
69,7% |
|
*valores de p comparados con pamidronato. | |||
La mediana de tiempo hasta la normocalcemia fue de 4 días. La mediana de tiempo hasta la recaída (reelevación de los valores de calcio sérico corregidos respecto a la albúmina > 2,9 mmol/l) fue de 30 a 40 días para los pacientes tratados con ácido zoledrónico frente a 17 días para los tratados con 90 mg de pamidronato (valores de p: 0,001 para 4 mg y 0,007 para 8 mg de ácido zoledrónico). No hubo diferencias estadísticamente significativas entre las dos dosis de ácido zoledrónico.
En los ensayos clínicos a 69 pacientes que recayeron o fueron refractarios al tratamiento inicial (ácido zoledrónico 4 mg, 8 mg o pamidronato 90 mg) se les repitió el tratamiento con 8 mg de ácido zoledrónico. La tasa de respuesta en estos pacientes fue de aproximadamente el 52%.
Dado que a estos pacientes se les repitió el tratamiento solo con la dosis de 8 mg, no se dispone de datos que permitan la comparación con la dosis de 4 mg de ácido zoledrónico.
En los ensayos clínicos realizados en pacientes con hipercalcemia inducida por tumor (HIT), el perfil de seguridad global de los tres grupos de tratamiento (4 mg y 8 mg de ácido zoledrónico y 90 mg de pamidronato) fue similar en cuanto a tipo y gravedad.
Población _ pediátrica
Resultados del ensayo clínico en el tratamiento de osteogénesis imperfecta grave en pacientes pediátricos de 1 a 17 años de edad
Se compararon los efectos del ácido zoledrónico intravenoso en el tratamiento de pacientes pediátricos (de 1 a 17 años) con osteogénesis imperfecta grave (tipos I, III y IV) con los efectos de pamidronato intravenoso, en un ensayo abierto, internacional, multicéntrico, aleatorizado con 74 y 76 pacientes en cada grupo de tratamiento, respectivamente. El periodo de tratamiento del estudio fue de 12 meses precedidos por un periodo de screening de 4 a 9 semanas durante el cual se tomaron suplementos de vitamina D y calcio elemental durante al menos 2 semanas. En el programa clínico los pacientes de 1 a < 3 años recibieron 0,025 mg/kg de ácido zoledrónico (hasta una dosis única máxima de 0,35 mg) cada 3 meses y los pacientes de 3 a 17 años recibieron 0,05 mg/kg de ácido zoledrónico (hasta una dosis única máxima de 0,83 mg) cada 3 meses. Se llevó a cabo un ensayo de extensión para examinar la seguridad general y renal a largo plazo de la administración de ácido zoledrónico una vez al año o dos veces al año durante el periodo de tratamiento de la extensión de 12 meses en niños que habían completado un año de tratamiento con ácido zoledrónico o pamidronato en el estudio principal.
La variable principal del estudio fue el porcentaje de cambio en la densidad mineral ósea (DMO) de la columna lumbar desde el inicio hasta después de 12 meses de tratamiento. Los efectos del tratamiento sobre la DMO estimados fueron similares, pero el diseño del ensayo no fue suficientemente robusto para establecer la no inferioridad de eficacia para el ácido zoledrónico. En particular, no se observó una evidencia clara de eficacia sobre la incidencia de fracturas o de dolor. Se notificaron efectos adveros de fracturas de los huesos largos en las extremidades inferiores en aproximadamente un 24% (fémur) y 14% (tibia) de los pacientes con osteogénesis imperfecta grave tratados con ácido zoledrónico frente a un 12% y 5% de pacientes tratados con pamidronato, independientemente del tipo de enfermedad y de la causalidad pero la incidencia global de fracturas fue comparable para los pacientes tratados con ácido zoledrónico y con pamidronato: 43%(32/74) frente a 41% (31/76). La interpretación del riesgo de fractura se confunde con el hecho que las fracturas son acontecimientos frecuentes en pacientes con osteogénesis imperfecta grave, como parte del proceso de la enfermedad.
El tipo de reacciones adversas observadas en esta población fue similar a las observadas anteriormente en adultos con procesos malignos avanzados que afectan al hueso (ver sección 4.8). Las reacciones adversas, agrupadas por frecuencia, se presentan en la Tabla 6. Se utiliza la siguiente clasificación convencional: muy frecuentes (> 1/10), frecuentes (>1/100 a <1/10), poco frecuentes (>1/1.000 a <1/100), raras (>1/10.000 a <1/1.000), muy raras (<1/10.000), frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
Tabla 6: Reacciones adversas observadas en pacientes pediátricos con osteogénesis imperfecta1
|
Trastornos del sistema nervioso Frecuentes:_ |
Cefalea |
|
Trastornos cardiacos | |
|
Frecuentes:_ |
Taquicardia |
|
Trastornos respiratorios, torácicos y mediastínicos | |
|
Frecuentes:_ |
Nasofaringitis |
|
Trastornos gastrointestinales Muy frecuentes: Frecuentes: |
Vómitos, náuseas Dolor abdominal |
|
Trastornos musculoesqueléticos y del tejido conjuntivo | |
|
Frecuentes: |
Dolor en las extremidades, artralgia, dolor |
|
musculoesauelético | |
|
Trastornos generales y alteraciones en |
el lugar de administración |
|
Muy frecuentes: |
Pirexia, fatiga |
|
Frecuentes:_ |
Reacción de fase asuda, dolor |
|
Exploraciones complementarias | |
|
Muy frecuentes: |
Hipocalcemia |
|
Frecuentes:_ |
_Hipofosfataemia |
Las reacciones adversas que aparecieron con frecuencias <5% se evaluaron médicamente y se demostró que estos casos eran consistentes con el perfil de seguridad bien establecido de Zometa (ver sección 4.8).
En pacientes pediátricos con osteogénesis imperfecta grave, el ácido zoledrónico parece que está asociado con riesgos más pronunciados de reacción de fase aguda, hipocalcemia y taquicardia no explicada, comparado con pamidronato, pero esta diferencia disminuyó tras las perfusiones posteriores.
La Agencia Europea de Medicamentos ha eximido al titular del medicamento de referencia para ácido zoledrónico de la obligación de presentar los resultados de los ensayos realizados con dicho medicamento en los diferentes grupos de la población pediátrica en el tratamiento de la hipercalcemia inducida por tumor y la prevención de eventos relacionados con el esqueleto en pacientes con neoplasias avanzadas con afectación ósea (ver sección 4.2 para consultar la información sobre el uso en población pediátrica).
5.2 Propiedades farmacocinéticas
Perfusiones únicas y múltiples durante 5 y 15 minutos de 2, 4, 8 y 16 mg de ácido zoledrónico en 64 pacientes con metástasis ósea dieron como resultado los datos farmacocinéticos siguientes, observándose que son independientes de la dosis.
Después de iniciar la perfusión de ácido zoledrónico, las concentraciones plasmáticas de ácido zoledrónico aumentaron rápidamente, alcanzando el pico al final del periodo de perfusión, seguido de un rápido descenso hasta < 10% del pico después de 4 horas y < 1% del pico después de 24 horas, con un periodo subsiguiente prolongado de concentraciones muy bajas que no superan el 0,1% del pico antes de la segunda perfusión de ácido zoledrónico el día 28.
El ácido zoledrónico administrado por vía intravenosa se elimina por un proceso trifásico: eliminación bifásica rápida de la circulación sistémica, con semividas de t1/2a 0,24 y t1/2p 1,87 horas, seguida por una fase de eliminación prolongada con una semivida de eliminación terminal de t1/2y 146 horas. Después de dosis múltiples cada 28 días no hubo acumulación de ácido zoledrónico en plasma. El ácido zoledrónico no se metaboliza y se excreta inalterado por vía renal. Durante las primeras 24 horas, el 39 ± 16% de la dosis administrada se recupera en la orina, mientras que la restante se une principalmente al tejido óseo. Del tejido óseo se libera muy lentamente volviendo a la circulación sistémica y se elimina por vía renal. El aclaramiento corporal total es 5,04 ± 2,5 l/h, independiente de la dosis, y no está afectado por el sexo, edad, raza ni peso corporal. Incrementando el tiempo de perfusión de 5 a 15 minutos se produjo un descenso del 30% en la concentración de ácido zoledrónico al final de la perfusión, sin afectar al área bajo la curva de la concentración plasmática frente al tiempo.
La variabilidad entre pacientes de los parámetros farmacocinéticos para el ácido zoledrónico fue elevada, tal como se ha visto con otros bisfosfonatos.
No se dispone de datos farmacocinéticos del ácido zoledrónico en pacientes con hipercalcemia ni en pacientes con insuficiencia hepática. El ácido zoledrónico no inhibe las enzimas humanas del citocromo P450 in vitro, no acusa biotransformación, y en estudios con animales, < 3% de la dosis administrada se
recuperó en heces, lo cual indica que la función hepática no desempeña una función importante en la farmacocinética del ácido zoledrónico.
El aclaramiento renal del ácido zoledrónico se correlacionó significativamente de forma positiva con el aclaramiento de creatinina, representando el aclaramiento renal el 75 ± 33% del aclaramiento de creatinina, que mostró una media de 84 ± 29 ml/min (rango de 22 a 143 ml/min) en los 64 pacientes con cáncer estudiados. El análisis de la población mostró que para un paciente con un aclaramiento de creatinina de 20 ml/min (insuficiencia renal grave), o 50 ml/min (insuficiencia moderada), el correspondiente aclaramiento esperado de ácido zoledrónico sería de 37% ó 72% respectivamente, del de un paciente con un aclaramiento de creatinina de 84 ml/min. Sólo se dispone de datos farmacocinéticos limitados en pacientes con insuficiencia renal grave (aclaramiento de creatinina < 30 ml/min).
El ácido zoledrónico carece de afinidad por los componentes celulares de la sangre; su unión a proteínas plasmáticas es baja (aproximadamente 56%) e independiente de la concentración de ácido zoledrónico.
Poblaciones especiales
Pacientes pediátricos
Datos farmacocinéticos limitados en niños con osteogénesis imperfecta grave sugieren que la farmacocinética de ácido zoledrónico en niños de 3 a 17 años es similar a la de los adultos a niveles de dosis mg/kg similares. Parece que la edad, el peso, el género y el aclaramiento de creatinina no tienen ningún efecto sobre la exposición sistémica a ácido zoledrónico.
5.3 Datos preclínicos sobre seguridad
Toxicidad aguda
La dosis única intravenosa máxima no letal fue de 10 mg/kg de peso corporal en ratones y 0,6 mg/kg en ratas.
Toxicidad crónica y subcrónica
El ácido zoledrónico fue bien tolerado cuando se administró por vía subcutánea a ratas y por vía intravenosa a perros en dosis de hasta 0,02 mg/kg diarios durante 4 semanas. La administración de 0,001 mg/kg/día por vía subcutánea a ratas y 0,005 mg/kg por vía intravenosa una vez cada 2-3 días a perros durante 52 semanas inclusive también fue bien tolerada.
El hallazgo más frecuente en estudios de dosis repetidas consistió en un aumento de la sustancia esponjosa primaria en las metáfisis de huesos largos de animales en crecimiento a prácticamente todas las dosis, hecho que refleja la actividad farmacológica antiresortiva del compuesto.
Los márgenes de seguridad relativos a los efectos renales fueron estrechos en estudios con animales a largo plazo con dosis parenterales repetidas pero los niveles sin efectos adversos (NOAELs) acumulados en estudios de dosis única (1,6 mg/kg) y dosis múltiples durante un mes (0,06-0,6 mg/kg/día) no indicaron efectos renales a dosis equivalentes o superiores a la dosis terapéutica mayor recomendada en humanos. La administración a más largo plazo de dosis repetidas próximas a la mayor dosis terapéutica recomendada en humanos de ácido zoledrónico produjo efectos toxicológicos en otros órganos incluyendo el tracto gastrointestinal, hígado, bazo y pulmones y en los lugares de inyección intravenosa.
Toxicidad en la reproducción
El ácido zoledrónico fue teratógeno en ratas en dosis subcutáneas > 0,2 mg/kg. No se observó teratogenicidad o fetotoxicidad en los conejos, pero sí toxicidad materna. Se observó distocia con la dosis mínima ensayada en ratas (0,01 mg/kg de peso corporal).
Mutagenicidad y potencial carcinogénico
El ácido zoledrónico no fue mutagénico en los ensayos de mutagenicidad realizados y los ensayos de carcinogénesis no revelaron signo alguno de potencial carcinogénico.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Manitol (E421)
Citrato de sodio (E331)
Agua para preparaciones inyectables
6.2 Incompatibilidades
STEOZOL no debe mezclarse con otras soluciones para perfusión que contengan calcio u otros cationes divalentes, como la solución de Ringer lactato, debiendo administrarse como una solución intravenosa única en una vía de perfusión distinta.
Este medicamento no debe mezclarse con otros medicamentos excepto con los mencionados en la sección 6.6.
6.3 Periodo de validez
3 años.
Después de la dilución: Desde el punto de vista microbiológico, la solución para perfusión diluida se debe utilizar inmediatamente. Si no se usa inmediatamente, el tiempo y las condiciones de almacenamiento durante su uso son responsabilidad del usuario y no deberían superar en condiciones normales las 24 horas a 2°C - 8°C. o a 25°C. La solución conservada en nevera debe alcanzar la temperatura ambiente antes de la administración.
6.4 Precauciones especiales de conservación
Este medicamento no requiere condiciones especiales de conservación.
Para las condiciones de conservación de la solución reconstituida para perfusión, ver sección 6.3.
6.5 Naturaleza y contenido del envase
5 ml de concentrado para solución se suministran en jeringa de plástico graduada constituida por un cuerpo de polímero (policicloolefina) transparente con capuchón de plástico y tapón de goma de polímero (estireno-butadieno) transparente.
Envases conteniendo 1, 3, 4 o 10 jeringas precargadas con 1, 3, 4 o 10 agujas para la reconstitución de la solución.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Antes de la administración, se deberán diluir 5,0 ml de concentrado de una jeringa o el volumen de concentrado requerido con 100 ml de una solución de cloruro sódico al 0,9% p/v o solución de glucosa al 5% p/v.
En la sección 4.2 se adjunta información adicional sobre la manipulación de STEOZOL, incluyendo instrucciones para la preparación de dosis reducidas.
Para la dilución utilizar la aguja de reconstitución.
Los estudios con frascos de cristal, así como diferentes tipos de bolsas de infusión y líneas de infusión de polivinilcloruro, polietileno y polopropileno (precargada con solución de cloruro de sodio 0,9% p/v o solución de glucosa 5% p/v) no mostraron incompatibilidad con STEOZOL.
Durante la preparación de la perfusión se deben utilizar técnicas asépticas. Para un sólo uso.
Sólo se deben utilizar soluciones transparentes libres de partículas y de coloración.
Se advierte a los profesionales sanitarios que no eliminen la porción no utilizada de STEOZOL mediante sistema de desagüe doméstico.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
CHEMI SpA
Via dei Lavoratory, 54
20092 Cinisello Balsamo (Italia)
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Enero de 2013
10. FECHA DE LA REVISIÓN DEL TEXTO
Mayo 2012
17 de 17