Sonovue 8 Microlitros/Ml Polvo Y Disolvente Para Dispersion Inyectable
ANEXO I
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
1. DENOMINACIÓN DEL MEDICAMENTO
SonoVue 8 microlitros/ml polvo y disolvente para dispersión inyectable
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Un ml contiene 8 ^l de microburbujas de hexafluoruro de azufre.
Una vez reconstituido, siguiendo las directrices, 1 ml de la dispersión resultante contiene 8 ^l de hexafluoruro de azufre en microburbujas, equivalente a 45 microgramos.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Polvo y disolvente para dispersión inyectable
SonoVue es un kit que incluye:
1 vial que contiene 25 mg de polvo liofilizado 1 jeringa precargada con 5 ml de cloruro sódico 1 sistema de transferencia MiniSpike
Se proporciona información sobre el aspecto de la solución reconstituida en la sección 6.6.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Este medicamento es únicamente para uso diagnóstico.
SonoVue se utiliza para mejorar la imagen por ultrasonidos de la ecogenicidad de la sangre, lo que tiene como resultado una mejoría de la proporción señal-ruido.
SonoVue debe utilizarse únicamente en pacientes en los que un estudio sin aumento del contraste no sea concluyente.
Ecocardiografía
SonoVue es un producto de contraste ecocardiográfico transpulmonar para uso en pacientes con enfermedad cardiovascular establecida o sospechada para proporcionar la opacidad de las cámaras cardiacas y resaltar la delimitación del borde endocardiaco ventricular izquierdo.
Doppler de macrovasculatura
SonoVue aumenta la exactitud en la detección o exclusión de anormalidades en las arterias cerebrales y carótida extracraneal o arterias periféricas mejorando la proporción señal-ruido del Doppler. SonoVue aumenta la calidad de la imagen del Doppler y la duración de esta señal mejorada y clínicamente útil en el examen de la vena porta.
Doppler de microvasculatura
SonoVue mejora la visión de la vascularización de las lesiones del hígado y mama durante la sonografía Doppler, proporcionando una caracterización más específica de la lesión.
4.2 Posología y forma de administración
Este producto debe ser utilizado exclusivamente por médicos con experiencia en diagnóstico por imágenes ultrasónicas.
Posología
Las dosis recomendadas de SonoVue son:
Imágenes en modo-B de las cámaras cardiacas, en reposo o con estrés: 2 ml.
Imágenes vasculares Doppler: 2,4 ml.
Durante una exploración única y cuando el médico lo considere necesario se podrá administrar una segunda inyección a la dosis recomendada.
Pacientes de edad avanzada
Las recomendaciones de dosificación también son aplicables a pacientes de edad avanzada.
Pacientes pediátricos
La seguridad y efectividad de SonoVue en pacientes menores de 18 años de edad no han sido establecidas y el producto no deberá utilizarse en estos pacientes.
Forma de administración
La dispersión de microburbujas se prepara antes de su utilización inyectando a través del septo 5 ml de solución de cloruro sódico 9 mg/ml (0,9%) para inyección al contenido del vial. El vial es después agitado fuertemente durante unos segundos hasta que el liofilizado esté completamente disuelto. El volumen deseado de esta dispersión puede entonces retirarse a una jeringa en cualquier momento hasta seis horas después de la reconstitución. Justo antes de aspirarlo a la jeringa se agitará el vial para resuspender las microburbujas. SonoVue deberá administrarse inmediatamente después de aspirarlo a la jeringa para inyectarlo en una vena periférica. Cada inyección deberá ser seguida de un chorro de 5 ml de solución de cloruro sódico 9 mg/ml (0,9%) para inyección.
Para consultar las instrucciones de preparación del medicamento antes de la administración, ver sección 6.6.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
SonoVue está contraindicado en pacientes con derivaciones de derecha a izquierda, hipertensión pulmonar severa (presión arterial pulmonar > 90 mmHg), hipertensión sistémica no controlada y en pacientes con síndrome de distrés respiratorio del adulto.
SonoVue no debe usarse en combinación con dobutamina en pacientes con condiciones que sugieran inestabilidad cardiovascular en las que dobutamina esté contraindicada.
4.4 Advertencias y precauciones especiales de empleo
Se debe monitorizar el ECG en pacientes de alto riesgo dado que está clínicamente indicado.
Se debe enfatizar que la ecocardiografía de estrés, la cual puede imitar un episodio isquémico, podría potencialmente aumentar el riesgo en las exploraciones con SonoVue. Por lo tanto, si se tiene que
utilizar SonoVue conjuntamente con la ecocardiografía de estrés, los pacientes deben tener una situación estable verificada por la ausencia de dolor torácico o modificaciones en el ECG durante los dos días precedentes.
Además, se debe realizar una monitorización del ECG y de la presión arterial durante la ecocardiografía realzada con SonoVue con estrés farmacológico (ej. con dobutamina).
Extremar las precauciones cuando se considere la administración de SonoVue en pacientes con síndrome coronario agudo reciente o enfermedad cardiaca isquémica clínicamente inestable, incluyendo: infarto de miocardio en evolución o en curso, angina típica de reposo en los últimos 7 días, empeoramiento significativo de los síntomas cardiacos en los últimos 7 días, intervención arterial coronaria reciente u otros factores sugestivos de inestabilidad clínica (por ejemplo, deterioro reciente del ECG, hallazgos de laboratorio o clínicos), insuficiencia cardiaca aguda, insuficiencia cardiaca clase III/IV, o trastornos graves del ritmo cardiaco dado que en estos pacientes, las reacciones alérgicas y/o vasodilatadoras pueden llegar a ser potencialmente mortales. SonoVue debe administrarse únicamente a estos pacientes tras una cuidadosa valoración del balance beneficio/riesgo.
Se debe tener disponibilidad inmediata de un equipo de emergencia y personal entrenado para su uso.
En el caso de una reacción anafiláctica, los beta bloqueantes (incluyendo preparaciones oculares) pueden agravar la reacción. Los pacientes podrían no responder a las dosis habituales de adrenalina utilizadas para tratar las reacciones alérgicas.
Se aconseja precaución cuando se administra SonoVue a pacientes con enfermedad pulmonar clínicamente significativa, incluyendo enfermedad pulmonar obstructiva crónica severa.
Se recomienda mantener a los pacientes bajo estrecha supervisión médica durante la administración de SonoVue y al menos en los 30 minutos siguientes.
Se aconseja precaución cuando se administre este producto en pacientes con: endocarditis aguda, prótesis valvulares, inflamación sistémica aguda y/o sepsis, estados hiperactivos de coagulación y/o tromboembolismo reciente y enfermedad renal o hepática terminal, ya que el número de pacientes con estas condiciones expuestos a SonoVue durante los ensayos clínicos fue limitado, por lo tanto la experiencia existente del uso de SonoVue en este tipo de pacientes es limitada.
SonoVue no es adecuado para pacientes con ventilación asistida, y aquellos con enfermedad neurológica inestable.
En estudios animales, la administración de agentes de contraste ecográficos mostraron efectos adversos biológicos (ej. daño celular endotelial, ruptura capilar) por interacción con la onda ultrasónica. Aunque estos efectos adversos biológicos no se han comunicado en humanos, se recomienda utilizar un índice mecánico bajo.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios de interacciones. No existe relación aparente con respecto a la ocurrencia de acontecimientos adversos en los estudios clínicos de pacientes que recibieron distintas categorías de las medicaciones concomitantes más comunes.
4.6 Embarazo y lactancia
Embarazo
No se dispone de datos clínicos de embarazos expuestos. Los estudios realizados en animales no indican efectos perjudiciales sobre la gestación, desarrollo embrional/fetal, el parto o desarrollo postnatal (ver sección 5.3, Datos preclínicos sobre seguridad). Como medida de precaución, es preferible evitar el uso de SonoVue durante el embarazo.
Lactancia
No se conoce si el hexafluoruro de azufre se excreta en la lecha materna. Sin embargo, debido a su rápida eliminación corporal a través del aire expirado, se considera que la lactancia materna se puede reanudar dos o tres horas después de la administración de SonoVue.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de SonoVue sobre la capacidad para conducir y utilizar máquinas es nula o insignificante.
4.8 Reacciones adversas
La seguridad de SonoVue se evaluó en 4653 pacientes adultos que participaron en 58 ensayos clínicos.
Las reacciones adversas se clasifican por la Clasificación de Órganos del sistema y frecuencia utilizando la siguiente convención: Muy frecuentes (> 1/10), Frecuentes (> 1/100 a < 1/10), Poco frecuentes (> 1/1.000 a < 1/100), Raras (> 1/10.000 a < 1/1.000), Muy raras (< 1/10.000), frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
|
Clasificación de Órganos del Sistema |
Reacciones adversas | ||
|
Frecuencia | |||
|
Poco frecuentes (> 1/1.000 a < 1/100) |
Raras (> 1/10.000 a < 1/1.000) |
Frecuencia no conocida No puede estimarse a partir de los datos disponibles | |
|
Trastornos del sistema inmunológico |
Hipersensibilidad* | ||
|
Trastornos psiquiátricos |
Insomnio | ||
|
Trastornos del sistema nervioso |
Cefalea, parestesia, mareos, disgeusia |
Dolor sinusal |
Reacción vasovagal |
|
Trastornos oculares |
Visión borrosa | ||
|
Trastornos vasculares |
Rubor |
Hipotensión | |
|
Trastornos cardiacos |
Infarto de miocardio** Isquemia miocárdica* * | ||
|
Trastornos respiratorios, torácicos y mediastínicos |
Faringitis | ||
|
Trastornos gastrointestinales |
Náuseas, dolor abdominal | ||
|
Trastornos de la piel y del tejido subcutáneo |
Prurito, rash | ||
|
Trastornos musculoesqueléticos, óseos y del tejido conjuntivo |
Dolor de espalda | ||
|
Trastornos generales y alteraciones en el lugar de administración |
Molestia en el pecho, reacción en el lugar de inyección, sensación de calor |
Dolor torácico, dolor, fatiga. | |
|
Exploraciones complementarias |
Aumento de glucosa en sangre | ||
* Pueden incluirse casos compatibles de hipersensibilidad: eritema de la piel, bradicardia, hipotensión, disnea, pérdida de consciencia, paro cardiaco/cardio-respiratorio, reacción anafiláctica, reacción anafiláctoide o shock anafiláctico.
** En algunos de los casos de hipersensibilidad, en pacientes con enfermedad arterial coronaria subyacente, se han notificado también isquemia miocárdica y/o infartos de miocardio.
En casos muy raros se han notificado desenlaces fatales, existiendo una asociación temporal con la utilización de SonoVue. Todos estos pacientes presentaban un riesgo subyacente elevado de complicaciones cardiacas mayores, lo que pudo contribuir al desenlace fatal.
Notificación de sospechas de reacciones adversas
Es importante notificar las sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Anexo V.
4.9 Sobredosis
Habida cuenta de que hasta la fecha no se han comunicado casos de sobredosis no se han identificado signos ni síntomas de sobredosis. En un estudio en Fase I se administró a voluntarios sanos dosis de hasta 56 ml de SonoVue sin que apareciesen acontecimientos adversos graves. En el caso de sobredosis, el paciente deberá ser observado y tratado de forma sintomática.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo Farmacoterapéutico: Medios de contraste para ultrasonidos, código ATC: V08DA.
La adición de solución de cloruro sódico 9 mg/ml (0,9%) para inyección al polvo liofilizado seguido de agitación fuerte da lugar a la producción de microburbujas de hexafluoruro de azufre. Las microburbujas tienen un diámetro medio de unos 2,5 pm, y el 90% tienen un diámetro inferior a 6 pm mientras que el 99% tienen un diámetro inferior a 11 pm. Cada mililitro de SonoVue contiene 8 pl de microburbujas. La interfaz entre la burbuja de hexafluoruro de azufre y el medio acuoso actúa como reflector de la onda ultrasónica mejorando, por tanto, la ecogenicidad sanguínea y aumentando el contraste entre la sangre y el tejido que la rodea.
La reflectividad es dependiente de la concentración de microburbujas y de la frecuencia de la onda ultrasónica. A las dosis clínicas propuestas SonoVue ha demostrado proporcionar un aumento significativo de la intensidad de la señal de más de 2 minutos para la imagen de la ecocardiografía en modo-B y de 3 a 8 minutos para la imagen Doppler de la macrovasculatura y microvasculatura.
El hexafluoruro de azufre es un gas inerte, poco soluble en soluciones acuosas e inocuo. Existen informes publicados en la literatura sobre el uso del gas en el estudio de la fisiología respiratoria y en la retinopexia respiratoria.
5.2 Propiedades farmacocinéticas
La cantidad total de hexafluoruro de azufre administrada en una dosis clínica es extremadamente pequeña (en una dosis de 2 ml las microburbujas contienen 16 pl de gas). El hexafluoruro de azufre se disuelve en sangre siendo exhalado posteriormente.
Después de la administración de una inyección intravenosa única de 0,03 ó 0,3 ml de SonoVue/kg (1 y 10 veces la dosis clínica máxima, aproximadamente) a voluntarios sanos, el hexafluoruro de azufre se aclaró rápidamente. La semivida terminal media fue de 12 minutos (rango de 2 a 33 minutos). Más del 80% del hexafluoruro de azufre administrado se recuperó del aire exhalado 2 minutos después de la inyección y casi el 100% después de 15 minutos.
En pacientes con fibrosis pulmonar intersticial difusa el porcentaje de dosificación recuperada en el aire espirado fue de una media del 100% y la semivida terminal fue similar a la medida en voluntarios sanos.
5.3 Datos preclínicos sobre seguridad
Los datos de los estudios preclínicos no muestran riesgo especial para los seres humanos según los estudios convencionales sobre farmacología de seguridad, genotoxicidad y toxicidad para la reproducción. Las lesiones cecales observadas en algunos estudios de dosis repetida en ratas, pero no en monos, no son relevantes en humanos en condiciones normales de administración.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Polvo:
Macrogol 4000 Distearoilfosfatidilcolina Dipalmitoilfosfatidilglicerol sódico Ácido Palmítico
Disolvente:
Solución de cloruro sódico 9 mg/ml (0,9%) para inyección
6.2 Incompatibilidades
Este medicamento no debe mezclarse con otros, excepto con los mencionados en la sección 6.6.
6.3 Periodo de validez 2 años.
Se ha demostrado que una vez reconstituido, la estabilidad química y física perdura durante 6 horas. Desde el punto de vista microbiológico el producto debe utilizarse inmediatamente. De no ser así, serán responsabilidad del usuario los tiempos y condiciones de almacenamiento.
6.4 Precauciones especiales de conservación
El medicamento no requiere condiciones especiales de conservación.
Para las condiciones de conservación tras la reconstitución del medicamento, ver sección 6.3.
6.5 Naturaleza y contenido del recipiente
Presentación 02 (con sistema de transferencia separado MiniSpike):
25 mg de polvo seco, liofilizado en una atmósfera de hexafluoruro de azufre en vial incoloro de vidrio Tipo I con cierre elastomérico.
Sistema de transferencia separado.
Jeringa de vidrio Tipo I, precargada con 5 ml de solución de cloruro sódico 9 mg/ml (0,9%) para inyección.
6.6 Precauciones especiales de eliminación
Antes de su empleo examinar el producto para asegurar que el envase y cierre no han sido dañados.
SonoVue deberá ser preparado antes de su empleo inyectando a través del septo 5 ml de solución de cloruro sódico 9 mg/ml (0,9%) para inyección en el contenido del vial. El vial es después agitado fuertemente durante veinte segundos; posteriormente el volumen deseado de la dispersión puede ser aspirado a la jeringa como se detalla a continuación:
Presentación 02 (con sistema de transferencia separado MiniSpike):
v1.0-08/2000 ©BRG 2000
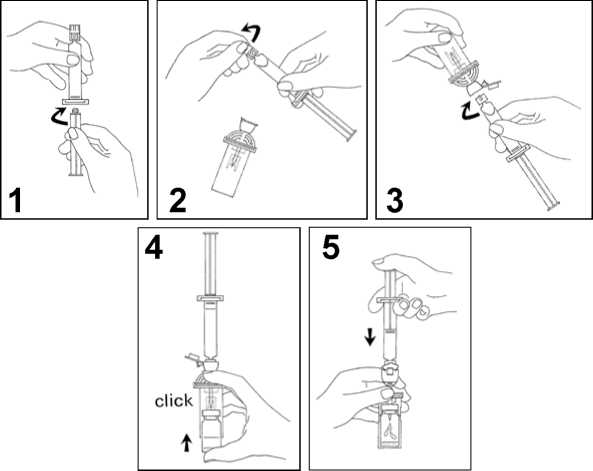
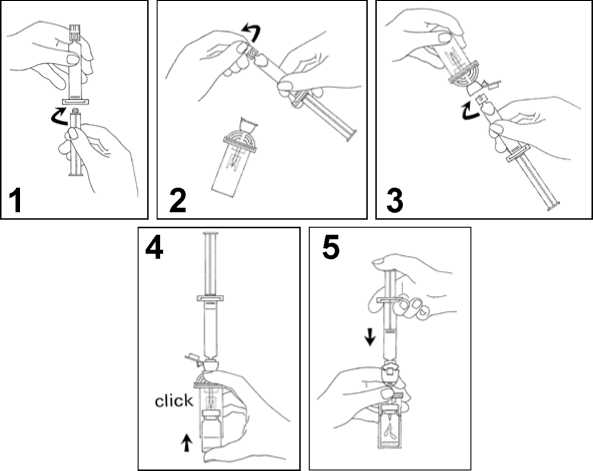
1. Conectar el émbolo a la jeringa, enroscándolo en el sentido de las agujas del reloj.
2. Abrir el blister del sistema de transferencia MiniSpike y extraer el tapón de la jeringa.
3. Abrir el tapón del sistema de transferencia y conectar la jeringa enroscándola en el sentido de las agujas del reloj.
4. Retirar el disco protector del vial. Deslizar el vial en la lámina transparente del sistema de transferencia y presionar firmemente para ajustar el vial en su sitio.
5. Vaciar el contenido de la jeringa en el vial, empujando el émbolo.
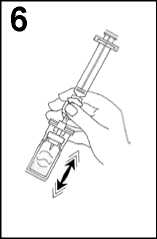
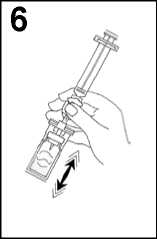
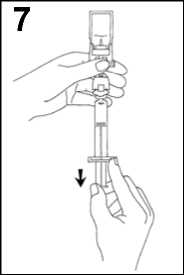
6. Agitar vigorosamente durante 20 segundos para mezclar los contenidos del vial para obtener un líquido lechoso homogéneo.
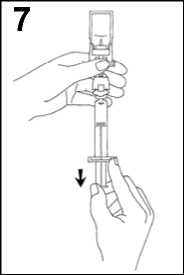
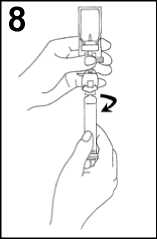
7. Invertir el sistema y extraer cuidadosamente SonoVue en la jeringa.
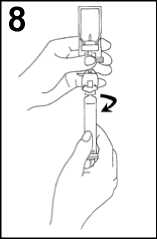
8. Desenroscar la jeringa del sistema de transferencia.
No utilizar si el líquido obtenido es transparente y/o si se observan partes sólidas del liofilizado
en la suspensión.
SonoVue deberá administrarse inmediatamente mediante inyección en una vena periférica.
En el caso de no utilizar SonoVue de inmediato después de la reconstitución la dispersión de microburbujas deberá ser agitada una vez más antes de su aspiración por la jeringa. Se ha demostrado que la estabilidad química y física de la dispersión de microburbujas perdura durante 6 horas.
El vial es sólo para una única exploración. La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Bracco International B.V.
Strawinskylaan 3051 NL - 1077 ZX Amsterdam Países Bajos
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/01/177/002
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA
AUTORIZACIÓN
26 de marzo de 2001 / 24 de abril de 2006
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu
A. FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE
COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN
SEGURA Y EFICAZ DEL MEDICAMENTO
A. FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección del fabricante responsable de la liberación de los lotes
Braceo Imaging S.p.A.
Via Ribes 5, Biondustry Park Colleretto Giacosa - 10010 (TO)
Italia
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica restringida (ver Anexo I: Resumen de las Características del Producto, sección 4.2).
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
El Titular de la Autorización de Comercialización (TAC) presentará los informes periódicos de seguridad para este medicamento de conformidad con las exigencias establecidas en la lista de fechas de referencia de la Unión (lista EUDR) prevista en el artículo 107ter, (párrafo 7), de la Directiva 2001/83/CE y publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado en la versión del PGR incluido en el Módulo 1.8.2. de la Autorización de Comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
Si coincide la presentación de un IPS con la actualización del PGR, ambos documentos se pueden presentar conjuntamente.
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
Etiqueta externa, Presentación 02
1. DENOMINACIÓN DEL MEDICAMENTO
SonoVue Microburbujas de hexafluoruro de azufre 8 microlitros/ml Polvo y disolvente para dispersión inyectable
2. PRINCIPIO(S) ACTIVO(S)
Un ml contiene 8 ^l de microburbujas de hexafluoruro de azufre.
3. LISTA DE EXCIPIENTES
Macrogol 4000, distearoilfosfatidilcolina, dipalmitoilfosfatidilglicerol sódico, ácido palmítico. Disolvente: Solución de cloruro sódico 9 mg/ml (0,9%) para inyección.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
1 vial que contiene 25 mg de polvo liofilizado para reconstituir con 5 ml de solución de cloruro sódico 9 mg/ml (0,9%) para inyección.
1 jeringa precargada que contiene solución de cloruro sódico 9 mg/ml (0,9%) para inyección.
1 sistema de transferencia MiniSpike Plus 6/8 (CE 0123).
1 ml de dispersión reconstituida contiene 8 microlitros de microburbujas de hexafluoruro de azufre.
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Vía intravenosa
Leer detenidamente el prospecto antes de utilizar.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera del alcance y de la vista de los niños.
7. OTRAS ADVERTENCIAS ESPECIALES, SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD:
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL PRODUCTO NO
UTILIZADO O DE LOS MATERIALES QUE ESTÉN EN CONTACTO DIRECTO CON EL PRODUCTO (CUANDO CORRESPONDA)_
Para un solo uso, deseche cualquier porción sobrante.
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Braceo International B.V., Strawinskylaan 3051,
NL - 1077 ZX Amsterdam, Países Bajos
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/01/177/002
13. NÚMERO DE LOTE DEL FABRICANTE
Lot:
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
1. DENOMINACIÓN DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
SonoVue 8 microlitros/ml de polvo para dispersión inyectable
2. FORMA DE ADMINISTRACIÓN
Vía intravenosa
3. FECHA DE CADUCIDAD
CAD:
4. NÚMERO DE LOTE DEL FABRICANTE
Lot:
5. CONTENIDO EN PESO, VOLUMEN O EN UNIDADES
25 mg de polvo liofilizado para reconstituir con 5 ml de una solución de cloruro sódico 9 mg/ml (0,9%) para inyección antes de la administración.
6. OTROS
1. DENOMINACIÓN DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Solución de cloruro sódico 9 mg/ml para inyección
2. FORMA DE ADMINISTRACIÓN
Vía intravenosa
3. FECHA DE CADUCIDAD
CAD:
4. NÚMERO DE LOTE DEL FABRICANTE
Lot:
5. CONTENIDO EN PESO, VOLUMEN O EN UNIDADES
5 ml
6. OTROS
Para utilizar con SonoVue.
B. PROSPECTO
Prospecto: información para el paciente SonoVue 8 microlitros/ml polvo y disolvente para dispersión inyectable
Hexafluoruro de azufre
Lea todo el prospecto detenidamente antes de que le administren este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata
_de efectos adversos que no aparecen en este prospecto. Ver sección 4._
Contenido del prospecto
1. Qué es SonoVue y para qué se utiliza
2. Qué necesita saber antes de empezar a usar SonoVue
3. Cómo usar SonoVue
4. Posibles efectos adversos
5. Conservación de SonoVue
6. Contenido del envase e información adicional
1. Qué es SonoVue y para qué se utiliza
SonoVue está indicado únicamente para uso diagnóstico.
SonoVue es un agente de contraste para ecografías que contiene microburbujas rellenas de un gas denominado hexafluoruro de azufre.
SonoVue es un agente de contraste que ayuda a obtener ecografías más nítidas del corazón o de vasos sanguíneos y/o tejidos del hígado y la mama.
2. Qué necesita saber antes de empezar a usar SonoVue
No use SonoVue:
- si es alérgico a hexafluoruro de azufre o a alguno de los demás componentes de este medicamento (incluidos en la sección 6).
- si el médico le ha dicho que tiene una derivación cardíaca de derecha a izquierda.
- si padece hipertensión pulmonar grave (presión arterial pulmonar > 90 mm Hg).
- si padece hipertensión no controlada.
- si padece un síndrome de distress respiratorio del adulto (una enfermedad grave que se caracteriza por una inflamación diseminada en los pulmones).
- si le han indicado que no tome dobutamina (un medicamento que estimula el corazón) debido a la enfermedad cardíaca grave que padece.
Advertencias y precauciones
Consulte a su médico, si en los últimos 2 días ha padecido:
- Episodios de angina o dolor en el pecho (torácico) frecuentes y/o repetidos, especialmente si
usted tiene una historia de enfermedad cardiaca,
- Cambios recientes en su electrocardiograma.
Consulte a su médico antes de que le administren SonoVue si:
- Ha padecido recientemente un infarto de miocardio o se ha sometido recientemente a una intervención coronaria.
- Padece angina de pecho, dolor en el pecho o cardiopatía grave.
- Padece trastornos graves del ritmo cardiaco.
- La cardiopatía que padece ha empeorado últimamente.
- Padece una inflamación cardíaca aguda de la membrana del corazón (endocarditis).
- Tiene implantadas válvulas cardíacas artificiales.
- Padece una inflamación o infección generalizadas agudas.
- Tiene problemas conocidos de coagulación de la sangre.
- Padece una enfermedad renal o hepática graves.
- Padece una enfermedad neurológica inestable.
- Padece una enfermedad grave de los pulmones o precisa respiración asistida.
Si le administran SonoVue de forma conjunta con un medicamento, un ejercicio o un dispositivo que estimulen el corazón para visualizar su actividad en situación de esfuerzo, monitorizarán su actividad cardíaca, tensión arterial y ritmo cardíaco.
Niños y adolescentes
SonoVue no se debe administrar a pacientes menores de 18 años, ya que no se ha evaluado en este grupo de edad.
Uso de SonoVue con otros medicamentos
Informe a su médico si está tomando, ha tomado recientemente o podría tener que tomar cualquier otro medicamento.
En concreto, informe a su médico si está tomando betabloqueantes (medicamentos para tratar las cardiopatías y la hipertensión o que se administran en forma de colirios para tratar el glaucoma).
Embarazo y lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento.
Se desconoce si SonoVue pasa a la leche materna. No obstante, se debe interrumpir la lactancia durante dos o tres horas después de la ecocardiografía.
Conducción y uso de máquinas
SonoVue no afecta a la capacidad para conducir y utilizar máquinas.
3. Cómo usar SonoVue
SonoVue se lo administrará el personal médico o sanitario debidamente cualificado en este tipo de exploraciones, que calculará la dosis correcta para usted en función de la parte del cuerpo que le vayan a examinar. La dosis recomendada es de 2 o 2,4 ml por paciente. Esta dosis puede repetirse en caso necesario hasta un máximo de 4,8 ml.
El personal médico le vigilará estrechamente durante la inyección de SonoVue y durante al menos 30 minutos después de esta.
Si le administran más SonoVue del que debe
Es improbable que se produzca una sobredosis, puesto que SonoVue lo administra el facultativo médico. En caso de que se produzca una sobredosis, el médico tomará las medidas adecuadas.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
La mayoría de los efectos secundarios de SonoVue son raros y no suelen ser graves. Sin embargo, algunos pacientes pueden experimentar efectos adversos graves y pueden necesitar tratamiento.
Informe a su médico inmediatamente si aprecia cualquiera de los siguientes efectos adversos, porque podría necesitar tratamiento médico:
- Signos de una reacción alérgica grave tales como hinchazón de cara, labios, boca o garganta que pueda dificultar tragar o respirar; erupción cutánea; urticaria; hinchazón de las manos, pies o tobillos.
A continuación se indican los efectos adversos que se han comunicado con el uso de SonoVue:
Efectos adversos poco frecuentes (pueden afectar hasta 1 de cada 100 personas):
- Dolor de cabeza
- Entumecimiento
- Mareos
- Extraño sabor en la boca
- Enrojecimiento
- Malestar en el pecho
- Irritación de garganta
- Sensación de malestar (náuseas)
- Dolor abdominal
- Prurito, erupción cutánea
- Dolor de espalda
- Sensación de calor
- Reacciones locales donde se aplicó la inyección, tales como: dolor o una sensación inusual en el lugar de la inyección
- Aumento de los niveles de azúcar en sangre
Efectos adversos raros (pueden afectar hasta 1 de cada 1.000 personas):
- Dificultad para dormir
- Dolor o presión en la frente, las mejillas, la nariz y entre los ojos
- Visión borrosa
- Disminución de la presión arterial
- Dolor en general
- Dolor en el pecho
- Fatiga
- Reacciones alérgicas graves y menos graves (incluyendo enrojecimiento de la piel, disminución de la frecuencia cardiaca, disminución de la presión arterial, falta de aire, pérdida de consciencia, paro cardiaco/cardio-respiratorio o reacción más grave acompañada de dificultad para respirar y mareo).
Frecuencia no conocida (no puede estimarse a partir de los datos disponibles)
- Desmayo
- En alguno de los casos de reacciones alérgicas en pacientes con angiocardiopatía se han comunicado casos de falta de aporte de oxígeno al corazón o parada cardíaca.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de SonoVue
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la etiqueta después de CAD. La fecha de caducidad es el último día del mes que se indica.
Este medicamento no requiere condiciones especiales de conservación.
La dispersión de SonoVue se le debe administrar en 6 horas desde su preparación.
6. Contenido del envase e información adicional Contenido de SonoVue
- El principio activo es hexafluoruro de azufre en forma de microburbujas.
- Los demás componentes son: macrogol 4000, distearoilfosfatidilcolina, dipalmitoilfosfatidilglicerol sódico, ácido palmítico.
La jeringa de vidrio contiene una solución de cloruro sódico 9 mg/ml (0,9 %) para inyección.
Aspecto del producto y tamaño del envase
SonoVue es un kit que incluye un vial de vidrio con polvo blanco, una jeringa de vidrio que contiene el disolvente y un sistema de transferencia.
Titular de la autorización de comercialización y responsable de la fabricación:
Titular de la autorización de comercialización
Bracco International B.V.
Strawinskylaan 3051 NL-1077 ZX Ámsterdam Países Bajos
Responsable de la fabricación:
Bracco Imaging S.p.A.
Via Ribes 5, Biondustry Park Colleretto Giacosa-10010 (TO)
Italia
Fecha de la última revisión de este prospecto:
Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia
Europea de Medicamentos: http://www.ema.europa.eu.
En la página web de la Agencia Europea de Medicamentos puede encontrarse este prospecto en todas las lenguas de la Unión Europea/Espacio Económico Europeo.
Esta información está destinada únicamente a profesionales del sector sanitario:
Si no se usa de inmediato SonoVue tras su reconstitución, la dispersión se agitará de nuevo antes de extraerla con la jeringuilla.
El medicamento es únicamente para una sola exploración. Todo volumen restante sin usar al final de una exploración se debe desechar.
Instrucciones de reconstitución:
Presentación 02 (con sistema de transferencia separado MiniSpike (CE0123))
v1.0-08/2000 ©BRG 2000
1. Conectar el émbolo a la jeringa, enroscándolo en el sentido de las agujas del reloj.
2. Abrir el blíster del sistema de transferencia MiniSpike y extraer el tapón de la jeringa.
3. Abrir el tapón del sistema de transferencia y conectar la jeringa enroscándola en el sentido de las agujas del reloj.
4. Retirar el disco protector del vial. Deslizar el vial en la lámina transparente del sistema de transferencia y presionar firmemente para ajustar el vial en su sitio.
5. Vaciar el contenido de la jeringa en el vial, empujando el émbolo.
6. Agitar vigorosamente durante 20 segundos para mezclar los contenidos del vial para obtener un líquido lechoso homogéneo.
7. Invertir el sistema y extraer cuidadosamente SonoVue en la jeringa.
8. Desenroscar la jeringa del sistema de transferencia.
Después de la reconstitución, SonoVue es una dispersión homogénea de color blanco lechoso.
No utilizar si el líquido obtenido es transparente y/o si se observan partes sólidas del liofilizado en la suspensión.
La dispersión inyectable SonoVue se debe administrar en las seis horas posteriores a su preparación.
24