Somatulina Autogel 90 Mg, Solucion Inyectable En Jeringa Precargada
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
SOMATULINA AUTOGEL 60 mg, solución inyectable en jeringa precargada.
SOMATULINA AUTOGEL 90 mg, solución inyectable en jeringa precargada.
SOMATULINA AUTOGEL 120 mg, solución inyectable en jeringa precargada.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Lanreotida 60 mg, 90 mg y 120 mg (en forma de acetato de lanreotida).
Cada jeringa precargada contiene una solución sobresaturada de acetato de lanreotida que corresponde a 0,246 mg de lanreotida base / mg de solución, que equivale a una dosis de 60 mg, 90 mg y 120 mg de lanreotida, respectivamente.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Solución inyectable en jeringa precargada.
Formulación semisólida de color blanco a amarillo pálido.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
- Tratamiento de pacientes con acromegalia en los que el tratamiento convencional es inadecuado o ineficaz.
- Tratamiento de pacientes adultos con tumores neuroendocrinos gastroenteropancreáticos (TNEs-GEP) de grado 1 y un subgrupo de grado 2 (índice Ki67 hasta10%) de intestino medio, páncreas o de origen desconocido donde se han excluido los de origen de intestino posterior, y que presentan enfermedad localmente avanzada irresecable o metastásica(ver sección 5.1).
- Tratamiento de los síntomas clínicos asociados a los tumores neuroendocrinos (tumores carcinoides, VIPomas, gastrinomas, glucagonomas, insulinomas).
4.2 Posología y forma de administración
4.2.1 Posología
Tratamiento de la acromegalia:
La dosis inicial recomendada es de 60 a 120 mg administrados cada 28 días.
En general, en pacientes previamente tratados con SOMATULINA 30 mg con una dosis cada 14 días, la dosis inicial de SOMATULINA AUTOGEL debe ser de 60 mg cada 28 días y en pacientes previamente tratados con SOMATULINA 30 mg con una dosis cada 10 días, la dosis inicial de SOMATULINA AUTOGEL debe ser de 90 mg cada 28 días. Alternativamente, aquellos pacientes correctamente controlados con SOMATULINA 30 mg cada 14 días pueden tratarse con SOMATULINA AUTOGEL 120 mg cada 56 días y aquellos pacientes correctamente controlados con SOMATULINA 30 mg cada 10 días pueden tratarse con SOMATULINA AUTOGEL 120 mg cada 42 días.
A partir de aquí, la dosis debe individualizarse en función de la respuesta del paciente (valorada por la mejora de los síntomas y/o disminución de los niveles de GH y/o IGF1).
Si no se logra la respuesta deseada se podrá aumentar la dosis hasta 120 mg cada 28 días.
Se podrá reducir la dosis si se logra el control total de los parámetros clínicos (niveles de GH por debajo de 1 ng/mL, niveles normalizados de IGF1 y desaparición de los síntomas).
El médico determinará la frecuencia de la monitorización de los síntomas y de los niveles de GH y de IGF1, en función de la clínica del paciente.
Si el paciente se encuentra en espera de recibir cirugía, la pauta de administración es de una inyección subcutánea profunda de SOMATULINA AUTOGEL 90 mg, cada 28 días.
Tratamiento de pacientes adultos con tumores neuroendocrinos gastroenteropancreáticos (TNEs-GEP) de grado 1 y un subgrupo de grado 2 (índice Ki67 hasta 10%) de intestino medio, páncreas o de origen desconocido donde se han excluido los de origen de intestino posterior, y que presentan enfermedad localmente avanzada irresecable o metastásica:
La dosis recomendada es una inyección de Somatulina Autogel 120 mg administrada cada 28 días. El tratamiento con Somatulina Autogel se debe continuar tanto como el control tumoral así lo requiera.
Tratamiento de los síntomas clínicos asociados a los tumores neuroendocrinos:
La dosis inicial recomendada es de 60 a 120 mg administrados cada 28 días. La dosis se ajustará de acuerdo con la mejora observada.
Insuficiencia renal y/o hepática:
En pacientes con alteraciones de la función renal o hepática no es necesario un ajuste de dosis debido a la amplia ventana terapéutica de la lanreotida (ver sección 5.2).
Población de edad avanzada:
En pacientes ancianos no es necesario un ajuste de dosis debido a la amplia ventana terapéutica de la lanreotida (ver sección 5.2).
Población pediátrica:
No se recomienda el uso de SOMATULINA AUTOGEL en niños y adolescentes debido a la falta de datos de seguridad y eficacia.
4.2.2 Forma de administración
SOMATULINA AUTOGEL debe administrarse por vía subcutánea profunda en el cuadrante supero-externo de la nalga. La administración la debe realizar un profesional sanitario.
Sin embargo, para los pacientes tratados para la acromegalia o tratados para los síntomas clínicos asociados a los tumores neuroendocrinosque reciben dosis estables de SOMATULINA AUTOGEL y tras recibir una instrucción adecuada, el medicamento puede ser administrado por el mismo paciente o por otra persona instruida para ello. En caso de autoadministración, la inyección se administrará en la zona superior de la cara externa del muslo.
El profesional sanitario es el que debe tomar la decisión sobre si es adecuada la administración por parte del paciente o de una persona instruida para ello.
Independientemente del lugar de la inyección, la aguja se insertará rápidamente en toda su longitud, sin plegar la piel y de forma perpendicular a ella.
El lugar de la inyección debe alternarse entre el lado derecho y el izquierdo.
Para consultar las instrucciones de uso, manipulación y eliminación del producto, ver sección 6.6.
4.3 Contraindicaciones
Hipersensibilidad a la somatostatina o péptidos relacionados o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
La lanreotida puede reducir la motilidad de la vesícula biliar, lo que facilita la formación de cálculos biliares. Por tanto, se recomienda realizar una ecografía de la vesícula biliar antes de la instauración del tratamiento y posteriormente de forma periódica.
Estudios farmacológicos en animales y en humanos muestran que la lanreotida, como la somatostatina y sus análogos, inhibe la secreción de insulina y glucagón. Por lo tanto, los pacientes tratados con lanreotida pueden experimentar hipoglicemia o hiperglicemia. Deben monitorizarse los niveles de glucosa en sangre cuando se inicia el tratamiento con lanreotida o cuando se modifica la dosis, así como ajustar convenientemente cualquier tratamiento antidiabético.
Se han observado ligeras disminuciones en las hormonas tiroideasdurante el tratamiento con lanreotida en pacientes acromegálicos, aunque el hipotiroidismo clínico es raro. Se recomienda realizar pruebas de la función tiroidea cuando estén clínicamente indicadas.
En pacientes sin patología cardiaca subyacente, el uso de lanreotida puede provocar una disminución de la frecuencia cardiaca sin alcanzar necesariamente el umbral debradicardia. En pacientes con alteraciones cardiacas anteriores al inicio del tratamiento con lanreotida, puede aparecer bradicardia sinusal. Se recomienda actuar con precaución cuando se inicie el tratamiento con lanreotida en pacientes con bradicardia (ver sección 4.5).
4.5 Interacción con otros medicamentos y otras formas de interacción
Los efectos farmacológicos gastrointestinales de lanreotida pueden producir una reducción de la absorción intestinal de medicamentos que se administren conjuntamente, incluyendo la ciclosporina. La administración concomitante de ciclosporina con lanreotida puede disminuir la biodisponibilidad relativa de la ciclosporina, y por tanto puede ser necesario el ajuste de la dosis de ciclosporina para mantener niveles terapéuticos.
Debido a la moderada unión de lanreotida con las proteínas séricas,las interacciones con medicamentos con una unión elevada a proteínas plasmáticas son poco probables.
Datos publicados limitados indican que la administración concomitante de análogos de somatostatina y bromocriptina puede incrementar la disponibilidad de la bromocriptina.
3E
La administración concomitante de medicamentos que inducen bradicardia (por ejemplo betabloqueantes) puede tener un efecto aditivo en la ligera reducción de la frecuencia cardiaca asociada a lanreotida, por lo que puede ser necesario un ajuste de dosis de este tipo de medicación concomitante.
Los limitados datos publicados disponibles indican que los análogos de somatostatina pueden disminuir el aclaramiento metabólico de compuestos que se sabe que se metabolizan mediante las enzimas del citocromo P450, lo que puede ser debido a la supresión de la hormona del crecimiento. Puesto que no puede excluirse que la lanreotida pueda tener este efecto, deben usarse con precaución otros medicamentos que se metabolicen principalmente por el CYP3A4 y que tengan un índice terapéutico bajo (p.ej. quinidina, terfenadina).
4.6 Fertilidad, embarazo y lactancia
Fertilidad y embarazo:
Datos no clínicos:
Los estudios en animales no muestran ninguna evidencia de efectos teratógenos asociados a lanreotida durante la organogénesis. Se observó una reducción de la fertilidad en ratas hembras debido a la inhibición de la secreción de la GH a dosis mucho mayores de las alcanzadas en humanos a dosis terapéuticas.
Datos clínicos:
Datos de un número limitado de mujeres embarazadas expuestas a lanreotida no indican efectos adversos de lanreotida en el embarazo o sobre la salud del feto/recién nacido. Actualmente, no se dispone de más datos epidemiológicos relevantes.
Puesto que los estudios en animales no siempre predicen la respuesta en humanos, sólo debe administrarse lanreotida a mujeres embarazadas si es claramente necesario.
Lactancia:
No se conoce si este medicamento se excreta en leche materna.
Puesto que muchos medicamentos se excretan en leche materna, se debe tener cuidado cuando la lanreotida se administre durante la lactancia.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
Aunque no se ha establecido ningún efecto en la capacidad de conducir y utilizar máquinas, se han comunicado mareos con SOMATULINA AUTOGEL. Si un paciente presenta mareos, no debería conducir ni utilizar máquinas.
4.8 Reacciones adversas
Las reacciones adversas notificadas por pacientes con acromegalia y tumores neuroendocrinos gastroenteropancreáticos (TNEs-GEP) tratados con lanreotida en ensayos clínicos se encuentran listados bajo el correspondiente grupo sistémico de acuerdo con la siguiente clasificación: muy frecuentes (>1/10); frecuentes (>1/100 a <1/10); poco frecuentes (>1/1.000 a <1/100).
Las reacciones adversas esperadas más frecuentes tras el tratamiento con lanreotida son las alteraciones gastrointestinales (las más comúnmente notificadas son diarrea y dolor abdominal, normalmente leve o moderado y transitorio), colelitiasis (a menudo asintomática) y reacciones en el lugar de inyección (dolor, nódulos e induración).
El perfil de reacciones adversas es similar en todas las indicaciones.
|
Clasificación por órganos y sistemas |
Muy frecuentes (>1/10) |
frecuentes (>1/100 a <1/10) |
poco frecuentes (>1/1000 a <1/100) |
Experiencia sobre seguridad postcomercialización (frecuencia no conocida) |
|
Exploraciones complementarias |
Aumento de la ALAT*, ASAT anormal*, ALAT anormal*, aumento de bilirrubina en sangre*, aumento de glucosa en sangre*, aumento de hemoglobina glicosilada*, pérdida de peso, disminución de los enzimas pancreáticos** |
Aumento de la ASAT*, aumento de la fosfatasa alcalina en sangre*, bilirrubina en sangre anormal*, disminución del sodio en sangre* | ||
|
Trastornos cardiacos |
Bradicardia sinusal* | |||
|
Trastornos del sistema nervioso |
Mareo, cefalea, somnolencia** | |||
|
Trastornos gastrointestinales |
Diarrea, heces blandas*, dolor abdominal |
Nauseas, vómitos, estreñimiento, flatulencias, distensión abdominal, molestias abdominales, dispepsia, esteatorrea** |
Heces descoloridas* |
Pancreatitis |
|
Trastornos de la piel y del tejido subcutáneo |
Alopecia, hipotricosis* | |||
|
Trastornos del metabolismo y de la nutrición |
Hipoglucemia, disminución del apetito**, hiperglucemia, diabetes mellius | |||
|
Trastornos vasculares |
Sofocos* | |||
|
Trastornos generales y alteraciones en el lugar de administración |
Astenia, fatiga, reacciones en el lugar de inyección (dolor, masas, induraciones, nódulos, prurito) | |||
|
Trastornos hepatobiliares |
Colelitiasis |
Dilatación biliar* | ||
|
Trastornos psiquiátricos |
Insomnio* | |||
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Dolor músculoesquelético** Mialgia** | |||
|
Trastornos del sistema |
Reacciones alérgicas |
LITTCA ALDAD ota efe
|
inmunológico |
(incluyendo angioedema, anafilaxis, hipersensividad) |
* Sobre la base de un grupo de estudios realizados en pacientes acromegálicos ** Sobre la base de un grupo de estudios realizados en pacientes con TNEs-GEP
Notificación de sospechas de reacciones adversas:
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de medicamentos de Uso Humano: https://www.notificaRAM.es.
4.9 Sobredosis
En caso de sobredosis, está indicado el tratamiento sintomático.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: inhibidores de la hormona del crecimiento.
Código ATC: H01C B03.
Lanreotida es un octapéptido análogo de la somatostatina natural. Como la somatostatina, la lanreotida es un péptido que inhibe un gran número de mecanismos endocrinos, neuroendocrinos, exocrinos y paracrinos. Presenta una elevada afinidad por los receptores de la somatostatina humana (SSTR) 2 y 5, y menos afinidad por los SSTR 1, 3 y 4. Se considera que la actividad en los SSTR 2 y 5 es el principal mecanismo responsable de la inhibición de la GH. La lanreotida es más activa que la somatostatina natural y muestra una mayor duración de la acción.
En cuanto a los tumores neuroendocrinos, la actividad inhibidora de la lanreotida sobre la secreción intestinal exocrina y las hormonas digestivas permiten que este péptido se pueda usar para el tratamiento sintomático de dichos tumores, especialmente los carcinoides.
Lanreotida, como la somatostatina, muestra una acción antisecretora exocrina general. Inhibe la secreción basal de motilina, del péptido inhibidor gástrico y del polipéptido pancreático, pero no tiene efectos significativos sobre la secreción en ayunas de secretina o gastrina. Además, disminuye los niveles plasmáticos de cromogranina A y de 5-HIAA (ácido 5-Hidroxiindolacetico) en orina en pacientes con TNEs-GEP y niveles elevados de estos marcadores tumorales.
La lanreotida inhibe notablemente los aumentos de flujo sanguíneo de la arteria mesentérica superior y el flujo sanguíneo venoso portal inducidos por las comidas. La lanreotida disminuye de manera significativa la secreción de agua, sodio, potasio y cloro del yeyuno, estimulada por la prostaglandina E-1. También reduce los niveles de prolactina en los pacientes acromegálicos con tratamiento prolongado.
En un estudio abierto, Somatulina Autogel 120 mg se administró cada 28 días durante 48 semanas en 90 pacientes acromegálicos diagnosticados con macroadenoma pituitario sin tratamiento previo. El estudio excluyó los pacientes en espera de recibir cirugía pituitaria o radioterapia durante el periodo del estudio.
En la semana 48, se observó una reducción del tumor > 20% (variable principal de eficacia del estudio) en el 63% de los pacientes, aunque no se alcanzó significación estadística (IC del 95%: 52%-73%). El

porcentaje medio de reducción del volumen tumoral fue del 26,8%, los niveles de hormona del crecimiento fueron inferiores a 2,5 pg/l en el 77,8% de los pacientes y los niveles de IGF-1 se normalizaron en el 50%. En el 43,5% de los pacientes se observaron niveles normalizados de IGF-1 conjuntamente con niveles de hormona del crecimiento por debajo de 2,5 pg/l.
Los pacientes informaron de un alivio de los síntomas de la acromegalia como fatiga, sudoración excesiva, artralgia o hinchazón de tejidos blandos.
A partir de la semana 12, se observó una reducción tanto del volumen tumoral como de los niveles de hormona del crecimiento y de IGF-1 que se mantuvo durante las 48 semanas del estudio.
Para evaluar el efecto antiproliferativo de lanreotida se llevó a cabo un estudio de fase III con Somatulina Autogel, multicéntrico, aleatorizado, doble ciego y controlado con placebo, de 96 semanas de duración, en pacientes con tumores neuroendocrinos gastroenteropancreáticos.
Los pacientes fueron aleatorizados 1: 1 para recibir Somatulina Autogel 120 mg cada 28 días (n = 101) o placebo (n = 103). La aleatorización se estratificó de acuerdo a la terapia previa a la inclusión y por la presencia/ausencia de progresión durante la fase de selección correspondiente a los 3 a 6 meses previos a la visita basal según evaluación por criterios RECIST 1.0 (Criterios de Evaluación de Respuesta en Tumores Sólidos).
Los pacientes tenían metástasis y/o enfermedad localmente avanzada inoperable con diagnóstico histológico confirmado de tumores bien o moderadamente diferenciados localizados principalmente en el páncreas (44,6% de los pacientes), intestino medio (35,8%), intestino posterior (6,9%) o de otra localización/localización del primario desconocida (12,7%).
El 69% de los pacientes con TNEs-GEP tenían tumores de grado 1 (G1), definido bien por un índice de proliferación Ki67 < 2% (50,5% del total de los pacientes) o un índice mitótico < 2 mitosis/10 HPF (18,5% del total de los pacientes) y un 30% de los pacientes con TNEs-GEP tenían tumores en el rango inferior del grado 2 (G2) (definido por un índice Ki67 > 2% - < 10%). En un 1% de los pacientes la información sobre el grado no estaba disponible. El estudio excluyó pacientes con TNEs-GEP G2 con uníndice de proliferación celular superior (Ki67 > 10% - <20%) y carcinomas neuroendocrinos GEP G3 (índice Ki67 > 20%).
En conjunto, el 52,5% de los pacientes tuvieron una carga tumoral hepática < 10%, el 14,5% tuvieron una carga tumoral hepática > 10 y < 25% y el 33% tuvieron una carga tumoral hepática > 25%.
El criterio principal de valoración fue la supervivencia libre de progresión (SLP) medida como tiempo hasta la progresión de la enfermedad de acuerdo a criterios RECIST 1.0 o muerte dentro de las 96 semanas después de la primera administración del tratamiento. El análisis de la SLP se basó en la evaluación de la progresión radiológica realizada de una manera centralizada e independiente.
Tabla 1: Resultados de eficacia del estudio de fase III
|
Mediana de la supervivencia libre de progresión (en semanas) |
Hazard Ratio (95% CI) |
Reducción del riesgo de progresión o muerte |
Valor p | |
|
Somatulina Autogel (n=101) |
Placebo (n=103) | |||
|
> 96 semanas |
72 semanas (95% CI : 48.57;, 96.00) |
0,470 (0.304, 0.729) |
53% |
0.0002 |
El efecto beneficioso de lanreotida en la reducción del riesgo de progresión o muerte fue consistente independientemente de la localización del tumor primario, la carga tumoral hepática, la quimioterapia previa, la línea basal de Ki67, el grado del tumor u otras características pre-especificadas como se muestra en la Figura 2.
Se observó un beneficio clínicamente relevante del tratamiento con Somatulina Autogel tanto en pacientes con tumores de páncreas, intestino medio y otro origen/origen desconocido como en la población global del estudio. El número limitado de pacientes con tumores del intestino posterior (14/204) contribuyó a la dificultad de interpretación de los resultados de este subgrupo. Los datos disponibles sugerirían que no habría beneficio en estos pacientes.
Figura 1: Curvas Kaplan-Meier de Supervivencia Libre de Progresión
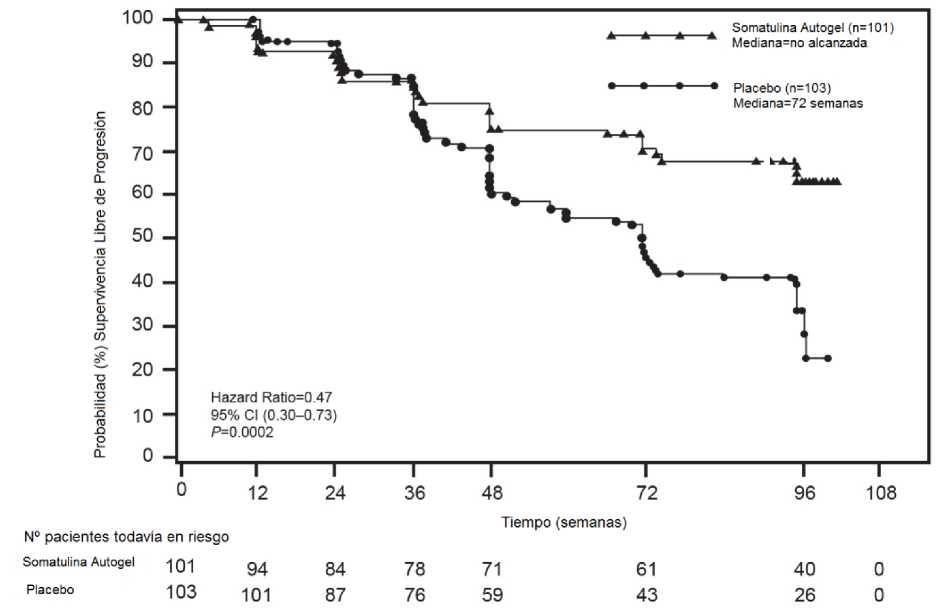
Figura 2 - Resultados del Análisis de Covariables de SLP mediante Modelo de Cox de Riesgos Proporcionales
0.01
A favor de Somatulina Autogel 120 mg -1-1-1-
0.25
0.125
0.5 1
Hazard Ratio (95% Cl)
A favor del placebo -1-r~
|
N | |
|
Edad |
204 |
|
Cromogranina A Basal |
199 |
|
Ki67 Basal |
204 |
|
índice de masa corporal |
195 |
|
Grado del tumor |
202 |
|
Carga tumoral hepática |
204 |
|
Localización del tumor primario |
204 |
|
Quimioterapia previa |
204 |
|
Cirugía previa del tumor primario |
204 ■ |
|
Raza |
204 - |
|
Sexo |
204 |
|
Tiempo hasta el diagnóstico |
204 |
Nota: Todos los HRs son los riesgos relativos para Somatulina Autogel vs placebo. Los resultados para las covariables derivan de modelos Cox PH separados con términos para el tratamiento, progresión basal, tratamiento previo de inicio, y el término etiquetado en el eje vertical.
El 45,6% (47/103) de los pacientes del grupo placebo pasaron a recibir tratamiento con Somatulina Autogel en la extensión abierta del estudio.
Un ensayo clínico realizado con pacientes acromegálicos bien controlados con SOMATULINA 30 mg cada 14 ó 10 días, demostróque la administración de SOMATULINA AUTOGEL 120 mg cada 56 ó 42 días es no inferior a la pauta posológica inicial según la evaluación de los niveles de GH.
5.1.4 Población pediátrica
La Agencia Europea de Medicamentos ha eximido de la obligación de presentar los resultados de los estudios con Somatulina Autogel en los diferentes grupos de la población pediátrica en acromegalia y gigantismo pituitario (ver sección 4.2 para consultar la información sobre el uso en población pediátrica).
La Agencia Europea de Medicamentos ha incluido los tumores neuroendocrinos gastroenteropancreáticos (excluyendo neuroblastoma, neuroganglioblastoma, feocromocitoma) en la lista de exenciones de clase.
5.2 Propiedades farmacocinéticas
Los parámetros farmacocinéticos intrínsecos de la lanreotida tras su administración intravenosa a voluntarios sanos indican una distribución extravascular limitada, con un volumen de distribución de 16,1 l en el estado estacionario. El aclaramiento total fue de 23,7 l/h, la vida media terminal fue de 1,14 horas y el tiempo medio de residencia fue de 0,68 horas.
En estudios que evaluaban la excreción, menos del 5% de la lanreotida se excretó en orina y menos del 0,5% se recuperó inalterado en heces, lo que indica algún tipo de excreción biliar.
3E
Después de una inyección subcutánea profunda de SOMATULINA AUTOGEL 60, 90 y 120 mg a voluntarios sanos, la concentración de lanreotida aumentó hasta alcanzar unas medias de concentración máxima en suero de 4.25, 8.39 y 6.79 ng/ml. Estos valores de Cmax se alcanzaron durante el primer día, a las 8, 12 y 7 horas (valores medios)tras la administración. Desde el pico de niveles séricos las concentraciones de lanreotida disminuyen lentamente siguiendo una cinética de primer orden con una vida media de eliminación terminal de 23.3, 27.4 y 30.1 días respectivamente y 4 semanas tras la administración, los niveles medios de lanreotida sérica eran de 0.9, 1.11 y 1.69 ng/ml, respectivamente. La biodisponibilidad absoluta es de 73.4, 69.0 y 78.4%.
Tras la administración subcutánea profunda de SOMATULINA AUTOGEL 60, 90 y 120mg a pacientes acromegálicos, la concentración de lanreotida aumentó hasta alcanzar unas medias de concentración máxima en suero de 1.6, 3.5 y 3.1 ng/ml. Estos valores de Cmax se alcanzaron durante el primer día, a las 6, 6 y 24 horastras la administración. Desde el pico de niveles séricos las concentraciones de lanreotida disminuyen lentamente siguiendo una cinética de primer orden y 4 semanas tras la administración los niveles medios de lanreotida en suero fueron de 0.7, 1.0 y 1.4 ng/ml, respectivamente.
Los niveles séricos de lanreotida en equilibrio estacionario se alcanzaron, de media, tras 4 inyecciones cada 4 semanas. Tras la administración repetida cada 4 semanas, los valores medios de Cmax en el equilibrio estacionario fueron 3.8, 5.7 y 7.7 ng/ml para 60, 90 y 120mg respectivamente, los valores medios de Cmin obtenidos fueron 1.8, 2.5 y 3.8 ng/ml. El valle del índice de fluctuación oscila de forma moderada del 81 al 108%.
Los perfiles farmacocinéticos lineales de liberación se observaron tras una administración subcutánea profunda de SOMATULINA AUTOGEL 60, 90 y 120mg en pacientes acromegálicos. Los niveles séricos mínimos de lanreotida obtenidos después de tres inyecciones subcutáneas profundas de SOMATULINA AUTOGEL 60, 90 ó 120 mg aplicadas cada 28 días son similares a los niveles séricos mínimos en estado de equilibrio de lanreotida hallados en los pacientes acromegálicos tratados previamente con administraciones intramusculares de lanreotida 30 mg (SOMATULINA) cada 14, 10 ó 7 días respectivamente.
En un análisis farmacocinético poblacional en 290 pacientes con TNEs-GEP que recibieron Somatulina Autogel 120 mg, se observó una liberación rápida inicial con valores medios de Cmax de 7,49 ± 7,58 ng/ml alcanzados en el primer día después de una sola inyección. Las concentraciones en el estado estacionario se alcanzaron después de 5 inyecciones de Somatulina Autogel 120 mg cada 28 días y se mantuvieron hasta la última evaluación (hasta 96 semanas después de la primera inyección). En el estado estacionario los valores medios de Cmax fueron 13,9 ± 7,44 ng/ml y los niveles séricos medios valle fueron 6,56 ± 1,99 ng/ml. La vida media terminal aparente fue de 49,8 ± 28,0 días.
Insuficiencia renal/hepática:
Los sujetos con insuficiencia renal grave muestran una disminución de aproximadamente 2 veces el aclaramiento sérico total de lanreotida, con el consecuente aumento en la vida media y el AUC. En sujetos con un daño renal moderado a grave se ha observado una reducción del aclaramiento (30%). El volumen de distribución y el tiempo medio de residencia aumentan en sujetos con cualquier grado de insuficiencia hepática.
No se observó ningún efecto en el aclaramiento de la lanreotida en un análisis farmacocinético poblacional de pacientes con TNEs-GEP que incluyó 165 con insuficiencia renal leve y moderada (106 y 59 respectivamente) tratados con SomatulinaAutogel. No se han estudiado pacientes con TNEs-GEP con deterioro de la función renal grave.
No se han estudiado pacientes con TNEs-GEP con insuficiencia hepática (según puntuación de Child-Pugh).
No es necesario modificar la dosis de inicio en pacientes con daño renal o hepático, ya que se espera que las concentraciones séricas de lanreotida en estas poblaciones estén dentro del rango de concentración bien tolerada en sujetos sanos.
Ancianos:
Los pacientes ancianos muestran un incremento en la vida media y el tiempo medio de residencia en relación con sujetos jóvenes sanos. No es necesario modificar la dosis de inicio en los pacientes ancianos, ya que se espera que las concentraciones séricas de lanreotida en esta población estén dentro del rango de concentración bien tolerada en sujetos sanos.
En un análisis farmacocinético poblacional en pacientes con TNEs-GEP que incluyó 122 pacientes de 65 a 85 años, no se observó ningún efecto de la edad sobre el aclaramiento y el volumen de distribución de lanreotida.
5.3 Datos preclínicos sobre seguridad
En los ensayos carcinogénicos realizados en ratas y ratones, no se observaron cambios neoplásicos sistémicos a dosis mucho mayores que las alcanzadas en humanos a dosis terapéuticas. Se observó un aumento en la incidencia de tumores subcutáneos en el lugar de inyección, probablemente debido al incremento en la frecuencia de dosis en los animales (diario) comparada con la dosis mensual en humanos, por lo que no debería ser clínicamente relevante.
Lanreotida no mostró ningún potencial genotóxico en las baterías de ensayos in vivo e in vitro realizadas. 6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Agua para inyección, ácido acético glacial (para ajuste de pH).
6.2 Incompatibilidades No procede.
6.3 Periodo de validez
2 años.
El producto se debe administrar inmediatamente una vez abierto el envoltorio laminado protector.
6.4 Precauciones especiales de conservación Conservar en nevera (entre 2°C y 8°C) en su envase original.
6.5 Naturaleza y contenido del envase
SOMATULINA AUTOGEL se suministra en una jeringa precargada (de polipropileno transparente) con un sistema de seguridad automático, una aguja (de acero inoxidable), una funda de plástico para la aguja (LDPE) y el tapón del émbolo (de goma de bromobutilo).
3E
i**4
'ni®:
Cada jeringa precargada se envasa en un envoltorio laminado (polietilentereftalato/aluminio/polietileno laminado) y una caja de cartón.
Caja con una jeringa precargada de 0,5 ml con un sistema de seguridad automático y una aguja (1,2 mm x 20 mm).
6.6 Precauciones especiales de eliminación y otras manipulaciones
Somatulina Autogel se suministra en forma de jeringa precargada lista para su uso con un sistema de seguridad que se coloca en su sitio automáticamente tras la administración del producto, para prevenir un posible pinchazo con la jeringa después de su utilización.
|
r=—HKv | ||
|
r- I = |
==[ *L |
- * j |
|
A Tapón de la |
--w |
A Protector del |
|
aguja |
ANTES DE USAR |
émbolo |
|
«F1 |
< * . • |
P=D |
|
DESPUÉS DE USAR (AGUJA EN LA FUNDA) | ||
Para un uso único e inmediato tras la primera apertura.
1. Sacar Somatulina Autogel de la nevera 30 minutos antes de la administración. Mantener el sobre cerrado hasta justo antes de la inyección.
2. Antes de abrir el sobre, compruebe que está intacto y que la medicación no ha caducado. La fecha de caducidad está impresa en la caja externa y en el sobre. NO UTILIZAR SI LA MEDICACIÓN HA CADUCADO O SI EL SOBRE PROTECTOR ESTÁ DAÑADO DE ALGÚN MODO.
4. Rasgar el sobre para abrirlo y sacar la jeringa precargada.
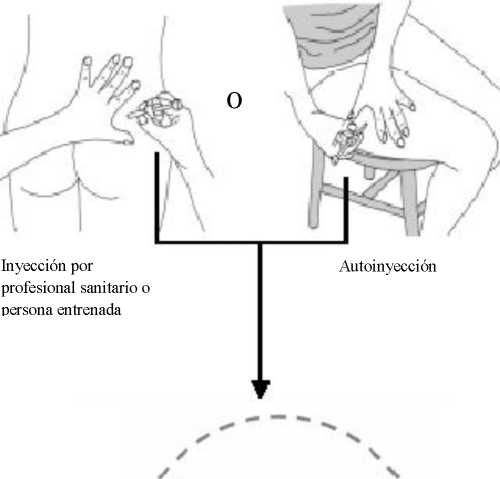
5. Seleccionar un lugar de inyección:
a. el cuadrante superior externo de la nalga (en caso de que la inyección la realice un profesional sanitario o un miembro de la familia o amigo entrenado), o
b. la parte superior del muslo (si lo está inyectando usted mismo).
Inyección por profesional sanitario o por persona entrenada
Autoinyección
5a.
5b.
A
o

• Alternar el lugar de inyección entre el lado izquierdo y derecho cada vez que reciba una inyección de Somatulina Autogel.
6. Limpiar el lugar de inyección.
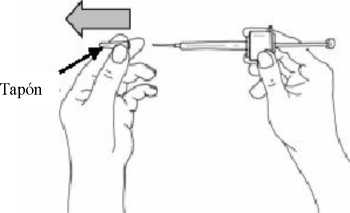
7. Girar el protector del émbolo y tirar hacia atrás para quitarlo.
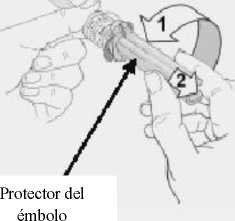
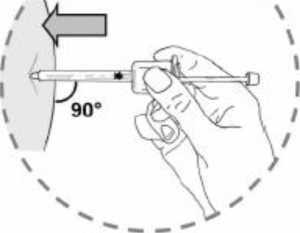
9. Mantener la piel tirante alrededor del lugar de inyección utilizando el pulgar y el índice. Sin plegar ni presionar la piel en el lugar de inyección, inserte rápidamente la aguja en toda su longitud (inyección
3E
subcutánea profunda), de forma perpendicular a la piel (90°).
10. Inyectar el producto lentamente. Suelen ser necesarios unos 20 segundos. Inyectar toda la dosis hasta que el émbolo llegue hasta el final. En este punto, oirá un “click”.
Nota: mantenga la presión sobre el émbolo con el pulgar para evitar la activación del sistema automático de seguridad.
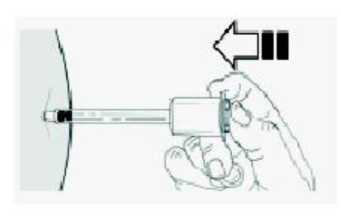
11.Sin dejar de presionar el émbolo con el pulgar, retire la aguja del lugar de inyección.
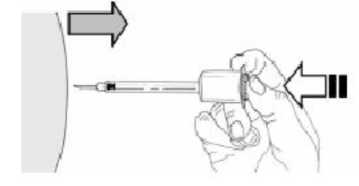
3E
12. Deje de presionar sobre el émbolo. La aguja se retraerá automáticamente dentro de la funda donde quedará permanentemente cerrada.
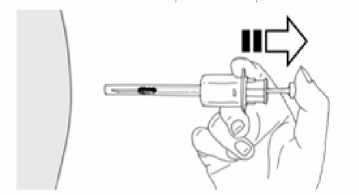
13. Aplicar una ligera presión en el lugar de inyección con un algodón seco o una gasa estéril para prevenir un posible sangrado. No frotar ni masajear el lugar de inyección tras la administración.
Eliminar la jeringa usada de acuerdo con las instrucciones de su médico. NO tire el dispositivo a la basura.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
IPSEN PHARMA, S.A.
Torre Realia, Plaza de Europa, 41-43 08908 L’Hospitalet de Llobregat Barcelona - España
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
SOMATULINA AUTOGEL 60 mg. N° Reg AEMPS: 64.837 SOMATULINA AUTOGEL 90 mg. N° Reg AEMPS: 64.838 SOMATULINA AUTOGEL 120 mg. N° Reg AEMPS: 64.839
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: Junio 2002 Fecha de la última renovación: Julio 2008
10. FECHA DE LA REVISIÓN DEL TEXTO
Septiembre 2015