Simbrinza 10Mg/Ml + 2Mg/Ml Colirio En Suspension
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO
1. NOMBRE DEL MEDICAMENTO
SIMBRINZA 10 mg/ml + 2 mg/ml colirio en suspensión
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
1 ml de suspensión contiene 10 mg de brinzolamida y 2 mg de tartrato de brimonidina, equivalente a
1,3 mg de brimonidina.
Excipiente(s) con efecto conocido:
Cada ml de suspensión contiene 0,03 mg de cloruro de benzalconio.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Colirio en suspensión (colirio).
Suspensión uniforme de color entre blanco y blanquecino, pH 6,5 (aproximadamente).
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Reducción de la presión intraocular (PIO) elevada en pacientes adultos con glaucoma de ángulo abierto o hipertensión ocular en los que la monoterapia produce una reducción insuficiente de la PIO (ver sección 5.1).
4.2 Posología y forma de administración
Posología
Uso en adultos, incluidos pacientes de edad avanzada
La dosis recomendada es de una gota de SIMBRINZA dos veces al día en el ojo(s) afectado(s).
Insuficiencia hepática y/o renal
No se ha estudiado el tratamiento con SIMBRINZA en pacientes con insuficiencia hepática por lo que se recomienda precaución en estos pacientes (ver sección 4.4).
No se ha estudiado el tratamiento con SIMBRINZA en pacientes con insuficiencia renal grave (aclaramiento de creatinina <30 ml/min) ni en pacientes con acidosis hiperclorémica. Como el componente de SIMBRINZA, la brinzolamida y su principal metabolito se excretan mayoritariamente por vía renal, SIMBRINZA está contraindicado en estos pacientes (ver sección 4.3).
Población _ pediátrica
No se ha establecido la seguridad y eficacia de SIMBRINZA en niños y adolescentes de 2 a 17 años de edad. No se dispone de datos. SIMBRINZA no se recomienda en niños o adolescentes (ver sección 4.4).
No se debe usar SIMBRINZA en neonatos y niños menores de 2 años de edad por motivos de seguridad (ver sección 4.3).
Forma de administración Vía oftálmica.
Se debe indicar a los pacientes que agiten bien el frasco antes de utilizarlo.
Después de la instilación es recomendable cerrar suavemente los ojos y ocluir el conducto nasolagrimal durante 2 minutos para reducir la absorción sistémica. De este modo se puede conseguir una disminución de los efectos adversos sistémicos y un aumento de la actividad local (ver sección 4.4).
Para evitar una posible contaminación de la punta del cuentagotas y de la suspensión, se debe tener la precaución de no tocar los párpados, áreas circundantes ni otras superficies con la punta del frasco. Indique a los pacientes que se debe mantener el frasco bien cerrado cuando no se utilice.
SIMBRINZA se puede utilizar concomitantemente con otros medicamentos oftálmicos para reducir la presión intraocular. Si se emplea más de un medicamento por vía oftálmica, las aplicaciones de los medicamentos se deben espaciar al menos 5 minutos.
Si se olvida una dosis, se debe continuar el tratamiento con la siguiente dosis que estaba prevista. La dosis no debe exceder de 1 gota 2 veces al día en el ojo (s) afectado(s).
4.3 Contraindicaciones
Hipersensibilidad a los principios activos o a alguno de los excipientes incluidos en la sección 6.1 o a las sulfonamidas (ver sección 4.4)
Pacientes tratados con inhibidores de la monoaminooxidasa (IMAO) (ver sección 4.5)
Pacientes tratados con antidepresivos que afectan la transmisión noradrenérgica (p.ej. antidepresivos tricíclicos y mianserina) (ver sección 4.5)
Pacientes con insuficiencia renal grave (ver sección 4.4)
Pacientes con acidosis hiperclorémica
Neonatos y niños menores de 2 años de edad (ver sección 4.4)
4.4 Advertencias y precauciones especiales de empleo
Este medicamento no se debe inyectar. Se debe indicar a los pacientes que no ingieran SIMBRINZA. Efectos oculares
No se ha estudiado la administración de SIMBRINZA en pacientes con glaucoma de ángulo estrecho, por lo que no se recomienda su utilización en estos pacientes.
No se ha establecido el posible papel de la brinzolamida sobre la función del endotelio corneal en pacientes con córneas alteradas (especialmente en pacientes con recuento de células endoteliales bajo). En particular, no se han estudiado pacientes portadores de lentes de contacto por lo que se recomienda un seguimiento cuidadoso de estos pacientes cuando utilicen brinzolamida, ya que los inhibidores de la anhidrasa carbónica pueden afectar la hidratación corneal y el uso de lentes de contacto podría aumentar el riesgo corneal. Se recomienda monitorización estricta en pacientes con córneas alteradas, tales como pacientes con diabetes mellitus o distrofias corneales. Con una monitorización estricta, se puede utilizar SIMBRINZA mientras se utilicen lentes de contacto (ver debajo de “Cloruro de benzalconio”).
El tartrato de brimonidina puede producir reacciones alérgicas oculares. Si se observan reacciones alérgicas, se debe suspender el tratamiento. Se han notificado reacciones de hipersensibilidad ocular retardada con tartrato de brimonidina, en algunos casos asociadas a un aumento de la PIO.
No se han estudiado los efectos potenciales después de la finalización del tratamiento con SIMBRINZA. Aunque no se ha estudiado la duración del efecto de disminución de la PIO de SIMBRINZA, es de esperar que el efecto de disminución de la PIO de la brinzolamida se mantenga durante 5-7 días. El efecto de disminución de la PIO de brimonidina puede ser más prolongado.
Efectos sistémicos
SIMBRINZA contiene brinzolamida, una sulfonamida inhibidora de la anhidrasa carbónica que, aunque se administra por vía oftálmica, se absorbe a nivel sistémico. Tras administración oftálmica, pueden aparecer las mismas reacciones adversas que las atribuidas a las sulfonamidas. En caso de que aparezcan signos de reacciones graves o de hipersensibilidad, se debe interrumpir el uso de este medicamento.
Trastornos cardíacos
En algunos pacientes se observaron pequeños descensos de la presión sanguínea después de la administración de SIMBRINZA. Se recomienda precaución cuando se utiliza concomitantemente con SIMBRINZA medicamentos tales como antihipertensivos y/o glucósidos cardíacos o en pacientes con enfermedad cardiovascular grave o inestable y no controlada (ver sección 4.5).
SIMBRINZA se debe utilizar con precaución en pacientes con depresión, insuficiencia cerebral o coronaria, fenómeno de Raynaud, hipotensión ortostática o tromboangeítis obliterante.
Trastornos ácido/base
Se han notificado trastornos ácido-base con inhibidores de la anhidrasa carbónica por vía oral. SIMBRINZA contiene brinzolamida, un inhibidor de la anhidrasa carbónica que, aunque se administra vía oftálmica, se absorbe a nivel sistémico. Tras administración oftálmica, pueden aparecer las mismas reacciones adversas que las atribuidas a los inhibidores carbónicos orales (p.ej. trastornos ácido-base) (ver sección 4.5).
Se debe utilizar con precaución en pacientes con riesgo de insuficiencia renal debido al posible riesgo de acidosis metabólica. SIMBRINZA está contraindicado en pacientes con insuficiencia renal grave (ver sección 4.3).
Insuficiencia hepática
No se ha estudiado el tratamiento con SIMBRINZA en pacientes con insuficiencia hepática por lo que se recomienda precaución en estos pacientes (ver sección 4.2).
Estado de alerta mental
En pacientes de edad avanzada, los inhibidores de la anhidrasa carbónica orales pueden empeorar la capacidad para realizar tareas que requieran alerta mental y/o coordinación física. Puesto que SIMBRINZA se absorbe sistémicamente, estos efectos se pueden presentar tras su administración oftálmica (ver sección 4.7).
Cloruro de benzalconio
SIMBRINZA contiene cloruro de benzalconio que puede producir irritación y se sabe que altera el color de las lentes de contacto blandas. Evitar el contacto con las lentes de contacto blandas. Se debe instruir a los pacientes para que se retiren las lentes de contacto antes de la aplicación de SIMBRINZA y esperen al menos 15 minutos después de la instilación de la dosis antes de volver a colocarlas.
También se ha notificado que el cloruro de benzalconio produce queratopatía punctata y/o queratopatía ulcerativa tóxica. Se recomienda monitorización estrecha si se utiliza con frecuencia o durante periodos prolongados.
Población pediátrica
No se ha establecido la seguridad y eficacia de SIMBRINZA en niños y adolescentes de 2 a 17 años de edad. En neonatos y niños que recibían colirio de brimonidina como parte de tratamiento médico para el glaucoma congénito, se han notificado síntomas de sobredosis de brimonidina (incluyendo pérdida de conciencia, hipotensión, hipotonía, bradicardia, hipotermia, cianosis y apnea). Por lo que, SIMBRINZA está contraindicado en niños menores de 2 años de edad (ver sección 4.3).
No se recomienda el tratamiento en niños de 2 años y mayores (especialmente en aquellos de edad comprendida entre 2-7 años y/o que pesen < 20 kg) debido a los potenciales efectos adversos sobre el sistema nervioso central (ver sección 4.9).
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios específicos de interacción farmacológica con SIMBRINZA.
SIMBRINZA está contraindicado en pacientes tratados con inhibidores de la monoaminooxidasa y en pacientes tratados con antidepresivos que afecten la transmisión noradrenérgica (p.ej. antidepresivos tricíclicos y mianserina), (ver sección 4.3). Los antidepresivos tricíclicos pueden bloquear la respuesta hipotensora ocular de SIMBRINZA.
Se recomienda precaución cuando se administra junto con depresores del SNC (p.ej. alcohol, barbitúricos, opiáceos, sedantes o anestésicos) debido a la posibilidad de aparición de un efecto aditivo o de potenciación.
No se dispone de datos sobre el nivel de catecolaminas circulantes después de la administración de SIMBRINZA. No obstante, se recomienda precaución en pacientes tratados con medicamentos que afecten al metabolismo y a la recaptación de aminas circulantes (p.ej. clorpromazina, metilfenidato, reserpina, inhibidores de la recaptación de la serotonina-norepinefrina).
La clase de fármacos agonistas alfa adrenérgicos (p.ej. tartrato de brimonidina) puede reducir el pulso y la presión sanguínea. En algunos pacientes se observaron pequeños descensos de la presión sanguínea después de la administración de SIMBRINZA. Se recomienda precaución cuando se utiliza concomitantemente con SIMBRINZA medicamentos tales como antihipertensivos y/o glucósidos cardiacos.
Se recomienda precaución cuando se inicie (o modifique la dosis) de medicamentos sistémicos administrados de forma concomitante (independientemente de la forma farmacéutica), que puedan interaccionar con agonistas a-adrenérgicos o interferir con su actividad, es decir, agonistas o antagonistas de receptores adrenérgicos (p.ej. isoprenalina, prazosina).
La brinzolamida es un inhibidor de la anhidrasa carbónica que aunque se administra por vía oftálmica, se absorbe a nivel sistémico. Se han notificado trastornos ácido-base con inhibidores de la anhidrasa carbónica orales. Se debe tener en cuenta la posibilidad de interacciones en pacientes tratados con SIMBRINZA.
En pacientes tratados con un inhibidor de la anhidrasa carbónica oral y brinzolamida oftálmica, existe un potencial de un efecto aditivo sobre los efectos sistémicos conocidos de inhibición de la anhidrasa carbónica. No se recomienda la administración concomitante de SIMBRINZA e inhibidores de la anhidrasa carbónica orales.
Los isoenzimas del citocromo P-450 responsables del metabolismo de brinzolamida son CYP3A4 (principal), CYP2A6, CYP2B6, CYP2C8 y CYP2C9. Es de esperar que inhibidores del CYP3A4 como ketoconazol, itraconazol, clotrimazol, ritonavir y troleandomicina inhiban el metabolismo de brinzolamida debido al CYP3A4. Se aconseja precaución si se administran inhibidores del CYP3A4 de forma concomitante. Sin embargo, dado que la principal vía de eliminación es la renal, es poco probable que se produzca acumulación de brinzolamida. La brinzolamida no es un inhibidor de los isoenzimas del citocromo P-450.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No hay datos o éstos son limitados relativos al uso de SIMBRINZA en mujeres embarazadas. La brinzolamida tras administración sistémica fue teratogénica en ratas, pero no en conejos. Los estudios en animales con brimonidina administrada vía oral no sugieren efectos perjudiciales directos en términos de toxicidad para la reproducción. En estudios con animales, la brimonidina atravesó la placenta y entró en la circulación fetal en grado limitado. No se recomienda utilizar SIMBRINZA durante el embarazo, ni en mujeres en edad fértil que no estén utilizando métodos anticonceptivos.
Lactancia
Se desconoce si SIMBRINZA oftálmica se excreta en la leche materna. Los datos farmacodinámicos/toxicológicos disponibles en animales muestran que tras administración oral, se excretan niveles mínimos de brinzolamida en la leche materna. La brimonidina se excreta en la leche materna tras administración oral. No se debe utilizar SIMBRINZA en madres en periodo de lactancia.
Fertilidad
Datos no clínicos no muestran ningún efecto de la brinzolamida ni de la brimonidina sobre la fertilidad. No se dispone de datos sobre el efecto de la administración oftálmica de SIMBRINZA en la fertilidad humana.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de SIMBRINZA sobre la capacidad para conducir y utilizar máquinas es moderada.
SIMBRINZA puede producir mareo, fatiga y/o somnolencia que pueden afectar la capacidad para conducir o utilizar máquinas.
La visión borrosa transitoria y otras alteraciones visuales pueden afectar la capacidad de conducir o utilizar máquinas. Si aparece visión borrosa durante la instilación, el paciente debe esperar hasta que la visión sea nítida antes de conducir o utilizar máquinas.
Los inhibidores de la anhidrasa carbónica vía oral pueden empeorar la capacidad de pacientes de edad avanzada para realizar tareas que requieran alerta mental y/o coordinación física (ver sección 4.4).
4.8 Reacciones adversas
Resumen del perfil de seguridad
Las reacciones adversas más frecuentes en ensayos clínicos con SIMBRINZA, administrado dos veces al día, fueron hiperemia ocular y reacciones de tipo alérgico ocular, que ocurrieron aproximadamente en el 6-7% de los pacientes y disgeusia (sabor amargo o extraño en la boca después de la instilación) que ocurrió aproximadamente en el 3% de los pacientes. El perfil de seguridad de SIMBRINZA fue similar al de los componentes por separado (brinzolamida 10 mg/ml y brimonidina 2 mg/ml).
Tabla resumen de reacciones adversas
Las siguientes reacciones adversas se han notificado durante estudios clínicos con SIMBRINZA administrado dos veces al día y durante estudios clínicos y vigilancia post-comercialización con los componentes por separado, brinzolamida y brimonidina. Se clasifican de acuerdo con el siguiente criterio: muy frecuentes (>1/10), frecuentes (>1/100 a <1/10), poco frecuentes (>1/1.000 a <1/100), raras (>1/10.000 a <1/1.000), muy raras (<1/10.000) y frecuencia no conocida (no puede estimarse a partir de los datos disponibles) Las reacciones adversas se enumeran en orden decreciente de gravedad, dentro de cada intervalo de frecuencia.
|
Sistema de clasificación de órganos |
Reacciones adversas |
|
Infecciones e infestaciones |
Poco frecuentes: nasofaringitis2, faringitis2, sinusitis2 No conocida: rinitis2 |
|
Trastornos de la sangre y del sistema linfático |
Poco frecuentes: recuento disminuido de hematíes2, cloruro elevado en sangre2 |
|
Trastornos del sistema inmunológico |
Poco frecuentes: hipersensibilidad3, |
|
Sistema de clasificación de órganos |
Reacciones adversas |
|
Trastornos psiquiátricos |
Poco frecuentes: apatía2, depresión23, estado de ánimo deprimido2, insomnio1, libido disminuida2, pesadilla2, nerviosismo2 |
|
Trastornos del sistema nervioso |
Frecuentes: somnolencia1, mareo3, disgeusia1 Poco frecuentes: cefalea1 disfunción motora2, amnesia2, alteración de la memoria2, parestesia2 Muy raras: síncope3 No conocida: temblor2, hipoestesia2, ageusia2 |
|
Trastornos oculares |
Frecuentes: alergia ocular1, queratitis1, dolor ocular1, molestia ocular1, visión borrosa1, visión anormal3, hiperemia ocular1, palidez conjuntival3 Poco frecuentes: erosión corneal1, edema corneal2, blefaritis1, depósitos corneales (precipitado querático)1, trastorno conjuntival (papilar)1, fotofobia1, fotopsia2, hinchazón ocular2, edema palpebral1, edema conjuntival1, ojo seco1, secreción ocular1, agudeza visual disminuida2, lagrimeo aumentado1, pterigión2, eritema del párpado1, meibomitis2, diplopia2, deslumbramiento2, hipoestesia ocular2, pigmentación de esclerótica2, quiste subconjuntival2, sensación anormal en el ojo1, astenopía1 Muy raras: uveítis3, miosis3 No conocida: alteraciones visuales2, madarosis2 |
|
Trastornos del oído y del laberinto |
Poco frecuentes: vértigo1, acúfenos2 |
|
Trastornos cardíacos |
Poco frecuentes: distrés cardiorrespiratorio2, angina de pecho2, arritmia3, palpitaciones2,3, frecuencia cardiaca irregular2, bradicardia2,3, taquicardia3 |
|
Trastornos vasculares |
Poco frecuentes: hipotensión1 Muy raras: hipertensión3 |
|
Trastornos respiratorios, torácicos y mediastínicos |
Poco frecuentes: disnea2, hiperactividad bronquial2, dolor faringolaríngeo2, garganta seca1, tos2, epistaxis2, congestión del tracto respiratorio alto2, congestión nasal1, rinorrea2, irritación de garganta2, sequedad nasal1, goteo postnasal1, estornudos2 No conocida: asma2 |
|
Trastornos gastrointestinales |
Frecuentes: boca seca1 Poco frecuentes: dyspepsia1, esofagitis2, molestia abdominal1, diarrea2, vómitos2, náuseas2, movimientos intestinales frecuentes2, flatulencia2, hipoestesia oral2, paraestesia oral1 |
|
Trastornos hepatobiliares |
No conocida: anomalías en las pruebas de la función hepática2 |
|
Trastornos de la piel y del tejido subcutáneo |
Poco frecuentes: dermatitis de contacto1, urticaria2, erupción2, erupción maculopapular2, prurito generalizado2, alopecia2, adelgazamiento de la piel2 No conocida: edema de cara3, dermatitis2,3, 2,3 eritema , |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Poco frecuentes: dolor de espalda2, espasmos musculares2, mialgia2 |
|
Sistema de clasificación de órganos |
Reacciones adversas |
|
No conocida: artralgia2, dolor de extremidades2 | |
|
Trastornos renales y urinarios |
Poco frecuentes: dolor renal2 No conocida: polaquiuria2 |
|
Trastornos del aparato reproductor y de la mama |
Poco frecuentes: disfunción eréctil2 |
|
Trastornos generales y alteraciones en el lugar de administración |
Poco frecuentes: dolor2, dolor torácico2, sensación anormal2, sensación de inquietud2, irritabilidad2, residuo de medicamento1 No conocida: dolor torácico2, edema periférico2,3 |
1
2
3
reacción adversa observada con Simbrinza
reacción adversa adicional observada con monoterapia de brinzolamida reacción adversa adicional observada con monoterapia de brimonidina
Descripción de reacciones adversas seleccionadas
La reacción adversa sistémica notificada con más frecuencia relacionada con el uso de SIMBRINZA fue disgeusia (3,4%). Posiblemente está causada por el paso del colirio a la nasofaringe a través del conducto nasolagrimal y se atribuye principalmente a la brinzolamida, componente de SIMBRINZA. La incidencia de este efecto puede reducirse con la oclusión nasolagrimal o cerrando los ojos suavemente (ver sección 4.2).
SIMBRINZA contiene brinzolamida, una sulfonamida inhibidora de la anhidrasa carbónica con absorción sistémica. Los inhibidores de la anhidrasa carbónica sistémicos generalmente se asocian a efectos gastrointestinales, del sistema nervioso, hematológicos, renales y metabólicos. Tras administración oftálmica, pueden aparecer las mismas reacciones adversas que las atribuidas a los inhibidores de la anhidrasa carbónica orales.
Las reacciones adversas más frecuentes relacionadas con uno de los componentes de SIMBRINZA, la brimonidina, incluyeron reacciones de tipo alergia ocular, fatiga y/o somnolencia, y boca seca. El uso de brimonidina se ha relacionado con mínimos descensos en la presión sanguínea. Algunos pacientes a los que se les administró SIMBRINZA experimentaron descensos de la presión sanguínea similares a los observados con el uso de brimonidina como monoterapia.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional
4.9 Sobredosis
Si se produce una sobredosis con SIMBRINZA, el tratamiento debe ser sintomático y de mantenimiento. Se debe mantener las vías respiratorias del paciente despejadas.
Debido a uno de los componentes de SIMBRINZA, la brinzolamida, puede aparecer desequilibrio electrolítico, desarrollo de un estado acidótico y posibles efectos sobre el sistema nervioso. Se deben monitorizar los niveles séricos de electrolitos (especialmente potasio) y el pH sanguíneo.
En adultos, hay información muy limitada respecto a la ingestión accidental de uno de los componentes de SIMBRINZA, la brimonidina. El único efecto adverso notificado hasta la fecha fue hipotensión. Se notificó que el episodio hipotensivo fue seguido por hipertensión de rebote.
Se ha descrito que sobredosis orales de otros agonistas alfa-2 causan síntomas tales como hipotensión, astenia, vómitos, letargo, sedación, bradicardia, arritmias, miosis, apnea, hipotonía, hipotermia, depresión respiratoria y convulsiones.
Población pediátrica
Se han notificado reacciones adversas graves en sujetos pediátricos después de la ingestión accidental con uno de los componentes de SIMBRINZA, la brimonidina. Los sujetos experimentaron síntomas típicos de depresión del SNC, coma temporal o bajo nivel de conciencia, letargo, somnolencia, hipotonía, bradicardia, hipotermia, palidez, depresión respiratoria y apnea, y requirieron el ingreso en cuidados intensivos con intubación cuando procedía. Se notificó que todos los sujetos se recuperaron totalmente, generalmente dentro de las siguientes 6-24 horas.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Oftalmológicos, Preparados antiglaucoma y mióticos Código ATC: S01EC54
Mecanismo de acción
SIMBRINZA contiene dos principios activos: brinzolamida y tartrato de brimonidina. Estos dos componentes disminuyen la presión intraocular (PIO) en pacientes con glaucoma de ángulo abierto (GAA) e hipertensión ocular (HTO) por reducción de la formación de humor acuoso en los procesos ciliares del ojo. A pesar de que ambos, brinzolamida y brimonidina, disminuyen la PIO por reducción de la formación de humor acuoso, lo hacen por diferentes mecanismos de acción.
La brinzolamida actúa por inhibición de la enzima anhidrasa carbónica (AC-II) en el epitelio ciliar del ojo, que reduce la formación de iones bicarbonato lo que conlleva una reducción del transporte de sodio y fluido a través del epitelio ciliar. El resultado es una disminución de la formación de humor acuoso. La brimonidina, un agonista alfa-2 adrenérgico, inhibe la enzima adenilato ciclasa y suprime la formación del humor acuoso dependiente de la cAMP. Adicionalmente, la administración de brimonidina produce un aumento del flujo de salida uveoescleral.
Efectos farmacodinámicos
Eficacia clínica y seguridad
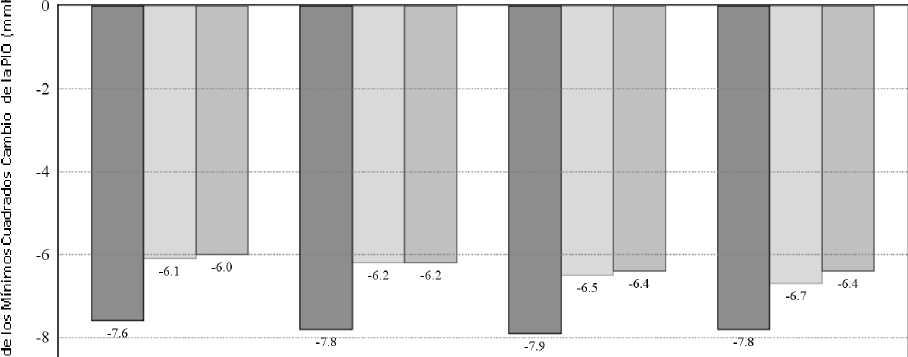
En un estudio clínico de contribución de los elementos, controlado, de 6 meses de duración, en el que participaron 560 pacientes con glaucoma de ángulo abierto (incluyendo pseudoexfoliación o síndrome de dispersión pigmentaria) y/o hipertensión ocular en los que, en opinión del investigador, estaba insuficientemente controlada con monoterapia o con varios medicamentos para reducir la PIO, y que presentaban una PIO basal media diurna de 26 mmHg, el efecto medio de disminución de la PIO diurna de SIMBRINZA, administrado dos veces al día, fue de aproximadamente 8 mmHg. Se observaron con SIMBRINZA reducciones estadísticamente superiores en la PIO media diurna, en comparación con brinzolamida 10 mg/ml o brimonidina 2 mg/ml, administradas dos veces al día, en todas las visitas a lo largo del estudio (Figura 1).
Figura 1. Mediaa Diurna (9 a.m., +2h, +7h) Cambio de la PIO respecto al valor basal (mmHg) -Estudio de contribución de los elementos
□ SIMBRINZA □ Brinzolamida □ Brimonidina
Semana 2 Semana 6 Mes 3 Mes 6
» n=191 n=191 n=174 n=188 n=189 n=172 n=176 n=182 n=161 n=160 n=178 n=145
un
ro
'■O
ai
i
10 -
aMedias de los mínimos cuadrados derivadas de un modelo estadístico que se aplica al centro estudiado, estrato PIO basal 9 a.m. y medidas de PIO correlacionadas por paciente.
Todas las diferencias de tratamiento (SIMBRINZA frente los componentes por separado) fueron estadísticamente significativas con p=0,0001 o inferior.
Las reducciones medias respecto a la PIO basal en cada tiempo y en cada visita fueron mayores con SIMBRINZA (de 6 a 9 mmHg) que en monoterapia con brinzolamida (de 5 a 7 mmHg) o brimonidina (de 4 a 7 mmHg). El porcentaje medio de reducciones de la PIO respecto al valor basal con SIMBRINZA osciló entre el 23 y 34%. Los porcentajes de pacientes con un valor de la PIO inferior a 18 mmHg fueron mayores en el grupo de SIMBRINZA que en el grupo de brinzolamida en 9 de los 12 controles durante el Mes 6 y fueron mayores en el grupo de SIMBRINZA que en el grupo de brimonidina en todos los 12 controles durante el Mes 6. En el punto de control + 2 h (el tiempo correspondiente al pico de eficacia de la mañana) de la visita de eficacia primaria en el Mes 3, el porcentaje de pacientes con una PIO inferior a 18 mmHg fue de 61,7% en el grupo de SIMBRINZA,
40,1 % en el grupo de brinzolamida y 40,0% en el grupo de brimonidina.
En un estudio clínico de no inferioridad, controlado, de 6 meses de duración, en el que participaron 890 pacientes con glaucoma de ángulo abierto (incluyendo pseudoexfoliación o síndrome de dispersión pigmentaria) y/o hipertensión ocular en los que, en opinión del investigador, estaba insuficientemente controlada con monoterapia o con varios medicamentos para reducir la PIO, y que presentaban una PIO basal media diurna de 26 a 27 mmHg, la no inferioridad de SIMBRINZA frente a brinzolamida 10 mg/ml + brimonidina 2 mg/ml, administradas conjuntamente, respecto a la reducción de la PIO media diurna respecto a la basal se demostró en todas las visitas a lo largo del estudio (Tabla 1).
Tabla 1. Comparación del cambio de la PIO Media Diurna (mmHg) respecto al valor basal - Estudio de no inferioridad
|
Visita |
SIMBRINZA Media3 |
Brinzolamida + Brimonidina Mediaa |
Diferencia Mediaa (95% IC) |
|
Semana 2 |
-8,4 (n=394) |
-8,4 (n=384) |
-0,0 (-0.4, 0.3) |
|
Semana 6 |
-8,5 (n=384) |
-8,4 (n=377) |
-0,1 (-0.4, 0.2) |
|
Mes 3 |
-8,5 (n=384) |
-8,3 (n=373) |
-0,1 (-0.5, 0.2) |
|
Mes 6 |
-8,1 (n=346) |
-8,2 (n=330) |
0,1 (-0.3, 0.4) |
aMedias de los mínimos cuadrados derivadas de un modelo estadístico que se aplica al centro estudiado, estrato PIO basal 9 a.m. y medidas de PIO correlacionadas por paciente.
Las reducciones medias respecto a la PIO basal en cada tiempo y en cada visita fueron similares (de 7 a 10 mmHg) con SIMBRINZA y con los componentes por separado, administrados concomitantemente. El porcentaje medio de reducciones de la PIO respecto al valor basal con SIMBRINZA osciló entre el 25 y 37%. Los porcentajes de pacientes con un valor de la PIO inferior a 18 mmHg fueron similares en los grupos de SIMBRINZA y brinzolamida + brimonidina a lo largo de las visitas del estudio en el mismo punto de control durante el Mes 6. En el punto de control + 2 h (el tiempo correspondiente al pico de eficacia de la mañana) de la visita de eficacia primaria en el Mes 3, el porcentaje de pacientes con una PIO inferior a 18 mmHg fue de 65,6 % en el grupo de SIMBRINZA y 63,7 % en los grupos brinzolamida+brimonidina.
Población pediátrica
La Agencia Europea de Medicamentos ha eximido al titular de la obligación de presentar los resultados de los ensayos realizados con SIMBRINZA en los diferentes grupos de población pediátrica en el tratamiento de glaucoma e hipertensión ocular (ver sección 4.2 para información sobre uso pediátrico).
5.2 Propiedades farmacocinéticas
Absorción
Después de la administración oftálmica, la brinzolamida se absorbe a través de la córnea. Esta sustancia también se absorbe en la circulación sistémica donde se une fuertemente a la anhidrasa carbónica de los eritrocitos. Las concentraciones plasmáticas son muy bajas. En humanos, la semivida de eliminación en sangre total es prolongada (>100 días) debido a la unión de la anhidrasa carbónica de los eritrocitos.
Después de la administración oftálmica, la brimonidina se absorbe rápidamente en el ojo. En conejos, en la mayoría de los casos, las concentraciones máximas oculares se alcanzaron en menos de una hora. Las concentraciones plasmáticas máximas en humanos son < 1 ng/ml y se alcanzaron en < 1 hora. Los niveles plasmáticos descendieron con una semivida de aproximadamente 2-3 horas. No se produce acumulación durante la administración crónica.
En un estudio clínico por vía oftálmica comparando la farmacocinética sistémica de SIMBRINZA, administrada dos o tres veces al día, con brinzolamida y brimonidina administradas por separado usando ambas posologías, el estado estacionario en sangre de brinzolamida y las farmacocinéticas de N-desetilbrinzolamida fueron similares entre la asociación y la brinzolamida administrada por separado. Asimismo, el estado estacionario farmacocinético en plasma de brimonidina en asociación fue similar al observado con la administración por separado de brimonidina, con excepción del grupo tratado con SIMBRINZA dos veces al día, con una media de AUC0-J2h alrededor de un 25 % inferior a la administración por separado con brimonidina dos veces al día.
Distribución
Estudios en conejos mostraron que tras administración oftálmica, las concentraciones máximas oculares de brinzolamida aparecen en los tejidos anteriores como la córnea, conjuntiva, humor acuoso y cuerpo ciliar e iris. La retención en los tejidos oculares se alarga debido a la unión con la anhidrasa carbónica. La brinzolamida se une moderadamente a las proteínas plasmáticas humanas (alrededor del 60 %).
La brimonidina presenta afinidad por tejidos oculares pigmentados, especialmente cuerpo ciliar e iris, debido a su conocida propiedad para unirse a la melanina. Sin embargo, los datos de seguridad clínicos y no clínicos muestran que presenta buena tolerancia y seguridad durante la administración crónica.
Biotransformación
La brinzolamida se metaboliza por isoenzimas hepáticas del citocromo P-450, en particular CYP3A4, CYP2A6, CYP2B6, CYP2C8 y CYP2C9. N-desetil-brinzolamida es el metabolito principal seguido de los metabolitos N-desmetoxipropil y O-desmetil, así como un análogo del ácido N-propiónico formado de la oxidación de la cadena lateral de N-propil de la O-desmetilbrinzolamida. La brinzolamida y el N-desetilbrinzolamida no inhiben las isoenzimas del citocromo P-450 a concentraciones de como mínimo 100-veces superiores a los niveles sistémicos máximos.
La brimonidina se metaboliza extensamente por la aldehído oxidasa hepática con la formación de los principales metabolitos 2-oxobrimonidina, 3-oxobrimonidina y 2,3-dioxobrimonidina. También se ha observado ruptura oxidativa del anillo imidazolina a 5-bromo-6-guanidinoquinoxalina.
Eliminación
La brinzolamida se elimina principalmente por la orina de forma inalterada. En humanos, la brinzolamida y N-desetilbrinzolamida en orina representa cerca del 60 y 6% de la dosis, respectivamente. Los datos en ratas muestran cierta excreción biliar (alrededor del 30%), principalmente en forma de metabolitos.
La brimonidina se elimina principalmente por la orina en forma de metabolitos. En ratas y monos, los metabolitos en orina representan de un 60 a 75% de las dosis orales o intravenosas.
Linealidad/No-linealidad
La farmacocinética de brinzolamida es inherentemente no lineal debido a la saturación de la unión con la anhidrasa carbónica en sangre y varios tejidos. La exposición en el estado estacionario no aumenta de forma proporcional con la dosis.
En cambio, la brimonidina muestra una farmacocinética lineal respecto al rango de la dosis clínica terapéutica.
Relación(es) farmacocinética/farmacodinámica( s)
SIMBRINZA está indicado para una acción local dentro del ojo. No es factible la valoración de la exposición ocular humana con dosis eficaces. No se ha establecido la relación farmacocinética/farmacodinámica en humanos para la disminución de la PIO.
Otras poblaciones especiales
No se han realizado estudios con SIMBRINZA para determinar los efectos de la edad, raza e insuficiencia renal o hepática. Un estudio de brinzolamida en pacientes japoneses frente a no-japoneses, mostró una farmacocinética sistémica similar entre los dos grupos. En un estudio de brinzolamida en sujetos con insuficiencia renal, se demostró un incremento en la exposición sistémica de 1,6 a 2,8 veces de brinzolamida y N-desetilbrinzolamida entre los sujetos con insuficiencia renal normal y moderada. Este incremento en las concentraciones estacionarias de eritrocitos del material relacionado con la sustancia, no inhibieron la actividad de la anhidrasa carbónica de los eritrocitos hasta niveles asociados con reacciones adversas sistémicas. Sin embargo, este medicamento no se recomienda en pacientes con insuficiencia renal grave (aclaramiento de creatinina <30 ml/min).
La Cmax, el AUC y la semivida de eliminación de la brimonidina son similares en los sujetos de edad avanzada (> 65 años) en comparación con adultos jóvenes. No se han evaluado los efectos de la insuficiencia renal o hepática sobre la farmacocinética sistémica de la brimonidina. Dada la baja exposición sistémica plasmática a la brimonidina tras administración oftálmica, se espera que los cambios en la exposición plasmática no sean clínicamente relevantes.
Población pediátrica
En pacientes pediátricos, no se ha estudiado la farmacocinética sistémica de brinzolamida y brimonidina, por separado o en asociación.
5.3 Datos preclínicos sobre seguridad
Brinzolamida
Datos no clínicos basados en estudios convencionales de farmacología de seguridad, toxicidad a dosis repetidas, genotoxicidad y potencial carcinogénico no revelaron especial riesgo en humanos.
En estudios no clínicos de toxicidad para la reproducción y desarrollo, únicamente se observaron efectos con exposiciones suficientemente en exceso de la exposición máxima en humanos, lo que indicó poca relevancia para el uso clínico.
En estudios de toxicidad materna de conejos con dosis orales de brinzolamida de hasta 6 mg/kg/día (261 veces la dosis clínica diaria recomendada de 23pg/Kg/día) no se evidenció ningún efecto sobre el desarrollo fetal. En ratas que recibieron dosis de 18 mg/kg/día (783 veces la dosis clínica diaria recomendada), pero no en las de 6 mg/kg/día, mostraron una leve reducción de la osificación del cráneo y esternebra de fetos. Estos hallazgos se observaron con dosis que causaron acidosis metabólica con disminución de la ganancia de peso corporal en las madres y reducción del peso fetal. En las crías de madres que recibieron de 2 a 18 mg/Kg/día se observaron disminuciones del peso fetal dependientes de la dosis administrada. Durante el periodo de lactancia, la concentración que no presentó efectos adversos en las crías fue de 5 mg/kg/día.
Brimonidina
Datos no clínicos basados en estudios convencionales de farmacología de seguridad, toxicidad a dosis repetidas, genotoxicidad, potencial carcinogénico y toxicidad para la reproducción y desarrollo no revelaron especial riesgo en humanos.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Cloruro de benzalconio Propilenglicol Carbómero 974P Ácido bórico Manitol
Cloruro de sodio Tiloxapol
Ácido clorhídrico y/o hidróxido de sodio (para ajustar el pH)
Agua purificada
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez 2 años.
4 semanas después de la primera apertura del envase.
6.4 Precauciones especiales de conservación
Este medicamento no requiere condiciones especiales de conservación.
6.5 Naturaleza y contenido del envase
Frascos redondos de polietileno de baja densidad (LDPE) opacos de 8 ml con un gotero dispensador de LDPE y tapón de rosca (DROP-TAINER) blanco de polipropileno que contiene 5 ml de suspensión.
Envase que contiene 1 ó 3 frascos.
Puede que solamente estén comercializados algunos tamaños de envase.
6.6 Precauciones especiales de eliminación
Ninguna especial.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Alcon Laboratories (UK) Ltd.
Frimley Business Park Frimley, Camberley Surrey GU16 7SR Reino Unido
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/14/933/001 -002
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización:
10. FECHA DE REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu
A. FABRICANTE(S) RESPONSABLE(S) DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
A. FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección del fabricante responsable de la liberación de los lotes
Alcon-Couvreur N.V.
Rijksweg 14 B-2870, Puurs Bélgica
o
Alcon Cusí, S.A.,
Camil Fabra 58,
08320 El Masnou,
Barcelona,
España
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica.
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
El Titular de la Autorización de Comercialización (TAC) presentará el primer informe periódico de seguridad para este medicamento en un plazo de 6 meses después de la autorización. Posteriormente, el titular de la autorización de comercialización presentará informes periódicos de seguridad para este medicamento de conformidad con las exigencias establecidas en la lista de fechas de referencia de la Unión (lista EURD), prevista en el artículo 107 ter, (párrafo 7), de la Directiva 2001/83/CE y publicados en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado en la versión del PGR incluido en el Módulo 1.8.2 de la Autorización de Comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos.
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
Si coincide la presentación de un IPS con la actualización del PGR, ambos documentos se pueden presentar conjuntamente.
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR CAJA DE UN FRASCO 5 ml
1. NOMBRE DEL MEDICAMENTO
SIMBRINZA 10 mg/ml + 2 mg/ml colirio en suspensión Brinzolamida/tartrato de brimonidina
2. PRINCIPIO(S) ACTIVO(S)
1 ml de suspensión contiene 10 mg de brinzolamida y 2 mg de tartrato de brimonidina
3. LISTA DE EXCIPIENTES
Cloruro de benzalconio, propilenglicol, carbómero 974P, ácido bórico, manitol, cloruro de sodio, tiloxapol, ácido clorhídrico y/o hidróxido de sodio (para ajustar el pH) y agua purificada.
Para mayor información consultar el prospecto
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Colirio en suspensión 1 x 5 ml 3 x 5 ml
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Agitar bien antes de usar.
Leer el prospecto antes de utilizar este medicamento. Vía oftálmica.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIALE(S), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
Desechar 4 semanas después de la primera apertura. Fecha de apertura:
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Alcon Laboratories (UK) Ltd. Frimley Business Park Frimley, Camberley Surrey GU16 7SR Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/14/933/001 1 x 5 ml EU/1/14/933/002 3 x 5 ml
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16 INFORMACIÓN EN BRAILLE
simbrinza
INFORMACIÓN MÍNIMA QUE DEBE INCLUIRSE EN PEQUEÑOS ACONDICIONAMIENTOS PRIMARIOS
ETIQUETA DEL FRASCO_
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
SIMBRINZA 10 mg/ml + 2 mg/ml colirio Brinzolamida/tartrato de brimonidina
Vía oftálmica
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
5 ml
6 OTROS
B. PROSPECTO
Prospecto: información para el usuario
SIMBRINZA 10 mg/ml + 2 mg/ml colirio en suspensión
Brinzolamida/tartrato de brimonidina
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico, oftalmólogo (oculista) o farmacéutico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico, oftalmólogo (oculista) o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es SIMBRINZA y para qué se utiliza
2. Qué necesita saber antes de empezar a usar SIMBRINZA
3. Cómo usar SIMBRINZA
4. Posibles efectos adversos
5. Conservación de SIMBRINZA
6. Contenido del envase e información adicional
1. Qué es SIMBRINZA y para qué se utiliza
SIMBRINZA contiene dos principios activos, brinzolamida y tartrato de brimonidina. La brinzolamida pertenece a un grupo de medicamentos llamados “inhibidores de la anhidrasa carbónica” y el tartrato de brimonidina pertenece a un grupo de medicamentos llamados “agonistas de los receptores alfa-2 adrenérgicos”. Ambos principios activos actúan juntos para reducir la presión en el interior del ojo.
SIMBRINZA se utiliza para reducir la presión en los ojos en pacientes adultos (mayores de 18 años de edad) que tienen enfermedades en el ojo conocidas como glaucoma o hipertensión ocular y en aquellos que no puede controlarse eficazmente la presión elevada en los ojos con un único medicamento.
2. Qué necesita saber antes de empezar a usar SIMBRINZA
No use SIMBRINZA:
- si es alérgico a brinzolamida o a tartrato de brimonidina o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6)
- si es alérgico a sulfonamidas (incluidos como ejemplo medicamentos utilizados para tratar diabetes e infecciones y también diuréticos (comprimidos para orinar))
- si está tomando inhibidores de la monoamino oxidasa (IMAO) (incluidos como ejemplo medicamentos para tratar la depresión o la enfermedad de Parkinson) o ciertos antidepresivos. Debe informar a su médico si está tomando algún medicamento para la depresión
- si padece problemas graves de riñón
- si tiene demasiada acidez en sangre (una enfermedad llamada acidosis hiperclorémica)
- en recién nacidos y niños menores de 2 años de edad.
Advertencias y precauciones
Consulte a su médico, oftalmólogo (oculista) o farmacéutico antes de empezar a usar SIMBRINZA si actualmente padece o ha padecido en el pasado:
- problemas de hígado.
- un tipo de presión elevada en los ojos llamada glaucoma de ángulo estrecho.
- ojos secos o problemas de córnea.
- enfermedad cardiaca coronaria (los síntomas pueden incluir o presión o dolor en el pecho, falta de aliento o ahogo), insuficiencia cardiaca, tensión arterial baja o alta.
- depresión
- trastorno o mala circulación sanguínea (tales como enfermedad de Raynaud o síndrome de Raynaud o insuficiencia cerebral).
si lleva lentes de contacto blandas, no utilice este colirio con las lentes de contacto puestas. Ver debajo de la sección “Si lleva lentes de contacto - SIMBRINZA contiene cloruro de benzalconio”.
Niños y adolescentes
No se recomienda SIMBRINZA en niños y adolescentes menores de 18 años. Es especialmente importante que no se utilice este medicamento en niños menores de 2 años (ver sección anterior “No use SIMBRINZA”). No se debe utilizar SIMBRINZA en niños debido al potencial de efectos adversos graves (ver sección 3).
Uso de SIMBRINZA con otros medicamentos
Informe a su médico, oftalmólogo (oculista) o farmacéutico si está utilizando, ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento.
SIMBRINZA puede afectar o puede ser afectado por otros medicamentos que esté utilizando, incluyendo otros colirios para el tratamiento del glaucoma.
Consulte a su médico si está utilizando o piensa utilizar alguno de los medicamentos siguientes:
- medicamentos para disminuir la presión sanguínea
- medicamentos para el corazón incluyendo digoxina (utilizado para tratar afecciones del corazón)
- otros medicamentos para el glaucoma que también sirven para tratar el mal de altura, conocidos como acetazolamida, metazolamida y dorzolamida
- medicamentos que pueden afectar el metabolismo como clorpromazina, metilfenidato y reserpina
- medicamentos antivirales, antiretrovirales (tipo de medicamentos utilizados para tratar el Virus de la Inmunodeficiencia Humana (VIH)) o antibióticos
- medicamentos antifúngicos (medicamentos frente a infecciones causadas por hongos) o antilevaduras (medicamentos frente a infecciones causadas por levaduras)
- inhibidores de la monoamino oxidasa (IMAO) o antidepresivos incluyendo amitriptilina, nortriptilina, clomipramina, mianserina, venlafaxina y duloxetina
- anestésicos
- sedantes, opiáceos o barbitúricos
- o si la dosis de cualquiera de sus medicamentos actuales cambia.
Uso de SIMBRINZA con alcohol
Si consume regularmente alcohol, consulte a su médico, oftalmólogo (oculista) o farmacéutico antes de utilizar este medicamento. SIMBRINZA puede ser afectado por el alcohol.
Embarazo y lactancia
Si está embarazada, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico, oftalmólogo (oculista) o farmacéutico antes de utilizar este medicamento. Se recomienda a las mujeres que puedan quedarse embarazadas que utilicen métodos anticonceptivos efectivos durante el tratamiento con SIMBRINZA. No se recomienda el uso de SIMBRINZA durante el embarazo. No utilice SIMBRINZA a menos que esté claramente indicado por su médico.
Si se encuentra en periodo de lactancia, SIMBRINZA puede pasar a la leche materna. No se recomienda el uso de SIMBRINZA durante la lactancia.
Conducción y uso de máquinas
Inmediatamente después de la aplicación de SIMBRINZA puede notar que su visión se vuelve borrosa o anormal. SIMBRINZA también puede causar mareos, somnolencia o cansancio en algunos pacientes.
No conduzca ni utilice máquinas hasta que los síntomas hayan desaparecido.
Si lleva lentes de contacto - SIMBRINZA contiene cloruro de benzalconio
SIMBRINZA contiene un conservante (cloruro de benzalconio) que puede causar irritación del ojo y se sabe que altera el color de las lentes de contacto blandas. Se debe evitar el contacto con lentes de contacto blandas. Si utiliza lentes de contacto debe quitárselas antes de la aplicación de SIMBRINZA y esperarse por lo menos 15 minutos después de la instilación de la dosis antes de volverse a colocar las lentes de contacto.
3. Cómo usar SIMBRINZA
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico, oftalmólogo (oculista) o farmacéutico. En caso de duda, consulte de nuevo a su médico, oftalmólogo (oculista) o farmacéutico.
Solo utilice SIMBRINZA en sus ojos. No tragar ni inyectar.
La dosis recomendada es una gota en el ojo u ojos afectados dos veces al día. Úselo a la misma hora cada día.
Cómo usar
Lávese las manos antes de empezar.
1
2
Agite bien antes de usar.
Desenrosque el tapón del frasco. Después de quitar el tapón, se debe retirar el anillo del precinto de seguridad antes de utilizar este medicamento.
No toque el cuentagotas con los dedos cuando abra o cierre el frasco, porque las gotas se podrían contaminar.
Sostenga el frasco, boca abajo, entre los dedos pulgar y corazón.
Incline la cabeza hacia atrás.
Separe suavemente el párpado inferior del ojo con un dedo, hasta que se forme una bolsa en la que deberá caer la gota (figura 1).
Acerque la punta del frasco al ojo. Se puede ayudar con un espejo.
No toque el ojo, el párpado, zonas próximas ni otras superficies con el cuentagotas, porque las gotas se podrían contaminar.
Presione suavemente la base del frasco para que caiga una gota de SIMBRINZA cada vez.
No apriete el frasco: está diseñado para que una suave presión en la base sea suficiente (figura 2).
Después de utilizar este colirio, cierre suavemente los ojos y presione con el dedo el borde del ojo, junto a la nariz durante al menos 2 minutos. Esto ayuda a evitar que el medicamento pase al resto del cuerpo.
Si se aplica gotas en ambos ojos, repita los puntos anteriores para el otro ojo. No es necesario cerrar y agitar el frasco entre las administraciones de ambos ojos. Enrosque bien el tapón en el frasco inmediatamente después de utilizar el producto.
Si está utilizando otros colirios, espere por lo menos cinco minutos entre la aplicación de SIMBRINZA y de las otras gotas.
Si una gota cae fuera del ojo, inténtelo de nuevo.
Si usa más SIMBRINZA del que debe
Puede eliminarlo lavando los ojos con agua templada. No se aplique más gotas hasta que sea la hora de la siguiente dosis.
Los adultos que ingirieron accidentalmente medicamentos que contenían brimonidina experimentaron una disminución del ritmo cardíaco, disminución de la presión sanguínea que pudo ir seguida de incremento de la presión sanguínea, insuficiencia cardiaca, dificultad para respirar y efectos sobre el sistema nervioso. Si esto sucede, contacte inmediatamente con su médico.
Se comunicaron efectos adversos graves en niños que habían ingerido accidentalmente medicamentos que contenían brimonidina. Los signos incluían somnolencia, flacidez, temperatura corporal baja, palidez y dificultad para respirar. Si esto sucede, contacte inmediatamente con su médico.
Si ha ingerido accidentalmente SIMBRINZA, contacte inmediatamente con su médico.
Si olvidó usar SIMBRINZA
Continúe con la siguiente dosis que estaba prevista. No se aplique una dosis doble para compensar las dosis olvidadas. No se aplique más de una gota dos veces al día en el ojo(s) afectado(s).
Si interrumpe el tratamiento con SIMBRINZA
No interrumpa el tratamiento con SIMBRINZA sin consultar antes con su médico, la presión en su ojo no estará controlada lo que le podría provocar pérdida de visión.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico, oftalmólogo (oculista) o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Si experimenta cualquiera de los siguientes efectos adversos, deje de usar este medicamento y busque inmediatamente atención médica ya que pueden ser los signos de una reacción al medicamento. No se conoce la frecuencia de una reacción alérgica a este medicamento (no se puede estimar la frecuencia a partir de los datos disponibles).
• Reacciones graves en la piel incluyendo erupción o enrojecimiento o picor en los ojos o en el cuerpo
• Problemas respiratorios
• Dolor en el pecho, latido irregular del corazón
Póngase inmediatamente en contacto con su médico si se siente mareado o extremadamente cansado.
Se han observado los siguientes efectos adversos con SIMBRINZA y con otros medicamentos que contienen brinzolamida o brimonidina por separado.
Efectos adversos frecuentes (pueden afectar hasta 1 de cada 10 personas)
- Efectos en el ojo: conjuntivitis alérgica (alergia en el ojo), inflamación de la superficie del ojo, dolor en el ojo, molestia en el ojo, visión borrosa o anormal, enrojecimiento del ojo
- Otros efectos adversos: somnolencia, mareo, mal sabor de boca, boca seca Efectos adversos poco frecuentes (pueden afectar hasta 1 de cada 100 personas)
- Efectos en el ojo: daño en la superficie del ojo con pérdida de células, inflamación del párpado, depósitos en la superficie del ojo, sensibilidad a la luz, hinchazón del ojo (afectando la córnea o párpado), ojo seco, secreción del ojo, ojos llorosos, enrojecimiento del párpado, sensación anormal o disminuida en los ojos, vista cansada, visión reducida, visión doble, partículas de producto en los ojos.
- Otros efectos adversos: descenso de la tensión arterial, dolor en el pecho, latido irregular del corazón, frecuencia cardiaca lenta o rápida, palpitaciones, dificultad para dormir (insomnio), pesadillas, depresión, debilidad generalizada, dolor de cabeza, mareo, nerviosismo, irritabilidad, sensación general de no sentirse bien, pérdida de memoria, falta de aliento, asma, sangrados nasales, síntomas de resfriado, sequedad nasal o de garganta, dolor de garganta, irritación de garganta, tos, secreción nasal (moqueo), nariz taponada, estornudos, sinusitis , congestión en el pecho, pitidos en los oídos, indigestión, gases intestinales o dolor abdominal, náuseas, diarrea, vómitos, sensación anormal en la boca, incremento de los síntomas de alergia en la piel, erupción, sensación anormal en la piel, pérdida de cabello, picor generalizado, incremento de los niveles sanguíneos de cloruro, o disminución del recuento de los glóbulos rojos en los análisis de sangre, dolor, dolor de espalda, dolor o espasmo muscular, dolor de riñones que se presenta como dolor en la parte baja de la espalda, deseo sexual disminuido, problemas sexuales masculinos.
Efectos adversos muy raros (pueden afectar hasta 1 de cada 10.000 personas)
- Efectos en el ojo: disminución del tamaño de la pupila
- Otros efectos adversos: desmayos, aumento de la tensión arterial Frecuencia no conocida (no se puede estimar a partir de los datos disponibles)
- Efectos en el ojo: disminución del crecimiento de las pestañas
- Otros efectos adversos: temblor, sensación disminuida, pérdida del gusto, valores anormales de las pruebas de la función del hígado observados en los análisis de sangre, hinchazón de la cara, dolor en articulaciones, orinar con frecuencia, dolor en el pecho, hinchazón de las extremidades
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, oftalmólogo (oculista) o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto.
También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el
Anexo V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de SIMBRINZA
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en el frasco y en la caja después de “CAD”. La fecha de caducidad es el último día del mes que se indica.
Este medicamento no requiere condiciones especiales de conservación.
Para evitar infecciones debe desechar el frasco 4 semanas después de la primera apertura. Escriba la fecha de apertura en el espacio provisto en la caja.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medioambiente.
6. Contenido del envase e información adicional Composición de SIMBRINZA
- Los principios activos son brinzolamida y tartrato de brimonidina. Un ml de suspensión contiene 10 mg de brinzolamida y 2 mg de tartrato de brimonidina, equivalente a 1,3 mg de brimonidina.
- Los demás componentes son cloruro de benzalconio (ver sección 2 “Si lleva lentes de contacto -SIMBRINZA contiene cloruro de benzalconio”), propilenglicol, carbómero 974P, ácido bórico, manitol, cloruro de sodio, tiloxapol, ácido clorhídrico y/o hidróxido de sodio y agua purificada.
Se añaden cantidades muy pequeñas de hidróxido de sodio y/o ácido clorhídrico para mantener los niveles normales de acidez (niveles de pH).
Aspecto del producto y contenido del envase
SIMBRINZA colirio en suspensión es un líquido (una suspensión uniforme de blanco a blanquecino) que se presenta en una caja que contiene uno o tres frascos de plástico de 5 ml con un tapón de rosca. Puede que solamente estén comercializados algunos tamaños de envase.
Titular de la autorización de comercialización
Alcon Laboratories (UK) Ltd.
Frimley Business Park Frimley, Camberley Surrey GU16 7SR Reino Unido
Responsable de fabricación
Alcon Cusí, S.A Camil Fabra 58 08320 El Masnou,
España
Responsable de fabricación
Alcon-Couvreur N.V.
Rijksweg 14 B-2870 Puurs Bélgica
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
Belgie/Belgique/Belgien Latvija
Luxembourg/Luxemburg Alcon Pharmaceuticals Ltd
Alcon NV W + 371 67 321 121
W + 32 (0)2 754 32 10 (Belgie/Belgique/Belgien)
Bt^rapnn
Ahkoh Etarapna EOOfl W + 359 2 950 15 65
Ceská republika
Alcon Pharmaceuticals (Czech Republic) s.r.o. W + 420 225 775 111
Danmark
Ísland
Norge
Suomi/Finland
Sverige
Alcon Nordic A/S W + 45 3636 4300
Deutschland
Alcon Pharma GmbH W + 49 (0) 761 1304-0
Eesti
Alcon Pharmaceuticals Ltd.
Eesti filiaal W + 372 6 313 214
EXXába
Kúnpoq
A^kov Aapnopáxoprg E^ág AEBE W + 30 210 68 78 300 (EUáSa)
España
Alcon Cusí, S.A.
W + 34 93 497 7000
France
Laboratoires Alcon W + 33 (0)1 47 10 47 10
Hrvatska
Alcon Farmaceutika d.o.o.
W + 385 1 4611 988
Ireland
Malta
United Kingdom
Alcon Laboratories (UK) Ltd.
W + 44 (0) 345 266 9363 (United Kingdom)
Lietuva
Alcon Pharmaceuticals Ltd. atstovybé W + 370 5 2 314 756
Magyarország
Alcon Hungária Gyógyszerkereskedelmi Kft. W + 36 1 463 9080
Nederland
Alcon Nederland BV W + 31 (0) 183 654 321
Portugal
Alcon Portugal - Produtos e Equipamentos Oftalmológicos, Lda.
W + 351 214 400 300
Romania
S.C. Alcon Romania S.R.L.
W + 40 21 203 93 24
Slovenija
Alcon d.o.o.
W + 386 1 422 5280
Slovenská republika
Novartis Slovakia s.r.o.
Alcon Division W + 421 2 5441 0378
Italia
Alcon Italia S.p.A.
® +39 02 81 80 31
Fecha de la última revisión de este prospecto:
Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu
30