Rotateq Solucion Oral
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
1. NOMBRE DEL MEDICAMENTO
RotaTeq solución oral
Vacuna frente a rotavirus, virus vivos
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Una dosis (2 ml) contiene: rotavirus tipo* G1 rotavirus tipo* G2 rotavirus tipo* G3 rotavirus tipo* G4 rotavirus tipo* P1A[8]
no menos de 2,2 x 106 UI1,2 no menos de 2,8 x 106 UI1,2 no menos de 2,2 x 106 UI1,2 no menos de 2,0 x 106 UI1,2 no menos de 2,3 x 106 UI1,2
* reasortantes de rotavirus humano-bovinos (virus vivos) producidos en células Vero. 1Unidades Infecciosas
2 Como límite inferior del intervalo de confianza (p = 0,95)
Excipientes con efecto conocido:
Esta vacuna contiene 1.080 mg de sacarosa (ver sección 4.4).
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Solución oral.
Líquido transparente amarillo pálido que puede tener un tono rosado.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
RotaTeq está indicado para la inmunización activa de niños a partir de las 6 semanas a 32 semanas de edad para la prevención de la gastroenteritis debida a infección por rotavirus (ver secciones 4.2, 4.4 y 5.1).
RotaTeq debe usarse de acuerdo con las recomendaciones oficiales.
4.2 Posología y forma de administración
Posología
Desde el nacimiento hasta las 6 semanas
RotaTeq no está indicado en este subconjunto de población pediátrica.
No se ha establecido la seguridad y eficacia de RotaTeq en individuos desde el nacimiento hasta las 6 semanas de edad.
Desde las 6 semanas hasta las 32 semanas
La pauta de vacunación consta de 3 dosis.
La primera dosis puede administrarse a partir de las 6 semanas de edad y no más tarde de las 12 semanas de edad.
RotaTeq puede administrarse a niños nacidos prematuramente siempre que el periodo de gestación haya sido de al menos 25 semanas. Estos niños deben recibir la primera dosis de RotaTeq al menos seis semanas después del nacimiento (ver secciones 4.4 y 5.1)
Debe haber intervalos de al menos 4 semanas entre dosis.
Se recomienda que la pauta de vacunación de tres dosis se complete a las 20-22 semanas de edad. Si es necesario, la tercera dosis (la última) se puede administrar hasta las 32 semanas de edad (ver sección 5.1).
Al no existir datos relativos a la intercambiabilidad de RotaTeq con otra vacuna frente a rotavirus, se recomienda que los niños que reciban RotaTeq para la primera inmunización frente a rotavirus reciban esta misma vacuna para las dosis siguientes.
Si se observa o se sospecha firmemente que se ha tomado una dosis incompleta (por ejemplo, el niño escupe o regurgita la vacuna), puede administrarse una única dosis de reemplazo en la misma visita, pero esta circunstancia no se ha estudiado en los ensayos clínicos. Si el problema se repite, no deben administrarse más dosis de reemplazo.
No se recomiendan más dosis después de completar el esquema de vacunación con 3 dosis (ver secciones 4.4 y 5.1 en cuanto a la información disponible sobre la persistencia de la protección).
Desde las 33 semanas hasta los 18 años
RotaTeq no está indicado en este subconjunto de población pediátrica.
Forma de administración
RotaTeq sólo se administra por vía oral.
RotaTeq NO DEBE SER INYECTADO BAJO NINGUNA CIRCUNSTANCIA.
RotaTeq puede administrarse independientemente de la comida, la bebida o la leche materna.
Ver sección 6.6 para instrucciones de administración.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1. Hipersensibilidad después de una administración previa de vacunas frente a rotavirus.
Historial previo de invaginación intestinal.
Individuos con malformación congénita del tracto gastrointestinal que pudiera predisponer a la invaginación intestinal.
Niños con inmunodeficiencia conocida o sospechada (ver secciones 4.4 y 4.8).
La administración de RotaTeq debe posponerse en niños que padecen una enfermedad aguda grave que cursa con fiebre. Una infección leve no es una contraindicación para la inmunización.
La administración de RotaTeq debe posponerse en niños con diarrea aguda o vómitos.
4.4 Advertencias y precauciones especiales de empleo
Como con todas las vacunas, siempre se debe disponer del tratamiento y la supervisión médica apropiada en el caso de que ocurra un episodio anafiláctico tras la administración de la vacuna (ver sección 4.8).
No se dispone de datos de seguridad o eficacia en ensayos clínicos respecto a la administración de RotaTeq a niños inmunocomprometidos, niños infectados por VIH o niños que han recibido una transfusión de sangre o inmunoglobulinas durante los 42 días anteriores a la administración de la dosis. No se espera que una infección asintomática por VIH afecte a la seguridad o eficacia de RotaTeq. Sin embargo, en ausencia de datos suficientes, no se recomienda la administración de RotaTeq a niños con VIH asintomáticos.
En la etapa de post comercialización se han notificado casos de gastroenteritis asociada con el virus de la vacuna en niños con inmunodeficiencia combinada severa (SCID, ver sección 4.3).
En los ensayos clínicos, RotaTeq se excretó en las heces del 8,9% de los vacunados casi exclusivamente en la semana posterior a la dosis 1 y en sólo un vacunado (0,3%) después de la dosis 3. El máximo de excreción se produjo en los 7 días posteriores a la administración de la dosis. Se ha observado post-comercialización la transmisión de cepas del virus de la vacuna a contactos no vacunados. RotaTeq debe ser administrado con precaución a individuos en contacto estrecho con inmunodeprimidos (por ejemplo, individuos con cáncer o inmunocomprometidos por otra causa o individuos que están recibiendo terapia inmunosupresora). Además, aquéllos que estén al cuidado de recién vacunados deben guardar una higiene cuidadosa, especialmente cuando manipulen heces.
En un ensayo clínico, RotaTeq se administró a aproximadamente 1.000 niños que habían nacido a una edad gestacional de 25 a 36 semanas. La primera dosis fue administrada a partir de las 6 semanas después del nacimiento. La seguridad y la eficacia de RotaTeq en este subconjunto de niños fueron equiparables a las de los niños nacidos a término. No obstante, 19 de los aproximadamente 1.000 niños habían nacido a una edad gestacional de 25 a 28 semanas, 55 habían nacido a una edad gestacional de 29 a 31 semanas y el resto había nacido a una edad gestacional de entre 32 y 36 semanas. Ver secciones 4.2 y 5.1.
Invaginación intestinal
Como precaución, los profesionales sanitarios deberían realizar un seguimiento de cualquier síntoma indicativo de invaginación intestinal (dolor abdominal grave, vómitos persistentes, sangre en heces, hinchazón abdominal y/o fiebre elevada) ya que los datos procedentes de estudios observacionales indican un aumento en el riesgo de invaginación intestinal, principalmente dentro de los 7 días tras la vacunación con rotavirus (ver sección 4.8) . Se debe aconsejar a los padres o tutores que informen rápidamente a su profesional sanitario en caso de presentar dichos síntomas.
Para sujetos con predisposición a la invaginación intestinal, ver sección 4.3.
No se dispone de datos de seguridad o eficacia para niños con enfermedades gastrointestinales activas (incluyendo diarrea crónica) o retraso en el crecimiento. La administración de RotaTeq puede considerarse con precaución en estos niños cuando, en opinión del médico, no administrar la vacuna implique un riesgo mayor.
El nivel de protección proporcionado por RotaTeq está basado en el cumplimiento de las 3 dosis. Como con cualquier vacuna, la vacunación con RotaTeq no siempre asegura la protección completa de todos los vacunados. RotaTeq no protege frente a las gastroenteritis debidas a otros patógenos diferentes de rotavirus.
Se llevaron a cabo ensayos clínicos de eficacia frente a gastroenteritis por rotavirus en Europa, Estados Unidos, Latinoamérica y Asia. Durante estos ensayos, el genotipo circulante más frecuente fue G1P[8], mientras que los genotipos G2P[4], G3P[8], G4P[8] y G9P[8] fueron identificados con menor frecuencia. No se conoce el alcance de la protección que RotaTeq podría proporcionar frente a otros tipos y en otras poblaciones.
No se dispone de datos clínicos sobre el uso de RotaTeq para la profilaxis post-exposición.
RotaTeq contiene sacarosa. Los pacientes con problemas hereditarios poco frecuentes de intolerancia a la fructosa, problemas de malabsorción de glucosa/galactosa o deficiencia de sacarasa-isomaltasa no deben tomar esta vacuna. Ver sección 2.
Cuando se administre la serie de inmunización primaria en niños prematuros de < 28 semanas de gestación y especialmente en aquéllos con un historial previo de inmadurez respiratoria, se debe considerar tanto el riesgo potencial de apnea como la necesidad de monitorización respiratoria durante 48-72 horas. Como el beneficio de la vacunación es alto en este grupo de niños, la vacunación no se debe impedir ni retrasar.
RotaTeq NO DEBE SER INYECTADO BAJO NINGUNA CIRCUNSTANCIA.
4.5 Interacción con otros medicamentos y otras formas de interacción
La co-administración de RotaTeq con otras vacunas conteniendo 1 ó más de los siguientes antígenos aproximadamente a los 2, 4 y 6 meses de edad demostró que las respuestas inmunes y los perfiles de seguridad de las vacunas administradas no se vieron afectadas:
- vacuna frente a difteria-tétanos-pertussis acelular (DTPa)
- vacuna frente a Haemophilus influenzae tipo b (Hib)
- vacuna frente a la poliomielitis inactivada u oral (VPI)
- vacuna frente a la hepatitis B (VHB)
- vacuna antineumocócica conjugada (PnC)
La co-administración de RotaTeq con la vacuna frente a DTPa-VPI-VHB-Hib (Infanrix Hexa) a los 2, 3 y 4 meses de edad aproximadamente demostró que las respuestas inmunes y los perfiles de seguridad de las vacunas co-administradas no se vieron afectados en comparación con la administración por separado.
La co-administración de RotaTeq con una vacuna del meningococo grupo C conjugada (MenCC, conjugada con toxoide tetánico) a los 3 y 5 meses de edad (en la mayoría de los casos al mismo tiempo que la vacuna DTPa-VPI-Hib), seguida de una tercera dosis de RotaTeq a los 6 meses de edad aproximadamente, demostró que la respuesta inmune de RotaTeq y MenCC no se ve afectada. La coadministración demostró un perfil de seguridad aceptable.
La administración concomitante de RotaTeq con la vacuna oral frente a la poliomielitis (VPO) no afecta a la respuesta inmune a los antígenos del poliovirus. Aunque la administración concomitante de VPO disminuyó ligeramente la respuesta inmune a la vacuna frente a rotavirus, actualmente no existe evidencia de que la protección clínica frente a la gastroenteritis grave por rotavirus se vea afectada. La respuesta inmune a RotaTeq no se vio afectada cuando la VPO se administró dos semanas después de RotaTeq.
Por lo tanto, RotaTeq se puede administrar concomitantemente con vacunas pediátricas monovalentes ó combinadas conteniendo uno ó más de los siguientes antígenos: DTPa, Hib, VPI ó VPO, VHB, PnC y MenCC.
4.6 Fertilidad, embarazo y lactancia
RotaTeq está indicado sólo en niños. Por lo tanto, no se dispone de datos sobre su uso en humanos durante el embarazo o la lactancia y no se han realizado estudios de reproducción o fertilidad en animales.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No procede.
4.8 Reacciones adversas
a. Resumen del perfil de seguridad
En un subconjunto de niños incluidos en 3 ensayos clínicos controlados con placebo (n=6.130 recibieron RotaTeq y 5.560 recibieron placebo), se evaluaron todos los efectos adversos de RotaTeq en los 42 días posteriores a la vacunación con o sin uso concomitante de otras vacunas pediátricas. En términos generales, el 47% de los niños a los que se administró RotaTeq experimentó una reacción adversa comparado con el 45,8% de los niños a los que se administró placebo. Las reacciones adversas notificadas más comúnmente y que ocurrieron con mayor frecuencia con la vacuna que con el placebo fueron fiebre (20,9%), diarrea (17,6%) y vómitos (10,1%).
Se evaluaron las reacciones adversas graves en todos los participantes (36.150 recibieron RotaTeq y 35.536 recibieron placebo) de 3 ensayos clínicos hasta 42 días después de cada dosis. La frecuencia global de estas reacciones adversas graves fue del 0,1% entre los receptores de RotaTeq y del 0,2% entre los receptores de placebo.
b. Resumen tabulado de las reacciones adversas
Las reacciones adversas más frecuentes en el grupo que recibió la vacuna se enumeran más abajo clasificadas por órganos y sistemas y por su frecuencia. En base a los datos agrupados de 3 ensayos clínicos en los que 6.130 niños recibieron RotaTeq y 5.560 niños recibieron placebo, las reacciones adversas enumeradas ocurrieron con una incidencia entre un 0,2% y un 2,5% superior en los niños que recibieron RotaTeq que en los que recibieron placebo.
Las frecuencias se definen de la siguiente forma:
Muy frecuentes (>1/10); Frecuentes (>1/100, <1/10); Poco frecuentes (>1/1.000, <1/100); Raras (>1/10.000, <1/1.000), Muy raras (< 1/10.000), No conocida (no puede estimarse a partir de los datos disponibles).
Reacciones adversas después de la administración de RotaTeq en ensayos clínicos y reacciones _adversas notificadas post-comercialización (en cursiva)_
|
Organos |
Frecuencia |
Reacciones /Acontecimientos adversos |
|
Infecciones e infestaciones |
Frecuentes |
Infección del tracto respiratorio superior |
|
Poco frecuentes |
Nasofaringitis, otitis media | |
|
Trastornos del sistema inmunológico |
Frecuencia no conocida |
Reacción anafiláctica* |
|
Trastornos respiratorios, torácicos y mediastínicos |
Raros |
Broncoespasmo |
|
Trastornos gastrointestinales |
Muy frecuentes |
Diarrea, vómitos |
|
Poco frecuentes |
Hematoquecia', dolor abdominal superior | |
|
Muy raros |
Invaginación intestinal1 | |
|
Trastornos de la piel y del tejido subcutáneo |
Poco frecuentes |
Erupción |
|
Raros |
Urticaria' | |
|
Frecuencia no conocida |
Angioedema* | |
|
Trastornos generales y alteraciones en el lugar de administración |
Muy frecuentes |
Pirexia |
|
Frecuencia no conocida |
Irritabilidad* |
' Esta reacción adversa se identificó a través de la vigilancia post-comercialización. La
categorización de la frecuencia se estimó en base a los ensayos clínicos relevantes. a La categorización de la frecuencia se estimó en base a datos de estudios observacionales.
* Ver sección 4.4.
* Reacciones adversas post-comercialización (la frecuencia no puede estimarse a partir de los datos disponibles)
c. Descripción de reacciones adversas seleccionadas
Se notificaron 5 casos de la enfermedad de Kawasaki en los 36.150 receptores de la vacuna (< 0,1%) y 1 caso en los 35.536 receptores de placebo (< 0,1%), con un riesgo relativo (RR) de 4,9 [IC 95%: 0,6 -239,1] (no estadísticamente significativo).
No se ha observado ningún aumento en el riesgo de enfermedad de Kawasaki entre los niños que recibieron RotaTeq en un amplio estudio post-comercialización observacional de vigilancia de seguridad (ver sección 5.1).
Invaginación intestinal
Los datos procedentes de estudios de seguridad observacionales realizados en varios países indican que las vacunas de rotavirus conllevan un aumento en el riesgo de invaginación intestinal, con hasta 6 casos adicionales por 100.000 niños dentro de los 7 días tras la vacunación. Existe evidencia limitada de un menor incremento del riesgo tras la segunda dosis. La incidencia de base de invaginación intestinal en niños menores de 1 año de edad en estos países varía de 33 a 101 por 100.000 niños por año. Aún no está claro si las vacunas de rotavirus afectan a la incidencia global de invaginación intestinal en periodos más largos de seguimiento (ver sección 4.4).
d. Otras poblaciones especiales
Apnea en niños prematuros de < 28 semanas de gestación (ver sección 4.4).
Se ha notificado tras la comercialización gastroenteritis con eliminación de virus vacunal en niños con inmunodeficiencia combinada severa (SCID).
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Apéndice V.
4.9 Sobredosis
Existen informes relativos a la administración de dosis de RotaTeq mayores a las recomendadas.
En general, el perfil de los acontecimientos adversos notificados con sobredosis fue comparable al observado con las dosis recomendadas de RotaTeq.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Vacunas. Vacunas Virales Código ATC: J07BH02
Eficacia
Se ha demostrado en ensayos clínicos, la eficacia frente a las gastroenteritis por rotavirus de los genotipos G1P[8], G2P[4], G3P[8], G4P[8] y G9P[8].
La eficacia protectora de RotaTeq fue evaluada de dos formas en el Ensayo Clínico de Eficacia y Seguridad frente a Rotavirus (REST), controlado con placebo:
1. En 5.673 niños administrados (2.834 en el grupo de la vacuna) la eficacia protectora se midió como una reducción en la incidencia de gastroenteritis por rotavirus (RV) causada por los genotipos de la vacuna (G1-G4) que se encontraron al menos 14 días después de la tercera dosis de vacuna durante toda la primera temporada de rotavirus después de la vacunación.
2. En 68.038 niños administrados (34.035 en el grupo de la vacuna) la eficacia protectora se midió como una reducción en el índice de hospitalizaciones y visitas a los servicios de urgencias por gastroenteritis por RV desde los 14 días después de la tercera dosis.
Los resultados de estos análisis se presentan en la siguiente tabla.
|
Reducción en la incidencia de gastroenteritis por RV durante una temporada completa después de la vacunación (RotaTeq n=2.834) % [IC 95%] | ||||||
|
Eficacia por genotipo (cualquier gravedad) | ||||||
|
Enfermedad grave* (G1-G4) |
Cualquier gravedad (G1-G4) |
G1 |
G2 |
G3 |
G4 |
G9 |
|
98,0% [88,3-100,0]* |
74,0% [66,8-79,9]* |
74,9% [67,3-80,9]* |
63,4% [2,6-88,21* |
82,7% [<0-99,6] |
48,1% [<0-91,6] |
65,4% [<0-99,3] |
* Grave definido como una puntuación >16/24 utilizando un sistema de puntuación clínica validado basado en la gravedad y duración de los síntomas (fiebre, vómitos, diarrea y cambios de conducta)
* Estadísticamente significativo
|
Reducción en hospitalizaciones/visitas a los servicios de urge después de la vacuna (RotaTeq n=34.035) % [] |
ncias por gastroenteritis por RV hasta 2 años ción [C 95%] | ||||
|
G1-G4 |
G1 |
G2 |
G3 |
G4 |
G9 |
|
94,5% [91,2-96,6]* |
95,1% [91,6-97,1]* |
87,6% [<0-98,5] |
93,4% [49,4-99,1]* |
89,1% [52,0-97,5]* |
100% [69,6-100]* |
* Estadísticamente significativo
La reducción en la incidencia de gastroenteritis por RV causada por los genotipos G1-G4 durante la segunda temporada de rotavirus después de la vacunación fue del 88,0% [IC 95% 49,4-98,7] para enfermedad grave y del 62,6% [IC 95% 44,3-75,4] para enfermedad de cualquier gravedad.
La eficacia frente a los genotipos de rotavirus G2P[4], G3P[8], G4P[8] y G9P[8] se basó en menos casos que para G1. La eficacia observada frente a G2P[4] probablemente resultó del componente G2 de la vacuna.
En un análisis post-hoc combinado de REST y otro estudio en fase III, la eficacia de la vacuna frente a casos de GEA por RV (cualquier gravedad) por los serotipos G1, G2, G3 y G4 fue del 61,5% [IC 95%: 14,2; 84,2] en niños que tenían entre 26 y 32 semanas de edad cuando recibieron la tercera dosis.
Existe una extensión del estudio REST realizada sólo en Finlandia. Esta extensión finlandesa del estudio (Finnish Extension Study - FES) incluyó un subconjunto de 20.736 sujetos que habían participado previamente en el estudio REST. Durante el estudio se siguió a los niños hasta 3 años después de la vacunación.
En el estudio REST hubo 403 consultas médicas (20 en el grupo de vacunados y 383 en el grupo placebo) relacionadas con gastroenteritis por rotavirus G1-G4 y G9 en la población por protocolo. Los datos adicionales del estudio FES aumentaron el número total en 136 consultas médicas, 9 en el grupo de vacunados y 127 en el grupo placebo. Sobre el total, un 31% y un 25% de las consultas en los respectivos grupos (vacuna y control), ocurrieron durante el FES.
Teniendo en cuenta los datos combinados de los estudios REST y FES, la reducción en la tasa de hospitalizaciones y visitas a urgencias hasta 3 años post-vacunación para gastroenteritis por RV fue del 94,4% (IC 95%: 91,6-96,2) para los genotipos G1-G4, 95,5% (IC 95%: 92,8-97,2) para el genotipo G1, 81,9% (IC 95%: 16,1-98,0), para el genotipo G2, 89,0% (IC 95%: 53,3-98,7) para el genotipo G3, 83,4% (IC 95%: 51,2-95,8) para genotipo G4, y 94,2% (IC 95%: 62,2-99,9) para el genotipo G9. Durante el tercer año no hubo ninguna consulta médica debida a gastroenteritis por RV en el grupo de vacunados (n = 3.112) y una (no serotipada) en el grupo placebo (n = 3.126).
Se debe administrar una pauta de vacunación de 3 dosis de RotaTeq (ver sección 4.2) para proporcionar el nivel y la duración de la protección frente a gastroenteritis por rotavirus observados en los ensayos clínicos. No obstante, los análisis post hoc mostraron que RotaTeq reducía el número de casos de gastroenteritis por rotavirus de cierta gravedad -requiriendo hospitalización o consulta de urgencia- antes de haber completado las 3 dosis (es decir, aproximadamente 14 días tras la administración de la primera dosis).
Eficacia en niños prematuros
En el estudio REST, RotaTeq se administró a aproximadamente 1.000 niños que habían nacido a una edad gestacional de 25 a 36 semanas. La eficacia de RotaTeq en este subconjunto de niños fue equiparable a la de los niños nacidos a término.
Estudio post-comercialización observacional de vigilancia de la seguridad
En un amplio estudio post-comercialización, observacional prospectivo en Estados Unidos, se analizó el riesgo de enfermedad de Kawasaki en 85.150 niños que recibieron una o más dosis de RotaTeq (17.433 personas-años de seguimiento).
Durante el periodo de seguimiento de 0-30 días tras la vacunación, no hubo diferencia estadísticamente significativa en la tasa de enfermedad de Kawasaki en comparación con la tasas basal esperada. Además no hubo un incremento estadísticamente significativo en el riesgo de estos acontecimientos adversos durante el periodo de seguimiento de 0-30 días cuando se compararon con un grupo de control concurrente de niños que recibieron DTPa, pero no RotaTeq (n=62.617, 12.339 personas-años de seguimiento). Hubo un caso confirmado entre los niños vacunados con RotaTeq y un caso confirmado entre los controles DTPa (riesgo relativo = 0,7, IC 95%: 0,01-55,56). En los análisis generales de seguridad, no se identificó ningún riesgo de seguridad específico.
Datos de estudios de efectividad
Estudios posteriores a la comercialización que demuestran efectividad para prevenir la gastroenteritis por RV (RVGE)
|
Diseño del estudio (Región) |
Población del estudio |
Criterios de valoración |
Efectividad % [IC 95%] |
Temporadas de RV |
|
Análisis de bases de datos de solicitudes (EE.UU.) |
33.140 vacunados 26.167 no vacunados Edades >7 meses Recibieron 3 dosis |
Hospitalización y visitas a Servicio de Urgencias (SU) debidas a RVGE Pacientes ambulatorios debidos a RVGE Hospitalización y visitas al SU debido a gastroenteritis por cualquier causa |
100% [87,100] 96% [76,100] 59% [47,68] |
2007-2008 |
|
Estudio de cohorte (Francia) |
1.895 vacunados con 3 dosis 2.102 no vacunados Edades <2 años |
Hospitalización debida a RVGE |
98% [83,100] |
2007- 2008 2008- 2009 |
|
Estudio de casos y controles (EE.UU.) |
402 casos 2.559 controles* Edades <8 años Recibieron 3 dosis |
Hospitalización y visitas al SU debidas a RVGE Específica de cepa - G1P[8] - G2P[4] - G3P[8] - G12P[8] Específica de edad - 1er año de vida - 2° año de vida - 3 er año de vida - 4° año de vida - 5° año de vida - 6°-7° año de vida |
80% [74,84] 89% [55,97] 87% [65,95] 80% [64,89] 78% [71,84] 91% [78,96] 82% [69,89] 88% [78,93] 76% [51,88] 60% [16,81] 69% [43,84] |
2011-2012 2012-2013 |
* Controles de gastroenteritis aguda RV-negativos
Inmunogenicidad
No se comprende completamente el mecanismo inmunológico por el cual RotaTeq protege frente a la gastroenteritis por rotavirus. Actualmente no se ha identificado la correlación inmunológica de protección para las vacunas de rotavirus. En los ensayos de fase III, entre el 92,5% y el 100% de los receptores de RotaTeq alcanzaron un incremento significativo de la IgA sérica anti-rotavirus después de un régimen de tres dosis. La vacuna induce una respuesta inmune (por ejemplo, aparición de anticuerpos séricos neutralizantes) a las cinco proteínas humanas de rotavirus expresadas en los reasortantes (G1, G2, G3, G4 y P[8]).
5.2 Propiedades farmacocinéticas
No procede.
5.3 Datos preclínicos sobre seguridad
Un estudio de toxicidad oral de dosis única y repetida en ratones no sugiere que existan riesgos especiales para los seres humanos. La dosis administrada a los ratones fue aproximadamente de 2,79 x 108 unidades infecciosas por kg (unas 14 veces la dosis pediátrica prevista).
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Sacarosa Citrato de sodio
Dihidrógeno fosfato de sodio monohidrato Hidróxido de sodio Polisorbato 80
Medio de cultivo (que contiene sales inorgánicas, aminoácidos y vitaminas)
Agua purificada
6.2 Incompatibilidades
En ausencia de estudios de compatibilidad, esta vacuna no debe mezclarse con otros medicamentos.
6.3 Periodo de validez 2 años
RotaTeq debe administrarse inmediatamente después de ser extraído de la nevera.
6.4 Precauciones especiales de conservación
Conservar en nevera (entre 2°C y 8°C).
Conservar el tubo dosificador en el embalaje exterior para protegerlo de la luz.
6.5 Naturaleza y contenido del envase
2 ml de solución en un tubo precargado exprimible (LDPE) con un tapón de media rosca (HDPE) en una bolsa protectora, en un envase de 1o 10 tubos precargados exprimibles.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
La vacuna debe administrarse por vía oral sin mezclar con ninguna otra vacuna o solución. No diluir.
Para administrar la vacuna:

r
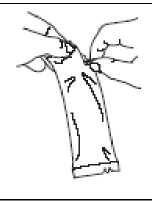
Rasgar la bolsa protectora y sacar el tubo dosificador.
Retire el líquido de la punta dispensadora sosteniendo el tubo verticalmente y dando golpecitos en el tapón de media rosca.
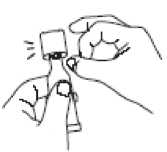
Abrir el tubo dosificador con 2 sencillos movimientos:
1. Perforar la punta dispensadora enroscando el tapón en el sentido de las agujas del reloj hasta que esté apretado.
2. Retirar el tapón girándolo en sentido contrario a las agujas del reloj.
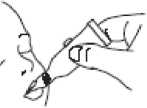
Administrar la dosis vertiendo cuidadosamente el líquido en el interior de la boca del niño hacia la parte interior de la mejilla hasta que el tubo dosificador esté vacío. (Una gota residual puede quedar en la punta del tubo.)
Desechar el tubo vacío y el tapón en contenedores para residuos biológicos aprobados de acuerdo con las exigencias locales.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Sanofi Pasteur MSD SNC, 162 avenue Jean Jaures, 69007 LYON, Francia
8. NÚMEROS DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/06/348/001
EU/1/06/348/002
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 27 de junio de 2006 Fecha de la última renovación: 27 de junio de 2011
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu
A. FABRICANTE(S) DEL (DE LOS) PRINCIPIO(S) ACTIVO(S) BIOLÓGICO(S) Y FABRICANTES(S) RESPONSABLE(S) DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
A. FABRICANTE(S) DEL(DE LOS) PRINCIPIO(S) ACTIVO(S) BIOLÓGICO(S) Y FABRICANTE(S) RESPONSABLE(S) DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección del (de los) fabricante(s) del (de los) principio(s) activo(s) biológico(s)
Nombre de la Compañía: Dirección:
País:
Teléfono:
Merck Sharp & Dohme Corp.
Sumneytown Pike - PO Box 4 - West Point - Pennsylvania 19486 Estados Unidos de América +1 215 652 5603
Nombre y dirección del (de los) fabricante(s) responsable(s) de la liberación de los lotes
Nombre de la Compañía: Dirección:
País:
Teléfono:
Telefax:
Merck Sharp and Dohme BV
Waarderweg 39, 2031 BN Haarlem, P.O. Box 581, 2003 PC Haarlem
Holanda
+31 23 5153153
+31 23 5148000
El prospecto impreso del medicamento debe especificar el nombre y dirección del fabricante responsable de la liberación del lote en cuestión.
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO Medicamento sujeto a prescripción médica.
• Liberación oficial de los lotes
De conformidad con el artículo 114 de la Directiva 2001/83/EC modificada, la liberación oficial de los lotes será realizada por un laboratorio estatal o uno designado a tal efecto.
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
Los requerimientos para la presentación de los informes periódicos de seguridad para este medicamento se establecen en la lista de fechas de referencia de la Unión (lista EURD) prevista en el artículo 107quater, apartado 7, de la Directiva 2001/83/CE y publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado en la versión del PGR incluido en el Módulo 1.8.2. de la Autorización de Comercialización y en cualquier actualización posterior del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos.
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o
como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
RotaTeq - Envase de 1 Tubo de dosis única (2 ml)
RotaTeq - Envase de 10 Tubos de dosis única (2 ml)_
1. NOMBRE DEL MEDICAMENTO
RotaTeq solución oral
Vacuna frente a rotavirus, virus vivos
2. PRINCIPIO(S) ACTIVO(S)
> 2,2 x 106 UI1
> 2,8 x 106 UI1
> 2,2 x 106 UI1
> 2,0 x 106 UI1
> 2,3 x 106 UI1
Una dosis (2 ml) contiene los tipos de rotavirus*:
G1
G2
G3
G4
P1A[8]
*
reasortantes de rotavirus humano-bovinos (virus vivos) producidos en células Vero.
1Unidades Infecciosas
3. LISTA DE EXCIPIENTES
Sacarosa
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
2 ml de solución oral en un tubo Envase de 1 tubo Envase de 10 tubos
5. FORMA Y VÍAS DE ADMINISTRACIÓN
SÓLO POR VÍA ORAL
Leer el prospecto antes de utilizar este medicamento
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños
7. OTRAS ADVERTENCIAS ESPECIALES, SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Conservar en nevera
Conservar el tubo dosificador en el embalaje exterior para protegerlo de la luz
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
Leer el prospecto para deshacerse de los medicamentos que no necesita
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Sanofi Pasteur MSD SNC, 162 avenue Jean Jaurés, 69007 Lyon, Francia
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/06/348/001 envase de 1 tubo EU/1/06/348/002 envase de 10 tubos
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
MEDICAMENTO SUJETO A PRESCRIPCIÓN MÉDICA
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Se acepta la justificación para no incluir la información en Braille
Texto para la bolsa protectora_
1. NOMBRE DEL MEDICAMENTO
RotaTeq solución oral
Vacuna frente a rotavirus, virus vivos
2. NOMBRE DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Sanofi Pasteur MSD, SNC
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE
Lot
5. OTROS
1 dosis
INFORMACIÓN MÍNIMA QUE DEBE INCLUIRSE EN PEQUEÑOS ACONDICIONAMIENTOS PRIMARIOS
Etiqueta del tubo_
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
RotaTeq Solución oral Vía oral
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE
Lot
5. CONTENIDO EN PESO, VOLUMEN O EN UNIDADES
1 dosis (2 ml)
6. OTROS
SANOFI PASTEUR MSD, SNC
B. PROSPECTO
Prospecto: información para el usuario
RotaTeq solución oral
Vacuna frente a rotavirus, virus vivos
Lea todo el prospecto detenidamente antes de que su hijo sea vacunado porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Si su hijo experimenta efectos adversos consulte a su médico o farmacéutico incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto:
1. Qué es RotaTeq y para qué se utiliza
2. Qué necesita saber antes de que su hijo empiece a usar RotaTeq
3. Cómo usar RotaT eq
4. Posibles efectos adversos
5. Conservación de RotaTeq
6. Contenido del envase e información adicional
1. Qué es RotaTeq y para qué se utiliza
RotaTeq es una vacuna oral que ayuda a proteger a los lactantes y niños pequeños frente a la gastroenteritis (diarrea y vómitos) causada por la infección por rotavirus y puede administrarse a niños desde las 6 semanas hasta las 32 semanas (ver sección 3). La vacuna contiene cinco tipos de cepas de rotavirus vivos. Cuando la vacuna se administra a un niño, el sistema inmune (las defensas naturales del organismo) creará anticuerpos frente a los tipos de rotavirus que aparecen más frecuentemente. Estos anticuerpos ayudan a proteger frente a la gastroenteritis causada por estos tipos de rotavirus.
2. Qué necesita saber antes de que su hijo empiece a usar RotaTeq
No use RotaTeq si:
- su hijo es alérgico a cualquiera de los componentes de esta vacuna (ver sección 6. Contenido del envase e información adicional).
- su hijo desarrolló una reacción alérgica después de recibir una dosis de RotaTeq u otra vacuna frente a rotavirus.
- su hijo ha tenido previamente invaginación intestinal (una obstrucción intestinal en la que un segmento de intestino se introduce dentro de otro segmento).
- su hijo nació con una malformación del sistema gastrointestinal que podría predisponer a la invaginación intestinal.
- su hijo tiene cualquier enfermedad que reduzca su resistencia a la infección.
- su hijo tiene una infección grave con fiebre alta. Podría ser necesario posponer la vacunación hasta su recuperación. Una infección leve tal como un catarro no debería ser un problema, pero consulte primero con su médico.
- su hijo tiene diarrea o está vomitando. Podría ser necesario posponer la vacunación hasta su recuperación.
Advertencias y precauciones
Consulte a su médico o farmacéutico si su hijo:
- ha recibido una transfusión de sangre o inmunoglobulinas en las últimas 6 semanas.
- tiene contacto estrecho con alguna persona, tal como un miembro de la familia, que tiene un sistema inmune debilitado, por ejemplo, una persona con cáncer o que está tomando medicamentos que puedan debilitar el sistema inmune.
- tiene cualquier trastorno del sistema gastrointestinal.
- no ha estado aumentando de peso y creciendo como se esperaba.
Como siempre, tenga cuidado de lavarse las manos meticulosamente después de cambiar pañales usados.
Como sucede con otras vacunas, RotaTeq no siempre asegura una protección completa a todos los niños vacunados, incluso después de haber sido administradas las tres dosis.
Si su hijo ya ha sido infectado por rotavirus, pero cuando se le vacunó todavía no estaba enfermo, RotaTeq puede no prevenir la enfermedad.
RotaTeq no protege frente a la diarrea y los vómitos debidos a causas diferentes de rotavirus.
Uso de RotaTeq con otros medicamentos:
RotaTeq puede administrarse al mismo tiempo que su hijo recibe otras vacunaciones normalmente recomendadas, tales como las vacunas frente a difteria, tétanos, pertussis (tos ferina), Haemophilus influenzae tipo b, poliomielitis inactivada u oral, hepatitis B, vacuna antineumocócica conjugada y vacuna frente a meningococo del grupo C conjugada.
Informe a su médico o farmacéutico si su hijo está utilizando, ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento (u otras vacunas).
Uso de RotaTeq con los alimentos y bebidas
No hay restricciones en el consumo de comida o bebida, incluyendo leche materna, ni antes ni después de la vacunación con RotaTeq.
RotaTeq contiene sacarosa
Si le han dicho que su hijo tiene intolerancia a algunos azúcares, informe a su médico o profesional sanitario antes de la administración de la vacuna.
3. Cómo usar RotaTeq
RotaTeq se administra SÓLO POR VÍA ORAL.
Un médico o enfermera administrará las dosis recomendadas de RotaTeq a su hijo. La vacuna se administrará apretando cuidadosamente el tubo y administrando la vacuna dentro de la boca de su hijo. La vacuna puede administrarse independientemente de la comida, la bebida o la leche materna. En el caso de que su hijo escupa o regurgite la mayor parte de la dosis de la vacuna, puede administrarse una única dosis de reemplazo en la misma visita.
Esta vacuna no debe inyectarse bajo ninguna circunstancia.
La primera dosis (2 ml) de RotaTeq puede administrarse a partir de las 6 semanas de edad y debe administrarse antes de las 12 semanas de edad (unos 3 meses). RotaTeq puede administrarse a niños prematuros siempre que el embarazo haya durado al menos 25 semanas. Estos niños deben recibir la primera dosis de la vacuna entre las 6 y 12 semanas después del nacimiento.
Su hijo recibirá 3 dosis de RotaTeq administradas con al menos cuatro semanas de intervalo entre una y otra. Es importante que su hijo reciba las 3 dosis de la vacuna para estar protegido frente a rotavirus. Es preferible que las tres dosis sean administradas antes de las 20-22 semanas de edad y como muy tarde las tres dosis deben ser administradas antes de las 32 semanas de edad.
Cuando se administre RotaTeq a su hijo para la primera dosis, se recomienda continuar con RotaTeq (y no con otra vacuna frente a rotavirus) para completar el régimen de vacunación.
Si olvidó una toma de RotaTeq:
Es importante que siga las instrucciones de su médico/profesional sanitario en cuanto a las visitas posteriores de su hijo para las dosis siguientes. Si olvida o no puede acudir a su cita en la fecha prevista, consulte a su medico/profesional sanitario.
4. Posibles efectos adversos
Al igual que todas las vacunas, esta vacuna puede producir efectos adversos, aunque no todas las personas los sufran.
Los siguientes efectos adversos fueron comunicados en ensayos clínicos en los que se utilizó RotaTeq o durante su comercialización:
|
Muy frecuentes (puede afectar a más de 1 de cada 10 niños) |
fiebre, diarrea y vómitos. |
|
Frecuentes (puede afectar hasta 1 de cada 10 niños) |
infecciones del aparato respiratorio superior. |
|
Poco frecuentes (puede afectar hasta 1 de cada 100 niños) |
dolores de estómago, moqueo y dolor de garganta, infección de oídos, erupción, presencia de sangre en las heces*. |
|
Raros (puede afectar hasta 1 de cada 1.000 niños) |
broncoespasmo (silbidos o tos), urticaria* |
|
Muy raros (puede afectar hasta 1 de cada 10.000 niños) |
Invaginación intestinal (una obstrucción intestinal en la que un segmento de intestino se pliega dentro de otro segmento)*, f. |
|
No conocida (la frecuencia no puede estimarse a partir de los datos disponibles) |
reacciones alérgicas que pueden ser graves (anafilaxis)*, inflamación alérgica que puede afectar a cara, labios, lengua o garganta*, irritabilidad*. |
* Este es un efecto adverso notificado durante la comercialización
f Los síntomas de invaginación puede ser dolor de estómago grave, vómitos persistentes, presencia de sangre en las heces, abdomen inflamado y/o fiebre elevada.
En niños nacidos muy prematuramente (a las 28 semanas de gestación o antes) se pueden producir intervalos entre respiraciones más largos de lo normal durante los 2 ó 3 días siguientes a la vacunación.
Si desea más información sobre los efectos adversos de RotaTeq, consulte a su médico o farmacéutico.
Comunicación de efectos adversos
Si su hijo experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V.
Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de RotaTeq
Mantener esta vacuna fuera de la vista y del alcance de los niños.
No utilice esta vacuna después de la fecha de caducidad que aparece en la etiqueta después de EXP (CAD). La fecha de caducidad es el último día del mes que se indica.
Conservar en nevera (entre 2°C y 8°C). Conservar el tubo dosificador en el embalaje exterior para protegerlo de la luz.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que no necesita. De esta forma ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de RotaTeq
Los principios activos de RotaTeq son 5 cepas reasortantes de rotavirus humano-bovinos:
G1 2,2 x 106 Unidades Infecciosas
G2 2,8 x 106 Unidades Infecciosas
G3 2,2 x 106 Unidades Infecciosas
G4 2,0 x 106 Unidades Infecciosas
P1A[8] 2,3 x 106 Unidades Infecciosas
Los demás componentes de RotaTeq son: sacarosa, citrato de sodio, dihidrógeno fosfato de sodio monohidrato, hidróxido de sodio, polisorbato 80, medio de cultivo (que contiene sales inorgánicas, aminoácidos y vitaminas) y agua purificada.
Aspecto del producto y contenido del envase
Solución oral
Esta vacuna está contenida en un tubo de dosis única y es un líquido transparente amarillo pálido que puede tener un tono rosado.
RotaTeq está disponible en envases de 1 y 10 tubos dosificados. Puede que no se comercialicen todos los tamaños de envases.
Titular de la autorización de comercialización y responsable de la fabricación
Titular de la autorización de comercialización: Sanofi Pasteur MSD SNC, 162 avenue Jean Jaures, 69007 Lyon, Francia
Responsable de la fabricación: Merck Sharp and Dohme, B.V., Waarderweg, 39, 2031 BN, Haarlem, Holanda
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización.
Belgie/Belgique/Belgien
Sanofi Pasteur MSD, Tél/Tel: +32.2.726.95.84
Bt^rapna
MepK fflapn u floyM Etarapua EOOfl Ten.: + 359 2 819 3737 Ceská republika
Merck Sharp & Dohme s.r.o., Tel.: +420 233 010 111
Danmark
Sanofi Pasteur MSD, Tlf: +45 23 32 69 29 Deutschland
Sanofi Pasteur MSD GmbH, Tel: +49 30 4991980
Eesti
Merck Sharp & Dohme OÜ, Tel: +372.6144 200 EXláóa
BIANEH A.E., T^: +30.210.8009111 España
Sanofi Pasteur MSD S.A., Tel: +34.91.371.78.00 France
Sanofi Pasteur MSD SNC, Tél: +33.4.37.28.40.00 Hrvatska
Merck Sharp & Dohme d.o.o.
Tel: + 385 1 6611 333 Ireland
Sanofi Pasteur MSD Ltd, Tel: +3531.468.5600 Ísland
Sanofi Pasteur MSD, Sími: +32.2.726.95.84 Italia
Sanofi Pasteur MSD Spa, Tel: +39.06.664.092.11 Kúrcpog
Merck Sharp & Dohme Cyprus Limited TpA.: 800 00 673 (+357 22866700)
Latvija
SIA Merck Sharp & Dohme Latvija Tel: +371.67364.224
Fecha de la última revisión de este prospecto:
Lietuva
UAB Merck Sharp & Dohme, Tel.:
+370.5.2780.247
Luxembourg/Luxemburg
Sanofi Pasteur MSD, Tél: +32.2.726.95.84
Magyarország
MSD Pharma Hungary Kft., Tel.: +
36.1.888.5300
Malta
Merck Sharp & Dohme Cyprus Limited., Tel: 8007 4433 (+356 99917558)
Nederland
Sanofi Pasteur MSD, Tel: +31.23.567.96.00 Norge
Sanofi Pasteur MSD, Tlf: +47.67.50.50.20 Osterreich
Sanofi Pasteur MSD GmbH, Tel:
+43 1 890 34 91 14 Polska
MSD Polska Sp. z o.o., Tel.: +48.22.549.51.00 Portugal
Sanofi Pasteur MSD, SA, Tel: +351.21.470.45.50 Romania
Merck Sharp & Dohme Romania S.R.L. Tel: +
4021 529 29 00
Slovenija
Merck Sharp & Dohme, inovativna zdravila d.o.o., Tel: +386.1.520.4201 Slovenská republika
Merck Sharp & Dohme, s. r. o., Tel: +421 2
58282010
Suomi/Finland
Sanofi Pasteur MSD, Puh/Tel: +358.9.565.88.30 Sverige
Sanofi Pasteur MSD, Tel: +46.8.564.888.60 United Kingdom
Sanofi Pasteur MSD Ltd, Tel: +44.1.628.785.291
Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu
Esta información está destinada únicamente a profesionales del sector sanitario: Instrucciones
Para administrar la vacuna:
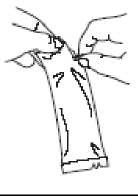
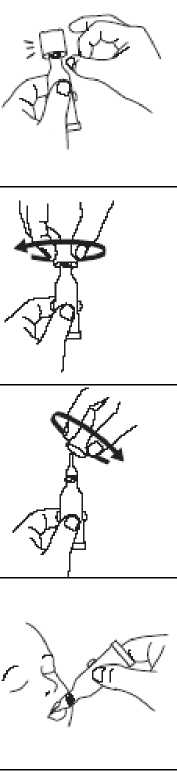
Rasgar la bolsa protectora y sacar el tubo dosificador.
Retire el líquido de la punta dispensadora sosteniendo el tubo verticalmente y dando golpecitos en el tapón de media rosca.
Abrir el tubo dosificador con 2 sencillos movimientos:
1. Perforar la punta dispensadora enroscando el tapón en el sentido de las agujas del reloj hasta que esté apretado.
2. Retirar el tapón girándolo en sentido contrario a las agujas del reloj.
Administrar la dosis vertiendo cuidadosamente el líquido en el interior de la boca del niño hacia la parte interior de la mejilla hasta que el tubo dosificador esté vacío. (Una gota residual puede quedar en la punta del tubo.)
Desechar el tubo vacío y el tapón en contenedores para residuos biológicos aprobados de acuerdo con las exigencias locales.
El medicamento no utilizado y todos los materiales que hayan estado en contacto con él se eliminarán de acuerdo con la normativa local.
Ver también sección 3. Cómo usar RotaTeq.
30