Risperdal Consta 25 Mg Polvo Y Disolvente Para Suspension De Liberacion Prolongada Para Inyeccion Intramuscular
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
RISPERDAL CONSTA 25 mg polvo y disolvente para suspensión de liberación prolongada para inyección intramuscular
RISPERDAL CONSTA 37,5 mg polvo y disolvente para suspensión de liberación prolongada para inyección intramuscular
RISPERDAL CONSTA 50 mg polvo y disolvente para suspensión de liberación prolongada para inyección intramuscular
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
1 vial contiene 25 mg de risperidona.
1 vial contiene 37,5 mg de risperidona.
1 vial contiene 50 mg de risperidona.
1 ml de suspensión reconstituída contiene 12,5 mg de risperidona.
1 ml de suspensión reconstituída contiene 18,75 mg de risperidona.
1 ml de suspensión reconstituída contiene 25 mg de risperidona.
Excipientes con efecto conocido
1 ml de suspensión reconstituída contiene 3 mg de sodio.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Polvo y disolvente para suspensión de liberación prolongada para inyección.
Vial con polvo.
Polvo suelto de color blanco a blanquecino.
Jeringa precargada con el disolvente para la reconstitución.
Solución acuosa, transparente e incolora.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
RISPERDAL CONSTA está indicado para el tratamiento de mantenimiento de la esquizofrenia en pacientes actualmente estabilizados con antipsicóticos orales.
MINISTERIODE SANIDAD, POLITICA SOCIAL E IGUALDAD Agencia esparto» de medicamentos y pfoouctos saltaros
4.2 Posología y forma de administración
Posología
Adultos Dosis de inicio:
Para la mayoría de los pacientes, la dosis recomendada es 25 mg cada dos semanas por vía intramuscular. Se debe considerar el esquema de conversión siguiente, para aquellos pacientes que ya recibían una dosis fija de risperidona oral durante dos o más semanas. Los pacientes tratados con dosis de 4 mg o menores de risperidona oral deben recibir 25 mg de RISPERDAL CONSTA, mientras que, para los pacientes tratados con dosis orales superiores se debe valorar la dosis superior de RISPERDAL CONSTA 37,5 mg.
En el caso de pacientes que no toman risperidona oral en la actualidad, se debe considerar el pretratamiento oral cuando se elija la dosis de inicio i.m. La dosis de inicio recomendada es RISPERDAL CONSTA 25 mg cada dos semanas. En los pacientes tratados con dosis orales superiores, se debe valorar la dosis superior de RISPERDAL CONSTA 37,5 mg.
Tras la primera inyección de RISPERDAL CONSTA se debe garantizar una cobertura antipsicótica suficiente con risperidona oral o el antipsicótico utilizado previamente durante las tres primeras semanas (ver sección 5.2).
RISPERDAL CONSTA no se debe utilizar en las exacerbaciones agudas de esquizofrenia sin asegurar una cobertura antipsicótica suficiente con risperidona oral o el antipsicótico anterior durante las tres semanas tras la primera inyección de RISPERDAL CONSTA.
Dosis de mantenimiento:
Para la mayoría de los pacientes la dosis recomendada es 25 mg cada dos semanas por vía intramuscular. Algunos pacientes se pueden beneficiar de dosis superiores de 37,5 mg o 50 mg. Durante el ajuste, el incremento de dosis no se debe hacer con una frecuencia inferior a 4 semanas. El efecto de este ajuste de dosis no se debería evaluar antes de que trascurran 3 semanas después de la primera inyección con la nueva dosis más alta. En ensayos clínicos, no se observó beneficio adicional a dosis de 75 mg. No se recomiendan dosis superiores de 50 mg cada 2 semanas.
Población de edad avanzada
No se requiere ajuste de la dosis. La dosis recomendada es 25 mg por vía intramuscular cada dos semanas. En el caso de pacientes que no toman actualmente risperidona oral, la dosis recomendada es 25 mg de RISPERDAL CONSTA cada dos semanas. Para aquellos pacientes con una dosis fija de risperidona oral durante dos o más semanas previas, se debe considerar el esquema de conversión siguiente. Los pacientes tratados con una dosis de risperidona oral de 4 mg o menor, deben recibir 25 mg de RISPERDAL CONSTA, mientras que los pacientes tratados previamente con dosis orales superiores se debe valorar la dosis superior de RISPERDAL CONSTA 37,5 mg.
Se debe asegurar una cobertura antipsicótica suficiente durante las tres primeras semanas tras la primera inyección de RISPERDAL CONSTA (ver sección 5.2). Los datos clínicos de RISPERDAL CONSTA en pacientes de edad avanzada son limitados. RISPERDAL CONSTA se debe utilizar con precaución en pacientes con edad avanzada.
Insuficiencia hepática y renal
RISPERDAL CONSTA no se ha estudiado en pacientes con insuficiencia hepática y renal.
Si los pacientes con insuficiencia hepática o renal requieren tratamiento con RISPERDAL CONSTA, se recomienda una dosis de inicio de 0,5 mg de risperidona oral dos veces al día durante la primera semana. La segunda semana se puede dar 1 mg dos veces al día o 2 mg una vez al día. Si una dosis oral diaria total de al menos 2 mg es bien tolerada, se puede administrar una inyección de RISPERDAL CONSTA 25 mg cada 2 semanas.
MINISTERIODE SANIDAD, POLITICA SOCIAL E IGUALDAD Agencia esparto» de medicamentos y pfoouctos saltaros
Se debe asegurar una cobertura antipsicótica suficiente durante las tres primeras semanas tras la primera inyección de RISPERDAL CONSTA (ver sección 5.2).
Población pediátrica
No se ha establecido la seguridad y eficacia de RISPERDAL CONSTA en niños menores de 18 años. No se dispone de datos.
Forma de administración
RISPERDAL CONSTA se debe administrar cada dos semanas mediante inyección intramuscular profunda en el deltoides o en el glúteo utilizando la aguja de seguridad adecuada. Para la administración en el deltoides, utilizar la aguja de 1 pulgada alternando las inyecciones entre los dos brazos. Para la administración en el glúteo, utilizar la aguja de 2 pulgadas alternando las inyecciones entre los dos glúteos. No se debe administrar por vía intravenosa (ver secciones 4.4 y 6.6).
Para consultar las instrucciones de reconstitución del medicamento antes de la administración, ver sección 6.6.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
En pacientes sin tratamiento previo con risperidona, se recomienda establecer la tolerabilidad con risperidona oral antes de iniciar el tratamiento con RISPERDAL CONSTA (ver sección 4.2).
Pacientes de edad avanzada con demencia
No se ha estudiado RISPERDAL CONSTA en pacientes de edad avanzada con demencia, por consiguiente, no está indicado su uso en este grupo de pacientes. RISPERDAL CONSTA no está autorizado para el tratamiento de los trastornos de conducta relacionados con la demencia.
Aumento de la mortalidad en pacientes de edad avanzada con demencia
En un meta-análisis de 17 ensayos controlados con antipsicóticos atípicos, incluyendo RISPERDAL oral, los pacientes de edad avanzada con demencia tratados con antipsicóticos atípicos presentaron un aumento de la mortalidad comparado con los pacientes que recibieron placebo. En los ensayos de RISPERDAL oral controlados con placebo en esta población, la incidencia de mortalidad fue del 4,0% en los pacientes tratados con RISPERDAL frente al 3,1% en los tratados con placebo. La razón de posibilidades (intervalo de confianza exacto de 95%) fue de 1,21 (0,7; 2,1). La media de edad de los pacientes fallecidos fue de 86 años (intervalo 67-100). Los datos de dos grandes estudios observacionales mostraron que los pacientes de edad avanzada con demencia que son tratados con antipsicóticos convencionales presentan también un pequeño aumento del riesgo de muerte en comparación con los no tratados. No hay datos suficientes para dar una estimación firme de la magnitud del riesgo y la causa del aumento del riesgo no se conoce. El alcance de los hallazgos sobre el aumento de la mortalidad en los estudios observacionales no está claro, podría atribuirse al antipsicótico en contraposición a ciertas características de los pacientes.
Uso concomitante con furosemida
En los ensayos de RISPERDAL oral controlados con placebo, en pacientes de edad avanzada con demencia, el tratamiento con furosemida más risperidona se asoció con una mayor incidencia de mortalidad (7,3%; edad media 89 años, rango 75-97) comparado con el tratamiento sólo con risperidona (3,1%; edad media 84 años, rango 70-96) o sólo con furosemida (4,1%; edad media 80 años, rango 67-90). El aumento de la mortalidad en pacientes tratados con furosemida y risperidona se observó en dos de los cuatro ensayos clínicos. El uso concomitante de risperidona con otros diuréticos (principalmente diuréticos del tipo de las tiacidas utilizados a dosis bajas) no se asoció con hallazgos similares.
MINISTERIODE SANIDAD, POLITICA SOCIAL E IGUALDAD Agencia esparto» de medicamentos y pfoouctos saltaros
No se ha encontrado ningún mecanismo fisiopatológico que explique este hallazgo, ni se ha observado una causa uniforme de las muertes. No obstante, hay que tener precaución y considerar los riesgos y beneficios de estacombinación o el co-tratamiento con otros diuréticos potentes antes de decidir su uso. En pacientes tratados con otros diuréticos a la vez que con risperidona no se ha observado aumento de la incidencia de mortalidad. Independientemente del tratamiento, la deshidratación fue un factor de riesgo general de mortalidad y, por lo tanto, se debe tener precaución y evitarse en pacientes de edad avanzada con demencia.
Accidentes cerebrovasculares (ACV)
En los ensayos clínicos aleatorizados controlados con placebo realizados con pacientes con demencia tratados con algunos antipsicóticos atípicos, se ha observado que aumenta aproximadamente 3 veces el riesgo de acontecimientos adversos cerebrovasculares. Los datos agrupados de seis estudios con RISPERDAL, controlados con placebo realizados principalmente en pacientes de edad avanzada (>65 años de edad) con demencia demostraron que se produjeron ACVs (graves y no graves, combinados) en el 3,3 % (33/1009) de los pacientes tratados con risperidona y en el 1,2 % (8/712) de los que recibieron placebo. La razón de probabilidades (intervalo de confianza exacto del 95 %) fue de 2,96 (1,34; 7,50). Se desconoce el mecanismo de este aumento del riesgo. No se puede excluir un aumento del riesgo para otros antipsicóticos u otras poblaciones de pacientes.
RISPERDAL CONSTA debe utilizarse con precaución en pacientes con riesgo de ataque cerebral. Hipotensión ortostática
Debido a la actividad alfa-bloqueante de risperidona, se puede producir hipotensión (ortostática) especialmente durante el período de inicio del tratamiento. Tras la comercialización, se ha observado hipotensión clínicamente relevante con el uso concomitante de risperidona y tratamientos antihipertensivos. Risperidona se debe utilizar con cuidado en pacientes con enfermedad cardiovascular conocida (p. ej., insuficiencia cardiaca, infarto de miocardio, alteraciones en la conducción, deshidratación, hipovolemia o enfermedad cerebrovascular). Debería evaluarse el riesgo/beneficio del tratamiento con RISPERDAL CONSTA, si la hipotensión ortostática clínicamente relevante persiste.
Leucopenia, neutropenia y agranulocitosis
Se han notificado casos de leucopenia, neutropenia y agranulocitosis con antipsicóticos, incluido RISPERDAL CONSTA. La agranulocitosis ha sido notificada en muy raras ocasiones (<1/10.000 pacientes) durante la experiencia post-comercialización.
Pacientes con un historial de un bajo recuento de glóbulos blancos clínicamente significativo (GB) o una leucopenia/neutropenia inducida por el medicamento deben ser monitorizados durante los primeros meses de tratamiento y se considerará interrumpir el tratamiento con RISPERDAL CONSTA si aparecen los primeros signos de disminución clínicamente significativa de GB, en ausencia de otros factores causales. Pacientes con neutropenia clínicamente significativa deben ser cuidadosamente monitorizados por la fiebre u otros síntomas o signos de infección y se deben tratar inmediatamente en caso de aparecer estos síntomas o signos. En pacientes con neutropenia grave (recuento total de neutrofilos <1x109/ l) se debe interrumpir el tratamiento con RISPERDAL CONSTA y controlar los niveles de GB hasta la recuperación.
Discinesia tardía/síntomas extrapiramidales (DT/SEP)
Los medicamentos con propiedades antagonistas de los receptores de la dopamina se han relacionado con la inducción de discinesia tardía, que se caracteriza por movimientos rítmicos involuntarios, predominantemente de la lengua y/o de la cara. El inicio de los síntomas extrapiramidales es un factor de riesgo de discinesia tardía. Si aparecen signos y síntomas de discinesia tardía, deberá considerarse suspender el tratamiento con todos los medicamentos antipsicóticos.
Síndrome neuroléptico maligno (SNM)
Con el uso de antipsicóticos se ha notificado síndrome neuroléptico maligno, caracterizado por hipertermia, rigidez muscular, inestabilidad autonómica, alteración de la conciencia y niveles de creatina fosfoquinasa
MINISTERIODE SANIDAD, POLITICA SOCIAL E IGUALDAD Agencia esparto» de medicamentos y pfoouctos saltaros
en suero elevados. Otros signos pueden ser mioglobinuria (rabdomiólisis) e insuficiencia renal aguda. Si esto sucede, se deben suspender todos los antipsicóticos, incluyendo RISPERDAL CONSTA.
Enfermedad de parkinson y demencia de los cuerpos de Lewy
El médico debe sopesar el riesgo-beneficio cuando prescriba antipsicóticos, incluido RISPERDAL CONSTA, a pacientes con Enfermedad de Parkinson o Demencia de los cuerpos de Lewy (DCL). La enfermedad de Parkinson puede empeorar con risperidona. Ambos grupos pueden aumentar el riesgo de Síndrome Neuroléptico Maligno, así como un aumento de la sensibilidad a medicamentos antipsicóticos; estos pacientes fueron excluidos de los ensayos clínicos. La manifestación de este aumento de sensibilidad puede incluir confusión, obnubilación, inestabilidad postural con caídas frecuentes, además de síntomas extrapiramidales.
Reacciones de hipersensibilidad
Aunque la tolerabilidad con risperidona oral se debe establecer previamente al inicio del tratamiento con RISPERDAL CONSTA, raramente se han notificado reacciones anafilácticas durante la experiencia poscomercialización en pacientes que previamente toleraron risperidona oral (ver secciones 4.2 y 4.8).
Si tienen lugar reacciones de hipersensibilidad, discontinuar el uso de RISPERDAL CONSTA, iniciar medidas generales de soporte clínicamente apropiadas y monitorizar al paciente hasta que las señales y los síntomas se resuelvan (ver secciones 4.3 y 4.8).
Hiperglucemia y diabetes mellitus
Durante el tratamiento con RISPERDALCONSTA, se han notificado casos de hiperglucemia, diabetes mellitus, y exacerbación de una diabetes preexistente. En algunos casos, se ha notificado un aumento del peso corporal previo que puede ser un factor de predisposición. La asociación con cetoacidosis se ha notificado muy raramente y raramente con coma diabético. Se recomienda una monitorización clínica adecuada de acuerdo con las guías antipsicóticas utilizadas. A los pacientes tratados con antipsicóticos atípicos, incluyendo RISPERDAL CONSTA, se les debe monitorizar los síntomas de la hiperglucemia (tales como polidipsia, poliuria, polifagia y debilidad) y a los pacientes con diabetes mellitus se les debe monitorizar regularmente el empeoramiento del control de glucosa.
Aumento de peso
Se ha notificado un aumento de peso significativo con el uso de RISPERDAL CONSTA. Se debe realizar regularmente una monitorización del peso.
Hiperprolactinemia
La hiperprolactinemia es un efecto adverso común del tratamiento con RISPERDAL CONSTA. Se recomienda la evaluación del nivel plasmático de prolactina en pacientes con evidencia de posibles efectos adversos relacionados con la prolactina (e.j. ginecomastia, trastornos del periodo menstrual, anovulación, trastorno de fertilidad, disminución de la líbido, disfunción eréctil, galactorrea).
Estudios de cultivo tisular sugieren que el crecimiento celular en tumores de pecho en humanos se puede estimular por la prolactina. Aunque hasta ahora no se haya demostrado una asociación clara con la administración de antipsicóticos en estudios clínicos y epidemiológicos, se recomienda precaución en pacientes con historia médica relevante.
Se debe utilizar con precaución RISPERDAL CONSTA en pacientes con hiperprolactinemia preexistente y en pacientes con posibles tumores dependientes de prolactina.
Prolongación del intervalo QT
En muy raras ocasiones, se ha notificado prolongación del intervalo QT tras la comercialización. Al igual que con otros antipsicóticos, se debe tener cuidado cuando se prescriba risperidona a pacientes con enfermedad cardiovascular conocida, historia familiar de prolongación del intervalo QT, bradicardia, o
MINISTERIODE SANIDAD, POLITICA SOCIAL E IGUALDAD Agencia esparto» de medicamentos y pfoouctos saltaros
ítp.
m
alteraciones de los electrolitos (hipopotasemia, hipomagnasemia), ya que puede aumentar el riesgo de efectos arritmogénicos, y con el uso concomitante de medicamentos conocidos para prolongar el intervalo QT.
Convulsiones
RISPERDAL CONSTA se debe utilizar con cuidado en pacientes con una historia de convulsiones o con otras enfermedades que potencialmente puedan disminuir el umbral de convulsión.
Priapismo
Puede aparecer priapismo con el tratamiento con RISPERDAL CONSTA debido a sus efectos bloqueantes alfa-adrenérgicos.
Regulación de la temperatura corporal
La alteración de la capacidad del cuerpo para reducir la temperatura corporal central se ha atribuido a medicamentos antipsicóticos. Se aconseja tener precaución cuando se prescriba RISPERDAL CONSTA a pacientes que sufran enfermedades que pueden contribuir a un aumento de la temperatura corporal central, p. ej., hacer ejercicio energéticamente, exposición a calor extremo, aquellos que reciben tratamiento concomitante con actividad anticolinérgica o estar sometido a deshidratación.
Tromboembolismo venoso
Se han notificado casos de tromboembolismo venoso (TEV) con medicamentos antipsicóticos. Dado que los pacientes tratados con antipsicóticos presentan con frecuencia factores de riesgo adquirido de TEV, todos los factores de riesgo posibles se deben identificar antes y durante el tratamiento con RISPERDAL CONSTA y deben aplicarse medidas preventivas.
Síndrome del iris flácido intraoperatorio
Se ha observado síndrome del iris flácido intraoperatorio (IFIS) durante la cirugía de cataratas en pacientes tratados con medicamentos con efecto antagonista alfa1a-adrenérgico, incluyendoRISPERDAL CONSTA (ver sección 4.8).
El IFIS puede aumentar el riesgo de complicaciones oculares durante y después de la intervención. Se debe informar al oftalmólogo antes de la cirugía sobre el uso actual o pasado de medicamentos con efecto antagonista alfa1a-adrenérgico. El beneficio potencial de la interrupción del tratamiento con bloqueantes alfa1 antes de la cirugía de cataratas no ha sido establecido y debe ser sopesado frente al riesgo de interrumpir el tratamiento antipsicótico.
Efecto antiemético
En los estudios preclínicos con risperidona se observó que tiene un efecto antiemético.De producirse en los seres humanos, puede enmascarar los signos y síntomas de la sobredosis de determinados medicamentos o de trastornos como la obstrucción intestinal, el síndrome de Reye y los tumores cerebrales.
Alteraciones hepáticas o renales
Aunque la risperidona oral ha sido estudiada, RISPERDAL CONSTA no ha sido estudiado en pacientes con insuficiencia renal o hepática. RISPERDAL CONSTA debería utilizarse con precaución en este grupo de pacientes (ver sección 4.2).
Administración
Se debe tener precaución para evitar la inyección de RISPERDAL CONSTA en un vaso sanguíneo de
MINISTERIODE SANIDAD, POLITICA SOCIAL E IGUALDAD Agencia esparto» de medicamentos y pfoouctos saltaros
forma accidental.
Excipientes
Este medicamento contiene menos de 1 mmol de sodio (23 mg) por dosis, es decir, prácticamente “libre de sodio”.
4.5 Interacción con otros medicamentos y otras formas de interacción
Las interacciones de RISPERDAL CONSTA con la administración concomitante de otros fármacos no han sido evaluadas sistemáticamente. Los datos de interacción farmacológica proporcionados en esta sección están basados en estudios con RISPERDAL oral.
Interacciones farmacodinámicas
Fármacos que prolongan el inérvalo QT
Como ocurre con otros antipsicóticos, se aconseja precaución cuando se prescriba risperidona junto con medicamentos que prolongan el intervalo QT, tales como antiarrítmicos (p. ej., quinidina, disopiramida, procainamida, propafenona, amiodarona, sotalol), antidepresivos tricíclicos (es decir, amitriptilina), antidepresivos tetracíclicos (es decir, maprotilina), algunos antihistamínicos, otros antipsicóticos, algunos antipalúdicos (es decir, quinina y mefloquina) y con medicamentos que producen desequilibrio electrolítico (hipopotasemia, hipomagnesemia), bradicardia, o aquellos que inhiben el metabolismo hepático de la risperidona. Esta lista es indicativa y no exhaustiva.
Fármacos de acción central y alcohol
Risperidona se debe usar con precaución si se combina con otras sustancias de acción central incluyendo notablemente alcohol, opiáceos, antihistamínicos y benzodiazepinas debido al aumento del riesgo de sedación.
Levodopa y agonistas de la dopamina
RISPERDAL CONSTA puede antagonizar el efecto de la levodopa y de otros agonistas dopaminérgicos. Si esta combinación se considera necesaria, en particular en la etapa final de la enfermedad de Parkinson, se debe prescribir la dosis eficaz más baja de cada tratamiento.
Fármacos con efecto hipotensivo
Se ha observado hipotensión clínicamente relevante después de la comercialización con el uso concomitante de risperidona y tratamientos antihipertensivos.
Interacciones relacionadas con la farmacocinética
La risperidona es principalmente metabolizada a través del CYP2D6 y en menor medida a través del CYP3A4. Ambas la risperidona y su metabolito activo 9-hidroxirisperidona son sustratos de la glicoproteína P (gp-P). Las sustancias que modifican la actividad de CYP2D6, o sustancias que inhiben o inducen potentemente al CYP3A4 y/o la actividad de la gp-P, pueden influir en la farmacocinética de la fracción antipsicótica activa de risperidona.
Inhibidores potentes de CYP2D6
La administración concomitante de RISPERDAL CONSTA con un inhibidor potente de CYP2D6 puede aumentar las concentraciones de risperidona en plasma, pero en menor medida de la fracción antipsicótica activa de risperidona. Dosis más altas de un inhibidor potente de CYP2D6 pueden elevar las concentraciones de la fracción antipsicótica activa de risperidona (p.ej., paroxetina, ver abajo). Se espera que otros inhibidores de CYP2D6, como quinidina, puedan afectar a las concentraciones de risperidona en plasma de forma similar. Cuando se inicia o interrumpe la administración concomitante de paroxetina, quinidina u otros inhibidores potentes de CYP2D6, especialmente a dosis más altas, el médico debe volver a evaluar la dosificación de RISPERDAL CONSTA.
Inhibidores de CYP3A4 y/o gp-P
MINISTERIODE SANIDAD, POLITICA SOCIAL E IGUALDAD Agencia esparto» de medicamentos y Ofoouctos saltaros
La administración concomitante de RISPERDAL CONSTA con un inhibidor potente de CYP3A4 y/o de la gp-P puede elevar sustancialmente las concentraciones de la fracción antipsicótica activa de risperidona en plasma. Cuando se inicia o interrumpe la administración de itrakonazol u otro inhibidor potente de CYP3A4 y/o de la gp-P, el médico debe volver a evaluar la dosificación de RISPERDAL CONSTA.
Inductores de CYP3A4y/o gp-P
La administración concomitante con un inductor potente de CYP3A4 y/o de la gp-P puede disminuir las concentraciones de la fracción antipsicótica activa de risperidona en plasma. Cuando se inicia o interrumpe la administración concomitante de carbamazepina u otro inductor potente de CYP3A4 y/o de la gp-P, el médico debe volver a evaluar la dosificación de RISPERDAL CONSTA. Los inductores de CYP3A4 ejercen su efecto de forma tiempo-dependiente y puede llevar al menos 2 semanas alcanzar el efecto máximo después de la introducción. Por el contrario en la interrupción, la inducción de CYP3A4 puede llevar al menos 2 semanas para disminuirlo.
Fármacos altamente unibles a proteínas
Cuando RISPERDAL CONSTA se administra con fármacos altamente unibles a proteínas, no hay desplazamiento de las proteínas plasmáticas de ningún fármaco clínicamente relevante.
Cuando se administra medicación concomitante, se debe consultar la etiqueta correspondiente para información de la ruta metabólica y la posible necesidad de ajustar la dosis.
Población pediátrica
Los estudios de interacciones se han realizado solo en adultos. La relevancia de los resultados de estos estudios en pacientes pediátricos se desconoce.
Ejemplos
Se enumeran abajo ejemplos de fármacos que pueden potencialmente interaccionar o que se demostró que no interaccionan con risperidona:
Efecto de otros medicamentos en la farmacocinética de risperidona Antibacterianos:
• Eritromicina, un inhibidor moderado de CYP3A4 e inhibidor de la gp-P, no cambia la farmacocinética de risperidona y de la fracción antipsicótica activa de risperidona.
• Rifampicina, un inductor potente de CYP3A4 e inductor de la gp-P, disminuye las concentraciones plasmáticas de la fracción antipsicótica activa.
Anticolinesterasas:
• Donezepil y galantamina, ambos sustratos de CYP2D6 y CYP3A4, no muestran un efecto clínicamente relevante sobre la farmacocinética de risperidona y la fracción antipsicótica activa.
Antiepilépticos:
• Se ha demostrado que la carbamazepina, un inductor potente de CYP3A4 e inductor de la gp-P, disminuye las concentraciones plasmáticas de la fracción antipsicótica activa de risperidona. Se han observado efectos similares p. ej., con fenitoína y fenobarbital que también son inductores de la enzima CYP3A4 hepática y de la glucoproteína P.
• Topiramato reduce modestamente la biodisponibilidadde risperidona, pero no de la fracción antipsicótica activa. Por tanto no es probable que esta interacción sea clínicamente significativa.
Antifungicos:
• Itraconazol, un inhibidor potente de CYP3A4 y un inhibidor de la gp-P, a dosis de 200 mg/día, incrementó las concentraciones plasmáticas de la fracción antipsicótica activa en alrededor de un 70%, a dosis de risperidona de 2 a 8 mg/día.
• Ketoconazol, un inhibidor potente de CYP3A4 y un inhibidor de gp-P, a dosis de 200 mg/día aumentó las concentraciones plasmáticas de risperidona y disminuyó las concentraciones plasmáticas de 9-hidroxirisperidona.
Antipsicóticos:
• Las fenotiacinas pueden aumentar las concentraciones plasmáticas de risperidona pero no las de la fracción antipsicótica activa.
Antivirales:
MINISTERIODE SANIDAD, POLITICA SOCIAL E IGUALDAD Agencia esparto» de medicamentos y pfoouctos saltaros
• Inhibidores de la proteasa: No hay datos de estudios formales disponibles; sin embargo, dado que ritonavir es un potente inhibidor de CYP3A4 y un inhibidor débil de CYP2D6, ritonavir y los inhibidores de la proteasa potenciados por ritonavir elevan potencialmente las concentraciones de la fracción antipsicótica activa de risperidona.
Beta-bloqueantes:
• Algunos beta-bloqueantes pueden aumentar las concentraciones plasmáticas de risperidona, pero no las de la fracción antipsicótica activa.
Bloqueantes de los canales de calcio:
• Verapamilo, un inhibidor moderado de CYP3A4 y un inhibidor de la gp-P, aumenta las concentraciones plasmáticas de risperidona y de la fracción antipsicótica activa.
Fármacos gastrointestinales:
• Antagonistas del receptor-H2: Cimetidina y ranitidina, ambos inhibidores débiles de CYP2D6 y CYP3A4, aumentan la biodisponibilidad de risperidona, pero solo marginalmente la de la fracción antipsicótica activa.
ISRS y antidepresivos tricíclicos:
• Fluoxeina, un inhibidor potente de CYP2D6, aumenta las concentraciones plasmáticas de risperidona pero en menor medida de la fracción antipsicótica activa.
• Paroxetina, un inhibidor potente de CYP2D6, aumenta las concentraciones plasmáticas de risperidona, pero, a dosis de hasta 20 mg/día, en menor medida las de la fracción antipsicótica activa. Sin embargo, dosis más altas de paroxetina pueden elevar las concentraciones de la fracción antipsicótica activa de risperidona.
• Los antidepresivos tricíclicos pueden aumentar las concentraciones plasmáticas de risperidona pero no las de la la fracción antipsicótica activa. Amitriptilina no afecta la farmacocinética de risperidona o de la fracción antipsicótica activa.
• Sertralina, un inhibidor débil de CYP2D6, y fluvoxamina, un inhibidor dédil de CYP3A4, a dosis de hasta 100 mg/día no está asociado con cambios clínicamente significativos en las concentraciones de la fracción antipsicótica activa de risperidona. Sin embargo, dosis de sertralina o fluvoxamina más altas que 100 mg/día pueden elevar las concentraciones de la fracción antipsicótica activa de risperidona.
Efecto de risperidona en la farmacocinética de otros medicamentos:
Antiepilépticos:
• Risperidona no presenta un efecto clínicamente relevante en la farmacocinética de valproato o topiramato
Antipsicóticos:
• Aripiprazol, un sustrato de CYP2D6 y CYP3A4: Los comprimidos o inyecciones de risperidona no afectaron a la farmacocinética de la suma de aripiprazol y su metabolito activo, dehidroaripiprazol.
Glucósidos digitálicos:
• Risperidona no muestra un efecto clínicamente relevante en la farmacocinética de digoxina.
Litio:
• Risperidona no muestra un efecto clínicamente relevante en la farmacocinética del litio.
Uso concomitante de risperidona con furosemida
Ver sección 4.4 respecto a la mortalidad aumentada en pacientes de edad avanzada con demencia que
reciben concomitantemente furosemida.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No existen datos suficientes sobre el uso de risperidona en mujeres embarazadas.
Risperidona no fue teratógena en estudios en animales, pero se observaron otros tipos de toxicidad para la reproducción (ver sección 5.3). Se desconoce el posible riesgo para los seres humanos.
MINISTERIODE SANIDAD, POLITICA SOCIAL E IGUALDAD Agencia esparto» de medicamentos y pfoouctos saltaros
Los recién nacidos expuestos a antipsicóticos (incluido RISPERDAL CONSTA) durante el tercer trimestre de embarazo están en peligro de sufrir reacciones adversas como síntomas extrapiramidales y/o síntomas de abstinencia que pueden variar en gravedad y duración tras el parto. Se han notificado casos de síntomas de agitación, hipertonía, hipotonía, temblor, somnolencia, dificultad respiratoria o alteraciones alimenticias. Por consiguiente, se debe vigilar estrechamente a los recién nacidos.
RISPERDAL CONSTA no se debe utilizar durante el embarazo excepto si fuera claramente necesario.
Lactancia
En los estudios con animales, risperidona y 9-hidroxi-risperidona se excretan en la leche. Se ha demostrado que risperidona y 9-hidroxi-risperidona también se excretan en pequeñas cantidades en la leche humana.
No se dispone de datos sobre efectos adversos en los lactantes.Por lo tanto, debería sopesarse el beneficio de amamantar frente a los posibles riesgos para el niño.
Fertilidad
Al igual que otros medicamentos que bloquean los receptores D2 de la dopamina, RISPERDAL CONSTA aumenta los niveles de prolactina. La hiperprolactinemia puede inhibir la hormona GnRH hipotalámica, provocando una reducción en la secreción de la gonadotropina pituitaria. Esto, a su vez, puede inhibir la función reproductora perjudicando la esteroidogénesis gonadal tanto en pacientes hombres como mujeres.
No se han observado efectos relevantes en los estudios no clínicos.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de RISPERDAL CONSTA sobre la capacidad para conducir y utilizar máquinas es pequeña o moderada, por sus posibles efectos sobre el sistema nervioso y la vista (ver sección 4.8). Por tanto, se aconsejará a los pacientes que no conduzcan ni utilicen máquinas hasta conocer su sensibilidad individual.
4.8 Reacciones adversas
Las reacciones adversas (RAs) notificadas con más frecuencia (incidencia >1/10) son: Insomnio, ansiedad, dolor de cabeza, infección del tracto respiratorio superior, parkinsonismo y depresión.
Las reacciones adversas que parecieron estar relacionadas con la dosis incluyeron parkinsonismo y acatisia.
Tras la comercialización se notificaron reacciones graves en el lugar de la inyección, incluyendo necrosis, absceso, celulitis, úlcera, hematoma, quiste y nódulo. Se considera la frecuencia como no conocida (no se puede estimar a partir de los datos disponibles). Casos aislados requirieron intervención quirúrgica.
A continuación se citan todas las RAs notificadas en ensayos clínicos y experiencia post-comercialización con risperidona estimada en función de la frecuencia a partir de ensayos clínicos con RISPERDAL CONSTA. Se aplican los siguientes términos y frecuencias: muy frecuentes (> 1/10), frecuentes (> 1/100 a < 1/10), poco frecuentes (> 1/1000 a < 1/100), raras (> 1/10.000 a < 1/1000), muy raras (< 1/10.000). Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
|
Clasificación por Sistema de Órganos |
Reacción adversa al medicamento | ||||
|
Frecuencia | |||||
|
Muy frecuentes |
Frecuentes |
Poco frecuentes |
Raras |
Muy raras | |
MINISTERIODE SANIDAD, POLITICA SOCIAL E IGUALDAD Agencia esparto» de medicamentos y pfoouctos saltaros
|
Infecciones e infestaciones |
infección del tracto respiratorio superior |
neumonía, bronquitis, sinusitis, infección del tracto urinario, gripe |
infección del tracto respiratorio, cistitis, infección de oídos, infección de ojos, amigdalitis, onicomicosis, celulitis, infección, infección localizada, infección vírica, acarodermatitis, absceso subcutáneo | ||
|
Trastornos de la sangre y del sistema linfático |
anemia |
disminución del recuento de glóbulos blancos, trombocitopenia, disminución del hematocrito |
agranulocitosisc, neutropenia, aumento del recuento de eosinófilos | ||
|
Trastornos del sistema inmunológico |
hipersensibilidad |
reacción anafilácticac |
MINISTB^IODE SANIDAD, POLITICA SOCIAL E IGUALDAD Agencia esparto» de medicamentos y prosudos saltaros
|
Trastornos endocrinos |
hiperprolactine-miaa |
presencia de glucosa en la orina |
secreción inapropiada de la hormona antidiurética | ||
|
Trastornos del metabolismo y de la nutrición |
hiperglucemia, aumento de peso, aumento del apetito, disminución de peso, disminución del apetito |
diabetes mellitusb,anorexia, aumento de los triglicéridos en sangre, aumento del colesterol en sangre |
intoxicación por aguac, hipoglucemia, hiperinsuline-miac, polidipsia |
cetoacidosis diabética | |
|
Trastornos psiquiátricos |
insomniod, depresión, ansiedad |
trastornos del sueño, agitación, disminución de la líbido |
manía, estado de confusión, anorgasmia, nerviosismo, pesadillas |
embotamiento afectivo | |
|
Trastornos del sistema nervioso |
parkinsonis mod, cefalea |
sedación/somno-lencia, acatisiad, distoníad, mareos, discinesiad, temblor |
discinesia tardía,isquemia cerebral, pérdida de la consciencia, convulsiónd, síncope, hiperactividad psicomotora, trastorno del equilibrio, coordinación anormal, mareo postural, alteración de la atención, disartria, disgeusia, hipoestesia, parestesia |
síndrome neuroléptico maligno, accidente cerebrovascular, sin respuesta a estímulos, disminución del nivel de consciencia, coma diabético, titubeo de la cabeza | |
|
Trastornos oculares |
visión borrosa |
conjuntivitis,sequed ad de ojos,aumento del lagrimeo, hiperemia ocular |
oclusión de la arteria retiniana, glaucoma, trastorno del movimiento de los ojos, giros de los ojos, fotofobia, costras en el borde del párpado, síndrome del iris flácido (intraoperatorio)c | ||
|
Trastornos del oído y del laberinto |
vértigo, acúfenos, dolor de oídos | ||||
|
Trastornos cardiacos |
taquicardia |
fibrilación auricular, bloqueo auriculoventricular, trastornos de la |
arritmia sinusal |
MINISTB^IODE SANIDAD, POLITICA SOCIAL E IGUALDAD Agencia esparto» de medicamentos y Ofoouctos saltaros
conducción, prolongación del intervalo QT en el electrocardiogra-ma, bradicardia, anomalías del electrocardiogra-ma, palpitaciones
hipotensión,
hipertensión
hipotensión
ortostática
embolismo pulmonar, trombosis venosa, rubor
Trastornos respiratorios, torácicos y mediastínicos
disnea, dolor faringolaríngeo, tos, congestión nasal
hiperventilation, congestion del tracto respiratorio, sibilancias, epistaxis
síndrome de apnea del sueño, neumonía por aspiración, congestión pulmonar, estertores, disfonía, trastorno respiratorio_
dolor abdominal, malestar abdominal, vómitos, náuseas, estreñimiento, gastroenteritis, diarrea, dispepsia, sequedad de boca, dolor de muelas
incontinencia fecal, disfagia, flatulencia
pancreatitis,obstru |íleo cción intestinal, hinchazón de la lengua, fecaloma, queilitis
MINISTERIO DE SANIDAD, POLITICA SOCIAL E IGUALDAD Agencia esparcía de medicamentos y Ofoouctos sanéanos
|
Trastornos de la piel y del tejido subcutáneo |
exantema |
prurito, alopecia, eccema, sequedad de la piel, eritema, decoloración de la piel, acné, dermatitis seborreica |
erupción debida al medicamento, urticaria, hiperqueratosis, caspa, alteraciones en la piel, lesiones en la piel |
angioedema | |
|
Trastornos musculoesquelétic os y del tejido conjuntivo |
espasmos musculares, dolor musculoesquelé-tico, dolor de espalda, artralgia |
aumento de la creatina fosfoquinasa en sangre, rigidez de las articulaciones, hinchazón de las articulaciones, debilidad muscular, dolor de cuello |
rabdomiólisis, anomalía postural | ||
|
Trastornos renales y urinarios |
incontinencia urinaria |
polaquiuria,retenció n urinaria, disuria | |||
|
Embarazo, puerperio y enfermedades perinatales |
síndrome de abstinencia neonatalc | ||||
|
Trastornos del aparato reproductor y de la mama |
disfunción eréctil, amenorrea, galactorrea |
trastorno de la eyaculación, retraso en la menstruación, trastornos menstrualesd, ginecomastia, disfunción sexual, dolor de las mamas, malestar de las mamas, secreción vaginal |
priapismoc, congestión de las mamas, aumento de las mamas, secreción mamaria | ||
|
Trastornos generales y alteraciones en el lugar de administración |
edemad, pirexia, dolor de pecho, astenia, fatiga, dolor, reacción en el lugar de la inyección |
edema facial, escalofríos, aumento de la temperatura corporal, alteración de la marcha, sed, malestar de pecho, malestar, sensación de anomalías, endurecimiento0 |
hipotermia, disminución de la temperatura corporal, frialdad en las extremidades, síndrome de abstinencia a medicamentos, malestar |
14 de 29 MiNisrmioDE
SANIDAD, POLITICA SOCIAL E IGUALDAD Agencia es parto» de medieamentos y Sfoouctos sarttanos
|
Trastornos hepatobiliares |
aumento de las transaminasas, aumento de la gamma- glutamiltransferasa |
aumento de las enzimas hepáticas |
ictericia | ||
|
Lesiones traumáticas, intoxicaciones y complicaciones de procedimientos terapéuticos |
caídas |
dolor debido al procedimiento |
a Hiperprolactinaemia puede en algunos casos conducir a ginecomastia, alteraciones menstruales, amenorrea, anovulación, galactorrea, trastorno de fertilidad, disminución de la libido y disfunción eréctil.
b En ensayos controlados con placebo, se notificó diabetes mellitus en un 0,18% de los pacientes tratados con risperidona comparado con un 0,11% del grupo placebo. En general, la incidencia en todos los ensayos clínicos fue de un 0,43% en todos los pacientes tratados con risperidona. c No se observaron en estudios clínicos de RISPERDAL CONSTA pero sí en la experiencia tras la comercialización con risperidona.
d Puede aparecer un trastorno extrapiramidal: Parkinsonismo (hipersecreción salivar, rigidez musculoesquelética, parkinsonismo, babeo, rigidez en rueda dentada, bradicinesia, hipocinesia, facies de máscara, espasmos musculares, acinesia, rigidez nucal, rigidez muscular, marcha tipo Enfermedad de Parkinson y reflejos anómalos en el entrecejo, temblor en reposo parkinsoniano), acatisia (acatisia, inquietud, hipercinesia y síndrome de piernas inquietas), temblor, discinesia (discinesia, espasmos musculares, coreoatetosis, atetosis y mioclonía) distonía. La distonía incluye distonía, hipertonía, torticulis, contracciones musculares involuntarias, contractura muscular, blefaroespasmo, convulsiones oculógiras, parálisis de la lengua, espasmo facial, laringoespasmos, miotonía, opistótono, espasmo orofaríngeo, pleurotótono, espasmo en la lengua y trismo. Se debe tener en cuenta que se incluye un abanico más amplio de síntomas que no tiene necesariamente un origen extrapiramidal. Insomnio incluye insomnio inicial, insomnio medio; Convulsión incluye convulsión del gran mal;
Trastornos menstruales incluyen menstruación irregular, oligomenorrea; Edema incluye edema generalizado, edema periférico, edema con fóvea.
Reacciones adversas notificadas con las formulaciones de paliperidona
Paliperidona es el metabolito activo de risperidona, por lo tanto, los perfiles de las reacciones adversas de estos compuestos (incluyendo ambas formulaciones la oral y la inyectable) son relevantes entre sí. Además de las reacciones adversas anteriormente mencionadas, se han notificado las siguientes reacciones adversas con el uso de paliperidona, las cuales se espera que aparezcan con RISPERDAL CONSTA.
Trastornos cardiacos
Síndrome de taquicardia postural ortostática
Reacción anafiláctica
En raras ocasiones, durante la experiencia post-comercialización, se han notificado casos de reacción anafiláctica después de la inyección de RISPERDAL CONSTA en los pacientes que habían tolerado previamente risperidona oral (ver sección 4.4).
Efectos de clase
Como ocurre con otros antipsicóticos, se han notificado casos muy raros de prolongación del QT en la experiencia post-comercialización con risperidona. Otros efectos cardíacos relacionados con la clase
MINISTERIODE SANIDAD, POLITICA SOCIAL E IGUALDAD Agencia esparto» de medicamentos y pfoouctos saltaros
notificados con los antipsicóticos que prolongan el intervalo QT son arritmia ventricular, fibrilación ventricular, taquicardia ventricular, muerte súbita, paro cardiaco y Torsade de Pointes.
Tromboembolismo venoso
Se han notificado con medicamentos antipsicóticos (frecuencia no conocida) casos de tromboembolismo venoso entre los que se incluyen casos de embolismo pulmonar y casos de trombosis venosa profunda.
Aumento de peso
En un estudio doble ciego controlado con placebo, de 12 semanas de duración, se observó un aumento de peso > 7% al final del estudio en un 9% de los pacientes tratados con RISPERDAL CONSTA comparado con un 6% de los pacientes tratados con placebo. En un estudio abierto con RISPERDAL CONSTA, de 1 año de duración, se observaron cambios en el peso de los pacientes generalmente en ± 7% desde el momento basal; un 25% de los pacientes tuvieron un aumento de peso > 7%.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de medicamentos de Uso Humano: https://www.notificaram.es.
4.9 Sobredosis
Aunque es menos probable que se produzca una sobredosis con el medicamento parenteral que con el oral, a continuación se presenta la información correspondiente a la formulación oral.
Síntomas
En general, los signos y síntomas notificados han sido los resultantes de la exageración de los efectos farmacológicos conocidos de risperidona. Se trata de somnolencia y sedación, taquicardia e hipotensión y síntomas extrapiramidales. En casos de sobredosis se ha notificado prolongación del intervalo QT y convulsiones. Se ha notificado Torsade de Pointes asociada a la sobredosis combinada de RISPERDAL oral y paroxetina.
En caso de sobredosis aguda se tendrá en cuenta la posibilidad de que estén implicados varios fármacos.
Tratamiento
Hay que obtener y mantener una vía respiratoria despejada y garantizar que la oxigenación y la ventilación sean adecuadas. El control cardiovascular debe empezar inmediatamente e incluir un control electrocardiográfico continuo para detectar posibles arritmias.
No hay ningún antídoto específico para RISPERDAL. Por tanto, se aplicarán las medidas de apoyo adecuadas. La hipotensión y el fracaso circulatorio deben tratarse con medidas terapéuticas adecuadas, como administración de líquidos por vía intravenosa y/o de simpaticomiméticos. En caso de síntomas extrapiramidales graves, se deberá administrar un medicamento anticolinérgico. Se mantendrán una supervisión y un control estrictos hasta que el paciente se recupere.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupofarmacoterapéutico: Otros antipsicóticos, código ATC: N05AX08.
MINISTERIODE SANIDAD, POLITICA SOCIAL E IGUALDAD Agencia esparto» de medicamentos y pfoouctos saltaros
Mecanismo de acción
Risperidona es un antagonista monoaminérgico selectivo con propiedades únicas. Posee una alta afinidad por los receptores 5-HT2 serotoninérgicos y D2 dopaminérgicos. Risperidona se une también a los receptores alfa1-adrenérgicos, y con baja afinidad por los receptores H1-histaminérgicos y alfa2-adrenérgicos. Risperidona no tiene afinidad por los receptores colinérgicos. Aunque risperidona es un potente antagonista D2 lo cual se considera que mejora los síntomas positivos de la esquizofrenia, causa una menor depresión de la actividad motriz e inducción de catalepsia que los antipsicóticos clásicos. El equilibrado antagonismo central de serotonina y dopamina puede disminuir el riesgo de efectos secundarios extrapiramidales y extender su actividad terapéutica a los síntomas negativos y afectivos de la esquizofrenia.
Eficacia clínica
La eficacia de RISPERDAL CONSTA (25 mg y 50 mg) en el control de las manifestaciones de los trastornos psicóticos (esquizofrenia/trastorno esquizoafectivo) se estableció en un ensayo controlado con placebo, de 12 semanas, realizado en pacientes adultos psicóticos hospitalizados y no hospitalizados que cumplieron con el criterio DMS-IV para esquizofrenia.
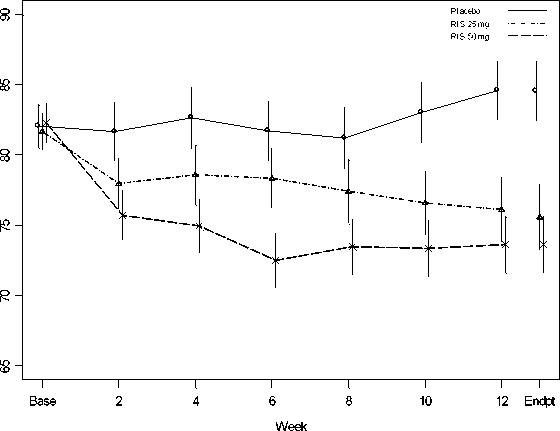
En un ensayo comparativo de 12 semanas de duración, realizado en pacientes estables con esquizofrenia, RISPERDAL CONSTA demostró ser tan eficaz como la formulación oral. La seguridad y eficacia de RISPERDAL CONSTA a largo plazo (50 semanas) fue también evaluada en un ensayo abierto en pacientes psicóticos estables hospitalizados y no hospitalizados que cumplieron con el criterio DMS-IV para esquizofrenia o trastorno esquizoafectivo. La eficacia con RISPERDAL CONSTA se mantuvo en el tiempo (Figura 1).
Figura 1. Puntuación media total en la PANSS (LOCF) en pacientes con esquizofrenia.
Efectos farmacodinámicos
MINISTERIO DE SANIDAD, POLITICA SOCIAL E IGUALDAD Agencia esparcía de medicamentos y Ofoouctos sanéanos
Población pediátrica
5.2 Propiedades farmacocinéticas
Absorción
La absorción de risperidona a partir de RISPERDAL CONSTA es completa.
Tras una inyección intramuscular de RISPERDAL CONSTA, el perfil de liberación consiste en una liberación inicial pequeña de risperidona (<1% de la dosis), seguido de un período de retardo en su actividad de 3 semanas. La liberación principal de risperidona comienza a partir de la semana 3 en adelante, se mantiene de 4 a 6 semanas y disminuye alrededor de la semana 7. Por tanto, debe administrarse un suplemento oral antipsicótico durante las primeras 3 semanas de tratamiento con RISPERDAL CONSTA (ver sección 4.2).
La combinación del perfil de liberación y el régimen de dosificación (inyección intramuscular cada dos semanas) da lugar a un mantenimiento de las concentraciones terapéuticas en plasma. Las concentraciones terapéuticas en plasma permanecen de 4 a 6 semanas después de la última inyección de RISPERDAL CONSTA.
Tras varias inyecciones intramusculares de 25 ó 50 mg de RISPERDAL CONSTA cada dos semanas, la media de las concentraciones plasmáticas mínima y máxima de la fracción antipsicótica activa osciló entre 9,9-19,2 ng/ml y 17,9-45,5 ng/ml, respectivamente. No se produjo acumulación de risperidona durante la administración a largo plazo (12 meses) a pacientes a los que se administraron inyecciones de 25-50 mg cada dos semanas.
Los estudios indicados fueron realizados con la inyección intramuscular glútea. Las inyecciones intramusculares deltoides y glúteas con las mismas dosis son bioequivalentes, y por lo tanto, ambos lugares de administración son intercambiables.
Distribución
Risperidona se distribuye rápidamente. El volumen de distribución es de 1-2 litros/kg. En plasma, risperidona se une a la albúmina y a la alfa-1-glucoproteína ácida. La unión de risperidona a proteínas plasmáticas es del 90 % y la del metabolito activo 9-hidroxi-risperidona del 77 %.
Metabolismo o Biotransformación
La CYP 2D6 metaboliza la risperidona a 9-hidroxi-risperidona, que tiene actividad farmacológica similar a la de risperidona. Risperidona y 9-hidroxi-risperidona forman la fracción antipsicótica activa. La CYP 2D6 está sujeta a polimorfismo genético. Los metabolizadores rápidos de la CYP 2D6 convierten risperidona en 9-hidroxi-risperidona rápidamente, mientras que los metabolizadores lentos de la CYP 2D6 la convierten mucho más lentamente. Aunque los metabolizadores rápidos tienen concentraciones más bajas de risperidona y mayores de 9-hidroxi-risperidona que los metabolizadores lentos, la farmacocinética combinada de risperidona y 9-hidroxi-risperidona (es decir, la fracción antipsicótica activa), tras la administración de dosis únicas y múltiples, son similares en los metabolizadores rápidos y lentos de la CYP 2D6.
Otra vía metabólica de risperidona es la N-desalquilación. En estudios in vitro realizados con microsomas hepáticos humanos se demostró que risperidona en concentraciones clínicamente relevantes no inhibe
MINISTERIODE SANIDAD, POLITICA SOCIAL E IGUALDAD Agencia esparto» de medicamentos y Ofoouctos saltaros
sustancialmente el metabolismo de los medicamentos metabolizados por las isoenzimas del citocromo P450, como CYP 1A2, CYP 2A6, CYP 2C8/9/10, CYP 2D6, CYP 2E1, CYP 3A4 y CYP 3A5.
Eliminación
Tras una semana de administración de risperidona oral, el 70 % de la dosis se excreta con la orina y el 14 % con las heces. En orina, risperidona más 9-hidroxi-risperidona representan el 35 % al 45 % de la dosis administrada vía oral. El resto son metabolitos inactivos. La fase eliminación es completa aproximadamente de 7 a 8 semanas después de la última inyección de RISPERDAL CONSTA.
Linealidad/ No linealidad
Las farmacocinéticas de risperidona son lineales tras dosis únicas de RISPERDAL CONSTA en el rango de dosis de 25-50 mg inyectado cada 2 semanas.
Pacientes de edad avanzada, insuficiencia hepática y renal
En un estudio farmacocinético a dosis única con risperidona oral se demostró que en pacientes de edad avanzada, por regla general, aumentan las concentraciones plasmáticas de la fracción antipsicótica activa en un 43 %, un aumento de la semivida en un 38% y una disminución del aclaramiento de la fracción antipsicótica activa del 30%.
En adultos con insuficiencia renal moderada el aclaramiento de la fracción activa fue aproximadamente el 48% del aclaramiento en adultos jóvenes sanos (rango de edad de 25 a 35 años). En adultos con insuficiencia renal grave el aclaramiento de la fracción activa fue aproximadamente el 31% del aclaramiento en adultos jóvenes sanos. La semivida de la fracción activa fue 16,7 horas en adultos jóvenes;
24,9 horas en adultos con enfermedad renal moderada (o aproximadamente 1,5 veces más prolongado que en adultos jóvenes), y 28,8 horas en aquellos con enfermedad renal grave (o aproximadamente 1,7 veces más prolongado que en adultos jóvenes).
Las concentraciones plasmáticas de risperidona fueron normales en pacientes con insuficiencia hepática, pero la fracción libre media de risperidona en plasma aumentó un 37,1%.
El aclaramiento oral y la vida media de eliminación de risperidona y de la fracción activa en adultos con insuficiencia hepática moderada y severa no fueron significativamente diferentes respecto a esos parámetros en adultos jóvenes sanos.
Sexo, raza y consumo de tabaco
En un análisis de farmacocinética poblacional se puso de manifiesto que aparentemente el sexo, la raza o el consumo de tabaco no tienen efecto sobre las farmacocinéticas de risperidona o de la fracción antipsicótica activa.
Datos de farmacocinética/ farmacodinamia(s)
No hubo relación entre las concentraciones en plasma de la fracción antipsicótica activa y el cambio en la puntuación total de la PANSS (Positive and Negative Síndrome Scale) y de la ESRS (Extrapiramidal Symptom Rating Scale) a lo largo de las visitas de valoración en ninguno de los ensayos en fase III donde se examinaron la eficacia y seguridad.
5.3 Datos preclínicos sobre seguridad
Al igual que en los estudios de toxicidad (sub)crónica con risperidona oral en ratas y perros, los efectos fundamentales durante el tratamiento con RISPERDAL CONSTA (hasta 12 meses de administración intramuscular) fueron la estimulación de la glándula mamaria y los cambios en el aparato genital femenino y masculino mediados por prolactina, y los efectos en el sistema nervioso central (SNC), relacionados con la actividad farmacodinámica de risperidona. En un estudio de toxicidad con ratas jóvenes tratadas con
19 de 29 WINISTWIODE
SANIDAD, POLITICA SOCIAL E IGUALDAD Apenca esparto» de medie ámenlos y pfoouctos saltaros
risperidona oral, se observó un aumento de mortalidad de las crías y un retraso en el desarrollo físico. En un estudio de 40 semanas con perros jóvenes tratados con risperidona oral, se observó retraso en la maduración sexual. En base al AUC, el crecimiento de los huesos largos no se vio afectado en perros a una exposición de 3,6 veces la exposición máxima oral humana en adolescentes (1,5 mg/día); mientras que los efectos en los huesos largos y en la maduración sexual se observaron a una exposición 15 veces la exposición máxima oral humana en adolescentes.
Risperidona no tuvo efectos teratógenos en ratas y conejos. En los estudios de reproducción con risperidona en ratas, se observaron efectos adversos en el comportamiento durante el apareamiento de los padres, y en el peso al nacer y en la supervivencia de las crías. En ratas, la exposición intrauterina a risperidona se asoció con deficiencias cognitivas en la edad adulta. Cuando se administraron otros antagonistas de la dopamina a animales preñados, se observó que causaron efectos negativos sobre el aprendizaje y el desarrollo motor de las crías.
La administración de RISPERDAL CONSTA a ratas macho y hembra durante 12 y 24 meses originó osteodistrofia a una dosis de 40 mg/kg/2 semanas. La dosis que causó osteodistrofia en ratas fue, basándose en mg/m2, 8 veces la dosis máxima recomendada en humanos y está asociada con una exposición en plasma equivalente al doble de la exposición máxima esperada en humanos para la dosis máxima recomendada. No se observó osteodistrofia en perros tratados durante 12 meses con RISPERDAL CONSTA hasta 20 mg/kg/2 semanas. Esta dosis originó exposiciones en plasma de hasta 14 veces la dosis máxima recomendada en humanos.
No se obtuvieron pruebas de potencial genotóxico.
Como era de esperar para un potente antagonista de la dopamina D2, en estudios de carcinogenicidad oral con risperidona en ratas y ratones, se observó un aumento de los adenomas en la glándula pituitaria (ratón), adenomas en el páncreas endocrino (rata) y adenomas en las glándulas mamarias (ambas especies).
En un estudio de carcinogenicidad intramuscular con RISPERDAL CONSTA en ratas Wistar (Hannover) (dosis de 5 y 40 mg/kg/2 semanas), se observó un aumento de las incidencias del páncreas endocrino, glándula pituitaria y tumor de médula suprarrenal a dosis de 40 mg/kg, mientras que los tumores de la glándula mamaria se observaron a dosis de 5 y 40 mg/kg. Estos tumores observados con la dosis oral e intramuscular pueden estar relacionados con un antagonismo prolongado de la dopamina D2 y la hiperprolactinemia. Los estudios del cultivo tisular sugieren que el crecimiento celular en los tumores de mama en humanos puede ser estimulado por prolactina. La hipercalemia reportada, que se atribuye a un aumento de la incidencia de tumores de médula suprarrenal en ratas tratadas con RISPERDAL CONSTA, fue observada en ambos grupos de dosis. No hay evidencia que sugiera que la hipercalemia pueda causar feocromocitomas en humanos.
En ratas macho tratadas con RISPERDAL COSTA aparecieron adenomas tubulares renales a dosis de 40 mg/kg/2 semanas. No se observaron tumores renales a dosis bajas, el NaCl 0,9%, o el grupo control del vehículo de las microesferas. Se desconoce el mecanismo subyacente de los tumores renales en ratas macho Wistar (Hannover) tratadas con RISPERDAL CONSTA. En estudios de carcinogenicidad llevados a cabo en ratas Wistar (Wiga) o en ratones suizos a los que se administró risperidona vía oral, no se observó un aumento, relacionado con el tratamiento, en la incidencia de tumores renales. Estudios realizados para investigar las diferencias entre las subrazas en cuanto al perfil del órgano del tumor sugieren que la subraza Wistar (Hannover) empleada en los estudios de carcinogenicidad oral difiere sustancialmente de la subraza Wistar (Wiga) empleada en los estudios de carcinogenicidad oral en lo que respecta a los cambios renales espontáneos no neoplásicos relacionados con la edad, aumentos de prolactina en suero y cambios renales como respuesta a la risperidona. No hay datos que indiquen cambios relacionados con el riñón en perros tratados crónicamente con RISPERDAL CONSTA.
Se desconoce, en términos de riesgo en humanos, la importancia de la osteodistrofia, de los tumores mediados por prolactina y la supuesta relevancia de la subraza específica de rata en los tumores renales.
Se observó irritación local en el lugar de la inyección en perros y ratas tras la administración de dosis altas
MINISTERIODE SANIDAD, POLITICA SOCIAL E IGUALDAD Agencia esparto» de medicamentos y Ofoouctos saltaros
de RISPERDAL CONSTA. En un estudio de carcinogenicidad en ratas tras la administración intramuscular durante 24 meses, no se observó, ni en el grupo al que se administró el vehículo de las microesferas ni al que se administró el fármaco activo, un aumento en la incidencia de tumores en el lugar de la inyección.
Los modelos animales muestran, in vivo e in vitro, que dosis altas de risperidona pueden provocar prolongación del intervalo QT, el cuál ha sido asociado con un aumento teórico del riesgo de Torsade de Pointes en pacientes.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Polvo para supensión para inyección poli-(d,l-láctido-co-glicólido)
Disolvente Polisorbato 20 Carmelosa sódica
Fosfato hidrogenado disódico dihidratado
Ácido cítrico anhidro
Cloruro sódico
Hidróxido sódico
Agua para inyección.
6.2 Incompatibilidades
Este medicamento no se debe mezclar con otros excepto con los mencionados en la sección 6.6.
6.3 Periodo de validez 3 años a 2-8°C.
Después de la reconstitución: Se ha demostrado la estabilidad química y física durante 24 horas a 25°C.
Desde un punto de vista microbiológico, el producto se debe usar inmediatamente. Si no se hace, los períodos de almacenamiento reconstituido y las condiciones previas a su utilización son la responsabilidad del usuario y no deben superar las 6 horas a 25°C, a no ser que la reconstitución se haya realizado en condiciones asépticas controladas y validadas.
6.4 Precauciones especiales de conservación
Conservar el envase completo en nevera (entre 2°C y 8°C).
Si no se dispone de refrigeración, RISPERDAL CONSTA se puede almacenar a temperaturas no superiores a 25°C durante 7 días como máximo antes de su administración.
Conservar en el embalaje original.
Para las condiciones de conservación del medicamento reconstituído, ver sección 6.3.
6.5 Naturaleza y contenido del envase
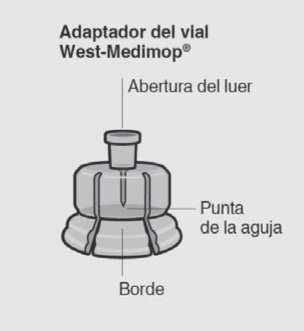
Dispositivo sin aguja para el acceso libre al vial
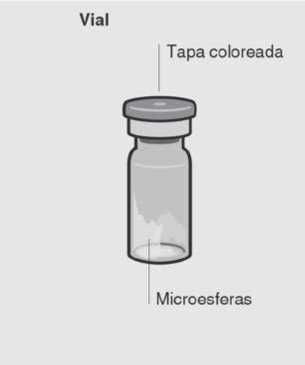
Un vial que contiene polvo para suspensión de liberación prolongada para inyección
Un adaptador West-Medimop® del vial (referido como Adaptador del Vial) para la reconstituciónUna
MINISTERIODE SANIDAD, POLITICA SOCIAL E IGUALDAD Agencia esparto» de medicamentos y Ofoouctos saltaros
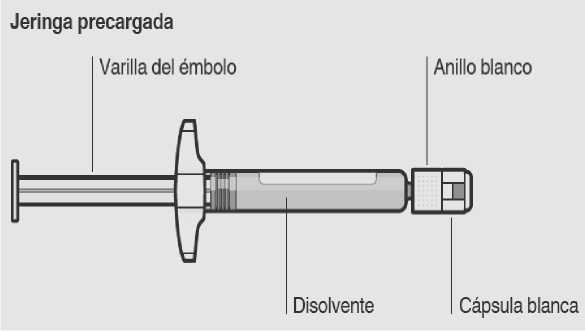
jeringa precargada que contiene el disolvente para RISPERDAL CONSTA
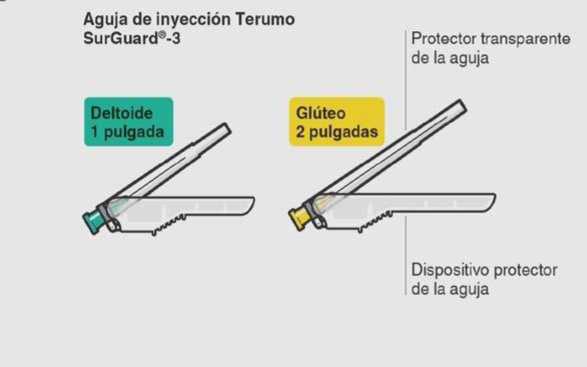
Dos agujas Terumo SurGuard®-3 para inyección intramuscular (una aguja de seguridad 21G UTW de 1 pulgada (0,8 mm x 25 mm) con dispositivo de seguridad protector para la aguja para la administración en el deltoides y una aguja de seguridad 20G TW de 2 pulgadas (0,9 mm x 51 mm) con dispositivo de seguridad protector para la aguja para la administración en el glúteo).
Solo en Alemania: Risperdal Consta está disponible en packs que contienen de 1 a 5 envases (agrupados).
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones Información importante
RISPERDAL® CONSTA® requiere una atención detallada en cada paso de las “Instrucciones de Uso” para ayudar a asegurar una administración exitosa.
Uso de los componentes proporcionados
Los componentes del envase están específicamente diseñados para el uso con RISPERDAL® CONSTA®. RISPERDAL® CONSTA® debe ser reconstituido solo con el disolvente suministrado en el envase.
No sustituir NINGUNO de los componentes de este envase.
No guardar la suspensión después de la reconstitución
Administrar la dosis lo antes posible después de la reconstitución, para evitar la sedimentación.
Dosis adecuada
Todo el contenido del vial debe ser administrado para asegurar que se administra la dosis adecuada de RISPERDAL® CONSTA®.
DISPOSITIVO DE UN SOLO USO
No reutilizar. Los dispositivos médicos requieren materiales de características específicas para funcionar adecuadamente. Estas características se han verificado para un solo uso. Cualquier intento de volver a procesar el dispositivo para su posterior reutilización puede afectar negativamente la integridad del dispositivo o llevar a un deterioro del funcionamiento.
MINISTERIODE SANIDAD, POLITICA SOCIAL E IGUALDAD Agencia esparto» de medicamentos y pfoouctos saltaros
MINISTBWDE SANIDAD, POLITICA SOCIAL E IGUALDAD Agencia es pañosa de medicamentos y productos s arpiaros
¿•í i-, allí® a
jm
Paso 1
Montar los componentes
Esperar 30 minutos
Sacar el envase de la dosis del frigorífico y dejar que alcance la temperatura ambiente durante al menos 30 minutos antes de reconstituir.
No calentar de ninguna otra forma.
Sacar el envase de la dosis Conectar el adaptador del vial al vial
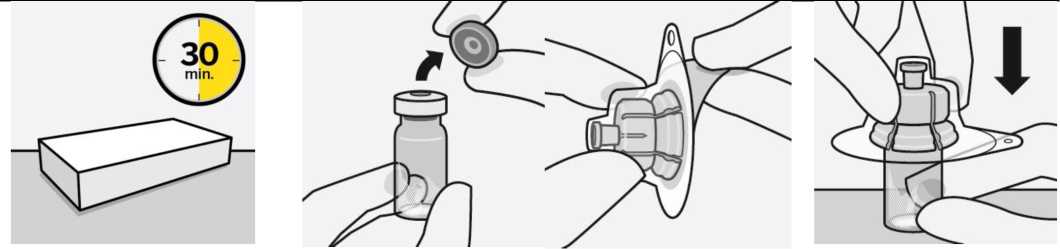
Retirar la tapa del vial
Retire la tapa coloreada del vial.
Limpie la parte superior del tapón gris con un algodón con alcohol.
Deje secar al aire.
No quitar el tapón gris de goma.
Preparar el adaptador del vial
Sujetar el blíster estéril como se muestra.
Retirar el soporte de papel.
No quitar el adaptador del vial del blíster.
No tocar la punta del punzón en ningún momento. Esto puede dar lugar a contaminación.
Acoplar el adaptador del vial al vial
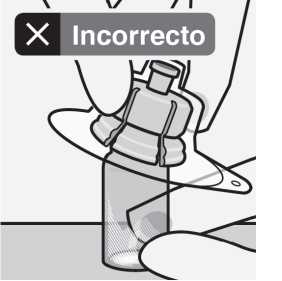
Coloque el vial en una superficie dura y sujételo por la base. Centre el adaptador del vial sobre el tapón gris de goma. Presione el adaptador del vial recto hacia abajo hasta que encaje con seguridad en el vial.
No colocar el adaptador del vial en ángulo, ya que puede perder disolvente en la transferencia al vial.
MINISTERIO DE SANIDAD, POLITICA SOCIAL E IGUALDAD Agaicaespanosade medicamentos y productos sanéanos
Retirar el blíster estéril
rA-^
Retirar el adaptador del vial del blíster estéril solo cuando esté listo para quitar la cápsula blanca de la jeringa precargada.
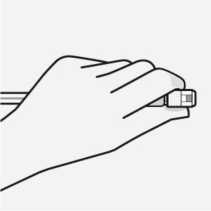

Mantener el vial vertical para prevenir pérdidas. Sujetar la base del vial y tirar de blíster estéril para quitarlo.
No agitar.
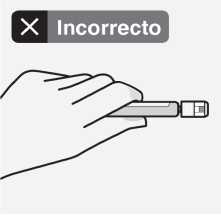
Utilizar la zona de sujeción adecuada
Sujetar por el anillo blanco de la punta de la jeringa.
No sujetar la jeringa por el vidrio durante el ensamblaje.
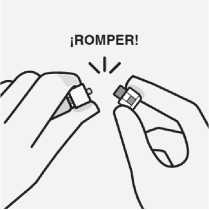
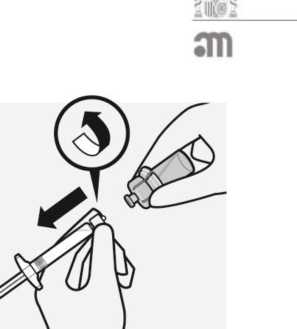
Retirar la cápsula
Sujetando el anillo blanco, rompa la cápsula blanca.
No girar o cortar la cápsula blanca.
No tocar la punta de la jeringa. Esto puede dar lugar a contaminación
No tocar el luer (cono) expuesto, abierto en el adaptador del vial.
Esto puede dar lugar a contaminación.
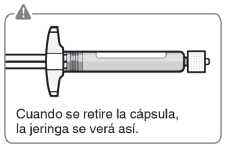
La cápsula rota se puede desechar.
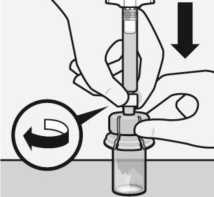
Acoplar la jeringa al adaptador del vial
Sujete el adaptador del vial por el borde para mantenerlo fijo. Sujete la jeringa por el anillo blanco y después inserte la punta en la abertura del luer (cono) del adaptador del vial.
No sujete la jeringa por el cilindro de vidrio.
Esto puede causar que el anillo blanco se afloje o desprenda. Conecte la jeringa al adaptador del vial con un movimiento firme de rotación en sentido de las agujas del reloj hasta que esté ajustado.
No presionar en exceso.
Presionar en exceso puede causar que la punta de la jeringa se rompa.
MINISTB?IOOE SANIDAD. P0UT1CA SOCIAL E IGUALDAD
pfOOuctos sarwaros
.•&P.
Inyectar disolvente
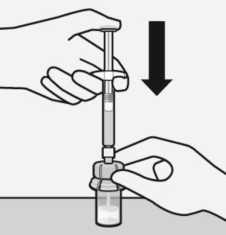
Inyectar en el vial toda la cantidad de disolvente de la jeringa.
rA-
El contenido del vial estará ahora bajo presión. Presione la varilla del émbolo hacia abajo con el dedo pulgar.
Transferir la suspensión a la jeringa
Invertir el vial por completo.
Tire lentamente de la varilla del émbolo hacia abajo para que pase todo el contenido del vial a la jeringa.
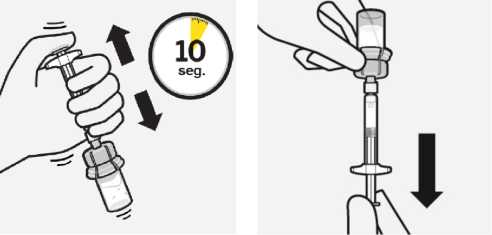
Suspender las microesferas en el disolvente
Continúe presionando hacia abajo el émbolo con el pulgar, agite enérgicamente, como se muestra, durante al menos 10 segundos. Revise la suspensión. Cuando esté
correctamente mezclado, la suspensión tendrá un aspecto uniforme, denso y de color lechoso.
Las microesferas serán visibles en el líquido. Inmediatamente proceda con el siguiente paso para evitar que la suspensión sedimente.
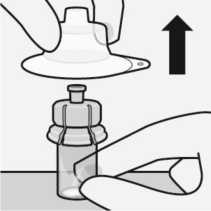
Retirar el adaptador del vial
Sujete la jeringa por el anillo blanco y desenrósquelo del adaptador del vial. Corte la etiqueta del vial por la zona perforada.
Coloque la etiqueta despegada en la jeringa para identificarla.
Deseche
adecuadamente tanto el vial como el adaptador del vial.
MINISTffilODE SANIDAD, POLITICA SOCIAL E IGUALDAD Ajenea espanosa oe máscamenos y
Paso 3
Colocar la aguja
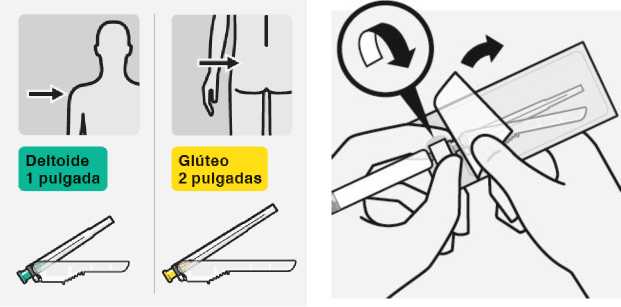
Seleccionar la aguja apropiada
Seleccione la aguja según la zona de inyección (glúteo o deltoides).
Colocar la aguja
Abra la bolsa del blíster por la zona parcialmente despegada y utilícela para coger la base de la aguja, como se muestra. Sujetando el anillo blanco de la jeringa, acople la jeringa al luer (cono) de la aguja con un movimiento firme de rotación en sentido de las agujas del reloj hasta que esté ajustado.
No tocar la abertura del luer de la aguja. Esto puede dar lugar a contaminación.
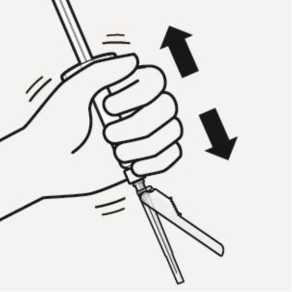
Resuspender las microesferas
Retirar completamente la bolsa del blíster.
Justo antes de la inyección, agite de nuevo enérgicamente la jeringa, por si se ha producido alguna sedimentación.
Paso 4
Inyectar la dosis
MINISTERIODE SANIDAD, POLITICA SOCIAL E IGUALDAD Agencia esparto» de medicamentos y Ofoouctos saltaros
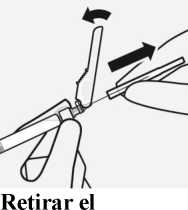
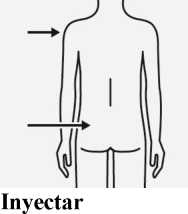
protector transparente de la aguja
Mueva el dispositivo de seguridad de la aguja hacia la jeringa, como se muestra.
Después, sujete el anillo blanco de la jeringa y quite cuidadosamente el protector transparente de la aguja.
No torcer el protector transparente de la aguja, ya que la conexión del luer (cono) se puede perder.
burbujas de aire
Sujetar la jeringa hacia arriba y golpear suavemente para hacer que las burbujas de aire alcancen la parte superior.
Lenta y
cuidadosamente, presione la varilla del émbolo para eliminar el aire.
Inyectar inmediatamente todo el contenido de la jeringa
intramuscularmente (IM) en el glúteo o en el músculo deltoides del paciente.
La inyección gluteal se debe hacer en el cuadrante superior externo del glúteo. No administrar por vía intravenosa.
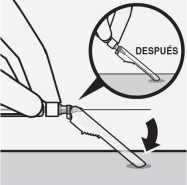
Proteger la aguja en el dispositivo de seguridad
Usando una mano, colocar el dispositivo de seguridad de la aguja con un ángulo de 45 grados, sobre una superficie plana y dura.
Presionar hacia abajo, con un movimiento firme y rápido, hasta que la aguja se encuentre completamente dentro del dispositivo de seguridad.
Para evitar un pinchazo con la aguja:
No usar dos manos. No desenganchar o manipular mal deliveradamente el dispositivo de seguridad de la aguja.
No trate de enderezar la aguja o acoplar el dispositivo de seguridad si la aguja está doblada o dañada.
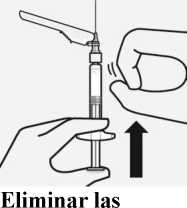
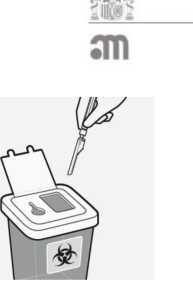
Desechar las agujas de forma apropiada
Comprobar que el dispositivo de seguridad de la aguja está completamente acoplado. Deséchelo en un contenedor para agujas usadas. Deseche también la aguja
proporcionada en el envase de la dosis que no ha usado.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
JANSSEN-CILAG, S.A.
Paseo de Las Doce Estrellas, 5-7 28042 Madrid, España
MINISTRO DE SANIDAD, POLITICA SOCIAL E IGUALDAD e3Ca*C*3 Ce
+34 917228100 +34 917228101
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
Risperdal Consta 25 mg polvo y disolvente para suspensión inyectable: 65.213 Risperdal Consta 37,5 mg polvo y disolvente para suspensión inyectable: 65.215 Risperdal Consta 50 mg polvo y disolvente para suspensión inyectable: 65.214
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 11 de Febrero de 2003 Fecha de la última renovación: 9 de Diciembre de 2014
10. FECHA DE LA REVISIÓN DEL TEXTO
Noviembre 2015
MINISTERIODE SANIDAD, POLITICA SOCIAL E IGUALDAD Agencia esparto» de medicamentos y pfoouctos saltaros
29 de 29