Ribujet 200 Microgramos/Dosis Solucion Para Inhalacion En Envase A Presion
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
RIBUJET, 200 microgramos/dosis, Solución para inhalación en envase a presión. Nueva fórmula sin CFC.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Composición cualitativa y cuantitativa
Cada pulsación de la válvula dosificadora libera una dosis de 200 microgramos de Budesonida.(D.O.E)
Para excipientes, ver apartado 6.1
3. FORMA FARMACÉUTICA Solución para inhalación en envase a presión.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Asma bronquial, en pacientes que previamente no hayan respondido a terapia con broncodilatadores y/o antialérgicos.
4.2 Posología y forma de administración
La dosificación de Ribujet para el tratamiento del asma bronquial debe ser individualizada, no obstante, como orientación general, se recomiendan las siguientes dosis:
200 microgramos (una inhalación) dos veces al día, por la mañana y por la tarde. Durante los períodos de asma grave la dosis diaria puede incrementarse hasta 1600 microgramos, lo que equivale a una o dos inhalaciones hasta 4 veces al día.
En pacientes bien controlados la dosis diaria puede reducirse por debajo de 400 microgramos, pero no debe ser menor de 200 microgramos al día.
En pacientes no corticoide-dependientes: un tratamiento con dosis recomendadas normalmente manifiesta los resultados al cabo de 7 días. Sin embargo, en ciertos pacientes con una excesiva secreción mucosa, es recomendable administrar simultáneamente durante una o dos semanas un corticosteroide oral cuya dosis se reducirá gradualmente hasta continuar solamente con la terapia a base de Budesonida. Las exacerbaciones asmáticas producidas por infecciones bacterianas deben controlarse con una terapia antibiótica y posiblemente incrementando la dosis de Budesonida, o si es necesario, administrando corticoides sistémicos.
En pacientes corticoide-dependientes: el tratamiento con Budesonida debe iniciarse en combinación con la dosis de corticoide oral utilizada hasta entonces y en un período relativamente estable. Esta terapia combinada se prolongará durante unos 10 días, al cabo de los cuales se podrá ir reduciendo la dosis oral de corticoide hasta el mínimo nivel que, en combinación con Budesonida mantenga una capacidad respiratoria estable. En muchos casos, puede retirarse por completo el corticoide oral y dejar al paciente bajo el tratamiento exclusivo con Budesonida. Sin embargo, en caso de que el paciente experimente desasosiego y en situaciones de stress físico tales como infecciones agudas, traumatismos o intervenciones quirúrgicas, deberá reinstaurarse el tratamiento corticoide oral adicional. Las exacerbaciones agudas, acompañadas de
un aumento de la viscosidad mucosa y taponamiento mucoso, requieren tratamiento complementario durante un corto período de tiempo con corticoides orales (ver 4.4 Advertencias y precauciones especiales de empleo).
Nota: Es importante instruir al paciente para que:
• Lea cuidadosamente las instrucciones del prospecto que acompaña a cada inhalador.
• Agite el inhalador vigorosamente.
• Espire lentamente a través de la boquilla.
• Inspire lenta y profundamente y libere la dosis presionando firmemente el inhalador a la vez que continúa inspirando.
• Contenga la respiración tanto tiempo como le sea posible, preferiblemente durante 10 segundos, y luego expulse el aire.
• Se enjuague la boca con agua tras haber inhalado la dosis prescrita para disminuir el riesgo de aparición de candidiasis orofaríngea. (ver apartado 4.4. Advertencias y precauciones especiales de empleo)
4.3 Contraindicaciones
Hipersensibilidad a la Budesonida o a cualquiera de los excipientes.
No debe utilizarse en niños menores de 6 años.
No debe utilizarse en pacientes con tuberculosis pulmonar activa.
4.4 Advertencias y precauciones especiales de empleo
Al inicio del tratamiento con Ribujet, debe advertirse al paciente que este medicamento no debe usarlo para tratar un ataque agudo de asma, sino que es un tratamiento preventivo de la enfermedad asmática. Se advertirá también al paciente que debe seguir el tratamiento con Budesonida de una forma regular a las dosis prescritas diarias, y que los efectos sobre los síntomas del asma puede que no los note hasta pasados unos días e incluso una o dos semanas.
Para prevenir las crisis agudas de asma, los pacientes en tratamiento con Ribujet deben disponer de un broncodilatador para inhalación de corta duración.
Las exacerbaciones agudas del asma pueden necesitar un aumento de las dosis de Budesonida, de un tratamiento adicional con un broncodilatador de corta duración, o incluso requerir la administración de corticosteroides orales y/o un antibiótico si existe infección.
Se advertirá a los pacientes que deben contactar con su médico si su asma empeora (mayor frecuencia de crisis asmáticas y consumo de broncodilatador de corta duración, o síntomas respiratorios persistentes), y se procederá a reevaluar al paciente.
Se debe advertir al paciente que una mejora de su estado clínico no debe llevar a una modificación de su tratamiento, en particular a interrumpir la administración de Budesonida inhalada, sin la supervisión de su médico.
Se tendrá especial precaución en pacientes que hayan padecido tuberculosis pulmonar latente o activa, o con infecciones fúngicas o virales de las vías respiratorias.
Se deberá controlar regularmente el crecimiento de los niños en tratamiento con corticosteroides, y evaluar el beneficio de esta terapia y el control del asma frente a la posibilidad de retraso del crecimiento.
Debe evitarse el tratamiento concomitante con ketoconazol u otros inhibidores potentes de CYP3A4 (ver apartado 4.5 Interacción con otros medicamentos y otras forma de interacción). Si no puede evitarse, debe pasar el mayor tiempo posible entre la administración de los medicamentos que interaccionan entre sí.
Se debe instruir al paciente para que se enjuague la boca con agua después de cada inhalación con el fin de minimizar el riesgo de infección orofaríngea por Candida.
Cualquier corticoide inhalado puede producir efectos sistémicos, sobre todo cuando se prescriben dosis altas durante largos periodos de tiempo. La probabilidad es menor cuando el tratamiento se inhala que cuando se administra por vía oral. Los posibles efectos sistémicos incluyen inhibición de la función suprarrenal, retraso del crecimiento en niños y adolescentes, descenso de la densidad mineral ósea, cataratas y glaucoma.
Una función hepática reducida puede afectar a la eliminación de corticoides. Sin embargo, la farmacocinética intravenosa de la Budesonida es similar en pacientes con cirrosis y en sujetos sanos. La farmacocinética después de la administración oral se vio afectada por una función hepática comprometida, evidenciándose por una disponibilidad sistémica incrementada.
El paso de un tratamiento oral con corticoides a un tratamiento con Budesonida, debe efectuarse con especial precaución, debido principalmente a la lenta normalización de la función hipotalámico-pituitaria-adrenal, previamente alterada por la corticoterapia oral. Esta normalización puede tardar algunos meses en alcanzarse. Durante este cambio de medicación los pacientes pueden recuperar la sintomatología primitiva (rinitis, eczema) o experimentar cansancio, cefaleas, dolores musculares o articulares y ocasionalmente náuseas y vómitos. En estos casos deberá procederse a un tratamiento sintomático complementario. Algunos pacientes pueden sentirse mal de forma no específica durante la fase de retirada de los corticoides sistémicos, apareciendo por ej. mialgias y artralgias.
Se deberá informar a los deportistas que este medicamento contiene un componente que puede establecer un resultado analítico de control de dopaje como positivo.
No se conocen completamente los efectos locales y sistémicos a largo plazo de Ribujet 200 microgramos en humanos. La dosis deberá ajustarse a la menor dosis de mantenimiento eficaz una vez que se ha alcanzado el control del asma. Se recomienda llevar a cabo una monitorización regular de la estatura de los niños que reciben tratamiento prolongado con corticoides inhalados. En caso de una ralentización del crecimiento, se debe volver a evaluar el tratamiento con el objetivo de reducir la dosis de corticoide inhalado. Deben sopesarse los beneficios del tratamiento con corticoides frente a los posibles riesgos de la disminución del crecimiento. Además, debe considerarse diferir al paciente a un neumólogo/alergólogo pediatra.
Los escasos datos obtenidos en los estudios a largo plazo sugieren que los niños y adolescentes tratados con Budesonida inhalada finalmente alcanzan la estatura adulta prevista. Sin embargo, se ha observado una pequeña reducción inicial, pero transitoria, del crecimiento (aproximadamente 1 cm). Esto ocurre generalmente durante el primer año de tratamiento.
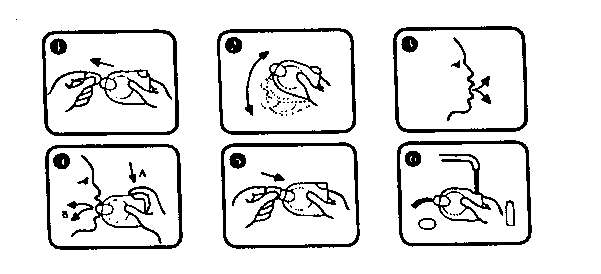
Instrucciones de uso y manipulación
El pulsador-espaciador JET ha sido diseñado para mejorar la eficacia de un inhalador bucal convencional y para facilitar el cumplimiento de la terapia al paciente (sobre todo ancianos y niños) con escasa experiencia en la técnica inhalatoria, evitándoles la sincronización obligada entre la pulsación del inhalador bucal y la inspiración.
El pulsador-espaciador JET reduce también el depósito de principio activo a nivel orofaríngeo, favoreciendo una buena tolerancia local.
Deben seguirse las siguientes instrucciones:
1. Colocar el pulsador-espaciador JET en posición vertical. Retirar el capuchón protector del pulsador-espaciador JET y sujetarlo tal y como muestra la figura.
2. Agitar enérgicamente.
3. Realizar una espiración profunda (expulsar el aire por la nariz).
4. Colocar firmemente entre los labios la boquilla del pulsador-espaciador JET. Presionar con el dedo índice sobre el frasco e inspirar profundamente, incluso después de algunos segundos (con cada pulsación se pueden realizar varias inspiraciones sucesivas a través del JET).
5. Terminada la inspiración, retener la respiración el mayor tiempo posible y cerrar el pulsador-espaciador JET con el capuchón protector.
6. El pulsador-espaciador JET debe mantenerse limpio. La limpieza puede efectuarse con agua tibia después de extraer el frasco, secándolo después.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se ha observado interacción entre la Budesonida y otros fármacos empleados para el tratamiento del asma.
El metabolismo de la Budesonida viene catalizado principalmente por el citocromo CYP 3A, en consecuencia los fármacos inhibidores de dicha enzima, como el Ketoconazol, pueden aumentar la exposición sistémica a Budesonida (ver 4.4 Advertencias y precauciones especiales de empleo).
El ketoconazol (200 mg diarios en dosis únicas) aumentó hasta 6 veces el promedio de los niveles plasmáticos de la Budesonida administrada simultáneamente por vía oral (dosis única de 3 mg). Cuando el ketoconazol se administró 12 horas después de la Budesonida, la concentración sérica de la Budesonida se multiplicó hasta tres veces de media. No se dispone de datos similares cuando la Budesonida se administra inhalada, aunque se puede esperar que los niveles séricos aumenten también considerablemente; por tanto, se debería evitar la administración de ambos fármacos simultáneamente, ya que no se dispone de datos para dar recomendaciones posológicas. Si esto no fuera posible, debería prolongarse el intervalo de tiempo entre la administración de los dos medicamentos o bien reducirse la dosis de Budesonida.
A las dosis recomendadas, la cimetidina posee un efecto leve y clínicamente irrelevante sobre la farmacocinética de la Budesonida oral.
4.6 Fertilidad, embarazo y lactancia
Los estudios en animales han demostrado que los corticoides pueden producir distintos tipos de malformaciones fetales, aunque tales efectos no parecen extrapolables al hombre. No se ha encontrado teratogenia asociada a la Budesonida inhalada en los datos procedentes de aproximadamente 2000 embarazos expuestos y de la experiencia post-comercialización acumulada a nivel mundial.
Los estudios en animales han demostrado que el exceso de glucocorticoides durante el periodo prenatal se relaciona con un riesgo mayor de retraso del crecimiento intrauterino, enfermedad cardiovascular en el adulto y cambios permanentes en la densidad del receptor glucocorticoideo, en la producción de neurotransmisores y en el comportamiento, en exposiciones con dosis por debajo de la dosis teratogénica. Sólo se debería utilizar Ribujet solución para inhalación en envase a presión durante el embarazo cuando los beneficios superen los riesgos potenciales. Debe utilizarse la dosis mínima eficaz de Budesonida necesaria para mantener el control del asma.
Por otra parte, no existen datos demostrativos de un posible paso de la Budesonida a la leche materna durante la lactancia. A pesar de estas consideraciones y por razones de seguridad, se desaconseja su empleo durante el embarazo y la lactancia.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de Ribujet sobre la capacidad para conducir y utilizar maquinas es nula.
4.8 Reacciones adversas
Los ensayos clínicos, publicaciones y la experiencia post-comercialización sugieren que se pueden producir las siguientes reacciones adversas:
Frecuentemente pueden producirse:
- Trastornos del aparato respiratorio
- Infección del tracto respiratorios superior, tos, infección de las vías respiratorias o bronquitis, exacerbación del asma o respiración sibilante.
- Trastornos orofaríngeos
- Ligera irritación de la garganta, tos y ronquera. Estos síntomas son reversibles y desaparecen al reducir la dosis o interrumpir el tratamiento.
- Sobreinfección por Cándida en la cavidad bucal, faringe y laringe. En la mayoría de los casos responde a una terapia antifúngica tópica sin interrumpir el tratamiento. Para prevenir dicho efecto se recomienda enjuagarse la boca tras cada aplicación.
Raramente puede producirse una broncoconstricción en pacientes hipersensibles, que deberá tratarse administrando un agonista beta-2 por inhalación. Con el fin de prevenir el broncoespasmo, es aconsejable administrar a estos pacientes un agonista beta-2 por vía inhalatoria, 5-10 minutos antes de dar Budesonida. Raramente se produce nerviosismo, inquietud, depresión, alteraciones del comportamiento, reacciones de hipersensibilidad inmediata y retardada, incluyendo rash, dermatitis de contacto, urticaria, angioedema y hematomas cutáneos.
En raras ocasiones, con glucocorticoides inhalados se pueden producir signos o síntomas del efecto sistémico de los glucocorticoides, incluyendo hipofunción de la glándula suprarrenal y reducción de la velocidad de crecimiento, dependiendo probablemente de la dosis, tiempo de exposición, exposición concomitante y previa a glucocorticoides, y sensibilidad individual.
4.9 Sobredosis
No es de esperar que la sobredosis aguda con Ribujet 200 microgramos, incluso con dosis muy elevadas, ocasione problemas de carácter clínico. Cuando se utilizan de forma crónica dosis muy elevadas pueden aparecer efectos propios de la administración de glucocorticoides sistémicos tales como hipercorticismo y supresión adrenal.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: R03BA02: Broncodilatadores y otros antiasmáticos por inhalación, glucocorticoides.
La Budesonida es un glucocorticoide que administrado sistemáticamente presenta una actividad glucocorticoide estándar, uniéndose con gran afinidad al receptor glucocorticoide.
Inhibe la adherencia de los neutrófilos y de los monocitos macrófagos a las células endoteliales de los capilares del área inflamada. Bloquea también el efecto del factor de inhibición de migración de los macrófagos y asimismo inhibe la actividad de la fosfolipasa A2 reduciendo de esta manera la formación de prostaglandinas y leucotrienos en el tejido local.
La potencia intrínseca de la Budesonida, medida como la afinidad por el receptor glucocorticoide, es aproximadamente 15 veces superior a la presentada por la prednisolona.
Un estudio clínico en pacientes asmáticos en el que se comparó la administración de la Budesonida por vía oral y por inhalación, evidenció de forma estadísticamente significativa la eficacia de la Budesonida inhalada frente a placebo, mientras que comparando con Budesonida administrada por vía oral no se hallaron diferencias significativas. Ello se explica por la acción directa de la Budesonida inhalada sobre el tracto respiratorio.
La Budesonida ha mostrado efectos antianafilácticos y antiinflamatorios en estudios de provocación realizados tanto en animales como en pacientes, que se manifiestan como una disminución de la obstrucción bronquial producida por las reacciones alérgicas, tanto inmediatas como retardadas.
Exacerbaciones del asma
La Budesonida inhalada, administrada una o dos veces al día, previene eficazmente las exacerbaciones del asma en niños y en adultos.
Asma inducido por ejercicio físico
El tratamiento con Budesonida inhalada ha sido eficaz en la prevención del asma inducido por ejercicio.
Reactividad de las vías aéreas
La Budesonida también disminuye la reactividad de las vías aéreas en pacientes hiperreactivos, tras provocación tanto directa como indirecta
Función del eje hipotalámico-hipofisario-suprarrenal
Los estudios realizados en voluntarios sanos con Budesonida inhalada (administrada en forma de polvo seco) han evidenciado un efecto relacionado con la dosis sobre el cortisol plasmático y urinario. La Budesonida inhalada en forma de polvo seco causa, a las dosis recomendadas, un efecto significativamente menor sobre la función suprarrenal que 10 mg de prednisolona, tal y como se demuestra en las pruebas de estimulación por ACTH.
5.2 Propiedades farmacocinéticas
Absorción
Después de la inhalación a través del envase a presión, alrededor de un 10-15% de la dosis liberada se deposita en los pulmones.
La concentración plasmática máxima después de la inhalación oral de una dosis única de 1 mg de Budesonida es de aproximadamente 2 nmol/l, y se alcanza aproximadamente a los 10 minutos. Se ha estimado que la disponibilidad sistémica de la Budesonida inhalada a través del envase a presión es aproximadamente un 26% de la cantidad dosificada, con una proporción de 2/5 procedente del fármaco deglutido.
Distribución
El volumen de distribución de la Budesonida es aproximadamente de 3 l/kg, y la unión a proteínas plasmáticas oscila entre el 85-90%.
Metabolismo o Biotransformación
La Budesonida sufre un alto grado de biotransformación (aprox. 90%) de primer paso en el hígado dando lugar a metabolitos de baja actividad glucocorticoide. La actividad glucocorticoide de los metabolitos principales, 6p-hidroxiBudesonida y 16 a-hidroxiprednisolona, es inferior a un 1% de la presentada por la Budesonida. El metabolismo de la Budesonida está mediado principalmente por una subfamilia del citocromo p450, la CYP3A.
Eliminación
Los metabolitos de la Budesonida se excretan como tales o en forma conjugada principalmente a través de los riñones. No se ha detectado Budesonida inalterada en la orina. La Budesonida presenta un aclaramiento sistémico elevado (aproximadamente 1,2 l/min), y la vida media tras la administración intravenosa oscila entre las 2 y 3 horas.
Linealidad/ No linealidad
A dosis clínicamente relevantes, la cinética de la Budesonida es proporcional a la dosis.
5.3 Datos preclínicos sobre seguridad
Los resultados de los estudios de toxicidad aguda, subaguda y crónica mostraron que los efectos sistémicos de la Budesonida, por ej. disminución del incremento de peso corporal y atrofia de los tejidos linfoides y de la corteza suprarrenal, son menos graves o similares a los observados tras la administración de otros glucocorticoides.
La Budesonida, evaluada en 6 pruebas analíticas diferentes, no mostró ningún efecto mutagénico o clastogénico.
En un estudio de carcinogénesis en ratas macho se observó una incidencia incrementada de gliomas cerebrales que no se pudo verificar en un segundo estudio repetido, en el que la incidencia de gliomas no se diferenció en ninguno de los grupos de tratamiento activo (Budesonida, prednisolona, acetónido de triamcinolona) y en los grupos control.
Las anomalías hepáticas (neoplasias hepatocelulares primarias), halladas en ratas macho en el estudio de carcinogénesis inicial, se observaron en el segundo estudio con la Budesonida al igual que con los otros glucocorticoides de referencia. Estos efectos están probablemente más relacionados con un efecto sobre el receptor, representando así un efecto de clase.
La experiencia clínica disponible hasta la fecha no indica que la Budesonida u otros glucocorticoides induzcan a la aparición de gliomas cerebrales o neoplasias hepatocelulares primarias en el hombre.
En estudios de reproducción en animales se ha demostrado que los corticoides como la Budesonida inducen malformaciones, como paladar hendido o malformaciones esqueléticas, aunque estos resultados experimentales no parecen ser aplicables al hombre a las dosis recomendadas.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Norflurano (1,1,1,2-tetrafluoroetano, HFA 134a), Etanol, y Glicerol.
6.2 Incompatibilidades No se han descrito.
6.3 Periodo de validez
18 meses
6.4 Precauciones especiales de conservación
No conservar a temperatura superior a 25°C. Evitar el contacto directo con fuentes calóricas intensas.
6.5 Naturaleza y contenido del envase
Envase a presión cerrado con una válvula dosificadora, conteniendo 200 dosis.
6.6 Precauciones especiales de eliminación
No procede
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
CHIESI ESPAÑA, S.A.
Plaqa d’Europa, 41-43, Planta 10 - 08908 L'Hospitalet de Llobregat - Barcelona (España)
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
N° Reg. AEMPS: 60.500
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Septiembre 2004 (Renovación)
10. FECHA DE LA REVISIÓN DEL TEXTO
Septiembre 2004.
8 de 8