Rhinocort 64 Microgramos Suspension Para Pulverizacion Nasal
"I
an
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
RHINOCORT 64 microgramos suspensión para pulverización nasal.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada dosis contiene: budesónida 64 microgramos (1,28 mg/ml) y 396 microgramos de glucosa. Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Suspensión para pulverización nasal.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
RHINOCORT 64 microgramos suspensión para pulverización nasal está indicado en el tratamiento sintomático de la rinitis alérgica estacional o perenne y de la rinitis no alérgica perenne, tanto en adultos como en niños de 6 años o mayores.
Asimismo está indicado para el tratamiento sintomático de la poliposis nasal y para su prevención tras polipectomía en pacientes adultos.
4.2 Posología y forma de administración
La posología debe ser individualizada y ajustarse a la mínima dosis capaz de mantener el control de los síntomas.
Se debe informar al paciente de que el efecto completo de la budesónida no se alcanza hasta después de unos días de tratamiento. El tratamiento de la rinitis estacional, si es posible, debe comenzar antes de la exposición a los alérgenos.
Para la forma de administración, ver apartado 6.6 “Instrucciones de uso y manipulación”.
4.2.1 Rinitis alérgica estacional y perenne, rinitis no alérgica perenne:
Adultos, ancianos y niños de 6 ó más años: La dosis inicial recomendada es de 256 microgramos diarios. Esta dosis puede administrarse como dos aplicaciones (2 x 64 microgramos) en cada fosa nasal una vez al día por la mañana o una aplicación (1 x 64 microgramos) en cada fosa nasal, por la mañana y por la noche.
La dosis diaria máxima recomendada es de 256 microgramos. Se desconoce la eficacia/seguridad de la administración de dosis superiores.
Una vez conseguidos los efectos clínicos deseados, normalmente al cabo de 1-2 semanas, la dosis de mantenimiento debe reducirse a la mínima necesaria para controlar los síntomas.
Los pacientes con rinitis alérgica estacional deberían iniciar el tratamiento con anterioridad a la exposición a los alergenos. Puede resultar necesario el tratamiento concomitante para el control de los síntomas oculares debidos a la alergia.
Es posible que el paciente note alivio de los síntomas desde el primer día de tratamiento con RHINOCORT 64 microgramos; sin embargo, pueden ser necesarios varios días de tratamiento para que se produzca el efecto completo (en ocasiones hasta 2 semanas).
4.2.2 Tratamiento de la poliposis nasal/prevención tras polipectomía:
La dosis recomendada es de 256 microgramos diarios, que pueden administrarse como dos aplicaciones (2 x 64 microgramos) en cada fosa nasal una vez al día por la mañana o una aplicación (1 x 64 microgramos) en cada fosa nasal, por la mañana y por la noche.
Una vez conseguidos los efectos clínicos deseados, la dosis de mantenimiento debe reducirse a la mínima necesaria para controlar los síntomas.
4.2.3 Insuficiencia renal y/o hepática:
No es necesario realizar ajuste de dosis (ver apartado 4.4 “Advertencias y precauciones especiales de empleo”).
4.2.4 Niños de edad inferior a 6 años:
No se ha establecido la seguridad y la eficacia del tratamiento con RHINOCORT 64 microgramos en este grupo de edad.
4.2.5 Forma de administración:
Ver apartado 6.6 “Instrucciones de uso y manipulación”.
4.3 Contraindicaciones
- Hipersensibilidad a la budesónida o a alguno de los excipientes.
- Infección localizada no tratada que afecte a la mucosa nasal.
4.4 Advertencias y precauciones especiales de empleo
El uso de dosis excesivas, o el tratamiento a largo plazo con glucocorticoides por vía nasal puede desencadenar signos o síntomas de hipercorticalismo, supresión de la función del eje hipotalámico-hipofisario-suprarrenal y/o supresión del crecimiento en niños. Pueden producirse efectos sistémicos propios de los corticosteroides nasales, sobre todo cuando se prescriben dosis altas durante largos períodos de tiempo. La probabilidad es menor que con corticosteroides orales y puede variar en función de cada paciente y entre los diferentes tipos de corticosteroides. Los efectos sistémicos potenciales pueden incluir Síndrome de Cushing, características Cushingoides, inhibición de la función suprarrenal, retraso del crecimiento en niños y adolescentes, cataratas, glaucoma. Y más raramente una variedad de efectos psicológicos o de comportamiento como hiperactividad psicomotora, trastornos del sueño, ansiedad, depresión y/o agresividad (especialmente en niños). Se recomienda especial precaución en pacientes previamente tratados con esteroides por vía sistémica, ya que el paso a la administración de budesónida por vía nasal puede desencadenar la aparición de insuficiencia suprarrenal. En este caso, se deberá volver a instaurar la administración por vía sistémica y se adoptarán las medidas de apoyo necesarias; sobre todo, si adicionalmente concurren situaciones de estrés, tales como cirugía, infección sistémica etc. Asimismo, algunos pacientes pueden experimentar inicialmente síntomas de retirada como dolor articular y/o muscular, cansancio y depresión. Se deberá tener también especial cuidado si se sospecha que el paciente pudiera tener su función suprarrenal alterada.
La función hepática reducida afecta a la eliminación de los glucocorticoides, causando una disminución de la tasa de eliminación y un aumento a la exposición sistémica. Debe ser consciente de los posibles efectos sistémicos secundarios. Sin embargo, la farmacocinética intravenosa de budesónida es similar en pacientes
t<áp.
alga
•m
cirróticos y en sujetos sanos. La farmacocinética tras la ingestión oral de budesónida se vio afectada por la función hepática comprometida, tal como evidencia la mayor disponibilidad sistémica. Sin embargo, este hecho tiene una importancia clínica limitada para RHINOCORT 64 microgramos ya que, tras la inhalación nasal, la contribución oral a la disponibilidad sistémica es relativamente pequeña.
RHINOCORT 64 microgramos no debe ser administrado a pacientes con tuberculosis pulmonar si dichos pacientes no están sometidos a un tratamiento anti-tuberculoso adecuado. Es necesario tener especial precaución en pacientes con tuberculosis pulmonar activa o latente y en pacientes con infección fúngica o vírica de las vías respiratorias.
No se conocen completamente los efectos a largo plazo de los glucocorticoides nasales en niños. Se recomienda llevar a cabo un seguimiento regular de la estatura de los niños que reciben tratamiento prolongado con corticosteroides por vía nasal. Si el crecimiento es más lento, se debe reevaluar la terapia con el fin de reducir la dosis de corticosteroides nasales. Deben sopesarse cuidadosamente los beneficios del tratamiento con corticosteroides frente a los posibles riesgos de la disminución del crecimiento. Se debe evaluar también la posibilidad de derivar al paciente a un especialista en neumología pediátrica. Se han notificado casos de retraso del crecimiento en niños que reciben corticosteroides por vía nasal a las dosis autorizadas.
En tratamientos de larga duración se recomienda efectuar una revisión de la mucosa nasal, al menos una vez al año. Se han descrito casos de alteración de la mucosa nasal y más raramente de perforación del tabique nasal, así como de aumento de la presión intraocular tras el uso de corticoides por vía nasal.
La administración de RHINOCORT 64 microgramos debe interrumpirse en caso de cirugía nasal o traumatismo nasal, en tanto no ocurra la cicatrización.
Debe evitarse el contacto del producto con los ojos. En caso de que se produzca contacto con los ojos, el paciente debe lavarlos inmediatamente con agua abundante.
Advertencias:
Se deberá advertir a los deportistas que RHINOCORT 64 microgramos contiene budesónida, que puede dar lugar a un resultado positivo en los tests de control de dopaje.
RHINOCORT 64 microgramos suspensión para pulverización nasal contiene 396 microgramos de glucosa por dosis, lo que deberá ser tenido en cuenta cuando se administre a pacientes diabéticos.
Por contener sorbato de potasio como excipiente, es perjudicial para pacientes con dietas pobres en potasio. El exceso de potasio puede producir, después de la administración oral, molestias de estómago y diarrea.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han registrado casos de interacción entre la budesónida y los fármacos empleados en el tratamiento de la rinitis.
El metabolismo de la budesónida está mediado principalmente por el CYP3A, por lo que los inhibidores de esta enzima, como el ketoconazol y el itraconazol, pueden incrementar varias veces la exposición sistémica a la budesónida. Puesto que no existen datos para avalar una recomendación concreta de dosificación, en principio debería evitarse esta combinación. Si esto no fuera posible, el periodo entre ambos tratamientos debe prolongarse en el tiempo e incluso se podría considerar una reducción de la dosis de budesónida.
En mujeres que están en tratamiento concomitante con estrógenos y esteroides anticonceptivos, se ha observado un aumento de las concentraciones plasmáticas y del efecto de los corticoides. Sin embargo, este efecto no se observa a dosis bajas de anticonceptivos orales combinados.
*2
Jll^a
sm
Es necesario tener en cuenta que, puesto que la función suprarrenal puede estar inhibida, la realización del test de estímulo con ACTH para el diagnóstico de insuficiencia hipofisaria podría dar como resultado valores falsos (más bajos de los reales).
A las dosis recomendadas, la cimetidina posee un ligero efecto, aunque clínicamente no significativo, sobre la farmacocinética de budesónida.
4.6 Fertilidad, embarazo y lactancia
Embarazo:
Los resultados procedentes de estudios epidemiológicos prospectivos y de la experiencia postcomercialización mundial, indican que no existe un riesgo mayor de malformaciones congénitas generales debidas al uso de la budesónida inhalada o intranasal durante las primeras etapas del embarazo. Como con otros fármacos, la administración de budesónida durante el embarazo, requiere que se sopesen los beneficios para la madre frente a los riesgos para el feto.
Lactancia:
La budesónida es excretada por la leche materna, pero no se esperan efectos en los niños lactantes con dosis terapéuticas de RHINOCORT. RHINOCORT puede ser utilizado durante la lactancia.
La exposición sistémica a la budesónida en niños lactantes se considera insignificante cuando la madre es tratada con las dosis de mantenimiento de budesónida inhalada (200 ó 400 microgramos dos veces al día.
En un estudio farmacocinético, la dosis diaria estimada para el lactante fue del 0,3% de la dosis diaria materna, en cualquiera de los dos niveles de dosificación, y la concentración plasmática promedio en los lactantes se estimó en 1/600 de las concentraciones observadas en el plasma materno, suponiendo una biodisponibilidad oral del lactante completa. Las concentraciones de budesónida en muestras de plasma infantil fueron inferiores al límite de cuantificación.
Basándose en datos obtenidos de la budesónida inhalada y el hecho de que la budesónida presenta propiedades pK lineales dentro del intervalo de dosis terapéuticas después una administración nasal, inhalada, oral y rectal, a dosis terapéuticas de budesónida, la exposición para el lactante se prevé que sea baja.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
RHINOCORT 64 microgramos no afecta la capacidad de conducir ni utilizar máquinas.
4.8 Reacciones adversas
Pueden ocurrir reacciones adversas sistémicas, especialmente cuando el medicamento se utiliza a dosis altas durante un período prolongado de tiempo.
En niños tratados con esteroides intranasales se ha notificado retraso en el crecimiento.
Los ensayos clínicos realizados, los informes publicados y la experiencia demostrada tras la comercialización de otras concentraciones de RHINOCORT sugieren que pueden producirse las siguientes reacciones adversas, clasificadas por categorías de sistema orgánico y por orden de frecuencia decreciente.
En cuanto a la frecuencia de las reacciones adversas, éstas se definen como: muy frecuentes (>1/10); frecuentes (>1/100 a <1/10); poco frecuentes (>1/1.000 a <1/100); raras (>1/10.000 a <1/1.000); muy raras (<1/10.000)
|
Sistema orgánico |
Frecuencia |
Reacción adversa |
|
Trastornos del sistema |
Poco frecuentes |
Reacciones de hipersensibilidad |
|
inmunológico |
inmediatas y a largo plazo, como urticaria, erupción, dermatitis, angiodema y prurito | |
|
Muy raras |
Reacción anafiláctica | |
|
Trastornos del sistema endocrino |
Raras |
Signos y síntomas de efectos sistémicos, como inhibición de la función suprarrenal y retraso del crecimiento |
|
Trastornos oculares |
Frecuencia no conocida |
Cataratas |
|
Glaucoma | ||
|
Trastornos respiratorios, torácicos y mediastínicos |
Frecuentes |
Secreción hemorrágica y epistaxis Irritación nasal |
|
Muy raras |
Ulceraciones de la membrana mucosa Perforación del tabique nasal Disfonía |
Pueden producirse efectos sistémicos propios de los corticosteroides nasales, sobre todo a dosis altas durante largos períodos de tiempo (ver sección 4.4).
Población pediátrica:
Se han comunicado casos de retraso del crecimiento en niños que reciben esteroides intranasales. Debido al riesgo de retraso del crecimiento en la población pediátrica, se debería monitorizar el crecimiento tal y como se describe en la sección 4.4.
4.9 Sobredosis
No se espera que la sobredosis aguda con RHINOCORT 64 microgramos, incluso con dosis excesivas, constituya un problema clínico.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
La budesónida es un glucocorticoide que administrado por vía nasal ejerce su acción antiinflamatoria a nivel local.
Código ATC: R01A D05.
No se conoce el mecanismo de acción exacto de los glucocorticoides en el tratamiento de la rinitis. Probablemente sean importantes las actividades antiinflamatorias, tales como la inhibición de la liberación del mediador inflamatorio y la inhibición de las respuestas inmunes mediadas por las citoquinas. La potencia intrínseca de la budesónida, medida como la afinidad al receptor de los glucocorticoides, es de aproximadamente 15 veces mayor que la de prednisolona.
Un estudio clínico en rinitis estacional que comparó budesónida por vía intranasal (inhalador nasal de RHINOCORT (en envase a presión)) y por vía oral con placebo, mostró que el efecto terapéutico de budesónida puede explicarse en su totalidad por la acción local.
t<áp.
alga
•m
En pacientes con rinitis alérgica estacional y perenne, se ha demostrado que RHINOCORT 64 microgramos produce una mejoría en los síntomas nasales (frente a placebo), en un tiempo igual o menor a 10 horas después de la administración de la primera dosis. Este hecho se deduce de dos ensayos doble ciego, controlados con placebo, aleatorios y de grupos paralelos: uno en pacientes con rinitis alérgica estacional, expuestos a polen de ambrosía en una Unidad de Exposición Ambiental; y otro multicéntrico, de cuatro semanas de duración, en pacientes con rinitis alérgica perenne.
La administración profiláctica de budesónida ha mostrado tener efectos protectores frente a lahiperrespuesta y a la eosinofilia inducida por estimulación nasal.
A las dosis recomendadas, RHINOCORT 64 microgramos no produce cambios clínicamente importantes en los niveles de cortisol plasmático basales o en la respuesta a la estimulación con ACTH en pacientes con rinitis. No obstante, en un estudio de 3 semanas de duración en 20 voluntarios sanos de edades comprendidas entre 19 y 27 años, se observó una supresión dosis-dependiente del cortisol en orina y plasma tras la administración a corto plazo de RHINOCORT 64 microgramos.
Población pediátrica
Los datos disponibles sobre la seguridad y eficacia en la población pediátrica de edades comprendidas entre 6 y 17 años son limitados. En un estudio de 4 semanas de duración, que incluyó 406 pacientes de edades comprendidas entre 6 y 73 años, no se observaron diferencias estadísticamente significativas en los niveles de cortisol estimulado por ACTH, desde el inicio hasta después del tratamiento, comparando tratamiento activo con placebo. En otro estudio de 3 semanas de duración, que incluyó 318 pacientes de edades comprendidas entre 12 y 67 años, no se encontraron diferencias significativas en los niveles de cortisol urinario respecto a placebo.
En cuanto a su efecto sobre el crecimiento, los resultados obtenidos en un estudio de 1 año de duración que incluyó 313 pacientes de edades comprendidas entre 6 y 17 años, junto a los datos obtenidos con otras formulaciones de RHINOCORT, permiten concluir que existe un efecto mensurable sobre el crecimiento en niños, motivo por el que se debe controlar periódicamente su talla.
Eficacia clínica
La eficacia terapéutica de RHINOCORT se ha evaluado en varios miles de adultos y niños. La mayoría de los estudios se realizaron con dosis liberadas de RHINOCORT por vía nasal de 32 a 256 pg una vez al día.
A continuación se muestran algunos ejemplos de estudios representativos que evalúan el uso de RHINOCORT para el tratamiento en niños con rinitis alérgica estacional y perenne. La variable de eficacia primaria fue la puntuación combinada de los síntomas nasales (CNSS), que es la suma de las puntuaciones individuales de los tres síntomas nasales (congestión, secreción nasal y estornudos, cada uno valorado en una escala de 0-3).
Rinitis alérgica estacional
En un estudio aleatorizado, doble ciego, controlado con placebo, de grupos paralelos, de 2 semanas de duración, para evaluar la eficacia y seguridad de RHINOCORT 16, 32 y 64 pg una vez al día en 400 niños (de 2 a 5 años de edad) con rinitis alérgica (estacional o perenne), hubo una marcada reducción de los CNSS de referencia en todos los grupos de tratamiento, incluyendo el placebo. La diferencia entre el tratamiento con RHINOCORT 64 pg y el tratamiento con placebo no fue estadísticamente significativa.
Rinitis alérgica _perenne
En un estudio aleatorizado, doble ciego, controlado con placebo, de grupos paralelos, de 6 semanas de duración para evaluar la eficacia y seguridad de RHINOCORT 128 pg una vez al día en 202 niños (de 6 a 16 años de edad) con rinitis alérgica perenne, las variables primarias de eficacia fueron el CNSS y las medidas del pico flujo nasal inspiratorio (PNIF). RHINOCORT mejoró los valores del CNSS y PNIF de forma más estadísticamente significativa que el placebo. El inicio de la acción de RHINOCORT fue de 12 horas después de la primera dosis para el CNSS y 48 horas para el PNIF.
Seguridad clínica
sm
En un estudio de crecimiento, aleatorizado, doble ciego, controlado con placebo, en 229 niños preadolescentes de 4 a 8 años de edad, tratados con RHINOCORT 64 pg o placebo una vez al día durante 12 meses después de un periodo de referencia de 6 meses, la velocidad de crecimiento fue similar entre los grupos tratados con RHINOCORT y con placebo después de 12 meses de tratamiento: la diferencia media en la velocidad de crecimiento (placebo-RHINOCORT) fue 0,27 cm/año (con un intervalo de confianza al 95%: -0,07 a 0,62).
Influencia en la concentración de cortisol en plasma
A las dosis recomendadas, RHINOCORT no causa cambios clínicamente relevantes en la concentración basal de cortisol en plasma o en el test de estimulación ACTH. En voluntarios sanos, después de la administración a corto plazo de RHINOCORT, se observó una supresión dependiente de la dosis de las concentraciones plasmáticas y urinarias de cortisol.
5.2 Propiedades farmacocinéticas
5.2.1 Absorción
La biodisponibilidad sistémica de la budesónida administrada como RHINOCORT 64 microgramos, con respecto a la cantidad dosificada, es de un 33%. En adultos, la concentración plasmática máxima tras la administración de 256 pg de budesónida administrada como RHINOCORT 64 microgramos es de 0,64 nmol/l y se alcanza a las 0,7 horas. El área bajo la curva (AUC) tras la administración de 256 pg de budesónida administrada como RHINOCORT 64 microgramos es 2,7 nmol x h/l en adultos.
5.2.2 Distribución
El volumen de distribución de la budesónida es aproximadamente 3 l/kg. La unión a las proteínas plasmáticas es de un promedio del 85-90%.
5.2.3 Biotransformación
La budesónida experimenta un alto grado de biotransformación (~90%) de primer paso en el hígado dando lugar a metabolitos de escasa actividad glucocorticoide. La actividad glucocorticoide de los principales metabolitos, 6p-hidroxibudesónida y 16a-hidroxiprednisolona, es inferior al 1% respecto a la de budesónida. El metabolismo de la budesónida es mediado principalmente por el CYP3A, perteneciente a la subfamilia del citocromo P450. La budesónida no se metaboliza localmente en la mucosa nasal.
5.2.4 Eliminación
Los metabolitos se excretan, como tales o en su forma conjugada, principalmente por vía renal, aunque con una actividad glucocorticoide notablemente reducida en comparación con el compuesto original. No se ha detectado budesónida intacta en la orina. Por tanto, no se considera necesario realizar un ajuste de dosis en pacientes con insuficiencia renal.
La budesónida posee un alto aclaramiento sistémico (aproximadamente 1,2 l/min) y la semivida plasmática tras una dosis intravenosa tiene un promedio de 2-3 horas.
5.2.5 Linealidad
La cinética de la budesónida es proporcional a la dosis, a dosis clínicamente relevantes.
5.2.6 Población pediátrica
La budesónida tiene un aclaramiento sistémico de aproximadamente 0,5 l/min en niños asmáticos de 4 a 6 años de edad. Por kilogramos de peso corporal, los niños poseen un aclaramiento que es aproximadamente un 50% mayor que en adultos. En niños asmáticos, la semivida terminal de la budesónida después de la
.-ítp.
ÍTTI
inhalación es de aproximadamente 2,3 horas. Esto es casi lo mismo que en adultos sanos. El área bajo la curva (AUC) tras la administración de 256 microgramos de budesónida mediante RHINOCORT 64 microgramos, es de 5,5 nmol*h/l en niños, indicando una mayor exposición sistémica glucocorticoide en niños que en adultos. A las dosis clínicamente recomendadas, la farmacocinética de la budesónida es proporcional a la dosis y la exposición plasmática está relacionada con el peso del paciente. Por lo tanto, al establecer las dosis pediátricas se debe tener esto en cuenta.
5.3 Datos preclínicos sobre seguridad
Los resultados procedentes de los estudios de toxicidad aguda, subaguda y crónica, muestran que los efectos sistémicos de la budesónida, por ejemplo disminución del aumento de peso corporal y atrofia de los tejidos linfoides y corteza suprarrenal, son menos graves o similares a los observados tras la administración de otros glucocorticoides.
La budesónida evaluada en 6 pruebas diferentes, que incluyen las tres pruebas de genotoxicidad convencionales, no manifiesta ningún efecto mutagénico o clastogénico.
La mayor incidencia de gliomas cerebrales en ratas macho observada en un estudio de carcinogénesis no pudo ser confirmada al repetir el estudio, en el cual la incidencia de gliomas no fue diferente entre los grupos con tratamiento activo (budesónida, prednisolona, acetónido de triamcinolona) y los grupos control.
Las alteraciones hepáticas (neoplasmas hepatocelulares primarios), halladas en ratas macho en el primer estudio de carcinogénesis, se observaron también en el segundo estudio, tanto con budesónida como con los glucocorticoides de referencia. Lo más probable es que estos efectos se relacionen con un efecto sobre el receptor representando así un efecto de clase.
La experiencia clínica disponible muestra que no existen indicios de que la budesónida u otros glucocorticoides induzcan la aparición de gliomas cerebrales o neoplasmas hepatocelulares primarios en el hombre.
Los estudios sobre la función reproductora han demostrado que la budesónida, al igual que otros glucocorticoides, está asociada a anomalías en el desarrollo fetal, tales como disminución en el peso corporal y retraso de la osificación y a malformaciones como paladar hendido, etc.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
• Edetato de disodio
• Sorbato de potasio (E 202)
• Glucosa anhidra
• Celulosa microcristalina (E 460)
• Carboximetil celulosa sódica (E 466)
• Polisorbato 80 (E 433)
• Ácido clorhídrico
• Agua purificada.
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
2 años.
an
6.4 Precauciones especiales de conservación
No conservar a temperatura superior a 30 °C. No congelar.
6.5 Naturaleza y contenido del envase
Envase de vidrio marrón de 10 ml conteniendo 120 dosis y provisto de una bomba pulverizadora y un aplicador nasal.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Instrucciones de uso
Antes de utilizar RHINOCORT 64 microgramos por primera vez el paciente leerá atentamente las siguientes instrucciones de uso siguiéndolas cuidadosamente.
Nota: Antes de utilizar el pulverizador nasal de RHINOCORT 64 microgramos por primera vez, agitar el envase y pulsar varias veces (5-10 veces) al aire hasta que empiece a aparecer una pulverización uniforme (ver Figura 1). Si no se utiliza diariamente, es necesario cargar de nuevo la bomba. En este caso, será suficiente realizar una (1) sola pulsación al aire.
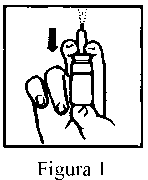
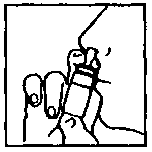
Figura 2
1. Limpiar bien ambas fosas nasales. Agitar el envase. Quitar la tapa marrón.
2. Sostener el envase en posición vertical tal como se muestra en las figuras.
3. Introducir el aplicador en un orificio nasal y liberar las dosis prescritas. Repetir la operación en el otro orificio nasal.
4. Volver a colocar la tapa marrón. No utilizar el pulverizador nasal de RHINOCORT 64 microgramos más veces de lo prescrito.
Limpieza
Limpiar regularmente las piezas superiores de plástico. Para ello, se debe retirar la tapa marrón y extraer el aplicador nasal de color blanco y lavarlos con agua templada, dejándolos secar completamente antes de volverlos a colocar.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
AstraZeneca Farmacéutica Spain, S.A.
C/ Serrano Galvache, 56 Edificio Álamo - 28033 Madrid España
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
N° Registro: 64730
ílMt
ÍTTI
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
26 de Abril de 2002 / Abril 2007
10. FECHA DE LA REVISIÓN DEL TEXTO
Julio 2012
06.Jul.2012 Var IB WS Ped (+ Var II/500) + II CI3b PhVWP / Oct 2006 (CDS) + Jun 2008 (CDS)+Nov.2011 (PWS FAR)
(Álamo)
MiNisrmeoE SANIDAD, POLITICA SOCIAL E IGUALDAD Agencia es paño» de medicamentos y oroouctos sallaros
10 de 10