Respreeza 1000Mg Polvo Y Disolvente Para Solucion Para Perfusion
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas. Ver la sección 4.8, en la que se incluye información sobre cómo notificarlas.
1. NOMBRE DEL MEDICAMENTO
Respreeza 1.000 mg polvo y disolvente para solución para perfusión.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Un vial contiene aproximadamente 1.000 mg de inhibidor de proteinasa alfai humano*, tal como se determina por su capacidad para neutralizar a la elastasa neutrófila (NE, por sus siglas en inglés) humana.
Después de su reconstitución con 20 ml de disolvente, la solución contiene aproximadamente 50 mg/ml de inhibidor de proteinasa alfai humano.
El contenido total de proteínas es de aproximadamente 1.100 mg por vial.
*Producido a partir del plasma de donantes humanos.
Excipiente con efecto conocido:
Respreeza contiene aproximadamente 1,9 mg de sodio por ml de solución reconstituida (81 mmol/l). Para consultar la lista completa de excipientes, ver la sección 6.1.
3. FORMA FARMACEUTICA
Polvo y disolvente para solución para perfusión.
El polvo es de color blanco a blanquecino. El disolvente es una solución transparente e incolora.
La osmolalidad de la solución reconstituida tiene un valor aproximado de 279 mOsmol/kg y un pH de 7,0.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Respreeza está indicado para el tratamiento de mantenimiento, para disminuir la progresión de enfisema en adultos con un grave déficit del inhibidor de proteinasa alfai documentado (p. ej., genotipos PiZZ, PiZ(nulo), Pi(nulo,nulo), PiSZ). Los pacientes deben recibir un tratamiento óptimo farmacológico y no farmacológico, así como mostrar signos de una enfermedad pulmonar progresiva (p. ej., un volumen espiratorio forzado por segundo (VEFj) más bajo del previsto, deterioro en la capacidad para andar o un mayor número de exacerbaciones) según se evalúe por un profesional sanitario con experiencia en el tratamiento del déficit del inhibidor de proteinasa alfai.
4.2 Posología y forma de administración
Se deben administrar las primeras perfusiones bajo la supervisión de un profesional sanitario con experiencia en el tratamiento del déficit del inhibidor de proteinasa alfai. Las subsiguientes perfusiones las podrá administrar un cuidador o el paciente (ver sección 4.4).
Posología
La dosis recomendada de Respreeza es de 60 mg/kg de peso corporal (pc) administrado una vez a la semana.
Población pediátrica
No se ha establecido la seguridad y la eficacia de Respreeza en la población pediátrica (menores de 18 años). No se dispone de datos.
Población de personas de edad avanzada
No se ha establecido la seguridad y la eficacia de Respreeza en los pacientes de edad avanzada (65 años de edad o mayores) en ensayos clínicos específicos.
Pacientes con insuficiencia renal o hepática
No se han realizado investigaciones especiales. No se puede recomendar en estos pacientes un régimen de dosis alternativo.
Forma de administración
Solo se debe administrar Respreeza por perfusión intravenosa después de su reconstitución.
El polvo se debe reconstituir con agua para preparaciones inyectables (ver las instrucciones sobre reconstitución en la sección 6.6) y filtrarse durante la administración utilizando un equipo de administración por vía intravenosa con un filtro adecuado para perfusión (tamaño de poro recomendado de 5 micrómetros (pm)).
La solución reconstituida se debe administrar por perfusión intravenosa mediante el uso de una línea separada dedicada para este fin a una velocidad de perfusión de alrededor de 0,08 ml/kg de pc/min. Se podrá ajustar esta velocidad de perfusión en función de la tolerabilidad del paciente. La perfusión de la dosis recomendada de 60 mg/kg pc tardará aproximadamente 15 minutos en completarse.
Cada vial de Respreeza es para un solo uso.
Para información detallada sobre la administración de la solución reconstituida, consulte las instrucciones al final del prospecto.
4.3 Contraindicaciones
• Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1 (ver también la sección 4.4).
• Pacientes con déficit de inmunoglobina del tipo A (IgA) con anticuerpos conocidos frente a IgA, debido al riesgo de que se manifiesten graves reacciones de hipersensibilidad y anafilácticas.
4.4 Advertencias y precauciones especiales de empleo
Se debe seguir la velocidad de perfusión recomendada indicada en la sección 4.2. Durante las primeras perfusiones se debe monitorizar estrechamente el estado clínico del paciente, incluidas las constantes vitales, durante todo el período de perfusión. De presentarse cualquier reacción que pudiera guardar alguna relación con la administración de Respreeza, se debe disminuir la velocidad de perfusión o interrumpirse la administración, según proceda en función de la condición clínica del paciente. Si los síntomas disminuyen pronto después de la interrupción, se puede reanudar la perfusión a una velocidad más baja que sea cómoda para el paciente.
Hipersensibilidad
Se pueden presentar reacciones de hipersensibilidad, incluso en los pacientes que han tolerado un tratamiento previo con un inhibidor de proteinasa alfai humano.
Respreeza puede contener trazas de IgA. Los pacientes con deficiencia de IgA selectiva o grave pueden desarrollar anticuerpos contra IgA y, por lo tanto, tienen mayor riesgo de desarrollar hipersensibilidad potencialmente grave y reacciones anafilácticas.
Es posible que las presuntas reacciones alérgicas o de tipo anafiláctico precisen de la interrupción inmediata de la perfusión, en función del tipo y la intensidad de la reacción. En caso de shock, se debe administrar el tratamiento médico de emergencia.
T ratamiento domiciliario/autoadministración
Se dispone de datos limitados sobre el uso de este medicamento en forma de tratamiento domiciliario/autoadministración.
Los posibles riesgos asociados al tratamiento domiciliario/autoadministración se relacionan con la manipulación y la administración del medicamento, así como con el manejo de las reacciones adversas, especialmente la hipersensibilidad. Se debe informar a los pacientes de los síntomas de las reacciones de hipersensibilidad.
La decisión de que un paciente sea apto para el tratamiento domiciliario/autoadministración la toma el médico prescriptor, que se asegurará que se proporciona la formación adecuada (p. ej., sobre la reconstitución, uso del dispositivo de transferencia o filtro, montaje del equipo de línea intravenosa, técnicas de perfusión, registro diario del tratamiento, identificación de reacciones adversas y medidas a tomar en caso de que se presenten dichas reacciones) y se revisa el uso a intervalos regulares.
Agentes transmisibles
Entre las medidas estándar para prevenir infecciones derivadas del uso de medicamentos preparados a partir de sangre o plasma humano se encuentran la selección de los donantes, el examen de las donaciones individuales y de las mezclas de plasma con el fin de detectar marcadores específicos de infecciones y la inclusión de etapas de fabricación efectivas para la inactivación o eliminación de virus. A pesar de estas medidas, al administrar medicamentos preparados con sangre o plasma humano no se puede excluir completamente la posibilidad de transmitir agentes infecciosos. Esto también es aplicable a virus desconocidos o de reciente aparición y a otros patógenos.
Las medidas adoptadas se consideran eficaces para los virus encapsulados como el virus de la inmunodeficiencia humana (VIH), el virus de la hepatitis B (VHB) y el virus de la hepatitis C (VHC), y para los virus no encapsulados de la hepatitis A (VHA) y el parvovirus B19.
Se debe considerar una vacunación apropiada (hepatitis A y B) en pacientes que reciben regular/repetidamente inhibidores de proteinasa derivados de plasma humano.
Se recomienda encarecidamente que cada vez que se administre Respreeza a un paciente, se registre el nombre y el número de lote del producto para mantener una conexión entre el paciente y el lote del producto.
Tabaquismo
El humo del tabaco es un importante factor de riesgo para el desarrollo y la progresión de enfisema. Por lo que se recomienda encarecidamente que se cese el hábito de fumar y se evite el humo ambiental del tabaco.
Contenido de sodio
Respreeza contiene aproximadamente 1,9 mg (<1 mmol) de sodio por ml de solución reconstituida, lo que deberá tenerse en cuenta en el tratamiento de pacientes con dietas pobres en sodio.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios de interacciones.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No se han realizado estudios con Respreeza relacionados con la reproducción en animales, y en ensayos clínicos controlados no se ha establecido su seguridad para uso en el embarazo humano. Debido a que el inhibidor de proteinasa alfa1 es una proteína humana endógena, se considera improbable que Respreeza cause daño en el feto cuando se administran las dosis recomendadas. No obstante, Respreeza se debe administrar con precaución a mujeres embarazadas.
Lactancia
Se desconoce si Respreeza/ metabolitos se excretan en la leche materna. No se ha estudiado en animales la excreción en la leche del inhibidor de proteinasa alfa1. Se debe decidir si es necesario continuar/interrumpir la lactancia o continuar/interrumpir el tratamiento con Respreeza tras considerar el beneficio de la lactancia para el niño y el beneficio del tratamiento con el inhibidor de proteinasa alfa1 humano para la madre.
Fertilidad
No se han realizado estudios sobre fertilidad animal con Respreeza, y en ensayos clínicos controlados no se ha establecido su efecto en la fertilidad humana. Debido a que el inhibidor de proteinasa alfa1 humano es una proteína humana endógena, no se prevé que cause efectos adversos en la fertilidad cuando se administran las dosis recomendadas.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
Se puede presentar mareo después de la administración de Respreeza (ver sección 4.8). Por tanto, la influencia de Respreeza sobre la capacidad para conducir y utilizar máquinas es pequeña.
4.8 Reacciones adversas
Resumen del perfil de seguridad
Se han observado reacciones de hipersensibilidad o alérgicas durante el tratamiento. En los casos más graves, las reacciones alérgicas se pueden agravar y convertir en reacciones anafilácticas graves incluso cuando el paciente no haya mostrado ninguna hipersensibilidad a administraciones previas (ver sección 4.4).
Tabla de las reacciones adversas
En la siguiente tabla se presentan las reacciones adversas (RA) que se recopilaron en seis estudios clínicos en 221 pacientes y en la experiencia poscomercialización, de acuerdo al Sistema de Clasificación de órganos (SOC [por sus siglas en inglés] y los Niveles de términos preferentes [PT]) de MedDRA. Se ha evaluado la frecuencia por paciente (basándose en seis meses de exposición durante los ensayos clínicos) conforme al siguiente criterio: frecuentes (>1/100 a <1/10), poco frecuentes (>1/1.000 a < 1/100) y muy raras (< 1/10.000). La frecuencia de las RA se considera como "no conocida (no puede estimarse a partir de los datos disponibles)” únicamente durante la poscomercialización.
Las reacciones adversas se presentan en orden descendiente de gravedad dentro de cada intervalo de frecuencia.
Frecuencia de las reacciones adversas (RA) en estudios clínicos y la experiencia de poscomercialización con Respreeza
|
Sistema de Clasificación de Órganos (SOC) |
Frecuencia de las RA | |||
|
Frecuentes (> 1/100 a < 1/10) |
Poco frecuentes (> 1/1.000 a < 1/100) |
Muy raras (< 1/10.000) |
No conocida | |
|
Trastornos de la sangre y del sistema linfático |
Dolor en ganglio linfático | |||
|
Trastornos del sistema inmunológico |
Reacciones de hipersensibilidad (incluidas, taquicardia, hipotensión, confusión, síncope, consumo de oxígeno disminuido y edema faríngeo) |
Reacciones anafilácticas | ||
|
Trastornos del sistema nervioso |
Mareo, cefalea |
Parestesia |
Hipoestesia | |
|
Trastornos oculares |
Hinchazón ocular | |||
|
Trastornos vasculares |
Rubefacción | |||
|
Trastornos respiratorios, torácicos y mediastínicos |
Disnea | |||
|
Trastornos gastrointestinales |
Náuseas |
Hinchazón labial | ||
|
Trastornos de la piel y del tejido subcutáneo |
Urticaria, erupción (incluida, exfoliativa y generalizada) |
Hiperhidrosis, prurito |
Hinchazón de cara | |
|
Trastornos generales y alteraciones en el lugar de administración |
Astenia, reacciones en la zona de perfusión (incluido, hematoma en el lugar de perfusión) |
Dolor torácico, escalofríos, pirexia | ||
Población pediátrica
No se ha establecido la seguridad y eficacia en la población pediátrica. No se dispone de datos. Población de edad avanzada
No se ha establecido la seguridad y la eficacia de Respreeza en los pacientes de edad avanzada (65 años de edad o mayores) en ensayos clínicos.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Apéndice V.
4.9 Sobredosis
Se desconocen las consecuencias de una sobredosis.
En caso de sobredosis, se debe mantener al paciente en estrecha observación por si se manifiestan reacciones adversas y disponerse de medidas de soporte según sea necesario.
PROPIEDADES FARMACOLÓGICAS
5.
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Antihemorrágicos, inhibidor de proteinasa, código ATC: B02AB02
El inhibidor de proteinasa alfa1 humano es un constituyente normal de la sangre humana. Presenta un peso molecular de 51 kDa y pertenece a la familia de los inhibidores de la serina proteasa.
Mecanismo de acción
Se sabe que el inhibidor de proteinasa alfa1 es la antiproteasa principal del tracto respiratorio inferior, donde inhibe a la elastasa neutrófila (NE, por sus siglas en inglés). Los individuos sanos producen suficientes niveles del inhibidor de proteinasa alfa1 para controlar a la NE producida por los neutrófilos activados y son, por lo tanto, capaces de prevenir la proteólisis inapropiada del tejido pulmonar por la elastasa neutrófila. Las condiciones que aumentan la acumulación y la activación de los neutrófilos en los pulmones, como las infecciones respiratorias y el tabaquismo, aumentarán a su vez los niveles de la EN. Sin embargo, los individuos con déficit del inhibidor de proteinasa alfa1 endógeno no pueden mantener una defensa antiproteasa apropiada y experimentan una proteólisis más rápida de las paredes alveolares que comienza antes del desarrollo de la enfermedad pulmonar obstructiva crónica clínicamente patente en la tercera o cuarta década.
Efectos farmacodinámicos
La administración de Respreeza aumenta y mantiene los niveles séricos y los niveles en el fluido de revestimiento epitelial pulmonar (ELF, por sus siglas en inglés) del inhibidor de proteinasa alfa1 lo que conduce a la disminución de la progresión de enfisema.
Eficacia clínica y seguridad
Estudios RAPID
Se evaluó la seguridad y la eficacia de Respreeza en un estudio aleatorizado, doble ciego, controlado con placebo, multicéntrico (RAPID) seguido de un estudio abierto de extensión de 2 años (estudio de extensión RAPID). Se aleatorizó a un total de 180 sujetos con déficit del inhibidor de proteinasa alfa1 caracterizado por niveles de dicho inhibidor de proteinasa alfa1 < 11 pM (es decir, < 50 mg/dl según se determina por nefelometría) y signos clínicos de enfisema, para recibir una dosis intravenosa semanal de 60 mg/kg pc de ya sea Respreeza (93 sujetos) o un placebo (87 sujetos) durante 24 meses. El intervalo de edad de los sujetos fue de 31 a 67 años (mediana de edades de 54 años) con niveles iniciales promedio del inhibidor de proteinasa alfa1 de aproximadamente 6,15 pM y una densidad pulmonar TC promedio ajustada por volumen de 47 g/l y 50 g/l para los sujetos que recibieron Respreeza y placebo, respectivamente.
Ciento cuarenta sujetos (76 sujetos tratados con Respreeza y 64 sujetos tratados con placebo en el estudio RAPID) continuaron en el estudio de extensión RAPID y fueron tratados con una dosis semanal de 60 mg / kg de peso corporal por vía intravenosa de Respreeza hasta los 24 meses.
Los estudios investigaron el efecto de Respreeza en la progresión de enfisema, que se evaluó mediante la disminución de la densidad pulmonar, medida por tomografía computarizada (TC).
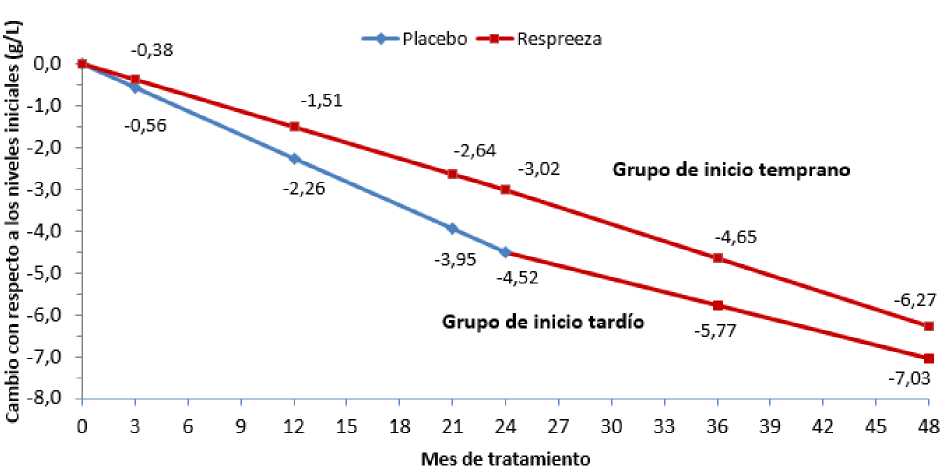
Los sujetos tratados con Respreeza demostraron un patrón uniforme de disminución de la densidad pulmonar más lento que los que recibieron un placebo (ver la Figura 1). La tasa anual de disminución de la densidad pulmonar, según se mide por TC a capacidad pulmonar total (TLC, por sus siglas en inglés) durante 2 años fue más baja con Respreeza (-1,45 g/l) que con un placebo (-2,19 g/l), lo que refleja una reducción del 34 % (p = 0,017, unilateral).
El estudio de extensión RAPID demostró que la disminución de la tasa reducida en la densidad pulmonar se mantuvo en los sujetos tratados de forma continua con Respreeza durante 4 años (ver figura 1).
Cambios en densidad pulmonar (TLC) respecto a los valores iniciales en el estudio RAPID y los estudios de extensión RAPID
Figura 1:
Se han administrado dosis únicas de 120 mg/kg pc a 137 sujetos tratados con Respreeza.
Población pediátrica
La Agencia Europea de Medicamentos ha eximido al titular de la obligación de presentar los resultados de los ensayos realizados con Respreeza en los diferentes grupos de la población pediátrica en la enfermedad pulmonar obstructiva crónica (EPOC) como consecuencia del déficit del inhibidor de proteinasa alfa1 (ver sección 4.2 para consultar la información sobre el uso en la población pediátrica).
5.2 Propiedades farmacocinéticas
Se realizaron cuatro estudios clínicos con Respreeza en 89 sujetos (59 hombres y 30 mujeres) para evaluar el efecto de Respreeza en los niveles séricos del inhibidor de proteinasa alfa1. El intervalo de edad de los sujetos fue de 29 a 68 años (mediana de edades de 49 años). En la selección, las concentraciones séricas del inhibidor de proteinasa alfa1 fueron entre 3,2 y 10,1 pM (media de 5,6 pM).
Se realizó un estudio farmacocinético cruzado, doble ciego, aleatorizado y controlado por activo en 13 hombres y 5 mujeres con déficit del inhibidor de proteinasa alfa1, y edades que oscilaron entre 36 y 66 años. Nueve sujetos recibieron una sola dosis de 60 mg/kg pc de Respreeza seguida por un producto comparador, y 9 sujetos recibieron un producto comparador seguido por una sola dosis de 60 mg/kg pc de Respreeza, con un período de lavado de 35 días entre las dosis. Se tomaron un total de 13 muestras séricas pos-perfusión en varios puntos de tiempo hasta el día 21. La Tabla 1 presenta la media de los resultados para los parámetros farmacocinéticos de Respreeza.
Tabla 1: Parámetros farmacocinéticos del inhibidor de proteinasa alfa1 después de una
sola dosis de 60 mg/kg pc de Respreeza
|
Parámetro farmacocinético |
Media (desviación estándar)* |
|
Área bajo la curva (AUC0.^) |
144 (±27) pM x día |
|
Concentración máxima (Cmáx) |
44,1 (±10,8) pM |
|
Semivida terminal (ti/2B) |
5,1 (± 2,4) días |
|
Aclaramiento total |
603 (± 129) ml/día |
|
Volumen de distribución en el estado estacionario |
3,8 (± 1,3) l |
* n=18 sujetos.
Se realizó un análisis farmacocinético utilizando los datos de 90 sujetos tratados con Respreeza del estudio RAPID. La semivida media estimada de la población fue de 6,8 días. La concentración media en el estado estacionario prevista por el modelo fue de 21,8 pM tras recibir una dosis de 60 mg/kg pc/semana. El análisis farmacocinético de la población no indicó que hubiera ningún efecto significativo de la edad, género, peso o concentraciones séricas iniciales del inhibidor de proteinasa alfa1 antigénico en la depuración de Respreeza.
Relación farmacocinética/farmacodinámica
En un estudio clínico controlado, doble ciego, para evaluar la seguridad y la eficacia bioquímica de Respreeza, fueron aleatorizados 44 sujetos para recibir una dosis intravenosa de 60 mg/kg pc de Respreeza una vez a la semana durante 24 semanas. Las concentraciones séricas mínimas medias del inhibidor de proteinasa alfa1 en el estado estacionario (semanas 7-11) se mantuvieron por encima de 11 pM. La media (desviación estándar) de las concentraciones séricas mínimas, en el estado de equilibrio, del inhibidor de proteinasa alfai para los sujetos tratados con Respreeza fue de 17,7 pM (2.5).
En un subgrupo de sujetos incluidos en este estudio (10 sujetos tratados con Respreeza), se había realizado un lavado broncoalveolar. Las mediciones de las concentraciones del inhibidor de proteinasa alfai en el fluido del revestimiento epitelial (ELF, por sus siglas en inglés) mostraron un aumento uniforme después del tratamiento. Las concentraciones ELF de los complejos del inhibidor de proteinasa alfai antigénico y del inhibidor de proteinasa alfai: elastasa neutrófila (NE) aumentaron con respecto a los valores iniciales. Los niveles de elastasa libre fueron muy bajos en todas las muestras y no se pudieron detectar.
Después de la finalización del estudio RAPID, se realizó un análisis de los valores obtenidos de las concentraciones medianas del inhibidor de proteinasa alfa1 y de la disminución de la densidad pulmonar. Este análisis reveló que existe una relación lineal inversa entre las concentraciones séricas mínimas del inhibidor de proteinasa alfa1 y la disminución anual en densidad pulmonar según se mide por las TC ajustadas por volumen de sujetos que recibieron dosis de 60 mg/kg pc por vía intravenosa de Respreeza.
5.3 Datos preclínicos sobre seguridad
En varios estudios preclínicos se ha evaluado la seguridad de Respreeza. Los datos no clínicos no muestran riesgos especiales para los humanos según los estudios convencionales de farmacología de seguridad y de toxicidad a corto plazo. No se han realizado estudios de toxicidad con dosis repetidas de duración superior a 5 días, estudios de toxicidad para la reproducción ni estudios de carcinogénesis. Dichos estudios no se consideran relevantes debido a la producción de anticuerpos frente a la proteína humana heteróloga en los animales. Puesto que el inhibidor de proteinasa alfa1 humano es una proteína y un constituyente fisiológico de la sangre humana, no cabe esperar que presente efectos carcinogénicos, genotóxicos ni teratogénicos.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Polvo:
Cloruro de sodio
Dihidrógeno fosfato de sodio monohidrato Manitol
Disolvente:
Agua para preparaciones inyectables
6.2 Incompatibilidades
Este medicamento no debe mezclarse con otros, excepto con los mencionados en la sección 6.6.
6.3 Período de validez 3 años.
Desde un punto de vista microbiológico, el producto se debe usar inmediatamente después de su reconstitución. No obstante, se ha demostrado que presenta una estabilidad en uso física y química de 3 h a temperatura ambiente (hasta 25 °C). No congelar la solución reconstituida.
6.4 Precauciones especiales de conservación
No conservar a temperatura superior a 25 °C. No congelar.
Para las condiciones de conservación tras la reconstitución del medicamento, ver sección 6.3.
6.5 Naturaleza y contenido del envase y de los equipos especiales para su administración
Vial de vidrio (tipo I) que contiene 1.000 mg de polvo, con tapón de goma (bromobutilo) y precinto de aluminio con cápsula de cierre de plástico tipo "flip off ".
Vial de vidrio (tipo I) que contiene 20 ml de agua para preparaciones inyectables, con tapón de goma (clorobutilo) y precinto de aluminio con cápsula de cierre de plástico tipo "flip off ".
Cada envase contiene:
Un vial de polvo Un vial de disolvente Un dispositivo de transferencia ventilado Un filtro.
6.6 Precauciones especiales de eliminación y otras manipulaciones
El producto se debe reconstituir, administrar y manipular con precaución utilizando una técnica aséptica para mantener la esterilidad del producto.
Reconstitución mediante el uso del dispositivo de transferencia y el vial de disolvente:
El polvo se debe reconstituir con 20 ml de disolvente (agua para preparaciones inyectables). Se debe reconstituir totalmente en el transcurso de 5 minutos.
Por favor siga las siguientes instrucciones:
Indicaciones sobre el uso del dispositivo de
transferencia:
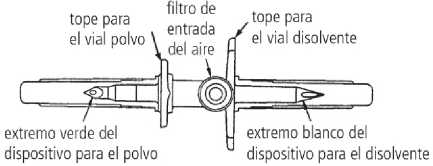
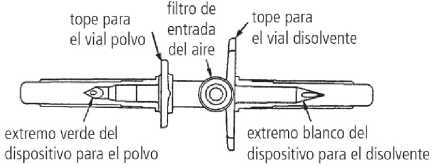
• El dispositivo de transferencia incluido en la caja de Respreeza presenta un extremo de color blanco (para el disolvente) con un orificio doble y un extremo de color verde (para el polvo) con un solo orificio.
• El uso incorrecto del dispositivo de transferencia conducirá a la pérdida del vacío e impedirá la transferencia del disolvente, prolongando o dificultando con ello la reconstitución de Respreeza.
• El dispositivo de transferencia es estéril. Una vez
que se hayan retirado las cubiertas protectoras (Pasos 3 y 4), no toque los extremos expuestos de las puntas._
1. Asegúrese de que el vial de polvo (cápsula de cierre verde) y el vial de disolvente (cápsula de cierre azul) estén a temperatura ambiente (hasta 25 °C).
Esto se puede lograr ya sea dejando los viales a temperatura ambiente alrededor de una hora o sujetándolos entre las manos unos cuantos minutos._
2. Retire las cápsulas de cierre de plástico "flip top" de cada uno de los viales que se vayan a utilizar.
Limpie cada uno de los tapones de goma con una solución antiséptica y déjelos secar.
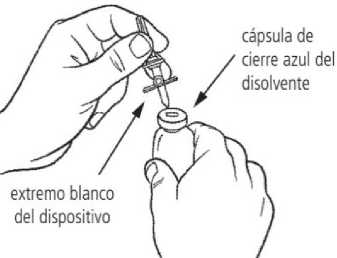
3. Retire la cubierta protectora del extremo blanco del dispositivo de transferencia. Coloque el vial de disolvente sobre una superficie plana e inserte el extremo blanco del dispositivo de transferencia en el centro del tapón del vial de disolvente en posición vertical (cápsula de cierre azul).
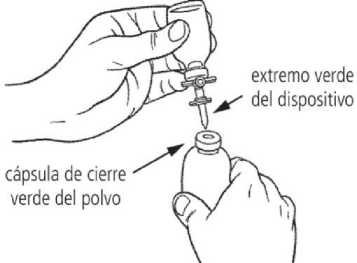
4. Coloque el vial de polvo (cápsula de cierre verde) sobre una superficie plana. Retire la cubierta protectora del extremo verde del dispositivo de transferencia. Invierta el vial del disolvente con el dispositivo de transferencia acoplado y, suavemente, inserte el extremo verde del dispositivo de transferencia en el centro del tapón de goma del vial de polvo en posición vertical (cápsula de cierre verde). El reborde del dispositivo de transferencia se debe apoyar en la superficie del tapón de modo que el disolvente fluya dentro del vial de polvo.
5. Deje que fluya el disolvente al vial de polvo. Esto sucede automáticamente por el vacío en el vial
de polvo. Si no hay vacío en el vial, el disolvente no fluye hacia el vial de polvo. Si este es el caso, no use el producto._
6. Durante la transferencia del disolvente, humecte el polvo totalmente inclinando con cuidado el vial
de polvo._
7. Una vez que haya finalizado la transferencia del disolvente, retire el dispositivo de transferencia del
vial de polvo y deseche el vial de disolvente y el dispositivo de transferencia._
8. Gire suavemente el vial de polvo hasta que el polvo se haya disuelto por completo. No agite para evitar la formación de espuma.
9. Examine visualmente la solución reconstituida. La solución debe ser transparente, incolora a ligeramente amarillenta y estar exenta de partículas visibles. No utilizar soluciones de coloración anormal, turbias o que presenten partículas.
10. Debido a que será necesario utilizar más de 1 vial de polvo para obtener la dosis requerida, repita las instrucciones de 1 a 9 anteriores utilizando un envase adicional que contenga un dispositivo de transferencia. No reutilice el dispositivo de transferencia.
U.Utilice una técnica aséptica para transferir las soluciones reconstituidas de los viales al envase de administración (p. ej., bolsa intravenosa vacía o frasco de vidrio vacío; no suministrado) mediante un equipo de tubos de transferencia intravenosos, disponibles comercialmente (no suministrados).
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
CSL Behring GmbH Emil-von-Behring-Strasse 76 D-35041 Marburg
Alemania
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/15/1006/001
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 20 de agosto de 2015.
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
ANEXO II
A. FABRICANTE(S) DEL (DE LOS) PRINCIPIO(S) ACTIVO(S) BIOLÓGICO(S) Y FABRICANTE(S) RESPONSABLE(S) DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
A. FABRICANTE(S) DEL (DE LOS) PRINCIPIO(S) ACTIVO(S) BIOLÓGICO(S) Y FABRICANTE(S) RESPONSABLE(S) DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección del fabricante del principio activo biológico
CSL Behring LLC
Route 50 North 1201 N. Kinzie
Bradley, IL 60915
Estados Unidos
Nombre y dirección del fabricante responsable de la liberación de los lotes
CSL Behring GmbH Emil-von-Behring-Strasse 76 35041 Marburg Alemania
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica restringida (ver Anexo I: Ficha Técnica o Resumen de las Características del Producto, sección 4.2).
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
Los requerimientos para la presentación de los informes periódicos de seguridad para este medicamento se establecen en la lista de fechas de referencia de la Unión (lista EURD) prevista en el artículo 107quater, apartado 7, de la Directiva 2001/83/CE y publicada en el portal web europeo sobre medicamentos.
El Titular de la Autorización de Comercialización (TAC) presentará el primer informe periódico de seguridad para este medicamento en un plazo de 6 meses después de la autorización.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado en la versión del PGR incluido en el Módulo 1.8.2 de la Autorización de Comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos.
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil
beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
• Obligación de llevar a cabo medidas posautorización
El TAC deberá llevar a cabo, dentro del plazo establecido, las siguientes medidas:
|
Descripción |
Fecha límite |
|
Estudio posautorización de eficacia (EPAE): Se ha convenido realizar un EPAE aleatorizado, a largo plazo, para estudiar la relación de dosis para determinar si los niveles de principio activo más altos obtenidos en sangre podrían influir en la tasa de disminución de la densidad pulmonar y si eso justificaría una mayor dosis de 120 mg/kg. El TAC deberá llevar a cabo y presentar los resultados de un estudio de eficacia aleatorizado, a largo plazo, realizado de conformidad con un protocolo acordado. |
Presentación del informe del estudio clínico final para el 31 de marzo de 2025 |
ANEXO III
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR CAJA EXTERIOR
1. NOMBRE DEL MEDICAMENTO
Respreeza 1.000 mg polvo y disolvente para solución para perfusión Inhibidor de proteinasa alfa1 humano
2. PRINCIPIO(S) ACTIVO(S)
Inhibidor de proteinasa alfa1 humano 1.000 mg
Tras la reconstitución con 20 ml de disolvente, la solución contiene aproximadamente 50 mg/ml del inhibidor de proteinasa alfa1 humano.
3. LISTA DE EXCIPIENTES
Excipientes: cloruro de sodio, dihidrógeno fosfato de sodio monohidrato, manitol.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Polvo y disolvente para solución para perfusión
1 vial de polvo 1 vial de disolvente
1 dispositivo de transferencia ventilado, para la reconstitución 1 filtro
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento. Para vía intravenosa.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD:
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
No conservar a temperatura superior a 25 °C. No congelar.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
CSL Behring GmbH, 35041 Marburg, Alemania
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/15/1006/001
13. NÚMERO DE LOTE
Lote:
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Respreeza
VIAL DE POLVO_
1. NOMBRE DEL MEDICAMENTO
Respreeza 1.000 mg polvo para solución para perfusión Inhibidor de proteinasa alfa1 humano
2. PRINCIPIO(S) ACTIVO(S)
Inhibidor de proteinasa alfa1 humano 1.000 mg
3. LISTA DE EXCIPIENTES
Excipientes: Cloruro de sodio, dihidrógeno fosfato de sodio monohidrato, manitol.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Polvo para solución para perfusión 1.000 mg
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento. Para vía intravenosa.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD:
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
No conservar a temperatura superior a 25 °C. No congelar.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
CSL Behring
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/15/1006/001
13. NÚMERO DE LOTE
Lote:
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
VIAL DE DISOLVENTE_
1. NOMBRE DEL MEDICAMENTO
Disolvente para Respreeza
2. PRINCIPIO(S) ACTIVO(S)
Agua para preparaciones inyectables
3. LISTA DE EXCIPIENTES
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
20 ml
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD:
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
CSL Behring
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/15/1006/001
13. NÚMERO DE LOTE
Lote:
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
B. PROSPECTO
Prospecto: Información para el usuario Respreeza 1.000 mg
Polvo y disolvente para solución para perfusión
Inhibidor de proteinasa alfai humano
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Puede contribuir comunicando los efectos adversos que pudiera usted tener. La parte final de la sección 4 incluye información sobre cómo comunicar estos efectos adversos.
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o profesional sanitario.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o profesional sanitario, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver la sección 4.
Contenido del prospecto:
1. Qué es Respreeza y para qué se utiliza
2. Qué necesita saber antes de empezar a usar Respreeza
3. Cómo usar Respreeza
4. Posibles efectos adversos
5. Conservación de Respreeza
6. Contenido del envase e información adicional
1. Qué es Respreeza y para qué se utiliza Qué es Respreeza
Este medicamento contiene el principio activo inhibidor de proteinasa alfai humano que es un componente normal de la sangre y se encuentra en los pulmones, donde su principal función es proteger al tejido pulmonar limitando la acción de una cierta enzima, llamada elastasa neutrófila. Esta puede causar daño si su acción no se controla (por ejemplo, en caso de que usted padezca un déficit del inhibidor de proteinasa alfa1).
Para qué se utiliza Respreeza
Este medicamento se utiliza en adultos con un déficit grave conocido del inhibidor de proteinasa alfa1 (una afección hereditaria a la que también se le llama déficit de antitripsina alfa1) quienes han desarrollado una afección pulmonar llamada enfisema.
Se desarrolla enfisema cuando la falta del inhibidor de proteinasa alfa1 afecta al adecuado control de la elastasa neutrófila, lo que daña a los diminutos sacos de aire en los pulmones a través de los cuales el oxígeno pasa al organismo. A causa de este daño, los pulmones no funcionan debidamente.
El uso regular de este medicamento aumenta las concentraciones sanguíneas y pulmonares del inhibidor de proteinasa alfa1 disminuyendo así la progresión de enfisema.
2. Qué necesita saber antes de empezar a usar Respreeza NO use Respreeza
• si es alérgico al inhibidor de proteinasa alfai humano o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
• si se ha determinado que usted padece de alguna deficiencia de ciertas proteínas sanguíneas llamadas inmunoglobulinas del tipo A (IgA) y ha desarrollado anticuerpos frente a ellas.
Advertencias y precauciones
Consulte a su médico o profesional de la salud antes de usar Respreeza.
Información sobre reacciones alérgicas: ¿cuándo es necesario detener o disminuir la velocidad de la perfusión?
Es posible que sea alérgico al inhibidor de proteinasa alfai humano aunque haya recibido previamente inhibidores de proteinasa alfai humanos y los haya tolerado bien. En algunos casos se pueden producir graves reacciones alérgicas. Su médico le informará acerca de los signos de las reacciones alérgicas (por ejemplo, escalofríos, enrojecimiento, latido cardíaco más rápido, caída de la presión arterial, mareo, erupción, ronchas, picazón, dificultad para respirar o tragar, así como hinchazón de sus manos, cara o boca) (ver también la sección 4).
Si usted nota dichas reacciones durante la perfusión de su medicamento, advierta a su médico o profesional de la salud de inmediato. En función del tipo y la intensidad de la reacción, puede que su médico decida disminuir la velocidad o detener por completo la perfusión e iniciar el tratamiento apropiado.
En caso de autoadministración/tratamiento domiciliario, detenga la perfusión de inmediato y póngase en contacto con su médico o profesional sanitario.
Información sobre seguridad con respecto a las infecciones
Respreeza se elabora a partir de plasma de sangre humana (esta es la parte líquida de la sangre de la que se han eliminado las células sanguíneas).
Debido a que a través de la sangre se pueden transmitir infecciones, cuando se fabrican medicamentos a partir de la sangre o el plasma humano, se ponen en práctica ciertas medidas para evitar que estas estén presentes en el medicamento y sean transmitidas a los pacientes. Entre dichas medidas figuran las siguientes:
• la selección cuidadosa de los donantes de sangre y plasma con el fin de garantizar la exclusión de las personas que puedan ser portadores de infecciones,
• la realización de pruebas de las muestras de sangre y plasma donados para tratar de evitar el uso de material con signos de virus o infecciones,
• la inclusión de medidas en el procesamiento de la sangre o del plasma que permitan inactivar o eliminar los virus.
Las medidas adoptadas se consideran eficaces para los virus como el virus de la inmunodeficiencia humana (VIH), el virus de la hepatitis A, el virus de la hepatitis B, el virus de la hepatitis C y el parvovirus B19.
Sin embargo, a pesar de estas medidas, al administrar medicamentos preparados a partir de sangre o plasma humano, no se puede excluir completamente la posibilidad de transmitir una infección.
Su médico puede recomendarle que considere la vacunación contra la hepatitis A y B si recibe un tratamiento regular/ repetido con inhibidores de proteinasa derivados de plasma humano.
Se recomienda encarecidamente que cada vez que reciba una dosis de Respreeza se registre el nombre y el número de lote del producto para mantener un registro de los lotes utilizados.
Tabaquismo
Debido a que el humo del tabaco es un importante factor de riesgo para el desarrollo y la progresión de enfisema, se le recomienda encarecidamente que deje de fumar y evite la exposición pasiva al humo del tabaco.
Niños y adolescentes
Este medicamento no es para uso en niños o adolescentes menores de 18 años de edad.
Uso de Respreeza con otros medicamentos
* Informe a su médico o profesional de la salud si está tomando, ha tomado recientemente o podría tener que tomar cualquier otro medicamento.
Embarazo, lactancia y fertilidad
* Si está embarazada o en periodo de lactancia, cree que podría estar o tiene intención de quedarse embarazada, consulte a su médico o profesional de la salud antes de utilizar este medicamento.
Dado que el inhibidor de proteinasa alfa1 es un componente normal de la sangre humana, no se espera que la dosis recomendada de este medicamento ocasione ningún daño al feto en desarrollo. Sin embargo, debido a que no se dispone de información sobre la seguridad del uso de Respreeza durante el embarazo, si usted está embarazada, solo se le debe administrar este medicamento con precaución. No se conoce si Respreeza pasa a la leche materna. Si está dando el pecho a su hijo, su médico le explicará los riesgos y beneficios de usar este medicamento.
No existen datos sobre los efectos en la fertilidad, si bien dado que el inhibidor de proteinasa alfa1 es un componente normal de la sangre humana, no se espera que cause efectos adversos en la fertilidad si usted usa Respreeza a la dosis recomendada.
Conducción y uso de máquinas
Se puede presentar mareo después de la administración de este medicamento. Si siente mareo, no debe conducir ni usar máquinas hasta que el mareo haya pasado (ver sección 4).
Respreeza contiene sodio
Este medicamento contiene 1,9 mg de sodio por ml de solución reconstituida. Su médico o profesional sanitario tendrá esto en cuenta si usted sigue una dieta con control de sodio.
3. Cómo usar Respreeza
Después de la reconstitución, Respreeza se administra por perfusión en una vena. Un profesional sanitario con experiencia en el tratamiento del déficit de inhibidor de proteinasa alfa1 supervisará las primeras perfusiones.
T ratamiento domiciliario/Autoadministración
Después de las primeras perfusiones, usted o una persona encargada de su cuidado podría también administrar Respreeza, pero únicamente después de recibir una formación adecuada. Si su médico decide que usted es apto para dicho tratamiento domiciliario/autoadministración, le enseñará sobre:
• cómo preparar y administrar este medicamento (ver las instrucciones ilustradas al final de este prospecto en “Información para los profesionales de la salud y para los pacientes aptos para el tratamiento domiciliario/autoadministración”)
• cómo mantener el producto estéril (técnicas asépticas de perfusión)
• cómo llevar un registro diario del tratamiento
• cómo identificar los efectos adversos, incluidos los signos de las reacciones alérgicas, y las medidas que deban tomarse en caso de que se manifiesten dichos efectos (ver también la sección 2 y la sección 4)
Su médico o profesional de la salud revisarán regularmente su técnica de perfusión o de la persona encargada de su cuidado para asegurar que se siga actuando adecuadamente.
Dosis
La cantidad de Respreeza que se le administra se basa en su peso corporal. La dosis recomendada es de 60 mg por kg de peso corporal y se debe administrar una vez por semana. La solución de perfusión normalmente se administra durante unos 15 minutos (aproximadamente 0,08 ml de solución por kg de peso corporal cada minuto). En función de su peso y tolerabilidad a la perfusión, su médico determinará la velocidad de perfusión apropiada para usted.
Si usa más Respreeza del que debe
Se desconocen las consecuencias de una sobredosis.
Avise a su médico o profesional sanitario si piensa que ha usado más Respreeza del que debe para que se tomen las medidas adecuadas.
Si olvidó usar Respreeza
Aplique inmediatamente la siguiente dosis y continúe a intervalos regulares siguiendo las indicaciones de su médico o profesional sanitario.
No tome una dosis doble para compensar la dosis olvidada.
Si interrumpe el tratamiento con Respreeza
No deje de usar este medicamento sin consultar antes a su médico o profesional sanitario. Si se suspende el tratamiento con Respreeza, su afección puede empeorar.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran. Estas reacciones adversas se pueden producir aunque usted haya recibido anteriormente inhibidores de proteinasa alfa1 humana y los haya tolerado bien.
Algunos efectos adversos pueden ser graves:
Se han observado reacciones alérgicas poco frecuentes (pueden afectar hasta 1 de cada 100 personas). En algunos casos muy raros (pueden afectar hasta 1 de cada 10.000 personas) pueden llegar a convertirse en reacciones alérgicas graves incluso si no ha mostrado signos de alergia con perfusiones previas.
Advierta a su médico o profesional sanitario de inmediato si usted percibe cualquier signo de reacciones alérgicas (por ejemplo, escalofríos, enrojecimiento, latido cardíaco más rápido, caída de la presión arterial, mareos, erupción, habón urticarial, picazón, dificultad para respirar o tragar, así como hinchazón de sus manos, cara o boca) durante la administración de Respreeza. En función del tipo y la intensidad de la reacción, puede que su médico o profesional sanitario decida disminuir la velocidad o detener por completo la administración e instituir el tratamiento apropiado para la reacción.
En caso de autoadministración/tratamiento domiciliario, detenga la perfusión de inmediato y póngase en contacto con su médico o profesional sanitario.
Otros efectos adversos pueden incluir:
Frecuentes (pueden afectar hasta 1 de cada 10 personas)
Mareos, dolor de cabeza, dificultad para respirar (disnea), náuseas.
Poco frecuentes (pueden afectar hasta 1 de cada 100 personas)
Sensación alterada del tacto como ardor, cosquilleo o sensación de entumecimiento en sus manos, brazos, piernas o pies (parestesia), enrojecimiento, ronchas (urticaria), erupción escamosa y erupción por todo el cuerpo, debilidad física (astenia), reacciones en el lugar de la perfusión (como ardor, pinchazos, dolor, hinchazón o enrojecimiento en el lugar de la perfusión (hematoma)).
Muy raras (pueden afectar hasta 1 de cada 10.000 personas)
Sensación disminuida del tacto como ardor, cosquilleo o sensación de entumecimiento en sus manos, brazos, piernas o pies (hipoestesia), sudoración excesiva (hiperhidrosis), picazón, dolor en el pecho, escalofrío, fiebre (pirexia).
Frecuencia no conocida (no puede estimarse a partir de los datos disponibles)
Dolor en ganglios linfáticos (masas de tejido de forma ovalada que se localizan en todo el cuerpo y que pueden palparse por ejemplo en las axilas, ingle o cuello), hinchazón de cara, ojos y labios.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o profesional de la salud, incluso si se trata de efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Respreeza
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la caja y en las etiquetas de los viales después de CAD. La fecha de caducidad es el último día del mes que se indica.
No conservar a temperatura superior a 25 °C. No congelar.
Después de la reconstitución, la solución deberá utilizarse inmediatamente. Si esto no fuera posible, las soluciones se pueden conservar hasta 3 horas a temperatura ambiente (hasta 25 °C). No congelar la solución reconstituida.
6. Contenido del envase e información adicional Composición de Respreeza
El principio activo es el inhibidor de proteinasa alfai. Un vial contiene aproximadamente 1.000 mg del inhibidor de proteinasa alfa1.
Los demás componentes son cloruro de sodio, dihidrógeno fosfato de sodio monohidrato y manitol (ver el último párrafo de la sección 2).
Disolvente: Agua para preparaciones inyectables.
Aspecto del producto y contenido del envase
Este medicamento es un polvo de color blanco a blanquecino.
Después de que se haya reconstituido con agua para preparaciones inyectables, la solución deberá ser transparente, incolora a ligeramente amarillenta y estar exenta de partículas visibles.
Contenido de un envase:
• 1 vial con polvo
• 1 vial con 20 ml de agua para preparaciones inyectables
• 1 dispositivo de transferencia para la reconstitución
• 1 filtro
Titular de la autorización de comercialización y responsable de la fabricación
CSL Behring GmbH
Emil-von-Behring-Strasse 76
D-35041 Marburg Alemania
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
|
Belgie/Belgique/Belgien CSL Behring NV Tél/Tel: +32 15 28 89 20 |
Lietuva CSL Behring GmbH Tel: +49 69 30584437 |
|
Btnrapnn HoBHMeg OOfl Ten: +359 2 850 86 17 |
Luxembourg/Luxemburg CSL Behring NV Tél/Tel: +32 15 28 89 20 |
|
Ceská republika CSL Behring s.r.o. Tel: +420 702 137 233 |
Magyarország CSL Behring Kft. Tel.: +36 1 213 4290 |
|
Danmark CSL Behring AB Tel: +46 8 544 966 70 |
Malta AM Mangion Ltd. Tel: +356 2397 6333 |
|
Deutschland CSL Behring GmbH Tel: +49 69 30584437 |
Nederland CSL Behring BV Tel: +31 85 111 96 00 |
|
Eesti CSL Behring GmbH Tel: +49 69 30584437 |
Norge CSL Behring AB Tlf: +46 8 544 966 70 |
|
EXláda CSL Behring EnE Tpk: +30 210 7255 660 |
Osterreich CSL Behring GmbH Tel: +43 1 80101 2463 |
|
España CSL Behring S.A. Tel: +34 933 67 1870 |
Polska CSL Behring Sp. z.o.o. Tel.: +48 22 213 22 65 |
|
France CSL Behring SA Tél: +33 1 53 58 54 00 |
Portugal CSL Behring Lda Tel: +351 21 782 62 30 |
|
Hrvatska PharmaSwiss d.o.o. Tel: +385 1 631 1833 |
Romania Nicopharma Distribution Group Tel.: +40 21 327 2614 |
|
Ireland CSL Behring UK Ltd. Tel: +44 1444 447405 |
Slovenija MediSanus d.o.o. Tel: +386 1 25 71 496 |
|
Ísland CSL Behring AB Sími: +46 8 544 966 70 |
Slovenská republika CSL Behring s.r.o. Tel: +421 911 653 862 |
|
Italia CSL Behring S.p.A. Tel: +39 02 34964 200 |
Suomi/Finland CSL Behring AB Puh/Tel: +46 8 544 966 70 |
Fecha de la última revisión de este prospecto: MM/AAAA
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
La siguiente información está destinada a profesionales de la salud y a pacientes aptos para el tratamiento domiciliario/autoadministración
Reconstitución y administración de Respreeza
El producto se debe reconstituir, administrar y manipular con precaución utilizando una técnica aséptica para mantener la esterilidad del producto.
Por favor siga las siguientes instrucciones:
Reconstitución
El polvo se debe reconstituir con 20 ml de disolvente (agua para preparaciones inyectables). Se debe reconstituir totalmente en el transcurso de 5 minutos.
Indicaciones sobre el uso del dispositivo de
transferencia:
• El dispositivo de transferencia incluido en la caja de Respreeza presenta un extremo de color blanco (para el disolvente) con un orificio doble y un extremo de color verde (para el polvo) con un solo orificio.
• El uso incorrecto del dispositivo de transferencia conducirá a la pérdida del vacío e impedirá la transferencia del disolvente, prolongando o dificultando con ello la reconstitución de Respreeza.
• El dispositivo de transferencia es estéril. Una vez
que se hayan retirado las cubiertas protectoras (Pasos 3 y 4), no toque los extremos expuestos de las puntas._
1. Asegúrese de que el vial de polvo (cápsula de cierre verde) y el vial de disolvente (cápsula de cierre azul) estén a temperatura ambiente (hasta 25 °C).
Esto se puede lograr ya sea dejando los viales a temperatura ambiente alrededor de una hora o sujetándolos entre las manos unos cuantos minutos._
2. Retire las cápsulas de cierre de plástico "flip top" de cada uno de los viales que se vayan a utilizar.
Limpie cada uno de los tapones de goma con una solución antiséptica y déjelos secar._
|
3. Retire la cubierta protectora del extremo blanco del dispositivo de transferencia. Coloque el vial de disolvente sobre una superficie plana e inserte el extremo blanco del dispositivo de transferencia en el centro del tapón del vial de disolvente en posición vertical (cápsula de cierre azul). |
/ cápsula de / / cierre azul del / y disolvente extremo blanco Y 1 \ de! dispositivo i ■) | |
|
una superficie plana. Retire la cubierta protectora del extremo verde del dispositivo de transferencia. Invierta el vial del disolvente con el dispositivo de transferencia acoplado y, suavemente, inserte el extremo verde del dispositivo de transferencia en el centro del tapón de goma del vial de polvo en posición vertical (cápsula de cierre verde). El reborde del dispositivo de transferencia deberá apoyarse en la superficie del tapón de modo que el disolvente fluya dentro del vial de polvo. |
extremo verde del dispositivo cápsula de cierre verde de! polvo yy 1 ' r) | |
|
5. Deje que fluya el disolvente al vial de polvo. Esto sucede automáticamente por el vacío en el vial de polvo. Si no hay vacío en el vial el disolvente no fluye hacia el vial de polvo. Si este es el caso, no use el producto. | ||
|
6. Durante la transferencia del disolvente, humecte el polvo totalmente inclinando con cuidado el vial de polvo. | ||
|
7. Una vez que haya finalizado la transferencia del disolvente, retire el dispositivo de transferencia del vial de polvo y deseche el vial de disolvente y el dispositivo de transferencia. | ||
|
8. Gire suavemente el vial de polvo hasta que el polvo se haya disuelto por completo. No agite para evitar la formación de espuma. |
cjob | |
|
9. Examine visualmente la solución reconstituida. La solución deberá ser transparente, incolora a ligeramente amarillenta y estar exenta de partículas visibles. No utilizar soluciones de coloración anormal, turbias o que presenten partículas. | ||
|
10.Debido a que será necesario utilizar más de 1 vial de polvo para obtener la dosis requerida, repita las instrucciones de 1 a 9 anteriores utilizando un envase adicional que contenga un dispositivo de transferencia. No reutilice el dispositivo de transferencia. | ||
|
11.Utilice una técnica aséptica para transferir las soluciones reconstituidas de los viales al envase de administración (p. ej., bolsa intravenosa vacía o frasco de vidrio vacío; no suministrados) mediante un equipo de tubos de transferencia intravenosos, disponibles comercialmente (no suministrados). | ||
Administración
La solución reconstituida se debe filtrar durante la administración utilizando un filtro adecuado para perfusión (tamaño de poro recomendado de 5 micrómetros) y un equipo de administración intravenosa (no suministrado).
1. Conecte el equipo de administración al envase de administración.
Asegúrese de que la válvula del equipo de administración esté cerrada.
Eleve el envase de administración (si la bolsa de administración intravenosa cuelga de un portasueros)._
Prepare la cámara oprimiendo la cámara de goteo hasta que se haya llenado a la mitad con Respreeza.
Abra lentamente la válvula del equipo de administración y deje que Respreeza fluya hasta que llegue al final del tubo sin burbujas de aire.
Cierre la válvula._
2. Acople el filtro de 5 micrómetros en el extremo del equipo de administración.
Vuelva a abrir la válvula y deje que Respreeza fluya hasta que se sature el filtro._
3. Conecte el otro extremo del filtro al equipo de inyección (p. ej., aguja tipo mariposa para perfusión
o catéter para perfusión)._
4. Proceda a inyectar/perfundir la solución reconstituida en la vena siguiendo las instrucciones que le indicó el médico. La velocidad de perfusión de la solución deberá ser alrededor de
0,08 ml por kg de peso corporal cada minuto, en función de su respuesta y su confort. La perfusión de la dosis recomendada de 60 mg por kg de peso corporal tardará aproximadamente 15 minutos en completarse._
5. Si nota que la perfusión se detiene o disminuye, es posible que se haya obstruido el filtro y será
necesario cambiarlo. Repita entonces los pasos 2-4._
Cada vial de Respreeza es para un solo uso.
Todo el producto no utilizado o material residual se debe desechar siguiendo las instrucciones de su médico o profesional sanitario.
33