Refacto Af 250 Ui, Polvo Y Disolvente Para Solucion Inyectable
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
1. NOMBRE DEL MEDICAMENTO
ReFacto AF 250 UI, polvo y disolvente para solución inyectable
ReFacto AF 500 UI, polvo y disolvente para solución inyectable
ReFacto AF 1000 UI, polvo y disolvente para solución inyectable
ReFacto AF 2000 UI, polvo y disolvente para solución inyectable
ReFacto AF 250 UI, polvo y disolvente para solución inyectable en jeringa precargada
ReFacto AF 500 UI, polvo y disolvente para solución inyectable en jeringa precargada
ReFacto AF 1000 UI, polvo y disolvente para solución inyectable en jeringa precargada
ReFacto AF 2000 UI, polvo y disolvente para solución inyectable en jeringa precargada
ReFacto AF 3000 UI, polvo y disolvente para solución inyectable en jeringa precargada
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
ReFacto AF 250 UI, polvo y disolvente para solución inyectable Cada vial contiene nominalmente 250 UI* de moroctocog alfa**.
Después de la reconstitución, cada ml de solución contiene aproximadamente 62,5 UI de moroctocog alfa.
ReFacto AF 500 UI, polvo y disolvente para solución inyectable Cada vial contiene nominalmente 500 UI* de moroctocog alfa**.
Después de la reconstitución, cada ml de solución contiene aproximadamente 125 UI de moroctocog alfa.
ReFacto AF 1000 UI, polvo y disolvente para solución inyectable Cada vial contiene nominalmente 1000 UI* de moroctocog alfa**.
Después de la reconstitución, cada ml de solución contiene aproximadamente 250 UI de moroctocog alfa.
ReFacto AF 2000 UI, polvo y disolvente para solución inyectable Cada vial contiene nominalmente 2000 UI* de moroctocog alfa**.
Después de la reconstitución, cadaml de solución contiene aproximadamente 500 UI de moroctocog alfa.
ReFacto AF 250 UI, polvo y disolvente para solución inyectable en jeringa precargada Cada jeringa precargada contiene nominalmente 250 UI* de moroctocog alfa**.
Después de la reconstitución, cada ml de solución contiene aproximadamente 62,5 UI de moroctocog alfa.
ReFacto AF 500 UI, polvo y disolvente para solución inyectable en jeringa precargada Cada jeringa precargada contiene nominalmente 500 UI* de moroctocog alfa**.
Después de la reconstitución, cada ml de solución contiene aproximadamente 125 UI de moroctocog alfa.
ReFacto AF 1000 UI, polvo y disolvente para solución inyectable en jeringa precargada Cada jeringa precargada contiene nominalmente 1000 UI* de moroctocog alfa**.
Después de la reconstitución, cada ml de solución contiene aproximadamente 250 UI de moroctocog alfa.
ReFacto AF 2000 UI, polvo y disolvente para solución inyectable en jeringa precargada Cada jeringa precargada contiene nominalmente 2000 UI* de moroctocog alfa**.
Después de la reconstitución, cadaml de solución contiene aproximadamente 500 UI de moroctocog alfa.
ReFacto AF 3000 UI, polvo y disolvente para solución inyectable en jeringa precargada Cada jeringa precargada contiene nominalmente 3000 UI* de moroctocog alfa**.
Después de la reconstitución, cadaml de solución contiene aproximadamente 750 UI de moroctocog alfa.
* La potencia (Unidades Internacionales) se determina utilizando el ensayo de sustrato cromogénico de la Farmacopea Europea. La actividad específica de ReFacto AF es de 7.600-13.800 UI/mg de proteína.
** Factor VIII de coagulación humano producido mediante tecnología de ADN recombinante en células de ovario de hámster chino (CHO). El moroctocog alfa es una glicoproteína con 1438 aminoácidos, con una secuencia comparable con la forma de 90 + 80 kDa del factor VIII (esto es, dominio B suprimido), y modificaciones post-translacionales similares a las de la molécula plasmática.
Se modificó el proceso de fabricación de ReFacto para eliminar toda proteína exógena, ya sea de origen humano o animal, en el proceso de cultivo celular, en la purificación o en la formulación final; y al mismo tiempo se cambió la denominación de fantasía a ReFacto AF.
Excipiente con efecto conocido:
Después de la reconstitución cada vial o jeringa precargada contiene 1,23 mmol (29 mg) de sodio Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
ReFacto AF 250 UI, 500 UI, 1000 UI, 2000 UI, polvo y disolvente para solución inyectable Polvo y disolvente para solución inyectable Torta/polvo de color blanco a blanquecino Disolvente transparente e incoloro
ReFacto AF 250 UI, 500 UI, 1000 UI, 2000 UI, 3000 UI, polvo y disolvente para solución inyectable en jeringa precargada
Polvo y disolvente para solución inyectable en jeringa precargada
Torta/polvo de color blanco a blanquecino en la cámara superior de la jeringa precargada
Disolvente transparente e incoloro en la cámara inferior de la jeringa precargada
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Tratamiento y profilaxis de episodios hemorrágicos en pacientes con hemofilia A (déficit congénito de factor VIII).
ReFacto AF es adecuado para su uso en adultos y niños de todas las edades, incluso recién nacidos.
ReFacto AF no contiene factor de von Willebrand y por lo tanto, no está indicado en la enfermedad de von Willebrand.
4.2 Posología y forma de administración
El tratamiento debe iniciarse bajo la supervisión de un médico experimentado en el tratamiento de la hemofilia A.
Supervisión del tratamiento
Durante el curso del tratamiento, se recomienda una determinación apropiada de los niveles del factor VIII para establecer la dosis que se debe administrar y la frecuencia de las perfusiones repetidas. La respuesta al factor VIII de cada paciente individual puede variar debido a las diferentes semividas y recuperaciones. La dosis basada en el peso corporal puede requerir un ajuste en pacientes con un peso insuficiente o sobrepeso. En el caso particular de intervenciones de cirugía mayor, es indispensable una monitorización precisa de la terapia de sustitución por medio de análisis de la coagulación (actividad del factor VIII plasmático).
Cuando se monitorizan los niveles de actividad de factor VIII de los pacientes durante el tratamiento con ReFacto AF, se recomienda el empleo del ensayo cromogénico. Cuando se utiliza un ensayo de coagulación en una fase, basado en el tiempo de tromboplastina (TTPA) in vitro para determinar la actividad del factor VIII en muestras sanguíneas de pacientes, los resultados de la actividad del factor VIII en plasma pueden verse afectados de manera significativa tanto por el tipo de reactivo de TTPA como por el estándar de referencia utilizado en el ensayo. También puede haber discrepancias significativas entre los resultados de los ensayos obtenidos con el ensayo de coagulación en una fase basado en el TTPA y el ensayo cromogénico. Normalmente, los resultados del ensayo de coagulación en una fase son un 20-50% menores que los resultados del ensayo del sustrato cromogénico. Puede utilizarse el patrón de laboratorio de ReFacto AF para corregir esta discrepancia (ver sección 5.2).
Esto es importante especialmente cuando se cambia el laboratorio y/o los reactivos utilizados en el ensayo.
Posología
La dosis y la duración de la terapia de sustitución dependen de la gravedad de la deficiencia del factor VIII, de la localización y el grado de la hemorragia y del estado clínico del paciente. Las dosis administradas deben calcularse según la respuesta clínica del paciente. En presencia de un inhibidor, pueden necesitarse dosis más altas o el tratamiento específico adecuado.
El número de unidades de factor VIII administrado se expresa en Unidades Internacionales (UI) que se refieren al estándar actual de la OMS para los productos del factor VIII. La actividad del factor VIII en plasma se expresa bien como un porcentaje (referido al plasma normal humano) o en UI (referido al Estándar Internacional para el factor VIII en plasma). Una UI de actividad de factor VIII es equivalente a la cantidad de factor VIII en un ml de plasma humano normal.
Otro producto de moroctocog alfa aprobado para su uso fuera de Europa tiene una potencia asignada diferente que se ha calibrado con la norma internacional de la OMS mediante el ensayo de coagulación en una fase; este producto se identifica mediante su nombre registrado XYNTHA. Debido a la diferencia de métodos utilizados para asignar la potencia del producto entre XYNTHA y ReFacto AF,
1 UI del producto XYNTHA (calibrado con el ensayo en una fase) equivale aproximadamente a 1,38 UI del producto ReFacto AF (calibrado con el ensayo cromogénico). Si a un paciente tratado normalmente con XYNTHA se le receta ReFacto AF, el médico podría considerar un ajuste de las recomendaciones posológicas en función de los valores de recuperación del factor VIII.
De acuerdo con su tratamiento actual, debe aconsejarse a las personas con hemofilia A que, en sus viajes, lleven consigo una cantidad suficiente de producto de factor VIII para el tratamiento previsto.
Se debe aconsejar a los pacientes que consulten con su médico antes de viajar.
Tratamiento a demanda
La estimación de la dosis necesaria de factor VIII se basa en el hallazgo empírico de que 1 UI de factor VIII por kg de peso corporal aumenta la actividad plasmática de factor VIII en 2 UI/dl. La dosis necesaria se determina utilizando la fórmula siguiente:
Unidades requeridas (UI) = peso corporal (en kg) x aumento deseado de factor VIII (% o UI/dl) x 0,5 (UI/kg por UI/dl), donde 0,5 UI/kg por UI/dl representa la inversa de la recuperación observada generalmente tras las perfusiones del factor VIII.
La cantidad que hay que administrar y la frecuencia de administración siempre deben orientarse a la eficacia clínica en el caso individual.
En el caso de los siguientes acontecimientos hemorrágicos, la actividad del factor VIII no debe caer por debajo de los niveles de plasma dados (en % del normal o en UI/dl) en el periodo correspondiente. Puede emplearse la siguiente tabla como guía para establecer la pauta de dosificación en episodios hemorrágicos y cirugía:
|
Grado de hemorragia/ Tipo de procedimiento quirúrgico |
Nivel de factor VIII requerido (% o UI/dl) |
Frecuencia de dosificación (horas)/ Duración de la terapia (días) |
|
Hemorragias | ||
|
Hemartrosis incipiente, hemorragia muscular u oral |
20-40 |
Repetir cada 12-24 horas al menos 1 día, hasta que el episodio hemorrágico, según indique el dolor, se resuelva o se logre la curación. |
|
Hemartrosis más extensa, hemorragia muscular o hematoma. |
30-60 |
Repetir la perfusión cada 12-24 horas durante un período de 3-4 días o más hasta que cesen el dolor y la discapacidad aguda. |
|
Hemorragias con peligro de muerte |
60-100 |
Repetir la perfusión cada 8-24 horas hasta superar el peligro. |
|
Cirugía | ||
|
Menor, incluida la extracción dental |
30-60 |
Cada 24 horas, al menos 1 día, hasta que se logre la cicatrización. |
|
Mayor |
80-100 (pre y postoperatoria) |
Repetir la perfusión cada 8-24 horas hasta la curación adecuada de la herida, luego seguir la terapia durante al menos otros 7 días para mantener una actividad del factor VIII del 30% al 60% (UI/dl). |
Profilaxis
En la profilaxis a largo plazo contra episodios hemorrágicos en pacientes con hemofilia A grave, las dosis habituales son de 20 a 40 UI de factor VIII por kg de peso corporal, en intervalos de 2 a 3 días. En algunos casos, especialmente en pacientes jóvenes, puede ser necesario un intervalo de dosis más corto o dosis mayores.
Población pediátrica
Para tratar a niños más pequeños (menores de 6 años de edad) con ReFacto AF es preciso tener en cuenta la necesidad de aumentar la dosis respecto a la utilizada con los adultos y los niños mayores. En un estudio de ReFacto en niños menores de 6 años el análisis farmacocinético reveló unos valores de semivida y recuperación menores que los observados en niños mayores y adultos (ver sección 5.2). Durante los ensayos clínicos, en niños menores de 6 años con una pauta profiláctica se utilizó una dosis media de 50 UI/kg de ReFacto y presentaron una media de 6,1 episodios hemorrágicos al año. Los niños mayores y los adultos con una pauta profiláctica utilizaron una dosis media de 27 UI/kg y presentaron una media de 10 episodios hemorrágicos al año. En un contexto de ensayo clínico la dosis media de ReFacto por perfusión para episodios hemorrágicos en niños menores de 6 años fue mayor que la dosis media administrada a niños mayores y a adultos (51,3 UI/kg y 29,3 UI/kg, respectivamente).
Pacientes de edad avanzada
Los ensayos clínicos no incluyeron pacientes de 65 años o mayores. En general, la dosis para un paciente de edad avanzada se debe individualizar.
Insuficiencia renal o hepática
No se ha estudiado en ensayos clínicos el ajuste de la dosis para pacientes con insuficiencia renal o hepática.
Forma de administración
Vía intravenosa.
ReFacto AF se administra en perfusión intravenosa a lo largo de varios minutos tras la reconstitución del polvo liofilizado para inyección con la solución inyectable de cloruro sódico con una concentración de 9 mg/ml (0,9%) (suministrado). La velocidad de administración vendrá determinada por la comodidad del paciente. Se recomienda formar adecuadamente a aquellas personas que no sean profesionales sanitarios y que vayan a administrar el producto.
Para consultar las instrucciones de reconstitución del medicamento antes de la administración, ver sección 6.6.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1. Reacción alérgica conocida a proteína de hámster.
4.4 Advertencias y precauciones especiales de empleo Hipersensibilidad
Se han observado reacciones de hipersensibilidad de tipo alérgico con ReFacto AF. El medicamento contiene cantidades residuales de proteínas de hámster. Si aparecen síntomas de hipersensibilidad, se debe aconsejar a los pacientes que interrumpan inmediatamente el uso del medicamento y contacten con su médico. Los pacientes deben ser informados acerca de los signos iniciales de las reacciones de hipersensibilidad, que incluyen habón urticarial, urticaria generalizada, opresión en el pecho, silbidos al respirar, hipotensión y anafilaxia.
En caso de shock, debe aplicarse el tratamiento médico habitual para el tratamiento del shock. Anticuerpos neutralizantes (inhibidores)
La formación de anticuerpos neutralizantes (inhibidores) del factor VIII es una complicación conocida en el cuidado de individuos con hemofilia A. Estos inhibidores son normalmente inmunoglobulinas IgG dirigidas contra la actividad procoagulante del factor VIII, que se cuantifica en unidades Bethesda (UB) por ml de plasma usando la modificación de Nijmegen del ensayo de Bethesda. El riesgo de desarrollar inhibidores se relaciona con la exposición al factor VIII, siendo este riesgo más alto dentro de los 20 primeros días de exposición. Rara vez se pueden desarrollar inhibidores transcurridos los primeros 100 días de exposición.
Se han observado casos de inhibidor recurrente (de bajo título) tras cambiar de un producto de factor VIII a otro, en pacientes previamente tratados con un periodo de exposición de más de 100 días y con antecedentes de desarrollo de inhibidores. Por eso, se recomienda realizar un seguimiento meticuloso del desarrollo de inhibidores en todos los pacientes tras cualquier cambio de producto.
En general, todos los pacientes tratados con productos del factor de coagulación VIII deben ser vigilados cuidadosamente, de cara al desarrollo de inhibidores, mediante las observaciones clínicas y pruebas de laboratorio adecuadas. Si no se alcanzan los niveles plasmáticos de actividad del factor VIII esperados, o si no se controla la hemorragia mediante una dosis adecuada, se debe realizar una prueba de presencia de inhibidor del factor VIII. En pacientes con de inhibidores de alto título, es posible que el tratamiento con factor VIII no resulte eficaz y se deberían considerar otras opciones terapéuticas. El manejo de esos pacientes debe ser dirigido por médicos con experiencia en el tratamiento de la hemofilia y de los inhibidores del factor VIII.
Informes de falta de efecto
Se han recibido informes de falta de efecto en los ensayos clínicos y en la experiencia postcomercialización de ReFacto, principalmente en pacientes en profilaxis. La falta de efecto notificada con ReFacto se ha descrito como hemorragias en articulaciones diana, como hemorragias en nuevas articulaciones o como un sentimiento subjetivo por parte del paciente de un nuevo episodio hemorrágico. Cuando se receta ReFacto AF es importante ajustar y controlar el nivel de factor de cada paciente con el fin de asegurar una respuesta terapéutica adecuada (ver sección 4.8).
Se recomienda encarecidamente que cada vez que se administre ReFacto AF a un paciente se registren el nombre que figura en el envase y número de lote del producto a fin de mantener un vínculo entre el paciente y el número de lote del producto. Los pacientes pueden fijar una de las etiquetas despegables que se encuentran en el vial o en la jeringa precargada para documentar el número del lote en su diario o para notificar cualquier efecto secundario.
Acontecimientos cardiovasculares
En pacientes con factores de riesgo cardiovascular existentes, la terapia de sustitución con el factor VIII puede aumentar el riesgo cardiovascular.
Complicaciones asociadas a los catéteres
Si se requiere un dispositivo de acceso venoso central (DAVC), hay que tener en cuenta el riesgo de complicaciones asociadas al DAVC, incluidas las infecciones localizadas, la bacteriemia y la trombosis en el lugar de implantación del catéter (ver sección 4.8).
Contenido en sodio
Después de la reconstitución cada vial o jeringa precargada contiene 1,23 mmol (29 mg) de sodio lo que deberá tenerse en cuenta en el tratamiento de pacientes con dietas pobres en sodio.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han notificado interacciones de los productos de factor de coagulación VIII recombinante con otros medicamentos.
4.6 Fertilidad, embarazo y lactancia
No se han realizado estudios de reproducción animal con el factor VIII, por lo que no se dispone de datos acerca de su efecto sobre la fertilidad. Debido a la rara aparición de hemofilia A en mujeres, no se dispone de experiencia con respecto al uso de Factor VIII durante el embarazo y la lactancia. Por lo tanto, el factor VIII debe usarse durante el embarazo y la lactancia sólo si está claramente indicado.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
ReFacto AF no influye sobre la capacidad para conducir y utilizar máquinas
4.8 Reacciones adversas
Resumen del perfil de seguridad
Se han observado, con poca frecuencia, hipersensibilidad o reacciones alérgicas con ReFacto. Dichas reacciones de hipersensibilidad o alérgicas pueden ser, entre otras: angioedema, quemazon y punzadas en el lugar de infusión, escalofríos, rubefacción, urticaria generalizada, cefalea, habón urticarial, hipotensión, letargia, náuseas, inquietud, taquicardia, opresión en el pecho, cosquilleo, vómitos, sibilancia); en algunos casos, pueden empeorar hasta convertirse en anafilaxis grave, incluido el shock anafiláctico (ver sección 4.4).
En ReFacto AF pueden estar presentes cantidades residuales de proteínas de hámster. Muy rara vez, se ha observado la aparición de anticuerpos frente a proteínas de hámster, aunque no se produjeron secuelas clínicas. En un estudio llevado a cabo sobre ReFacto, 20 de 113 (18%) PTP (pacientes tratados previamente) mostraron un aumento en el título de anticuerpos anti-CHO, sin que apareciese ningún efecto clínico apreciable.
La aparición de anticuerpos neutralizadores (inhibidores) del factor VIII es bien conocida en el tratamiento de los pacientes con hemofilia A. Como ocurre con todos los productos de factor de coagulación VIII, se debe realizar un seguimiento de los pacientes para ver si desarrollan inhibidores que se deben titular en unidades Bethesda (UB) usando la modificación de Nijmegen del ensayo de Bethesda. Si aparecen dichos inhibidores, la afección puede manifestarse en forma de una respuesta clínica insuficiente. En estos casos, se recomienda ponerse en contacto con un centro especializado en hemofilia.
Tabla de reacciones adversas
En la siguiente tabla se presentan las reacciones adversas según el sistema de clasificación de órganos del sistema MedDRA (SOC, por sus siglas en inglés y nivel de términos preferidos). Las frecuencias se han evaluado según la siguiente convención: muy frecuentes (> 1/10), frecuentes (> 1/100 a < 1/10) y poco frecuentes (> 1/1.000 a <1/100). La tabla enumera las reacciones adversas notificadas en los ensayos clínicos con ReFacto o ReFacto AF. Las frecuencias se basan en los acontecimientos adversos surgidos durante el tratamiento por cualquier causa observados en los ensayos clínicos agrupados con 655 sujetos (554 PTPs, 101 PUPs).
Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
|
Sistema de clasificación de órganos |
Muy frecuentes > 1/10 |
Frecuentes > 1/100 a < 1/10 |
Poco frecuentes > 1/1.000 a < 1/100 |
|
Trastornos de la sangre y del sistema linfático |
Inhibición del Factor VIII (PUPs) |
Inhibición del Factor VIII (PTPs) | |
|
Trastornos del sistema inmunológico |
Reacción anafiláctica | ||
|
Trastornos del metabolismo y de la nutrición |
Disminución del apetito | ||
|
Trastornos del sistema nervioso |
Cefalea |
Mareo |
Neuropatía periférica; somnolencia; disgeusia |
|
Trastornos cardíacos |
Angina de pecho; taquicardia; palpitaciones | ||
|
Trastornos vasculares |
Hemorragia; hematoma |
Hipotensión; tromboflebitis; rubefacción |
|
Sistema de clasificación de órganos |
Muy frecuentes £ 1/10 |
Frecuentes £ 1/100 a < 1/10 |
Poco frecuentes > 1/1.000 a < 1/100 |
|
Trastornos respiratorios, torácicos y mediastínicos |
Tos |
Disnea | |
|
Trastornos gastrointestinales |
Diarrea; vómitos; dolor abdominal; náuseas | ||
|
Trastornos de la piel y del tejido subcutáneo |
Urticaria; erupción cutánea; prurito |
Hiperhidrosis | |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Artralgia |
Mialgia | |
|
Trastornos generales y alteraciones en el lugar de administración |
Pirexia |
Escalofríos; reacción relacionada con la localización del catéter |
Astenia; reacción en el lugar de la inyección; dolor en el lugar de la inyección; inflamación del lugar de la inyección |
|
Exploraciones complementarias |
Determinación de anticuerpos positiva; Determinación de anticuerpos contra el factor VIII positiva |
Aumento de la aspartato aminotransferasa; aumento de la alanina aminotransferasa; aumento de la bilirrubinemia; aumento de la creatina fosfoquinasa en sangre |
Descripción de reacciones adversas seleccionadas Inhibición del factor VIII
En un estudio clínico llevado a cabo con ReFacto en pacientes tratados previamente (PTP), la variable primaria de seguridad fue la incidencia de inhibidores del factor VIII. Se observaron dos inhibidores transitorios, de bajo título y clínicamente asintomáticos, en 94 pacientes con una mediana de exposición de 76 días de exposición (DE, intervalo de 1 a 92), lo que correspondía a que un 2,2% de los 89 pacientes tuvieron como mínimo 50 DE. En un estudio de apoyo realizado conReFacto AF, se observaron 1 inhibidor de novo y 2 inhibidores recurrentes (todos ellos de bajo título, conforme a lo determinado por un laboratorio central) en 110 pacientes; la mediana de exposición fue de 58 DE (intervalo de 5 a 140) y 98 pacientes tuvieron como mínimo 50 DE a ReFacto AF. En un segundo estudio de apoyo, se siguió proporcionando el tratamiento a noventa y ocho (98) de los 110 pacientes originales, quienes tuvieron una exposición ampliada subsiguiente a ReFacto AF, con una mediana de exposición de 169 DE adicionales (intervalo de 9 a 425). Se observó un (1) inhibidor de novo adicional, a una concentración baja. La frecuencia de los inhibidores observada en los mencionados estudios está dentro del intervalo esperado.
En un estudio clínico llevado a cabo en PTP con hemofilia A (factor VIII:C < 2%) y sometidos a cirugía mayor, se observó 1 inhibidor en 30 pacientes que recibieron tratamiento con ReFacto AF.
En un estudio clínico llevado a cabo con ReFacto en PTP, se observó 1 inhibidor en 113 pacientes. Además, se han realizado informes espontáneos, post-comercialización, en los que se notificaron inhibidores de alto título que habrían afectado a PTP.
Se están llevando a cabo estudios clínicos en pacientes no tratados previamente (PUP), con ReFacto AF. En un estudio clínico con ReFacto, 32 de 101 (32%) PUP (FVIII:C < 2%) desarrollaron inhibidores. De los 62 pacientes con FVIII:C < 1%, 19 desarrollaron un inhibidor (31%). De los 32 casos de desarrollo de inhibidor de la cohorte total de pacientes (n=101), 16 (16%) se clasificaron
como de alto título (> 5 UB/ml) y 16 (16%) como de bajo título (< 5 UB/ml). La mediana del número de días de exposición hasta el desarrollo de inhibidor en estos 32 pacientes fue de 12 (intervalo de 3 a 49). De los 16 pacientes con alto título, 15 recibieron inducción de inmunotolerancia (ITI). Se inició ITI en 10 de los 16 pacientes con bajo título.
Población pediátrica
Se han notificado como posiblemente relacionados con el tratamiento con ReFacto AF un caso de quiste en un paciente de 11 años y un caso descrito como confusión en un paciente de 13 años.
Se evaluó la seguridad de ReFacto AF en niños y adolescentes tratados previamente (n=18, edad 12-16 años, en un estudio y n=49, edad 7-16 años, en un estudio complementario). Aunque se ha estudiado a un número limitado de niños, hay una tendencia a una mayor frecuencia de reacciones adversas en niños de 7-16 años en comparación con los adultos. Se están llevando a cabo ensayos clínicos que evalúan la utilización de ReFacto AF en niños menores de 6 años.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Apéndice V.
4.9 Sobredosis
No se ha notificado ningún síntoma de sobredosis con los productos de factor de coagulación VIII recombinante.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: factor VIII de la coagulación, antihemorrágico; código ATC: B02BD02
ReFacto AF contiene factor VIII de coagulación recombinante con dominio B suprimido (moroctocog alfa). Es una glicoproteína con un peso molecular aproximado de 170.000 Dalton, que consta de 1438 aminoácidos. ReFacto AF posee características funcionales comparables a las del factor VIII endógeno. La actividad del factor VIII se reduce mucho en los pacientes con hemofilia A, y por ello es necesaria la terapia de sustitución.
Cuando se perfunde en un paciente hemofílico, el factor VIII se une con el factor de von Willebrand presente en la circulación del paciente.
El factor VIII activado actúa como un cofactor para el factor activado IX acelerando la conversión del factor X al factor X activado. El factor X activado convierte la protrombina en trombina. La trombina convierte el fibrinógeno en fibrina y se forma un coágulo. La hemofilia A es un trastorno hereditario, ligado al sexo, de la coagulación de la sangre debido a niveles bajos de factor VIII:C y da como resultado una hemorragia intensa en las articulaciones, músculos u órganos internos, bien espontáneamente o como resultado de un trauma accidental o quirúrgico. Por la terapia de sustitución, se aumentan los niveles de factor VIII, permitiendo por lo tanto una corrección temporal de la deficiencia del factor y la corrección de la propensión a hemorragias.
Inducción de inmunotolerancia
Se han recogido datos de la inducción de inmunotolerancia (ITI) en pacientes con hemofilia A que habían desarrollado inhibidores del factor VIII. Dentro del estudio pivotal con ReFacto en PUPs, se han revisado los datos de ITI de 25 pacientes (ver sección 4.8). De los 25 pacientes, 20 tuvieron una disminución del título del inhibidor a < 0,6 UB/ml, de los cuales inicialmente 11 de 15 tenían títulos altos (> 5 UB/ml) y 9 de 10 tenían títulos bajos. De los 6 pacientes que desarrollaron inhibidores de bajo título, pero no recibieron ITI, 5 presentaron disminuciones similares del título. No se dispone de la respuesta a largo plazo.
5.2 Propiedades farmacocinéticas
En la tabla siguiente se presentan las propiedades farmacocinéticas de ReFacto, obtenidas en un estudio cruzado de ReFacto y un concentrado de FVIII derivado del plasma mediante el ensayo del sustrato cromogénico (ver sección 4.2) en 18 pacientes tratados previamente.
|
Estimaciones de los parámetros farmacocinéticos de ReFacto en pacientes con hemofilia A tratados previamente. | |||
|
Parámetro farmacocinético |
Media |
DE |
Mediana |
|
AUCt (UIh/ml) |
19,9 |
4,9 |
19,9 |
|
t¡/2 (h) |
14,8 |
5,6 |
12,7 |
|
CL (ml/hkg) |
2,4 |
0,75 |
2,3 |
|
MRT (h) |
20,2 |
7,4 |
18,0 |
|
Recuperación (UI/dl de incremento en FVIII:C por IU/kg de FVIII dadas) |
2,4 |
0,38 |
2,5 |
Abreviaturas: AUCt = área bajo la curva concentración plasmática-tiempo desde cero hasta la última concentración medible; t/2 = semivida; CL = aclaramiento; FVIII:C = actividad de FVIII; MRT = tiempo de residencia medio
En un estudio en el que se midió la potencia de ReFacto AF y ReFacto y la actividad de FVIII en el plasma del paciente mediante el ensayo del sustrato cromogénico, ReFacto AF demostró ser bioequivalente a ReFacto. Los cocientes de las medias geométricas según mínimos cuadrados entre ReFacto AF y ReFacto fueron del 100,6%, el 99,5% y el 98,1% para la recuperación, el AUCt y el AUC^ (área bajo la curva concentración plasmática-tiempo desde cero hasta el infinito), respectivamente. Los intervalos de confianza correspondientes al 90% de los cocientes de las medias geométricas entre ReFacto AF y ReFacto se hallaron dentro del margen de bioequivalencia del 80% al 125%, demostrando la bioequivalencia entre ReFacto AF y ReFacto.
En un estudio farmacocinético cruzado, se determinaron los parámetros farmacocinéticos de ReFacto AF en 25 pacientes tratados previamente (> 12 años), en el momento basal y después de la administración repetida de ReFacto AF durante seis meses. Los cocientes de las medias geométricas según mínimos cuadrados entre el mes 6 y el basal fueron del 107%, el 100% y el 104% para la recuperación, el AUCt y el AUC», respectivamente. Los intervalos de confianza correspondientes al 90% de los cocientes entre el mes 6 y el basal para los parámetros farmacocinéticos señalados se hallaron dentro del margen de bioequivalencia del 80% al 125%, lo que indica que no hay cambios de las propiedades farmacocinéticas de ReFacto AF dependientes del tiempo.
En el mismo estudio, en el que se determinaron la potencia del producto ReFacto AF y de un producto de comparación de factor VIII recombinante de longitud completa (FLrFVIII), así como la actividad de FVIII medida en muestras plasmáticas de los pacientes, utilizando para ello el mismo ensayo de coagulación en una fase en un laboratorio central y con un método de bioequivalencia estándar, ReFacto AF demostró ser equivalente farmacocinéticamente a FLrFVIII en 30 pacientes tratados previamente (> 12 años).
Se determinaron los parámetros farmacocinéticos de ReFacto utilizando el ensayo cromogénico en pacientes no tratados previamente (PUPs). Estos pacientes (n=59; mediana de edad 10 ± 8,3 meses) tuvieron una recuperación media en la semana 0 de 1,5 ± 0,6 UI/ dl por UI/kg (rango 0,2 a 2,8 UI/dl por UI/kg) que fue menor que la obtenida en PTP tratados con ReFacto en la semana 0 con un valor de recuperación de 2,4 ± 0,4 UI/dl por UI/kg (rango 1,1 a 3,8 UI/dl por UI/kg). En los PUPs la
recuperación media fue estable con el tiempo (5 visitas durante un periodo de 2 años) y tuvo un rango de 1,5 a 1,8 UI/dl por UI/Kg. El modelo farmacocinético poblacional utilizando datos de 44 PUPs dio una semivida media estimada de 8,0 ± 2,2 horas.
5.3 Datos preclínicos de seguridad
Los datos de los estudios preclínicos no muestran riesgos especiales para los seres humanos según estudios convencionales de farmacología de seguridad, toxicidad a dosis repetidas y genotoxicidad.
No se han realizado investigaciones sobre el potencial carcinogénico ni sobre toxicidad para la reproducción.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Polvo
Sacarosa
Dihidrato de cloruro cálcico L-Histidina Polisorbato 80 Cloruro sódico
Disolvente Cloruro sódico
Agua para preparaciones inyectables
6.2 Incompatibilidades
En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros medicamentos incluyendo otras soluciones para perfusión.
Sólo debe utilizarse el sistema de perfusión que se suministra porque puede producirse un fallo en el tratamiento como consecuencia de la adsorción del factor VIII de coagulación humano a las superficies internas de algunos sistema de perfusión.
6.3 Período de validez
3 años.
El producto puede sacarse del lugar en el que se conserva refrigerado, para un único período máximo de 3 meses a temperatura ambiente (de hasta 25°C). Finalizado dicho período de conservación a temperatura ambiente, no debe volver a conservarse el producto refrigerado, sino que debe ser utilizado o desechado.
Después de la reconstitución
Se ha demostrado la estabilidad física y química, para su utilización, durante 3 horas a temperaturas de hasta 25°C.
ReFacto AF 250 UI, 500 UI, 1000 UI, 2000 UI, polvo y disolvente para solución inyectable Este producto no contiene conservantes. Una vez reconstituido debe ser utilizado inmediatamente, o en un plazo de 3 horas después de la reconstitución. Otros periodos de tiempo y condiciones de conservación previos a su empleo son responsabilidad del usuario.
ReFacto AF 250 UI, 500 UI, 1000 UI, 2000 UI, 3000 UI, polvo y disolvente para solución inyectable en jeringa precargada
Este producto no contiene conservantes. Una vez reconstituido debe ser utilizado inmediatamente, o en un plazo de 3 horas después de la reconstitución o la eliminación del tapón gris. Otros periodos de tiempo y condiciones de conservación previos a su empleo son responsabilidad del usuario.
6.4 Precauciones especiales de conservación
ReFacto AF 250 UI, 500 UI, 1000 UI, 2000 UI, polvo y disolvente para solución inyectable
ReFacto AF 250 UI, 500 UI, 1000 UI, 2000 UI, 3000 UI, polvo y disolvente para solución inyectable
en jeringa precargada
Conservar y transportar refrigerado (entre 2°C y 8°C). No congelar.
Conservar el medicamento en el embalaje exterior para protegerlo de la luz.
Para las condiciones de conservación del medicamento reconstituido, ver sección 6.3.
6.5 Naturaleza y contenido del envase
ReFacto AF 250 UI, 500 UI, 1000 UI, 2000 UI, polvo y disolvente para solución inyectable
250 UI, 500 UI, 1000 UI o 2000 UI de polvo en un vial de 10 ml (vidrio tipo 1) con un tapón (butilo) y
un cierre tipo «flip-off» (aluminio) y 4 ml de disolvente en una jeringa precargada (vidrio tipo 1) con un tapón de goma (butilo), un protector (butilo) y un dispositivo estéril de adaptación al vial para reconstitución, un sistema de perfusión estéril, toallitas con alcohol, esparadrapo y gasas.
ReFacto AF 250 UI, 500 UI, 1000 UI, 2000 UI, 3000 UI, polvo y disolvente para solución inyectable en jeringa precargada
250 UI, 500 UI, 1000 UI, 2000 UI o 3000 UI de polvo liofilizado en la cámara superior y 4 ml de disolvente en la cámara inferior de la jeringa precargada (vidrio tipo 1) con émbolos y cierre de goma de butilo, un émbolo para el ensamblado, un tapón estéril de polipropileno perforado para la ventilación, un sistema de perfusión estéril, toallitas con alcohol, esparadrapo y gasas.
Tamaño del envase: 1.
6.6 Precauciones especiales de eliminación y otras manipulaciones
ReFacto AF 250 UI, 500 UI, 1000 UI, 2000 UI, polvo y disolvente para solución inyectable El vial de polvo liofilizado del producto para inyección debe reconstituirse con el disolvente suministrado en la jeringa precargada [solución de cloruro sódico de 9 mg/ml (0,9%)] utilizando el dispositivo estéril de adaptación al vial para reconstitución. El vial debe moverse suavemente con movimientos rotatorios hasta que se disuelva todo el polvo. Para obtener información adicional sobre la reconstitución y administración del producto, consúltese la sección 3 del prospecto.
Una vez reconstituida, la solución se aspira hacia el interior de la jeringa. La solución será transparente o ligeramente opalescente e incolora. La solución debe desecharse si se observan partículas en su interior o algún tipo de decoloración.
ReFacto AF 250 UI, 500 UI, 1000 UI, 2000 UI, 3000 UI, polvo y disolvente para solución inyectable en jeringa precargada
El polvo liofilizado situado en la cámara superior de la jeringa precargada debe reconstituirse con el disolvente [solución de cloruro sódico de 9 mg/ml (0,9%)] situado en la cámara inferior de la jeringa precargada. La jeringa precargada debe moverse suavemente con movimientos rotatorios hasta que se disuelva todo el polvo. Para obtener información adicional sobre la reconstitución y administración del medicamento, consulte la sección 3 del prospecto.
Una vez reconstituida, la solución será transparente o ligeramente opalescente e incolora. La solución debe desecharse si se observan partículas en su interior o algún tipo de cambio de color.
Cuando se reconstituye, el producto contiene polisorbato-80, lo cual aumenta el índice de extracción de di-(2-Etilhexil) ftalato (DEHP) a partir del cloruro de polivinilo (PVC), lo que se debe considerar durante la preparación y administración del producto, incluyendo el tiempo de almacenamiento transcurrido desde que está en el PVC hasta la reconstitución. Es importante seguir cuidadosamente las recomendaciones de la sección 6.3.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Pfizer Limited Ramsgate Road Sandwich Kent CT13 9NJ Reino Unido
8. NÚMERO(S) DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/99/103/001
EU/1/99/103/002
EU/1/99/103/003
EU/1/99/103/004
EU/1/99/103/009
EU/1/99/103/006
EU/1/99/103/007
EU/1/99/103/008
EU/1/99/103/005
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 13 de abril de 1999 Fecha de la última renovación: 15 de abril de 2014
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea del Medicamento http://www.ema.europa.eu/.
A. FABRICANTE DEL PRINCIPIO ACTIVO BIOLÓGICO Y FABRICANTE RESPONSABLES DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
A. FABRICANTE DEL PRINCIPIO ACTIVO BIOLÓGICO Y FABRICANTE RESPONSABLES DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección del fabricante del principio activo biológico
Swedish Orphan Biovitrum AB (publ)
Strandbergsgatan 49 SE-11276 Estocolmo Suecia
Nombre y dirección del fabricante responsable de la liberación de los lotes
Wyeth Farma S.A.
Autovía del Norte A-1 Km 23
Desvío Algete Km 1
28700 San Sebastián de los Reyes
Madrid
España
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica restringida (ver Anexo I: Ficha Técnica o Resumen de las Características del Producto, sección 4.2).
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
Los requerimientos para la presentación de los informes periódicos de seguridad para este medicamento se establecen en la lista de fechas de referencia de la Unión (lista EURD) prevista en el artículo 107quater, apartado 7, de la Directiva 2001/83/CE y cualquier actualización posterior publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo
acordado en la versión del PGR incluido en el Módulo 1.8.2 de la Autorización de
Comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos.
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR ESTUCHE DE REFACTO AF
1. NOMBRE DEL MEDICAMENTO_
ReFacto AF 250 UI polvo y disolvente para solución inyectable ReFacto AF 500 UI polvo y disolvente para solución inyectable ReFacto AF 1000 UI polvo y disolvente para solución inyectable ReFacto AF 2000 UI polvo y disolvente para solución inyectable Moroctocog alfa
(factor VIII de coagulación recombinante humano)
2. PRINCIPIO(S) ACTIVO(S)
1 vial: 250 UI de moroctocog alfa (aproximadamente 62,5 UI/ml después de la reconstitución).
1 vial: 500 UI de moroctocog alfa (aproximadamente 125 UI/ml después de la reconstitución)
1 vial: 1000 UI de moroctocog alfa (aproximadamente 250 UI/ml después de la reconstitución)
1 vial: 2000 UI de moroctocog alfa (aproximadamente 500 UI/ml después de la reconstitución)
3. LISTA DE EXCIPIENTES
Sacarosa,
dihidrato de cloruro cálcico,
L-histidina, polisorbato 80, cloruro sódico
Para mayor información consultar el prospecto.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Polvo y disolvente para solución inyectable
1 vial con 250 UI de moroctocog alfa 1 vial con 500 UI de moroctocog alfa 1 vial con 1000 UI de moroctocog alfa 1 vial con 2000 UI de moroctocog alfa
1 jeringa precargada con 4 ml de disolvente 1 adaptador del vial
1 sistema de perfusión estéril
2 toallitas con alcohol 1 esparadrapo
1 gasa
Leer el prospecto antes de utilizar este medicamento.
Para administración intravenosa, después de la reconstitución.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
No utilizar después de la fecha de caducidad.
Utilizar inmediatamente o en un plazo de 3 horas desde la reconstitución.
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Conservar y transportar entre 2°C y 8°C.
No congelar
Conservar el vial en el embalaje original para protegerlo de la luz.
ReFacto AF puede conservarse a temperatura ambiente (hasta 25°C) durante un único periodo máximo de 3 meses. El producto no puede volver a refrigerarse después de haber sido almacenado a temperatura ambiente.
Fecha en la que se saca del frigorífico: ...................
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
Desechar cualquier sobrante de la solución reconstituida.
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Pfizer Limited Ramsgate Road Sandwich Kent CT13 9NJ Reino Unido
EU/1/99/103/001
EU/1/99/103/002
EU/1/99/103/003
EU/1/99/103/004
13. NÚMERO DEL LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
ReFacto AF 250 ReFacto AF 500 ReFacto AF 1000 ReFacto AF 2000
ETIQUETA DEL VIAL DE REFACTO AF
1. NOMBRE DEL MEDICAMENTO Y VIA(S) DE ADMINISTRACIÓN
ReFacto AF 250 UI polvo para solución inyectable ReFacto AF 500 UI polvo para solución inyectable ReFacto AF 1000 UI polvo para solución inyectable ReFacto AF 2000 UI polvo para solución inyectable Moroctocog alfa
(factor VIII de coagulación recombinante humano) Administración intravenosa
2. FORMA DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento.
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
6. OTROS
Conservar en nevera
ETIQUETA DE LA JERINGA PRECARGADA DE DISOLVENTE DE REFACTO AF
1. NOMBRE DEL MEDICAMENTO Y VIA(S) DE ADMINISTRACIÓN
Disolvente de ReFacto AF
2. FORMA DE ADMINISTRACIÓN
Administración intravenosa tras la reconstitución.
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
Contiene 4 ml de solución inyectable de cloruro sódico con una concentración de 9 mg/ml (0,9%)
6. OTROS
Conservar en nevera
1. NOMBRE DEL MEDICAMENTO_
ReFacto AF 250 UI polvo y disolvente para solución inyectable en jeringa precargada ReFacto AF 500 UI polvo y disolvente para solución inyectable en jeringa precargada ReFacto AF 1000 UI polvo y disolvente para solución inyectable en jeringa precargada ReFacto AF 2000 UI polvo y disolvente para solución inyectable en jeringa precargada ReFacto AF 3000 UI polvo y disolvente para solución inyectable en jeringa precargada Moroctocog alfa
(factor VIII de coagulación recombinante humano)
2. PRINCIPIO(S) ACTIVO(S)
1 jeringa precargada: 250 UI de moroctocog alfa (aproximadamente 62,5 UI/ml después de la reconstitución).
|
1 jeringa precargada: 500 UI de moroctocog alfa (aproximadamente 125 UI/ml después de la | |
|
reconstitución). | |
|
1 jeringa precargada: 1000 UI de moroctocog alfa (aproximadamente 250 UI/ml después de la | |
|
reconstitución). | |
|
1 jeringa precargada: 2000 UI de moroctocog alfa (aproximadamente 500 UI/ml después de la | |
|
reconstitución). | |
1 jeringa precargada: 3000 UI de moroctocog alfa (aproximadamente 750 UI/ml después de la reconstitución).
3. LISTA DE EXCIPIENTES
Para mayor información consultar el prospecto Sacarosa,
dihidrato de cloruro cálcico,
L-histidina, polisorbato 80, cloruro sódico
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Polvo y disolvente para solución inyectable en jeringa precargada FuseNGo
1 jeringa precargada (250 UI de polvo en la cámara superior y 4 ml de disolvente en la cámara inferior)
1 jeringa precargada (500 UI de polvo en la cámara superior y 4 ml de disolvente en la cámara inferior)
1 jeringa precargada (1000 UI de polvo en la cámara superior y 4 ml de disolvente en la cámara inferior)
1 jeringa precargada (2000 UI de polvo en la cámara superior y 4 ml de disolvente en la cámara inferior)
1 jeringa precargada (3000 UI de polvo en la cámara superior y 4 ml de disolvente en la cámara inferior)
1 émbolo
1 sistema de perfusión estéril
2 toallitas con alcohol 1 esparadrapo
1 gasa
1 tapón estéril de ventilación
5. FORMA Y VIA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento. Vía intravenosa. Administración para un solo uso.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
Utilizar inmediatamente o en un plazo de 3 horas desde la reconstitución o después de la eliminación del tapón de goma gris de la cápsula doble de la jeringa precargada.
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Conservar y transportar refrigerado (entre 2°C y 8°C).
No congelar
Conservar la jeringa precargada en el embalaje original para protegerlo de la luz.
ReFacto AF puede conservarse a temperatura ambiente (hasta 25°C) durante un único periodo máximo de 3 meses. El producto no puede volver a refrigerarse después de haber sido almacenado a temperatura ambiente.
Fecha en la que se saca del frigorífico: ...................
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Pfizer Limited Ramsgate Road Sandwich Kent CT13 9NJ Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/99/103/009
EU/1/99/103/006
EU/1/99/103/007
EU/1/99/103/008
EU/1/99/103/005
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
ReFacto AF 250 ReFacto AF 500 ReFacto AF 1000 ReFacto AF 2000 ReFacto AF 3000
ETIQUETA DE LA JERINGA PRECARGADA
1. NOMBRE DEL MEDICAMENTO Y VIA(S) DE ADMINISTRACIÓN
ReFacto AF 250 UI polvo y disolvente para solución inyectable ReFacto AF 500 UI polvo y disolvente para solución inyectable ReFacto AF 1000 UI polvo y disolvente para solución inyectable ReFacto AF 2000 UI polvo y disolvente para solución inyectable ReFacto AF 3000 UI polvo y disolvente para solución inyectable Moroctocog alfa
(factor VIII de coagulación recombinante humano)
Vía intravenosa
2. FORMA DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento.
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
250 UI moroctocog alfa para un solo uso IV 500 UI moroctocog alfa para un solo uso IV 1000 UI moroctocog alfa para un solo uso IV 2000 UI moroctocog alfa para un solo uso IV 3000 UI moroctocog alfa para un solo uso IV
6. OTROS ~
Conservar en nevera
B. PROSPECTO
Prospecto: información para el usuario
ReFacto AF 250 UI polvo y disolvente para solución inyectable ReFacto AF 500 UI polvo y disolvente para solución inyectable ReFacto AF 1000 UI polvo y disolvente para solución inyectable ReFacto AF 2000 UI polvo y disolvente para solución inyectable
Moroctocog alfa (factor de coagulación VIII recombinante humano)
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted y no debe dárselo a otras personas, aunque tengan los mismos síntomas, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto:
1. Qué es ReFacto AF y para qué se utiliza
2. Qué necesita saber antes de empezar a usar ReFacto AF
3. Cómo usar ReFacto AF
4. Posibles efectos adversos
5. Conservación de ReFacto AF
6. Contenido del envase e información adicional
1. Qué es ReFacto AF y para qué se utiliza
ReFacto AF contiene el principio activo moroctocog alfa, factor de coagulación VIII recombinante humano. El factor VIII es necesario para que la sangre forme coágulos y detenga las hemorragias. En los pacientes con hemofilia A (deficiencia del factor VIII de nacimiento) no está presente o no actúa adecuadamente.
ReFacto AF se utiliza para el tratamiento y la prevención (profilaxis) de episodios hemorrágicos en adultos y niños de todas las edades (incluidos recién nacidos) con hemofilia A.
2. Qué necesita saber antes de empezar a usar ReFacto AF
No use ReFacto AF:
- si es alérgico a moroctocog alfa o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
- si es alérgico a las proteínas de hámster.
Consulte a su médico si tiene dudas.
Advertencias y precauciones
Consulte a su médico o farmacéutico antes de empezar a usar ReFacto AF
- si sufre reacciones alérgicas. Algunos de los signos de las reacciones alérgicas son dificultad para respirar, falta de aliento, hinchazón, urticaria, picores, opresión torácica, silbidos al respirar y tensión arterial baja. La anafilaxia es una reacción alérgica grave que produce dificultad para tragar o para respirar, enrojecimiento o hinchazón de las manos, de la cara o de ambas. Si se presenta alguno de esos síntomas, interrumpa la perfusión inmediatamente y póngase en contacto con su médico o busque asistencia médica de urgencias inmediata. En casos de reacciones alérgicas graves se debe plantear tratamiento alternativo.
- si su hemorragia no se detiene como cabría esperar póngase en contacto con su médico o busque asistencia médica de urgencia inmediata.
- si la hemorragia no se controla adecuadamente con la dosis habitual. Los pacientes que reciben productos con factor VIII pueden desarrollar en ocasiones anticuerpos contra el factor VIII (también llamados inhibidores del factor VIII), que pueden impedir que el producto de factor VIII funcione adecuadamente. Mientras esté en tratamiento con ReFacto AF se le debe someter a un control para determinar la presencia de algún inhibidor del factor VIII.
Uso de ReFacto AF con otros medicamentos
Informe a su médico o farmacéutico si está utilizando, ha utilizado recientemente o podría tener que
utilizar cualquier otro medicamento.
Embarazo, lactancia y fertilidad
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de
quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento.
Conducción y uso de máquinas
ReFacto AF no tiene influencia sobre la capacidad para conducir y utilizar máquinas.
ReFacto AF contiene sodio
ReFacto AF contiene 1,23 mmol (o 29 mg) de sodio por vial de polvo reconstituido. Informe a su
médico si está siguiendo una dieta pobre en sodio.
3. Cómo usar ReFacto AF
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico. En caso de duda, consulte a su médico o farmacéutico.
El tratamiento con ReFacto AF debe ser iniciado por un médico con experiencia en el tratamiento de pacientes con hemofilia A. Su médico decidirá la dosis de ReFacto AF que debe recibir. Esta dosis y su duración dependerán de sus necesidades individuales de tratamiento sustitutivo con factor VIII. ReFacto AF se administra mediante inyección en una vena y dicha inyección dura varios minutos. Las inyecciones de ReFacto AF pueden ser administradas por los pacientes o por sus cuidadores, siempre que hayan recibido la formación adecuada.
Durante su tratamiento su médico puede modificar la dosis de ReFacto AF que usted recibe.
Consulte con su médico antes de viajar. Cuando viaje debe llevar su producto de factor VIII en cantidad suficiente para el tratamiento previsto.
Se recomienda que cada vez que se administre ReFacto AF registre el nombre que figura en el envase y el número de lote del producto. Puede fijar una de las etiquetas despegables que se encuentran en el vial para documentar el número del lote en su diario o para notificar cualquier efecto secundario.
Reconstitución y administración
Las instrucciones facilitadas a continuación son una guía para la reconstitución y administración de ReFacto AF. Los pacientes deben seguir las instrucciones de reconstitución y administración específicas indicadas por sus médicos.
Para la reconstitución utilice sólo la jeringa precargada que se encuentra en el envase. Para la administración se pueden utilizar otras jeringas estériles desechables.
ReFacto AF se administra por perfusión intravenosa (IV) después de reconstituir el polvo liofilizado para inyección con la jeringa de disolvente suministrada, [una solución inyectable de cloruro sódico de 9 mg/ml (0,9%)]. No se debe mezclar ReFacto AF con otras soluciones para perfusión.
Lávese siempre las manos antes de realizar la reconstitución y administración. Durante el procedimiento de reconstitución debe seguirse una técnica aséptica (es decir, limpia y libre de gérmenes).
Reconstitución:
1. Espere a que el vial liofilizado de ReFacto AF y la jeringa precargada del disolvente alcancen la temperatura ambiente.
2. Retire el tapón de cierre de plástico del vial de ReFacto AF para que quede visible la parte central del tapón de goma.
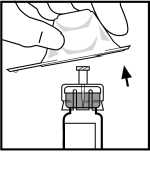
3. Limpie la parte superior del vial con la toallita empapada en alcohol que se proporciona o con otra solución antiséptica, y espere a que se seque. Después de limpiarlo no toque el tapón de goma con la mano ni deje que éste toque ninguna superficie.
4. Despegue la tapa del envase del adaptador del vial de plástico transparente. No saque el adaptador del envase.
5. Coloque el vial en una superficie plana. Mientras sujeta el envase del adaptador, coloque el adaptador del vial sobre el vial y presione con firmeza sobre el envase hasta que el adaptador encaje en la parte superior del vial y el punzón del adaptador penetre en el tapón del vial.
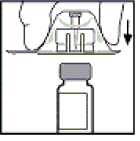
6. Retire el envase del adaptador y deseche el envase.
7.
Acople la varilla del émbolo a la jeringa de disolvente insertando la varilla en la apertura del tapón de la jeringa, presionándola y girándola con firmeza hasta que esté asentada en el tapón.
8. Retire la punta del tapón de plástico de la jeringa de disolvente rompiendo la perforación de la tapa. Esto se consigue doblando la tapa hacia arriba y hacia abajo hasta que se rompa la perforación. No toque el interior de la tapa ni la punta de la jeringa. Puede ser necesario volver a colocar la tapa (si no se administra de inmediato el ReFacto AF reconstituido), por lo que debe colocarse a un lado sobre su parte superior.
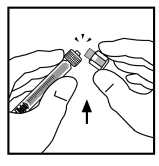
9. Coloque el vial sobre una superficie plana. Conecte la jeringa de disolvente al adaptador del vial insertando la punta de la jeringa en la apertura del adaptador mientras se presiona y gira con firmeza en el sentido de las agujas del reloj hasta que queda fija la conexión.

10. Empuje lentamente la varilla del émbolo para inyectar todo el disolvente en el vial de ReFacto AF.
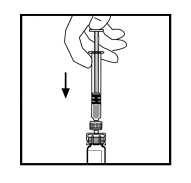
11. Con la jeringa aún conectada al adaptador, gire suavemente el vial hasta disolver el polvo.
12. Inspeccione visualmente la solución final en cuanto a la presencia de partículas antes de la administración. La solución tendrá un aspecto de transparente a ligeramente opalescente y será incolora.
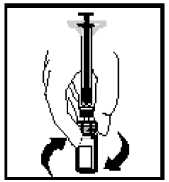
Nota: Si usa más de un vial de ReFacto AF por perfusión, cada vial debe reconstituirse siguiendo las instrucciones anteriores. La jeringa de disolvente debe ser retirada, dejando el adaptador del vial colocado en su sitio y puede utilizarse otra jeringa grande con cierre luer para extraer los contenidos reconstituidos de cada uno de los viales individuales.
13. Asegúrese de que la varilla del émbolo de la jeringa está aún totalmente introducida, dé la vuelta al vial y vuelva a poner lentamente toda la solución en la jeringa a través del adaptador del vial.
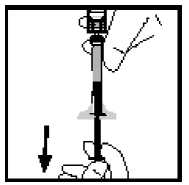
14. Separe la jeringa del adaptador del vial tirando de la jeringa y girándola en el sentido contrario al de las agujas del reloj. Deseche el vial con el adaptador.
Nota: Si no se usa inmediatamente la solución, se ha de colocar nuevamente la tapa de la jeringa cuidadosamente. No tocar la punta de la jeringa ni el interior de la tapa.
ReFacto AF debe utilizarse inmediatamente, o en las 3 horas siguientes a su reconstitución. Antes de la administración, la solución reconstituida puede conservarse a temperatura ambiente.
Administración (Perfusión Intravenosa):
ReFacto AF debe administrarse utilizando el sistema de perfusión suministrado en este envase y la jeringa precargada de disolvente que se suministra o una jeringa de plástico estéril desechable con cierre luer.
1. Acople la jeringa a la conexión luer del sistema de perfusión.
2. Aplique un torniquete y prepare el sitio de inyección limpiando bien la piel con una de las toallitas con alcohol que se suministran.
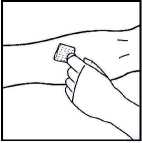
3. Inserte la aguja del sistema de perfusión en la vena, siguiendo las instrucciones de su médico, y retire el torniquete. Elimine el aire que pueda haber en el sistema de perfusión aspirándolo a la jeringa. Se debe inyectar por vía intravenosa el producto reconstituido en varios minutos. Su médico puede cambiarle la velocidad de perfusión recomendada para que sea más cómoda.
Deseche la solución no utilizada, el vial(es) vacío(s) y las agujas y jeringas utilizadas en un recipiente adecuado para eliminar desechos médicos, ya que estos materiales pueden dañar a otros si no se eliminan adecuadamente.
Si usa más ReFacto AF del que debiera
Consulte a su médico o farmacéutico.
Si interrumpe el tratamiento con ReFacto AF
No deje de utilizar ReFacto AF sin consultar con su médico.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Reacciones alérgicas
Si aparecen reacciones alérgicas (anafilácticas)súbitas, graves, debe detenerse inmediatamente la
infusión. Debe consultar a su médico inmediatamente si usted presenta alguno de los siguientes síntomas tempranos de reacciones alérgicas:
• erupción, habón urticarial, ronchas, picor generalizado
• hinchazón de labios y lengua
• dificultad para respirar, silbidos al respirar, opresión en el pecho
• sensación general de malestar
• mareo y pérdida de consciencia
Los síntomas graves, como la dificultad para respirar y el desmayo (o el casi desmayo), precisan de un rápido tratamiento de emergencia. Las reacciones alérgicas (anafilácticas) súbitas, graves son poco frecuentes (pueden afectar hasta 1 de cada 100 pacientes)
Desarrollo de inhibidores
Los pacientes con hemofilia A pueden presentar anticuerpos neutralizantes (inhibidores) al factor VIII. Un signo de la aparición de tales inhibidores puede ser un aumento de la cantidad de ReFacto AF que se necesita habitualmente para tratar una hemorragia, o la continuación de una hemorragia después de un tratamiento. En esos casos se recomienda ponerse en contacto con un centro especializado en hemofilia. Su médico puede querer vigilar la aparición de inhibidores. Aparecieron inhibidores en aproximadamente el 2% de los pacientes que recibieron ReFacto AF en un estudio de investigación.
Efectos adversos muy frecuentes (pueden afectar a más de 1 de cada 10 pacientes)
• desarrollo de inhibidores en pacientes que nunca habían sido tratados previamente con productos de factor VIII
• dolor de cabeza
• tos
• dolor articular
• fiebre
Efectos adversos frecuentes (pueden afectar hasta 1 de cada 10 pacientes)
• hemorragia
• desarrollo de inhibidores en pacientes que habían sido tratados previamente con productos de factor VIII
• mareo
• pérdida del apetito, diarrea, vómitos, dolor de estómago, náuseas
• urticaria, erupción cutánea, picor
• dolor muscular
• escalofríos, reacción relacionada con la localización del catéter
• algunos análisis de sangre pueden mostrar un incremento de anticuerpos contra el factor VIII
Efectos adversos poco frecuentes (pueden afectar hasta 1 de cada 100 pacientes)
• reacción alérgica grave
• entumecimiento, somnolencia, alteración del gusto
• dolor en el pecho, latidos cardíacos rápidos, palpitaciones
• presión arterial baja, dolor y enrojecimiento de las venas relacionado con la presencia de coágulos de sangre, rubefacción
• dificultad para respirar
• sudoración excesiva
• debilidad, reacción en el lugar de la inyección (incluido el dolor)
• ligero aumento de las enzimas cardiacas
• aumento de las enzimas hepáticas, aumento de la bilirrubina
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de ReFacto AF
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en el envase exterior y en la etiqueta del vial después de CAD. La fecha de caducidad es el último día del mes que se indica.
Conservar y transportar refrigerado (2°C-8°C). No congelar para evitar que se dañe la jeringa precargada que contiene el disolvente.
Para su comodidad, el medicamento se puede retirar de dicho almacenamiento y conservar a temperatura ambiente (hasta 25°C) durante un único período de 3 meses como máximo. Al final de este periodo de almacenamiento a temperatura ambiente el producto no debe volver a refrigerarse, debe ser utilizado o desechado. Anote en el envase exterior la fecha en la que se retira el ReFacto AF de la nevera y se pone a temperatura ambiente (hasta 25°C). Mantenga el vial dentro del envase exterior para protegerlo de la luz.
El producto reconstituido debe utilizarse en las 3 horas siguientes a la reconstitución.
La solución será de clara a ligeramente opalescente e incolora. No utilizar este medicamento si aprecia que es turbia o contiene partículas visibles.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que no necesita. De esta forma ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de ReFacto AF
- El principio activo es moroctocog alfa (factor VIII de coagulación recombinante). Cada vial de ReFacto AF contiene nominalmente 250, 500, 1000 o 2000 UI de moroctocog alfa.
- Los demás componentes son sacarosa, dihidrato de cloruro cálcico, L-histidina, polisorbato 80 y cloruro sódico. También se suministra un disolvente [solución inyectable de cloruro sódico de
9 mg/ml (0,9%)] para la reconstitución.
- Después de la reconstitución con el disolvente [solución de cloruro sódico de 9 mg/ml (0,9%)], cada vial contiene 62,5; 125; 250 o 500 UI, respectivamente (según la potencia de moroctocog alfa, es decir, 250, 500, 1000 o 2000 UI) de moroctocog alfa por 1 ml de solución preparada para inyección.
Aspecto del producto y contenido del envase
ReFacto AF es un vial de vidrio con polvo para inyección y un disolvente suministrado en una jeringa precargada.
El contenido del envase es:
- un vial de 250, 500, 1000 o 2000 UI de polvo de moroctocog alfa
- una jeringa precargada de disolvente, 4 ml de solución estéril inyectable de cloruro sódico de 9 mg/ml (0,9%), con una varilla de émbolo
- un dispositivo estéril de adaptación al vial para reconstitución
- un sistema de perfusión estéril
- dos toallitas con alcohol
- esparadrapo
- una gasa
Titular de la autorización de comercialización y responsable de la fabricación
Pfizer Limited Ramsgate Road Sandwich Kent CT13 9NJ Reino Unido
Fabricantes
Wyeth Farma S.A
Autovía del Norte A-1 Km 23
Desvío Algete Km 1
28700 San Sebastián de los Reyes
Madrid
España
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización.
|
Belgie /Belgique / Belgien Pfizer S.A./N.V. Tél/Tel: +32 (0)2 554 62 11 |
Lietuva Pfizer Luxembourg SARL filialas Lietuvoje Tel. +3705 2514000 |
|
Bt^rapna n^afeep HroKceMÓypr CAPH, KaoH Etarapua Tea.: +359 2 970 4333 |
Luxembourg/Luxemburg Pfizer S.A. Tél/Tel: +32 (0)2 554 62 11 |
|
Ceská Republika Pfizer PFE, spol. s.r.o. Tel: +420 283 004 111 |
Magyarország Pfizer Kft. Tel.: + 36 1 488 37 00 |
|
Danmark Pfizer ApS Tlf: +45 44 20 11 00 |
Malta Vivian Corporation Ltd. Tel: + 356 21 344610 |
|
Deutschland Pfizer Pharma GmbH Tel: +49 (0)30 550055 51000 |
Nederland Pfizer bv Tel: +31 (0)10 406 43 01 |
|
Eesti Pfizer Luxembourg SARL Eesti filiaal +372 666 7500 |
Norge Pfizer Norge AS Tlf: +47 67 526 100 |
|
EXláSa PFIZER EAAAI A.E. TpL +30 210 678 5800 |
Osterreich Pfizer Corporation Austria Ges.m.b.H. Tel: +43 (0)1 521 15-0 |
|
España Pfizer S.L. Tel: +34 91 490 99 00 |
Polska Pfizer Polska Sp. z o.o., Tel.: +48 22 335 61 00 |
|
France Pfizer Tél: +33 (0)1 58 07 34 40 |
Portugal Pfizer Biofarmaceutica, Sociedade Unipessoal Lda Tel: +351 21 423 5500 |
Hrvatska
Pfizer Croatia d.o.o.
Tel: + 385 1 3908 777
Ireland
Pfizer Healthcare Ireland Tel: 1800 633 363 (toll free) +44 (0)1304 616161
Ísland
Icepharma hf.
Sími: + 354 540 8000
Italia
Pfizer S.r.l.
Tel: +39 06 33 18 21
Kúrcpog
PFIZER EAAAI A.E. (CYPRUS BRANCH)
T^: +357 22 817690
Latvija
Pfizer Luxembourg SARL filíale Latvija
Tel: +371 670 35 775
Fecha de la última revisión de este prospecto:
Romanía
Pfizer Romania S.R.L.
Tel: +40 21 207 28 00
Slovenija
Pfizer Luxembourg SARL
Pfizer, podruznica za svetovanje s podrocja farmacevtske dejavnosti, Ljubljana Tel: + 386 (0) 1 52 11 400
Slovenská republika
Pfizer Luxembourg SARL, organizacná zlozka Tel: +421-2-3355 5500
Suomi/Finland
Pfizer Oy
Puh/Tel: +358 (0)9 43 00 40 Sverige
Pfizer Innovations AB Tel: + 46 (0)8 550 520 00
United Kingdom
Pfizer Limited
Tel: +44 (0)1304 616161
La información detallada de este medicamento está disponible en la página web de la Agencia Europea del Medicamento: http://www.ema.europa.eu/.
Prospecto: información para el usurario
ReFacto AF 250 UI polvo y disolvente para solución inyectable en jeringa precargada ReFacto AF 500 UI polvo y disolvente para solución inyectable en jeringa precargada ReFacto AF 1000 UI polvo y disolvente para solución inyectable en jeringa precargada ReFacto AF 2000 UI polvo y disolvente para solución inyectable en jeringa precargada ReFacto AF 3000 UI polvo y disolvente para solución inyectable en jeringa precargada
Moroctocog alfa (factor de coagulación VIII recombinante humano)
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted y no debe dárselo a otras personas, aunque tengan los mismos síntomas, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto:
1. Qué es ReFacto AF y para qué se utiliza
2. Qué necesita saber antes de empezar a usar ReFacto AF
3. Cómo usar ReFacto AF
4. Posibles efectos adversos
5. Conservación de ReFacto AF
6. Contenido del envase e información adicional
1. Qué es ReFacto AF y para qué se utiliza
ReFacto AF contiene el principio activo moroctocog alfa, factor de coagulación VIII recombinante humano. El factor VIII es necesario para que la sangre forme coágulos y detenga las hemorragias. En los pacientes con hemofilia A (deficiencia del factor VIII de nacimiento) no está presente o no actúa adecuadamente.
ReFacto AF se utiliza para el tratamiento y la prevención (profilaxis) de episodios hemorrágicos en adultos y niños de todas las edades (incluidos recién nacidos) con hemofilia A.
2. Qué necesita saber antes de empezar a usar ReFacto AF No use ReFacto AF:
- si es alérgico a moroctocog alfa o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
- si es alérgico a las proteínas de hámster.
Consulte a su médico si tiene dudas.
Advertencias y precauciones
Consulte a su médico o farmacéutico antes de empezar a usar ReFacto AF
- si sufre reacciones alérgicas. Algunos de los signos de las reacciones alérgicas son dificultad para respirar, falta de aliento, hinchazón, urticaria, picores, opresión torácica, silbidos al respirar y tensión arterial baja. La anafilaxia es una reacción alérgica grave que produce dificultad para tragar o para respirar, enrojecimiento o hinchazón de las manos, de la cara o de ambas. Si se presenta alguno de esos síntomas, interrumpa la perfusión inmediatamente y póngase en contacto con su médico o busque asistencia médica de urgencias inmediata. En casos de reacciones alérgicas graves se debe plantear tratamiento alternativo.
- si su hemorragia no se detiene como cabría esperar póngase en contacto con su médico o busque asistencia médica de urgencias inmediata.
- si la hemorragia no se controla adecuadamente con la dosis habitual. Los pacientes que reciben productos con factor VIII pueden desarrollar en ocasiones anticuerpos contra el factor VIII (también llamados inhibidores del factor VIII), que pueden impedir que el producto de factor VIII funcione adecuadamente. Mientras esté en tratamiento con ReFacto AF se le debe someter a un control para determinar la presencia de algún inhibidor del factor VIII.
Uso de ReFacto AF con otros medicamentos
Informe a su médico o farmacéutico si está utilizando, ha utilizado recientemente o podría tener que
utilizar cualquier otro medicamento.
Embarazo, lactancia y fertilidad
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de
quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento
Conducción y uso de máquinas
ReFacto AF no tiene influencia sobre la capacidad para conducir y utilizar máquinas.
ReFacto AF contiene sodio.
ReFacto AF contiene 1,23 mmol (ó 29 mg) de sodio por jeringa precargada de polvo
reconstituido. Informe a su médico si está siguiendo una dieta pobre en sodio.
3. Cómo usar ReFacto AF
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico. En caso de duda, consulte a su médico o farmacéutico.
El tratamiento con ReFacto AF debe ser iniciado por un médico con experiencia en el tratamiento de pacientes con hemofilia A. Su médico decidirá la dosis de ReFacto AF que debe recibir. Esta dosis y su duración dependerán de sus necesidades individuales de tratamiento sustitutivo con factor VIII. ReFacto AF se administra mediante inyección en una vena y dicha inyección dura varios minutos. Las inyecciones de ReFacto AF pueden ser administradas por los pacientes o por sus cuidadores, siempre que hayan recibido la formación adecuada.
Durante su tratamiento su médico puede modificar la dosis de ReFacto AF que usted recibe.
Consulte con su médico antes de viajar. Cuando viaje debe llevar su producto de factor VIII en cantidad suficiente para el tratamiento previsto.
Se recomienda que cada vez que se administre ReFacto AF registre el nombre que figura en el envase y el número de lote del producto. Puede fijar una de las etiquetas despegables que se encuentran en la jeringa precargada para documentar el número del lote en su diario o para notificar cualquier efecto secundario.
Reconstitución y administración
Las instrucciones facilitadas a continuación son una guía para la reconstitución y administración de ReFacto AF suministrado en jeringa precargada. Los pacientes deben seguir las instrucciones de reconstitución y administración específicas indicadas por sus médicos.
ReFacto AF se administra por perfusión intravenosa (IV) después de la reconstitución. La jeringa precargada está formada por dos cámaras, una cámara contiene el polvo liofilizado de ReFacto AF y la otra cámara contiene el disolvente [solución de cloruro sódico de 9 mg/ml (0,9%)]. A lo largo de estas instrucciones, se hará referencia a este dispositivo como jeringa precargada.
Para la reconstitución utilice sólo la jeringa precargada que se encuentra en el envase. Para la administración se pueden utilizar otras jeringas estériles desechables.
No se debe mezclar ReFacto AF con otras soluciones de perfusión.
Nota: Si necesita utilizar más de una jeringa precargada de ReFacto AF por perfusión, cada jeringa debe ser reconstituida de acuerdo a las instrucciones específicas. Para sacar el contenido reconstituido de cada jeringa, se puede utilizar una jeringa de 10 cc o una jeringa más grande con cierre luer (no incluida en este kit) (consultar las Instrucciones Adicionales).
Preparación
1. Lávese siempre las manos antes de realizar los siguientes procedimientos.
2. Durante el procedimiento de reconstitución debe seguirse una técnica aséptica (es decir, limpia y libre de gérmenes).
3. Para minimizar la exposición al aire, todos los componentes utilizados en la reconstitución y administración de este producto deben utilizarse lo antes posible después de la apertura del envase estéril.
Reconstitución
1. Deje que la jeringa precargada alcance la temperatura ambiente.
2. Extraiga los componentes del kit de la jeringa precargada de ReFacto AF y deposítelos en una superficie limpia, y asegúrese de que tiene todos los materiales que va a necesitar.
3. Sujete el émbolo como se muestra en el diagrama. Enrosque firmemente el émbolo en la apertura de la jeringa precargada de ReFacto AF, empujando y enroscando en el sentido de las agujas del reloj hasta notar resistencia (aproximadamente 2 giros).
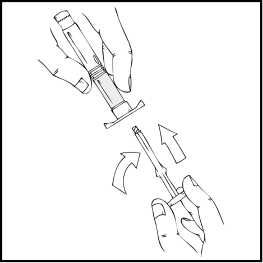
Durante el proceso de reconstitución, es importante mantener la jeringa precargada de ReFacto AF en posición vertical (con el polvo blanco encima de la solución clara) para prevenir posibles fugas.
4. Sujetando la jeringa precargada en posición vertical, quite el precinto blanco de seguridad
doblando el precinto de izquierda a derecha (o mediante un movimiento cuidadoso de balanceo) para romper la perforación del tapón y dejar descubierto el tapón de goma gris de la jeringa precargada de ReFacto AF.
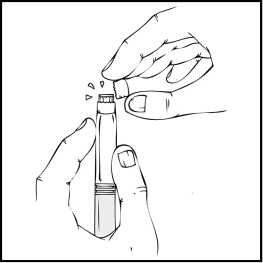
5. Retire el tapón azul estéril de ventilación de su envase.
Mientras sujeta la jeringa precargada de ReFacto AF en posición vertical, retire el tapón de goma gris y sustitúyalo con el tapón de protección azul para ventilación. Este tapón de ventilación tiene pequeños orificios que permiten que el aire escape para prevenir un aumento de la presión. Evite tocar la parte final abierta de la jeringa o el tapón de protección azul de ventilación.
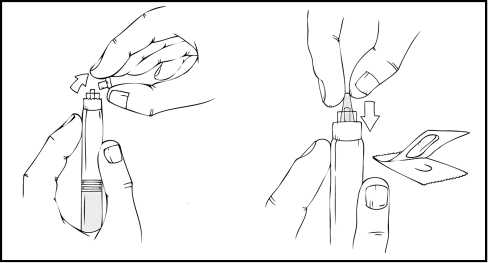
6. Empuje el émbolo lenta y cuidadosamente hasta que los dos émbolos de la jeringa precargada choquen, y todo el disolvente sea transferido a la cámara superior que contiene el polvo de ReFacto AF.
Nota: Para prevenir la fuga de fluido de la punta de la jeringa, no empuje el émbolo con excesiva fuerza.
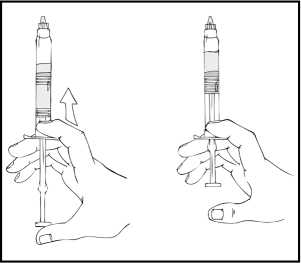
7. Con la jeringa precargada de ReFacto AF en posición vertical, agítela cuidadosamente varias veces hasta que el polvo se disuelva.
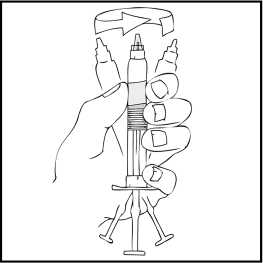
Inspeccione visualmente la solución final en cuanto a la presencia de partículas o decoloración. La solución debe tener un aspecto de transparente a ligeramente opalescente y será incolora. Deseche la jeringa precargada si se observan partículas o decoloración.
8. Continuando con la jeringa precargada de ReFacto AF en posición vertical, avance el émbolo hasta que prácticamente se haya eliminado, pero no todo, el aire de la cámara (superior).
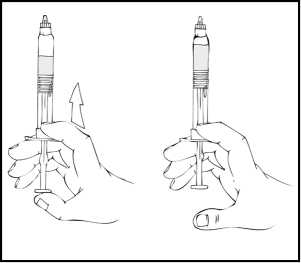
ReFacto AF debe utilizarse en las 3 horas siguientes a su reconstitución o eliminación del tapón gris de la jeringa precargada.
Si no va a utilizar la solución de ReFacto AF inmediatamente, debe guardar la jeringa en posición vertical, con el tapón azul de protección para ventilación en la jeringa precargada hasta que esté listo para la perfusión. La solución reconstituida se puede conservar a temperatura ambiente hasta 3 horas. Si no la ha utilizado en 3 horas, tírela.
Administración (Perfusión intravenosa)
Su médico u otro profesional sanitario le enseñará a realizar la perfusión de ReFacto AF. Una vez que haya aprendido como realizar la auto-perfusión, usted podrá seguir las instrucciones incluidas en este prospecto.
ReFacto AF se administra mediante perfusión intravenosa (IV) después de la reconstitución del polvo con el disolvente (cloruro sódico 0,9%). Una vez reconstituido y antes de la administración, ReFacto AF debe ser inspeccionado visualmente en cuanto a la presencia de partículas o decoloración.
ReFacto AF se debe administrar utilizando el sistema de perfusión incluido en este kit, a no ser que su médico u otro profesional sanitario le haya dado otra recomendación.
1. Retire el tapón de protección azul para la ventilación y acople firmemente el dispositivo de perfusión en la jeringa precargada de ReFacto AF.
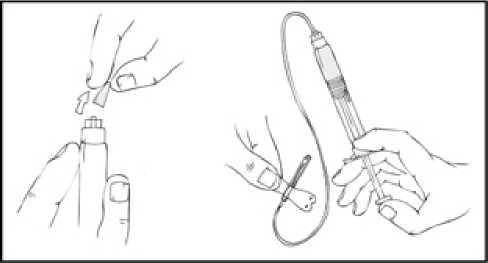
2. Aplique un torniquete y prepare el sitio de inyección limpiando bien la piel con una de las toallitas con alcohol que se suministran.
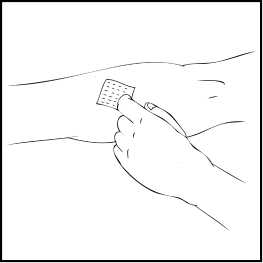
3. Retire la tapa protectora de la aguja e inserte la aguja de mariposa del sistema de perfusión en la vena, siguiendo las instrucciones de su médico u otro profesional sanitario. Se debe inyectar por vía intravenosa el producto reconstituido en varios minutos. Su médico puede cambiarle la velocidad de perfusión recomendada para que sea más cómoda. Hable con su médico u otro profesional sanitario sobre el procedimiento de perfusión. No realice auto-perfusión a no ser que esté entrenado debidamente.
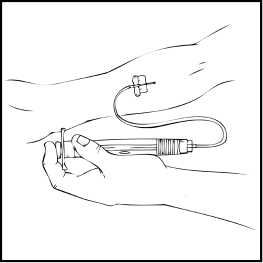
ReFacto AF reconstituido no debe ser administrado en el mismo tubo o envase con otros medicamentos.
4. Después de la perfusión de ReFacto AF, retire el sistema de perfusión y deséchelo. La cantidad de medicamento que queda en el sistema de perfusión no afecta a su tratamiento.
Nota: Deseche la solución no utilizada, la jeringa precargada vacía y los materiales médicos utilizados en un recipiente adecuado para eliminar desechos médicos, ya que estos materiales pueden dañar a otros si no se eliminan adecuadamente.
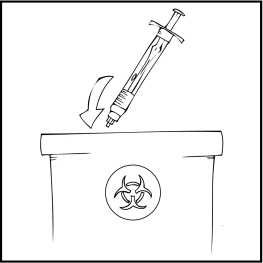
Se recomienda anotar el número de lote que se encuentra en la etiqueta de la jeringa precargada de ReFacto AF cada vez que utilice ReFacto AF. Puede utilizar la etiqueta despegable de la jeringa precargada de ReFacto AF para registrar el número de lote.
Instrucciones adicionales:
Reconstitución múltiple de ReFacto AF en jeringa precargada a una jeringa de 10cc o una jeringa más grande con cierre luer (las jeringas de 10cc o con cierre luer no se proporcionan en el kit).
Las siguientes instrucciones son para el uso de múltiples kits de ReFacto AF en jeringa precargada con una jeringa de 10cc o una jeringa más grande con cierre luer.
1. Reconstituya todas las jeringas precargadas de ReFacto AF siguiendo las instrucciones que se muestran más arriba (ver Reconstitución y Administración).
Sujete la jeringa precargada de ReFacto AF en posición vertical, lentamente empuje el émbolo hasta que casi, pero no todo, el aire haya salido de la cámara donde se encuentra el producto.
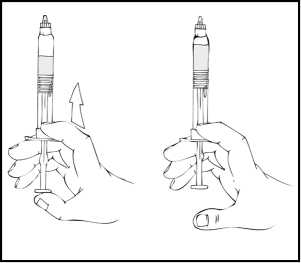
2. Retire el conector de la jeringa luer-to-luer del envase (los conectores de jeringa luer-to-luer no están incluidos).
3. Conecte una jeringa estéril de 10 cc o una jeringa más grande de cierre luer con el puerto abierto del conector de la jeringa y la jeringa precargada de ReFacto AF con el puerto abierto restante del lado opuesto.
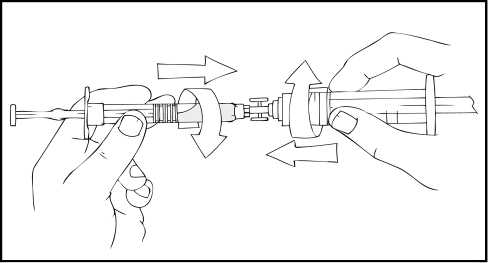
4. Con la jeringa precargada de ReFacto AF en la parte de arriba, empuje lentamente el émbolo hasta que el contenido se vacíe dentro de la jeringa de 10 cc o una jeringa más grande de cierre tipo luer.
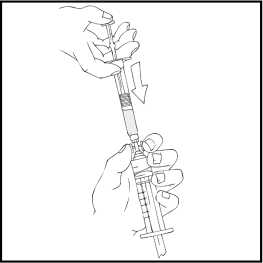
5. Retire la jeringa precargada de ReFacto AF y repita los procedimientos 3 y 4 para reconstituciones adicionales de jeringas.
6. Retire el conector de jeringa luer-to-luer de la jeringa de 10 cc o de la jeringa más grande de cierre luer y conecte el sistema de perfusión, según se describe más arriba en las instrucciones para la administración de la jeringa precargada [ver Administración (Perfusión intravenosa)].
Nota: Deseche la solución no utilizada, la jeringa precargada vacía y los materiales médicos utilizados en un recipiente adecuado para eliminar desechos médicos, ya que estos materiales pueden dañar a otros si no se eliminan adecuadamente.
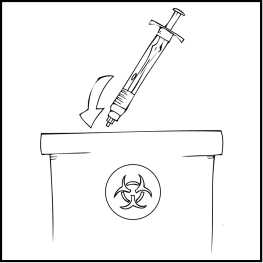
Si usa más ReFacto AF del que debiera
Consulte a su médico o farmacéutico.
Si interrumpe el tratamiento con ReFacto AF
No deje de utilizar ReFacto AF sin consultar con su médico.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Reacciones alérgicas
Si aparecen reacciones alérgicas (anafilácticas) súbitas, graves, debe detenerse inmediatamente la
infusión. Debe consultar a su médico inmediatamente si usted presenta alguno de los siguientes síntomas tempranos de reacciones alérgicas:
• erupción, habón urticarial, ronchas, picor generalizado
• hinchazón de labios y lengua
• dificultad para respirar, silbidos al respirar, opresión en el pecho
• sensación general de malestar
• mareo y pérdida de consciencia
Los síntomas graves, como la dificultad para respirar y el desmayo (o el casi desmayo), precisan de un rápido tratamiento de emergencia. Las reacciones alérgicas (anafilácticas) súbitas, graves son poco frecuentes (pueden afectar hasta 1 de cada 100 pacientes)
Desarrollo de inhibidores
Los pacientes con hemofilia A pueden presentar anticuerpos neutralizantes (inhibidores) al factor VIII. Un signo de la aparición de tales inhibidores puede ser un aumento de la cantidad de ReFacto AF que se necesita habitualmente para tratar una hemorragia, o la continuación de una hemorragia después de un tratamiento. En esos casos se recomienda ponerse en contacto con un centro especializado en hemofilia. Su médico puede querer vigilar la aparición de inhibidores. Aparecieron inhibidores en aproximadamente el 2% de los pacientes que recibieron ReFacto AF en un estudio de investigación.
Efectos adversos muy frecuentes (pueden afectar a más de 1 de cada 10 pacientes)
• desarrollo de inhibidores en pacientes que nunca habían sido tratados previamente con productos de factor VIII
• dolor de cabeza
• tos
• dolor articular
• fiebre
Efectos adversos frecuentes (pueden afectar hasta 1 de cada 10 pacientes)
• hemorragia
• desarrollo de inhibidores en pacientes que habían sido tratados previamente con productos de factor VIII
• mareo
• pérdida del apetito, diarrea, vómitos, dolor de estómago, náuseas
• urticaria, erupción cutánea, picor
• dolor muscular
• escalofríos, reacción relacionada con la localización del catéter
• algunos análisis de sangre pueden mostrar un incremento de anticuerpos contra el factor VIII
Efectos adversos poco frecuentes (pueden afectar hasta 1 de cada 100 pacientes)
• reacción alérgica grave
• entumecimiento, somnolencia, alteración del gusto
• dolor en el pecho, latidos cardíacos rápidos, palpitaciones
• presión arterial baja, dolor y enrojecimiento de las venas relacionado con la presencia de coágulos de sangre, rubefacción
• dificultad para respirar
• sudoración excesiva
• debilidad, reacción en el lugar de la inyección (incluido el dolor)
• ligero aumento de las enzimas cardiacas
• aumento de las enzimas hepáticas, aumento de la bilirrubina
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de ReFacto AF
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en el envase exterior y en la etiqueta de la jeringa precargada después de CAD. La fecha de caducidad es el último día del mes que se indica.
Conservar y transportar refrigerado (entre 2°C y 8°C). No congelar para evitar que se dañe la jeringa precargada.
Para su comodidad, el medicamento se puede retirar de dicho almacenamiento y conservar a temperatura ambiente (hasta 25°C) durante un único período de 3 meses como máximo. Al final de este periodo de almacenamiento a temperatura ambiente el producto no debe volver a refrigerarse, debe ser utilizado o desechado. Anote en el envase exterior la fecha en la que se retira ReFacto AF en jeringa precargada de la nevera y se pone a temperatura ambiente (hasta 25°C). Mantenga la jeringa precargada dentro del envase exterior para protegerlo de la luz.
El producto reconstituido debe utilizarse en las 3 horas siguientes a la reconstitución o eliminación del tapón gris.
La solución será de clara a ligeramente opalescente e incolora. No utilizar este medicamento si aprecia que es turbia o contiene partículas visibles.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de ReFacto AF
- El principio activo es moroctocog alfa (factor VIII de coagulación recombinante). Cada jeringa precargada de ReFacto AF contiene nominalmente 250, 500, 1000, 2000 o 3000 UI de moroctocog alfa.
Para la reconstitución de moroctocog alfa, se incluye un disolvente [solución inyectable de cloruro sódico de 9 mg/ml (0,9%)] en el envase de ReFacto AF jeringa precargada.
- Los demás componentes son sacarosa, dihidrato de cloruro cálcico, L-histidina, polisorbato 80 y cloruro sódico.
- Después de la reconstitución con el disolvente [solución de cloruro sódico de 9 mg/ml (0,9%)], la solución para inyección preparada contiene 62,5, 125, 250, 500 o 750 UI de moroctocog alfa por ml, respectivamente (según la potencia de moroctocog alfa, es decir, 250, 500, 1000, 2000 o 3000 UI).
Aspecto del producto y contenido del envase
ReFacto AF es una jeringa precargada con polvo y disolvente para solución inyectable que contiene el polvo de ReFacto AF en la cámara superior y el disolvente [solución inyectable de cloruro sódico de 9 mg/ml (0,9%)] en la cámara inferior.
El contenido del envase es:
- una jeringa precargada contiene 250, 500, 1000, 2000 o 3000 UI de polvo de moroctocog alfa y 4 ml de disolvente estéril de cloruro sódico 9 mg/ml (0,9%) solución para inyección para la reconstitución
- un émbolo
- un tapón protector estéril para la ventilación
- un sistema de perfusión estéril
- dos toallitas con alcohol
- esparadrapo
- una gasa
Titular de la autorización de comercialización y responsable de la fabricación
Pfizer Limited Ramsgate Road Sandwich Kent CT13 9NJ Reino Unido
Fabricante
Wyeth Farma, S.A.
Autovía del Norte A-1 Km 23
Desvío Algete Km 1
28700 San Sebastián de los Reyes
Madrid
España
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización.
Tel. +3705 2514000
|
Etnrapun n^afeep HroKceMÓypr CAPH, Khoh Etnrapna Ten.: +359 2 970 4333 |
Luxembourg/Luxemburg Pfizer S.A. Tél/Tel: +32 (0)2 554 62 11 |
|
Ceská Republika Pfizer PFE, spol. s.r.o. Tel: +420 283 004 111 |
Magyarország Pfizer Kft. Tel.: + 36 1 488 37 00 |
|
Danmark Pfizer ApS Tlf: +45 44 20 11 00 |
Malta Vivian Corporation Ltd. Tel : + 356 21 344610 |
|
Deutschland Pfizer Pharma GmbH Tel: +49 (0)30 550055 51000 |
Nederland Pfizer bv Tel: +31 (0)10 406 43 01 |
|
Eesti Pfizer Luxembourg SARL Eesti filiaal +372 666 7500 |
Norge Pfizer Norge AS Tlf: +47 67 526 100 |
|
EXláSa PFIZER EAAAI A.E. Tp^: +30 210 678 5800 |
Osterreich Pfizer Corporation Austria Ges.m.b.H. Tel: +43 (0)1 521 15-0 |
|
España Pfizer, S.L. Tel: +34 91 490 99 00 |
Polska Pfizer Polska Sp. z o.o., Tel.: +48 22 335 61 00 |
|
France Pfizer Tél: +33 (0)1 58 07 34 40 |
Portugal Pfizer Biofarmaceutica, Sociedade Unipessoal Lda Tel: +351 21 423 5500 |
|
Hrvatska Pfizer Croatia d.o.o. Tel: + 385 1 3908 777 |
Romanía Pfizer Romania S.R.L. Tel: +40 21 207 28 00 |
|
Ireland Pfizer Healthcare Ireland Tel: 1800 633 363 (toll free) +44 (0)1304 616161 |
Slovenija Pfizer Luxembourg SARL Pfizer, podruznica za svetovanje s podrocja farmacevtske dejavnosti, Ljubljana Tel: + 386 (0) 1 52 11 400 |
|
Ísland Icepharma hf. Sími: + 354 540 8000 |
Slovenská republika Pfizer Luxembourg SARL, organizacná zlozka Tel: +421-2-3355 5500 |
|
Italia Pfizer S.r.l. Tel: +39 06 33 18 21 |
Suomi/Finland Pfizer Oy Puh/Tel: +358 (0)9 43 00 40 |
Kúrcpog
Sverige
Pfizer Innovations AB Tel: + 46 (0)8 550 520 00
PFIZER EAAAI A.E. (CYPRUS BRANCH)
T^: +357 22 817690
Latvija
Pfizer Luxembourg SARL filíale Latvija
Tel: +371 670 35 775
United Kingdom
Pfizer Limited
Tel: +44 (0)1304 616161
Fecha de la última revisión de este prospecto:
La información detallada de este medicamento está disponible en la página web de la Agencia Europea del Medicamento: http://www.ema.europa.eu/.
51