Reandron 1000 Mg/4 Ml Solucion Inyectable
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
Reandron 1000 mg/4 ml, solución inyectable.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada ml de solución inyectable contiene 250 mg de undecanoato de testosterona, que corresponden a 157,9 mg de testosterona.
Cada ampolla /vial con 4 ml de solución inyectable contiene 1000 mg de undecanoato de testosterona que corresponden a 631,5 mg de testosterona.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA Solución inyectable.
Solución oleosa clara de color amarillento.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Terapia de sustitución de testosterona en el hipogonadismo masculino, cuando el déficit de testosterona ha sido confirmado mediante datos clínicos y pruebas bioquímicas (ver sección 4.4 )
4.2 Posología y forma de administración 4.2.1 Posología
Se administra 1 ampolla /vial de Reandron (que corresponde a 1000 mg de undecanoato de testosterona) mediante inyección, cada 10 a 14 semanas. La administración de las inyecciones con esta frecuencia permite mantener niveles suficientes de testosterona sin producir acumulación.
Comienzo del tratamiento
Antes de comenzar el tratamiento y durante el inicio del mismo, se deben determinar los niveles séricos de testosterona. Dependiendo de los niveles séricos de testosterona y de los síntomas clínicos, el intervalo a partir de la primera inyección puede reducirse hasta un mínimo de 6 semanas, comparado con el intervalo recomendado de mantenimiento de 10 a 14 semanas. Con esta dosis inicial, se pueden alcanzar más rápidamente los niveles de testosterona suficientes para lograr el estado de equilibrio.
Mantenimiento e individualización del tratamiento
El intervalo entre las inyecciones debe mantenerse dentro del límite recomendado de 10 a 14 semanas. Se requiere realizar un seguimiento cuidadoso de los niveles séricos de testosterona durante el mantenimiento del tratamiento. Es recomendable determinar los niveles séricos de testosterona de forma regular. Las determinaciones deben realizarse inmediatamente antes de la siguiente dosis , teniendo en cuenta también los síntomas clínicos. Estos niveles séricos deberían encontrarse dentro del tercio inferior del rango normal. Los niveles séricos que estén por debajo del rango normal indicarían la necesidad de acortar el intervalo
entre las inyecciones. En caso de que los niveles séricos estén elevados, puede valorarse un aumento del intervalo entre las inyecciones.
Poblaciones especiales
Población pediátrica
No está indicado el uso de Reandron en niños y adolescentes, y no ha sido evaluado clínicamente en hombres menores de 18 años de edad (ver sección 4.4).
Pacientes de edad avanzada
Los escasos datos disponibles no sugieren la necesidad de un ajuste de dosis en pacientes de edad avanzada (ver sección 4.4).
Pacientes con insuficiencia hepática
No se han realizado estudios en pacientes con insuficiencia hepática. El uso de Reandron está contraindicado en hombres que tienen o han tenido tumores hepáticos (ver sección 4.3).
Pacientes con insuficiencia renal
No se han realizado estudios en pacientes con insuficiencia renal.
4.2.2 Forma de administración Administración por vía intramuscular.
Las inyecciones deben administrarse muy lentamente (durante dos minutos). Reandron sólo debe administrarse por vía intramuscular. Se debe tener cuidado de inyectar Reandron en el músculo glúteo de forma profunda, siguiendo las precauciones habituales para la administración intramuscular. Se debe tener especial precaución para evitar la inyección intravasal (ver en sección 4.4, “Aplicación”). El contenido de la ampolla / vial se debe administrar por vía intramuscular inmediatamente tras su apertura (Para la ampolla ver en sección 6.6 las instrucciones para abrir la ampolla de forma segura).
4.3 Contraindicaciones
El uso de Reandron está contraindicado en hombres:
- con carcinoma prostático andrógeno dependiente o carcinoma de glándula mamaria en hombres
- que hayan tenido o que tengan tumores hepáticos
- con hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
El uso de Reandron en mujeres está contraindicado.
4.4 Advertencias y precauciones especiales de empleo
No se recomienda el uso de Reandron en niños y adolescentes.
Reandron solo debe usarse si el hipogonadismo (hiper e hipogonadotrófico) ha sido demostrado y si cualquier otra etiología, responsable de los síntomas, ha sido excluida antes del inicio del tratamiento.
La insuficiencia de testosterona debe ser claramente demostrada mediante datos clínicos (regresión de las características sexuales secundarias, cambio en la composición corporal, astenia, disminución de la libido, disfunción eréctil, etc...) y confirmada mediante dos determinaciones de testosterona sérica distintas.
Pacientes de edad avanzada
La experiencia sobre la seguridad y eficacia del uso de Reandron en pacientes mayores de 65 años de edad es limitada. Actualmente, no existe consenso sobre unos valores de referencia de testosterona específicos según la edad. No obstante, debe tenerse en cuenta que los niveles séricos fisiológicos de testosterona disminuyen con la edad.
Examen médico y pruebas de laboratorio
Examen médico
Antes del inicio del tratamiento con testosterona, se debe realizar un examen médico detallado a todos los pacientes, con el fin de excluir el riesgo de un cáncer de próstata ya existente. En pacientes que reciban terapia con testosterona debe realizarse un seguimiento prostático y mamario periódico cuidadoso, de acuerdo a los métodos establecidos (tacto rectal y determinación sérica de PSA), al menos una vez al año, y dos veces al año en pacientes de edad avanzada o pacientes de riesgo (aquellos con factores de riesgo clínicos o familiares). Se tendrán en cuenta las directrices locales para la monitorización de la seguridad en la terapia de sustitución de la testosterona.
Pruebas de laboratorio
Se deben monitorizar los niveles de testosterona basal y a intervalos regulares durante el tratamiento. Los facultativos deben ajustar la dosis de forma individualizada para asegurar el mantenimiento de niveles de testosterona eugonadales.
En pacientes en tratamiento con andrógenos a largo plazo, se monitorizarán además de forma periódica los siguientes parámetros analíticos: hemoglobina y hematocrito, pruebas de función hepática y perfil lipídico (ver sección 4.8).
Debido a la variabilidad en los valores de laboratorio, todas las determinaciones de testosterona deben ser realizadas en el mismo laboratorio.
Tumores
Los andrógenos pueden acelerar la progresión de un cáncer subclínico de próstata y una hiperplasia benigna de próstata.
Reandron debe usarse con precaución en pacientes con cáncer y riesgo de hipercalcemia (e hipercalciuria asociada) debido a metástasis óseas. En estos pacientes se recomienda el control regular de las concentraciones séricas de calcio.
Se han comunicado casos de tumores hepáticos benignos y malignos en usuarios de productos hormonales, como los andrógenos. Si aparecen molestias graves en la parte superior del abdomen, hepatomegalia o signos de hemorragia abdominal en hombres que han recibido tratamiento con Reandron, deberá considerarse un diagnóstico diferencial de tumor hepático.
Insuficiencia cardiaca, hepática o renal
En pacientes con insuficiencia cardiaca, hepática o renal grave o con cardiopatía isquémica, el tratamiento con testosterona puede causar complicaciones graves, caracterizadas por edema con o sin insuficiencia cardiaca congestiva. En este caso, se debe interrumpir el tratamiento inmediatamente.
Insuficiencia hepática o renal
No se han realizado estudios para demostrar la eficacia y seguridad de este medicamento en pacientes con insuficiencia hepática o renal. Por tanto, el tratamiento de sustitución de testosterona en estos pacientes se realizará con precaución.
Insuficiencia cardiaca
Debe emplearse especial precaución en pacientes con predisposición a desarrollar edema, por ejemplo en caso de insuficiencia cardiaca, hepática o renal grave o de cardiopatía isquémica, ya que el tratamiento con andrógenos puede aumentar la retención de sodio y agua. En caso de complicaciones graves determinadas por la presencia de edema, con o sin insuficiencia cardiaca congestiva, el tratamiento debe interrumpirse inmediatamente (ver sección 4.8).
La testosterona puede aumentar la presión arterial, por lo que Reandron se debe usar con precaución en varones con hipertensión. Como norma general, siempre se deben tener en cuenta las limitaciones en el uso de inyecciones intramusculares en pacientes con trastornos hereditarios o adquiridos de la coagulación sanguínea.
Otras patologías
Reandron debe usarse con precaución en pacientes con epilepsia o migraña, ya que estas enfermedades pueden verse agravadas.
En pacientes tratados con andrógenos que alcanzan concentraciones plasmáticas normales de testosterona tras la terapia de sustitución puede ocurrir un aumento de la sensibilidad a la insulina.
Determinados signos clínicos: irritabilidad, nerviosismo, aumento de peso, erecciones prolongadas o frecuentes, pueden indicar una excesiva exposición a los andrógenos, requiriéndose un ajuste de la dosis.
Puede potenciarse la apnea del sueño preexistente.
Se debe advertir a los atletas tratados con sustitución de testosterona por hipogonadismo masculino primario o secundario que este medicamento contiene un principio activo que puede dar lugar a resultados positivos en los análisis de dopaje.
Los andrógenos no son apropiados para mejorar el desarrollo muscular en personas sanas o para aumentar la capacidad física.
El tratamiento con Reandron deber ser retirado de forma permanente si los síntomas por una exposición excesiva a los andrógenos persisten o aparecen de nuevo durante el tratamiento a las dosis recomendadas.
Aplicación
Como con todas las soluciones oleosas, Reandron debe inyectarse únicamente por vía intramuscular y muy lentamente (durante dos minutos). El microembolismo pulmonar relacionado con las soluciones oleosas puede dar lugar en raras ocasiones a signos o síntomas tales como tos, disnea, malestar, hiperhidrosis, dolor torácico, mareos, parestesia o síncope. Estas reacciones pueden ocurrir durante o inmediatamente después de la inyección y son reversibles. El paciente deberá ser mantenido en observación durante e inmediatamente después de cada inyección con el fin de poder apreciar los posibles signos y síntomas de microembolismo pulmonar relacionado con las soluciones oleosas. El tratamiento es normalmente de apoyo, por ejemplo, administración de oxígeno suplementario.
Aceite de ricino refinado
Este medicamento puede producir reacciones alérgicas graves porque contiene aceite de ricino refinado.
Se han notificado sospechas de reacciones anafilácticas tras la inyección de Reandron.
4.5 Interacción con otros medicamentos y otras formas de interacción
Anticoagulantes orales
Se ha informado que la testosterona y sus derivados aumentan la actividad de los anticoagulantes orales derivados cumarínicos. Aquellos pacientes en tratamiento con anticoagulantes orales requieren un estrecho seguimiento, especialmente durante el comienzo y finalización de la terapia con andrógenos. Se recomienda un aumento de la monitorización del tiempo de la protrombina y de las determinaciones de INR.
¡m
Otras interacciones
La administración concomitante de testosterona con ACTH o corticosteroides puede favorecer la formación de edema; de esta manera, estos principios activos deben ser administrados cuidadosamente, particularmente en pacientes con enfermedades hepáticas o cardiacas, o en pacientes con predisposición al edema.
Interacciones con pruebas de laboratorio: los andrógenos pueden disminuir los niveles de la globulina fijadora de tiroxina, dando lugar a una disminución de los niveles séricos totales de T4 y un aumento de la captación de resina de T3 y T4. No obstante, los niveles de hormona tiroidea libre permanecen inalterados, no existiendo evidencia clínica de disfunción tiroidea.
4.6 Fertilidad, embarazo y lactancia
Fertilidad
La terapia de sustitución de testosterona puede reducir la espermatogénesis de forma reversible (ver secciones 4.8 y 5.3).
Embarazo y lactancia
El uso de Reandron no está indicado en mujeres y no debe ser usado en mujeres embarazadas o en periodo de lactancia (ver sección 4.3).
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
Reandron no influye sobre la capacidad para conducir y utilizar máquinas.
4.8 Reacciones adversas Resumen del perfil de seguridad
Para las reacciones adversas asociadas al uso de andrógenos, ver también la sección 4.4.
Las reacciones adversas notificadas más frecuentemente durante el tratamiento con Reandron son acné y dolor en el lugar de inyección.
El microembolismo pulmonar relacionado con las soluciones oleosas puede dar lugar en casos raros a signos y síntomas como tos, disnea, malestar, hiperhidrosis, dolor torácico, mareo, parestesia o síncope. Estas reacciones pueden ocurrir durante o inmediatamente después de la inyección y son reversibles. Tanto en ensayos clínicos como en la experiencia post-comercialización los casos en los que existe una sospecha de microembolismo pulmonar oleoso se han descrito (ya sea por parte de la compañía o de otros notificadores) raramente (frecuencia entre > 1/10.000 y < 1/1.000 inyecciones) (ver sección 4.4).
Se han notificado sospechas de reacciones anafilácticas tras la inyección de Reandron.
Los andrógenos pueden acelerar la progresión del cáncer de próstata subclínico y de la hiperplasia prostática benigna.
La tabla 1 muestra las reacciones adversas a este medicamento según la clasificación por órganos y sistemas MedDRA. Las frecuencias se basan en datos obtenidos de los ensayos clínicos y se definen como frecuentes (> 1/100 a < 1/10), poco frecuentes (> 1/1000 a < 1/100) y raras (>1/10.000 a < 1/1.000). Se recogieron reacciones adversas procedentes de 6 ensayos clínicos (N = 422) y fueron consideradas al menos posiblemente relacionadas con Reandron.
Tabla de reacciones adversas
¡m
Tabla 1, Grupos de frecuencias de hombres con reacciones adversas, según la clasificación por órganos y sistemas MedDRA - a partir de datos agrupados procedentes de seis ensayos clínicos, N = 422 (100,0%), de los que, N =302 hombres con hipogonadismo tratados con inyecciones intramusculares de 4 ml y N = 120 hombres con hipogonadismo tratados con inyecciones de 3 ml de testosterona undecanoato 250mg/ml.
|
Clasificación órgano -sistema |
Frecuentes (> 1/100 a < 1/10) |
Poco frecuentes: (> 1/1000 a <1/100) |
Raras (>1/10.000 a < 1/1.000) |
|
Trastornos de la sangre y del sistema linfático |
Policitemia Aumento del hematocrito* Aumento del recuento de eritrocitos* Aumento de la hemoglobina* | ||
|
Trastornos del sistema inmunológico |
Hipersensibilidad | ||
|
Trastornos del metabolismo y de la nutrición |
Aumento de peso |
Aumento del apetito Aumento de la hemoglobina glicosilada Hipercolesterolemia Aumento de los triglicéridos en sangre Aumento del colesterol en sangre | |
|
Trastornos psiquiátricos |
Depresión Alteraciones emocionales Insomnio Inquietud Agresividad Irritabilidad | ||
|
Trastornos del sistema nervioso |
Cefalea Migraña Temblores | ||
|
Trastornos vasculares |
Sofocos |
Alteraciones cardiovasculares Hipertensión Mareos | |
|
Trastornos respiratorios, torácicos y mediastínicos |
Bronquitis Sinusitis Tos Disnea Ronquidos Disfonía | ||
|
Trastornos gastrointestinales |
Diarrea Nauseas | ||
|
Trastornos hepatobiliares |
Alteraciones de las pruebas de la función hepática Aumento de la aspartato aminotransferasa | ||
|
Trastornos de la piel y del tejido subcutáneo |
Acné |
Alopecia Eritema Erupción 1 Prurito Piel seca | |
|
Trastornos musculoesqueléticos y |
Artralgia Dolor en las extremidades |
¡m
|
Clasificación órgano - |
Frecuentes |
Poco frecuentes: |
Raras |
|
sistema |
(> 1/100 a < 1/10) |
(> 1/1000 a <1/100) |
(>1/10.000 a < 1/1.000) |
|
del tejido conjuntivo |
Alteraciones musculares 2 Rigidez musculoesquelética Aumento de creatin fosfoquinasa en sangre | ||
|
Disminución del flujo | |||
|
Trastornos renales y |
urinario | ||
|
urinarios |
Retención urinaria Alteraciones del conducto urinario Nocturia Disuria | ||
|
Trastornos del aparato reproductor y de la mama |
Aumento del antígeno prostático específico Examen anormal de la próstata Hiperplasia prostática benigna |
Neoplasia prostática intraepitelial Induración de la próstata Prostatitis Alteración de la próstata Alteraciones de la libido Dolor testicular Induración mamaria Dolor mamario Ginecomastia Aumento del estradiol Aumento de la testosterona | |
|
Trastornos generales y alteraciones en el lugar de administración |
Diversos tipos de reacciones en el lugar de la inyección3 |
Fatiga Astenia Hiperhidrosis 4 | |
|
Lesiones traumáticas, |
Microembolia | ||
|
intoxicaciones y complicaciones de procedimientos terapéuticos |
pulmonar grasa** |
* Frecuencias observadas con el uso de medicamentos que contienen testosterona. ** Frecuencia determinada en base al número de inyecciones
Se incluye el término MedDRA más adecuado para describir una determinada reacción. No se enumeran los sinónimos y trastornos relacionados, pero también deberán tenerse en cuenta.
1 Erupción: incluye erupción papular.
2 Alteraciones musculares: espasmo muscular, distensión muscular y mialgia.
3 Diversos tipos de reacciones en el lugar de la inyección: dolor, malestar, prurito, eritema, hematoma, irritación o reacción en el lugar de inyección.
4 Hiperhidrosis: hiperhidrosis y sudores nocturnos.
Descripción de reacciones adversas seleccionadas
La microembolia pulmonar asociada a la administración de soluciones oleosas puede, en raras ocasiones, dar lugar a síntomas tales como tos, disnea, malestar, hiperhidrosis, dolor torácico, mareos, parestesia o síncope. Estas reacciones pueden producirse durante o inmediatamente después de la inyección y son reversibles. Tanto en la experiencia post-comercialización como en las sospechas notificadas por la compañía o los investigadores en ensayos clínicos, la microembolia pulmonar grasa se ha notificado raramente con frecuencias de > 1/10.000 y < 1/1.000 inyecciones (ver sección 4.4.).
Además de las reacciones adversas mencionadas anteriormente, durante el tratamiento con productos que contienen testosterona se ha informado de casos de nerviosismo, hostilidad, apnea del sueño, diversas
¡m
reacciones dérmicas incluyendo seborrea, crecimiento excesivo del vello, aumento de la frecuencia de las erecciones y en casos muy raros, ictericia.
El tratamiento con productos con dosis elevadas de testosterona generalmente interrumpe o reduce de forma reversible la espermatogénesis, reduciéndose el tamaño de los testículos; la terapia de sustitución de testosterona en el hipogonadismo puede dar lugar en casos raros a erecciones persistentes y dolorosas (priapismo). En tratamientos prolongados o con altas dosis de testosterona, puede aumentar ocasionalmente la retención de líquidos y edema.
Notificaciones de sospechas de reacciones adversas
Es importante notificar las sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: www.notificaram.es.
4.9 Sobredosis
En caso de sobredosis no es necesaria ninguna medida terapéutica especial, excepto interrumpir el tratamiento con el medicamento o reducir la dosis.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Andrógenos, derivados del 3-oxoandrosteno (4)
Código ATC: G03BA03
El undecanoato de testosterona es un éster del andrógeno natural testosterona. La forma activa, testosterona, se forma por rotura de la cadena lateral.
La testosterona es el andrógeno más importante del hombre, sintetizado principalmente en los testículos y, en menor grado, en la corteza suprarrenal.
La testosterona es responsable de la aparición de las características masculinas durante la vida fetal, la primera infancia y el desarrollo puberal, siendo posteriormente la hormona que mantiene el fenotipo masculino y las funciones que dependen de los andrógenos (por ej.: espermatogénesis, glándulas sexuales accesorias). También realiza funciones, por ej.: en la piel, los músculos, los huesos, los riñones, el hígado, la médula ósea y el SNC.
Dependiendo del órgano sobre el que realice su acción, el espectro de actividades de la testosterona es principalmente androgénico (por ej., próstata, vesículas seminales, epidídimo) o proteico-anabólico (músculos, huesos, hematopoyesis, riñón, hígado).
Los efectos de la testosterona en algunos órganos surgen a partir de la conversión periférica de la testosterona en estradiol, que luego se une a los receptores estrogénicos en el núcleo de las células diana, por ej.: células hipofisarias, grasas, cerebrales, óseas y células de Leydig testiculares.
5.2 Propiedades farmacocinéticas
Absorción
Reandron es una preparación de undecanoato de testosterona de liberación lenta que se administra por vía intramuscular, evitando de esta manera el efecto de primer paso. Después de la inyección intramuscular del undecanoato de testosterona en forma de solución oleosa, el compuesto se libera gradualmente y se descompone casi por completo a través de las estearasas séricas en testosterona y ácido undecanoico. Un día después de la administración ya es posible detectar un aumento de los niveles séricos de testosterona por encima de los valores basales.
¡m
Condiciones de equilibrio
Después de la 1a inyección intramuscular de 1000 mg de undecanoato de testosterona en varones hipogonádicos, se alcanzaron valores medios de Cmax de 38 nmol/L (11 ng/mL) después de 7 días. La segunda dosis fue administrada 6 semanas después de la 1a inyección, alcanzándose concentraciones máximas de testosterona de aproximadamente 50 nmol/L (15 ng/mL). Durante las tres siguientes administraciones se mantuvo un intervalo constante de dosificación de 10 semanas, alcanzándose el estado de equilibrio entre la 3a y la 5a administración. Los valores medios aproximados de la Cmáx y la Cmín de testosterona en estado de equilibrio fueron de 37 (11 ng/mL) y 16 nmol/L (5 ng/mL), respectivamente. La variabilidad intra e interindividual media (coeficiente de variación, %) de los valores de Cmin fue del 22% (rango: 9-28%) y 34% (rango: 25-48%), respectivamente.
Distribución
En el suero del hombre, aproximadamente el 98% de la testosterona circulante se une a la globulina fijadora de hormonas sexuales (SHBG) y a la albúmina. Sólo la fracción libre de la testosterona se considera biológicamente activa. Después de la infusión intravenosa de testosterona a hombres de edad avanzada, la vida media de eliminación de la testosterona fue aproximadamente de 1 hora, determinándose un volumen de distribución aparente de 1,0 l/kg aproximadamente.
Biotransformación
La testosterona, que se genera por la rotura del éster de undecanoato de testosterona, se metaboliza y excreta de la misma manera que la testosterona endógena. El ácido undecanoico se metaboliza por p-oxidación de la misma manera que otros ácidos carboxílicos alifáticos. Los principales metabolitos activos de la testosterona son estradiol y dihidrotestosterona.
Eliminación
La testosterona sufre un amplio metabolismo hepático y extrahepático. Después de la administración de testosterona marcada radioactivamente, cerca del 90% de la radioactividad se encuentra en la orina en forma de conjugados de ácido glucurónico y sulfúrico, y el 6% se encuentra en las heces después de pasar la circulación enterohepática. Los productos medicinales urinarios incluyen la androsterona y la etiocolanolona. Después de la administración intramuscular de esta formulación depot, la tasa de liberación se caracteriza por una vida media de 90 ± 40 días.
5.3 Datos preclínicos sobre seguridad
Los estudios toxicológicos no han mostrado otros efectos que aquellos que pueden ser explicados basándose en el perfil hormonal de Reandron.
Testosterona ha mostrado ser no mutagénica in vitro, usando el modelo de mutación invertida (test de Ames) o células ováricas de hámster. En estudios con animales de laboratorio se ha encontrado una relación entre el tratamiento con andrógenos y determinados tipos de cáncer. Los datos experimentales en ratas han mostrado un aumento en las incidencias de cáncer de próstata después del tratamiento con testosterona.
Se sabe que las hormonas sexuales facilitan el desarrollo de determinados tumores, inducidos por agentes carcinogénicos conocidos. Se desconoce la relevancia clínica de esta última observación.
Los estudios de fertilidad realizados en roedores y primates han demostrado que el tratamiento con testosterona puede afectar la fertilidad suprimiendo la espermatogénesis de forma dosis-dependiente.
¡m
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Benzoato de bencilo aceite de ricino refinado.
6.2 Incompatibilidades
No se han realizado estudios de compatibilidad por lo cual este medicamento no debe mezclarse con otros medicamentos.
6.3 Periodo de validez
5 años.
El medicamento debe ser usado inmediatamente después de abrirse por primera vez.
6.4 Precauciones especiales de conservación
Este medicamento no requiere condiciones especiales de conservación.
6.5 Naturaleza y contenido del envase Ampolla
Ampollas de vidrio de color topacio (tipo I) de 5 ml, que contienen un volumen de llenado de 4 ml.
Tamaño del envase: 1 x 4 ml.
Vial
Vial de vidrio (tipo I) de color topacio de 6 ml con tapón de bromobutilo de color gris con revestimiento de ETFE para inyectables y cápsula de cierre, con un volumen de llenado de 4 ml.
Tamaño del envase: 1 x 4 ml
6.6 Precauciones especiales de eliminación y otras manipulaciones
La solución para inyección intramuscular debe ser inspeccionada de forma visual antes de su uso, debiendo ser usadas solo aquellas soluciones claras y libres de partículas.
El medicamento es para un único uso, debiendo desecharse el resto de solución no utilizada. La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
Ampolla
Normas para abrir la ampolla de Reandron con sistema de apertura de “Un punto de corte” (UPC):
La ampolla tiene una marca por debajo del punto coloreado. Antes de abrir, asegúrese de que no queda solución en la parte superior de la ampolla. Utilice ambas manos para abrirla; sujetar con una mano la parte inferior de la ampolla y utilizar la otra mano para presionar hacia fuera y romper la parte superior de la ampolla en dirección opuesta al punto coloreado.
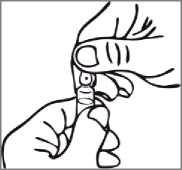
.<&p.
ÜE
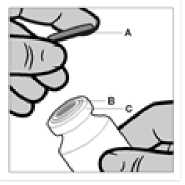
Vial
El vial es para un único uso. El contenido del vial debe inyectarse inmediatamente después de cargarse a la jeringa. Tras retirar la cubierta de plástico (A), no retirar el anillo metálico (B) ni la cubierta del reborde (C).
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Bayer Hispania, S.L.
Av. Baix Llobregat 3-5
08970 - Sant Joan Despí - BARCELONA
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
N° Reg. AEMPS: 66.470
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 16 de Noviembre de 2004 Fecha de la última renovación: 25 de Noviembre de 2008
10. FECHA DE LA REVISIÓN DEL TEXTO
Marzo 2016