Reactine Levocabastina 0,5Mg/Ml Suspension Para Pulverizacion Nasal
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
REACTINE Levocabastina 0,5mg/ml suspensión para pulverización nasal
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada ml contiene:
Levocabastina (como hidrocloruro) equivalente a 0,5 mg de levocabastina (50 microgramos en cada aplicación)
Excipientes con efecto conocido:
Cloruro de benzalconio: 0.15 mg,
Para consultar la lista completa de excipientes ver sección 6.1.
3. FORMA FARMACÉUTICA
Suspensión para pulverización nasal.
Se trata de una suspensión homogénea de color blanco.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Alivio temporal de los síntomas de la rinitis alérgica tales como: estornudos, picor y secreción nasal.
4.2 Posología y forma de administración Posología:
- Adultos y adolescentes mayores de 12 años:
por fosa nasal (cada aplicación corresponden a 50 fuera necesario se puede administrar 3 ó 4 veces al día, 8 aplicaciones (400 microgramos) por cada fosa nasal en
La dosis recomendada es de 2 aplicaciones microgramos), 2 veces al día (cada 12 horas). Si cada 6 u 8 horas según necesidad. No superar las 24 horas.
Población pediátrica No se debe administrar a niños menores de 12 años.
Forma de administración Vía nasal.
Antes de cada aplicación agitar bien el envase.
Antes de administrar el producto por vez primera se debe llenar el dosificador presionando hasta que salga medicamento. Colocar el aplicador del envase en uno de los orificios de la nariz de forma que no lo tape totalmente y presionar la bomba dosificadora 2 veces mientras se inspira suavemente para que el medicamento se distribuya uniformemente por la nariz. Repetir la operación en la otra fosa nasal.
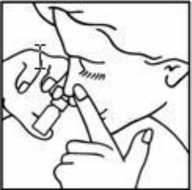
Para evitar contagios el medicamento no se debe usar por más de 1 persona.
Después de cada aplicación la boquilla del envase se tiene que limpiar con un paño húmedo.
Si los síntomas persisten o si empeoran después de 3 días de tratamiento, se deberá suprimir el mismo y evaluar la situación clínica.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluídos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
En los pacientes con insuficiencia renal se debe realizar una evaluación clínica antes de utilizar este medicamento, ya que se excreta principalmente por vía renal.
Advertencias sobre excipientes:
Este medicamento contiene cloruro de benzalconio. Puede producir inflamación de la mucosa nasal, especialmente con tratamiento de larga duración. Si se sospecha tal reacción (congestión nasal persistente), siempre que sea posible, se debería utilizar un medicamento de uso nasal que no contenga este excipiente.
Como todas las preparaciones nasales que contienen cloruro de benzalconio y propilenglicol y ésteres puede causar irritación en la piel.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios de interacciones.
Interferencias con pruebas analíticas
Los antihistamínicos pueden disminuir la respuesta a pruebas diagnósticas alergénicas, lo que deberá tenerse en cuenta en caso de realizar dichas pruebas.
4.6 Fertilidad, embarazo y lactancia
Embarazo:
No hay datos o estos son limitados relativo al uso de Levocabastina en mujeres embarazadas..
Los estudios realizados en animales han mostrado toxicidad para la reproducción.
No se recomienda utilizar Reactine Levocabastina durante el embarazo a no ser que el beneficio potencial para la madre justifique el riesgo potencial para el feto.
Lactancia:
La Levocabastina se excreta por la leche materna. Se puede esperar que el 0,6% de la dosis administrada por vía intranasal se pueda transferir al lactante. No hay datos sobre el efecto Levocabastina en recién nacidos. Este medicamento no se debería usar durante el periodo de lactancia, salvo que el medico lo considere, consultar al medico antes de tomar el medicamento.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No se espera que Reactine Levocabastina interfiera con la capacidad para conducir y utilizar maquinaria. Si durante el tratamiento se produjera somnolencia, habrá que tenerlo en cuenta en caso de conducir y utilizar máquinas.
4.8 Reacciones adversas
Las reacciones adversas de Reactine Levocabastina se han identificado durante ensayos clínicos, epidemiológicos y durante el periodo de comercialización.
Datos obtenidos de ensayos clínicos
La seguridad de Reactine Levocabastina nasal se ha evaluado en 2328 individuos que participaron en 12 ensayos clínicos doble-ciego placebo-controlados y 1 ensayo clínico abierto. Todas las reacciones adversas reportadas en más de 1% de los individuos enrolados en estos ensayos clínicos se presentan en la Tabla 1.
|
Tabla 1: reacciones adversas reportadas en más de 1% de los individuos tratados con Reactine Levocabastina nasal en 12 ensayos clínicos doble-ciego, placebo-controlados | ||
|
Clasificación de órganos del sistema MedDRA |
REACTINE |
Placebo |
|
MedDRA PT |
(N=2328) |
(n=1537) |
|
% |
% | |
|
Trastornos gastrointestinales Náuseas |
1,3 |
1,2 |
|
Trastornos generales y alteraciones en el lugar de administración Fatiga |
2,1 |
0,9 |
|
Dolor |
1,2 |
0,9 |
|
Infecciones e infestaciones Sinusitis |
1,8 |
0,9 |
|
Trastornos del sistema nervioso Cefalea |
10,1 |
11,9 |
|
Somnolencia |
2,1 |
0,8 |
|
Mareo |
1,3 |
0,9 |
|
Trastornos respiratorios, torácicos y mediastínicos Dolor faringo-laríngeo |
2,9 |
2,3 |
|
Epistaxis |
1,6 |
1,0 |
|
Tos |
1,7 |
1,3 |
Las reacciones adversas reportadas en menos de 1% de los individuos enrolados en estos ensayos clínicos se presentan en la Tabla 2.
Tabla 2: reacciones adversas reportadas en menos de 1% de los individuos tratados con Reactine Levocabastina nasal en 12 ensayos clínicos doble-ciego, placebo-controlados Clasificación de órganos del sistema MedDRA MedDRA PT
Trastornos generales y alteraciones en el lugar de administración
Irritación en el lugar de administración Dolor en el lugar de administración
Sequedad en el lugar de administración Sensación de quemazón en el lugar de administración Molestia en el lugar de administración Trastornos respiratorios, torácicos y mediastínicos Molestia nasal Congestión nasal
Datos postcomercialización
En la tabla 3 y en la tabla 4 se incluyen las reacciones adversas identificadas durante el periodo postcomercialización. Debido a que estas reacciones se han reportado voluntariamente a partir de una población de tamaño desconocido, no es siempre posible estimar de manera fiable su frecuencia o establecer la relación causal con la exposición al medicamento. Las frecuencias se fijan de acuerdo con la siguiente convención:
- Muy frecuentes (>1/10).
- Frecuentes (>1/100 y <1/10).
- Poco frecuentes (>1/1000 y <1/100).
- Raras (>1/10000 y <1/1000)
- Muy raras (<1/10000).
- Frecuencia no conocida (no puede estimarse a partir de los datos disponibles)
En la tabla 3, las reacciones adversas se presentan por categoría de frecuencia basada en las notificaciones espontáneas, mientras que en la tabla 4, las mismas reacciones adversas se presentan por categoría de frecuencia basada en la incidencia en ensayos clínicos y estudios epidemiológicos.
|
Tabla 3: reacciones adversas identificadas durante el periodo postcomercialización con Reactine Levocabastina nasal por categoría de frecuencia estimada a partir de | |
|
notificaciones espontáneas | |
|
Trastornos cardiacos | |
|
Muy raras |
Palpitaciones, Taquicardia |
|
Trastornos oculares | |
|
Muy raras |
Edema en el párpado |
|
Trastornos generales y alteraciones en el lugar de administración | |
|
Muy raras |
Malestar |
|
Trastornos del sistema inmunológico | |
|
Muy raras |
Anafilaxia, Hipersensibilidad |
|
Trastornos respiratorios, torácicos y mediastínicos | |
|
Muy raras |
Broncoespasmo, Disnea, , malestar en la nariz, congestion nasal |
|
Tabla 4: reacciones adversas identificadas durante el periodo postcomercialización con Reactine Levocabastina nasal por categoría de frecuencia estimada a partir de ensayos | |
|
clínicos y estudios epidemiológicos | |
|
Trastornos cardiacos | |
|
Poco frecuentes |
Palpitaciones |
|
Raras |
Taquicardia |
|
Trastornos oculares | |
|
Desconocida |
Edema en el párpado |
|
Trastornos generales y alteraciones en el lugar de administración | |
|
Poco frecuentes |
Malestar |
|
Trastornos del sistema inmunológico | |
|
Desconocida |
Anafilaxia |
|
Poco frecuentes |
Hipersensibilidad |
|
Trastornos respiratorios, torácicos y mediastínicos | |
|
Desconocida |
Broncoespasmo |
|
Poco frecuentes |
Disnea |
|
Raras |
Edema nasal |
Notificación de sospechas de reacciones adversas
Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de medicamentos de uso humano, https: //www.notificaRAM.es
4.9 Sobredosis
Síntomas
No se han reportado casos de sobredosificación con Reactine Levocabastina, aunque no se pueden excluir, algunos casos de sedación después de la ingesta accidental del contenido del envase.
Tratamiento
En caso de ingestión accidental, se aconseja al paciente beber gran cantidad de líquidos no alcohólicos a fin de acelerar la eliminación renal de levocabastina
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: preparados de uso nasal; descongestivos y otros preparados nasales para uso topico; agentes antialérgicos, excluyendo corticosteroides; levocabastina., código ATC: R01AC02
La levocabastina es un antagonista selectivo de los receptores Hj de histamina con un inicio de acción a los
5 minutos aproximadamente y una duración de acción de más de 12 horas
Como consecuencia del bloqueo de este receptor histaminérgico, se produce una reducción de la frecuencia de estornudos, así como de la vasodilatación nasal e, indirectamente, de la secreción mucosa, típicamente asociados a la liberación local de histamina producida por la degranulación de los mastocitos en respuesta al estímulo alérgico.
5.2 Propiedades farmacocinéticas
Tras la aplicación nasal de 50 microgramos de levocabastina se produce una absorción incompleta, dando lugar a una biodisponibilidad del 60-80%. La unión a proteínas plasmáticas es del 55% aproximadamente. La Cmax se alcanza transcurridas 1-2 horas tras la aplicación. El 70% de la levocabastina absorbida se elimina inalterada en orina, el 10-20% en heces y el resto en forma de metabolito acilglucurónido en orina. La semi-vida plasmática de la levocabastina es de 35 horas aproximadamente.
5.3 Datos preclínicos sobre seguridad
En rata, raton y conejo dosis sistémicas de hasta 1.250 veces la dosis tópica clínicamente recomendada, no mostró efectos embriotóxicos ni teratogénicos. Sin embargo la administración de dosis sistémicas por encima de 2,500 veces, han mostrado efectos embriotóxicos y teratógenos (polidactilia, hidrocefalia y braquignatia).
Basado en la determinación de las concentraciones de levocabastina en saliva y leche materna en una mujer en periodo de lactancia, que recibió una dosis oral simple de 0,5mg de levocabastina, se puede esperar que aproximadamente el 0,6% de la dosis total administrada vía nasal puede ser transferida al bebé lactante. Sin embargo, debido a lo limitado de los datos clínicos y experimentales, se recomienda administrar con precaución Reactine Levocabastina a mujeres en periodo de lactancia.
Datos preclínicos sugieren que el cloruro de benzalconio puede producir un efecto ciliar tóxico, incluyendo inmovilidad irreversible, dependiente de la concentración y del tiempo de exposición, y puede producir cambios histopatológicos en la mucosa nasal.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Cloruro de benzalconio,
Hidrogenofosfato de disodio anhidro,
Dihidrogenofosfato de sodio monohidrato,
Hipromelosa
Propilenglicol,
Polisorbato 80,
Edetato de disodio,
Agua para preparaciones inyectables.
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
2 años.
6.4 Precauciones especiales de conservación
No requiere condiciones especiales de conservación.
6.5 Naturaleza y contenido del envase
Envase conteniendo de 10 ml de suspensión
6.6 Precauciones especiales de eliminación y otras manipulaciones
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Johnson & Johnson S.A.
Paseo de las Doce Estrellas, 5-7
28042
ESPAÑA
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
60.919
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
01/12/1996
10. FECHA DE LA REVISIÓN DEL TEXTO
Febrero 2016
7 de 7