Reactine Levocabastina 0,5Mg/Ml Colirio En Suspension
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
REACTINE Levocabastina 0,5mg/ml colirio en suspensión.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada ml contiene:
Levocabastina (como hidrocloruro) equivalente a 0,5 mg de levocabastina (15 microgramos en cada aplicación)
Excipientes con efecto conocido:
Cloruro de benzalconio: 0,15 mg
Para consultar la lista completa de excipientes ver sección 6.1.
3. FORMA FARMACÉUTICA Colirio en suspensión.
Se trata de una suspensión homogénea de color blanco.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Alivio temporal de los síntomas de la conjuntivitis alérgica tales como: picor de ojos, lagrimeo y enrojecimiento.
4.2 Posología y forma de administración
4.2.1 Posología
Adultos y adolescentes mayores de 12 años:
La dosis recomendada es 1 gota (15 microgramos) en cada ojo, 2 veces al día (cada 12 horas). Si fuera necesario se puede administrar 3 ó 4 veces al día, cada 6 u 8 horas, según necesidad. No superar la dosis de 60 microgramos en cada ojo en 24 horas.
Población pediátrica.
No se debe administrar a niños menores de 12 años.
4.2.2 Forma de administración Vía oftálmica.
Agitar el envase antes de cada aplicación.
Con las manos recién lavadas abrir el envase procurando que el tapón y el gotero no toquen nada
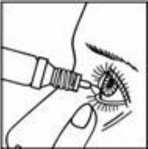
Con la cabeza inclinada hacia atrás, separe hacia abajo el párpado inferior, presione el frasco con mucho cuidado hasta verter 1 gota en saco conjuntival mientras dirige la mirada hacia arriba. Procure parpadear para extender uniformemente la gota por todo el ojo.
Agencia esparto» de medicamentos y productos saltaros
La aplicación del colirio se debe realizar con la máxima pulcritud, evitando en lo posible cualquier contacto con el gotero (por ejemplo: párpados, dedos, etc.)
Después de cada aplicación cerrar bien el envase.
Por tratarse de un medicamento estéril se recomienda seguir las siguientes instrucciones:
- cada envase solo se debe utilizar por un único paciente
- una vez finalizado el tratamiento, desechar el medicamento aunque no se haya agotado totalmente el contenido del frasco.
Si los síntomas persisten o si empeoran después de 2 días de tratamiento, se deberá suprimir el mismo y evaluar la situación clínica
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
Advertencias sobre excipientes
Este medicamento puede producir irritación ocular porque contiene cloruro de benzalconio, propilenglicol y ésteres.
Evitar el contacto con las lentes de contacto blandas.
Retirar las lentes de contacto antes de la aplicación y esperar al menos 15 minutos antes de volver a colocarlas.
Altera el color de las lentes de contacto blandas.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se ha descrito ningún tipo de interacción, pero en todo caso se debe separar al menos 10 minutos desde la administración de cualquier otro preparado oftálmico.
Interferencias con pruebas analíticas:
Los antihistamínicos pueden disminuir la respuesta a pruebas diagnósticas alergénicas, lo que deberá tenerse en cuenta en caso de realizar dichas pruebas.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No hay datos o estos son limitados relativo al uso de Levocabastina en mujeres embarazadas.
Los estudios realizados en animales han mostrado toxicidad para la reproducción.
No se recomienda utilizar Levocabastina colirio durante el embarazo a no ser que el beneficio potencial para la madre justifique el riesgo potencial para el feto.
Lactancia
La Levocabastina se excreta por la leche materna. Se puede esperar que el 0,3% de la dosis la dosis administrada por vía oftálmica, se pueda transferir al lactante. No hay datos sobre el efecto
del principio activo en recién nacidos. Este medicamento no se debería usar durante el periodo de lactancia, salvo que el medico lo considere, consultar al medico antes de tomar el medicamento.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
Después de la instilación, puede aparecer en los ojos: irritación, dolor, inflamación, picor, enrojecimiento, sensación de quemazón y visión borrosa transitoria; que pueden afectar a la capacidad para connducir o utilizar máquinas. Si aparecen estos efectos, el paciente debe esperar hasta que la visión sea nítida antes de conducir o utilizar máquinas. Por lo tanto, se debe tener precaución al conducir o manejar maquinaria tras aplicar Reactine Levocabastina colirio.
4.8 Reacciones adversas
Las reacciones adversas de Reactine se han identificado durante ensayos clínicos, epidemiológicos y durante el periodo de postcomercialización.
Datos obtenidos de ensayos clínicos
La seguridad de REACTINE colirio se ha evaluado en 508 individuos que participaron en 4 ensayos clínicos placebo-controlados y 1 ensayo clínico abierto. Todas las reacciones adversas reportadas por los individuos enrolados en estos ensayos clínicos se presentan en la Tabla 1.
|
Tabla 1: reacciones adversas reportadas por individuos tratados con REACTINE en 5 ensayos clínicos | ||
|
Clasificación de órganos del sistema MedDRA MedDRA PT |
REACTINE (N=508) % |
Placebo (n=178) % |
|
Trastornos oculares Irritación ocular |
11,6 |
4,5 |
Datos postcomercialización
En la tabla 2 y en la tabla 3 se incluyen las reacciones adversas identificadas durante el periodo postcomercialización. Debido a que estas reacciones se han reportado voluntariamente a partir de una población de tamaño desconocido, no es siempre posible estimar de manera fiable su frecuencia o establecer la relación causal con la exposición al medicamento. Las frecuencias se fijan de acuerdo con la siguiente convención:
- Muy frecuentes (>1/10).
- Frecuentes (>1/100 y <1/10).
- Poco frecuentes (>1/1000 y <1/100).
- Raras (>1/10000 y <1/1000)
- Muy raras (<1/10000).
- Frecuencia no conocida (no puede estimarse a partir de los datos disponibles)
En la tabla 2, las reacciones adversas se presentan por categoría de frecuencia basada en las notificaciones espontáneas, mientras que en la tabla 3, las mismas reacciones adversas se presentan por categoría de frecuencia basada en la incidencia en ensayos clínicos y estudios epidemiológicos.
|
Tabla 2: reacciones adversas identificadas durante el periodo postcomercialización con REACTINE colirio por categoría de frecuencia estimada a partir de notificaciones | |
|
espontáneas | |
|
Trastornos cardiacos | |
|
Muy raras |
Palpitaciones |
|
Trastornos oculares | |
|
Muy raras |
Dolor de ojo, Conjuntivitis, Edema en el párpado, Inflamación del ojo, Blefaritis, Hiperemia ocular, Visión borrosa, Calcificación corneal1 |
|
Trastornos generales y alteraciones en el lugar de administración | |
|
Muy raras |
Reacciones en el lugar de aplicación como, sensación de quemazón en el ojo, ojo enrojecido, irritación y dolor ocular, inflamación del ojo, picor de ojo, ojos llorosos y visión borrosa. |
|
Trastornos del sistema inmunológico | |
|
Muy raras |
Anafilaxia, Angioedema Hipersensibilidad |
|
Trastornos de la piel y del tejido subcutáneo | |
|
Muy raras |
Dermatitis de contacto, Urticaria |
|
Trastornos del sistema nervioso | |
|
Muy raras |
Dolor de cabeza |
1 se han reportado casos muy raros de calcificación corneal en asociación con el uso de colirios que contienen fosfatos en algunos pacientes con daño corneal significativo
|
Tabla 3: reacciones adversas identificadas durante el periodo postcomercialización con REACTINE colirio por categoría de frecuencia estimada a partir de ensayos clínicos o | |
|
estudio epidemiológicos | |
|
Trastornos cardiacos | |
|
Desconocida |
Palpitaciones |
|
Trastornos oculares | |
|
Frecuentes |
Dolor de ojo, Visión borrosa |
|
Poco frecuentes |
Edema en el párpado |
|
Muy raras |
Calcificación corneal1 |
|
Desconocida |
Conjuntivitis, Inflamación del ojo, Blefaritis, Hiperemia ocular |
|
Trastornos generales y alteraciones en el lugar de administración | |
|
Desconocida |
Reacciones en el lugar de aplicación como, sensación de quemazón en el ojo, ojo enrojecido, irritación y dolor ocular, inflamación del ojo, picor de ojo, ojos llorosos y visión borrosa. |
|
Trastornos del sistema inmunológico | |
|
Desconocida |
Anafilaxia, Angioedema Hipersensibilidad |
|
Trastornos de la piel y del tejido subcutáneo | |
|
Desconocida |
Dermatitis de contacto, Urticaria |
|
Trastornos del sistema nervioso | |
|
Frecuentes |
Dolor de cabeza |
1 se han reportado casos muy raros de calcificación corneal en asociación con el uso de colirios que contienen fosfatos en algunos pacientes con daño corneal significativo
Notificación de sospechas de reacciones adversas
Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de medicamentos de uso humano, https: //www.notificaRAM.es
4.9 Sobredosis
No se conocen casos reacciones específicas por sobredosificación ocular.
En caso de ingerir accidentalmente el contenido del envase, no podría excluirse la posibilidad de cierto grado de somnolencia.
Tratamiento:
En caso de ingestión accidental, se debe aconsejar al paciente la ingesta de líquidos en cantidad importante con el fin de acelerar la excreción renal del medicamento.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: oftálmico, descongestivos y antialérgicos; otros antialérgicos; levocabastina código ATC: S01GX02
La levocabastina es un antagonista selectivo de los receptores H1 de histamina con un inicio de acción a los 15 minutos aproximadamente y una duración de acción de más de 12 horas.
Como consecuencia del bloqueo de este receptor histaminérgico, se produce una reducción del picor, el lagrimeo y el enrojecimiento ocular, tipicamente asociados a la liberación local de histamina producida por la degranulación de los mastocitos en respuesta al estímulo alérgico.
5.2 Propiedades farmacocinéticas
Después de una instilación en los ojos de levocabastina se produce una absorción incompleta, dando lugar a una biodisponibilidad del 30 - 60%. La unión a proteínas plasmáticas es del 55% aproximadamente. Las concentraciones plasmáticas de levocabastina detectadas son muy bajas como para producir efectos sistémicos. La semivida plasmática es de 35 a 40 horas aproximadamente. La farmacocinética cuando se administra por vía oftálmica es lineal y previsible.
El 70% de la levocabastina absorbida se elimina inalterada en orina, el 10-20% en heces y el resto en forma de metabolitoacilglucurónido en orina.
5.3 Datos preclínicos sobre seguridad
En ratas, ratones y conejos, a dosis sistémicas de hasta 8300 veces la dosis tópica clínicamente recomendada, no mostró efectos embriotóxicos ni teratogénicos; con 16500 veces esta misma dosis y superiores se ha observado: polidactilia, hidrocefalia y braquignatia.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Propilenglicol
Hidrogenofosfato de disodio anhidro
Dihidrogenofosfato de sodio monohidrato
Hipromelosa
Polisorbato 80
Cloruro de benzalconio
Edetato de disodio
Agua para preparaciones inyectables
6.2 Incompatibilidades No procede.
6.3 Periodo de validez
24 meses.
Después de la primera vez que se abre el envase, no usar si han pasado 28 días.
6.4 Precauciones especiales de conservación Conservar por debajo de 25°C.
6.5 Naturaleza y contenido del envase
Envase cuentagotas de polietileno de baja densidad. Está equipado con tapón de rosca y contiene 4 ml de suspensión.
6.6 Precauciones especiales de eliminación y otras manipulaciones
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Johnson & Johnson S.A..
Paseo de las Doce Estrellas, 5-7
28042
ESPAÑA
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
60.920
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
01/12/1996
10. FECHA DE LA REVISIÓN DEL TEXTO
Febrero 2016
7 de 7