Pulmicort Turbuhaler 200 Microgramos/Inhalación Polvo Para Inhalacion
FICHA TÉCNICA

1. NOMBRE DEL MEDICAMENTO
PULMICORT® TURBUHALER® 100 microgramos/inhalación polvo para inhalación PULMICORT® TURBUHALER® 200 microgramos/inhalación polvo para inhalación PULMICORT® TURBUHALER® 400 microgramos/inhalación polvo para inhalación
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
PULMICORT TURBUHALER 100 microgramos/inhalación polvo para inhalación: Cada dosis contiene: budesónida 100 microgramos/inhalación.
PULMICORT TURBUHALER 200 microgramos/inhalación polvo para inhalación: Cada dosis contiene: budesónida 200 microgramos/inhalación.
PULMICORT TURBUHALER 400 microgramos/inhalación polvo para inhalación: Cada dosis contiene: budesónida 400 microgramos/inhalación.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Polvo para inhalación.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Pulmicort Turbuhaler está indicado en pacientes con asma bronquial que requieran tratamiento de mantenimiento con glucocorticoides para el control de la inflamación subyacente de las vías respiratorias.
PULMICORT TURBUHALER está también indicado en pacientes con enfermedad pulmonar obstructiva crónica (EPOC) en los que se ha identificado una respuesta beneficiosa durante los primeros 3-6 meses de tratamiento.
4.2 Posología y forma de administración
Asma bronquial
La dosis de PULMICORT TURBUHALER ha de ser individualizada. La dosis inicial recomendada y la dosis máxima recomendada de PULMICORT TURBUHALER, teniendo en cuenta la terapia previa para el asma se detallan en la siguiente tabla:
Terapia previa Dosis inicial recomendada
Dosis máxima recomendada
Adultos y No tratados con
ancianos esteroides
200 a 400 microgramos una vez al día ó
100 a 400 microgramos dos veces al día
800 pg dos veces al día
Glucocorticoides
inhalados
200 a 400 microgramos una vez al día 800 pg dos veces al día
ó
100 a 400 microgramos dos veces al día
Agencia esparioiaóe medicamentos y proouctos san-tanos
.Uí1.
"I ■"
¡m
|
Glucocorticoides orales |
400 a 800 microgramos dos veces al día |
800 pg dos veces al día | |
|
Niños a partir de 6 años |
No tratados con esteroides |
200 a 400 microgramos una vez al día ó 100 a 200 microgramos dos veces al día |
400 pg dos veces al día |
|
Glucocorticoides inhalados |
200 a 400 microgramos una vez al día ó 100 a 200 microgramos dos veces al día |
400 pg dos veces al día | |
|
Glucocorticoides orales |
200 a 400 microgramos dos veces al día |
400 pg dos veces al día |
En caso de asma grave y durante las exacerbaciones, algunos pacientes pueden conseguir una mejoría al dividir la dosis diaria en 3-4 administraciones por día.
Dosis de mantenimiento:
Una vez alcanzado el control del asma, la dosis debería ser gradualmente reducida en todos los pacientes hasta la dosis de mantenimiento mínima necesaria. Rango de dosis de mantenimiento:
• Adultos y ancianos: 100-1600 microgramos diarios
• Niños: 100-800 microgramos diarios
Dosis una vez al día:
La dosis diaria se divide habitualmente en 1-2 administraciones. La administración una vez al día puede considerarse en adultos y en pacientes pediátricos a partir de 6 años de edad, que requieran una dosis de mantenimiento de 100 a 400 microgramos de budesónida al día. La administración una vez al día puede instaurarse tanto en pacientes no tratados con esteroides como en pacientes controlados con glucocorticoides inhalados. La dosis puede administrarse por la mañana o por la noche. Si se produce un empeoramiento del asma, deberá aumentarse la dosis diaria y la frecuencia de administración.
Inicio del efecto:
La mejoría en el control del asma tras la administración inhalada de PULMICORT TURBUHALER puede producirse en el plazo de 24 horas tras el inicio del tratamiento, aunque el beneficio máximo podría no alcanzarse hasta transcurridas como mínimo 1 ó 2 semanas tras el inicio del tratamiento.
Pacientes no tratados con glucocorticoides
Los pacientes que requieran una terapia de mantenimiento para el asma pueden emplear PULMICORT TURBUHALER a las dosis recomendadas en la tabla anterior. Aquellos pacientes que no respondan adecuadamente a la dosis inicial, pueden requerir dosis superiores para controlar los síntomas del asma.
Pacientes bajo tratamiento con glucocorticoides inhalados
Los estudios clínicos realizados en el hombre han demostrado una mejor eficacia para la misma cantidad de budesónida administrada mediante TURBUHALER, en comparación con el aerosol. Por ello, al pasar de un tratamiento con Pulmicort aerosol a PULMICORT TURBUHALER, es posible reducir la dosis como máximo hasta la mitad cuando el paciente está en una fase estable. Asimismo, en aquellos pacientes previamente tratados con otros glucocorticoides inhalados, puede considerarse una reducción de la dosis de
.Hf.
¿fe;
ÍTTI
PULMICORT TURBUHALER, una vez que hayan sido tratados inicialmente con una dosis similar a la administrada con el fármaco anterior.
Pacientes bajo tratamiento con glucocorticoides orales
PULMICORT TURBUHALER permite una sustitución o reducción significativa en la dosis de glucocorticoides orales manteniendo o mejorando el control de los síntomas del asma.
Al pasar de un tratamiento con esteroides orales a un tratamiento con PULMICORT TURBUHALER, el paciente debe estar en una fase relativamente estable. Inicialmente, se empleará una dosis alta de PULMICORT TURBUHALER conjuntamente con la dosis previamente utilizada del glucocorticoide oral. Después de unos 10 días, la dosis oral se reducirá gradualmente (por ejemplo 2,5 miligramos de prednisolona o su equivalente cada mes) hasta la cantidad mínima necesaria. En muchos casos, puede retirarse por completo el corticoide oral y dejar al paciente únicamente bajo tratamiento con PULMICORT TURBUHALER. Para mayor información sobre la retirada de los corticoides, véase la sección 4.4.
Durante el paso de un tratamiento a otro, algunos pacientes pueden experimentar síntomas debidos a la retirada del glucocorticoide sistémico, por ej. dolor muscular y/o en las articulaciones, laxitud y depresión, aunque se mantenga o incluso mejore la función pulmonar. Estos pacientes deben ser alentados a continuar el tratamiento con PULMICORT TURBUHALER pero deberán monitorizarse por si se observan signos objetivos de insuficiencia suprarrenal. En el caso de que se observara insuficiencia suprarrenal, deberán incrementarse temporalmente las dosis de corticoides sistémicos iniciando de nuevo la reducción de los mismos de forma más lenta. Durante las fases de estrés o un ataque grave de asma, estos pacientes pueden requerir un tratamiento adicional con corticoides sistémicos.
EPOC
La dosis recomendada de PULMICORT TURBUHALER es 400 microgramos dos veces al día.
Los pacientes con EPOC bajo tratamiento con glucocorticoides orales que pasen a recibir un tratamiento con PULMICORT TURBUHALER deberán seguir las mismas recomendaciones detalladas anteriormente para asma bronquial, en caso de que se reduzca la dosis oral.
Instrucciones para el uso correcto del Turbuhaler:
El dispositivo Turbuhaler es un inhalador que se activa por la inspiración del paciente; es decir, que cuando el paciente inspira a través de la boquilla, el fármaco es transportado por el aire inspirado hasta los pulmones.
NOTA: Es importante instruir al paciente para que:
Lea detenidamente las instrucciones antes de empezar a usar su medicamento.
Boquilla ^
Ventana del Indicadora
Rosca ^ Figura 1

Tapa

Pulmicort Turbuhaler es un inhalador multidosis con el que se administran pequeñas dosis de polvo. (Figura 1)
Cuando el paciente inspire a través del Turbuhaler el polvo será liberado a sus pulmones. Por tanto, es importante que el paciente inspire enérgica y profundamente a través de la boquilla.
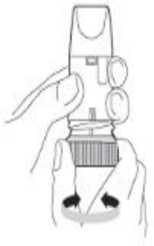
Figura 2
Preparación del Turbuhaler por primera vez:
Antes de utilizar Pulmicort Turbuhaler por primera vez, el paciente debe preparar el inhalador para su empleo.
Debe desenroscar y levantar la tapa, manteniendo el inhalador en posición vertical con la rosca en la parte inferior (Figura 2).
No debe agarrar la boquilla cuando gire la rosca.
Debe girar la rosca hasta el tope en una dirección y luego volver a girarla hasta el tope en la otra dirección. No importa en qué dirección la gire primero. Durante este procedimiento el paciente oirá un clic. Debe realizar este procedimiento dos veces.
En este momento el inhalador está listo para ser utilizado y no se debe repetir el procedimiento anterior. Para inhalar una dosis, el paciente debe seguir las instrucciones que se indican a continuación.

CÓMO UTILIZAR PULMICORT TURBUHALER
Para administrar una dosis, el paciente debe seguir las siguientes instrucciones:
1. Desenroscar y levantar la tapa.
2. Mantener el inhalador en posición vertical con la rosca en la parte inferior (Figura 2). No debe agarrar la boquilla cuando gire la rosca. Para cargar el inhalador con una dosis debe girar la rosca hasta el tope en una dirección y luego volver a girarla hasta el tope en la otra dirección. No importa en qué dirección la gire primero. Durante este procedimiento oirá un clic.
3. Sujetar el inhalador lejos de la boca. Expulsar el aire. No soplar a través de la boquilla.
4. Situar la boquilla suavemente entre los dientes, cerrar los labios e inhalar enérgica y profundamente a través del dispositivo (Figura 3). No morder ni presionar la boquilla.
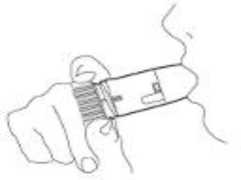
Figura 3
5. Retirar el inhalador de la boca, antes de expulsar el aire.
6. Si necesita realizar otra inhalación, debe repetir los pasos 2-5.
7. Volver a colocar la tapa firmemente tras la utilización.
8. Enjuagarse la boca con agua tras inhalar la dosis prescrita.
.Uí1.
"I
an
Indicador de dosis:
Es importante explicar al paciente que cuando vea por primera vez una marca roja en la ventana del indicador, quedan aproximadamente 20 dosis (Figura 4). Cuando la marca roja alcance el margen inferior de la ventana, el inhalador no liberará la cantidad correcta de medicamento y deberá desecharse (Figura 5). El sonido que se oye al agitar el inhalador se debe a un agente desecante y no al medicamento.

Figura 4
Figura 5
NOTA:
El paciente nunca debe expulsar el aire a través de la boquilla.
Debe colocar siempre la tapa adecuadamente tras la utilización.
Debido a la pequeña cantidad de fármaco administrada por el Turbuhaler, puede que los pacientes no noten sabor o sensación a ningún medicamento.
4.3 Contraindicaciones
Hipersensibilidad a budesónida.
4.4 Advertencias y precauciones especiales de empleo
PULMICORT TURBUHALER no está indicado para el alivio rápido de los episodios agudos de asma donde se requiere la administración de un broncodilatador de acción corta. En el caso de que el broncodilatador de acción corta no proporcione la eficacia deseada, o necesite una dosis inhalada mayor a la habitual, el paciente deberá solicitar atención médica. En este caso, se considerará la necesidad de aumentar la terapia antiinflamatoria, por ej. dosis superiores de budesónida inhalada o un periodo de tratamiento con corticoides orales.
La falta de respuesta o exacerbación de la EPOC deberá tratarse con terapia adicional según el juicio del médico responsable.
Deberá tenerse especial precaución cuando los pacientes pasen de una terapia con glucocorticoides orales a glucocorticoides inhalados, ya que durante un periodo de tiempo considerable pueden permanecer en riesgo de presentar una disminución de la función suprarrenal. También pueden estar en esta situación de riesgo los pacientes que hayan requerido un tratamiento de emergencia con corticoides por vía parenteral a dosis elevadas, o los que hayan estado en tratamiento a largo plazo con corticoides inhalados a la dosis más alta recomendada. Estos pacientes pueden mostrar signos y síntomas de insuficiencia suprarrenal en situaciones de estrés grave. Durante estas situaciones de estrés grave o intervenciones quirúrgicas programadas, deberá considerarse el tratamiento adicional con corticoides sistémicos.
Algunos pacientes pueden sentirse mal de forma no específica durante la fase de retirada de los corticoides sistémicos, apareciendo por ej. mialgias y artralgias. Raramente, puede sospecharse un efecto glucocorticoide insuficiente si aparecen síntomas tales como cansancio, cefaleas, nauseas y vómitos. En estos casos, es necesario en ocasiones un incremento temporal de la dosis de corticoides orales.
El paso de un tratamiento con esteroides sistémicos a un tratamiento con terapia inhalada puede desenmascarar alergias, por ej. rinitis y eczema, que previamente habían sido controlados con el fármaco sistémico. Estas alergias deberán controlarse sintomáticamente con antihistamínicos y/o preparaciones tópicas.
Cualquier corticoide inhalado puede producir efectos sistémicos, sobre todo cuando se prescriben dosis altas durante largos periodos de tiempo. La probabilidad de que ocurran estos efectos es menor cuando el tratamiento se inhala que cuando se administra por vía oral. Los posibles efectos sistémicos incluyen Síndrome de Cushing, características Cushingoides, inhibición de la función suprarrenal, retraso del crecimiento en niños y adolescentes, descenso en la densidad mineral ósea, cataratas y glaucoma.
Una función hepática reducida afecta a la eliminación de corticoides, causando una disminución de la tasa de eliminación y un aumento de la exposición sistémica. Debe ser consciente de los posibles efectos sistémicos secundarios. Sin embargo, la farmacocinética intravenosa de budesónida es similar en pacientes con cirrosis y en sujetos sanos. La farmacocinética después de la administración oral se vio afectada por una función hepática comprometida, evidenciándose por una disponibilidad sistémica incrementada.
Los estudios in vivo han mostrado que la administración oral de ketoconazol e itraconazol, inhibidores conocidos de la actividad CYP3A4 en el hígado y mucosa intestinal (ver apartado 4.5 Interacción con otros medicamentos y otras formas de interacción), puede causar un aumento de la exposición sistémica a la budesónida. Esto es de relevancia clínica limitada en el tratamiento a corto plazo (1-2 semanas), pero deberá tenerse en cuenta durante el tratamiento a largo plazo. Debe evitarse el uso concomitante de ketoconazol, inhibidores de la proteasa del VIH o de otros inhibidores potentes del CYP3A4. Si no es posible, el periodo entre ambos tratamientos debe ser lo más largo posible (ver también sección 4.5).
Se prestará especial precaución en pacientes con tuberculosis pulmonar activa o latente, y en pacientes con infección fúngica o vírica de las vías respiratorias.
Pueden tener lugar (principalmente en niños) una serie de efectos psicológicos o de comportamiento, incluyendo inquietud, trastornos del sueño, nerviosismo, depresión y agitación (ver sección 4.8).
Durante la terapia con corticosteroides inhalados puede desarrollarse candidiasis oral. Esta infección puede requerir tratamiento con terapia antifúngica adecuada y en algunos pacientes puede ser necesaria la interrupción del tratamiento (ver sección 4.2). Se debe instruir al paciente para que se enjuague la boca con agua después de cada inhalación con el fin de minimizar el riesgo de infección orofaríngea por Candida.
Como sucede con otros tratamientos inhalados, después de la inhalación se puede producir un broncoespasmo paradójico con aumento de las sibilancias. Si esto ocurre, se debe interrumpir inmediatamente el tratamiento con budesónida inhalada y el paciente debe ser evaluado y tratado con una terapia alternativa si fuese necesario.
No se conocen completamente los efectos locales y sistémicos a largo plazo de PULMICORT TURBUHALER en humanos. Es importante que la dosis de corticosteroide inhalado sea ajustada a la menor dosis de mantenimiento con la que se mantenga un control eficaz del asma.
Efectos sobre el crecimiento
Se recomienda llevar a cabo una monitorización regular del crecimiento de los niños que reciben tratamiento prolongado con corticoides inhalados. En el caso de una ralentización del crecimiento, se debe volver a evaluar el tratamiento con el objetivo de reducir la dosis de corticosteroides inhalados. Deben sopesarse cuidadosamente los beneficios del tratamiento con corticoides frente a los posibles riesgos de la disminución del crecimiento. Además, debe considerarse la posibilidad de derivar al paciente a un especialista en neumología pediátrica.
Deberá informarse a los deportistas que este medicamento contiene un componente que puede producir un resultado positivo en los controles de dopaje.
.-ítp.
ÍTTI
4.5 Interacción con otros medicamentos y otras formas de interacción
No se ha observado interacción entre la budesónida y otros fármacos empleados para el tratamiento del asma o de la EPOC. El metabolismo de la budesónida está mediado principalmente por CYP3A4. Los inhibidores de esta enzima, por ejemplo, ketoconazol e itraconazol, pueden, en consecuencia, aumentar varias veces la exposición sistémica a la budesónida (ver sección 4.4). Puesto que no existen datos para avalar una recomendación de la dosificación, debe evitarse esta combinación. Si no es posible, el periodo entre ambos tratamientos debe ser lo más largo posible e incluso se podría considerar una reducción de la dosis de budesónida.
Existen datos limitados sobre esta interacción para dosis altas de budesónida inhalada, que indican que puede darse un incremento notable en los niveles plasmáticos (en promedio cuatro veces más) si se administra concomitantemente itraconazol, 200 mg una vez al día, con budesónida inhalada (dosis única de
1.000 pg).
En mujeres que además están en tratamiento con estrógenos y esteroides anticonceptivos, se ha observado un aumento de las concentraciones plasmáticas y un aumento del efecto de los corticoides, sin embargo no se ha observado ningún efecto con budesónida y el tratamiento concomitante a dosis bajas de anticonceptivos orales combinados.
Debido a que la función suprarrenal puede estar inhibida, el test de estímulo con ACTH para el diagnóstico de insuficiencia hipofisaria puede mostrar resultados falsos (valores bajos).
A las dosis recomendadas, la cimetidina posee un efecto leve y clínicamente irrelevante sobre la farmacocinética de la budesónida oral.
4.6 Fertilidad, embarazo y lactancia
Los resultados de un amplio estudio epidemiológico prospectivo y de la experiencia post-comercialización mundial, indican que la budesónida inhalada durante el embarazo no tiene efectos adversos sobre la salud del feto o del recién nacido. Al igual que con otros fármacos, la administración de budesónida durante el embarazo requiere la valoración de los posibles beneficios para la madre frente a los riesgos para el feto.
Los glucocorticoides se emplearán preferentemente por vía inhalatoria para el tratamiento del asma, debido a sus menores efectos secundarios comparado con dosis equipotentes de glucocorticoides orales.
La budesónida se excreta en la lecha materna; sin embargo, no se esperan efectos en los niños lactantes con dosis terapéuticas de Pulmicort Turbuhaler. Pulmicort Turbuhaler puede utilizarse durante la lactancia.
El tratamiento de mantenimiento con budesónida inhalada (200 o 400 microgramos dos veces al día) en mujeres asmáticas en periodo de lactancia resulta en una exposición sistémica insignificante a la budesónida en niños lactantes.
En un estudio farmacocinético, la dosis diaria estimada para el lactante fue del 0,3% de la dosis diaria materna, en cualquiera de los dos niveles de dosificación, y la concentración plasmática promedio en los lactantes se estimó en 0,16% de las concentraciones observadas en el plasma materno, suponiendo una biodisponibilidad oral del lactante completa. Las concentraciones de budesónida en muestras de plasma infantil fueron inferiores al límite de cuantificación.
Basándose en datos obtenidos de la budesónida inhalada y el hecho de que la budesónida presenta propiedades farmacocinéticas lineales dentro del intervalo de dosis terapéuticas después de una administración nasal, inhalada, oral y rectal, a dosis terapéuticas de budesónida, la exposición para el lactante se prevé que sea baja.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
PULMICORT TURBUHALER no afecta a la capacidad de conducir ni utilizar máquinas.
"I
an
4.8 Reacciones adversas
Las siguientes definiciones aplican a la incidencia de reacciones adversas:
Estas frecuencias se definen como: muy frecuentes (>1/10); frecuentes (>1/100 a <1/10); poco frecuentes (>1/1.000 a <1/100); raras (>1/10.000 a <1/1.000); muy raras (<1/10.000).
Los ensayos clínicos, publicaciones y la experiencia post-comercialización sugieren que se pueden producir las siguientes reacciones adversas:
Tabla 1 Reacciones Adversas clasificadas por sistemas orgánicos y frecuencias
|
Sistema orgánico |
Frecuencia |
Reacción adversa |
|
Infecciones e infestaciones |
Frecuentes |
Candidiasis orofaríngea |
|
Trastornos del sistema inmunológico |
Raras |
Reacciones de hipersensibilidad inmediata y retardada incluyendo erupción cutánea, dermatitis de contacto, urticaria, angioedema y reacción anafiláctica |
|
Trastornos del sistema endocrino |
Raras |
Signos y síntomas de efectos sistémicos de los corticosteroides, como inhibición de la función suprarrenal y retraso del crecimiento** |
|
Trastornos oculares |
Frecuencia no conocida |
Glaucoma Cataratas |
|
Trastornos | ||
|
psiquiátricos |
Raras |
Inquietud Nerviosismo Depresión Alteraciones del comportamiento (principalmente en niños) |
|
Frecuencia |
Trastornos del sueño | |
|
no conocida |
Ansiedad Hiperactividad psicomotora Agresividad | |
|
Trastornos |
Frecuentes |
Tos |
|
respiratorios, |
Ronquera | |
|
torácicos y mediastínicos |
Irritación de garganta | |
|
Raras |
Broncoespasmo | |
|
Trastornos de la piel y del tejido subcutáneo |
Raras |
Hematomas cutáneos |
** consultar “Población pediátrica”, a continuación
Raramente, a través de mecanismos de acción desconocidos, los fármacos por vía inhalatoria pueden producir broncoespasmo.
t<áp.
alga
•m
En raras ocasiones, con glucocorticoides inhalados se pueden producir signos o síntomas del efecto sistémico de los glucocorticoides, incluyendo hipofunción de la glándula suprarrenal y reducción de la velocidad de crecimiento, dependiendo probablemente de la dosis, tiempo de la exposición, exposición concomitante y previa a glucocorticoides, y sensibilidad individual.
Descripción de reacciones adversas seleccionadas
Hay un mayor riesgo de neumonía en pacientes con diagnóstico reciente de EPOC que estén empezando a ser tratados con corticosteroides inhalados. Sin embargo, en una evaluación ponderada de 8 ensayos clínicos agrupados con 4.643 pacientes con EPOC tratados con budesónida y 3643 pacientes aleatorizados a un tratamiento sin corticosteroides no se demostró un aumento del riesgo de desarrollar neumonía. Se publicó un meta-análisis de los resultados de los 7 primeros de estos 8 ensayos.
Población pediátrica
Debido al riesgo de retraso del crecimiento en la población pediátrica, el crecimiento debería ser monitorizado como se describe en la sección 4.4.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: www.notificaRAM.es
4.9 Sobredosis
No es de esperar que la intoxicación aguda con PULMICORT TURBUHALER, incluso con dosis muy elevadas, ocasione problemas de carácter clínico.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
La budesónida es un glucocorticoide con un elevado efecto antiinflamatorio local.
Grupo farmacoterapéutico: Otros antiasmáticos, en inhalación, glucocorticoides.
Código ATC: R03BA02
Efecto anti-inflamatorio tópico
No se conoce completamente el mecanismo de acción exacto de los glucocorticoides en el tratamiento del asma y de la EPOC. Probablemente sean importantes las acciones antiinflamatorias, tales como la inhibición de la liberación del mediador inflamatorio y la inhibición de las respuestas inmunes mediadas por la citoquina. La potencia intrínseca de la budesónida, medida como la afinidad por el receptor glucocorticoide, es aproximadamente 15 veces superior a la presentada por la prednisolona.
Un estudio clínico en pacientes asmáticos en el que se comparó la administración de la budesónida por vía oral y por inhalación, evidenció de forma estadísticamente significativa la eficacia de la budesónida inhalada frente a placebo, mientras que comparándola con la budesónida administrada por vía oral no se hallaron diferencias significativas. Así pues, el efecto terapéutico de dosis convencionales de budesónida inhalada puede explicarse ampliamente por su acción directa sobre el tracto respiratorio.
t<áp.
•m
La budesónida ha mostrado efectos anti-anafilácticos y antiinflamatorios en estudios de provocación realizados tanto en animales como en pacientes, que se manifiestan como una disminución de la obstrucción bronquial producida por las reacciones alérgicas, tanto inmediatas como retardadas.
Exacerbaciones del asma
La budesónida inhalada, administrada una o dos veces al día, previene eficazmente las exacerbaciones del asma en niños y en adultos.
Asma inducido por ejercicio físico
El tratamiento con budesónida inhalada, administrada tanto una como dos veces al día ha sido eficaz en la prevención del asma inducido por ejercicio.
Reactividad de las vías aéreas
La budesónida también disminuye la reactividad de las vías aéreas en pacientes hiperreactivos, tras provocación tanto directa como indirecta.
EPOC
En pacientes con EPOC leve a moderada, el tratamiento con 400 microgramos de PULMICORT TURBUHALER dos veces al día originó una mejoría en el FEV1 tras 3-6 meses de tratamiento en comparación con placebo, manteniéndose durante un periodo de 3 años de tratamiento.
Función del eje hipotalámico-hipofisario-suprarrenal
Los estudios realizados en voluntarios sanos con PULMICORT TURBUHALER han evidenciado un efecto relacionado con la dosis sobre el cortisol plasmático y urinario. A las dosis recomendadas, PULMICORT TURBUHALER causa un efecto significativamente menor sobre la función suprarrenal que 10 mg de prednisolona, tal y como se demuestra en las pruebas por ACTH.
Crecimiento
Los estudios a largo plazo muestran que niños y adolescentes tratados con budesónida inhalada alcanzan finalmente su altura correspondiente de adulto. Sin embargo, se ha observado una disminución inicial leve y transitoria en el crecimiento (de aproximadamente 1 cm), que generalmente se produce durante el primer año de tratamiento.
Seguridad clínica
Población pediátrica:
Se realizaron exámenes con lámpara de hendidura en 157 niños (de 5 a 16 años de edad), tratados con una dosis media diaria de 504 pg durante 3-6 años. Los resultados fueron comparados con 111 niños asmáticos de la misma edad. La budesónida inhalada no se relacionó con una mayor incidencia de catarata subcapsular posterior.
Influencia sobre las concentraciones plasmáticas de cortisol:
Estudios con PULMICORT TURBUHALER en voluntarios sanos han demostrado que existe relación entre la dosis y las concentraciones plasmáticas y urinarias de cortisol. Como se muestra en el test ACTH, a las dosis recomendadas, PULMICORT TURBUHALER causa significativamente menos efecto en la función suprarrenal que 10 mg de prednisona.
5.2 Propiedades farmacocinéticas
Absorción
Después de la inhalación oral a través de PULMICORT TURBUHALER, se obtienen concentraciones plasmáticas pico de budesónida (4,0 nmol/l tras una dosis de 800 pg) en un intervalo de 30 minutos. La concentración plasmática máxima y el área bajo la curva perfil concentración plasmática-tiempo aumentan linealmente con la dosis, pero son ligeramente (20-30%) más altas después de dosis repetidas (3 semanas de tratamiento) que después de una dosis única. La deposición pulmonar en voluntarios sanos se estimó en un 34% ± 10% (media aritmética ± desviación estandar) de la cantidad dosificada , mientras que el 22% queda retenido en la boquilla y el resto (aproximadamente el 45% de la cantidad dosificada) se ingiere.
Distribución
El volumen de distribución de la budesónida es de aproximadamente 3 l/kg, y el promedio de la unión a proteínas plasmáticas del 85-90%.
Biotransformación
La budesónida sufre un alto grado (aprox. 90%) de biotransformación de primer paso en el hígado a metabolitos de baja actividad glucocorticoide. La actividad glucocorticoide de los metabolitos principales, 6a-hidroxibudesónida y 16 p-hidroxiprednisolona, es inferior a un 1% de la presentada por budesónida. El metabolismo de budesónida está mediado principalmente por una subfamilia del citocromo p450, la CYP3A.
Eliminación
Los metabolitos de la budesónida se excretan como tales o en su forma conjugada principalmente a través de los riñones. No se ha detectado budesónida inalterada en la orina. La budesónida presenta un aclaramiento sistémico elevado (aproximadamente 1,2 l/min), en adultos sanos, y la vida media tras la administración intravenosa oscila entre las 2 y 3 horas.
Linealidad
A dosis clínicamente relevantes, la cinética de la budesónida es proporcional a la dosis.
Población pediátrica
La budesónida presenta un aclaramiento sistémico de aproximadamente 0,5 l/min en niños asmáticos de 4 a 6 años de edad. Por kilogramo de peso corporal, los niños poseen un aclaramiento que es aproximadamente un 50% mayor que en adultos. En niños asmáticos, la semivida terminal de la budesónida después de la inhalación es de aproximadamente 2,3 horas. Esto es casi lo mismo que en adultos sanos. En niños asmáticos tratados con PULMICORT TURBUHALER (dosis única de 800 pg), la concentración plasmática alcanzó su Cmax (4,85 nmol/l) a los 13,8 minutos después de la inhalación, y luego disminuyó rápidamente; el área bajo la curva (AUC) fue de 10,3 nmohh/l. El valor del AUC es generalmente comparable al observado en adultos con la misma dosis, sin embargo, el valor de Cmax tiende a ser mayor en niños. El depósito pulmonar en niños (31% de la dosis nominal) es similar al medido en adultos sanos (34% de la dosis nominal).
5.3 Datos preclínicos sobre seguridad
Los resultados de los estudios de toxicidad aguda, subaguda y crónica mostraron que los efectos sistémicos de la budesónida son menos graves o similares a los observados con otros glucocorticoides, por ej. ganancia de peso disminuida y atrofia de los tejidos linfoides y de la corteza suprarrenal.
La budesónida evaluada en 6 pruebas analíticas diferentes no mostró ningún efecto mutagénico o clastogénico.
En un estudio de carcinogénesis en ratas macho se ha observado una incidencia incrementada de gliomas cerebrales que no se pudo verificar en un segundo estudio repetido, en el que la incidencia de gliomas no se
.-ítp.
ÍTTI
diferenció en ninguno de los grupos de tratamiento activo (budesónida, prednisolona, acetónido de triamcinolona) y en los grupos control.
Las anomalías hepáticas (principalmente neoplasmas hepatocelulares), halladas en ratas macho en el estudio de carcinogénesis inicial, se observaron en el segundo estudio con budesónida al igual que con los otros glucocorticoides de referencia. Estos efectos están probablemente más relacionados con un efecto sobre el receptor, representando así un efecto de clase.
La experiencia clínica disponible hasta la fecha no indica que la budesónida u otros glucocorticoides induzcan la aparición de gliomas cerebrales o neoplasmas hepatocelulares primarios en el hombre.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
PULMICORT TURBUHALER no contiene propelentes ni otro tipo de excipientes.
6.2 Incompatibilidades No aplicable
6.3 Periodo de validez
2 años.
6.4 Precauciones especiales de conservación
Mantener el envase perfectamente cerrado. No conservar a temperatura superior a 30 °C.
6.5 Naturaleza y contenido del envase
PULMICORT TURBUHALER es un inhalador multidosis de polvo seco que libera la dosis por simple inspiración. El inhalador está formado por piezas de plástico. Cada inhalador puede contener 50, 100 ó 200 dosis.
PULMICORT® TURBUHALER® 100 microgramos/inhalación polvo para inhalación: 200 dosis PULMICORT® TURBUHALER® 200 microgramos/inhalación polvo para inhalación: 100 dosis PULMICORT® TURBUHALER® 400 microgramos/inhalación polvo para inhalación: 100 dosis
6.6 Precauciones especiales de eliminación y otras manipulaciones
Ver apartado 4.2.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
AstraZeneca Farmacéutica Spain, S.A.
C/ Serrano Galvache, 56 - Edifico Álamo
28033 Madrid
España
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
PULMICORT® TURBUHALER® 100 microgramos/inhalación polvo para inhalación: 62.046 PULMICORT® TURBUHALER® 200 microgramos/inhalación polvo para inhalación: 59.254 PULMICORT® TURBUHALER® 400 microgramos/inhalación polvo para inhalación: 59.255
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
PULMICORT® TURBUHALER® 100 microgramos/inhalación polvo para inhalación: Octubre 1998 / Diciembre 2008
PULMICORT® TURBUHALER® 200 microgramos/inhalación polvo para inhalación: Abril 1996 / Diciembre 2008
PULMICORT® TURBUHALER® 400 microgramos/inhalación polvo para inhalación: Abril 1992 / Diciembre 2008
10. FECHA DE LA REVISIÓN DEL TEXTO
Octubre 2013
07.11.2013 (Var IB Ciz click sound)/CPIL Oct 2012
MINISrSUODE SANIDAD, POLITICA SOCIAL E IGUALDAD Agencia es paño» de medicamentos y proouctos sallaros
13 de 13