Priorix-Tetra Polvo Y Disolvente En Jeringa Precargada Para Solucion Inyectable
1. Nombre del medicamento
Priorix-Tetra - polvo y disolvente en jeringa precargada para solución inyectable Vacuna frente al sarampión, la parotiditis, la rubéola y la varicela (viva)
2. Composición cualitativa y cuantitativa
Después de la reconstitución, 1 dosis (0,5 ml) contiene:
Virus del sarampión1 de la cepa Schwarz (vivos, atenuados)
no menos de
103.0 CCID50 3
Virus de la parotiditis1 de la cepa RIT 4385, derivada de la cepa
Jeryl Lynn (vivos, atenuados) no menos de
Virus de la rubéola2 de la cepa Wistar RA 27/3 (vivos, atenuados) no menos de
Virus de la varicela2 de la cepa Oka (vivos, atenuados) no menos de
104,4 CCID503
103.0 CCID503 103,3 UFP4
1 producido en células de embrión de pollo
2 producido en células diploides humanas ( MRC-5)
3 dosis que infecta el 50% de los cultivos celulares
4 unidades formadoras de placa
Esta vacuna contiene cantidades traza de neomicina. Ver sección 4.3.
Excipiente con efecto conocido:
La vacuna contiene 14 mg de sorbitol, ver sección 4.4.
Para consultar la lista completa de excipientes ver sección 6.1.
3. Forma farmacéutica
Polvo y disolvente en jeringa precargada para solución inyectable.
Antes de la reconstitución, el polvo es una pastilla de color blanco a ligeramente rosado y el disolvente es un líquido transparente e incoloro.
4. Datos clínicos
4.1. Indicaciones terapéuticas
Priorix-Tetra está indicado para la inmunización activa frente al sarampión, la parotiditis, la rubéola y la varicela en niños desde los 11 meses hasta los 12 años de edad inclusive.
Se puede considerar el uso en niños de 9-10 meses de edad en circunstancias especiales. Ver sección 4.2. Nota: el uso de Priorix-Tetra debe estar basado en las recomendaciones oficiales.
4.2. Posología y forma de administración Posología
Niños desde los 11 meses hasta los 12 años
Los niños a partir de los 11 meses y hasta los 12 años de edad deben recibir dos dosis de Priorix-Tetra (cada una de 0,5 ml). La edad a la que los niños pueden recibir Priorix-Tetra debe reflejar las recomendaciones oficiales aplicables*, las cuales varían en función de la epidemiología de estas enfermedades.
El intervalo entre dosis debe ser preferiblemente* entre 6 semanas y 3 meses. Cuando se administra la primera dosis a los 11 meses de edad, la segunda dosis debe administrarse en un plazo de 3 meses. Bajo ninguna circunstancia el intervalo entre dosis debe ser inferior a 4 semanas. Ver sección 5.1.
Alternativamente, y de acuerdo con las recomendaciones oficiales aplicables*:
• Se puede administrar una dosis única de Priorix-Tetra a niños que ya hayan recibido una dosis única de otra vacuna frente al sarampión, la parotiditis y la rubéola (vacuna triple vírica o TV) y/o una dosis única de otra vacuna antivaricela.
• Se puede administrar una dosis única de Priorix-Tetra seguida de una dosis única de otra vacuna frente al sarampión, la parotiditis y la rubéola (vacuna triple vírica o TV) y/o una dosis única de otra vacuna antivaricela.
• Las recomendaciones oficiales aplicables pueden variar en lo que respecta al intervalo entre dosis y a la necesidad de una o dos dosis para las vacunas que contengan los componentes sarampión, parotiditis y rubéola y varicela.
Niños desde los 9 hasta los 10 meses
En el caso de que una situación epidemiológica requiera la vacunación de niños menores de 11 meses de edad, se puede administrar la primera dosis de Priorix-Tetra a partir de los 9 meses de edad. Se debe administrar una segunda dosis de Priorix-Tetra tres meses después de la primera dosis (ver sección 5.1).
Forma de administración
La vacuna se debe inyectar por vía subcutánea en la región deltoidea de la parte superior del brazo o en el área anterolateral superior del muslo.
Para consultar las instrucciones de reconstitución del medicamento antes de la administración, ver sección 6.6.
4.3. Contraindicaciones
Tal y como ocurre con otras vacunas, se debe posponer la administración de Priorix-Tetra a personas que padezcan enfermedades febriles agudas graves. Sin embargo, la presencia de una infección leve, como un resfriado, no debería posponer la vacunación.
Hipersensibilidad a los principios activos o a alguno de los excipientes incluidos en la sección 6.1 o a la neomicina. Un historial previo de dermatitis por contacto a la neomicina no es una contraindicación. Para la alergia al huevo, ver sección 4.4.
Hipersensibilidad tras la administración previa de vacunas frente al sarampión, la parotiditis, la rubéola y/o la varicela.
Inmunodeficiencia humoral o celular grave (primaria o adquirida), p.ej., inmunodeficiencia grave combinada, agammaglobulinemia y SIDA o infección por VIH sintomática, o con un porcentaje determinado de linfocitos T CD4+ para cada edad: en niños menores de 12 meses: CD4+ < 25%; niños entre 12-35 meses: CD4+ < 20%; niños entre 36-59 meses: CD4+ < 15% (ver sección 4.4).
Embarazo. Además, se debe evitar el embarazo durante 1 mes después de la vacunación (ver sección 4.6).
4.4. Advertencias y precauciones especiales de empleo
Como con todas las vacunas inyectables, se deberá disponer en todo momento del tratamiento y supervisión médica apropiados, para el caso poco común de aparición de una reacción anafiláctica tras la administración de la vacuna.
Antes de administrar la vacuna se debe dejar evaporar el alcohol o cualquier otro antiséptico empleado sobre la piel, ya que podrían inactivar los virus vacunales.
Los componentes de sarampión y parotiditis de la vacuna se producen en cultivos celulares de embrión de pollo y, por tanto, pueden contener trazas de proteínas de huevo. Las personas con historial de reacción anafiláctica, anafilactoide u otras reacciones inmediatas posteriores a la ingestión de huevo (p.ej., urticaria generalizada, inflamación de la boca y la garganta, dificultad para respirar, hipotensión o shock), pueden tener más riesgo de reacciones de hipersensibilidad inmediata después de la vacunación, aunque se ha visto que este tipo de reacciones son muy raras. Las personas que hayan experimentado una reacción anafiláctica tras la ingesta de huevo deben ser vacunadas con extrema precaución, disponiéndose de acceso fácil al tratamiento médico apropiado en previsión de que se presenten este tipo de reacciones.
Este medicamento contiene sorbitol. Los pacientes con intolerancia hereditaria a la fructosa no deben vacunarse con esta vacuna.
Se debe evitar el uso de salicilatos durante 6 semanas después de cada vacunación con Priorix-Tetra dado que se ha notificado el síndrome de Reye después del uso de salicilatos durante la infección por el virus salvaje de la varicela.
Se puede adquirir cierta protección frente al sarampión o la varicela si se administra la vacuna dentro de las primeras 72 horas tras la exposición a los virus salvajes.
Convulsiones febriles
Se observó un mayor riesgo de fiebre y de convulsiones febriles entre los 5 y los 12 días después de la primera dosis de Priorix-Tetra, en comparación con la administración concomitante de la vacuna TV y de la vacuna antivaricela (ver secciones 4.8 y 5.1).
La vacunación de individuos con un historial personal o familiar de convulsiones (incluyendo convulsiones febriles) debe ser considerada con precaución. En estos individuos, para la primera dosis, se debe considerar la inmunización alternativa con la vacuna antivaricela y la vacuna TV administradas por separado (ver sección 4.2). En cualquier caso, se debe supervisar la aparición de fiebre en los vacunados durante el periodo de riesgo.
Normalmente, las tasas de fiebre son elevadas después de la primera dosis de vacunas con el componente sarampión. No hubo indicios de un mayor riesgo de fiebre después de la segunda dosis.
Pacientes inmunocomprometidos
Se puede considerar la vacunación en pacientes con determinadas inmunodeficiencias donde los beneficios sobrepasen a los riesgos (p.ej., personas con VIH asintomáticas, deficiencias de subclases de IgG, neutropenia congénita, enfermedad granulomatosa crónica y enfermedades por déficit del complemento).
Los pacientes inmunocomprometidos que no tienen contraindicación para esta vacunación (ver sección 4.3) pueden no responder tan bien como los individuos inmunocompetentes; por lo tanto, algunos de estos pacientes pueden adquirir sarampión, parotiditis, rubéola o varicela en caso de contacto, a pesar de la apropiada administración de la vacuna. En estos pacientes se deberá hacer un seguimiento cuidadoso de la aparición de signos de sarampión, parotiditis, rubéola y varicela.
Transmisión
No se ha documentado la transmisión de los virus del sarampión, de la parotiditis ni de la rubéola entre las personas vacunadas y sus contactos susceptibles. No obstante, se sabe que la excreción faríngea del virus
de la rubéola se produce aproximadamente entre los 7 y los 28 días después de la vacunación, con un pico de excreción hacia el día 11. Se ha observado, con una frecuencia muy baja, la transmisión del virus vacunal (cepa OKA) desde personas vacunadas que desarrollan exantema post-vacunal a sus contactos seronegativos. No se puede descartar la transmisión del virus vacunal (cepa OKA) desde una persona vacunada que no desarrolla exantema post-vacunal a sus contactos seronegativos.
Las personas vacunadas, incluso aquellas que no desarrollan exantema variceliforme, deben intentar evitar, cuando sea posible, la interacción estrecha con personas con alto riesgo susceptibles a la varicela durante las 6 semanas posteriores a la vacunación. En aquellas circunstancias en las que sea inevitable el contacto con personas con alto riesgo susceptibles a la varicela, se debe sopesar el posible riesgo de transmitir el virus vacunal frente al de adquirir y transmitir el virus salvaje.
Entre las personas con alto riesgo susceptibles a la varicela se incluyen:
• Sujetos inmunocomprometidos (ver secciones 4.3 y 4.4).
• Mujeres embarazadas sin historial de varicela positivo documentado o sin evidencia de infección previa confirmada por el laboratorio.
• Recién nacidos de madres sin historial de varicela positivo documentado o sin evidencia de infección previa confirmada por el laboratorio.
Priorix-Tetra no se debe administrar por vía intravascular o intradérmica bajo ninguna circunstancia.
Trombocitopenia
Tras la administración de vacunas de virus vivos de sarampión, parotiditis y rubéola a personas que sufrieron trombocitopenia tras la primera dosis, se han notificado casos de empeoramiento de la trombocitopenia y de recurrencia de la misma. En estos casos, se deben evaluar cuidadosamente los riesgos y los beneficios de la inmunización con Priorix-Tetra.
Después de cualquier vacunación, o incluso antes, se puede producir, especialmente en adolescentes, un síncope (desfallecimiento) como una reacción psicógena a la inyección de la aguja. Durante la recuperación, éste puede ir acompañado de varios signos neurológicos tales como déficit visual transitorio, parestesia y movimientos tónico clónicos en los miembros. Es importante que se disponga de procedimientos para evitar daños causados por las pérdidas de conocimiento.
Como con cualquier vacuna, puede que no se genere una respuesta inmune protectora en todos los vacunados. Al igual que con otras vacunas antivaricela, se han observado casos de varicela en personas que previamente habían recibido Priorix-Tetra. Estos casos de varicela breakthrough (varicela en sujetos vacunados) son normalmente leves y cursan con un menor número de lesiones y fiebre de menor intensidad que los casos en personas no vacunadas.
Existen muy pocas notificaciones de varicela diseminada con afectación de órganos internos tras la vacunación con la vacuna antivaricela (cepa OKA), sobre todo en pacientes inmunocomprometidos.
Interferencia con las pruebas serológicas (ver sección 4.5)
4.5. Interacción con otros medicamentos y otras formas de interacción
Los ensayos clínicos han demostrado que Priorix-Tetra se puede administrar simultáneamente con cualquiera de las siguientes vacunas monovalentes o combinadas [incluyendo vacunas hexavalentes (DTPa-VHB-VPI/Hib)]: vacuna antidiftérica, antitetánica y antitosferina acelular (DTPa), vacuna frente a Haemophilus influenzae tipo b (Hib), vacuna frente a la polio inactivada (VPI), vacuna antihepatitis B (VHB), vacuna frente al meningococo del serogrupo B (MenB), vacuna conjugada frente al meningococo del serogrupo C (MenC), vacuna conjugada frente al meningococo de los serogrupos A, C, W-135 e Y (MenACWY) y vacuna conjugada 10-valente frente al neumococo.
Debido a un mayor riesgo de fiebre, dolor a la presión en el lugar de la inyección, cambio en los hábitos alimentarios e irritabilidad cuando Bexsero se administra conjuntamente con Priorix-Tetra, se debe considerar, siempre que sea posible, la vacunación por separado.
Actualmente no hay datos suficientes que respalden la administración de Priorix-Tetra con otras vacunas.
Si se tiene que administrar Priorix-Tetra al mismo tiempo que otra vacuna inyectable, las vacunas siempre se deben administrar en lugares de inyección diferentes.
Pruebas serológicas
Si se tiene que realizar la prueba de la tuberculina, ésta se debe realizar antes o simultáneamente a la administración de la vacuna, ya que se ha comunicado que las vacunas combinadas de sarampión, parotiditis y rubéola pueden producir una disminución temporal de la sensibilidad de la piel a la tuberculina. Dado que esta anergia puede durar hasta un máximo de 6 semanas, no debe realizarse la prueba de la tuberculina durante dicho periodo de tiempo para evitar resultados falsos negativos.
En personas que han recibido gammaglobulinas humanas o transfusiones sanguíneas, se debe retrasar la vacunación durante al menos tres meses debido a la probabilidad de fallo vacunal por la presencia de anticuerpos adquiridos de forma pasiva.
Los receptores de la vacuna deben evitar el uso de salicilatos durante 6 semanas después de cada vacunación con Priorix-Tetra (ver sección 4.4)
4.6. Fertilidad, embarazo y lactancia
Fertilidad
No se han realizado estudios de fertilidad con Priorix-Tetra.
Embarazo
Las mujeres embarazadas no se deben vacunar con Priorix-Tetra.
Sin embargo, no se ha documentado daño fetal cuando se administran vacunas de sarampión, parotiditis, rubéola o varicela a mujeres embarazadas.
El embarazo se debe evitar durante 1 mes después de la vacunación. Las mujeres que estén intentando un embarazo deben ser advertidas para que lo retrasen.
Lactancia
No se dispone de datos adecuados en humanos sobre el uso de Priorix-Tetra durante la lactancia.
4.7. Efectos sobre la capacidad para conducir y utilizar máquinas Sin relevancia.
4.8. Reacciones adversas Resumen del perfil de seguridad
El perfil de seguridad que se muestra a continuación está basado en datos de ensayos clínicos en los que se administraron más de 6.700 dosis de Priorix-Tetra a más de 4.000 niños de 9 a 27 meses de edad. Los eventos fueron registrados hasta los 42 días post-vacunación.
Las reacciones adversas más frecuentes tras la administración de Priorix-Tetra fueron dolor y enrojecimiento en el lugar de la inyección y fiebre > 38°C (rectal) o > 37,5°C (axilar/oral).
Listado de reacciones adversas
Las reacciones adversas notificadas se enumeran de acuerdo con las siguientes frecuencias:
Muy frecuentes (>1/10)
Frecuentes (>1/100 a <1/10)
Poco frecuentes (>1/1.000 a <1/100)
Raras (>1/10.000 a <1/1.000)
Muy raras (<1/10.000)
Datos de ensayos clínicos
Infecciones e infestaciones:
Poco frecuentes: infección del tracto respiratorio superior Raras: otitis media
Trastornos de la sangre y del sistema linfático:
Poco frecuentes: linfadenopatía
Trastornos del metabolismo y de la nutrición:
Poco frecuentes: anorexia
Trastornos psiquiátricos:
Frecuentes: irritabilidad
Poco frecuentes: llanto anormal, nerviosismo, insomnio
Trastornos del sistema nervioso:
Raras: convulsiones febriles*
Trastornos respiratorios, torácicos y mediastínicos:
Poco frecuentes: rinitis Raras: tos, bronquitis
Trastornos gastrointestinales:
Poco frecuentes: aumento de tamaño de la glándula parótida, diarrea, vómitos
Trastornos de la piel y del tejido subcutáneo:
Frecuentes: erupción cutánea
Trastornos generales y alteraciones en el lugar de administración:
Muy frecuentes: dolor y enrojecimiento en el lugar de la inyección, fiebre (rectal > 38°C - < 39,5°C; axilar/oral > 37,5°C - < 39°C)**
Frecuentes: hinchazón en el lugar de la inyección, fiebre (rectal > 39,5°C; axilar/oral > 39°C)**
Poco frecuentes: letargia, malestar general, cansancio
*En un análisis de bases de datos retrospectivo se evaluó el riesgo de convulsiones febriles en niños entre 9 y 30 meses de edad tras la primera dosis de la vacunación con Priorix-Tetra versus con la vacuna TV o con las vacunas TV y antivaricela administradas simultáneamente pero de forma separada.
El estudio incluyó 82.656 niños inmunizados con Priorix-Tetra, 149.259 con la vacuna TV y 39.203 con las vacunas TV y antivaricela administradas de forma separada.
Dependiendo de la definición de caso utilizada para identificar las convulsiones febriles en el principal periodo de riesgo de 5 a 12 días tras la primera dosis, las incidencias de convulsiones febriles fueron del 2,18 (IC 95%: 1,38; 3,45) o del 6,19 (IC 95%: 4,71; 8,13) por cada 10.000 individuos en el grupo de Priorix-Tetra y del 0,49 (IC 95%: 0,19; 1,25) o del 2,55 (IC 95%: 1,67; 3,89) por cada 10.000 individuos en los grupos control pareados.
Estos datos sugieren un caso adicional de convulsiones febriles por cada 5.882 o 2.747 individuos vacunados con Priorix-Tetra, en comparación con los grupos control pareados que recibieron la vacuna TV o las vacunas TV y antivaricela administradas simultáneamente pero de forma separada (riesgo atribuible de 1,70 (IC 95% :-1,86; 3,46) y de 3,64 (IC 95%: -6,11; 8,30) por cada 10.000 individuos, respectivamente) - ver sección 5.1.
**Tras la administración de la primera dosis de la vacuna combinada frente al sarampión, la parotiditis, la rubéola y la varicela, las incidencias de fiebre observadas fueron más altas (aproximadamente 1,5 veces) en comparación con la administración concomitante, en lugares de inyección diferentes, de la vacuna TV y de la vacuna antivaricela.
Datos de vigilanciapost-comercialización
Las siguientes reacciones adversas adicionales han sido identificadas en raras ocasiones durante la vigilancia post-comercialización. Debido a que son notificadas voluntariamente por una población de tamaño desconocido, no se puede proporcionar una estimación verdadera de la frecuencia.
Infecciones e infestaciones :
Meningitis, herpes zóster***, , síndrome similar al sarampión, síndrome similar a las paperas (incluyendo orquitis, epididimitis y parotiditis)
Trastornos de la sangre y del sistema linfático :
Trombocitopenia, púrpura trombocitopénica
Trastornos del sistema inmunológico:
Reacciones alérgicas (incluyendo reacciones anafilácticas y anafilactoides)
Trastornos del sistema nervioso:
Encefalitis, cerebelitis, ictus, síndrome de Guillain Barré, mielitis transversa, neuritis periférica, síntomas parecidos a los de la cerebelitis (incluyendo trastorno transitorio de la marcha y ataxia transitoria)
Trastornos vasculares:
Vasculitis
Trastornos de la piel y del tejido subcutáneo:
Eritema multiforme, exantema variceliforme
Trastornos musculoesqueléticos y del tejido conjuntivo:
Artralgia, artritis
***Esta reacción adversa notificada tras la vacunación también es una consecuencia de la infección natural por el virus de la varicela. No hay indicios de que haya un mayor riesgo de aparición de herpes zóster después de la vacunación en comparación con la enfermedad natural.
Notificación de sospechas de reacciones adversas
Es importante notificar las sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano, https://www.notificaram.es/
4.9. Sobredosis
No se han notificado casos de sobredosis.
5. Propiedades farmacológicas
5.1. Propiedades farmacodinámicas
Grupo farmacoterapéutico: vacunas antivirales, código ATC: J07BD54 Eficacia
En un amplio ensayo clínico aleatorizado, en el que se utilizó Priorix (vacuna combinada viva atenuada de GlaxoSmithKline frente al sarampión, la parotiditis y la rubéola) como control, se evaluó la eficacia de Varilrix (vacuna monovalente viva atenuada de GlaxoSmithKline frente a la varicela) y de Priorix-Tetra para prevenir la varicela. El estudio se realizó en países europeos en los que no está implementada la vacunación rutinaria frente a la varicela. Se administraron dos dosis de Priorix-Tetra (N = 2.279) con un intervalo de seis semanas o una dosis de Varilrix (N = 2.263) a niños de 12 a 22 meses y se les realizó un seguimiento durante un periodo de aproximadamente 35 meses post-vacunación (el seguimiento a largo plazo, a 10 años, sigue en marcha). La eficacia vacunal observada frente a cualquier forma de varicela (definida de acuerdo a una escala predeterminada) confirmada epidemiológicamente o mediante PCR (Reacción en Cadena de la Polimerasa) fue del 94,9% (IC 97,5%: 92,4; 96,6%) después de dos dosis de Priorix-Tetra y del 65,4 % (IC 97,5%: 57,2; 72,1%) después de una dosis de Varilrix. La eficacia vacunal frente a varicela confirmada moderada o grave fue del 99,5% (IC 97,5%: 97,5; 99,9%) después de dos dosis de Priorix-Tetra y del 90,7% (IC 97,5%: 85,9; 93,9%) después de una dosis de Varilrix.
En un estudio realizado en Finlandia, diseñado específicamente para evaluar la eficacia vacunal de Varilrix, se realizó el seguimiento de 493 niños de 10 a 30 meses de edad durante un periodo de aproximadamente 2,5 años tras la vacunación con una dosis. La eficacia protectora fue del 100% (IC 95%: 80; 100%) frente a casos clínicos habituales o graves de varicela ( > 30 vesículas) y del 88% (IC 95%: 72; 96%) frente a cualquier caso de varicela confirmada serológicamente (al menos 1 vesícula o pápula).
Efectividad
Los datos de efectividad sugieren que tras dos dosis de una vacuna con el componente varicela se logra un mayor nivel de protección y una disminución de la varicela breakthrough (varicela en individuos vacunados) que tras una dosis.
La efectividad de dos dosis de Priorix-Tetra durante brotes de varicela en centros de atención diurna en Alemania, en donde se recomienda la vacunación sistemática frente a la varicela en niños a partir de los 11 meses de edad, fue del 91% (IC 95%: 65; 98%) frente a cualquier forma de la enfermedad y del 94% (IC 95%: 54; 99%) frente a la enfermedad moderada.
La efectividad de una dosis de Varilrix, estimada a partir de diferentes contextos (brotes, estudios de casos-control y de bases de datos), osciló entre un 20%-92% frente a cualquier forma de varicela y entre un 86%-100% frente a varicela moderada o grave.
Respuesta inmune
En varios ensayos clínicos se evaluó la respuesta inmune obtenida con Priorix-Tetra. Se determinaron los títulos de anticuerpos antisarampión, antiparotiditis y antirubéola utilizando ensayos de inmunoabsorción enzimática (ELISA) comerciales. Adicionalmente, se realizó la titulación de anticuepos antiparotiditis utilizando un ensayo de neutralización por reducción en placas. Estos parámetros serológicos están ampliamente aceptados como marcadores subrogados de protección inmune. Para comparar la respuesta inmune frente a la varicela obtenida con Priorix-Tetra versus Varilrix se utilizaron un ensayo de inmunofluorescencia indirecta (IFA) comercial modificado y un ELISA comercial.
En tres ensayos clínicos realizados en Europa (Austria, Finlandia, Alemania, Grecia, Polonia) se administraron 2 dosis de Priorix-Tetra con un intervalo de 6 semanas a, aproximadamente, 2.000 niños de 11 a 23 meses de edad previamente no vacunados. Las tasas de seroconversión (SC) y las medias geométricas de los títulos/concentraciones de anticuerpos (GMC/GMT) se resumen en la siguiente tabla.
|
Ensayo de anticuerpos (punto de corte) |
Post-dosis 1 |
Post-dosis 2 | ||
|
SC (IC 95 %) |
GMC/GMT (IC 95 %) |
SC (IC 95 %) |
GMC/GMT (IC 95 %) | |
|
Sarampión ELISA (lSOmUIml) |
96,4% (IC: 95,5 - 97,2) |
3.184,5 (IC: 3.046.5 - 3.328,7) |
99,1% (IC: 98,6 - 99,5) |
4.828,6 (IC: 4.644.3 - 5.020,1) |
|
Parotiditis ELISA (231L7ml) Neutralización (1:28) |
91,3% (IC: 90,0 - 92,5) 95,4% (IC: 94.3 - 96.3) |
976,7 (IC: 934,8 - 1.020,5) 147,0 (IC: 138,6 - 155,8) |
98,8% (IC: 98,2 - 99,2) 99,4% (IC: 98,9 - 99,7) |
1.564.4 (IC: 1.514,6-1.615,8) 478.4 (IC: 455,1 -503,0) |
|
Rubéola ELISA (40 mi) |
99,7% (IC: 99.4 - 99.9) |
62,2 (IC: 60,0 - 64,5) |
99,9% (IC: 99,6 - 100) |
119,7 (IC: 116.4-123,1) |
|
Varicela IFA (1:4) |
97,2% (IC: 96,3 - 97,9) |
97,5 (IC: 92,2 - 103,1) |
99,8% (IC: 99,5 - 100) |
2.587,8 (IC: 2.454,0 - 2.728,9) |
|
ELISA (50mUI/ml) |
89,4% (IC: 87,8 - 90,8) |
112,0 (IC: 93,5 - 134,0) |
99,2% (IC: 98,5 - 99,6) |
2.403,9 (IC: 1.962,4 - 2.944,6) |
Las tasas de seroconversión y las medias geométricas de los títulos/concentraciones de anticuerpos fueron similares a las observadas tras la vacunación con Varilrix y Priorix por separado.
En niños vacunados a los 11 meses de edad, la proporción de niños con títulos protectores frente al sarampión (>150 mUI/ml) tras la primera dosis es del 91-92%, inferior a la proporción observada cuando la primera dosis se administra a partir de los 12 meses de edad.
La segunda dosis de Priorix-Tetra produjo un aumento de las tasas de seroconversión y/o de los niveles de anticuerpos frente a los componentes del sarampión, la parotiditis y la rubéola de la vacuna. Así pues, para evitar la infección durante el intervalo entre dosis, es preferible que la segunda dosis se administre dentro de los tres meses siguientes a la primera dosis.
Los datos sugieren que con dos dosis de la vacuna se obtienen una mayor eficacia y una disminución de la varicela breakthrough (varicela en individuos vacunados) que con una dosis. Esto se correlaciona con un aumento de los anticuerpos antivaricela que se obtiene con la segunda dosis, sugiriendo que la segunda dosis del antígeno varicela actúa como refuerzo.
En dos ensayos clínicos se evaluó la respuesta inmune de Priorix-Tetra administrada como segunda dosis de la vacuna TV en niños de 24 meses a 6 años de edad. Los niños fueron previamente primovacunados con una vacuna TV o con una vacuna TV coadministrada con una vacuna antivaricela viva atenuada. Las tasas de seropositividad para los anticuerpos antivaricela fueron del 98,1% (IFA) en los niños previamente vacunados con una vacuna TV y del 100% en los niños previamente vacunados con una vacuna TV
coadministrada con una vacuna antivaricela viva atenuada. Las tasas de seropositividad para los anticuerpos antisarampión, antiparotiditis y antirubéola fueron del 100% en ambos estudios.
Respuesta inmune en niños de 9 a 10 meses de edad
Un ensayo clínico realizado en Asia (Singapur) reclutó a 300 niños sanos de 9 a 10 meses de edad en el momento de recibir la primera dosis de la vacuna. De estos, 153 individuos recibieron 2 dosis de Priorix-Tetra con un intervalo de 3 meses y 147 individuos recibieron Priorix y Varilrix. Las tasas de seroconversión y las medias geométricas de los títulos/concentraciones de anticuerpos fueron similares a las observadas tras la vacunación con Priorix y Varilrix por separado. Las tasas de seroconversión después de una primera dosis de Priorix-Tetra fueron comparables para todos los antígenos, excepto para el sarampión, a las observadas en niños de 12 a 24 meses de edad en otros ensayos clínicos. La tasa de seroconversión descrita para el sarampión en niños de 9 a 10 meses de edad después de 1 dosis de Priorix-Tetra fue del 93,3% (IC 95%: 87,6;96,9). Es posible que los niños no respondan suficientemente a los componentes de la vacuna en su primer año de vida debido a la posible interferencia con los anticuerpos maternos. Por lo tanto, se debe administrar una segunda dosis de Priorix-Tetra tres meses después de la primera dosis.
Persistencia de la respuesta inmune
En un amplio ensayo clínico, las tasas de seropositividad dos años después de la vacunación con dos dosis de Priorix-Tetra fueron del 99,4% (ELISA) y 99,2% (IFA) para los anticuerpos antivaricela y del 99,1%, 90,5% y 100% (ELISA) para los anticuerpos antisarampión, antiparotiditis y antirubéola respectivamente.
Estudio observacional de vigilancia de la seguridad post-comercialización
Se evaluó, mediante un análisis de bases de datos retrospectivo, el riesgo de convulsiones febriles tras la primera dosis de Priorix-Tetra en niños de 9 a 30 meses de edad (ver sección 4.8).
5.2. Propiedades farmacocinéticas No aplica.
5.3. Datos preclínicos sobre seguridad
Un estudio de toxicidad de dosis repetidas en animales no reveló ninguna toxicidad local ni sistémica de la vacuna.
6 . Datos farmacéuticos 6.1. Lista de excipientes
Polvo:
Aminoácidos Lactosa anhidra Manitol Sorbitol Medio 199
Disolvente:
Agua para preparaciones inyectables

6.2. Incompatibilidades
En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros.
6.3. Periodo de validez 18 meses.
Una vez reconstituida, la vacuna se debe administrar rápidamente o mantenerse en la nevera (2° C - 8° C). Desechar la vacuna si no se utiliza en un plazo de 24 horas tras la reconstitución.
6.4. Precauciones especiales de conservación Conservar y transportar refrigerada (entre 2°C y 8°C).
No congelar.
Conservar en el embalaje original para protegerla de la luz.
Para las condiciones de conservación tras la reconstitución del medicamento, ver sección 6.3.
6.5. Naturaleza y contenido del envase
Polvo en un vial (vidrio de tipo I) con un tapón (goma de butilo).
0,5 ml de disolvente en una jeringa precargada (vidrio de tipo I) con tapón del émbolo (goma de butilo) con o sin agujas separadas en los siguientes tamaños de envases:
• con 2 agujas separadas: envases de 1 o 10
• sin aguja: envases de 1, 10, 20 o 50
Puede que solamente estén comercializados algunos tamaños de envases.
6.6. Precauciones especiales de eliminación y otras manipulaciones
Se debe inspeccionar visualmente la vacuna reconstituida para detectar cualquier partícula extraña y/o apariencia física anormal. Si se observa cualquiera de ellas, desechar la vacuna.
La vacuna se debe reconstituir añadiendo todo el contenido de la jeringa precargada al vial que contiene el
polvo.
Para saber cómo insertar la aguja en la jeringa, véase el dibujo explicativo. No obstante, la jeringa facilitada con Priorix-Tetra puede ser ligeramente diferente (sin rosca de tornillo) a la jeringa descrita en el dibujo. En tal caso, la aguja deberá insertarse sin enroscar.
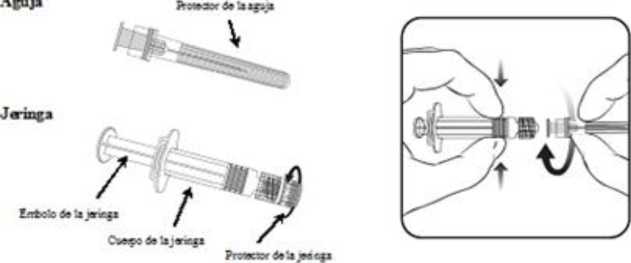
Agencia esparto» de medicamentos y productos saratanos
1. Sujetar el cuerpo de la jeringa con una mano (evitar sostener el émbolo de la jeringa) y con la otra, desenroscar el protector de la jeringa girándolo en sentido contrario a las agujas del reloj.
2. Insertar la aguja en la jeringa y a continuación, girar la aguja en el sentido de las agujas del reloj hasta que se bloquee (ver dibujo).
3. Retirar el protector de la aguja; en algunas ocasiones puede resultar un poco difícil.
Añadir el disolvente al polvo. Después de añadir el disolvente al polvo, se debe agitar bien la mezcla hasta que el polvo esté completamente disuelto.
El color de la vacuna reconstituida puede variar del naranja claro al rosa fucsia debido a pequeñas variaciones en su pH. Esto es normal y no compromete la acción de la vacuna. En el caso de que se observe otra variación, desechar la vacuna.
Se debe utilizar una aguja nueva para administrar la vacuna.
Retirar todo el contenido del vial.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
7. Titular de la autorización de comercialización
GlaxoSmithKline Biologicals s.a.
Rue de l’Institut 89 B-1330 Rixensart Bélgica
8. Número(s) de autorización de comercialización
79632.
9. Fecha de la primera autorización/ renovación de la autorización
Noviembre del 2014.
10. Fecha de la revisión del texto
Septiembre 2016
La información detallada y actualizada de este medicamento está disponible en la página Web de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) http://www.aemps.gob.es/.
12 de 12