Praxbind 2,5G/50Ml Solucion Inyectable Y Para Perfusion
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas. Ver la sección 4.8, en la que se incluye información sobre cómo notificarlas.
1. NOMBRE DEL MEDICAMENTO
Praxbind 2,5 g/50 ml solución inyectable y para perfusión
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada ml de solución inyectable y para perfusión contiene 50 mg de idarucizumab.
Cada vial contiene 2,5 g de idarucizumab en 50 ml.
Idarucizumab se produce mediante la tecnología de ADN recombinante en células ováricas de hámster chino.
Excipientes con efecto conocido
Cada vial de 50 ml contiene 2 g de sorbitol y 25 mg de sodio (ver sección 4.4).
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Solución inyectable y para perfusión
Solución de transparente a ligeramente opalescente y de incolora a ligeramente amarilla.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Praxbind es un agente de reversión específico para dabigatrán y está indicado en pacientes adultos tratados con Pradaxa (dabigatrán etexilato) cuando se necesita una reversión rápida de sus efectos anticoagulantes:
• Para intervenciones quirúrgicas de urgencia o procedimientos urgentes.
• En el caso de hemorragias potencialmente mortales o no controladas.
4.2 Posología y forma de administración
Limitado únicamente a uso hospitalario.
Posología
La dosis recomendada de Praxbind es de 5 g (2 x 2,5 g/50 ml).
En un subconjunto de pacientes, se ha producido la recurrencia de concentraciones plasmáticas de dabigatrán libre y la prolongación concomitante de las pruebas de coagulación hasta 24 horas después de la administración de idarucizumab (ver sección 5.1).
Se puede considerar la administración de una segunda dosis de 5 g de Praxbind en las siguientes situaciones:
• recurrencia de sangrado clínicamente relevante junto con tiempos de coagulación prolongados, o
• si un posible nuevo sangrado fuese potencialmente mortal y se observa la prolongación de los tiempos de coagulación, o
• los pacientes necesitan una segunda intervención quirúrgica de urgencia o procedimiento urgente y presentan prolongación de los tiempos de coagulación.
Los principales parámetros de la coagulación son el tiempo de tromboplastina parcial activado (TTPa), el tiempo de trombina diluido (TTd) o el tiempo de coagulación de ecarina (TCE) (ver sección 5.1).
No se ha investigado una dosis máxima diaria.
Reinicio del tratamiento antitrombótico
El tratamiento con Pradaxa (dabigatrán etexilato) puede reiniciarse 24 horas después de la administración de Praxbind, siempre y cuando el paciente se encuentre clínicamente estable y se haya alcanzado una hemostasia adecuada.
Tras la administración de Praxbind, es posible iniciar otro tratamiento antitrombótico (por ejemplo, con heparina de bajo peso molecular) en cualquier momento, siempre y cuando el paciente se encuentre clínicamente estable y se haya alcanzado una hemostasia adecuada.
La ausencia de tratamiento antitrombótico expone a los pacientes al riesgo trombótico derivado de su enfermedad o afección subyacentes.
Insuficiencia renal
No se requiere ajuste de dosis en pacientes con insuficiencia renal. La insuficiencia renal no influyó en el efecto de reversión de idarucizumab.
Insuficiencia hepática
No se requiere ajuste de dosis en pacientes con insuficiencia hepática (ver sección 5.2).
Pacientes de edad avanzada
No se requiere ajuste de dosis en pacientes de edad avanzada de 65 años de edad o mayores (ver sección 5.2).
Población pediátrica
No se ha establecido todavía la seguridad y eficacia de Praxbind en niños menores de 18 años. No se dispone de datos.
Forma de administración
Vía intravenosa.
Praxbind (2 x 2,5 g/50 ml) se administra por vía intravenosa en dos perfusiones consecutivas de entre 5 y 10 minutos cada una o en una inyección rápida (bolo).
Para consultar instrucciones adicionales sobre el uso y la manipulación, ver sección 6.6.
Ninguna.
4.4 Advertencias y precauciones especiales de empleo
Idarucizumab se une de forma específica a dabigatrán y revierte su efecto anticoagulante. No revierte los efectos de otros anticoagulantes (ver sección 5.1).
El tratamiento con Praxbind se puede utilizar en combinación con otras medidas estándar de soporte, si se considera que estas son médicamente apropiadas.
Hipersensibilidad
El riesgo de utilizar Praxbind en pacientes con hipersensibilidad conocida (por ejemplo, reacción anafilactoide) a idarucizumab o a alguno de los excipientes se debe valorar cuidadosamente frente al beneficio potencial de este tratamiento de urgencia. Si se produce una reacción anafiláctica u otra reacción alérgica grave, la administración de Praxbind se debe suspender de inmediato e iniciar el tratamiento adecuado.
Intolerancia hereditaria a la fructosa
La dosis recomendada de Praxbind contiene 4 g de sorbitol como excipiente. En pacientes con intolerancia hereditaria a la fructosa, la administración parenteral de sorbitol se ha asociado a casos de hipoglucemia, hipofosfatemia, acidosis metabólica, aumento del ácido úrico, insuficiencia hepática aguda con fracaso de la función excretora y sintética y muerte. Por tanto, en pacientes con intolerancia hereditaria a la fructosa, el riesgo de administrar tratamiento con Praxbind se debe valorar frente al beneficio potencial de este tratamiento de urgencia. Si se administra Praxbind en estos pacientes, se requiere intensificar la asistencia médica durante la exposición a Praxbind y dentro de las 24 horas tras la exposición al mismo.
Acontecimientos tromboembólicos
Los pacientes que estén recibiendo tratamiento con dabigatrán presentan enfermedades subyacentes que les predisponen a los acontecimientos tromboembólicos. La reversión del tratamiento con dabigatrán expone a los pacientes al riesgo trombótico derivado de su enfermedad o afección subyacentes. Para reducir este riesgo, se debe considerar la reanudación del tratamiento anticoagulante tan pronto como sea médicamente apropiado (ver sección 4.2).
Análisis de proteínas en orina
Praxbind provoca proteinuria transitoria como reacción fisiológica a la llegada de una concentración elevada de proteínas a nivel renal tras la aplicación rápida (bolo) o a corto plazo de 5 g de idarucizumab por vía intravenosa (ver sección 5.2). La proteinuria transitoria no es indicativa de daño renal, lo que se debe tener en cuenta en los análisis de orina.
Contenido en sodio
Este medicamento contiene 2,2 mmol (o 50 mg) de sodio por dosis, lo que deberá tenerse en cuenta en el tratamiento de pacientes con dietas pobres en sodio.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios formales de interacciones con Praxbind y otros medicamentos. De acuerdo a las propiedades farmacocinéticas y a la alta especificidad de la unión a dabigatrán, se considera improbable que se produzcan interacciones clínicamente relevantes con otros medicamentos.
Las investigaciones preclínicas con idarucizumab han demostrado que no se producen interacciones con:
• expansores de volumen.
• concentrados de factores de coagulación, tales como concentrados de complejo de protrombina (CCP, por ejemplo, factor 3 y factor 4), CCP activado (CCPa) y factor recombinante VIIa..
• otros anticoagulantes (por ejemplo, inhibidores de la trombina distintos a dabigatrán, inhibidores del factor Xa incluida la heparina de bajo peso molecular, antagonistas de la vitamina K o heparina). Por tanto, idarucizumab no revertirá los efectos de otros anticoagulantes.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No hay datos relativos al uso de Praxbind en mujeres embarazadas. Dada la naturaleza y el uso clínico previsto del medicamento, no se han realizado estudios de toxicidad para la reproducción ni el desarrollo. Praxbind se puede utilizar durante el embarazo si los beneficios clínicos esperados superan los riesgos potenciales.
Lactancia
Se desconoce si idarucizumab se excreta en la leche materna.
Fertilidad
No hay datos relativos al efecto de Praxbind sobre la fertilidad (ver sección 5.3).
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No procede.
4.8 Reacciones adversas
Se ha evaluado la seguridad de Praxbind en 224 individuos sanos, así como en 123 pacientes en un ensayo de fase III en curso que habían presentado una hemorragia no controlada o necesitado una intervención quirúrgica o procedimiento de urgencia y que estaban en tratamiento con Pradaxa (dabigatrán etexilato).
No se han identificado reacciones adversas.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Apéndice V.
No existe experiencia clínica con sobredosis de Praxbind.
La dosis única más alta de Praxbind estudiada en individuos sanos fue de 8 g. No se han identificado señales de seguridad en este grupo.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: todos los demás productos terapéuticos, antídotos, código ATC: V03AB37 Mecanismo de acción
Idarucizumab es un agente de reversión específico para dabigatrán. Es un fragmento de anticuerpo monoclonal humanizado (Fab) que se une a dabigatrán con una afinidad muy alta, aproximadamente 300 veces más potente que la afinidad de unión de dabigatrán a la trombina. El complejo idarucizumab-dabigatrán se caracteriza por una constante de asociación rápida y una constante de disociación extremadamente lenta, lo que da lugar a un complejo muy estable. Idarucizumab se une de forma potente y específica a dabigatrán y a sus metabolitos y neutraliza su efecto anticoagulante.
Eficacia clínica y seguridad
Se llevaron a cabo tres estudios de fase I aleatorizados, doble ciego y controlados con placebo en 283 individuos (224 tratados con idarucizumab) con el fin de evaluar la seguridad, la eficacia, la tolerancia, la farmacocinética y la farmacodinámica de idarucizumab, administrado solo o tras la administración de dabigatrán etexilato. La población investigada estaba formada por individuos sanos e individuos que presentaban unas características de población específicas que abarcaban la edad, el peso corporal, la raza, el sexo y la insuficiencia renal. En estos estudios, las dosis de idarucizumab oscilaron entre 20 mg y 8 g y la duración de las perfusiones osciló entre 5 minutos y 1 hora.
Los valores representativos de los parámetros farmacocinéticos y farmacodinámicos se establecieron basándose en individuos sanos de edades comprendidas entre 45 y 64 años que recibieron 5 g de idarucizumab (ver secciones 5.1 y 5.2).
En la actualidad hay en curso un estudio prospectivo, abierto, no aleatorizado y no controlado (RE-VERSE AD) para investigar el tratamiento de pacientes adultos que presentaron una hemorragia no controlada o potencialmente mortal relacionada con dabigatrán (Grupo A) o que necesitaron una intervención quirúrgica o procedimientos urgentes (Grupo B). El criterio de valoración principal fue el porcentaje máximo de reversión del efecto anticoagulante de dabigatrán en las 4 horas posteriores a la administración de idarucizumab, de acuerdo a la determinación por parte de un laboratorio central del tiempo de trombina diluido (TTd) o el tiempo de coagulación de ecarina (TCE). Un criterio de valoración secundario clave es la restauración de la hemostasia.
Un análisis intermedio de RE-VERSE AD incluyó datos de 123 pacientes: 66 pacientes con sangrado grave (Grupo A) y 57 que necesitaron un procedimiento urgente (Grupo B). Aproximadamente la mitad de los pacientes de cada grupo eran varones. La mediana de la edad fue de 77 años y la mediana del aclaramiento de creatinina fue de 61 ml/min. Aproximadamente el 68% de los pacientes del Grupo A y el 63% de los pacientes del Grupo B habían sido tratados con 110 mg de dabigatrán dos veces al día. Los resultados de las evaluaciones del laboratorio central estuvieron disponibles para un subconjunto de 90 pacientes (51 del Grupo A y 39 del Grupo B).
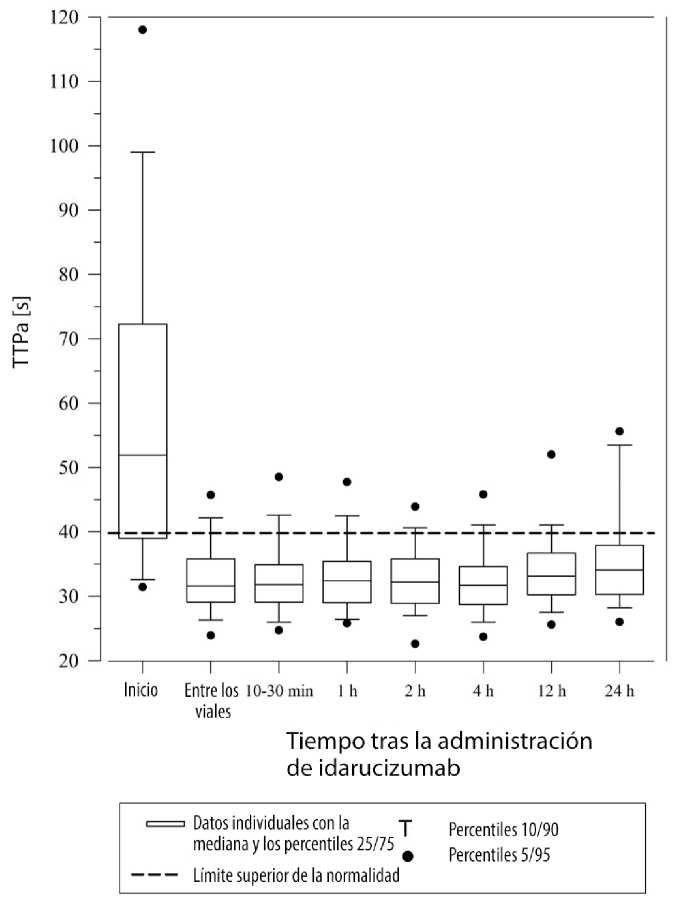
La mayoría de los pacientes (>89%), tanto en el Grupo A como en el B, lograron una reversión completa del efecto anticoagulante de dabigatrán determinada mediante el TTd o el TCE en las primeras 4 horas tras la administración de 5 g de idarucizumab. Los efectos de la reversión fueron evidentes inmediatamente después de la administración.
Figura 1: Reversión de la prolongación del tiempo de coagulación inducida por dabigatrán, determinado mediante el TTd en 90 pacientes del estudio RE-VERSE AD
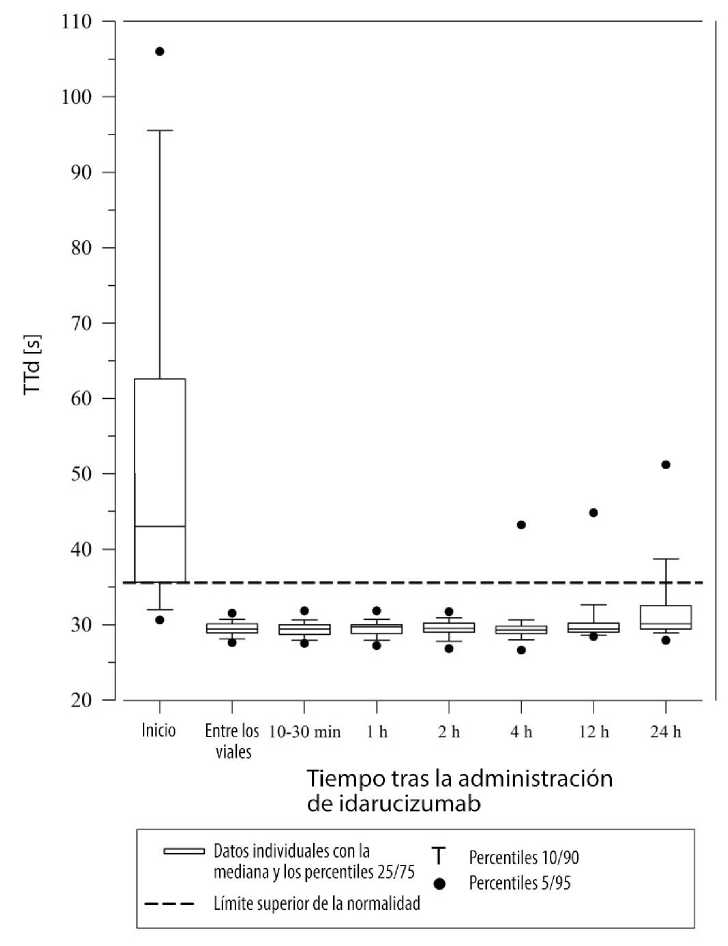
Figura 2: Reversión de la prolongación del tiempo de coagulación inducida por dabigatrán, determinado mediante el TTPa en 90 pacientes del estudio RE-VERSE AD
La restauración de la hemostasia se alcanzó en el 91% de los pacientes evaluables que presentaron sangrado grave y se observó una hemostasia normal en el 92% de los pacientes que necesitaron un procedimiento urgente.
Del total de 123 pacientes, 26 pacientes murieron. Cada una de las muertes pudo atribuirse a una complicación del evento por el que ha entrado en el ensayo o asociarse a comorbilidades. Se notificaron acontecimientos trombóticos en 5 pacientes, aunque ninguno de ellos se encontraba en tratamiento antitrombótico en el momento del acontecimiento. En cada uno de estos casos, el acontecimiento trombótico pudo atribuirse al trastorno médico subyacente del paciente. Se notificaron síntomas leves de hipersensibilidad potencial (pirexia, broncoespasmo, hiperventilación, erupción cutánea o prurito). No pudo establecerse una relación causal con idarucizumab. Otros acontecimientos adversos, notificados en al menos el 5% de los pacientes, fueron hipocaliemia (9/123; 7%), delirio (9/123; 7%), estreñimiento (8/123; 7%), pirexia (7/123; 6%), neumonía (7/123; 6 %).
Efectos farmacodinámicos
Se investigó la farmacodinámica de idarucizumab tras la administración de dabigatrán etexilato en 141 individuos en estudios de fase I, de los cuales se presentan los datos de un subgrupo representativo de 6 individuos sanos de edades comprendidas entre 45 y 64 años que estaban recibiendo una dosis de 5 g en perfusión intravenosa. La mediana de la exposición máxima a dabigatrán en los individuos sanos investigados estaba en el rango de una administración dos veces al día de 150 mg de dabigatrán etexilato en pacientes.
Efecto de idarucizumab sobre la exposición y la actividad anticoagulante de dabigatrán
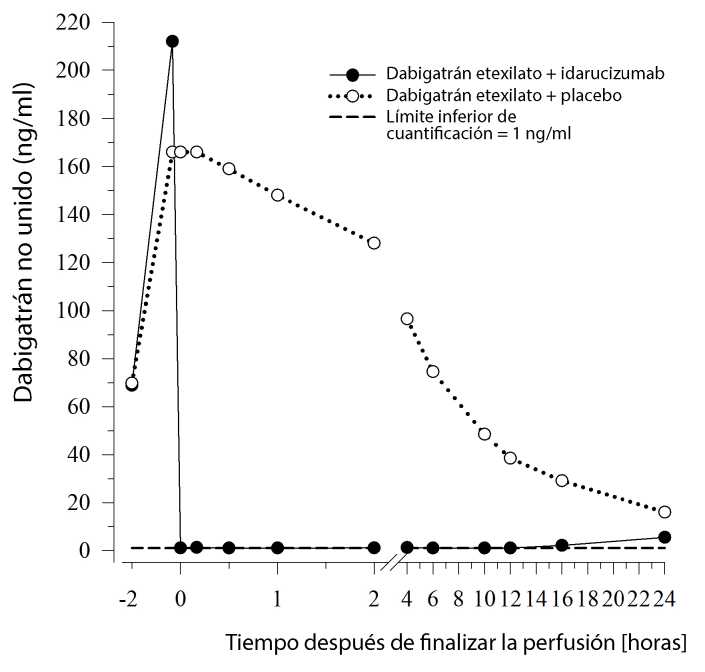
Inmediatamente después de la administración de idarucizumab, las concentraciones plasmáticas de dabigatrán libre se redujeron en más del 99%, lo que dio lugar a niveles sin actividad anticoagulante.
La mayoría de los pacientes mostró una reversión sostenida de las concentraciones plasmáticas de dabigatrán de hasta 12 horas (>90%). En un subgrupo de pacientes, se observado la recurrencia de concentraciones plasmáticas de dabigatrán libre y la elevación concomitante de las pruebas de coagulación, posiblemente debido a la redistribución de dabigatrán desde la periferia. Este hecho se produjo entre 2 y 24 horas tras la administración de idarucizumab, principalmente en tiempos >12 horas.
Figura 3: Niveles plasmáticos de dabigatrán libre en el grupo representativo de individuos sanos (administración de idarucizumab o placebo a las 0 h)
Dabigatrán prolonga el tiempo de coagulación de los marcadores de coagulación, como el tiempo de trombina diluido (TTd), el tiempo de trombina (TT), el tiempo de tromboplastina parcial activado (TTPa) y el tiempo de coagulación de ecarina (TCE), que proporcionan una indicación aproximada de la intensidad de la anticoagulación. Un valor en el rango normal después de la administración de idarucizumab indica que el paciente ya no está anticoagulado. Un valor por encima del rango normal puede reflejar la existencia de dabigatrán residual activo u otros cuadros clínicos, como la presencia de otros fármacos o una coagulopatía por transfusión. Estas pruebas se utilizaron para evaluar el efecto anticoagulante de dabigatrán. Inmediatamente después de la perfusión de idarucizumab, se observó una reversión completa y sostenida de la prolongación del tiempo de coagulación inducida por dabigatrán, que se mantuvo durante todo el periodo de observación de al menos 24 horas.
Figura 4: Reversión de la prolongación del tiempo de coagulación inducida por dabigatrán, determinado mediante el TTd en el grupo representativo de individuos sanos (administración de idarucizumab o placebo a las 0 h)
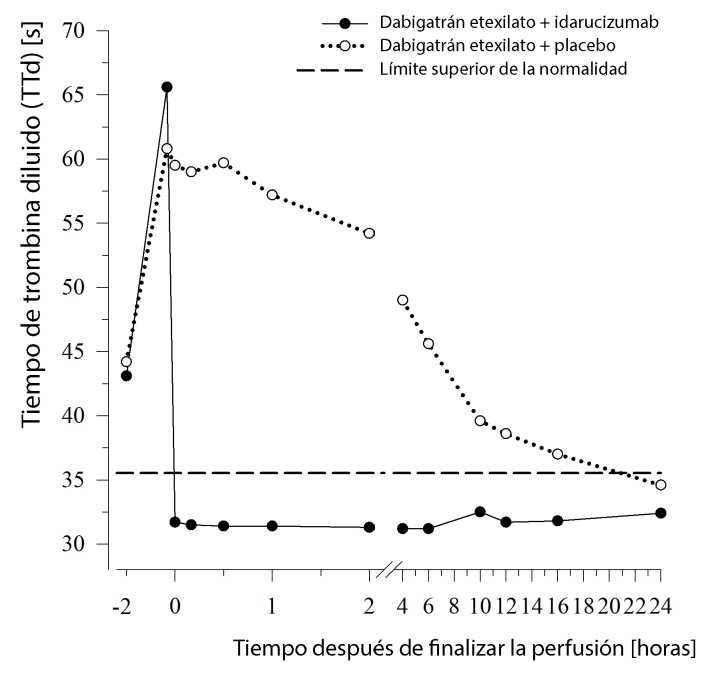
Figura 5: Reversión de la prolongación del tiempo de coagulación inducida por dabigatrán, determinado mediante el TCE en el grupo representativo de individuos sanos (administración de idarucizumab o placebo a las 0 h)
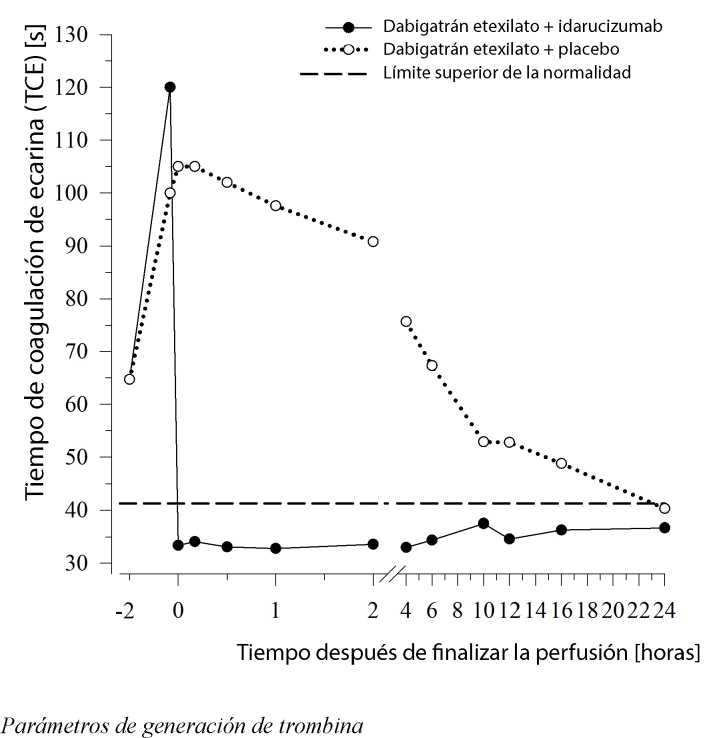
Dabigatrán ejerce efectos pronunciados sobre los parámetros del potencial endógeno de la trombina (PET). El tratamiento con idarucizumab normalizó ambos, el índice de tiempo de latencia de la trombina y el índice de tiempo hasta el valor máximo a los niveles basales, según se determinó de 0,5 a 12 horas después de finalizar la perfusión de idarucizumab. Idarucizumab solo no ha mostrado ningún efecto procoagulante medido como PET. Eso sugiere que idarucizumab no tiene efecto protrombótico.
Readministración de dabigatrán etexilato
24 horas después de la perfusión de idarucizumab, la readministración de dabigatrán etexilato dio lugar a la actividad anticoagulante esperada.
Inmunogenicidad
Se evaluaron muestras de suero de 283 individuos (224 tratados con idarucizumab) para buscar anticuerpos frente a idarucizumab antes y después del tratamiento.
Se detectaron anticuerpos preexistentes con reactividad cruzada frente a idarucizumab en aproximadamente el 13% (36/283) de los individuos. En estos individuos no se observó ningún impacto sobre la farmacocinética ni sobre el efecto de reversión de idarucizumab, ni tampoco reacciones de hipersensibilidad.
Se observaron títulos bajos de anticuerpos antiidarucizumab relacionados con el tratamiento en el 4% (9/224) de los individuos, lo que sugiere un bajo potencial inmunógeno de idarucizumab. En un subgrupo de 6 individuos, idarucizumab se administró por segunda vez, dos meses después de la primera administración. No se detectaron anticuerpos antiidarucizumab en estos individuos antes de la segunda administración. En un individuo, se detectaron anticuerpos antiidarucizumab relacionados con el tratamiento después de la segunda administración.
Farmacodinámica preclínica
Se realizó un modelo traumático en cerdos utilizando una lesión hepática contusa después de administrar dabigatrán con el fin de alcanzar concentraciones supraterapéuticas de aproximadamente 10 veces los niveles plasmáticos humanos. Idarucizumab revirtió de forma rápida y eficaz la hemorragia potencialmente mortal durante los 15 minutos siguientes a la inyección. Todos los cerdos sobrevivieron a dosis de idarucizumab de aproximadamente 2,5 y 5 g. Sin idarucizumab, la mortalidad en el grupo anticoagulado fue del 100%.
La Agencia Europea de Medicamentos ha concedido al titular un aplazamiento para presentar los resultados de los ensayos realizados con Praxbind en uno o más grupos de la población pediátrica en la prevención y el tratamiento de las hemorragias asociadas a dabigatrán (ver sección 4.2 para consultar la información sobre el uso en la población pediátrica).
5.2 Propiedades farmacocinéticas
La farmacocinética de idarucizumab se investigó en 224 individuos sanos en estudios de fase I, de los cuales se presentan datos de un subgrupo representativo de 6 individuos sanos entre 45 y 64 años de edad que recibieron una dosis de 5 g en perfusión intravenosa.
Distribución
Idarucizumab mostró una cinética de disposición multifase y una distribución extravascular limitada. Tras la perfusión intravenosa de una dosis de 5 g, la media geométrica del volumen de distribución en el estado estacionario (Vss) fue de 8,9 l (coeficiente de variación geométrica (gCV) 24,8%).
Biotransformación
Se han descrito varias vías que pueden contribuir al metabolismo de los anticuerpos. Todas estas vías implican la biodegradación del anticuerpo a moléculas más pequeñas, es decir, pequeños péptidos o aminoácidos que luego se reabsorben y se incorporan a la síntesis general de proteínas.
Eliminación
Idarucizumab se eliminó rápidamente, con un aclaramiento total de 47,0 ml/min (gCV 18,4%), una semivida inicial de 47 minutos (gCV 11,4%) y una semivida terminal de 10,3 horas (gCV 18,9%). Después de la administración intravenosa de 5 g de idarucizumab, se recuperó en la orina el 32,1% (gCV 60,0%) de la dosis, con un periodo de recogida de 6 horas, mientras que en las 18 horas siguientes se recuperó menos del 1%. Se supone que la parte restante de la dosis se elimina mediante el catabolismo de proteínas, principalmente en el riñón.
Se ha observado proteinuria tras el tratamiento con idarucizumab. La proteinuria transitoria es una reacción fisiológica a la llegada de una concentración elevada de proteínas a nivel renal tras la aplicación rápida o a corto plazo de 5 g de idarucizumab por vía intravenosa. La proteinuria transitoria suele alcanzar su máximo aproximadamente 4 horas tras la administración de idarucizumab y se normaliza entre las 12 y 24 horas. En casos individuales, la proteinuria transitoria persistió durante más de 24 horas.
Pacientes con insuficiencia renal
Se ha investigado Praxbind en estudios de fase I en individuos con un aclaramiento de creatinina comprendido entre 44 y 213 ml/min. Los individuos con un aclaramiento de creatinina inferior a 44 ml/min no se han estudiado en la fase I.
Dependiendo del grado de insuficiencia renal, el aclaramiento total se redujo en comparación con los individuos sanos, dando lugar a un aumento de la exposición de idarucizumab.
De acuerdo a los datos farmacocinéticos de 68 pacientes con diferentes grados de función renal (aclaramiento medio de creatinina entre 19,2 y 126 ml/min), se estima que la exposición media a idarucizumab (AUC0 -24h) se incrementa en un 26% en los pacientes con insuficiencia renal leve (AcCr 60-90 ml/min), en un 78% en los pacientes con insuficiencia renal moderada (30-60 ml/min) y en un 199% en los pacientes con insuficiencia renal grave (0-30 ml/min). Puesto que dabigatrán también se excreta principalmente a través de los riñones, también se observan incrementos en la exposición a dabigatrán con el empeoramiento de la función renal.
De acuerdo a estos datos y al grado de reversión del efecto anticoagulante de dabigatrán en los pacientes, la insuficiencia renal no parece tener impacto en el efecto de reversión de idarucizumab, aunque la conclusión para los pacientes con insuficiencia renal grave se ha extraído solamente a partir de un pequeño subconjunto de pacientes.
Pacientes con insuficiencia hepática
Praxbind no se ha estudiado en pacientes con insuficiencia hepática. Se sabe que los fragmentos de anticuerpos se eliminan principalmente mediante catabolismo proteolítico en el riñón. No se espera que la insuficiencia hepática afecte a la farmacocinética de idarucizumab.
Personas de edad avanzada/Sexo/Raza
Según los análisis farmacocinéticos poblacionales, ni el sexo, ni la edad ni la raza tienen un efecto clínicamente relevante sobre la farmacocinética de idarucizumab.
5.3 Datos preclínicos sobre seguridad
Los datos preclínicos no muestran riesgos especiales para los seres humanos de acuerdo a los estudios de toxicidad a dosis repetidas de hasta cuatro semanas en ratas y dos semanas en monos. Los estudios de farmacología de seguridad no han demostrado efectos sobre los sistemas respiratorio, nervioso central o cardiovascular.
No se han realizado estudios para evaluar el potencial mutágeno y carcinógeno de idarucizumab. De acuerdo a su mecanismo de acción y a las características de las proteínas, no se esperan efectos carcinógenos ni genotóxicos.
No se han realizado estudios para evaluar los potenciales efectos de idarucizumab sobre la reproducción. No se han identificado efectos relacionados con el tratamiento en tejidos reproductores de cualquier sexo durante los estudios de toxicidad intravenosa a dosis repetidas de hasta cuatro semanas en ratas y dos semanas en monos. Además, no se observó ninguna unión de idarucizumab a tejidos reproductores humanos en un estudio de reactividad cruzada en tejidos. Por tanto, los resultados preclínicos no sugieren que exista riesgo para la fertilidad o el desarrollo embriofetal.
No se observaron irritaciones locales de los vasos sanguíneos después de la administración intravenosa o paravenosa de idarucizumab. La formulación de idarucizumab no produjo hemólisis de sangre completa humana in vitro.
DATOS FARMACÉUTICOS
6.
6.1 Lista de excipientes
acetato de sodio trihidrato ácido acético sorbitol polisorbato 20
agua para preparaciones inyectables
6.2 Incompatibilidades
Este medicamento no debe mezclarse con otros medicamentos.
6.3 Periodo de validez
30 meses.
Tras la apertura del vial, se ha demostrado la estabilidad química y física en uso de idarucizumab durante 1 hora a temperatura ambiente.
Desde un punto de vista microbiológico, a menos que el método de apertura excluya el riesgo de contaminación microbiana, el producto se debe utilizar inmediatamente después de abrirlo. Si no se utiliza de inmediato, los tiempos de almacenamiento en uso y las condiciones previas al uso son responsabilidad del usuario.
6.4 Precauciones especiales de conservación
Conservar en nevera (entre 2 °C y 8 °C).
No congelar.
Conservar en el embalaje original para protegerlo de la luz.
Antes de su uso, el vial puede mantenerse a temperatura ambiente (25 °C) durante hasta 48 horas, si se conserva en el embalaje original para protegerlo de la luz, o durante 6 horas, si está expuesto a la luz.
Para las condiciones de conservación tras la apertura del medicamento, ver sección 6.3.
6.5 Naturaleza y contenido del envase
50 ml de solución en un vial de vidrio (vidrio tipo I), con un tapón de goma butílica, una cápsula de aluminio y una etiqueta con un colgador integrado.
Tamaño del envase de 2 viales.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Antes de su administración, los medicamentos parenterales como Praxbind se deben someter a una inspección visual para ver si presentan partículas o decoloración.
Praxbind no se debe mezclar con otros medicamentos. Para la administración de Praxbind se puede utilizar una vía intravenosa preexistente. Dicha vía debe aclararse con una solución inyectable de 9 mg/ml de cloruro sódico (0,9%) antes y al final de la perfusión. No se debe administrar ninguna otra perfusión en paralelo a través del mismo acceso intravenoso.
Praxbind es para un solo uso y no contiene conservantes (ver sección 6.3).
No se han observado incompatibilidades entre Praxbind y equipos de perfusión de cloruro de polivinilo, polietileno o poliuretano, ni tampoco con jeringas de polipropileno.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Boehringer Ingelheim International GmbH Binger Str. 173 D-55216 Ingelheim am Rhein Alemania
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/15/1056/001
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 20 de noviembre de 2015
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
A. FABRICANTE DEL PRINCIPIO ACTIVO BIOLÓGICO Y FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
A. FABRICANTE DEL PRINCIPIO ACTIVO BIOLÓGICO Y FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección del fabricante del principio activo biológico
Boehringer Ingelheim Pharma GmbH & Co. KG Birkendorfer StraBe 65 88397 Biberach an der Riss ALEMANIA
Nombre y dirección del fabricante responsable de la liberación de los lotes
Boehringer Ingelheim Pharma GmbH & Co. KG Birkendorfer StraBe 65 88397 Biberach an der Riss ALEMANIA
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica restringida (ver Anexo I: Ficha Técnica o Resumen de las Características del Producto, sección 4.2).
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
Los requerimientos para la presentación de los informes periódicos de seguridad para este medicamento se establecen en la lista de fechas de referencia de la Unión (lista EURD) prevista en el artículo 107quater, apartado 7, de la Directiva 2001/83/CE y publicada en el portal web europeo sobre medicamentos.
El Titular de la Autorización de Comercialización (TAC) presentará el primer informe periódico de seguridad para este medicamento en un plazo de 6 meses después de la autorización.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado
en la versión del PGR incluido en el Módulo 1.8.2 de la Autorización de Comercialización y en
cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos.
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR ESTUCHE
1. NOMBRE DEL MEDICAMENTO
Praxbind 2,5 g/50 ml solución inyectable y para perfusión Idarucizumab
2. PRINCIPIO(S) ACTIVO(S)
Cada vial de 50 ml contiene 2,5 g de idarucizumab.
3. LISTA DE EXCIPIENTES
Excipientes: acetato de sodio trihidrato, ácido acético, sorbitol, polisorbato 20 y agua para preparaciones inyectables.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
solución inyectable y para perfusión 2 viales de 50 ml cada uno
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Vía intravenosa.
Leer el prospecto antes de utilizar este medicamento.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
Para un solo uso.
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Conservar en nevera. No congelar.
Conservar en el embalaje original para protegerlo de la luz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Boehringer Ingelheim International GmbH Binger Str. 173 D-55216 Ingelheim am Rhein Alemania
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/15/1056/001
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN_
15. INSTRUCCIONES DE USO_
16. INFORMACIÓN EN BRAILLE_
Se acepta la justificación para no incluir la información en Braille.
17. OTROS: impresión en el interior de la tapa_
• El prospecto adjunto contiene información adicional para los profesionales sanitarios
• La dosis recomendada de Praxbind es de 5 g (2 x 2,5 g/50 ml)
• Administración por vía intravenosa en dos perfusiones consecutivas de entre 5 y 10 minutos cada una o en inyecciones rápidas (bolo)
INFORMACIÓN QUE DEBE FIGURAR EN EL ACONDICIONAMIENTO PRIMARIO Etiqueta del vial
1. NOMBRE DEL MEDICAMENTO
Praxbind 2,5 g/50 ml solución inyectable y para perfusión Idarucizumab
|
2. PRINCIPIO(S) ACTIVO(S) | |
|
Cada vial de 50 ml contiene 2,5 g de idarucizumab. | |
|
3. LISTA DE EXCIPIENTES | |
Excipientes: acetato de sodio trihidrato, ácido acético, sorbitol, polisorbato 20 y agua para preparaciones inyectables.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
2 viales de 50 ml de solución inyectable y para perfusión cada uno
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Vía intravenosa.
Leer el prospecto antes de utilizar este medicamento
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
Para un solo uso.
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Conservar en nevera. No congelar.
Conservar en el embalaje original para protegerlo de la luz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Boehringer Ingelheim International GmbH Binger Str. 173 D55216 Ingelheim am Rhein Alemania
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/15/1056/001
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
MEDICAMENTO SUJETO A PRESCRIPCIÓN MÉDICA.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Se acepta la justificación para no incluir la información en Braille
B. PROSPECTO
Prospecto: información para el paciente y usuario
Praxbind 2,5 g/50 ml solución inyectable y para perfusión
idarucizumab
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Puede contribuir comunicando los efectos adversos que pudiera usted tener. La parte final de la sección 4 incluye información sobre cómo comunicar estos efectos adversos.
Lea todo el prospecto detenidamente, porque contiene información importante para usted. Tenga en cuenta que este medicamento se utiliza principalmente en situaciones de urgencia en las que su médico ha decidido que lo necesita.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o enfermero.
- Si experimenta efectos adversos, consulte a su médico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es Praxbind y para qué se utiliza
2. Qué necesita saber antes de empezar a recibir Praxbind
3. Cómo usar Praxbind
4. Posibles efectos adversos
5. Conservación de Praxbind
6. Contenido del envase e información adicional
1. Qué es Praxbind y para qué se utiliza Qué es Praxbind
Praxbind es un agente de reversión específico para dabigatrán (Pradaxa), un medicamento que diluye la sangre y bloquea una sustancia del cuerpo que interviene en la formación de coágulos de sangre. Praxbind se utiliza para capturar rápidamente dabigatrán con el fin de anular su efecto.
Praxbind contiene el principio activo idarucizumab.
Para qué se utiliza Praxbind
Praxbind se utiliza en adultos en situaciones de urgencia cuando su médico decide que es necesario anular rápidamente el efecto de Pradaxa.
- Para intervenciones quirúrgicas de urgencia o procedimientos urgentes.
- En el caso de hemorragias potencialmente mortales o no controladas.
2. Qué necesita saber cuando reciba Praxbind Advertencias y precauciones
Informe a su médico o enfermero
- si es alérgico a idarucizumab o a alguno de los demás componentes incluidos en la sección 6.
- si tiene una enfermedad genética llamada intolerancia hereditaria a la fructosa. En este caso, la sustancia sorbitol contenida en este medicamento puede provocar reacciones adversas graves.
Estos profesionales tendrán en cuenta estos factores antes de tratarle con Praxbind.
Este medicamento solo elimina dabigatrán de su cuerpo. No elimina otros medicamentos utilizados para evitar la formación de coágulos de la sangre.
Después de que dabigatrán se haya eliminado de su cuerpo, no está protegido frente a la formación de coágulos de sangre. Su médico seguirá tratándole con medicamentos utilizados para evitar la formación de coágulos de la sangre tan pronto como su situación médica lo permita.
Niños y adolescentes
No existe información sobre el uso de Praxbind en niños.
Uso de Praxbind con otros medicamentos
Informe a su médico o farmacéutico si está tomando, ha tomado recientemente o pudiera tener que tomar cualquier otro medicamento.
Este medicamento se ha desarrollado para unirse solo a dabigatrán. Es improbable que Praxbind interfiera con el efecto de otros medicamentos, o que otros medicamentos interfieran con Praxbind.
Embarazo y lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico.
No existe información sobre los efectos de este medicamento en mujeres embarazadas o en periodo de lactancia. Praxbind no afecta a ninguna función en el organismo como tal, por lo que puede que su médico decida administrarle este medicamento, si los beneficios esperados superan los riesgos potenciales.
Praxbind contiene sodio
Este medicamento contiene 50 mg de sodio por dosis, lo que debe ser tenido en cuenta en los pacientes con dietas pobres en sodio.
3. Cómo usar Praxbind
Este medicamento es únicamente para uso hospitalario.
La dosis recomendada es de 5 g (2 viales de 50 ml).
En casos raros, puede seguir teniendo demasiado dabigatrán en su sangre tras una primera dosis de Praxbind y su médico puede decidir administrarle una segunda dosis de 5 g en situaciones específicas.
Su médico o enfermero le administrarán este medicamento mediante inyección o perfusión en una vena.
Después de recibir Praxbind, su médico decidirá si debe continuar con el tratamiento para evitar la formación de coágulos en la sangre. Pradaxa puede administrarse de nuevo a las 24 horas después de la administración de Praxbind.
Al final de este prospecto se incluyen instrucciones detalladas para el médico o el enfermero sobre cómo administrar Praxbind (ver "Instrucciones de manipulación").
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Hasta ahora, no se han identificado efectos adversos.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Praxbind
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en el vial y en la caja después de “CAD”. La fecha de caducidad es el último día del mes que se indica.
Conservar en nevera (entre 2 °C y 8 °C).
No congelar.
Conservar en el embalaje original para protegerlo de la luz.
Una vez abierto, Praxbind es para uso inmediato.
6. Contenido del envase e información adicional
Composición de Praxbind
- El principio activo es idarucizumab.
- Los demás componentes son acetato de sodio trihidrato, ácido acético, sorbitol, polisorbato 20 y agua para preparaciones inyectables.
Aspecto del producto y contenido del envase
Praxbind solución inyectable y para perfusión es una solución de transparente a ligeramente opalescente y de incolora a ligeramente amarilla que se suministra en un vial de vidrio cerrado con un tapón de goma butílica y una cápsula de aluminio.
Cada envase contiene dos viales.
Titular de la autorización de comercialización
Boehringer Ingelheim International GmbH Binger Str. 173 D-55216 Ingelheim am Rhein Alemania
Responsable de la fabricación
Boehringer Ingelheim Pharma GmbH & Co. KG Birkendorfer Strasse 65 D-88397 Biberach an der Riss Alemania
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
|
Belgie/Belgique/Belgien SCS Boehringer Ingelheim Comm.V Tél/Tel: +32 2 773 33 11 |
Lietuva Boehringer Ingelheim RCV GmbH & Co KG Lietuvos filialas Tel: +370 37 473922 |
|
Etarapna Eboprarep HHreaxaHM P^B Tm6X h Ko. Kr - KaoH Ebarapna Tea: +359 2 958 79 98 |
Luxembourg/Luxemburg SCS Boehringer Ingelheim Comm.V Tél/Tel: +32 2 773 33 11 |
|
Ceská republika Boehringer Ingelheim spol. s r.o. Tel: +420 234 655 111 |
Magyarország Boehringer Ingelheim RCV GmbH & Co KG Magyarországi Fióktelepe Tel: +36 1 299 8900 |
|
Danmark Boehringer Ingelheim Danmark A/S Tlf: +45 39 15 88 88 |
Malta Boehringer Ingelheim Ltd. Tel: +44 1344 424 600 |
|
Deutschland Boehringer Ingelheim Pharma GmbH & Co. KG Tel: +49 (0) 800 77 90 900 |
Nederland Boehringer Ingelheim b.v. Tel: +31 (0) 800 22 55 889 |
|
Eesti Boehringer Ingelheim RCV GmbH & Co KG Eesti filiaal Tel: +372 612 8000 |
Norge Boehringer Ingelheim Norway KS Tlf: +47 66 76 13 00 |
|
EXXáSa Boehringer Ingelheim Ellas A.E. T^: +30 2 10 89 06 300 |
Osterreich Boehringer Ingelheim RCV GmbH & Co KG Tel: +43 1 80 105-0 |
|
España Boehringer Ingelheim España, S.A. Tel: +34 93 404 51 00 |
Polska Boehringer Ingelheim Sp.zo.o. Tel: +48 22 699 0 699 |
|
France Boehringer Ingelheim France S.A.S. Tél: +33 3 26 50 45 33 |
Portugal Boehringer Ingelheim, Unipessoal, Lda. Tel: +351 21 313 53 00 |
|
Hrvatska Boehringer Ingelheim Zagreb d.o.o. Tel: +385 1 2444 600 |
Romania Boehringer Ingelheim RCV GmbH & Co KG Viena-Sucursala Bucuresti Tel: +40 21 302 2800 |
|
Ireland Boehringer Ingelheim Ireland Ltd. Tel: +353 1 295 9620 |
Slovenija Boehringer Ingelheim RCV GmbH & Co KG Podruznica Ljubljana Tel: +386 1 586 40 00 |
|
Ísland Vistor hf. Sími: +354 535 7000 |
Slovenská republika Boehringer Ingelheim RCV GmbH & Co KG organizacná zlozka Tel: +421 2 5810 1211 |
Sverige
Boehringer Ingelheim AB
Tel: +46 8 721 21 00
Puh/Tel: +358 10 3102 800
Kúnpoq
Boehringer Ingelheim Ellas A.E. T^: +30 2 10 89 06 300
Latvija United Kingdom
Boehringer Ingelheim RCV GmbH & Co KG Boehringer Ingelheim Ltd. Latvijas filíale Tel: +44 1344 424 600
Tel: +371 67 240 011
Fecha de la última revisión de este prospecto: MM/AAAA.
Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
Esta información está destinada únicamente a profesionales sanitarios:
Praxbind se une de forma específica a dabigatrán y revierte su efecto anticoagulante. No revierte los efectos de otros anticoagulantes.
El tratamiento con Praxbind se puede utilizar en combinación con otras medidas estándar de soporte, si se considera que estas son médicamente apropiadas.
La dosis recomendada de Praxbind contiene 4 g de sorbitol como excipiente. En pacientes con intolerancia hereditaria a la fructosa, existe el riesgo de reacciones adversas graves, que se debe valorar frente al beneficio de un tratamiento de urgencia con Praxbind. Si se administra Praxbind en estos pacientes, se requiere intensificar la asistencia médica durante la exposición a Praxbind y dentro de las 24 horas tras la exposición al mismo.
Posología y forma de administración:
La dosis recomendada de Praxbind es de 5 g (2 x 2,5 g/50 ml)
Se puede considerar la administración de una segunda dosis de 5 g de Praxbind en las siguientes situaciones:
• recurrencia de sangrado clínicamente relevante junto con tiempos de coagulación prolongados,o
• si un posible nuevo sangrado fuese potencialmente mortal y se observa la prolongación de los tiempos de coagulación, o
• los pacientes necesitan una segunda intervención quirúrgica de urgencia o procedimiento urgente y presentan prolongación de los tiempos de coagulación.
Los principales parámetros de la coagulación son el tiempo de tromboplastina parcial activado (TTPa), el tiempo de trombina diluido (TTd) o el tiempo de coagulación de ecarina (TCE).
No se ha investigado una dosis máxima diaria.
Praxbind (2 x 2,5 g/50 ml) se administra por vía intravenosa en dos perfusiones consecutivas de entre 5 y 10 minutos cada una o en una inyección rápida.
Los pacientes que estén recibiendo tratamiento con dabigatrán presentan enfermedades subyacentes que les predisponen a los acontecimientos tromboembólicos. La reversión del tratamiento con dabigatrán expone a los pacientes al riesgo trombótico derivado de su enfermedad o afección subyacentes. Para reducir este riesgo, se debe considerar la reanudación del tratamiento anticoagulante tan pronto como sea médicamente apropiado.
El tratamiento con Pradaxa (dabigatrán etexilato) puede reiniciarse a las 24 horas después de la administración de Praxbind, siempre y cuando el paciente se encuentre clínicamente estable y se haya alcanzado una hemostasia adecuada.
Tras la administración de Praxbind, es posible iniciar otro tratamiento antitrombótico (por ejemplo, con heparina de bajo peso molecular) en cualquier momento, siempre y cuando el paciente se encuentre clínicamente estable y se haya alcanzado una hemostasia adecuada.
Instrucciones de manipulación:
Praxbind no se debe mezclar con otros medicamentos. Para la administración de Praxbind se puede utilizar una vía intravenosa preexistente. Dicha vía debe aclararse con una solución inyectable de 9 mg/ml de cloruro sódico (0,9%) antes y al final de la perfusión. No se debe administrar ninguna otra perfusión en paralelo a través del mismo acceso intravenoso.
Praxbind es para un solo uso y no contiene conservantes.
Antes de su uso, el vial puede mantenerse a temperatura ambiente (25 °C) durante hasta 48 horas, si se conserva en el embalaje original para protegerlo de la luz, o durante 6 horas, si está expuesto a la luz. Tras la apertura del vial, se ha demostrado la estabilidad química y física en uso de idarucizumab durante1 hora a temperatura ambiente.
Desde un punto de vista microbiológico, a menos que el método de apertura excluya el riesgo de contaminación microbiana, el medicamento se debe utilizar inmediatamente después de abrirlo. Si no se utiliza de inmediato, los tiempos de almacenamiento en uso y las condiciones previas al uso son responsabilidad del usuario.
No se han observado incompatibilidades entre Praxbind y equipos de perfusión de cloruro de polivinilo, polietileno o poliuretano, ni tampoco con jeringas de polipropileno.
32