Picato 150 Microgramos/Gramo Gel
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
▼ Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas. Ver la sección 4.8, en la que se incluye información sobre cómo notificarlas.
1. NOMBRE DEL MEDICAMENTO
Picato 150 microgramos/gramo gel
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada gramo de gel contiene 150 ^g de ingenol mebutato. Cada tubo contiene 70 ^g de ingenol mebutato en 0,47 g de gel.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Gel.
Gel transparente incoloro.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Picato está indicado para el tratamiento cutáneo de la queratosis actínica no hiperqueratósica y no hipertrófica en adultos.
4.2 Posología y forma de administración
Posología
Queratosis actínica en la cara y el cuero cabelludo en adultos
Un tubo de Picato 150 (ig/g gel (que contiene 70 ^g de ingenol mebutato) debe aplicarse una vez al día en el área afectada durante 3 días consecutivos.
Población pediátrica
No existe una recomendación de uso específica para Picato en la población pediátrica.
Población de edad avanzada
No se requiere ajuste de dosis (ver sección 5.1).
Forma de administración
El contenido de un tubo es el suficiente para un área de tratamiento de 25 cm2 (p. ej. 5 cm x 5 cm). El contenido del tubo debe aplicarse en un área de tratamiento de 25 cm2. El tubo es para un solo uso y debe desecharse tras su uso (ver sección 6.6).
El gel del tubo debe vaciarse sobre la yema de un dedo y extenderse uniformemente sobre toda el área de tratamiento, dejándolo secar durante 15 minutos. El contenido de un tubo debe emplearse para un área de tratamiento de 25 cm2.
Para un solo uso.
Para el tratamiento del cuello: Si más de la mitad del área de tratamiento está localizada en la parte superior del cuello, debe emplearse la posología para la cara y el cuero cabelludo. Si más de la mitad del área de tratamiento está localizada en la parte inferior del cuello, debe emplearse la posología para el tronco y las extremidades.
Si se trata simultáneamente un área de la cara o el cuero cabelludo y otra área del tronco o las extremidades, entonces los pacientes deben ser informados para garantizar que emplean las dosis adecuadas. Se debe tener cuidado de no aplicar el gel de 500 ^g/g en la cara o el cuero cabelludo puesto que esto podría conllevar a una mayor incidencia de respuestas cutáneas locales.
Se debe advertir a los pacientes que es necesario que se laven las manos con agua y jabón, inmediatamente después de la aplicación de Picato y entre aplicaciones tópicas si dos áreas distintas requieren dosis diferentes. Si la zona tratada son las manos, únicamente debe lavarse la yema del dedo que se utilice para aplicar el gel.
Se debe evitar el lavado y el contacto con el área tratada durante un periodo de 6 horas tras la aplicación de Picato. Tras este periodo, el área tratada puede lavarse utilizando agua y un jabón suave.
Picato no debe aplicarse inmediatamente después de ducharse ni en las 2 horas previas a acostarse.
El área tratada no debe cubrirse con vendajes oclusivos después de la aplicación de Picato.
El efecto terapéutico óptimo puede evaluarse aproximadamente 8 semanas después del tratamiento.
Se puede dar un ciclo de tratamiento repetido con Picato si se observa una respuesta incompleta en la visita de seguimiento a las 8 semanas o si las lesiones que han blanqueado en esta visita recurren en visitas posteriores.
No se dispone de datos clínicos sobre el tratamiento de pacientes inmunodeprimidos, pero no son de esperar riesgos sistémicos puesto que ingenol mebutato no se absorbe a nivel sistémico.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo Exposición ocular
El contacto con los ojos puede producir conjuntivitis química y quemaduras corneales. Los pacientes deben lavarse las manos cuidadosamente tras la aplicación del gel y después de cualquier contacto con el área tratada, para evitar la transferencia involuntaria del gel a los ojos. En caso de contacto accidental, los ojos deben lavarse inmediatamente con abundante agua y el paciente debe recibir atención médica tan pronto como sea posible. Pueden aparecer alteraciones oculares tales como dolor en el ojo, edema palpebral y edema periorbitario, tras la exposición ocular accidental a Picato (ver sección 4.8).
Ingestión
Picato no debe ser ingerido. En caso de ingestión accidental, el paciente debe beber abundante agua y solicitar atención médica.
General
No se recomienda la administración de Picato hasta que la piel se haya recuperado de cualquier tratamiento previo con medicamentos o quirúrgico y no debe aplicarse en heridas abiertas o piel lesionada en la que la barrera cutánea está alterada.
Picato no debe emplearse cerca de los ojos, en el interior de las fosas nasales, en el interior de los oídos ni en los labios.
Respuestas cutáneas locales
Puede esperarse que se produzcan respuestas cutáneas locales como eritema, descamación/formación de escamas y costras tras la aplicación cutánea de Picato (ver sección 4.8). Las respuestas cutáneas localizadas son transitorias y habitualmente se producen durante el primer día de tratamiento alcanzando su máxima intensidad hasta 1 semana después de la finalización del mismo. Las respuestas cutáneas localizadas habitualmente se resuelven durante las 2 semanas siguientes al inicio del tratamiento, cuando se tratan áreas de la cara y cuero cabelludo, y durante las 4 semanas siguientes al inicio del tratamiento, cuando se tratan áreas del tronco y extremidades. Es posible que el efecto del tratamiento no pueda evaluarse adecuadamente hasta la resolución de las respuestas cutáneas locales.
Exposición solar
Se han llevado a cabo estudios para evaluar los efectos de la irradiación UV de la piel tras la aplicación única o repetida de ingenol mebutato gel, 100 pg/g. Ingenol mebutato gel no mostró ningún potencial para producir efectos fotoalérgicos o fotoirritantes. Sin embargo, debido a la naturaleza de la enfermedad, debe evitarse o minimizarse la exposición excesiva a la luz solar (incluyendo lámparas de sol artificial y cabinas de bronceado).
Manejo de la queratosis actínica
Las lesiones clínicamente atípicas de queratosis actínica o sospechosas de malignización deben biopsiarse para determinar el tratamiento apropiado.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios de interacciones. Las interacciones con medicamentos que se absorben sistémicamente se consideran poco probables puesto que Picato no se absorbe a nivel sistémico.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No hay datos relativos al uso de ingenol mebutato en mujeres embarazadas. Los estudios realizados en animales mostraron escasa toxicidad embriofetal (ver sección 5.3). El riesgo en humanos que reciben tratamiento cutáneo con ingenol mebutato se considera improbable puesto que Picato no se absorbe a nivel sistémico. Como medida de precaución, es preferible evitar el uso de Picato durante el embarazo.
Lactancia
No se prevén efectos en niños/recién nacidos lactantes puesto que Picato no se absorbe a nivel sistémico. Se debe advertir a la madre en período de lactancia que debe evitarse el contacto físico entre su niño/recién nacido y el área tratada durante un periodo de 6 horas tras la aplicación de Picato.
Fertilidad
No se han realizado estudios de fertilidad con ingenol mebutato.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de Picato sobre la capacidad para conducir y utilizar máquinas es nula o insignificante.
4.8 Reacciones adversas Resumen del perfil de seguridad
Las reacciones adversas notificadas con mayor frecuencia son respuestas cutáneas locales incluyendo eritema, descamación/formación de escamas, costras, hinchazón, vesículas/pústulas y erosión/ulceración en el lugar de aplicación de ingenol mebutato gel, ver tabla 1 para terminología MedDRA. Tras la aplicación de ingenol mebutato, la mayoría de pacientes (>95%) experimentó una o diversas respuestas cutáneas locales. Se ha notificado infección en el lugar de aplicación cuando se trata la cara y el cuero cabelludo.
Tabla de reacciones adversas
La tabla 1 refleja la exposición a Picato 150 ^g/g o 500 (ig/g de 499 pacientes con queratosis actínica, tratados en cuatro estudios fase 3 controlados frente a vehículo, en los que se incluyeron un total de 1.002 pacientes. Los pacientes recibieron tratamiento de campo (área de 25 cm2) con Picato a concentraciones de 150 ^g/g o 500 ^g/g o vehículo una vez al día durante 3 ó 2 días consecutivos, respectivamente.
La tabla que aparece a continuación recoge las reacciones adversas según la clasificación de órganos del sistema MedDRA y su localización anatómica.
Las frecuencias se han definido según la siguiente convención:
Muy frecuentes (>1/10); frecuentes (>1/100 a <1/10); poco frecuentes (>1/1.000 a <1/100); raras (>1/10.000 a <1/1.000); muy raras (<1/10.000) y de frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
Dentro de cada grupo de frecuencia, las reacciones adversas se enumeran en orden decreciente de gravedad.
|
Tabla 1 Reacciones adversas según Clasificación de Órganos del Sistema MedDRA | ||
|
Frecuencia | ||
|
Sistema de clasificación de órganos |
Cara y cuero cabelludo |
Tronco y extremidades |
|
Infecciones e infestaciones | ||
|
Pústulas en el lugar de aplicación |
Muy frecuentes |
Muy frecuentes |
|
Infección en el lugar de aplicación |
Frecuentes | |
|
Trastornos del sistema inmunológico | ||
|
Hipersensibilidad (incluyendo angioedema) |
Poco frecuentes |
Poco frecuentes |
|
Trastornos del sistema nervioso | ||
|
Cefalea |
Frecuentes | |
|
Trastornos oculares* | ||
|
Edema palpebral |
Frecuentes | |
|
Edema periorbitario |
Frecuentes | |
|
Conjuntivitis química, quemadura corneal** |
Poco frecuentes |
Poco frecuentes |
|
Dolor ocular |
Poco frecuentes | |
|
Trastornos generales y alteraciones en el lugar de administración | ||
|
Erosión en el lugar de aplicación |
Muy frecuentes |
Muy frecuentes |
|
Vesículas en el lugar de aplicación |
Muy frecuentes |
Muy frecuentes |
|
Hinchazón en el lugar de aplicación |
Muy frecuentes |
Muy frecuentes |
|
Exfoliación en el lugar de aplicación |
Muy frecuentes |
Muy frecuentes |
|
Costra en el lugar de aplicación |
Muy frecuentes |
Muy frecuentes |
|
Eritema en el lugar de aplicación |
Muy frecuentes |
Muy frecuentes |
|
Dolor en el lugar de aplicación*** |
Muy frecuentes |
Frecuentes |
|
Prurito en el lugar de aplicación |
Frecuentes |
Frecuentes |
|
Irritación en el lugar de aplicación |
Frecuentes |
Frecuentes |
|
Secreción en el lugar de aplicación |
Poco frecuentes | |
|
Parestesia en el lugar de aplicación |
Poco frecuentes |
Poco frecuentes |
|
Úlcera en el lugar de aplicación |
Poco frecuentes |
Poco frecuentes |
|
Cambios de la pigmentación en el lugar de aplicación |
Poco frecuentes |
Poco frecuentes |
|
Calor en el lugar de aplicación |
Poco frecuentes |
*: La hinchazón en el lugar de aplicación, cuando se aplica en la cara o en el cuero cabelludo, puede alcanzar la zona ocular
**: Exposición ocular accidental: Se han recibido informes post-comercialización de conjuntivitis química y quemadura corneal relacionadas con la exposición ocular accidental (ver las secciones 4.2 y 4.4 para la prevención de la exposición ocular)
***: Incluyendo sensación de quemazón en el lugar de aplicación.
Descripción de las reacciones adversas seleccionadas
Las incidencias de las respuestas cutáneas locales que se produjeron con una incidencia >1% en la ‘cara/cuero cabelludo’ y en el ‘tronco/extremidades’, respectivamente, son: eritema en el lugar de aplicación (94% y 92%), exfoliación en el lugar de aplicación (85% y 90%), costra en el lugar de aplicación (80% y 74%), hinchazón en el lugar de aplicación (79% y 64%), vesículas en el lugar de aplicación (13% y 20%), pústulas en el lugar de aplicación (43% y 23%) y erosión en el lugar de aplicación (31% y 25%).
Las respuestas cutáneas locales graves se produjeron con una incidencia del 29% en la cara y el cuero cabelludo y con una incidencia del 17% en el tronco y las extremidades. Las incidencias de las respuestas cutáneas locales graves que se produjeron con una incidencia >1% en la ‘cara/cuero cabelludo’ y en el ‘tronco/extremidades’, respectivamente, son: eritema en el lugar de aplicación (24% y 15%), exfoliación en el lugar de aplicación (9% y 8%), costra en el lugar de aplicación (6% y 4%), hinchazón en el lugar de aplicación (5% y 3%) y pústulas en el lugar de aplicación (5% y 1%).
Seguimiento a largo plazo
A un total de 198 pacientes con aclaramiento completo en el día 57 (184 tratados con Picato y 14 tratados con vehículo) se les realizó un seguimiento adicional durante 12 meses. En otro estudio, 329 pacientes que fueron tratados inicialmente con crioterapia en la cara/cuero cabelludo, fueron randomizados a las tres semanas a Picato 150 ^g/g (n=158) o vehículo (n=150) durante 3 días en la misma área. Se hizo un seguimiento durante 12 meses de 149 pacientes del grupo tratado con Picato y de 140 del grupo que recibió vehículo. En un estudio posterior 450 pacientes fueron tratados inicialmente con Picato 150 ^g/g, de éstos 134 pacientes fueron randomizados a un segundo ciclo de tratamiento con Picato 150 ^g/g y se hizo un seguimiento de los pacientes durante 12 meses tras el primer tratamiento.
Estos resultados no modificaron el perfil de seguridad de Picato (ver sección 5.1).
Notificación de sospechas de reacciones adversas
Es importante notificar las sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Apéndice V.
4.9 Sobredosis
La sobredosis de Picato puede dar lugar a una mayor incidencia de respuestas cutáneas locales. El manejo de la sobredosis debe consistir en el tratamiento de los síntomas clínicos.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Antibióticos y quimioterápicos para uso dermatológico, otros quimioterápicos, código ATC: D06BX02.
Mecanismo de acción
El mecanismo de acción de ingenol mebutato para uso en queratosis actínica no ha sido totalmente caracterizado. Modelos in vitro e in vivo han mostrado un mecanismo de acción dual para los efectos de ingenol mebutato: 1) inducción de la muerte celular en la lesión local y 2) promoción de una respuesta inflamatoria caracterizada por producción local de citoquinas y quimioquinas proinflamatorias e infiltración de células inmunocompetentes.
Efectos farmacodinámicos
Los resultados obtenidos en dos estudios clínicos sobre los efectos biológicos de ingenol mebutato han mostrado que la administración tópica inducía necrosis epidérmica y una respuesta inflamatoria intensa tanto en la epidermis como en la dermis superior de la piel tratada, con predominio de células T infiltrantes, neutrófilos y macrófagos. La necrosis en la dermis se observó raramente.
Los perfiles de expresión genética de las biopsias de piel obtenida de las áreas tratadas sugieren una respuesta inflamatoria y respuesta a la lesión, lo que es consistente con las evaluaciones histológicas. El examen no invasivo de la piel tratada realizado mediante microscopia confocal de reflectancia ha mostrado que los cambios de la piel inducidos por ingenol mebutato son reversibles, con una normalización casi completa de todos los parámetros determinados en el día 57 tras el tratamiento, lo que también está avalado por los hallazgos clínicos y los estudios en animales.
Eficacia clínica y seguridad
La eficacia y seguridad de Picato 150 ^g/g, aplicado en la cara o el cuero cabelludo durante 3 días consecutivos, se estudió en dos ensayos clínicos doble ciego controlados con vehículo, que incluyeron 547 pacientes adultos. Así mismo, se estudió la eficacia y seguridad de Picato 500 ^g/g, aplicado en tronco y extremidades durante 2 días consecutivos, en dos ensayos clínicos doble ciego controlados con vehículo, que incluyeron 458 pacientes adultos. Los pacientes continuaron en los estudios durante un periodo de seguimiento de 8 semanas durante el cual regresaron para ser evaluados clínicamente y monitorizados desde el punto de vista de seguridad. La eficacia, determinada como tasa de aclaramiento parcial y completo, así como la mediana del porcentaje de reducción, fue evaluada en el día 57 (ver tabla 2).
Los pacientes presentaban de 4 a 8 lesiones de queratosis actínica clínicamente típicas, visibles, diferenciadas, no hiperqueratósicas y no hipertróficas, en un área de tratamiento contigua de 25 cm2 en la cara o el cuero cabelludo o en el tronco o las extremidades. En los días programados de tratamiento, se aplicó el gel en estudio en toda el área de tratamiento.
La tasa de cumplimiento fue alta, completando estos estudios el 98% de los pacientes.
La edad de los pacientes incluidos en los estudios estaba comprendida entre los 34 y los 89 años (media de 64 y 66 años, respectivamente, para las dos concentraciones) y el 94% tenía piel tipo I, II o III según la escala de Fitzpatrick.
En el día 57, los pacientes tratados con Picato tuvieron tasas de aclaramiento parcial y completo superiores a las de los pacientes tratados con el vehículo del gel (p<0,001). La mediana del porcentaje de reducción de lesiones de queratosis actínica fue superior en el grupo tratado con ingenol mebutato comparado con el grupo que recibió vehículo (ver tabla 2).
|
Tabla 2 Tasa de sujetos con aclaramiento parcial y completo y mediana del porcentaje (%) de reducción de lesiones de queratosis actínica | ||||
|
Cara y cuero cabelludo |
Tronco y extremidades | |||
|
Picato 150 ^g/g (n=277) |
Vehículo (n=270) |
Picato 500 ^g/g (n=226) |
Vehículo (n=232) | |
|
Tasa Aclaramiento Completo3 |
42,2% d |
3,7% |
34,1% d |
4,7% |
|
Tasa Aclaramiento Parcialb (> 75%) |
63,9% d |
7,4% |
49,1% d |
6,9% |
|
Mediana del % de reducción3 |
83% |
0% |
75% |
0% |
a Tasa de aclaramiento completo definida como la proporción de pacientes sin (cero) lesiones de queratosis actínica visibles clínicamente en el área de tratamiento.
b Tasa de aclaramiento parcial definida como el porcentaje de pacientes en los que el 75% o más del número de lesiones de queratosis actínica basales desaparecieron.
c Mediana del porcentaje (%) de reducción de lesiones de queratosis actínica comparado con el nivel basal. dp<0,001; comparado con vehículo mediante regresión logística con tratamiento, estudio y localización anatómica.
El nivel de eficacia varió entre las localizaciones anatómicas individuales. Dentro de cada localización, las tasas de aclaramiento parcial y completo fueron superiores en el grupo tratado con ingenol mebutato comparado con el grupo que recibió vehículo (ver tabla 3 y 4).
|
Tabla 3 Número y porcentaje (IC 95%) de sujetos que alcanzan aclaramiento parcial y completo en el día 57 por localización anatómica en cara y cuero cabelludo | ||||
|
Aclaramiento completo |
Aclaramiento parcial ( > 75%) | |||
|
Picato 150 pg/g (n=277 ) |
Vehículo (n=270 ) |
Picato 150 pg/g (n=277) |
Vehículo (n=270) | |
|
Cara |
104/220 47% (41-54%) |
9/220 4% (2-8%) |
157/220 71% (65-77%) |
18/220 8% (5-13%) |
|
Cuero cabelludo |
13/57 23% (13-36%) |
1/50 2% (0-11%) |
20/57 35% (23-49%) |
2/50 4% (1-14%) |
|
Tabla 4 Número y porcentaje (IC 95%) de sujetos que alcanzan aclaramiento parcial y completo en el día 57 por localización anatómica en tronco y extremidades | ||||
|
Aclaramiento completo |
Aclaramiento parcial ( > 75%) | |||
|
Picato 500 pg/g (n=226) |
Vehículo (n=232) |
Picato 500 pg/g (n=226) |
Vehículo (n=232) | |
|
Brazo |
49/142 35% (27-43%) |
7/149 5% (2-9%) |
75/142 53% (44-61%) |
11/149 7% (4-13%) |
|
Dorso de la mano |
10/54 19% (9-31%) |
0/56 0% (0-6%) |
16/54 30% (18-44%) |
1/56 2% (0-10%) |
|
Tórax |
11/14 79% (49-95%) |
2/11 18% (2-52%) |
12/14 86% (57-98%) |
2/11 18% (2-52%) |
|
Otrosa |
7/16 44% (20-70%) |
2/16 13% (2-38%) |
8/16 50% (25-75%) |
2/16 13% (2-38%) |
|
aOtros incluye hombro, espalda, pierna. | ||||
La seguridad del tratamiento con Picato 150 pg/g durante 3 días o del tratamiento con Picato 500 pg/g durante 2 días se evaluó hasta el día 57, la mayoría de las reacciones adversas notificadas y las respuestas cutáneas locales fueron leves o moderadas en intensidad y todas se resolvieron sin secuelas.
Se observaron diferencias estadísticamente significativas en los resultados notificados por los pacientes, a favor de los pacientes que recibieron Picato comparado con aquellos que recibieron el vehículo del gel. Se observaron puntuaciones medias de satisfacción global del paciente superiores, indicando un nivel superior de satisfacción global, en los grupos tratados con ingenol mebutato comparado con los grupos tratados con vehículo (p<0,001), determinado mediante el Cuestionario de Satisfacción con el Tratamiento para Medicamentos (TSQM).
Eficacia a largo plazo
Se llevaron a cabo tres estudios prospectivos observacionales de seguimiento a largo plazo durante 1 año, para evaluar la eficacia continuada a partir de la recurrencia de las lesiones de queratosis actínica en el campo de tratamiento y la seguridad, en pacientes que habían recibido tratamiento con Picato. Uno de los estudios incluyó pacientes tratados con Picato 150 pg/g en la cara o el cuero cabelludo durante 3 días y los otros dos estudios incluyeron pacientes tratados con Picato 500 pg/g en el tronco o las extremidades durante 2 días. Unicamente aquellos pacientes que alcanzaron un aclaramiento completo en el área de tratamiento al final de los estudios de fase 3 (día 57) fueron seleccionados para el seguimiento a largo plazo. El seguimiento de los pacientes se realizó cada 3 meses durante 12 meses (ver tabla 5).
|
Tabla 5 Tasa de recurrencia de las lesiones de queratosis actínica | ||
|
Picato 150 pg/g gel Cara y cuero cabelludo (n=108) |
Picato 500 pg/g gel Tronco y extremidades (n=76c) | |
|
Tasa de recurrencia a los 12 meses Estimación KM (IC 95%)a |
53,9% (44,6-63,7) |
56,0% (45,1-67,6) |
|
Tasa de recurrencia según la lesiónb a los 12 meses Media (DE) |
12,8% (19,1) |
13,2% (23,0) |
|
a La tasa de recurrencia es la estimación de Kaplan-Meier (KM) en la fecha de visita de final de estudio expresada como porcentaje (IC 95%). La recurrencia se definió como cualquier lesión de queratosis actínica identificada en el área previamente tratada en pacientes que alcanzaron un aclaramiento completo en el día 57 en los estudios fase 3 previos. b La tasa de recurrencia según la lesión para cada paciente se definió como la relación entre el número de lesiones de queratosis actínica a los 12 meses y el número de lesiones basales en los estudios fase 3 previos. c De éstos, 38 sujetos fueron previamente tratados en un estudio fase 3 controlado con vehículo y 38 sujetos fueron previamente tratados en un estudio fase 3 no controlado. | ||
Riesgo de progresión a carcinoma escamoso celular
En los ensayos clínicos de queratosis actínica llevados a cabo con ingenol mebutato gel, la tasa de carcinoma escamoso celular (CEC) notificada en el área de tratamiento fue comparable en pacientes tratados con ingenol mebutato gel (0,3%, 3 de 1.165 pacientes) y en pacientes tratados con vehículo (0,3%, 2 de 632 pacientes), al final del estudio (día 57).
No se notificó CEC en el área de tratamiento en ningún paciente (0 de 184 pacientes previamente tratados con ingenol mebutato gel) en los tres estudios prospectivos observacionales de seguimiento a largo plazo durante 1 año.
Experiencia con más de un ciclo de tratamiento
En un estudio doble ciego, controlado con vehículo, se administraron hasta dos ciclos de tratamiento con Picato 150 pg/g a 450 pacientes con 4-8 QAs en un área de tratamiento de 25 cm2 en la cara o el cuero cabelludo. Aquellos pacientes en los que un primer ciclo de tratamiento no conllevó un aclaramiento completo de todas las QAs en el área de tratamiento a las 8 semanas, fueron randomizados a otro ciclo de tratamiento con Picato o vehículo. Aquellos pacientes en los que un primer ciclo de tratamiento conllevó un aclaramiento completo, fueron visitados en la semana 26 y 44 y randomizados a un segundo ciclo de tratamiento si tenían una recurrencia en el campo. En todos los pacientes se evaluó la eficacia a las 8 semanas de la randomización. El primer ciclo de tratamiento, dado de forma abierta, dió lugar a una tasa de aclaramiento completo del 62% (277/450). Los resultados del segundo ciclo de tratamiento ciego y randomizado se muestran en la tabla 6.
|
Tabla 6 Aclaramiento completo3 del campo a las 8 semanas de la randomización y en el Mes 12 | ||||
|
Campo recalcitrantec |
Campo recurrented | |||
|
Picato 150 pg/g gel (n= 92) |
Vehículo (n=49) |
Picato 150 pg/g gel (n=42) |
Vehículo (n=20) | |
|
8 semanas tras randomización |
47% (43) (p=0,001b) |
18% (9) |
60% (25) (p=0,013b) |
25% (5) |
|
Mes 12 |
18% (17) (p=0,016b) |
4% (2) |
31% (13) (p=0,10b) |
15% (3) |
a Tasa de aclaramiento completo definida como la proporción de pacientes sin (cero) lesiones de queratosis actínica visibles clínicamente en el área de tratamiento.
b Test de Cochran-Mantel-Haenszel conPicato gel 150 pg/g comparado con vehículo ajustado por localización anatómica (cara/cuero cabelludo) y país.
c Pacientes en los que un primer ciclo de tratamiento no conllevó un aclaramiento completo de todas las QAs en el área de tratamiento.
d Pacientes en los que un primer ciclo de tratamiento conllevó un aclaramiento completo y que sufrieron una recurrencia en el área de tratamiento en la semana 26 o 44.
Queratosis Actínica en la Cara y el Cuero Cabelludo, uso secuencial tras crioterapia En un estudio de dos brazos, 329 pacientes adultos con QA en la cara o el cuero cabelludo fueron randomizados para recibir tratamiento con Picato gel 150 pg/g o vehículo 3 semanas después de recibir crioterapia en todas las lesiones visibles en el área de tratamiento. Se incluyeron en el estudio pacientes con 4 a 8 lesiones de QA clínicamente típicas, visibles, diferenciadas, no hiperqueratósicas y no hipertróficas, en un área de tratamiento contigua de 25 cm2.
A las once semanas desde el inicio, lo que equivale a 8 semanas después de la aplicación de Picato gel o vehículo, la tasa de aclaramiento completo fue del 61% entre los pacientes randomizados a Picato gel y del 49% entre los pacientes randomizados a vehículo. A los 12 meses, las tasas de aclaramiento completo en estos grupos fueron del 31% y del 19%, respectivamente. El porcentaje de reducción en el recuento de QA en el grupo de Picato fue del 83% a las 11 semanas y del 57% a los 12 meses, siendo en el grupo de vehículo del 78% a las 11 semanas y del 42% a los 12 meses. El número medio de QAs en el grupo de Picato fue de 5,7 al inicio, 0,8 en la semana 11 y 0,9 en el mes 12 mientras que fue de 5,8, 1,0 y 1,2 en el grupo de vehículo para estos mismos tiempos.
Los resultados de seguridad del estudio fueron comparables al perfil de seguridad de Picato gel 150 pg/g como monoterapia.
Experiencia con el tratamiento en un área más extensa
En un ensayo clínico doble ciego controlado con vehículo para evaluar la exposición sistémica, se aplicó el contenido de 4 tubos de Picato 500 pg/g, en un área de tratamiento contigua de 100 cm2, diariamente durante 2 días consecutivos. Los resultados no mostraron absorción sistémica.
Picato 500 pg/g fue bien tolerado cuando se aplicó en un área de tratamiento contigua de 100 cm2 en el tronco y extremidades.
Población pediátrica
La Agencia Europea de Medicamentos ha eximido al titular de la obligación de presentar los resultados de los ensayos realizados con Picato en los diferentes grupos de la población pediátrica en queratosis actínica (ver sección 4.2 para consultar la información sobre el uso en población pediátrica).
Población de edad avanzada
De los 1.165 pacientes tratados con Picato en ensayos clínicos sobre queratosis actínica llevados a cabo con ingenol mebutato gel, 656 pacientes (56%) tenían 65 años o más, mientras que 241 pacientes (21%) tenían 75 años o más. No se observaron diferencias globales en eficacia y seguridad entre los pacientes más jóvenes y los de mayor edad.
5.2 Propiedades farmacocinéticas
El perfil farmacocinético sistémico de ingenol mebutato y sus metabolitos no ha sido caracterizado en humanos debido a la ausencia de niveles sanguíneos cuantificables para todos ellos tras administración cutánea.
No se detectó absorción sistémica en o por encima del límite de detección inferior (0,1 ng/ml) cuando el contenido de 4 tubos de Picato 500 ^g/g se aplicó en un área de 100 cm2 en el dorso del antebrazo de pacientes con queratosis actínica, una vez al día durante 2 días consecutivos.
Los resultados de un estudio in vitro muestran que ingenol mebutato no inhibe ni induce las isoformas del citocromo P450 humano.
5.3 Datos preclínicos sobre seguridad
Los datos de los estudios no clínicos no muestran riesgos especiales para los seres humanos según los estudios convencionales de farmacología de seguridad, toxicidad a dosis repetidas y genotoxicidad.
Los estudios no clínicos de seguridad mostraron que la administración cutánea de ingenol mebutato gel es bien tolerada, siendo reversible cualquier irritación cutánea y con un riesgo insignificante de toxicidad sistémica en las condiciones de uso recomendadas.
En ratas, ingenol mebutato no se asoció con efectos sobre el desarrollo fetal a dosis IV de hasta 5 ^g/kg/día (30 ^g/m2/día). En conejos no se produjeron anomalías graves. Se observaron anomalías fetales de poca importancia o variantes en fetos de hembras tratadas a dosis de 1 ^g/kg/día (12 ^g/m2/día).
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Alcohol isopropílico Hidroxietilcelulosa Ácido cítrico monohidrato Citrato de sodio Alcohol bencílico Agua purificada
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
2 años
6.4 Precauciones especiales de conservación
Conservar en nevera (entre 2°C y 8°C).
Los tubos deben desecharse tras la primera apertura.
6.5 Naturaleza y contenido del envase
Tubos laminados unidosis con una capa interna de Polietileno de Alta Densidad (HDPE) y aluminio como capa protectora. Tapones de HDPE.
Picato 150 ^g/g gel está disponible en cajas que contienen 3 tubos con 0,47 g de gel en cada uno.
6.6 Precauciones especiales de eliminación
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
LEO Pharma A/S Industriparken 55 2750 Ballerup Dinamarca +45 4494 5888
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/12/796/001
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 15 Noviembre 2012
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
▼ Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas. Ver la sección 4.8, en la que se incluye información sobre cómo notificarlas.
1. NOMBRE DEL MEDICAMENTO
Picato 500 microgramos/gramo gel
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada gramo de gel contiene 500 ^g de ingenol mebutato. Cada tubo contiene 235 ^g de ingenol mebutato en 0,47 g de gel.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Gel.
Gel transparente incoloro.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Picato está indicado para el tratamiento cutáneo de la queratosis actínica no hiperqueratósica y no hipertrófica en adultos.
4.2 Posología y forma de administración
Posología
Queratosis actínica en el tronco y las extremidades en adultos
Un tubo de Picato 500 (ig/g gel (que contiene 235 ^g de ingenol mebutato) debe aplicarse una vez al día en el área afectada durante 2 días consecutivos.
Población pediátrica
No existe una recomendación de uso específica para Picato en la población pediátrica.
Población de edad avanzada
No se requiere ajuste de dosis (ver sección 5.1).
Forma de administración
El contenido de un tubo es el suficiente para un área de tratamiento de 25 cm2 (p. ej. 5 cm x 5 cm). El contenido del tubo debe aplicarse en un área de tratamiento de 25 cm2. El tubo es para un solo uso y debe desecharse tras su uso (ver sección 6.6).
El gel del tubo debe vaciarse sobre la yema de un dedo y extenderse uniformemente sobre toda el área de tratamiento, dejándolo secar durante 15 minutos. El contenido de un tubo debe emplearse para un área de tratamiento de 25 cm2.
Para un solo uso.
Para el tratamiento del cuello: Si más de la mitad del área de tratamiento está localizada en la parte superior del cuello, debe emplearse la posología para la cara y el cuero cabelludo. Si más de la mitad del área de tratamiento está localizada en la parte inferior del cuello, debe emplearse la posología para el tronco y las extremidades.
Si se trata simultáneamente un área de la cara o el cuero cabelludo y otra área del tronco o las extremidades, entonces los pacientes deben ser informados para garantizar que emplean las dosis adecuadas. Se debe tener cuidado de no aplicar el gel de 500 ^g/g en la cara o el cuero cabelludo puesto que esto podría conllevar a una mayor incidencia de respuestas cutáneas locales.
Se debe advertir a los pacientes que es necesario que se laven las manos con agua y jabón, inmediatamente después de la aplicación de Picato y entre aplicaciones tópicas si dos áreas distintas requieren dosis diferentes. Si la zona tratada son las manos, únicamente debe lavarse la yema del dedo que se utilice para aplicar el gel.
Se debe evitar el lavado y el contacto con el área tratada durante un periodo de 6 horas tras la aplicación de Picato. Tras este periodo, el área tratada puede lavarse utilizando agua y un jabón suave.
Picato no debe aplicarse inmediatamente después de ducharse ni en las 2 horas previas a acostarse.
El área tratada no debe cubrirse con vendajes oclusivos después de la aplicación de Picato.
El efecto terapéutico óptimo puede evaluarse aproximadamente 8 semanas después del tratamiento.
Se puede dar un ciclo de tratamiento repetido con Picato si se observa una respuesta incompleta en la visita de seguimiento a las 8 semanas o si las lesiones que han blanqueado en esta visita recurren en visitas posteriores.
No se dispone de datos clínicos sobre el tratamiento de pacientes inmunodeprimidos, pero no son de esperar riesgos sistémicos puesto que ingenol mebutato no se absorbe a nivel sistémico.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo Exposición ocular
El contacto con los ojos puede producir conjuntivitis química y quemaduras corneales. Los pacientes deben lavarse las manos cuidadosamente tras la aplicación del gel y después de cualquier contacto con el área tratada, para evitar la transferencia involuntaria del gel a los ojos. En caso de contacto accidental, los ojos deben lavarse inmediatamente con abundante agua y el paciente debe recibir atención médica tan pronto como sea posible. Pueden aparecer alteraciones oculares tales como dolor en el ojo, edema palpebral y edema periorbitario, tras la exposición ocular accidental a Picato (ver sección 4.8).
Ingestión
Picato no debe ser ingerido. En caso de ingestión accidental, el paciente debe beber abundante agua y solicitar atención médica.
General
No se recomienda la administración de Picato hasta que la piel se haya recuperado de cualquier tratamiento previo con medicamentos o quirúrgico y no debe aplicarse en heridas abiertas o piel lesionada en la que la barrera cutánea está alterada.
Picato no debe emplearse cerca de los ojos, en el interior de las fosas nasales, en el interior de los oídos ni en los labios.
Respuestas cutáneas locales
Puede esperarse que se produzcan respuestas cutáneas locales como eritema, descamación/formación de escamas y costras tras la aplicación cutánea de Picato (ver sección 4.8). Las respuestas cutáneas localizadas son transitorias y habitualmente se producen durante el primer día de tratamiento alcanzando su máxima intensidad hasta 1 semana después de la finalización del mismo. Las respuestas cutáneas localizadas habitualmente se resuelven durante las 2 semanas siguientes al inicio del tratamiento, cuando se tratan áreas de la cara y cuero cabelludo, y durante las 4 semanas siguientes al inicio del tratamiento, cuando se tratan áreas del tronco y extremidades. Es posible que el efecto del tratamiento no pueda evaluarse adecuadamente hasta la resolución de las respuestas cutáneas locales.
Exposición solar
Se han llevado a cabo estudios para evaluar los efectos de la irradiación UV de la piel tras la aplicación única o repetida de ingenol mebutato gel, 100 pg/g. Ingenol mebutato gel no mostró ningún potencial para producir efectos fotoalérgicos o fotoirritantes. Sin embargo, debido a la naturaleza de la enfermedad, debe evitarse o minimizarse la exposición excesiva a la luz solar (incluyendo lámparas de sol artificial y cabinas de bronceado).
Manejo de la queratosis actínica
Las lesiones clínicamente atípicas de queratosis actínica o sospechosas de malignización deben biopsiarse para determinar el tratamiento apropiado.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios de interacciones. Las interacciones con medicamentos que se absorben sistémicamente se consideran poco probables puesto que Picato no se absorbe a nivel sistémico.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No hay datos relativos al uso de ingenol mebutato en mujeres embarazadas. Los estudios realizados en animales mostraron escasa toxicidad embriofetal (ver sección 5.3). El riesgo en humanos que reciben tratamiento cutáneo con ingenol mebutato se considera improbable puesto que Picato no se absorbe a nivel sistémico. Como medida de precaución, es preferible evitar el uso de Picato durante el embarazo.
Lactancia
No se prevén efectos en niños/recién nacidos lactantes puesto que Picato no se absorbe a nivel sistémico. Se debe advertir a la madre en período de lactancia que debe evitarse el contacto físico entre su niño/recién nacido y el área tratada durante un periodo de 6 horas tras la aplicación de Picato.
Fertilidad
No se han realizado estudios de fertilidad con ingenol mebutato.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de Picato sobre la capacidad para conducir y utilizar máquinas es nula o insignificante.
4.8 Reacciones adversas Resumen del perfil de seguridad
Las reacciones adversas notificadas con mayor frecuencia son respuestas cutáneas locales incluyendo eritema, descamación/formación de escamas, costras, hinchazón, vesículas/pústulas y erosión/ulceración en el lugar de aplicación de ingenol mebutato gel, ver tabla 1 para terminología MedDRA. Tras la aplicación de ingenol mebutato, la mayoría de pacientes (>95%) experimentó una o diversas respuestas cutáneas locales. Se ha notificado infección en el lugar de aplicación cuando se trata la cara y el cuero cabelludo.
Tabla de reacciones adversas
La tabla 1 refleja la exposición a Picato 150 ^g/g o 500 ^g/g de 499 pacientes con queratosis actínica, tratados en cuatro estudios fase 3 controlados frente a vehículo, en los que se incluyeron un total de
1.002 pacientes. Los pacientes recibieron tratamiento de campo (área de 25 cm2) con Picato a concentraciones de 150 ^g/g o 500 ^g/g o vehículo una vez al día durante 3 ó 2 días consecutivos, respectivamente.
La tabla que aparece a continuación recoge las reacciones adversas según la clasificación de órganos del sistema MedDRA y su localización anatómica.
Las frecuencias se han definido según la siguiente convención:
Muy frecuentes (>1/10); frecuentes (>1/100 a <1/10); poco frecuentes (>1/1.000 a <1/100); raras (>1/10.000 a <1/1.000); muy raras (<1/10.000) y de frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
Dentro de cada grupo de frecuencia, las reacciones adversas se enumeran en orden decreciente de gravedad.
|
Tabla 1 Reacciones adversas según Clasificación de Órganos del Sistema MedDRA | ||
|
Frecuencia | ||
|
Sistema de clasificación de órganos |
Cara y cuero cabelludo |
Tronco y extremidades |
|
Infecciones e infestaciones | ||
|
Pústulas en el lugar de aplicación |
Muy frecuentes |
Muy frecuentes |
|
Infección en el lugar de aplicación |
Frecuentes | |
|
Trastornos del sistema inmunológico | ||
|
Hipersensibilidad (incluyendo angioedema) |
Poco frecuentes |
Poco frecuentes |
|
Trastornos del sistema nervioso | ||
|
Cefalea |
Frecuentes | |
|
Trastornos oculares* | ||
|
Edema palpebral |
Frecuentes | |
|
Edema periorbitario |
Frecuentes | |
|
Conjuntivitis química, quemadura corneal** |
Poco frecuentes |
Poco frecuentes |
|
Dolor ocular |
Poco frecuentes | |
|
Trastornos generales y alteraciones en el lugar de administración | ||
|
Erosión en el lugar de aplicación |
Muy frecuentes |
Muy frecuentes |
|
Vesículas en el lugar de aplicación |
Muy frecuentes |
Muy frecuentes |
|
Hinchazón en el lugar de aplicación |
Muy frecuentes |
Muy frecuentes |
|
Exfoliación en el lugar de aplicación |
Muy frecuentes |
Muy frecuentes |
|
Costra en el lugar de aplicación |
Muy frecuentes |
Muy frecuentes |
|
Eritema en el lugar de aplicación |
Muy frecuentes |
Muy frecuentes |
|
Dolor en el lugar de aplicación*** |
Muy frecuentes |
Frecuentes |
|
Prurito en el lugar de aplicación |
Frecuentes |
Frecuentes |
|
Irritación en el lugar de aplicación |
Frecuentes |
Frecuentes |
|
Secreción en el lugar de aplicación |
Poco frecuentes | |
|
Parestesia en el lugar de aplicación |
Poco frecuentes |
Poco frecuentes |
|
Úlcera en el lugar de aplicación |
Poco frecuentes |
Poco frecuentes |
|
Cambios de la pigmentación en el lugar de aplicación |
Poco frecuentes |
Poco frecuentes |
|
Calor en el lugar de aplicación |
Poco frecuentes |
*: La hinchazón en el lugar de aplicación, cuando se aplica en la cara o en el cuero cabelludo, puede alcanzar la zona ocular
**: Exposición ocular accidental: Se han recibido informes post-comercialización de conjuntivitis química y quemadura corneal relacionadas con la exposición ocular accidental (ver las secciones 4.2 y 4.4 para la prevención de la exposición ocular)
***: Incluyendo sensación de quemazón en el lugar de aplicación.
Descripción de las reacciones adversas seleccionadas
Las incidencias de las respuestas cutáneas locales que se produjeron con una incidencia >1% en la ‘cara/cuero cabelludo’ y en el ‘tronco/extremidades’, respectivamente, son: eritema en el lugar de aplicación (94% y 92%), exfoliación en el lugar de aplicación (85% y 90%), costra en el lugar de aplicación (80% y 74%), hinchazón en el lugar de aplicación (79% y 64%), vesículas en el lugar de aplicación (13% y 20%), pústulas en el lugar de aplicación (43% y 23%) y erosión en el lugar de aplicación (31% y 25%).
Las respuestas cutáneas locales graves se produjeron con una incidencia del 29% en la cara y el cuero cabelludo y con una incidencia del 17% en el tronco y las extremidades. Las incidencias de las respuestas cutáneas locales graves que se produjeron con una incidencia >1% en la ‘cara/cuero cabelludo’ y en el ‘tronco/extremidades’, respectivamente, son: eritema en el lugar de aplicación (24% y 15%), exfoliación en el lugar de aplicación (9% y 8%), costra en el lugar de aplicación (6% y 4%), hinchazón en el lugar de aplicación (5% y 3%) y pústulas en el lugar de aplicación (5% y 1%).
Seguimiento a largo plazo
A un total de 198 pacientes con aclaramiento completo en el día 57 (184 tratados con Picato y 14 tratados con vehículo) se les realizó un seguimiento adicional durante 12 meses. En otro estudio, 329 pacientes que fueron tratados inicialmente con crioterapia en la cara/cuero cabelludo, fueron randomizados a las tres semanas a Picato 150 ^g/g (n=158) o vehículo (n=150) durante 3 días en la misma área. Se hizo un seguimiento durante 12 meses de 149 pacientes del grupo tratado con Picato y de 140 del grupo que recibió vehículo. En un estudio posterior 450 pacientes fueron tratados inicialmente con Picato 150 ^g/g, de éstos 134 pacientes fueron randomizados a un segundo ciclo de tratamiento con Picato 150 ^g/g y se hizo un seguimiento de los pacientes durante 12 meses tras el primer tratamiento.
Estos resultados no modificaron el perfil de seguridad de Picato (ver sección 5.1).
Notificación de sospechas de reacciones adversas
Es importante notificar las sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Apéndice V.
4.9 Sobredosis
La sobredosis de Picato puede dar lugar a una mayor incidencia de respuestas cutáneas locales. El manejo de la sobredosis debe consistir en el tratamiento de los síntomas clínicos.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Antibióticos y quimioterápicos para uso dermatológico, otros quimioterápicos, código ATC: D06BX02.
Mecanismo de acción
El mecanismo de acción de ingenol mebutato para uso en queratosis actínica no ha sido totalmente caracterizado. Modelos in vitro e in vivo han mostrado un mecanismo de acción dual para los efectos de ingenol mebutato: 1) inducción de la muerte celular en la lesión local y 2) promoción de una respuesta inflamatoria caracterizada por producción local de citoquinas y quimioquinas proinflamatorias e infiltración de células inmunocompetentes.
Efectos farmacodinámicos
Los resultados obtenidos en dos estudios clínicos sobre los efectos biológicos de ingenol mebutato han mostrado que la administración tópica inducía necrosis epidérmica y una respuesta inflamatoria intensa tanto en la epidermis como en la dermis superior de la piel tratada, con predominio de células T infiltrantes, neutrófilos y macrófagos. La necrosis en la dermis se observó raramente.
Los perfiles de expresión genética de las biopsias de piel obtenida de las áreas tratadas sugieren una respuesta inflamatoria y respuesta a la lesión, lo que es consistente con las evaluaciones histológicas. El examen no invasivo de la piel tratada realizado mediante microscopia confocal de reflectancia ha mostrado que los cambios de la piel inducidos por ingenol mebutato son reversibles, con una normalización casi completa de todos los parámetros determinados en el día 57 tras el tratamiento, lo que también está avalado por los hallazgos clínicos y los estudios en animales.
Eficacia clínica y seguridad
La eficacia y seguridad de Picato 150 ^g/g, aplicado en la cara o el cuero cabelludo durante 3 días consecutivos, se estudió en dos ensayos clínicos doble ciego controlados con vehículo, que incluyeron 547 pacientes adultos. Así mismo, se estudió la eficacia y seguridad de Picato 500 ^g/g, aplicado en tronco y extremidades durante 2 días consecutivos, en dos ensayos clínicos doble ciego controlados con vehículo, que incluyeron 458 pacientes adultos. Los pacientes continuaron en los estudios durante un periodo de seguimiento de 8 semanas durante el cual regresaron para ser evaluados clínicamente y monitorizados desde el punto de vista de seguridad. La eficacia, determinada como tasa de aclaramiento parcial y completo, así como la mediana del porcentaje de reducción, fue evaluada en el día 57 (ver tabla 2).
Los pacientes presentaban de 4 a 8 lesiones de queratosis actínica clínicamente típicas, visibles, diferenciadas, no hiperqueratósicas y no hipertróficas, en un área de tratamiento contigua de 25 cm2 en la cara o el cuero cabelludo o en el tronco o las extremidades. En los días programados de tratamiento, se aplicó el gel en estudio en toda el área de tratamiento.
La tasa de cumplimiento fue alta, completando estos estudios el 98% de los pacientes.
La edad de los pacientes incluidos en los estudios estaba comprendida entre los 34 y los 89 años (media de 64 y 66 años, respectivamente, para las dos concentraciones) y el 94% tenía piel tipo I, II o III según la escala de Fitzpatrick.
En el día 57, los pacientes tratados con Picato tuvieron tasas de aclaramiento parcial y completo superiores a las de los pacientes tratados con el vehículo del gel (p<0,001). La mediana del porcentaje de reducción de lesiones de queratosis actínica fue superior en el grupo tratado con ingenol mebutato comparado con el grupo que recibió vehículo (ver tabla 2).
|
Tabla 2 Tasa de sujetos con aclaramiento parcial y completo y mediana del porcentaje (%) de reducción de lesiones de queratosis actínica | ||||
|
Cara y cuero cabelludo |
Tronco y extremidades | |||
|
Picato 150 ^g/g (n=277) |
Vehículo (n=270) |
Picato 500 ^g/g (n=226) |
Vehículo (n=232) | |
|
Tasa Aclaramiento Completo3 |
42,2% d |
3,7% |
34,1% d |
4,7% |
|
Tasa Aclaramiento Parcialb (> 75%) |
63,9% d |
7,4% |
49,1% d |
6,9% |
|
Mediana del % de reducción3 |
83% |
0% |
75% |
0% |
a Tasa de aclaramiento completo definida como la proporción de pacientes sin (cero) lesiones de queratosis actínica visibles clínicamente en el área de tratamiento.
b Tasa de aclaramiento parcial definida como el porcentaje de pacientes en los que el 75% o más del número de lesiones de queratosis actínica basales desaparecieron.
c Mediana del porcentaje (%) de reducción de lesiones de queratosis actínica comparado con el nivel basal. dp<0,001; comparado con vehículo mediante regresión logística con tratamiento, estudio y localización anatómica.
El nivel de eficacia varió entre las localizaciones anatómicas individuales. Dentro de cada localización, las tasas de aclaramiento parcial y completo fueron superiores en el grupo tratado con ingenol mebutato comparado con el grupo que recibió vehículo (ver tabla 3 y 4).
|
Tabla 3 Número y porcentaje (IC 95%) de sujetos que alcanzan aclaramiento parcial y completo en el día 57 por localización anatómica en cara y cuero cabelludo | ||||
|
Aclaramiento completo |
Aclaramiento parcial ( > 75%) | |||
|
Picato 150 pg/g (n=277 ) |
Vehículo (n=270 ) |
Picato 150 pg/g (n=277) |
Vehículo (n=270) | |
|
Cara |
104/220 47% (41-54%) |
9/220 4% (2-8%) |
157/220 71% (65-77%) |
18/220 8% (5-13%) |
|
Cuero cabelludo |
13/57 23% (13-36%) |
1/50 2% (0-11%) |
20/57 35% (23-49%) |
2/50 4% (1-14%) |
|
Tabla 4 Número y porcentaje (IC 95%) de sujetos que alcanzan aclaramiento parcial y completo en el día 57 por localización anatómica en tronco y extremidades | ||||
|
Aclaramiento completo |
Aclaramiento parcial ( > 75%) | |||
|
Picato 500 pg/g (n=226) |
Vehículo (n=232) |
Picato 500 pg/g (n=226) |
Vehículo (n=232) | |
|
Brazo |
49/142 35% (27-43%) |
7/149 5% (2-9%) |
75/142 53% (44-61%) |
11/149 7% (4-13%) |
|
Dorso de la mano |
10/54 19% (9-31%) |
0/56 0% (0-6%) |
16/54 30% (18-44%) |
1/56 2% (0-10%) |
|
Tórax |
11/14 79% (49-95%) |
2/11 18% (2-52%) |
12/14 86% (57-98%) |
2/11 18% (2-52%) |
|
Otrosa |
7/16 44% (20-70%) |
2/16 13% (2-38%) |
8/16 50% (25-75%) |
2/16 13% (2-38%) |
|
aOtros incluye hombro, espalda, pierna. | ||||
La seguridad del tratamiento con Picato 150 pg/g durante 3 días o del tratamiento con Picato 500 pg/g durante 2 días se evaluó hasta el día 57, la mayoría de las reacciones adversas notificadas y las respuestas cutáneas locales fueron leves o moderadas en intensidad y todas se resolvieron sin secuelas.
Se observaron diferencias estadísticamente significativas en los resultados notificados por los pacientes, a favor de los pacientes que recibieron Picato comparado con aquellos que recibieron el vehículo del gel. Se observaron puntuaciones medias de satisfacción global del paciente superiores, indicando un nivel superior de satisfacción global, en los grupos tratados con ingenol mebutato comparado con los grupos tratados con vehículo (p<0,001), determinado mediante el Cuestionario de Satisfacción con el Tratamiento para Medicamentos (TSQM).
Eficacia a largo plazo
Se llevaron a cabo tres estudios prospectivos observacionales de seguimiento a largo plazo durante 1 año, para evaluar la eficacia continuada a partir de la recurrencia de las lesiones de queratosis actínica en el campo de tratamiento y la seguridad, en pacientes que habían recibido tratamiento con Picato. Uno de los estudios incluyó pacientes tratados con Picato 150 pg/g en la cara o el cuero cabelludo durante 3 días y los otros dos estudios incluyeron pacientes tratados con Picato 500 pg/g en el tronco o las extremidades durante 2 días. Unicamente aquellos pacientes que alcanzaron un aclaramiento completo en el área de tratamiento al final de los estudios de fase 3 (día 57) fueron seleccionados para el seguimiento a largo plazo. El seguimiento de los pacientes se realizó cada 3 meses durante 12 meses (ver tabla 5).
|
Tabla 5 Tasa de recurrencia de las lesiones de queratosis actínica | ||
|
Picato 150 pg/g gel Cara y cuero cabelludo (n=108) |
Picato 500 pg/g gel Tronco y extremidades (n=76c) | |
|
Tasa de recurrencia a los 12 meses Estimación KM (IC 95%)a |
53,9% (44,6-63,7) |
56,0% (45,1-67,6) |
|
Tasa de recurrencia según la lesiónb a los 12 meses Media (DE) |
12,8% (19,1) |
13,2% (23,0) |
|
a La tasa de recurrencia es la estimación de Kaplan-Meier (KM) en la fecha de visita de final de estudio expresada como porcentaje (IC 95%). La recurrencia se definió como cualquier lesión de queratosis actínica identificada en el área previamente tratada en pacientes que alcanzaron un aclaramiento completo en el día 57 en los estudios fase 3 previos. b La tasa de recurrencia según la lesión para cada paciente se definió como la relación entre el número de lesiones de queratosis actínica a los 12 meses y el número de lesiones basales en los estudios fase 3 previos. c De éstos, 38 sujetos fueron previamente tratados en un estudio fase 3 controlado con vehículo y 38 sujetos fueron previamente tratados en un estudio fase 3 no controlado. | ||
Riesgo de progresión a carcinoma escamoso celular
En los ensayos clínicos de queratosis actínica llevados a cabo con ingenol mebutato gel, la tasa de carcinoma escamoso celular (CEC) notificada en el área de tratamiento fue comparable en pacientes tratados con ingenol mebutato gel (0,3%, 3 de 1.165 pacientes) y en pacientes tratados con vehículo (0,3%, 2 de 632 pacientes), al final del estudio (día 57).
No se notificó CEC en el área de tratamiento en ningún paciente (0 de 184 pacientes previamente tratados con ingenol mebutato gel) en los tres estudios prospectivos observacionales de seguimiento a largo plazo durante 1 año.
Experiencia con más de un ciclo de tratamiento
En un estudio doble ciego, controlado con vehículo, se administraron hasta dos ciclos de tratamiento con Picato 150 pg/g a 450 pacientes con 4-8 QAs en un área de tratamiento de 25 cm2 en la cara o el cuero cabelludo. Aquellos pacientes en los que un primer ciclo de tratamiento no conllevó un aclaramiento completo de todas las QAs en el área de tratamiento a las 8 semanas, fueron randomizados a otro ciclo de tratamiento con Picato o vehículo. Aquellos pacientes en los que un primer ciclo de tratamiento conllevó un aclaramiento completo, fueron visitados en la semana 26 y 44 y randomizados a un segundo ciclo de tratamiento si tenían una recurrencia en el campo. En todos los pacientes se evaluó la eficacia a las 8 semanas de la randomización. El primer ciclo de tratamiento, dado de forma abierta, dió lugar a una tasa de aclaramiento completo del 62% (277/450). Los resultados del segundo ciclo de tratamiento ciego y randomizado se muestran en la tabla 6.
|
Tabla 6 Aclaramiento completo3 del campo a las 8 semanas de la randomización y en el Mes 12 | ||||
|
Campo recalcitrantec |
Campo recurrented | |||
|
Picato 150 pg/g gel (n= 92) |
Vehículo (n=49) |
Picato 150 pg/g gel (n=42) |
Vehículo (n=20) | |
|
8 semanas tras randomización |
47% (43) (p=0,001b) |
18% (9) |
60% (25) (p=0,013b) |
25% (5) |
|
Mes 12 |
18% (17) (p=0,016b) |
4% (2) |
31% (13) (p=0,10b) |
15% (3) |
a Tasa de aclaramiento completo definida como la proporción de pacientes sin (cero) lesiones de queratosis actínica visibles clínicamente en el área de tratamiento.
b Test de Cochran-Mantel-Haenszel conPicato gel 150 pg/g comparado con vehículo ajustado por localización anatómica (cara/cuero cabelludo) y país.
c Pacientes en los que un primer ciclo de tratamiento no conllevó un aclaramiento completo de todas las QAs en el área de tratamiento.
d Pacientes en los que un primer ciclo de tratamiento conllevó un aclaramiento completo y que sufrieron una recurrencia en el área de tratamiento en la semana 26 o 44.
Queratosis Actínica en la Cara y el Cuero Cabelludo, uso secuencial tras crioterapia En un estudio de dos brazos, 329 pacientes adultos con QA en la cara o el cuero cabelludo fueron randomizados para recibir tratamiento con Picato gel 150 pg/g o vehículo 3 semanas después de recibir crioterapia en todas las lesiones visibles en el área de tratamiento. Se incluyeron en el estudio pacientes con 4 a 8 lesiones de QA clínicamente típicas, visibles, diferenciadas, no hiperqueratósicas y no hipertróficas, en un área de tratamiento contigua de 25 cm2.
A las once semanas desde el inicio, lo que equivale a 8 semanas después de la aplicación de Picato gel o vehículo, la tasa de aclaramiento completo fue del 61% entre los pacientes randomizados a Picato gel y del 49% entre los pacientes randomizados a vehículo. A los 12 meses, las tasas de aclaramiento completo en estos grupos fueron del 31% y del 19%, respectivamente. El porcentaje de reducción en el recuento de QA en el grupo de Picato fue del 83% a las 11 semanas y del 57% a los 12 meses, siendo en el grupo de vehículo del 78% a las 11 semanas y del 42% a los 12 meses. El número medio de QAs en el grupo de Picato fue de 5,7 al inicio, 0,8 en la semana 11 y 0,9 en el mes 12 mientras que fue de 5,8, 1,0 y 1,2 en el grupo de vehículo para estos mismos tiempos.
Los resultados de seguridad del estudio fueron comparables al perfil de seguridad de Picato gel 150 pg/g como monoterapia.
Experiencia con el tratamiento en un área más extensa
En un ensayo clínico doble ciego controlado con vehículo para evaluar la exposición sistémica, se aplicó el contenido de 4 tubos de Picato 500 pg/g, en un área de tratamiento contigua de 100 cm2, diariamente durante 2 días consecutivos. Los resultados no mostraron absorción sistémica.
Picato 500 pg/g fue bien tolerado cuando se aplicó en un área de tratamiento contigua de 100 cm2 en el tronco y extremidades.
Población pediátrica
La Agencia Europea de Medicamentos ha eximido al titular de la obligación de presentar los resultados de los ensayos realizados con Picato en los diferentes grupos de la población pediátrica en queratosis actínica (ver sección 4.2 para consultar la información sobre el uso en población pediátrica).
Población de edad avanzada
De los 1.165 pacientes tratados con Picato en ensayos clínicos sobre queratosis actínica llevados a cabo con ingenol mebutato gel, 656 pacientes (56%) tenían 65 años o más, mientras que 241 pacientes (21%) tenían 75 años o más. No se observaron diferencias globales en eficacia y seguridad entre los pacientes más jóvenes y los de mayor edad.
5.2 Propiedades farmacocinéticas
El perfil farmacocinético sistémico de ingenol mebutato y sus metabolitos no ha sido caracterizado en humanos debido a la ausencia de niveles sanguíneos cuantificables para todos ellos tras administración cutánea.
No se detectó absorción sistémica en o por encima del límite de detección inferior (0,1 ng/ml) cuando el contenido de 4 tubos de Picato 500 ^g/g se aplicó en un área de 100 cm2 en el dorso del antebrazo de pacientes con queratosis actínica, una vez al día durante 2 días consecutivos.
Los resultados de un estudio in vitro muestran que ingenol mebutato no inhibe ni induce las isoformas del citocromo P450 humano.
5.3 Datos preclínicos sobre seguridad
Los datos de los estudios no clínicos no muestran riesgos especiales para los seres humanos según los estudios convencionales de farmacología de seguridad, toxicidad a dosis repetidas y genotoxicidad.
Los estudios no clínicos de seguridad mostraron que la administración cutánea de ingenol mebutato gel es bien tolerada, siendo reversible cualquier irritación cutánea y con un riesgo insignificante de toxicidad sistémica en las condiciones de uso recomendadas.
En ratas, ingenol mebutato no se asoció con efectos sobre el desarrollo fetal a dosis IV de hasta 5 ^g/kg/día (30 ^g/m2/día). En conejos no se produjeron anomalías graves. Se observaron anomalías fetales de poca importancia o variantes en fetos de hembras tratadas a dosis de 1 ^g/kg/día (12 ^g/m2/día).
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Alcohol isopropílico Hidroxietilcelulosa Ácido cítrico monohidrato Citrato de sodio Alcohol bencílico Agua purificada
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
2 años
6.4 Precauciones especiales de conservación
Conservar en nevera (entre 2°C y 8°C).
Los tubos deben desecharse tras la primera apertura.
6.5 Naturaleza y contenido del envase
Tubos laminados unidosis con una capa interna de Polietileno de Alta Densidad (HDPE) y aluminio como capa protectora. Tapones de HDPE.
Picato 500 ^g/g gel está disponible en cajas que contienen 2 tubos con 0,47 g de gel en cada uno.
6.6 Precauciones especiales de eliminación
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
LEO Pharma A/S Industriparken 55 2750 Ballerup Dinamarca +45 4494 5888
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/12/796/002
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 15 Noviembre 2012
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
A. FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
Nombre y dirección del fabricante responsable de la liberación de los lotes LEO Laboratories Ltd.
285 Cashel Road Crumlin, Dublín 12 Irlanda
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica.
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
El Titular de la Autorización de Comercialización (TAC) presentará los informes periódicos de seguridad para este medicamento de conformidad con las exigencias establecidas en la lista de fechas de referencia de la Unión (lista EURD) prevista en el artículo 107ter (párrafo 7) de la Directiva 2001/83/CE y publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN
SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado en la versión del PGR incluido en el Módulo 1.8.2 de la Autorización de Comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos.
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
Si coincide la presentación de un IPS con la actualización del PGR, ambos documentos se pueden presentar conjuntamente.
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
1. NOMBRE DEL MEDICAMENTO
Picato 150 microgramos/g gel Ingenol mebutato
2. PRINCIPIO(S) ACTIVO(S)
Cada gramo de gel contiene 150 microgramos de ingenol mebutato. Cada tubo contiene 70 microgramos de ingenol mebutato en 0,47 g de gel.
3. LISTA DE EXCIPIENTES
Alcohol isopropílico Hidroxietilcelulosa Ácido cítrico monohidrato Citrato de sodio Alcohol bencílico Agua purificada
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
gel
3 tubos
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Para un solo uso
Leer el prospecto antes de utilizar este medicamento. Uso cutáneo
A imprimir en la parte interior de la tapa de la caja:
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Conservar en nevera
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
LEO Pharma A/S Industriparken 55 DK-2750 Ballerup Dinamarca
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/12/796/001
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Picato 150mcg/g
1. NOMBRE DEL MEDICAMENTO
Picato 500 microgramos/g gel Ingenol mebutato
2. PRINCIPIO(S) ACTIVO(S)
Cada gramo de gel contiene 500 microgramos de ingenol mebutato. Cada tubo contiene 235 microgramos de ingenol mebutato en 0,47 g de gel.
3. LISTA DE EXCIPIENTES
Alcohol isopropílico Hidroxietilcelulosa Ácido cítrico monohidrato Citrato de sodio Alcohol bencílico Agua purificada
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
gel
2 tubos
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Para un solo uso
Leer el prospecto antes de utilizar este medicamento. Uso cutáneo
A imprimir en la parte interior de la tapa de la caja:
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Conservar en nevera
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
LEO Pharma A/S Industriparken 55 DK-2750 Ballerup Dinamarca
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/12/796/002
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Picato 500 mcg/g
TUBO 150 ^g/g GEL_
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Picato 150 ^g/g gel Ingenol mebutato Uso cutáneo
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
0,47 g
6. OTROS
TUBO 500 ^g/g GEL_
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Picato 500 ^g/g gel Ingenol mebutato Uso cutáneo
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
0,47 g
6. OTROS
B. PROSPECTO
Prospecto: información para el paciente
Picato 150 microgramos/gramo gel
Ingenol mebutato
▼ Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Puede contribuir comunicando los efectos adversos que pudiera usted tener. La parte final de la sección 4 incluye información sobre cómo comunicar estos efectos adversos.
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es Picato y para qué se utiliza
2. Qué necesita saber antes de empezar a usar Picato
3. Cómo usar Picato
4. Posibles efectos adversos
5. Conservación de Picato
6. Contenido del envase e información adicional
1. Qué es Picato y para qué se utiliza
Picato contiene ingenol mebutato como principio activo.
Este medicamento se utiliza para el tratamiento tópico (en la piel) de la queratosis actínica, también denominada queratosis solar, en adultos. La queratosis actínica consiste en zonas ásperas de la piel que aparecen en personas que se han expuesto mucho al sol durante su vida. Picato 150 microgramos/gramo gel se utiliza para el tratamiento de la queratosis actínica en cara y cuero cabelludo.
2. Qué necesita saber antes de empezar a usar Picato
No use Picato
- Si es alérgico a ingenol mebutato o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
Advertencias y precauciones
- No ponga Picato en contacto con sus ojos. Lávese las manos cuidadosamente después de haberse aplicado el gel. Lávese las manos de nuevo si se toca la zona donde se aplicó el gel. Tenga cuidado de que el gel no se transfiera desde la zona de tratamiento a sus ojos. En caso de contacto accidental, retire el gel lavando con abundante agua y solicite atención médica tan pronto como sea posible.
- No ingiera este medicamento. Beba abundante agua si accidentalmente ingiere este medicamento y solicite atención médica.
- Asegúrese de que su piel está recuperada de cualquier otro tratamiento farmacológico o quirúrgico anterior, antes de usar este medicamento. No aplique Picato sobre heridas abiertas o piel lesionada.
- No aplique este medicamento internamente, en la zona cercana a los ojos, en el interior de las fosas nasales, en el interior de los oídos ni en los labios.
- Evite la luz solar lo máximo posible (incluyendo lámparas de sol artificial y cabinas de bronceado).
- Este medicamento es para tratar una zona de 25 cm2 durante tres días. Esto debe cumplirse estrictamente.
- No aplique más gel que el indicado por su médico.
- Es de esperar que se produzcan reacciones locales en la piel, tales como enrojecimiento e hinchazón, tras el tratamiento con este medicamento (ver sección 4). Consulte a su médico si estas reacciones locales en la piel se agravan.
Niños y adolescentes
La queratosis actínica no se produce en niños, y este medicamento no debe emplearse en niños y adolescentes menores de 18 años.
Uso de Picato con otros medicamentos
Informe a su médico o farmacéutico si está utilizando, ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento.
Si previamente ha utilizado Picato u otros medicamentos similares, informe a su médico antes de iniciar el tratamiento.
Embarazo y lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico antes de utilizar este medicamento. Debe evitar el empleo de Picato si está embarazada.
Si está dando el pecho, evite el contacto físico del bebé con la zona tratada durante un periodo de 6 horas tras la aplicación de este medicamento.
Conducción y uso de máquinas
Este medicamento no afecta a su capacidad para conducir o para utilizar máquinas.
3. Cómo usar Picato
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico.
En caso de duda, consulte de nuevo a su médico o farmacéutico.
Si se le han recetado dos dosis diferentes para el tratamiento de dos zonas distintas, se debe asegurar
que emplea la dosis recetada en la zona correcta.
- El tratamiento de la queratosis actínica en la cara y cuero cabelludo consiste en la aplicación de un tubo de Picato 150 microgramos/g gel (que contiene 70 microgramos de ingenol mebutato) una vez al día durante 3 días seguidos.
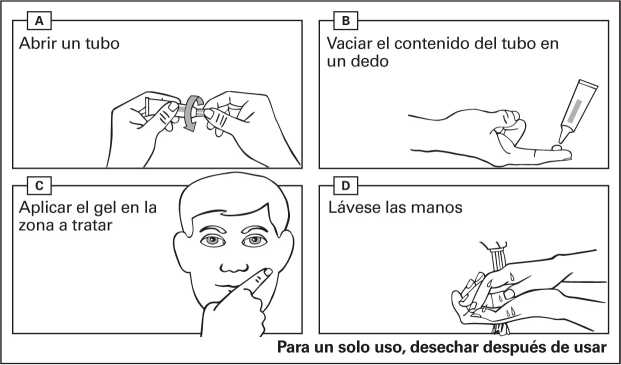
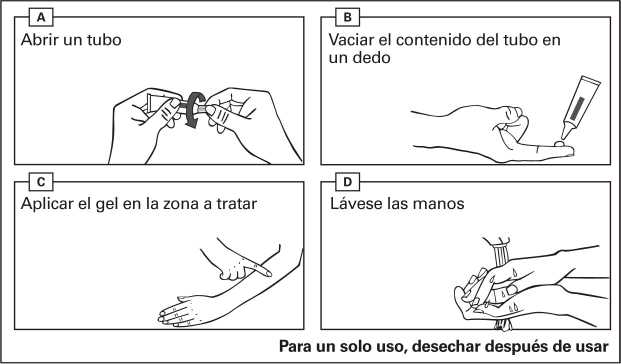
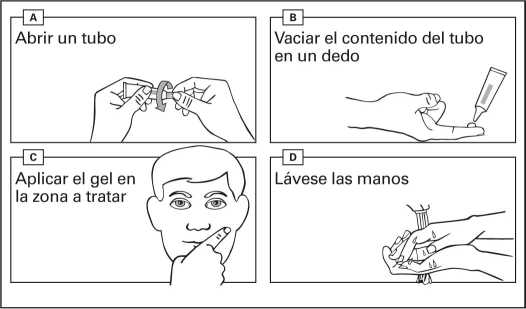
Instrucciones de uso:
- Abra un tubo nuevo cada vez que use este medicamento. Retire el tapón del tubo en el momento de su uso.
- Vacíe el gel de un tubo en la punta de su dedo.
- Aplique el contenido de un tubo en una zona de 25 cm2 (p. ej. 5 cm x 5 cm).
- Extienda el gel suavemente sobre la zona a tratar.
- Deje que la zona se seque durante 15 minutos. Evite tocar la zona tratada durante las 6 horas siguientes a la aplicación del medicamento.
- Lávese las manos con agua y jabón inmediatamente después de la aplicación del gel, y también entre administraciones si se han recetado dos dosis diferentes para dos zonas distintas.
- No aplique este medicamento inmediatamente después de ducharse ni en las 2 horas previas a acostarse.
- No lave las zonas donde se ha aplicado el gel durante al menos las 6 horas siguientes a su aplicación.
No se toque la zona tratada ni permita que nadie ni ninguna mascota la toque durante un periodo de 6 horas después de aplicar el gel.
No cubra la zona tratada con vendajes oclusivos tras la aplicación de este medicamento.
El efecto completo de Picato puede evaluarse aproximadamente 8 semanas después del tratamiento.
Si usa más Picato del que debe
Consulte a su médico o farmacéutico si ha usado más Picato del que debe.
Si olvida usar Picato
Consulte a su médico o farmacéutico si olvida usar Picato.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Tras el uso de este medicamento, es probable que la zona de la piel donde se lo aplica se enrojezca, se descame y se formen costras. Estos efectos adversos muy a menudo se producen durante el primer día de la aplicación de este medicamento. Los efectos adversos pueden empeorar hasta una semana después de la finalización del empleo de este medicamento. Éstos habitualmente mejoran durante las 2 semanas siguientes al inicio del tratamiento.
Puede producirse infección de la piel en la zona tratada (se ha notificado como un efecto adverso frecuente, que puede afectar hasta 1 de cada 10 personas, cuando se trata la cara y el cuero cabelludo).
La hinchazón en el lugar de aplicación es muy frecuente (se ha observado en más de 1 de cada 10 personas). La hinchazón en el lugar de aplicación, cuando se aplica en la cara o en el cuero cabelludo, puede alcanzar la zona de los ojos.
Si los síntomas antes descritos se intensifican después de la primera semana de la finalización del empleo de este medicamento, o si se produce supuración, puede ser que tenga una infección y debe consultar a su médico o farmacéutico.
Efectos adversos que ocurren con mayor frecuencia cuando se trata la cara y el cuero cabelludo:
Efectos adversos muy frecuentes en la zona de tratamiento, que pueden afectar a más de 1 de cada 10 personas:
En la zona de tratamiento:
- Parte de la capa externa de su piel puede desprenderse (erosión)
- Ampollas (vesículas, pústulas)
- Hinchazón
- Descamación (exfoliación)
- Costras
- Enrojecimiento debido a la dilatación de pequeños vasos sanguíneos (eritema)
- Dolor (incluyendo sensación de quemazón en el lugar de aplicación)
Efectos adversos que ocurren con mayor frecuencia cuando se trata el tronco y las extremidades:
Efectos adversos muy frecuentes en la zona de tratamiento, que pueden afectar a más de 1 de cada 10 personas:
En la zona de tratamiento:
- Parte de la capa externa de su piel puede desprenderse (erosión)
- Ampollas (vesículas, pústulas)
- Hinchazón
- Descamación (exfoliación)
- Costras
- Enrojecimiento debido a la dilatación de pequeños vasos sanguíneos (eritema)
Otros posibles efectos adversos cuando se trata la cara y el cuero cabelludo:
Efectos adversos frecuentes, que pueden afectar hasta 1 de cada 10 personas:
En la zona de tratamiento:
- Picor (prurito)
- Irritación
Otros efectos adversos:
- Inflamación alrededor del ojo (edema periorbitario)
- Inflamación (edema) del párpado
- Dolor de cabeza
Efectos adversos poco frecuentes, que pueden afectar hasta 1 de cada 100 personas:
En la zona de tratamiento:
- Hormigueo o insensibilidad (parestesia)
- Úlceras
- Secreción de líquido
- Cambio del color de la piel (cambio de la pigmentación)
Otros efectos adversos:
- Dolor en el ojo
- Reacción alérgica que puede incluir hinchazón de boca, lengua o garganta
- Lesión o irritación de la superficie del ojo (córnea, conjuntiva) tras exposición accidental
Otros posibles efectos adversos cuando se trata el tronco y las extremidades:
Efectos adversos frecuentes, que pueden afectar hasta 1 de cada 10 personas:
En la zona de tratamiento:
- Picor (prurito)
- Irritación
- Dolor (incluyendo sensación de quemazón en el lugar de aplicación)
Efectos adversos poco frecuentes, que pueden afectar hasta 1 de cada 100 personas:
En la zona de tratamiento:
- Hormigueo o insensibilidad (parestesia)
- Úlceras
- Cambio del color de la piel (cambio de la pigmentación)
- Calor
Otros efectos adversos:
- Reacción alérgica que puede incluir hinchazón de boca, lengua o garganta
- Lesión o irritación de la superficie del ojo (córnea, conjuntiva) tras exposición accidental
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Picato
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la caja y en el tubo después de CAD. La fecha de caducidad es el último día del mes que se indica.
Conservar en nevera (entre 2°C y 8°C).
Para un solo uso. Los tubos no deben reutilizarse una vez abiertos.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de Picato
- El principio activo es ingenol mebutato. Cada gramo de gel contiene 150 microgramos de ingenol mebutato. Cada tubo contiene 70 microgramos de ingenol mebutato en 0,47 g de gel.
- Los demás componentes son alcohol isopropílico, hidroxietilcelulosa, ácido cítrico monohidrato, citrato de sodio, alcohol bencílico y agua purificada.
Aspecto del producto y contenido del envase
Picato 150 microgramos/g gel es transparente e incoloro y cada caja contiene 3 tubos con 0,47 g de gel en cada uno.
Titular de la autorización de comercialización y responsable de la fabricación
Titular de la autorización de comercialización
LEO Pharma A/S Industriparken 55 DK-2750 Ballerup Dinamarca
Responsable de la fabricación
LEO Laboratories Ltd.
285 Cashel Road, Crumlin, Dublín 12 Irlanda
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
|
Belgie/Belgique/Belgien LEO Pharma N.V./S.A Tél/Tel: +32 3 740 7868 |
Lietuva LEO Pharma A/S Tel: +45 44 94 58 88 |
|
Etnrapna Borola Ltd Ten.: +359 2 9156 136 |
Luxembourg/Luxemburg LEO Pharma N.V./S.A Tél/Tel: +32 3 740 7868 |
|
Ceská republika LEO Pharma s.r.o. Tel: +420 225 992 272 |
Magyarország LEO Pharma Tel: +36 1 888 0525 |
|
Danmark LEO Pharma AB Tlf: +45 70 22 49 11 |
Malta PHARMA-COS LTD Tel: +356 2144 1870 |
|
Deutschland LEO Pharma GmbH Tel: +49 6102 2010 |
Nederland LEO Pharma B.V. Tel: +31 205104141 |
|
Eesti LEO Pharma A/S Tel: +45 44 94 58 88 |
Norge LEO Pharma AS Tlf: +47 22514900 |
|
EXXáSa LEO Pharmaceutical Hellas S.A. Tn^: +30 210 68 34322 |
Osterreich LEO Pharma GmbH Tel: +43 1 503 6979 |
|
España Laboratorios LEO Pharma, S.A. Tel: +34 93 221 3366 |
Polska LEO Pharma Sp. z o.o. Tel.: +48 22 244 18 40 |
|
France LEO Pharma Tél: +33 1 3014 4000 |
Portugal LEO Farmacéuticos Lda. Tel: +351 21 711 0760 |
|
Hrvatska Remedia d.o.o Tel: +385 1 3778 770 |
Romania LEO Pharma Romania Tel: +40 213121963 |
|
Ireland LEO Pharma Tel: +353 1 490 8924 |
Slovenija PHARMAGAN d.o.o. Tel: +386 4 2366 700 |
|
Ísland Vistor hf. Sími: +354 535 7000 |
Slovenská republika LEO Pharma s.r.o. Tel: +421 2 5939 6236 |
|
Italia LEO Pharma S.p.A Tel: +39 06 52625500 |
Suomi/Finland LEO Pharma Oy Puh/Tel: +358 20 721 8440 |
|
Kúnpoq The Star Medicines Importers Co. Ltd. Tn^: +357 2537 1056 |
Sverige LEO Pharma AB Tel: +46 40 3522 00 |
|
Latvija |
United Kingdom |
LEO Pharma A/S Tel: +45 44 94 58 88
LEO Laboratories Ltd Tel: +44 1844 347333
Fecha de la última revisión de este prospecto:
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
Prospecto: información para el paciente
Picato 500 microgramos/gramo gel
Ingenol mebutato
▼ Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Puede contribuir comunicando los efectos adversos que pudiera usted tener. La parte final de la sección 4 incluye información sobre cómo comunicar estos efectos adversos.
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es Picato y para qué se utiliza
2. Qué necesita saber antes de empezar a usar Picato
3. Cómo usar Picato
4. Posibles efectos adversos
5. Conservación de Picato
6. Contenido del envase e información adicional
1. Qué es Picato y para qué se utiliza
Picato contiene ingenol mebutato como principio activo.
Este medicamento se utiliza para el tratamiento tópico (en la piel) de la queratosis actínica, también denominada queratosis solar, en adultos. La queratosis actínica consiste en zonas ásperas de la piel que aparecen en personas que se han expuesto mucho al sol durante su vida. Picato 500 microgramos/gramo gel se utiliza para el tratamiento de la queratosis actínica en cuerpo, brazos, manos y piernas.
2. Qué necesita saber antes de empezar a usar Picato
No use Picato
- Si es alérgico a ingenol mebutato o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
Advertencias y precauciones
- No ponga Picato en contacto con sus ojos. Lávese las manos cuidadosamente después de haberse aplicado el gel. Lávese las manos de nuevo si se toca la zona donde se aplicó el gel. Tenga cuidado de que el gel no se transfiera desde la zona de tratamiento a sus ojos. En caso de contacto accidental, retire el gel lavando con abundante agua y solicite atención médica tan pronto como sea posible.
- No ingiera este medicamento. Beba abundante agua si accidentalmente ingiere este medicamento y solicite atención médica.
- Asegúrese de que su piel está recuperada de cualquier otro tratamiento farmacológico o quirúrgico anterior, antes de usar este medicamento. No aplique Picato sobre heridas abiertas o piel lesionada.
- No aplique este medicamento internamente, en la zona cercana a los ojos, en el interior de las fosas nasales, en el interior de los oídos ni en los labios.
- Evite la luz solar lo máximo posible (incluyendo lámparas de sol artificial y cabinas de bronceado).
- Este medicamento es para tratar una zona de 25 cm2 durante dos días. Esto debe cumplirse estrictamente.
- No aplique más gel que el indicado por su médico.
- Es de esperar que se produzcan reacciones locales en la piel, tales como enrojecimiento e hinchazón, tras el tratamiento con este medicamento (ver sección 4). Consulte a su médico si estas reacciones locales en la piel se agravan.
Niños y adolescentes
La queratosis actínica no se produce en niños, y este medicamento no debe emplearse en niños y adolescentes menores de 18 años.
Uso de Picato con otros medicamentos
Informe a su médico o farmacéutico si está utilizando, ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento.
Si previamente ha utilizado Picato u otros medicamentos similares, informe a su médico antes de iniciar el tratamiento.
Embarazo y lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico antes de utilizar este medicamento. Debe evitar el empleo de Picato si está embarazada.
Si está dando el pecho, evite el contacto físico del bebé con la zona tratada durante un periodo de 6 horas tras la aplicación de este medicamento.
Conducción y uso de máquinas
Este medicamento no afecta a su capacidad para conducir o para utilizar máquinas.
3. Cómo usar Picato
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico.
En caso de duda, consulte de nuevo a su médico o farmacéutico.
Si se le han recetado dos dosis diferentes para el tratamiento de dos zonas distintas, se debe asegurar
que emplea la dosis recetada en la zona correcta.
- El tratamiento de la queratosis actínica en el cuerpo, brazos, manos y piernas consiste en la aplicación de un tubo de Picato 500 microgramos/g gel (que contiene 235 microgramos de ingenol mebutato) una vez al día durante 2 días seguidos.
Instrucciones de uso:
- Abra un tubo nuevo cada vez que use este medicamento. Retire el tapón del tubo en el momento de su uso.
- Vacíe el gel de un tubo en la punta de su dedo.
- Aplique el contenido de un tubo en una zona de 25 cm2 (p. ej. 5 cm x 5 cm).
- Extienda el gel suavemente sobre la zona a tratar.
- Deje que la zona se seque durante 15 minutos. Evite tocar la zona tratada durante las 6 horas siguientes a la aplicación del medicamento.
- Lávese las manos con agua y jabón inmediatamente después de la aplicación del gel, y también entre administraciones si se han recetado dos dosis diferentes para dos zonas distintas. Si se está tratando las manos, debe lavarse únicamente la punta del dedo con la que se ha aplicado el gel.
- No aplique este medicamento inmediatamente después de ducharse ni en las 2 horas previas a acostarse.
No lave las zonas donde se ha aplicado el gel durante al menos las 6 horas siguientes a su aplicación.
No se toque la zona tratada ni permita que nadie ni ninguna mascota la toque durante un periodo de 6 horas después de aplicar el gel.
No cubra la zona tratada con vendajes oclusivos tras la aplicación de este medicamento.
El efecto completo de Picato puede evaluarse aproximadamente 8 semanas después del tratamiento.
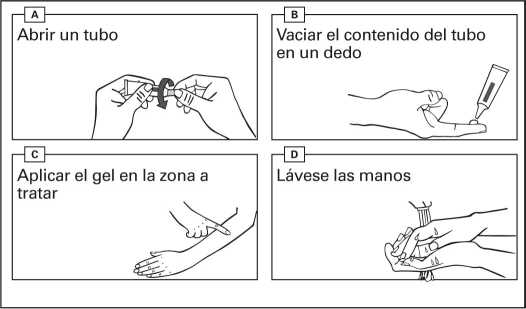
Si usa más Picato del que debe
Consulte a su médico o farmacéutico si ha usado más Picato del que debe.
Si olvida usar Picato
Consulte a su médico o farmacéutico si olvida usar Picato.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Tras el uso de este medicamento, es probable que la zona de la piel donde se lo aplica se enrojezca, se descame y se formen costras. Estos efectos adversos muy a menudo se producen durante el primer día de la aplicación de este medicamento. Los efectos adversos pueden empeorar hasta una semana después de la finalización del empleo de este medicamento. Éstos habitualmente mejoran durante las 4 semanas siguientes al inicio del tratamiento.
Puede producirse infección de la piel en la zona tratada (se ha notificado como un efecto adverso frecuente, que puede afectar hasta 1 de cada 10 personas, cuando se trata la cara y el cuero cabelludo).
La hinchazón en el lugar de aplicación es muy frecuente (se ha observado en más de 1 de cada 10 personas). La hinchazón en el lugar de aplicación, cuando se aplica en la cara o en el cuero cabelludo, puede alcanzar la zona de los ojos.
Si los síntomas antes descritos se intensifican después de la primera semana de la finalización del empleo de este medicamento, o si se produce supuración, puede ser que tenga una infección y debe consultar a su médico o farmacéutico.
Efectos adversos que ocurren con mayor frecuencia cuando se trata la cara y el cuero cabelludo:
Efectos adversos muy frecuentes en la zona de tratamiento, que pueden afectar a más de 1 de cada 10 personas:
En la zona de tratamiento:
- Parte de la capa extema de su piel puede desprenderse (erosión)
- Ampollas (vesículas, pústulas)
- Hinchazón
- Descamación (exfoliación)
- Costras
- Enrojecimiento debido a la dilatación de pequeños vasos sanguíneos (eritema)
- Dolor (incluyendo sensación de quemazón en el lugar de aplicación)
Efectos adversos que ocurren con mayor frecuencia cuando se trata el tronco y las extremidades:
Efectos adversos muy frecuentes en la zona de tratamiento, que pueden afectar a más de 1 de cada 10 personas:
En la zona de tratamiento:
- Parte de la capa externa de su piel puede desprenderse (erosión)
- Ampollas (vesículas, pústulas)
- Hinchazón
- Descamación (exfoliación)
- Costras
- Enrojecimiento debido a la dilatación de pequeños vasos sanguíneos (eritema)
Otros posibles efectos adversos cuando se trata la cara y el cuero cabelludo:
Efectos adversos frecuentes, que pueden afectar hasta 1 de cada 10 personas:
En la zona de tratamiento:
- Picor (prurito)
- Irritación
Otros efectos adversos:
- Inflamación alrededor del ojo (edema periorbitario)
- Inflamación (edema) del párpado
- Dolor de cabeza
Efectos adversos poco frecuentes, que pueden afectar hasta 1 de cada 100 personas:
En la zona de tratamiento:
- Hormigueo o insensibilidad (parestesia)
- Úlceras
- Secreción de líquido
- Cambio del color de la piel (cambio de la pigmentación)
Otros efectos adversos:
- Dolor en el ojo
- Reacción alérgica que puede incluir hinchazón de boca, lengua o garganta
- Lesión o irritación de la superficie del ojo (córnea, conjuntiva) tras exposición accidental
Otros posibles efectos adversos cuando se trata el tronco y las extremidades:
Efectos adversos frecuentes, que pueden afectar hasta 1 de cada 10 personas:
En la zona de tratamiento:
- Picor (prurito)
- Irritación
- Dolor (incluyendo sensación de quemazón en el lugar de aplicación)
Efectos adversos poco frecuentes, que pueden afectar hasta 1 de cada 100 personas:
En la zona de tratamiento:
- Hormigueo o insensibilidad (parestesia)
- Úlceras
- Cambio del color de la piel (cambio de la pigmentación)
Calor
Otros efectos adversos:
- Reacción alérgica que puede incluir hinchazón de boca, lengua o garganta
- Lesión o irritación de la superficie del ojo (córnea, conjuntiva) tras exposición accidental
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Picato
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la caja y en el tubo después de CAD. La fecha de caducidad es el último día del mes que se indica.
Conservar en nevera (entre 2°C y 8°C).
Para un solo uso. Los tubos no deben reutilizarse una vez abiertos.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de Picato
- El principio activo es ingenol mebutato. Cada gramo de gel contiene 500 microgramos de ingenol mebutato. Cada tubo contiene 235 microgramos de ingenol mebutato en 0,47 g de gel.
- Los demás componentes son alcohol isopropílico, hidroxietilcelulosa, ácido cítrico monohidrato, citrato de sodio, alcohol bencílico y agua purificada.
Aspecto del producto y contenido del envase
Picato 500 microgramos/g gel es transparente e incoloro y cada caja contiene 2 tubos con 0,47 g de gel en cada uno.
Titular de la autorización de comercialización y responsable de la fabricación
Titular de la autorización de comercialización
LEO Pharma A/S Industriparken 55 DK-2750 Ballerup Dinamarca
Responsable de la fabricación
LEO Laboratories Ltd.
285 Cashel Road, Crumlin, Dublín 12 Irlanda
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
|
Belgie/Belgique/Belgien LEO Pharma N.V./S.A Tél/Tel: +32 3 740 7868 |
Lietuva LEO Pharma A/S Tel: +45 44 94 58 88 |
|
Etarapna Borola Ltd Tea.: +359 2 9156 136 |
Luxembourg/Luxemburg LEO Pharma N.V./S.A Tél/Tel: +32 3 740 7868 |
|
Ceská republika LEO Pharma s.r.o. Tel: +420 225 992 272 |
Magyarország LEO Pharma Tel: +36 1 888 0525 |
|
Danmark LEO Pharma AB Tlf: +45 70 22 49 11 |
Malta PHARMA-COS LTD Tel: +356 2144 1870 |
|
Deutschland LEO Pharma GmbH Tel: +49 6102 2010 |
Nederland LEO Pharma B.V. Tel: +31 205104141 |
|
Eesti LEO Pharma A/S Tel: +45 44 94 58 88 |
Norge LEO Pharma AS Tlf: +47 22514900 |
|
EXXáSa LEO Pharmaceutical Hellas S.A. T^: +30 210 68 34322 |
Osterreich LEO Pharma GmbH Tel: +43 1 503 6979 |
|
España Laboratorios LEO Pharma, S.A. Tel: +34 93 221 3366 |
Polska LEO Pharma Sp. z o.o. Tel.: +48 22 244 18 40 |
|
France LEO Pharma Tél: +33 1 3014 4000 |
Portugal LEO Farmacéuticos Lda. Tel: +351 21 711 0760 |
|
Hrvatska Remedia d.o.o Tel: +385 1 3778 770 |
Romania LEO Pharma Romania Tel: +40 213121963 |
|
Ireland LEO Pharma Tel: +353 1 490 8924 |
Slovenija PHARMAGAN d.o.o. Tel: +386 4 2366 700 |
|
Ísland Vistor hf. Sími: +354 535 7000 |
Slovenská republika LEO Pharma s.r.o. Tel: +421 2 5939 6236 |
|
Italia LEO Pharma S.p.A Tel: +39 06 52625500 |
Suomi/Finland LEO Pharma Oy Puh/Tel: +358 20 721 8440 |
|
Kúnpoq The Star Medicines Importers Co. Ltd. |
Sverige LEO Pharma AB |
Latvija
LEO Pharma A/S Tel: +45 44 94 58 88
United Kingdom
LEO Laboratories Ltd Tel: +44 1844 347333
Fecha de la última revisión de este prospecto:
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
ANEXO IV
CONCLUSIONES CIENTÍFICAS Y MOTIVOS PARA LA MODIFICACIÓN DE LAS CONDICIONES DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Conclusiones científicas
Teniendo en cuenta lo dispuesto en el Informe de Evaluación del Comité para la Evaluación de Riesgos en Farmacovigilancia (PRAC) sobre el informe periódico de seguridad (IPS) para ingenol mebutato, las conclusiones científicas del Comité de Medicamentos de Uso Humano (CHMP) son las siguientes:
Tras una revisión acumulada, se han documentado casos que sugieren claramente hipersensibilidad a ingenol mebutato, incluyendo casos de angioedema. Se considera que la información del producto debe ser actualizada para añadir hipersensibilidad incluyendo angioedema.
Además, tras la notificación de conjuntivitis química y quemaduras corneales debido a un contacto accidental de ingenol mebutato con los ojos, la información del producto debe actualizarse para proporcionar una advertencia sobre este riesgo a los prescriptores y a los pacientes.
Además, se han recibido informes post-comercialización de cambios de pigmentación tras la utilización de ingenol mebutato, incluyendo tanto hipo como hiperpigmentación. En algunos casos los cambios no se resuelven pasado un año tras el tratamiento. Tras una revisión acumulada por el TAC, el PRAC acordó que la información del producto debía actualizarse para añadir esta reacción adversa. Por tanto, teniendo en cuenta los datos presentados en esta revisión del IPS, el PRAC considera que los cambios en la información del producto de los medicamentos conteniendo ingenol mebutato están justificados.
El CHMP está de acuerdo con las conclusiones científicas del PRAC.
Motivos para la modificación de las condiciones de la autorización de comercialización
De acuerdo con las conclusiones científicas para ingenol mebutato, el CHMP considera que el balance beneficio-riesgo de los medicamentos que contienen ingenol mebutato no varía sujeto a los cambios propuestos en la información del producto.
El CHMP recomienda que se modifiquen las condiciones de la autorización de comercialización.
50