Physioneal 40 Glucosa 1,36% P/V / 13,6 Mg/Ml Clear-Flex Solucion Para Dialisis Peritoneal
1. NOMBRE DEL MEDICAMENTO
Physioneal 40 Glucosa 1,36% p/v / 13,6 mg/ml Clear-Flex Solución para diálisis peritoneal
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Antes de mezclado:
|
1000 ml de solución electrolítica (cámara “A” grande) contiene: Principios activos: Glucosa monohidrato |
20,0 |
g |
|
equivalente a Glucosa anhidra |
18,2 |
g |
|
Cloruro de calcio dihidrato |
0,245 |
g |
|
Cloruro de magnesio hexahidrato |
0,068 |
g |
|
1000 ml de solución tampón (cámara “B” pequeña) contiene: Principios activos: Cloruro de sodio |
19,95 |
g |
|
Bicarbonato sódico |
9,29 |
g |
|
Solución de S-Lactato de sodio |
6,73 |
g |
Después de mezclado:
|
1000 ml de solución mezclada | |
|
contiene: | |
|
Principios activos: | |
|
Glucosa monohidrato |
15,0 g |
|
equivalente a Glucosa anhidra |
13,6 g |
|
Cloruro de sodio |
5,38 g |
|
Cloruro de calcio dihidrato |
0,184 g |
|
Cloruro de magnesio hexahidrato |
0,051 g |
|
Bicarbonato sódico |
2,10 g |
|
Solución de S-Lactato de sodio |
1,68 g |
1000 ml de solución final después de mezclado se corresponde con 750 ml de solución A y 250 ml de solución B.

Glucosa anhidra (C6Hi2O6) Na+
Ca++
Mg++
Cl-
HCO3-
C3H5O3-
3h5o3
75,5mmol/l 132 mmol/l 1,25mmol/l 0,25mmol/l 95 mmol/l 25 mmol/l 15 mmol/l
Para consultar la lista completa de excipientes ver sección 6.1.
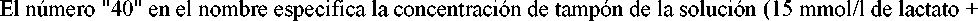
25 mmol/l de bicarbonato = 40 mmol/l).
3. FORMA FARMACÉUTICA
Solución para diálisis peritoneal. Solución incolora, transparente y estéril. El pH de la solución final es 7,4. Osmolaridad 344 mOsmol/l
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
PHYSIONEAL 40 está indicado en aquellos casos en los que se emplee la diálisis peritoneal, incluyendo:
- Insuficiencia renal aguda y crónica
- Retención hídrica grave
- Desequilibrio electrolítico grave
- Intoxicación por medicamentos con sustancias dializables, cuando no se dispone de una alternativa terapéutica más adecuada.
Las soluciones de diálisis peritoneal PHYSIONEAL 40 de bicarbonato/lactato con pH fisiológico están especialmente indicadas en pacientes en los que las soluciones únicamente de tampón lactato, con pH bajo, causan dolor abdominal a la entrada y/o molestias.
4.2 Posología y forma de administración
4.2.1 Posología
El médico debe seleccionar el modo de terapia, la frecuencia del tratamiento, el volumen de intercambio, el tiempo de permanencia y la duración de la diálisis.
Adultos: los pacientes en tratamiento con diálisis peritoneal continua ambulatoria (DPCA) habitualmente realizan 4 intercambios por día (24 horas). Los pacientes en tratamiento con diálisis peritoneal
Agencia esparto» de medicamentos y productos saratanos
automatizada (DPA) habitualmente realizan 4-5 ciclos por la noche y hasta 2 intercambios durante el día. El volumen de llenado depende del tamaño corporal, normalmente de 2,0 a 2,5 litros.
Personas de edad avanzada: como en adultos.
Población pediátrica (pacientes desde recién nacidos prematuros hasta adolescentes):
No se han evaluado pacientes pediátricos en estudios clínicos con PHYSIONEAL 40. Por lo tanto, los beneficios clínicos de PHYSIONEAL 40 deben sopesarse frente al riesgo de efectos adversos en esta categoría de pacientes.
El uso de Physioneal 40 en envase Clear-Flex no se recomienda en niños que requieren un volumen de llenado < 1600 ml debido al riesgo de no detectar una posible mala perfusión (administración de la cámara pequeña solamente). - Ver sección 4.4.
Se aconseja seleccionar la solución de diálisis peritoneal con nivel más bajo de osmolaridad compatible con los requisitos de eliminación de fluidos para cada intercambio, con el objeto de evitar el riesgo de deshidratación grave, hipovolemia y para reducir la pérdida de proteínas.
4.2.2 Forma de administración
Precauciones que se deben tomar antes de manipular o administrar el medicamento.
• PHYSIONEAL 40 es sólo para administración intraperitoneal. No utilizar para administración intravenosa.
• Las soluciones de diálisis peritoneal deben calentarse a 37 °C para mayor comodidad del paciente. No obstante, sólo debe utilizarse calor seco (por ejemplo, con una placa de calor o una placa térmica). Las soluciones no deben calentarse en agua o en un microondas ya que podría resultar incómodo para el paciente o producirle daños.
• Se debe utilizar una técnica aséptica durante todo el procedimiento de diálisis peritoneal.
• No administrar si la solución está coloreada, turbia, contiene partículas en suspensión, muestra signos de fugas entre las cámaras o en el exterior, o bien si los sellados no están intactos.
• Debe inspeccionarse el líquido drenado para comprobar si está turbio o si contiene fibrina, lo que podría indicar la presencia de peritonitis.
• Para un solo uso.
• Una vez retirada la sobrebolsa, romper inmediatamente el sellado largo (sellado entre las cámaras) para mezclar las dos soluciones y después romper el sellado corto Safety Moon (sellado junto al acceso) para permitir la administración de la solución mezclada. La solución intraperitoneal debe perfundirse dentro de las 24 h. siguientes a su mezclado.
• Para más información sobre el uso del medicamento ver sección 6.6 Precauciones especiales de eliminación y otras manipulaciones.
4.3 Contraindicaciones
Hipersensibilidad a los principios activos o a alguno de los excipientes incluidos en la sección 6.1.
PHYSIONEAL 40 no debe utilizarse en pacientes con:
• defectos mecánicos incorregibles que eviten una DP eficaz o aumenten el riesgo de infección
pérdida documentada de la función peritoneal o adherencias extensas que comprometan la función peritoneal
4.4 Advertencias y precauciones especiales de empleo
• La diálisis peritoneal se debe realizar con precaución a pacientes con: 1) alteraciones abdominales, incluyendo daño de la membrana peritoneal y del diafragma debido a una intervención quirúrgica, anomalías congénitas o traumatismos hasta que se haya completado su curación, tumores abdominales, infección de la pared abdominal, hernias, fístula fecal, colostomía o ileostomía, episodios frecuentes de diverticulitis, inflamación o isquemia intestinal , poliquistosis renal u otras alteraciones que afecten a la integridad de la pared abdominal, a la superficie abdominal o a la cavidad intra-abdominal; y 2) otras condiciones, incluyendo un injerto aórtico reciente y neumopatías graves.
• La esclerosis peritoneal encapsulante (EPE) es una complicación conocida y rara de de la terapia con diálisis peritoneal. Se ha notificado EPE en pacientes que están recibiendo soluciones de diálisis peritoneal, incluyendo a algunos pacientes que utilizan PHYSIONEAL 40 como parte de su terapia de diálisis peritoneal.
• Si se produce una peritonitis, la elección y la dosis de antibióticos deberán basarse en los resultados de los estudios de identificación y sensibilidad del organismo aislado, siempre que sea posible. Antes de la identificación de los organismos asociados, se pueden utilizar antibióticos de amplio espectro.
• Las soluciones que contienen glucosa derivada de almidón (maíz) hidrolizado se deben de utilizar con precaución en pacientes con alergia conocida al maíz o a los productos derivados del maíz. Pueden ocurrir reacciones de hipersensibilidad similares a las que aparecen con la alergia al almidón de maíz, incluyendo reacciones anafilácticas/anafilactoides. Detenga la administración inmediatamente y drene la solución de la cavidad peritoneal si se desarrollan signos o síntomas de una sospecha de reacción de hipersensibilidad. Se deben instaurar medidas terapéuticas compensatorias apropiadas que estén clínicamente indicadas.
• Los pacientes con niveles elevados de lactato deben utilizar con precaución las soluciones para diálisis peritoneal que contienen lactato. Se debe controlar la aparición de acidosis láctica en los pacientes que presenten situaciones clínicas conocidas que incrementen el riesgo de acidosis láctica [por ejemplo, hipotensión severa, sepsis, insuficiencia renal aguda, alteraciones congénitas del metabolismo, tratamiento con medicamentos como la metformina y nucleósidos y nucleótidos inhibidores de la transcriptasa inversa (NRTIs)] antes y durante el tratamiento con soluciones de diálisis peritoneal que contengan lactato.
• Cuando se prescribe la solución hay que tener en cuenta las posibles interacciones entre el tratamiento de diálisis peritoneal y los tratamientos de otras enfermedades existentes. Los niveles séricos de potasio deben monitorizarse cuidadosamente en los pacientes tratados con glucósidos cardíacos.
• En pacientes con hiperparatiroidismo secundario, deben considerarse detenidamente los beneficios y riesgos de utilizar soluciones de diálisis con 1,25 mmol/l de calcio como PHYSIONEAL 40, dado que pueden empeorar el hiperparatiroidismo.
• Debe mantenerse un exacto registro del equilibrio de fluidos y el peso del paciente debe monitorizarse cuidadosamente para evitar una hiper o hipohidratación con consecuencias graves que incluyen el fallo cardíaco congestivo, la depleción de volumen y shock.
• En pacientes con niveles de bicarbonato plasmático por encima de 30 mmol/l, debe valorarse el riesgo de una posible alcalosis metabólica frente al beneficio del tratamiento con este producto.
• Durante la diálisis peritoneal se pueden producir pérdidas de proteínas, aminoácidos y vitaminas hidrosolubles y otros medicamentos, lo que puede requerir de terapia de sustitución.
• Una administración excesiva de soluciones de PHYSIONEAL 40 en la cavidad peritoneal puede producir distensión abdominal/dolor abdominal y/o dificultad al respirar.
• El tratamiento para la administración excesiva de la solución para diálisis peritoneal consiste en drenar la solución de la cavidad peritoneal.
• El uso excesivo de la solución para diálisis peritoneal PHYSIONEAL 40 con un mayor contenido de dextrosa (glucosa) durante el tratamiento de diálisis puede producir una pérdida excesiva de agua del paciente.
• Las soluciones de PHYSIONEAL 40 no contienen potasio debido al riesgo de hiperpotasemia. La adición de cloruro potásico (hasta una concentración de 4 mEq/l) puede estar indicada cuando los niveles séricos de potasio sean normales o haya hipopotasemia para prevenir una hipopotasemia grave, y debe hacerse únicamente bajo supervisión médica después de haber controlado cuidadosamente los niveles séricos y totales de potasio.
• Se deben evaluar periódicamente las concentraciones de electrolitos en sangre (particularmente bicarbonato, potasio, magnesio, calcio y fosfato), los parámetros químicos sanguíneos (incluyendo la hormona paratiroidea y los parámetros lipídicos) y hematológicos.
• En pacientes con diabetes, se deben monitorizar los niveles de glucosa en sangre y se debe ajustar la dosis de insulina u otros tratamientos para la hiperglucemia.
• Una secuencia inadecuada del cebado o del pinzado puede producir la perfusión de aire dentro de la cavidad peritoneal, lo cual puede provocar dolor abdominal y/o peritonitis.
• Debe instruirse a los pacientes para abrir tanto el sellado largo como el corto previamente a la perfusión. Si se abre únicamente el sellado corto Safety Moon, la perfusión de la solución sin mezclar puede causar dolor abdominal, hipernatremia y alcalosis metabólica grave. En caso de perfusión de la solución sin mezclar, el paciente debe drenar la solución inmediatamente y utilizar una bolsa mezclada nuevamente.
Población pediátrica
• La eficacia y seguridad en pacientes pediátricos no se ha establecido.
4.5 Interacción con otros medicamentos y otras formas de interacción
- Durante la diálisis puede reducirse la concentración sanguínea de los medicamentos dializables. Debe considerarse una posible compensación de las pérdidas.
- Los niveles plasmáticos de potasio en pacientes que utilizan glucósidos cardíacos deben monitorizarse cuidadosamente dado que existe riesgo de intoxicación por digitálicos. Puede ser necesario el suplemento de potasio.
4.6 Fertilidad, embarazo y lactancia
4.6.1 Embarazo
No hay datos o estos son limitados relativos al uso de PHYSIONEAL 35 en mujeres embarazadas.
No se recomienda utilizar PHYSIONEAL 35 durante el embarazo, ni en mujeres en edad fértil que no estén utilizando métodos anticonceptivos.
4.6.2 Lactancia
Se desconoce si metabolitos de PHYSIONEAL 35 se excretan en la leche materna.
No se puede excluir el riesgo en recién nacidos/niños.
Se debe decidir si es necesario interrumpir la lactancia o interrumpir el tratamiento tras considerar el beneficio de la lactancia para el niño y el beneficio del tratamiento para la madre.
4.6.3 Fertilidad
No hay datos clínicos sobre la fertilidad.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
Los pacientes con insuficiencia renal terminal en tratamiento con diálisis peritoneal pueden sufrir reacciones adversas que podrían afectar a la capacidad de conducir o utilizar maquinaria.
4.8 Reacciones adversas
Las reacciones adversas (que aparecen en el 1% de los pacientes o más) notificadas en los ensayos clínicos y durante la fase post-comercialización se describen a continuación.
La reacción adversa más frecuentemente comunicada en los ensayos clínicos con PHYSIONEAL 40 fue alcalosis, produciéndose en aproximadamente el 10% de los pacientes. En la mayoría de los casos, estaba basada en los niveles de bicarbonato sérico únicamente y generalmente no estaba asociada con síntomas clínicos.
Las reacciones adversas que se detallan en esta sección se han clasificado utilizando el siguiente criterio recomendado de frecuencias: muy frecuentes (>1/10), frecuentes (> 1/100 a <1/10), poco frecuentes (> 1/1.000 a < 1/100), raras (> 1/10.000 a < 1/1.000), muy raras (< 1/10.000), frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
|
Clasificación de órganos del sistema |
Término preferido de |
Frecuencia |
|
(COS) |
MedDRA | |
|
Trastornos de la sangre y del sistema |
Eosinofilia |
Frecuencia no conocida |
|
linfático | ||
|
Trastornos del metabolismo y de |
Alcalosis |
Frecuentes |
|
la nutrición |
Hipopotasemia |
Frecuentes |
|
Retención de fluidos |
Frecuentes | |
|
Hipercalcemia |
Frecuentes | |
|
Hipervolemia |
Poco frecuentes | |
|
Anorexia |
Poco frecuentes | |
|
Deshidratación |
Poco frecuentes | |
|
Hiperglucemia |
Poco frecuentes | |
|
Acidosis láctica |
Poco frecuentes |
|
Trastornos psiquiátricos |
Insomnio |
Poco frecuentes |
|
Trastornos del sistema |
Vértigo |
Poco frecuentes |
|
nervioso |
Cefalea |
Poco frecuentes |
|
Trastornos vasculares |
Hipertensión |
Frecuentes |
|
Hipotensión |
Poco frecuentes | |
|
Trastornos respiratorios, torácicos y |
Disnea |
Poco frecuentes |
|
mediastínicos |
Tos |
Poco frecuentes |
|
Trastornos gastrointestinales |
Peritonitis |
Frecuentes |
|
Fallo de la membrana peritoneal |
Poco frecuentes | |
|
Dolor abdominal |
Poco frecuentes | |
|
Dispepsia |
Poco frecuentes | |
|
Flatulencia |
Poco frecuentes | |
|
Náuseas |
Poco frecuentes | |
|
Esclerosis peritoneal encapsulante |
Frecuencia no conocida | |
|
Efluente de dializado peritoneal turbio |
Frecuencia no conocida | |
|
Trastornos de la piel y del tejido |
Angioedema |
Frecuencia no conocida |
|
subcutáneo |
Erupción cutánea |
Frecuencia no conocida |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Dolor musculoesquelético |
Frecuencia no conocida |
|
Trastornos generales y alteraciones en |
Edema |
Frecuentes |
|
el lugar de administración |
Astenia |
Frecuentes |
|
Escalofríos |
Poco frecuentes | |
|
Edema facial |
Poco frecuentes | |
|
Hernia |
Poco frecuentes | |
|
Malestar general |
Poco frecuentes | |
|
Sed |
Poco frecuentes | |
|
Pirexia. |
Frecuencia no conocida | |
|
Exploraciones complementarias |
Aumento de peso |
Frecuentes |
|
Aumento de PCO2 |
Poco frecuentes |
Otras reacciones adversas de la diálisis peritoneal relacionadas con el procedimiento incluyen: peritonitis bacteriana, infección relacionada con el catéter, complicación relacionada con el catéter.
Notificación de sospechas de reacciones adversas
Es importante notificar las sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de FV de medicamentos de Uso Humano https://www.notificaram.es.
4.9 Sobredosis
Las posibles consecuencias de la sobredosis incluyen la hipervolemia, hipovolemia, alteraciones electrolíticas o hiperglucemia (en pacientes diabéticos). Ver sección 4.4.
Manejo de la sobredosis:
La hipervolemia se puede tratar utilizando soluciones para diálisis peritoneal hipertónicas y con restricción de fluidos.
La hipovolemia se puede tratar con reemplazo de fluidos de forma oral o intravenosa, dependiendo del grado de deshidratación.
Las alteraciones electrolíticas se tratarán en función del electrolito alterado que se ha verificado mediante un análisis de sangre. La alteración más probable, hipopotasemia, se puede tratar ingiriendo potasio o mediante la adición de cloruro potásico a la solución para diálisis peritoneal prescrita por el médico.
La hiperglucemia (en paciente diabéticos) se deberá tratar ajustando la dosis de insulina de acuerdo con el esquema de insulina prescrito por el médico.
Ver sección 4.4. para más información relativa a la perfusión excesiva de PHYSIONEAL 40 y su tratamiento.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Soluciones para diálisis peritoneal.
Código ATC: B05DB.
Para pacientes con insuficiencia renal, la diálisis peritoneal es un procedimiento de eliminación de sustancias tóxicas producidas por el metabolismo del nitrógeno y que normalmente se excretan por los riñones, y para ayudar a la regulación de fluidos y electrolitos así como al equilibrio ácido-base.
Este procedimiento se realiza administrando en la cavidad peritoneal fluido de diálisis peritoneal a través de un catéter. La glucosa produce una solución hiperosmolar con el plasma, creando un gradiente osmótico que facilita la eliminación de fluidos del plasma hacia la solución. Según los principios de ósmosis y difusión, a través de la membrana peritoneal se realiza la transferencia de sustancias entre los capilares peritoneales del paciente y el fluido de diálisis. Después del tiempo de permanencia, la solución se satura con sustancias tóxicas y debe cambiarse. Con la excepción del lactato, presente como precursor del bicarbonato, las concentraciones electrolíticas del fluido se han formulado para intentar normalizar las concentraciones electrolíticas del plasma. Los productos de desecho nitrogenados presentes en la sangre en elevada concentración, cruzan la membrana peritoneal hacia el fluido de diálisis. Más del 30% de los pacientes de los ensayos clínicos eran mayores de 65 años. La evaluación de los resultados obtenidos para este grupo no mostró ninguna diferencia con respecto a la del resto de los pacientes.
Estudios in vitro y ex vivo han mostrado una mejoría en los indicadores de biocompatibilidad de PHYSIONEAL 40 en comparación con soluciones estándar con lactato como tampón. Además, estudios clínicos en un número limitado de pacientes con dolor abdominal en la zona de entrada del catéter, han confirmado algunos beneficios sintomáticos. Sin embargo, a fecha de hoy, no se dispone de datos que indiquen que las complicaciones clínicas generales se reduzcan o que el uso regular de dichas soluciones pueda traducirse en beneficios significativos a largo plazo.
5.2 Propiedades farmacocinéticas
La glucosa, los electrolitos y el agua administrados intraperitonealmente se absorben en la sangre y se metabolizan por las vías habituales.
La glucosa se metaboliza (1 g de glucosa = 4 kilocalorías ó 17 kilojulios) en CO2 y H2O.
5.3 Datos preclínicos sobre seguridad
No hay datos preclínicos considerados relevantes para la seguridad clínica aparte de los datos incluidos en otras secciones de la ficha técnica.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Acido clorhídrico diluido (ajuste de pH)
Hidróxido sódico (ajuste de pH)
Agua para preparaciones inyectables.
6.2 Incompatibilidades
Este medicamento no se debe mezclar con otros medicamentos, excepto con los mencionados en la sección 6.6.
6.3 Periodo de validez
Periodo de validez:
2 años.
Periodo de validez después de mezclado:
El producto, una vez retirada su sobrebolsa y mezclado debe utilizarse dentro de las 24 horas siguientes.
6.4 Precauciones especiales de conservación
No conservar a temperatura inferior a 4°C.
6.5 Naturaleza y contenido del envase
La solución de PHYSIONEAL 40 se conserva en una bolsa bicompartimental (de dos cámaras) fabricada de una lámina coextruída (lámina Clear-flex) de polipropileno, poliamida y una mezcla de polipropileno, SEBS (estireno-etileno y butileno-estireno) y polietileno.
En la cámara superior se adhiere una toma de inyección para añadir medicación a la solución de glucosa con electrolitos. En la cámara inferior se adhiere una toma de válvula para la conexión a un equipo de administración adecuado para permitir los procedimientos de diálisis.
El conector lineo que puede encontrarse en la presentación en bolsa doble (Sistema de Desconexión Integrado) contiene un 10,5% de pomada de povidona iodada.
La bolsa se incluye dentro de una sobrebolsa transparente fabricada con copolímeros multicapa.
Volúmenes de envase después de su reconstitución: 1500 ml (1125 ml de solución A y 375 ml de solución B), 2000 ml (1500 ml de solución A y 500 ml de solución B), 2500 ml (1875 ml de solución A y 625 ml de solución B), 3000 ml (2250 ml de solución A y 750 ml de solución B), 4500 ml (3375 ml de solución A y 1125 ml de solución B), 5000 ml (3750 ml de solución A y 1250 ml de solución B).
La bolsa sencilla es una bolsa bicompartimental (de dos cámaras) (cámara A grande y cámara B pequeña, ver sección 2) para utilizarse en diálisis peritoneal automatizada. La bolsa doble es una bolsa bicompartimental (de dos cámaras) (cámara A grande y B pequeña, ver sección 2) con un Sistema de Desconexión Integrado con una bolsa adicional de drenaje vacía para utilizarse en diálisis peritoneal continua ambulatoria.
Puede que solamente estén comercializados algunos tamaños de envases.
|
1,5 l |
Caja de 5 unidades |
Bolsa sencilla bicompartimental |
Conector luer |
|
1,5 l |
Caja de 5 unidades |
Bolsa doble bicompartimental |
Conector luer |
|
1,5 l |
Caja de 5 unidades |
Bolsa doble bicompartimental |
Conector lineo |
|
1,5 l |
Caja de 6 unidades |
Bolsa sencilla bicompartimental |
Conector luer |
|
1,5 l |
Caja de 6 unidades |
Bolsa doble bicompartimental |
Conector luer |
|
1,5 l |
Caja de 6 unidades |
Bolsa doble bicompartimental |
Conector lineo |
|
2,0 l |
Caja de 4 unidades |
Bolsa sencilla bicompartimental |
Conector luer |
|
2,0 l |
Caja de 4 unidades |
Bolsa doble bicompartimental |
Conector luer |
|
2,0 l |
Caja de 4 unidades |
Bolsa doble bicompartimental |
Conector lineo |
|
2,0 l |
Caja de 5 unidades |
Bolsa sencilla bicompartimental |
Conector luer |
|
2,0 l |
Caja de 5 unidades |
Bolsa doble bicompartimental |
Conector luer |
|
2,0 l |
Caja de 5 unidades |
Bolsa doble bicompartimental |
Conector lineo |
|
2,5 l |
Caja de 3 unidades |
Bolsa sencilla bicompartimental |
Conector luer |
|
2,5 l |
Caja de 3 unidades |
Bolsa doble bicompartimental |
Conector luer |
|
2,5 l |
Caja de 3 unidades |
Bolsa doble bicompartimental |
Conector lineo |
|
2,5 l |
Caja de 4 unidades |
Bolsa sencilla bicompartimental |
Conector luer |
|
2,5 l |
Caja de 4 unidades |
Bolsa doble bicompartimental |
Conector luer |
|
2,5 l |
Caja de 4 unidades |
Bolsa doble bicompartimental |
Conector lineo |
|
3,0 l |
Caja de 3 unidades |
Bolsa sencilla bicompartimental |
Conector luer |
|
3,0 l |
Caja de 3 unidades |
Bolsa doble bicompartimental |
Conector luer |
|
3,0 l |
Caja de 3 unidades |
Bolsa doble bicompartimental |
Conector lineo |
|
4,5 l |
Caja de 2 unidades |
Bolsa sencilla bicompartimental |
Conector luer |
|
5,0 l |
Caja de 2 unidades |
Bolsa sencilla bicompartimental |
Conector luer |
|
5,0 l |
Caja de 2 unidades |
Bolsa sencilla bicompartimental |
Conector luer + Equipo Homechoice de DPA con conector lineo |
|
5,0 l |
Caja de 2 unidades |
Bolsa sencilla bicompartimental |
Conector luer + Equipo Homechoice de DPA con |
conector luer + carcasa y minicap.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Para obtener información detallada de las condiciones de administración, ver sección 4.2.
- Los pacientes reciben instrucciones detalladas sobre el procedimiento de intercambio de diálisis peritoneal por medio de entrenamiento en centros especializados antes de su uso doméstico.
- Una vez retirada la sobrebolsa, romper inmediatamente el sellado largo (sellado entre las cámaras) para mezclar las dos soluciones y después romper el sellado corto Safety Moon (sellado junto al acceso) para permitir la administración de la solución mezclada. La solución intraperitoneal debe perfundirse dentro de las 24 horas siguientes a su mezclado. Ver sección 4.2.
- Se ha demostrado una estabilidad física y química en uso durante 24 horas a 25°C para: cefazolina (750 mg/l), heparina (2500 Ul/l), heparina de bajo peso molecular (Innohep 2500 Ul/l), netilmicina (60 mg/l) y vancomicina (1000 mg/l).
- Se ha demostrado una estabilidad física y química en uso durante 6 horas a 25°C para insulina (Actrapid 4 Ul/l; 10 Ul/l, 20 Ul/l y 40 Ul/l).
- Se pueden añadir gentamicina (60 mg/l) y tobramicina (60 mg/l) si se utiliza la solución inmediatamente tras su adición
- Los medicamentos deben ser añadidos a través del sitio de adición de medicamentos situado en la cámara grande antes de romper el sellado. Antes de la adición debe comprobarse la compatibilidad del medicamento y debe tenerse en cuenta el pH y las sales de la solución. El producto debe utilizarse inmediatamente después de la adición de cualquier medicamento.
- Desechar cualquier solución restante no utilizada.
- La solución está libre de endotoxinas bacterianas.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Baxter, S.L.
Pouet de Camilo 2
46394 Ribarroja del Turia (Valencia)
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
66.306
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Diciembre 2008
10. FECHA DE LA REVISIÓN DEL TEXTO
Septiembre 2015