Pheburane 483Mg/G Granulado
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
1. NOMBRE DEL MEDICAMENTO
PHEBURANE 483 mg/g granulado
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada gramo de granulado contiene 483 mg de fenilbutirato de sodio Excipiente(s') con efecto conocido:
Por cada gramo de fenilbutirato de sodio, el granulado contiene 124 mg (5,4 mmol) de sodio y 768 mg de sacarosa.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Granulado.
Granulado blanco a blanquecino.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
PHEBURANE está indicado como terapia complementaria en el tratamiento prolongado de los trastornos del ciclo de la urea que cursan con déficit de carbamoilfosfato-sintetasa, ornitina-transcarbamoilasa o argininosuccinato-sintetasa.
Está indicado en pacientes con presentación neonatal (déficit enzimático completo que se manifiesta en los primeros 28 días de vida). También está indicado en pacientes con presentación tardía (déficit enzimático parcial que se manifiesta tras el primer mes de vida) con antecedentes de encefalopatía hiperamoniémica.
4.2 Posología y forma de administración
El tratamiento con PHEBURANE debe estar supervisado por un médico con experiencia en el tratamiento de los trastornos del ciclo de la urea.
Posología
La dosis diaria debe ajustarse de forma individual para cada paciente según su tolerancia a las proteínas y la ingesta diaria de proteínas necesaria para favorecer el crecimiento y el desarrollo.
La dosis diaria total habitual de fenilbutirato de sodio en la práctica clínica es de:
• 450 - 600 mg/kg/día en neonatos, lactantes y niños con un peso inferior a 20 kg.
• 9,9 - 13,0 g/m2/día en niños con un peso superior a 20 kg, adolescentes y adultos.
No se han establecido la seguridad y la eficacia de dosis superiores a 20 g/día.
Monitorización terapéutica:
Las concentraciones plasmáticas de amonio, arginina, aminoácidos esenciales (especialmente aminoácidos de cadena ramificada), carnitina y proteínas séricas deben mantenerse dentro de los límites de la normalidad. La glutamina plasmática debe mantenerse en niveles inferiores a
1.000 pmol/l.
Control nutricional:
El tratamiento con PHEBURANE debe combinarse con una restricción de proteínas en la dieta y, en algunos casos, con complementos de aminoácidos esenciales y carnitina.
A los pacientes a los que se haya diagnosticado un déficit de carbamoilfosfato-sintetasa u ornitina-transcarbamoilasa de presentación neonatal se les deberá administrar un complemento de citrulina o arginina a una dosis de 0,17 g/kg/día o 3,8 g/m2/día.
A los pacientes a los que se haya diagnosticado un déficit de argininosuccinato-sintetasa se les deberá administrar un complemento de arginina a una dosis de 0,4-0,7 g/kg/día u 8,8-15,4 g/m2/día.
En caso de que esté indicado un complemento calórico, se recomienda un producto libre de proteínas.
Poblaciones especiales
Insuficienciarenal y hepática
Dado que el metabolismo y la excreción del fenilbutirato de sodio afecta al hígado y a los riñones, PHEBURANE debe utilizarse con precaución en los pacientes con insuficiencia hepática o renal.
Forma de administración
PHEBURANE debe administrarse por vía oral. A causa de su lenta disolución, PHEBURANE no debe administrarse por sonda nasogástrica o mediante gastrostomía.
La dosis diaria total debe dividirse en cantidades iguales y administrarse con cada comida o biberón (p. ej., 4-6 veces al día en niños pequeños). El granulado se puede tragar directamentecon una bebida (agua, zumo de fruta, fórmulas para lactantes sin proteínas) o se puede añadir a una cucharada de alimentos sólidos (puré de patata o compota de manzana); en este caso, es importante que se tome inmediatamente, con el fin de conservar el enmascaramiento de sabor.
Se incluye una cucharilla de medida calibrada, que dosifica hasta 3 g de fenilbutirato de sodio mediante una graduación de 250 mg.
4.3 Contraindicaciones
• Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
• Embarazo.
• Lactancia.
4.4 Advertencias y precauciones especiales de empleo
Contenido de electrolitos clínicamente importantes
• PHEBURANE contiene 124 mg (5,4 mmol) de sodio por gramo de fenilbutirato de sodio, correspondientes a 2,5 g (108 mmol) de sodio por 20 g de fenilbutirato de sodio, que es la dosis diaria máxima. Por tanto, PHEBURANE debe usarse con prudencia en pacientes con insuficiencia cardíaca congestiva o insuficiencia renal grave, y en situaciones clínicas en las que exista retención de sodio con edema.
• Durante el tratamiento, deberán controlarse los niveles de potasio en suero, ya que la excreción renal de fenilacetilglutamina podría provocar una pérdida de potasio por orina.
Consideraciones generales
• Incluso aunque estén recibiendo tratamiento, puede producirse una encefalopatía hiperamoniémica aguda en algunos pacientes.
• No se recomienda PHEBURANE para el tratamiento de la hiperamoniemia aguda, que se considera una urgencia médica.
Excipientes con efecto conocido
• Este medicamento contiene sodio. Esto se debe tener en cuenta en los pacientes con dietas pobres en sodio .
• Este medicamento contiene sacarosa. Esto se debe tener en cuenta en los pacientes con diabetes mellitus. Los pacientes con intolerancia hereditaria a la fructosa, malabsorción de glucosa o galactosa o insuficiencia de sacarosa-isomaltasa no deben tomar este medicamento.
4.5 Interacción con otros medicamentos y otras formas de interacción
La administración conjunta de probenecid puede afectar a la excreción renal del metabolito conjugado del fenilbutirato de sodio.Se han publicado informes según los cuales el haloperidol y el valproato provocanhiperamoniemia. Los corticosteroides pueden dar lugar a una descomposición de las proteínas corporales y por consiguiente aumentar la concentración plasmática de amonio. Se aconseja un control más frecuente de las concentraciones plasmáticas de amonio cuando tengan que utilizarse estos medicamentos.
4.6 Fertilidad, embarazo y lactancia
Mujeres en edad fértil / Anticoncepción en hombres y mujeres
Las mujeres en edad fértil deben adoptar medidas anticonceptivas eficaces.
Embarazo
No se ha confirmado la seguridad de este medicamento para su uso en embarazadas. La evaluación de los estudios experimentales con animales ha demostrado la existencia de toxicidad para la función reproductora por parte del fenilbutirato de sodio, es decir, efectos sobre el desarrollo del embrión o del feto. La exposición prenatal de crías de rata al fenilacetato (el metabolito activo del fenilbutirato) produjo lesiones en las células piramidales corticales; las espinas dendríticas eran más largas y finas de lo normal y su número, reducido. Se desconoce la significación de estos datos en embarazadas; por consiguiente, el uso de PHEBURANE está contraindicado durante el embarazo (ver sección 4.3). Las mujeres en edad fértil deben adoptar medidas anticonceptivas eficaces.
Lactancia
Al administrar dosis altas de fenilacetato (190-474 mg/kg) por vía subcutánea a crías de rata, se observó una disminución de la proliferación y un aumento de la pérdida de neuronas, así como una reducción de la mielina del SNC. Se retrasó la maduración de las sinapsis cerebrales y se redujo el número de terminaciones nerviosas en funcionamiento en el cerebro, lo que provocó un retraso del crecimiento cerebral. No se ha determinado si el fenilacetato se secreta en la leche materna humana, por lo que el uso de PHEBURANE está contraindicado durante la lactancia (ver sección 4.3).
Fertilidad
No se dispone de pruebas sobre el efecto del fenilbutirato de sodio sobre la fertilidad.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de PHEBURANE sobre la capacidad para conducir y utilizar máquinas es insignificante.
4.8 Reacciones adversas
Resumen del perfil de seguridad
En ensayos clínicos con fenilbutirato de sodio, el 56% de los pacientes experimentaron al menos un acontecimiento adverso y se consideró que el 78% de estos acontecimientos no estaban relacionados con el fenilbutirato de sodio.
Las reacciones adversas afectaron fundamentalmente a los aparatos reproductor y digestivo.
Tabla de reacciones adversas
En la siguiente tabla se enumeran las reacciones adversas, por clasificación de órganos del sistema y por frecuencia. La frecuencia se define como muy frecuentes (>1/10), frecuentes (>1/100 a <1/10), poco frecuentes (>1/1.000 a <1/100), raras (>1/10,000 a <1/1,000), muy raras (<1/10,000) y de frecuencia no conocida (no puede estimarse a partir de los datos disponibles). Las reacciones adversas se presentan en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
|
Clasificación de clasificación de órganos |
Frecuencia |
Reacción adversa |
|
Trastornos de la sangre y del sistema linfático |
Frecuentes |
Anemia, trombocitopenia, leucopenia, leucocitosis, trombocitosis |
|
Poco frecuentes |
Anemia aplásica, equímosis | |
|
Trastornos del metabolismo y de la nutrición |
Frecuentes |
Acidosis metabólica, alcalosis, disminución del apetito |
|
Trastornos psiquiátricos |
Frecuentes |
Depresión, irritabilidad |
|
Trastornos del sistema nervioso |
Frecuentes |
Síncope, cefalea |
|
Trastornos cardiacos |
Frecuentes |
Edema |
|
Poco frecuentes |
Arritmia | |
|
Trastornos gastrointestinales |
Frecuentes |
Dolor abdominal, vómitos, náuseas, estreñimiento, disgeusia |
|
Poco frecuentes |
Pancreatitis, úlcera péptica, hemorragia rectal, gastritis | |
|
Trastornos de la piel y del tejido subcutáneo |
Frecuentes |
Erupción cutánea, olor anormal de la piel |
|
Trastornos renales y urinarios |
Frecuentes |
Acidosis tubular renal |
|
Trastornos del aparato reproductor y de la mama |
Muy frecuentes |
Amenorrea, menstruación irregular |
|
Exploraciones complementarias |
Frecuentes |
Disminución del potasio, la albúmina, las proteínas totales y el fosfato en la sangre. Aumento de la fosfatasa alcalina, las transaminasas, la bilirrubina, el ácido úrico, el cloro, el fosfato y el sodio en la sangre. Aumento de peso |
Descripción de reacciones adversas selecionadas
Se comunicó un caso probable de reacción tóxica a fenilbutirato de sodio (450 mg/kg/día) en una paciente anoréxica de 18 años que padeció una encefalopatía metabólica asociada con acidosis láctica, hipopotasemia grave, pancitopenia, neuropatía periférica y pancreatitis. Se recuperó tras reducir la dosis, excepto de los episodios recurrentes de pancreatitis que al final dieron lugar a la retirada del tratamiento.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Apéndice V.
4.9 Sobredosis
Se produjo un caso de sobredosis en un lactante de 5 meses con una dosis única accidental de 10 g
(1.370 mg/kg). El paciente presentó diarrea, irritabilidad y acidosis metabólica con hipopotasemia. El paciente se recuperó en 48 horas después del tratamiento sintomático.
Estos síntomas son compatibles con la acumulación de fenilacetato, que manifestó neurotoxicidad limitante de la dosis cuando se administró por vía intravenosa a dosis de hasta 400 mg/kg/día. Las manifestaciones de neurotoxicidad fueron fundamentalmente somnolencia, cansancio y mareos. Manifestaciones menos frecuentes fueron confusión, cefalea, disgeusia, hipoacusia, desorientación, deterioro de la memoria y exacerbación de una neuropatía preexistente.
En el caso de sobredosis, deberá retirarse el tratamiento e iniciarse medidas de apoyo. La hemodiálisis o la diálisis peritoneal pueden resultar beneficiosas.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Otros productos para el tracto alimentario y el metabolismo, productos varios para el tracto alimentario y el metabolismo, código ATC: A16AX03
Mecanismo de acción y efectos farmacodinámicos
El fenilbutirato de sodio es un profármaco y se metaboliza rápidamente a fenilacetato. El fenilacetato es un compuesto metabólicamente activo que se conjuga con glutamina por acetilación para formar fenilacetilglutamina, que se excreta a continuación por vía renal. En base molar, la fenilacetilglutamina es comparable a la urea (cada una contiene 2 moles de nitrógeno) y, por consiguiente, proporciona un vehículo alternativo para la excreción del nitrógeno sobrante.
Eficacia clínica y seguridad
Basándose en estudios sobre la excreción de la fenilacetilglutamina en pacientes con trastornos del ciclo de la urea, es posible calcular que, para cada gramo de fenilbutirato de sodio administrado, se producen entre 0,12 y 0,15 g de nitrógeno de fenilacetilglutamina. Como consecuencia, el fenilbutirato de sodio reduce las concentraciones plasmáticas elevadas de amonio y glutamina en pacientes con trastornos del ciclo de la urea. Es importante que el diagnóstico sea realizado precozmente y el tratamiento iniciado inmediatamente para mejorar la supervivencia y la respuesta clínica.
En los pacientes con deficiencia de aparición tardía, incluidas las mujeres heterocigóticas para la deficiencia de ornitina transcarbamoilasa, que se recuperaron de una encefalopatía hiperamoniémica y luego recibieron tratamiento crónico con restricción de las proteínas de la dieta y fenilbutirato de sodio, la tasa de supervivencia fue del 98 %. El CI de la mayoría de los pacientes evaluados se encontraba en el intervalo de medio a medio bajo/retraso mental limítrofe. Su rendimiento cognitivo se mantuvo relativamente estable durante el tratamiento con fenilbutirato. Es improbable que el tratamiento corrija un deterioro neurológico preexistente y, en algunos pacientes, el deterioro neurológico puede continuar.
Puede ser necesaria la administración de por vida de PHEBURANE, a menos que se opte por un trasplante ortotópico de hígado.
Población pediátrica
En el pasado, la los trastornos del ciclo de la urea de presentación neonatal resultaban mortales en la práctica totalidad de los casos en el primer año de vida, incluso cuando se trataban con diálisis peritoneal y aminoácidos esenciales o sus análogos no nitrogenados. Con hemodiálisis, el uso de vías alternativas para la excreción del nitrógeno sobrante (fenilbutirato de sodio, benzoato de sodio y fenilacetato de sodio), una restricción de proteínas en la dieta y, en algunos casos, un complemento de aminoácidos esenciales, la tasa de supervivencia en los neonatos diagnosticados tras el nacimiento (pero durante el primer mes de vida) aumentó a casi un 80% y la mayoría de las muertes se produjeron durante un episodio agudo de encefalopatía hiperamoniémica. En los pacientes con enfermedad de aparición neonatal hubo una incidencia alta de retraso mental.
En pacientes diagnosticados durante la gestación y tratados antes de que se produjesen episodios de encefalopatía hiperamoniémica, la supervivencia fue del 100%, pero incluso en estos pacientes, muchos presentaron con posterioridad alteraciones cognitivas u otros déficits neurológicos.
5.2 Propiedades farmacocinéticas
Se sabe que el fenilbutirato se oxida convirtiéndose en fenilacetato, que se conjuga por vía enzimática con glutamina para formar fenilacetilglutamina en el hígado y el riñón. Las esterasas hepáticas y sanguíneas también hidrolizan el fenilacetato.
Las concentraciones plasmáticas y urinarias de fenilbutirato y sus metabolitos han sido obtenidas de adultos normales en ayunas que recibieron una dosis única de 5 g de fenilbutirato de sodio y de pacientes con trastornos del ciclo de la urea, hemoglobinopatías y cirrosis que recibieron dosis orales únicas y repetidas de hasta 20 g/día (estudios no controlados). También se ha estudiado el destino del fenilbutirato y sus metabolitos en pacientes con cáncer tras infusión intravenosa de fenilbutirato de sodio (hasta 2 g/m2) o de fenilacetato.
Absorción
El fenilbutirato se absorbe rápidamente en ayunas. Tras una dosis oral única de 5 g de fenilbutirato de sodio, en forma de granulado, se detectaron concentraciones plasmáticas apreciables de fenilbutirato 15 minutos después de la toma. El tiempo medio para alcanzar la concentración máxima fue de una hora y la media de dicha concentración máxima fue de 195 pg/ml. Se calculó que la semivida de eliminación era de 0,8 horas.
Se desconoce el efecto de la comida en la absorción.
Distribución
El volumen de distribución del fenilbutirato es de 0,2 l/kg.
Biotransformación
Tras una dosis única de 5 g de fenilbutirato de sodio, en forma de granulado, se detectaron concentraciones plasmáticas apreciables de fenilacetato y de fenilacetilglutamina 30 y 60 minutos después de la toma respectivamente. El tiempo medio para alcanzar las concentraciones máximas fue de 3,55 y 3,23 horas respectivamente, y la media de la concentración máxima fue de 45,3 y 62,8 pg/ml respectivamente. Se calculó que la semivida de eliminación era de 1,3 y 2,4 horas respectivamente.
Estudios con altas dosis intravenosas de fenilacetato mostraron una farmacocinética no lineal caracterizada por la saturación del metabolismo a fenilacetilglutamina. La administración repetida de fenilacetato mostró indicios de inducción del aclaramiento.
En la mayoría de los pacientes con trastornos del ciclo de la urea o hemoglobinopatías a los que se administraron diversas dosis de fenilbutirato (300-650 mg/kg/día hasta 20 g/día) no pudo detectarse concentración plasmática alguna de fenilacetato tras el ayuno nocturno. En pacientes con insuficiencia hepática, la conversión de fenilacetato en fenilacetilglutamina puede ser relativamente más lenta. Tres (de seis) pacientes cirróticos a los que se administraron dosis repetidas por vía oral de fenilbutirato de sodio (20 g/día en tres tomas) mostraron al tercer día concentraciones plasmáticas mantenidas de fenilacetato que eran cinco veces superiores a las obtenidas tras la primera toma.
En voluntarios normales se encontraron diferencias entre ambos sexos para los parámetros farmacocinéticos del fenilbutirato y el fenilacetato (AUC y Cmax alrededor de 30-50% mayores en mujeres), pero no de la fenilacetilglutamina. Esto puede deberse a la lipofilia del fenilbutirato de
sodio y a las consiguientes diferencias en el volumen de distribución.
Eliminación
Aproximadamente el 80 y el 100% del fármaco es excretado por los riñones en 24 horas como producto conjugado (fenilacetilglutamina).
5.3 Datos preclínicos sobre seguridad
El fenilbutirato de sodio ha dado resultados negativos en dos pruebas de mutagénesis, en concreto el test de Ames y el test del micronúcleo. Los resultados indican que el fenilbutirato de sodio no produjo ningún efecto mutagénico en la prueba de Ames con o sin activación metabólica.
Los resultados del test del micronúcleo indican que se consideró que el fenilbutirato de sodio no había producido ningún efecto clastogénico en ratas tratadas con dosis a niveles tóxicos o no tóxicos (examinadas 24 y 48 horas después de la administración de una dosis oral única de 878 a 2.800 mg/kg).
No se han realizado estudios de carcinogénesis ni de fertilidad con fenilbutirato de sodio.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Esferas de azúcar (sacarosa y almidón de maíz),
hipromelosa,
etilcelulosa N7,
macrogol 1500,
povidona K25.
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez 3 años.
Después de la primera apertura, se debe usar en un plazo de 45 días,
6.4 Precauciones especiales de conservación No conservar a temperatura superior a 25 °C.
6.5 Naturaleza y contenido del envase
Frasco de HDPE, con cierre con un dispositivo de seguridad para niños, con desecante, con 174 g de granulado.
Cada caja contiene un frasco.
Se suministra una cucharilla de medida calibrada.
6.6 Precauciones especiales de eliminación y otras manipulaciones
En caso de mezcla del granulado con alimentos sólidos o líquidos, es importante que el producto se ingiera inmediatamente después de hacer la mezcla.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Lucane Pharma 172 rue de Charonne 75011 París Francia
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/13/822/001
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 31 de julio 2013
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
A. FABRICANTE(S) RESPONSABLE(S) DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
A. FABRICANTE(S) RESPONSABLE(S) DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección del (de los) fabricantc(s) rcsponsablc(s) de la liberación de los lotes
Lucane Pharma 172 rue de Charonne 75011 París Francia
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica restringida (ver Anexo I: Resumen de las Características del Producto, sección 4.2).
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos actualizados de seguridad (IPS)
El Titular de la Autorización de Comercialización (TAC) presentará los informes periódicos actualizados de seguridad para este medicamento de conformidad con las exigencias establecidas en la lista de fechas de referencia de la Unión (lista EURD), prevista en el artículo 107 ter, párrafo 7, de la Directiva 2001/83/CE y publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
No procede.
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR Y EL ACONDICIONAMIENTO PRIMARIO
CAJA Y ETIQUETA DEL FRASCO
1. NOMBRE DEL MEDICAMENTO
PHEBURANE 483 mg/g granulado. Fenilbutirato de sodio
2. PRINCIPIO(S) ACTIVO(S)
1 gramo de granulado contiene 483 mg de fenilbutirato de sodio.
3. LISTA DE EXCIPIENTES
Contiene sodio y sacarosa.
Para mayor información consutar el prospecto.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Granulado
Caja: un frasco con 174 g de granulado. Frasco: 174 g de granulado.
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento.
Vía oral.
Usar solo la cucharilla de medida calibrada que se suministra.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
No conservar a temperatura superior a 25 °C.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO, CUANDO CORRESPONDA
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Lucane Pharma 172 rue de Charonne 75011 París - Francia
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/13/822/001
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
PHEBURANE 483 mg/g {Solo para la caja}
17. IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D
Incluido el código de barras 2D que lleva el identificador único
18. IDENTIFICADOR ÚNICO - INFORMACIÓN EN CARACTERES VISUALES
PC:
SN:
NN:
B. PROSPECTO
Prospecto: información para el usuario
PHEBURANE 483 mg comprimidos
Fenilbutirato de sodio
Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante para usted.
• Conserve este prospecto, ya que puede tener que volver a leerlo.
• Si tiene alguna duda, consulte a su médico o farmacéutico.
• Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
• Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto:
1. Qué es PHEBURANE y para qué se utiliza
2. Qué necesita saber antes de empezar a tomar PHEBURANE
3. Cómo tomar PHEBURANE
4. Posibles efectos adversos
5. Conservación de PHEBURANE
6. Contenido del envase e información adicional
1. Qué es PHEBURANE y para qué se utiliza
PHEBURANE contiene el principio activo fenilbutirato de sodio, que se usa para tratar a pacientes de todas las edades con trastornos del ciclo de la urea. Estos trastornos raros son causados por una deficiencia de ciertas enzimas del hígado que son necesarias para eliminar el nitrógeno residual en forma de amonio.
El nitrógeno es un elemento constitutivo de las proteínas, que son una parte esencial de los alimentos que comemos. A medida que el organismo descompone las proteínas después de comer, el nitrógeno residual, en forma de amonio, se acumula porque el organismo no puede eliminarlo. El amonio es especialmente tóxico para el cerebro y, en casos graves, puede provocar una pérdida del conocimiento y coma.
PHEBURANE ayuda al organismo a eliminar el nitrógeno residual y reduce la cantidad de amoníaco del organismo.
Sin embargo, PHEBURANE debe usarse con una dieta baja en proteínas, que el médico o el dietista haya elaborado específicamente para su caso. Deberá seguir esa dieta a conciencia.
2. Qué necesita saber antes de empezar a tomar PHEBURANE No tome PHEBURANE:
• si es alérgico al fenilbutirato de sodio o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
• si está embarazada.
• si está dando el pecho.
Advertencias y precauciones
Consulte a su médico o farmacéutico antes de empezar a tomar PHEBURANE si usted:
• padece insuficiencia cardíaca (un tipo de enfermedad cardíaca en la que el corazón no puede bombear suficiente sangre para el organismo) o una disminución de la función renal
• padece una disminución de la función de los riñones o del hígado, ya que PHEBUTANE se elimina del organismo por estos órganos.
PHEBURANE no previene por completo que se produzca un exceso de amonio en la sangre. Si esto ocurre, usted presentará síntomas como náuseas, vómitos, confusión, y deberá recibir atención médica con urgencia.
Si ha de hacerse análisis, es importante que le recuerde al médico que está tomando PHEBURANE, ya que el fenilbutirato de sodio puede interferir en los resultados de algunos análisis (como los electrolitos o las proteínas en la sangre, o las pruebas de función hepática).
En caso de cualquier duda, consulte a su médico o farmacéutico.
Otros medicamentos y PHEBURANE
Informe a su médico o farmacéutico si está tomando, ha tomado recientemente o podría tener que tomar cualquier otro medicamento.
Es especialmente importante que informe a su médico si está tomando medicamentos que contengan:
• valproato (un medicamento antiepiléptico),
• haloperidol (utilizado para tratar algunos trastornos psicóticos),
• corticoesteroides (medicamentos que se utilizan para aliviar zonas inflamadas del organismo),
• probenecid (para el tratamiento de la hiperuricemia, concentración alta de ácido úrico en la sangre, asociada a la gota)
Estos medicamentos pueden modificar el efecto de PHEBURANE, y deberá hacerse análisis de sangre con mayor frecuencia. Si no está seguro de si los medicamentos que está usando contienen estos principios activos, consulte a su médico o farmacéutico.
Embarazo y lactancia
No tome PHEBURANE si está embarazada, ya que este medicamento puede dañar al feto.
En caso de que pudiera quedarse embarazada, debe utilizar, durante el tratamiento con PHEBURANE, un método anticonceptivo eficaz. Consulte los detalles a su médico.
No use PHEBURANE si está dando el pecho, ya que este medicamento puede pasar a la leche materna y puede dañar a su bebé.
Conducción y uso de máquinas
Es poco probable que PHEBURANE afecte a su capacidad para conducir y usar máquinas. PHEBURANE contiene sodio y sacarosa.
Este medicamento contiene 124 mg (5,4 mmol) de sodio por 1 g de fenilbutirato de sodio. Esto se debe tener en cuenta si recibe usted una dieta pobre en sodio.
Este medicamento contiene 768 mg de sucrosa por 1 g de fenilbutirato de sodio. Esto se debe tener en cuenta si usted padece diabetes. Si su médico le ha dicho que padece una intolerancia a ciertos azúcares, consulte a su médico antes de tomar este medicamento.
3. Cómo tomar PHEBURANE
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico. En caso de duda, consulte de nuevo a su médico o farmacéutico.
Dosificación
La dosis diaria de PHEBURANE se basará en su peso corporal o en su superficie corporal, y se ajustará según su tolerancia a las proteínas y la dieta. Deberá hacerse análisis de sangre con regularidad para ajustar la dosis diaria correcta. Su médico le indicará la cantidad que debe tomar.
Forma de administración
PHEBURANE debe tomarse por vía oral. Debido a que se disuelve lentamente, PHEBURANE no se debe administrar mediante una gastrostomía (una sonda que va hasta el estómago a través del abdomen) ni mediante una sonda nasogástrica (una sonda que va hasta el estómago por la nariz).
PHEBURANE debe tomarse mientras se lleva una dieta especial, baja en proteínas.
Debe tomar PHEBURANE con cada comida. En los niños pequeños, esto puede ser de 4 a 6 veces al día.
Este medicamento se suministra con una cucharilla de medida calibrada, que administra hasta 3 g de fenilbutirato de sodio. Solo se debe usar esta cucharilla para medir la dosis.
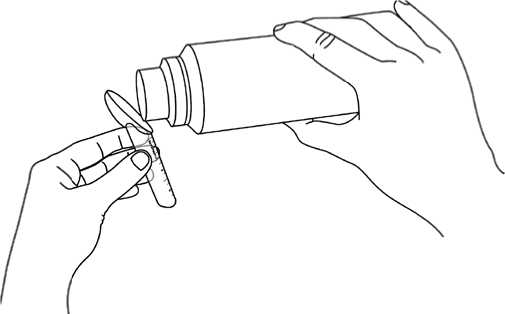
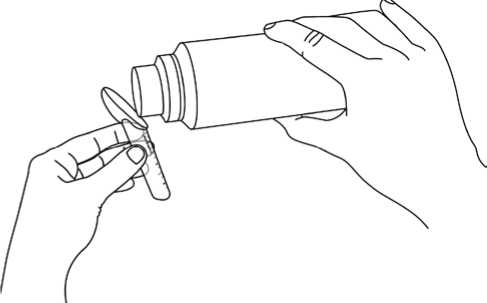
Para medir la dosis:
• Las líneas de la cucharilla indican la cantidad (en gramos de fenilbutirato de sodio). Tome la cantidad correcta que le haya recetado el médico.
• Vierta el granulado directamente en la cucharilla, como se muestra en la figura (en la caja y al final de la página 2 de este prospecto).
• Golpee ligeramente una vez la cucharilla, para obtener un nivel horizontal de granulado y seguir llenando, si es necesario.
El granulado se puede tragar directamente con una bebida (agua, zumo de frutas, fórmulas sin proteínas para lactantes), o se puede añadir a una cucharada de alimentos sólidos (puré de patatas o compota de manzana). Si lo mezcla con los alimentos, es importante que lo tome inmediatamente. Esto permitirá conservar el enmascaramiento de sabor.
Deberá tomar este medicamento y seguir una dieta de por vida.
Si toma más PHEBURANE del que debe
Los pacientes que han tomado dosis muy altas de fenilbutirato de sodio han experimentado:
• somnolencia, cansancio, mareos y, con menor frecuencia, confusión;
• dolor de cabeza;
• cambios en el gusto (trastornos gustativos);
• disminución de la capacidad auditiva;
• desorientación;
• problemas de memoria;
• empeoramiento de las afecciones neurológicas existentes.
En caso de experimentar alguno de estos síntomas, debe ponerse en contacto inmediatamente con su médico o con el servicio de urgencias del hospital más próximo para recibir tratamiento sintomático.
Si olvidó tomar PHEBURANE
Debe tomar una dosis tan pronto como sea posible con la siguiente comida. Asegúrese de que pasan por lo menos 3 horas entre dos dosis. No tome una dosis doble para compensar las dosis olvidadas.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Si se producen vómitos persistentes, debe llamar inmediatamente a su médico.
Efectos adversos muy frecuentes (pueden afectar a más de 1 de cada 10 personas): menstruaciones irregulares y detención de la menstruación en las mujeres fértiles.
Es posible que la ausencia de la menstruación en las mujeres sexualmente activas no esté provocada por el uso de PHEBURANE. Si esto ocurre, consulte con su médico, ya que ello podría ser causado por un embarazo (ver «Embarazo y lactancia» en la sección anterior) o por la menopausia.
Efectos adversos frecuentes (pueden afectar a más de 1 de cada 100 personas): cambios en la cantidad de células sanguíneas (glóbulos rojos, glóbulos blancos y plaquetas), cambios en la cantidad de bicarbonato en la sangre (lo que altera su equilibrio ácido-básico), disminución del apetito, depresión, irritabilidad, dolor de cabeza, desmayos, retención de líquidos (hinchazón), cambios en el gusto (trastornos gustativos), dolor abdominal, vómitos, náuseas, estreñimiento, mal olor corporal, sarpullido, funcionamiento renal anormal, aumento de peso, alteración de los resultados de los análisis.
Efectos adversos poco frecuentes (pueden afectar a más de 1 de cada 1 000 personas): recuento bajo de glóbulos rojos (anemia) debido a un fallo de la médula ósea, cardenales, alteración del ritmo cardiaco, hemorragia rectal, irritación estomacal, úlcera gastroduodenal, inflamación del páncreas.
Comunicación de efectos adversos
Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de PHEBURANE
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice PHEBURANE después de la fecha de caducidad que aparece en la caja y la etiqueta del frasco después de «CAD». La fecha de caducidad es el último día del mes que se indica.
No conservar a temperatura superior a 25 °C.
Después de abrirlo por primera vez, PHEBURANE se puede utilizar en un plazo de 45 días.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de PHEBURANE
El principio activo es fenilbutirato de sodio
Cada gramo de granulado contiene 483 mg de fenilbutirato de sodio.
Los demás componentes son: esferas de azúcar (sacarosa y almidón de maíz, ver sección 2 «PHEBURANE contiene sacarosa»), hipromelosa, etilcelulosa N7, macrogol 1500, povidona K25.
Aspecto del producto y contenido del envase
PHEBURANE granulado es blanco a blanquecino.
El granulado está envasado en un frasco de plástico, con cierre con un dispositivo de seguridad para
de granulado. Cada caja contiene un frasco.
medicamento dirigiéndose al representante local del
Lietuva
Medical Need Europe AB Tel: + 46 8 533 39 500 info@medicalneed.com
Luxembourg/Luxemburg
Lucane Pharma
Tél/Tel: + 33 153 868 750
Magyarország
Medical Need Europe AB Tel.: + 46 8 533 39 500 info@medicalneed.com
Malta
Lucane Pharma
Tel: + 33 153 868 750
Nederland
Lucane Pharma
Tel: + 33 153 868 750
Norge
Medical Need Europe AB Tlf: + 46 8 533 39 500 info@medicalneed.com
Osterreich
niños y un desecante. Cada frasco contiene 174g
Titular de la autorización de comercialización
Lucane Pharma 172 rue de Charonne 75011 París - Francia
Responsable de la fabricación
Lucane Pharma 172 rue de Charonne 75011 París Francia
Pueden solicitar más información respecto a este titular de la autorización de comercialización:
Belgie/Belgique/Belgien
Lucane Pharma
Tél/Tel: + 33 153 868 750
Etarapna
Lucane Pharma
Tea.: + 33 153 868 750
Ceská republika
Medical Need Europe AB Tel: + 46 8 533 39 500 info@medicalneed.com
Danmark
Medical Need Europe AB Tlf: + 46 8 533 39 500 info@medicalneed.com
Deutschland
Lucane Pharma
Tel: + 33 153 868 750
Eesti
Medical Need Europe AB Tel: + 46 8 533 39 500 info@medicalneed.com
EXláóa
|
Lucane Pharma T pk: + 33 153 868 750 |
Lucane Pharma Tel: + 33 153 868 750 |
|
España Lucane Pharma Tel: + 33 153 868 750 |
Polska Medical Need Europe AB Tel.: + 46 8 533 39 500 info@medicalneed.com |
|
France Lucane Pharma Tél: + 33 153 868 750 |
Portugal Lucane Pharma Tel: + 33 153 868 750 |
|
Hrvatska Lucane Pharma Tel: + 33 153 868 750 |
Romania Lucane Pharma Tel: + 33 153 868 750 |
|
Ireland Lucane Pharma Tel: + 33 153 868 750 |
Slovenija Medical Need Europe AB Tel: + 46 8 533 39 500 info@medicalneed.com |
|
Ísland Medical Need Europe AB Sími: + 46 8 533 39 500 info@medicalneed.com |
Slovenská republika Medical Need Europe AB Tel: + 46 8 533 39 500 info@medicalneed.com |
|
Italia Lucane Pharma Tel: + 33 153 868 750 |
Suomi/Finland Medical Need Europe AB Puh/Tel: + 46 8 533 39 500 info@medicalneed.com |
|
Kúrcpog Lucane Pharma Tnk: + 33 153 868 750 |
Sverige Medical Need Europe AB Tel: + 46 8 533 39 500 info@medicalneed.com |
|
Latvija Medical Need Europe AB Tel: + 46 8 533 39 500 info@medicalneed.com |
United Kingdom Lucane Pharma Tel: + 33 153 868 750 |
|
Fecha de la última revisión de este prospecto: |
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu/.
También existen enlaces a otras páginas web sobre enfermedades raras y medicamentos huérfanos.
24