Ovitrelle 250 Microgramos Solucion Inyectable En Pluma Precargada
ANEXO 1
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
1. NOMBRE DEL MEDICAMENTO
Ovitrelle 250 microgramos/0,5 ml, solución inyectable en jeringa precargada.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada jeringa precargada contiene 250 microgramos de coriogonadotropina alfa1 (equivalentes a 6.500 UI aproximadamente) en 0,5 ml solución.
* gonadotropina coriónica humana recombinante, r-hCG producida por tecnología de ADN recombinante en células de ovario de hámster chino (OHC).
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Solución inyectable en jeringa precargada.
Solución transparente, incolora o ligeramente amarillenta.
El pH de la solución es 7,0 ± 0,3, su osmolalidad es de 250-400 mOsm/kg.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Ovitrelle está indicado en el tratamiento de:
• Mujeres adultas sometidas a superovulación para practicar técnicas de reproducción asistida, tales como la fertilización in vitro (FIV): Ovitrelle se administra para desencadenar la maduración folicular final y la luteinización tras la estimulación del desarrollo folicular.
• Mujeres adultas con anovulación u oligovulación: Ovitrelle se administra para desencadenar la ovulación y la luteinización en mujeres con anovulación u oligovulación tras la estimulación del desarrollo folicular.
4.2 Posología y forma de administración
El tratamiento con Ovitrelle debe realizarse bajo la supervisión de un médico con experiencia en el tratamiento de los problemas de la fertilidad.
Posología
La dosis máxima es de 250 microgramos. Se debe utilizar la siguiente pauta de administración:
• Mujeres sometidas a superovulación para practicar técnicas de reproducción asistida, tales como la fertilización in vitro (FIV):
Debe administrarse una jeringa precargada de Ovitrelle (250 microgramos) 24 a 48 horas después de la última administración de un preparado de folitropina (FSH) o de gonadotropina menopáusica humana (hMG), es decir, cuando se ha logrado una estimulación óptima del desarrollo folicular.
Poblaciones especiales
Insuficiencia renal o hepática
No se han establecido todavía la seguridad, eficacia ni farmacocinética de Ovitrelle en pacientes con insuficiencia renal o hepática.
Población pediátrica
No existe una recomendación de uso específica para Ovitrelle en la población pediátrica.
Forma de administración
Para uso por vía subcutánea. La autoadministración de Ovitrelle sólo debe realizarse por pacientes adecuadamente entrenadas, con acceso al consejo de un profesional.
Ovitrelle es para un solo uso.
4.3 Contraindicaciones
• Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
• Tumores del hipotálamo o de la hipófisis.
• Aumento del tamaño de los ovarios o quistes no debidos a enfermedad del ovario poliquístico.
• Hemorragias ginecológicas de etiología desconocida.
• Carcinoma ovárico, uterino o mamario.
• Embarazo extrauterino en los 3 meses anteriores.
• Trastornos tromboembólicos activos.
• Insuficiencia ovárica primaria.
• Malformaciones de los órganos sexuales incompatibles con el embarazo.
• Fibromas uterinos incompatibles con el embarazo.
• Mujeres posmenopáusicas.
4.4 Advertencias y precauciones especiales de empleo
Antes de iniciar el tratamiento, debe valorarse adecuadamente el tipo de infertilidad de la pareja y la posible existencia de contraindicaciones para el embarazo. En particular, debe descartarse la presencia de hipotiroidismo, insuficiencia suprarrenal, hiperprolactinemia y tumores hipofisarios o hipotalámicos, instaurando el tratamiento específico apropiado.
No se dispone de experiencia clínica con Ovitrelle en el tratamiento de otras enfermedades (tales como la insuficiencia del cuerpo lúteo o los trastornos masculinos), por lo tanto Ovitrelle no está indicado para estas enfermedades.
Síndrome de hiperestimulación ovárica (SHO)
Las pacientes sometidas a estimulación ovárica tienen un mayor riesgo de presentar un SHO, debido al desarrollo de múltiples folículos.
El síndrome de hiperestimulación ovárica puede convertirse en un problema médico grave, caracterizado por grandes quistes ováricos que pueden romperse y por la presencia de ascitis, aumento de peso, disnea, oliguria o en el contexto de un cuadro clínico de disfunción circulatoria. En casos raros el SHO grave se puede complicar con hemoperitoneo, síndrome de distrés respiratorio agudo, torsión ovárica y tromboembolia.
Para minimizar el riesgo de SHO, se deben realizar evaluaciones ecográficas del desarrollo folicular o una determinación de los niveles séricos de estradiol antes del tratamiento y a intervalos regulares durante el tratamiento. En caso de anovulación, el riesgo de SHO aumenta si existe un nivel sérico de estradiol >1.500 pg/ml (5.400 pmol/l) y más de 3 folículos con un diámetro igual o superior a 14 mm. En las técnicas de reproducción asistida, aumenta el riesgo de SHO con unos niveles séricos de estradiol >3.000 pg/ml (11.000 pmol/l) y 18 folículos o más con un diámetro igual o superior a 11 mm.
El SHO debido a una respuesta ovárica excesiva puede evitarse dejando de administrar hCG. Por tanto, si aparecen signos de hiperestimulación ovárica tales como un nivel de estradiol >5.500 pg/ml (20.000 pmol/l) o un total de 30 folículos o más, se recomienda abstenerse de administrar hCG y advertir a la paciente que no practique el coito o que utilice métodos anticonceptivos de barrera durante al menos 4 días.
Embarazo múltiple
En pacientes sometidas a inducción de la ovulación, la incidencia de embarazo y partos múltiples (en su mayoría gemelares) es más elevada que en el caso de concepción natural. El riesgo de embarazos múltiples en pacientes sometidas a técnicas de reproducción asistida se relaciona con el número de embriones implantados.
El riesgo de SHO y de embarazos múltiples puede minimizarse utilizando la dosis y el esquema posológico de Ovitrelle recomendados y controlando cuidadosamente el tratamiento.
Abortos
La incidencia de abortos, tanto en las pacientes con anovulación como en las sometidas a técnicas de reproducción asistida, es superior a la observada en la población normal, pero comparable a las tasas observadas en mujeres con otros problemas de fertilidad.
Embarazo ectópico
Como las mujeres infértiles sometidas a ART, y especialmente a FIV, tienen con frecuencia anomalías de las trompas, la incidencia de embarazos ectópicos puede verse incrementada. Es importante obtener confirmación ecográfica temprana de que un embarazo es intrauterino y excluir la posibilidad de un embarazo extrauterino.
Malformaciones congénitas
La incidencia de malformaciones congénitas después de ART puede ser algo mayor que después de concepciones espontáneas. Se cree que esto se debe a diferencias en las características de los padres (p. ej., la edad materna, características del esperma) y a la mayor incidencia de embarazos múltiples.
Episodios tromboembólicos
En mujeres con enfermedad tromboembólica reciente o en curso, con factores de riesgo generalmente reconocidos para padecer episodios tromboembólicos tales como los antecedentes personales o familiares, el tratamiento con gonadotropinas puede aumentar más el riesgo de agravación o aparición de dichos episodios. En estas mujeres, deben sopesarse los beneficios de la administración de gonadotropina frente a sus riesgos. Sin embargo, hay que señalar que el propio embarazo, así como el SHO también llevan asociado un mayor riesgo de episodios tromboembólicos, tales como embolia pulmonar, ictus isquémico o infarto de miocardio.
Interferencia con pruebas analíticas en suero y en orina
Tras su administración, Ovitrelle puede interferir durante un periodo de hasta 10 días con la determinación inmunológica de hCG en suero u orina, lo que puede dar lugar a un falso positivo en el resultado de la prueba de embarazo.
Se debe advertir a las pacientes de este hecho.
Información adicional
Durante el tratamiento con Ovitrelle puede producirse una discreta estimulación tiroidea, cuya relevancia clínica se desconoce.
Este medicamento contiene menos de 1 mmol de sodio (23 mg) por dosis; esto es, esencialmente “exento de sodio”.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios específicos de interacciones entre Ovitrelle y otros medicamentos; no obstante, no se han descrito interacciones farmacológicas clínicamente significativas durante el tratamiento con hCG.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No existe ninguna indicación para la utilización de Ovitrelle durante el embarazo. No se dispone de datos clínicos en relación con la exposición durante el embarazo. No se han realizado estudios de reproducción con coriogonadotropina alfa en animales (ver sección 5.3). Se desconoce el riesgo potencial para el ser humano.
Lactancia
Ovitrelle no está indicado durante la lactancia. No existen datos sobre la excreción de coriogonadotropina alfa en la leche.
Fertilidad
Ovitrelle está indicado para el uso contra la infertilidad (ver sección 4.1).
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
Se prevé que la influencia de Ovitrelle sobre la capacidad para conducir y utilizar máquinas sea nula o insignificante.
4.8 Reacciones adversas
Resumen del perfil de seguridad
En ensayos clínicos comparativos con diferentes dosis de Ovitrelle, se observaron las siguientes reacciones adversas relacionadas con la dosis de Ovitrelle: SHO, vómitos y náuseas. El SHO se observó aproximadamente en el 4 % de las pacientes tratadas con Ovitrelle. Menos del 0,5 % de las pacientes presentaron un SHO grave (ver sección 4.4.).
Lista de reacciones adversas
Las siguientes definiciones se aplican a la terminología sobre frecuencia empleada a continuación: muy frecuentes (>1/10), frecuentes (>1/100 a <1/10), poco frecuentes (>1/1.000 a <1/100), raras (>1/10.000 a <1/1.000), muy raras (<1/10.000), frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
Trastornos del sistema inmunológico
Muy raros: reacciones de hipersensibilidad moderadas o graves, incluyendo reacciones
anafilácticas y shock.
Trastornos psiquiátricos
Poco frecuentes: depresión, irritabilidad, inquietud.
Trastornos del sistema nervioso Frecuentes: cefalea.
Trastornos vasculares
Muy raros: tromboembolismo, usualmente asociado con SHO graves.
Trastornos gastrointestinales
Frecuentes: vómitos, náuseas, dolor abdominal.
Poco frecuentes: diarrea.
Trastornos de la _piel y del tejido subcutáneo
Muy raros: reacciones cutáneas leves, reversibles, que se manifiestan en forma de erupción.
Trastornos del aparato reproductor y de la mama Frecuentes: SHO leve o moderado.
Poco frecuentes: SHO grave, dolor mamario.
Trastornos generales y alteraciones en el lugar de administración Frecuentes: cansancio, reacciones locales en el lugar de inyección.
Se ha descrito embarazo ectópico, torsión ovárica y otras complicaciones en pacientes tras la administración de hCG. Éstas se consideran efectos concomitantes relacionados con las técnicas de reproducción asistida.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Anexo V.
4.9 Sobredosis
Se desconocen los efectos de la sobredosis de Ovitrelle. Sin embargo, existe la posibilidad de que una sobredosis de Ovitrelle dé lugar a SHO (ver sección 4.4).
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: hormonas sexuales y moduladores del sistema genital, gonadotrofinas, código ATC: G03GA08.
Mecanismo de acción
Ovitrelle es un medicamento con coriogonadotropina alfa, producida por técnicas de ADN recombinante. Posee la misma secuencia de aminoácidos que la hCG urinaria. La gonadotropina coriónica se une a las células de la teca (y de la granulosa) ovárica, por medio de un receptor transmembranario que comparte con la hormona luteinizante, el receptor LH/CG.
Efectos farmacodinámicos
El principal efecto farmacodinámico en mujeres es la reanudación de la meiosis ovocitaria, la rotura folicular (ovulación), la formación del cuerpo lúteo y la producción de progesterona y estradiol por el cuerpo lúteo.
En las mujeres, la gonadotropina coriónica actúa como un pico sustituto de la hormona luteinizante, que desencadena la ovulación.
Ovitrelle se utiliza para desencadenar la maduración folicular final y la luteinización precoz tras el uso de medicamentos que estimulan el desarrollo folicular.
Eficacia clínica y seguridad
En ensayos clínicos comparativos, la administración de una dosis de 250 microgramos de Ovitrelle fue tan eficaz como 5.000 UI ó 10.000 UI de hCG urinaria para inducir la maduración folicular final y la luteinización precoz al utilizar técnicas de reproducción asistida, y fue tan eficaz como 5.000 UI de hCG urinaria en inducción de la ovulación.
Hasta el momento, no hay signos de la formación de anticuerpos frente a Ovitrelle en seres humanos. La exposición repetida a Ovitrelle sólo se ha investigado en pacientes varones. La investigación clínica en mujeres para la indicación de ART y de anovulación se limitó a un ciclo de tratamiento.
5.2 Propiedades farmacocinéticas
Tras la administración intravenosa, la coriogonadotropina alfa se distribuye en el espacio extracelular con una semivida de distribución de alrededor de 4,5 horas. En equilibrio estacionario, el volumen de distribución y el aclaramiento total son de 61 y de 0,2 l/h, respectivamente. No hay evidencias de que la coriogonadotropina alfa se metabolice y se excrete de forma distinta a como lo hace la hCG endógena.
Tras la administración subcutánea, la coriogonadotropina alfa se elimina del organismo con una semivida de eliminación de alrededor de 30 horas, y la biodisponibilidad absoluta es del 40 % aproximadamente.
Un estudio comparativo entre la formulación liofilizada y la solución inyectable demostró la bioequivalencia de ambas formulaciones.
5.3 Datos preclínicos sobre seguridad
Los datos de los estudios no clínicos no muestran riesgos especiales para los seres humanos según los estudios convencionales de farmacología de seguridad, toxicidad a dosis repetidas y genotoxicidad. No se han realizado estudios sobre el potencial carcinogénico. Ello se justifica por la naturaleza proteica del principio activo y el resultado negativo de las pruebas de genotoxicidad.
No se han realizado estudios de reproducción en animales.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Manitol.
Metionina.
Poloxámero 188.
Ácido fosfórico (para el ajuste del pH).
Hidróxido sódico (para el ajuste del pH).
Agua para inyección.
6.2 Incompatibilidades
En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros.
6.3 Periodo de validez 2 años.
Una vez abierto, el medicamento debe utilizarse inmediatamente. Sin embargo, se ha demostrado la estabilidad en uso durante 24 horas, conservado en nevera (entre 2 °C y 8 °C).
6.4 Precauciones especiales de conservación
Conservar en nevera (entre 2 °C y 8 °C). Conservar en el embalaje original. Durante el periodo de validez, la solución puede conservarse a una temperatura no superior a 25 °C durante un máximo de 30 días sin volverla a refrigerar durante este periodo, y debe desecharse si no se utiliza después de estos 30 días.
6.5 Naturaleza y contenido del envase
0,5 ml de solución en una jeringa precargada (vidrio tipo I) con un tapón-émbolo (goma de halobutilo) y émbolo (plástico) y con una aguja para inyección (inoxidable): envase de 1.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Unicamente debe utilizarse una solución transparente, sin partículas.
Para un solo uso.
La autoadministración de Ovitrelle sólo debe realizarse por pacientes adecuadamente entrenadas, con acceso al consejo de un profesional.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Merck Serono Europe Limited 56, Marsh Wall London E14 9TP.
Reino Unido
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/00/165/007
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 02/febrero/2001.
Fecha de la última renovación: 02/febrero/2006.
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
1. NOMBRE DEL MEDICAMENTO
Ovitrelle 250 microgramos solución inyectable en pluma precargada.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada pluma precargada contiene 250 microgramos de coriogonadotropina alfa2 (equivalentes a 6.500 UI aproximadamente).
* gonadotropina coriónica humana recombinante, r-hCG producida por tecnología de ADN recombinante en células de ovario de hámster chino (OHC).
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Solución inyectable en pluma precargada.
Solución transparente, incolora o ligeramente amarillenta.
El pH de la solución es 7,0 ± 0,3, su osmolalidad es de 250-400 mOsm/kg.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Ovitrelle está indicado en el tratamiento de:
• Mujeres adultas sometidas a superovulación para practicar técnicas de reproducción asistida, tales como la fertilización in vitro (FIV): Ovitrelle se administra para desencadenar la maduración folicular final y la luteinización tras la estimulación del desarrollo folicular.
• Mujeres adultas con anovulación u oligovulación: Ovitrelle se administra para desencadenar la ovulación y la luteinización en mujeres con anovulación u oligovulación tras la estimulación del desarrollo folicular.
4.2 Posología y forma de administración
El tratamiento con Ovitrelle debe realizarse bajo la supervisión de un médico con experiencia en el tratamiento de los problemas de la fertilidad.
Posología
La dosis máxima es de 250 microgramos. Se debe utilizar la siguiente pauta de administración:
• Mujeres sometidas a superovulación para practicar técnicas de reproducción asistida, tales como la fertilización in vitro (FIV):
Debe administrarse una pluma precargada de Ovitrelle (250 microgramos) 24 a 48 horas después de la última administración de un preparado de folitropina (FSH) o de gonadotropina menopáusica humana (hMG), es decir, cuando se ha logrado una estimulación óptima del desarrollo folicular.
Poblaciones especiales
Insuficiencia renal o hepática
No se han establecido todavía la seguridad, eficacia ni farmacocinética de Ovitrelle en pacientes con insuficiencia renal o hepática.
Población pediátrica
No existe una recomendación de uso específica para Ovitrelle en la población pediátrica.
Forma de administración
Para uso por vía subcutánea. La autoadministración de Ovitrelle sólo debe realizarse por pacientes adecuadamente entrenadas, con acceso al consejo de un profesional.
Ovitrelle es para un solo uso.
Para consultar las instrucciones de administración con la pluma precargada, ver la sección 6.6 y las “Instrucciones de uso” proporcionadas en el envase.
4.3 Contraindicaciones
• Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
• Tumores del hipotálamo o de la hipófisis.
• Aumento del tamaño de los ovarios o quistes no debidos a enfermedad del ovario poliquístico.
• Hemorragias ginecológicas de etiología desconocida.
• Carcinoma ovárico, uterino o mamario.
• Embarazo extrauterino en los 3 meses anteriores.
• Trastornos tromboembólicos activos.
• Insuficiencia ovárica primaria.
• Malformaciones de los órganos sexuales incompatibles con el embarazo.
• Fibromas uterinos incompatibles con el embarazo.
• Mujeres posmenopáusicas.
4.4 Advertencias y precauciones especiales de empleo
Antes de iniciar el tratamiento, debe valorarse adecuadamente el tipo de infertilidad de la pareja y la posible existencia de contraindicaciones para el embarazo. En particular, debe descartarse la presencia de hipotiroidismo, insuficiencia suprarrenal, hiperprolactinemia y tumores hipofisarios o hipotalámicos, instaurando el tratamiento específico apropiado.
No se dispone de experiencia clínica con Ovitrelle en el tratamiento de otras enfermedades (tales como la insuficiencia del cuerpo lúteo o los trastornos masculinos); por lo tanto, Ovitrelle no está indicado para estas enfermedades.
Síndrome de hiperestimulación ovárica (SHO)
Las pacientes sometidas a estimulación ovárica tienen un mayor riesgo de presentar un SHO, debido al desarrollo de múltiples folículos.
El SHO puede convertirse en un problema médico grave, caracterizado por grandes quistes ováricos que pueden romperse, aumento de peso, disnea, oliguria o la presencia de ascitis en el contexto de un cuadro clínico de disfunción circulatoria. En casos raros el SHO grave se puede complicar con hemoperitoneo, síndrome de distrés respiratorio agudo, torsión ovárica y tromboembolia.
Para minimizar el riesgo de SHO, se deben realizar evaluaciones ecográficas del desarrollo folicular y/o una determinación de los niveles séricos de estradiol antes del tratamiento y a intervalos regulares durante el tratamiento. En caso de anovulación, el riesgo de SHO aumenta si existe un nivel sérico de estradiol >1.500 pg/ml (5.400 pmol/l) y más de 3 folículos con un diámetro igual o superior a 14 mm. En las técnicas de reproducción asistida, aumenta el riesgo de SHO con unos niveles séricos de estradiol >3.000 pg/ml (11.000 pmol/l) y 18 folículos o más con un diámetro igual o superior a 11 mm.
El SHO debido a una respuesta oválica excesiva puede evitarse dejando de administrar hCG. Por tanto, si aparecen signos de hiperestimulación ovárica tales como un nivel de estradiol >5.500 pg/ml (20.000 pmol/l) y/o un total de 30 folículos o más, se recomienda abstenerse de administrar hCG y advertir a la paciente que no practique el coito o que utilice métodos anticonceptivos de barrera durante al menos 4 días.
Embarazo múltiple
En pacientes sometidas a inducción de la ovulación, la incidencia de embarazo y partos múltiples (en su mayoría gemelares) es más elevada que en el caso de concepción natural. El riesgo de embarazos múltiples en pacientes sometidas a técnicas de reproducción asistida se relaciona con el número de embriones implantados.
El riesgo de SHO y de embarazos múltiples puede minimizarse utilizando la dosis y el esquema posológico de Ovitrelle recomendados y controlando cuidadosamente el tratamiento.
Abortos
La incidencia de abortos, tanto en las pacientes con anovulación como en las sometidas a técnicas de reproducción asistida, es superior a la observada en la población normal, pero comparable a las tasas observadas en mujeres con otros problemas de fertilidad.
Embarazo ectópico
Como las mujeres infértiles sometidas a ART, y especialmente a FIV, tienen con frecuencia anomalías de las trompas, la incidencia de embarazos ectópicos puede verse incrementada. Es importante obtener confirmación ecográfica temprana de que un embarazo es intrauterino y excluir la posibilidad de un embarazo extrauterino.
Malformaciones congénitas
La incidencia de malformaciones congénitas después de ART puede ser algo mayor que después de concepciones espontáneas. Se cree que esto se debe a diferencias en las características de los padres (p. ej., la edad materna, características del esperma) y a la mayor incidencia de embarazos múltiples.
Episodios tromboembólicos
En mujeres con enfermedad tromboembólica reciente o en curso, con factores de riesgo generalmente reconocidos para padecer episodios tromboembólicos tales como los antecedentes personales o familiares, el tratamiento con gonadotropinas puede aumentar más el riesgo de agravación o aparición de dichos episodios. En estas mujeres, deben sopesarse los beneficios de la administración de gonadotropina frente a sus riesgos. Sin embargo, hay que señalar que el propio embarazo, así como el SHO también llevan asociado un mayor riesgo de episodios tromboembólicos, tales como embolia pulmonar, ictus isquémico o infarto de miocardio.
Interferencia con pruebas analíticas en suero y en orina
Tras su administración, Ovitrelle puede interferir durante un periodo de hasta 10 días con la determinación inmunológica de hCG en suero u orina, lo que puede dar lugar a un falso positivo en el resultado de la prueba de embarazo.
Se debe advertir a las pacientes de este hecho.
Información adicional
Durante el tratamiento con Ovitrelle puede producirse una discreta estimulación tiroidea, cuya relevancia clínica se desconoce.
Este medicamento contiene menos de 1 mmol de sodio (23 mg) por dosis; esto es, esencialmente “exento de sodio”.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios específicos de interacciones entre Ovitrelle y otros medicamentos; no obstante, no se han descrito interacciones farmacológicas clínicamente significativas durante el tratamiento con hCG.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No existe ninguna indicación para la utilización de Ovitrelle durante el embarazo. No se dispone de datos clínicos en relación con la exposición durante el embarazo. No se han realizado estudios de reproducción con coriogonadotropina alfa en animales (ver sección 5.3). Se desconoce el riesgo potencial para el ser humano.
Lactancia
Ovitrelle no está indicado durante la lactancia. No existen datos sobre la excreción de coriogonadotropina alfa en la leche.
Fertilidad
Ovitrelle está indicado para el uso en caso de infertilidad (ver sección 4.1).
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
Se prevé que la influencia de Ovitrelle sobre la capacidad para conducir y utilizar máquinas sea nula o insignificante.
4.8 Reacciones adversas
Resumen del perfil de seguridad
En ensayos clínicos comparativos con diferentes dosis de Ovitrelle, se observaron las siguientes reacciones adversas relacionadas con la dosis de Ovitrelle: SHO, vómitos y náuseas. El SHO se observó aproximadamente en el 4 % de las pacientes tratadas con Ovitrelle. Menos del 0,5 % de las pacientes presentaron un SHO grave (ver sección 4.4.).
Lista de reacciones adversas
Las siguientes definiciones se aplican a la terminología sobre frecuencia empleada a continuación: muy frecuentes (>1/10), frecuentes (>1/100 a <1/10), poco frecuentes (>1/1.000 a <1/100), raras (>1/10.000 a <1/1.000), muy raras (<1/10.000), frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
Trastornos del sistema inmunológico
Muy raros: reacciones de hipersensibilidad moderadas o graves, incluyendo reacciones
anafilácticas y shock.
Trastornos psiquiátricos
Poco frecuentes: depresión, irritabilidad, inquietud.
Trastornos del sistema nervioso Frecuentes: cefalea.
Trastornos vasculares
Muy raros: tromboembolismo, usualmente asociado con SHO graves.
Trastornos gastrointestinales
Frecuentes: vómitos, náuseas, dolor abdominal.
Poco frecuentes: diarrea.
Trastornos de la _piel y del tejido subcutáneo
Muy raros: reacciones cutáneas leves, reversibles, que se manifiestan en forma de erupción.
Trastornos del aparato reproductor y de la mama Frecuentes: SHO leve o moderado.
Poco frecuentes: SHO grave, dolor mamario.
Trastornos generales y alteraciones en el lugar de administración Frecuentes: cansancio, reacciones locales en el lugar de inyección.
Se ha descrito embarazo ectópico, torsión ovárica y otras complicaciones en pacientes tras la administración de hCG. Éstas se consideran efectos concomitantes relacionados con las técnicas de reproducción asistida.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Anexo V.
4.9 Sobredosis
Se desconocen los efectos de la sobredosis de Ovitrelle. Sin embargo, existe la posibilidad de que una sobredosis de Ovitrelle dé lugar a SHO (ver sección 4.4).
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: hormonas sexuales y moduladores del sistema genital, gonadotrofinas, código ATC: G03GA08.
Mecanismo de acción
Ovitrelle es un medicamento con coriogonadotropina alfa, producida por técnicas de ADN recombinante. Posee la misma secuencia de aminoácidos que la hCG urinaria. La gonadotropina coriónica se une a las células de la teca (y de la granulosa) ovárica, por medio de un receptor transmembranario que comparte con la hormona luteinizante, el receptor LH/CG.
Efectos farmacodinámicos
El principal efecto farmacodinámico en mujeres es la reanudación de la meiosis ovocitaria, la rotura folicular (ovulación), la formación del cuerpo lúteo y la producción de progesterona y estradiol por el cuerpo lúteo.
En las mujeres, la gonadotropina coriónica actúa como un pico sustituto de la hormona luteinizante, que desencadena la ovulación.
Ovitrelle se utiliza para desencadenar la maduración folicular final y la luteinización precoz tras el uso de medicamentos que estimulan el desarrollo folicular.
Eficacia clínica y seguridad
En ensayos clínicos comparativos, la administración de una dosis de 250 microgramos de Ovitrelle fue tan eficaz como 5.000 UI ó 10.000 UI de hCG urinaria para inducir la maduración folicular final y la luteinización precoz al utilizar técnicas de reproducción asistida, y fue tan eficaz como 5.000 UI de hCG urinaria en inducción de la ovulación.
Hasta el momento, no hay signos de la formación de anticuerpos frente a Ovitrelle en seres humanos. La exposición repetida a Ovitrelle sólo se ha investigado en pacientes varones. La investigación clínica en mujeres para la indicación de ART y de anovulación se limitó a un ciclo de tratamiento.
5.2 Propiedades farmacocinéticas
Tras la administración intravenosa, la coriogonadotropina alfa se distribuye en el espacio extracelular con una semivida de distribución de alrededor de 4,5 horas. En equilibrio estacionario, el volumen de distribución y el aclaramiento total son de 6 l y de 0,2 l/h, respectivamente. No hay evidencias de que la coriogonadotropina alfa se metabolice y se excrete de forma distinta a como lo hace la hCG endógena.
Tras la administración subcutánea, la coriogonadotropina alfa se elimina del organismo con una semivida de eliminación de alrededor de 30 horas, y la biodisponibilidad absoluta es del 40% aproximadamente.
Un estudio comparativo entre la formulación liofilizada y la solución inyectable demostró la bioequivalencia de ambas formulaciones.
5.3 Datos preclínicos sobre seguridad
Los datos de los estudios no clínicos no muestran riesgos especiales para los seres humanos según los estudios convencionales de farmacología de seguridad, toxicidad a dosis repetidas y genotoxicidad. No se han realizado estudios sobre el potencial carcinogénico. Ello se justifica por la naturaleza proteica del principio activo y el resultado negativo de las pruebas de genotoxicidad.
No se han realizado estudios de reproducción en animales.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Manitol.
Metionina.
Hidrogenofosfato de disodio dihidrato.
Dihidrogenofosfato de sodio monohidrato.
Poloxámero 188.
Ácido fosfórico (para el ajuste del pH).
Hidróxido sódico (para el ajuste del pH).
Agua para inyección.
6.2 Incompatibilidades
En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros.
6.3 Periodo de validez 2 años.
Una vez abierto, el medicamento debe utilizarse inmediatamente.
6.4 Precauciones especiales de conservación
Conservar en nevera (entre 2 °C y 8 °C). No congelar.
6.5 Naturaleza y contenido del envase
Cartucho de 3 ml (vidrio tipo I con un tapón-émbolo de goma de bromobutilo y una cápsula plegada de aluminio con goma de bromobutilo) pre-ensamblado en una pluma precargada. Cada pluma precargada contiene 0,5 ml de solución inyectable.
Envase de 1 pluma precargada y 1 aguja para inyección.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Consultar las “Instrucciones de uso” proporcionadas en el envase.
Unicamente debe utilizarse una solución transparente, sin partículas. Utilizar cada aguja y pluma una sola vez.
La autoadministración de Ovitrelle sólo debe realizarse por pacientes adecuadamente entrenadas, con acceso al consejo de un profesional.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Merck Serono Europe Limited 56, Marsh Wall London E14 9TP.
Reino Unido
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/00/165/008
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 02/febrero/2001.
Fecha de la última renovación: 02/febrero/2006.
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
ANEXO II
A. FABRICANTE DEL PRINCIPIO ACTIVO BIOLÓGICO Y FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
A. FABRICANTE DEL PRINCIPIO ACTIVO BIOLÓGICO Y FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección del fabricante del principio activo biológico
Merck Serono S.A.
Zone Industrielle de l’Ouriettaz
1170 Aubonne
Suiza
Nombre y dirección del fabricante responsable de la liberación de los lotes
Merck Serono S.p.A.
Via delle Magnolie 15 70026 Modugno (Bari)
Italia
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica restringida (ver Anexo I: Ficha Técnica o Resumen de las Características del Producto, sección 4.2).
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
El Titular de la Autorización de Comercialización (TAC) presentará los informes periódicos de seguridad para este medicamento de conformidad con las exigencias establecidas en la lista de fechas de referencia de la Unión (lista EURD) prevista en el artículo 107ter, párrafo 7, de la Directiva 2001/83/CE y publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado en la versión del PGR incluido en el Módulo 1.8.2 de la Autorización de Comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos.
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
Si coincide la presentación de un IPS con la actualización del PGR, ambos documentos se pueden presentar conjuntamente.
ANEXO III
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
1. NOMBRE DEL MEDICAMENTO
Ovitrelle 250 microgramos/0,5 ml solución inyectable en jeringa precargada. Coriogonadotropina alfa.
2. PRINCIPIO(S) ACTIVO(S)
Cada jeringa precargada contiene: 250 microgramos (6.500 UI) de coriogonadotropina alfa.
3. LISTA DE EXCIPIENTES
Manitol, metionina, poloxámero 188, ácido fosfórico (para el ajuste del pH), hidróxido sódico (para el ajuste del pH), agua para inyección.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
1 jeringa precargada con 0,5 ml de solución inyectable.
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Para un solo uso.
Leer el prospecto antes de utilizar este medicamento. Vía subcutánea.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Conservar en nevera. Conservar en el embalaje original. Puede conservarse a temperatura no superior a 25 °C durante un máximo de 30 días, sin refrigerarlo de nuevo durante este periodo y debe desecharse si no se utiliza durante estos 30 días.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Merck Serano Europe Limited 56, Marsh Wall London E14 9TP Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/00/165/007
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
ovitrelle 250/0,5 ml
1. NOMBRE DEL MEDICAMENTO
Ovitrelle 250 microgramos solución inyectable en pluma precargada Coriogonadotropina alfa
2. PRINCIPIO(S) ACTIVO(S)
Cada pluma precargada contiene 250 microgramos (aproximadamente 6.500 UI) de coriogonadotropina alfa.
3. LISTA DE EXCIPIENTES
Manitol, metionina, hidrogenofosfato de disodio dihidrato, dihidrogenofosfato de sodio monohidrato, poloxámero 188, ácido fosfórico (para el ajuste del pH), hidróxido sódico (para el ajuste del pH), agua para inyección.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Solución inyectable.
1 pluma precargada con 0,5 ml de solución 1 aguja para inyección
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Para un solo uso.
Leer el prospecto antes de utilizar este medicamento. Vía subcutánea.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Conservar en nevera. No congelar.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Merck Serono Europe Limited 56, Marsh Wall London E14 9TP Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/00/165/008
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
ovitrelle 250 pluma
ETIQUETA DE LA JERINGA PRECARGADA
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Ovitrelle 250 microgramos/0,5 ml solución inyectable en jeringa precargada. Coriogonadotropina alfa.
Vía subcutánea.
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
250 microgramos/0,5 ml.
6. OTROS
ETIQUETA DE LA PLUMA PRECARGADA
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Ovitrelle 250 microgramos solución inyectable en pluma precargada. Coriogonadotropina alfa.
Vía subcutánea.
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
250 microgramos/0,5 ml.
6. OTROS
B. PROSPECTO
Prospecto: información para el usuario
Ovitrelle 250 microgramos/0,5 ml solución inyectable en jeringa precargada.
Coriogonadotropina alfa.
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto:
1. Qué es Ovitrelle y para qué se utiliza
2. Qué necesita saber antes de empezar a usar Ovitrelle
3. Cómo usar Ovitrelle
4. Posibles efectos adversos
5. Conservación de Ovitrelle
6. Contenido del envase e información adicional
1. Qué es Ovitrelle y para qué se utiliza Qué es Ovitrelle
Ovitrelle contiene un medicamento denominado “coriogonadotropina alfa”, fabricado en laboratorio mediante una técnica especial de ADN recombinante. La coriogonadotropina alfa es similar a una hormona que se encuentra en su organismo de forma natural denominada “gonadotropina coriónica”, que interviene en la reproducción y la fertilidad.
Para qué se utiliza Ovitrelle
Ovitrelle se utiliza junto con otros medicamentos:
• Para ayudar a que se desarrollen y maduren varios folículos (cada uno contiene un óvulo) en mujeres sometidas a Técnicas de Reproducción Asistida (procedimiento que puede ayudarle a quedarse embarazada), tales como la “fertilización in vitro”. Se darán primero otros medicamentos para desencadenar el crecimiento de varios folículos.
• Para ayudar a que se libere un óvulo del ovario (inducción de la ovulación) en mujeres que no pueden producir óvulos (“anovulación”) o producen muy pocos (“oligovulación”). Se darán primero otros medicamentos para desarrollar y madurar los folículos.
2. Qué necesita saber antes de empezar a usar Ovitrelle No use Ovitrelle
• si es alérgica a la coriogonadotropina alfa, o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6)
• si tiene un tumor en una parte de su cerebro llamada “hipotálamo” o “hipófisis”,
• si tiene ovarios grandes o bolsas grandes de líquido dentro de los ovarios (quistes ováricos) de
origen desconocido,
• si tiene hemorragias vaginales de causa desconocida,
• si tiene un cáncer de ovario, útero o mama,
• si ha tenido un embarazo fuera del útero (embarazo extrauterino) en los últimos tres meses,
• si padece de inflamación grave de las venas o coágulos de sangre en las venas (problemas
tromboembólicos activos),
• si presenta Vd. alguna circunstancia que por lo general impide un embarazo normal, como menopausia o menopausia precoz (insuficiencia ovárica), o malformaciones de los órganos sexuales.
No use Ovitrelle si se cumple cualquiera de las anteriores condiciones. Si no está segura, consulte a su médico antes de tomar este medicamento.
Advertencias y precauciones
Antes de iniciar el tratamiento, su fertilidad y la de su pareja deben ser evaluadas por un médico experto en el tratamiento de problemas de fertilidad.
Síndrome de hiperestimulación ovárica (SHO)
Este medicamento puede aumentar el riesgo de que presente un SHO. Esto ocurre cuando los folículos se desarrollan demasiado y se convierten en grandes quistes.
Si nota dolor en la parte inferior del abdomen, aumenta de peso rápidamente, tiene náuseas o vomita, o tiene dificultad para respirar, no se administre la inyección de Ovitrelle y consulte a su médico inmediatamente (ver la sección 4). Si desarrolla un SHO, se le puede indicar que no practique el sexo o que utilice un método anticonceptivo de barrera durante al menos cuatro días.
El riesgo de SHO disminuye si se utiliza la dosis habitual de Ovitrelle y si Vd. es controlada cuidadosamente a lo largo del ciclo de tratamiento (por ejemplo, mediante análisis de sangre para medir los niveles de estradiol y ecografías).
Embarazo múltiple o anomalías congénitas
Durante el uso de Ovitrelle Vd. tiene un mayor riesgo de quedarse embarazada de más de un bebé al mismo tiempo (“embarazo múltiple”, normalmente de gemelos) que si concibe de forma natural. El embarazo múltiple puede dar lugar a complicaciones para Vd. y para sus bebés. Durante el tratamiento con técnicas de reproducción asistida, el riesgo de tener un embarazo múltiple está relacionado con el número de óvulos fertilizados o embriones que se le implanten en el cuerpo. Los embarazos múltiples y ciertas características específicas de las parejas con problemas de fertilidad (p. ej., la edad) pueden estar relacionados también con un aumento de las probabilidades de anomalías congénitas.
El riesgo de embarazos múltiples disminuye si se utiliza la dosis habitual de Ovitrelle y si Vd. es controlada cuidadosamente a lo largo del ciclo de tratamiento (por ejemplo, mediante análisis de sangre para medir los niveles de estradiol y ecografías).
Embarazo ectópico
Puede producirse un embarazo fuera del útero (embarazo ectópico) en mujeres con lesiones en las trompas de Falopio (los conductos que transportan el óvulo desde el ovario hasta el útero). Por tanto, su médico debe realizar un examen ecográfico temprano para descartar la posibilidad de embarazo fuera del útero.
Aborto
Durante el tratamiento con técnicas de reproducción asistida o de estimulación de sus ovarios para producir óvulos, tiene una mayor probabilidad de tener un aborto que la media de las mujeres.
Problemas de coagulación de la sangre (episodios tromboembólicos)
Si ha tenido en el pasado o recientemente coágulos de sangre en las piernas o pulmones, o un ataque al corazón o un ictus, o si los ha padecido algún familiar, entonces puede tener un riesgo mayor de que aparezcan estos problemas o empeoren con el tratamiento con Ovitrelle.
Pruebas de embarazo
Si se realiza una prueba de embarazo con suero u orina después de usar Ovitrelle, y hasta diez días después, puede ocurrir que obtenga un resultado de la prueba falso positivo. Si no está segura, consúltelo con su médico.
Niños y adolescentes
Ovitrelle no se debe utilizar en niños y adolescentes.
Uso de Ovitrelle con otros medicamentos
Informe a su médico si está utilizando, ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento.
Embarazo y lactancia
No use Ovitrelle si está embarazada o en periodo de lactancia.
Consulte a su médico o farmacéutico antes de utilizar cualquier medicamento.
Conducción y uso de máquinas
No se prevé que Ovitrelle afecte a su capacidad de conducir o usar máquinas.
Información importante sobre algunos de los componentes de Ovitrelle
Este medicamento contiene menos de 1 mmol de sodio (23 mg) por dosis; esto es, esencialmente “exento de sodio”.
3. Cómo usar Ovitrelle
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico. En caso de duda, consulte de nuevo a su médico o farmacéutico.
Cuánto utilizar
• La dosis recomendada es 1 jeringa precargada (250 microgramos/0,5 ml) en una inyección única.
• Su médico le habrá explicado exactamente cuándo debe ponerse la inyección.
Uso de este medicamento
• Ovitrelle se administra por vía subcutánea, es decir, mediante inyección bajo la piel.
• Cada jeringa precargada es para un solo uso. Sólo debe utilizarse una solución transparente, sin partículas.
• Su médico o enfermero le enseñará cómo usar la jeringa precargada de Ovitrelle para inyectar el medicamento.
• Inyéctese Ovitrelle del modo que le enseñó su médico o enfermero.
• Después de la inyección, deseche la aguja usada de forma segura.
Si se va a administrar Ovitrelle usted misma, lea con detenimiento las siguientes instrucciones:
1. Lávese las manos. Es importante que sus manos y los materiales que utilice estén lo más limpios posible.
2. Reúna todo lo que vaya a necesitar. Tenga en cuenta que las torundas empapadas en alcohol no se incluyen en el embalaje. Busque un lugar limpio y prepare todo:
- dos torundas de algodón empapadas en alcohol,
- una jeringa precargada que contiene el medicamento.
Inyecte la solución inmediatamente: su médico o enfermero le habrán indicado dónde debe poner la inyección (p. ej., vientre, parte delantera del muslo). Limpie la zona elegida con un algodón embebido de alcohol. Pellizque enérgicamente la piel e introduzca la aguja con un ángulo de 45° a 90°, con un movimiento similar al de los dardos. Inyecte bajo la piel, según las instrucciones recibidas. No inyecte directamente en una vena. Introduzca la solución presionando suavemente sobre el émbolo. Emplee todo el tiempo que necesite hasta inyectar la totalidad de la solución. Retire inmediatamente la aguja y limpie la piel con un algodón embebido de alcohol realizando un movimiento circular.
3. Inyección:
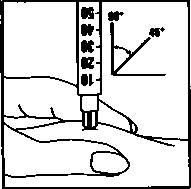
4. Deseche todo el material usado:
Una vez finalizada la inyección, deseche inmediatamente todas las agujas y envases de vidrio vacíos en una caja para material desechable. Debe desecharse cualquier porción de la disolución no utilizada.
Si usa más Ovitrelle del que debe
Si se utiliza demasiado Ovitrelle, es posible que se produzca un síndrome de hiperestimulación ovárica Acuda a su médico inmediatamente si nota dolor en la parte inferior del abdomen, aumenta de peso rápidamente, tiene náuseas o vomita, o tiene dificultad para respirar.
Si olvidó usar Ovitrelle
Si olvidó usar Ovitrelle, contacte con su médico tan pronto como se dé cuenta.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no
todas las personas los sufran.
Si nota alguno de los siguientes efectos adversos graves, interrumpa el uso de Ovitrelle y consulte
inmediatamente a un médico, puede que necesite tratamiento médico urgente:
• Las reacciones alérgicas tales como pulso acelerado o irregular, hinchazón de la lengua o garganta, estornudos, sibilancias o dificultad respiratoria grave son muy raras (pueden afectar hasta a 1 de cada 10.000 personas).
• El dolor en la parte inferior del abdomen acompañado de náuseas (tener ganas de vomitar) o los vómitos pueden ser síntomas del síndrome de hiperestimulación ovárica (SHO). Esto puede indicar que los ovarios reaccionaron de manera exagerada al tratamiento y se desarrollaron grandes quistes ováricos (ver también en la sección 2 bajo “Síndrome de hiperestimulación ovárica”). Estos episodios son frecuentes (pueden afectar hasta a 1 de cada 10 personas).
• El SHO puede llegar a hacerse grave con ovarios claramente agrandados, un descenso en la producción de orina, aumento de peso, dificultad respiratoria y posible acumulación de líquidos en el estómago o pecho. Estos episodios son poco frecuentes (pueden afectar hasta a 1 de cada 100 personas).
• Las complicaciones graves de coagulación de la sangre (episodios tromboembólicos) independientes del SHO se observan muy raramente. Éstas podrían provocar dolor en el pecho, falta de aliento, ictus o ataque al corazón (ver también en la sección 2 bajo “Problemas de coagulación de la sangre”).
Otros efectos adversos
Frecuentes (pueden afectar hasta a 1 de cada 10 personas)
• Dolor de cabeza, sensación de cansancio.
• Reacciones locales en el lugar de inyección, tales como dolor, enrojecimiento o hinchazón.
Poco frecuentes (pueden afectar hasta a 1 de cada 100 personas)
• Diarrea.
• Depresión, irritabilidad o intranquilidad.
• Dolor en las mamas.
Muy raros (pueden afectar hasta a 1 de cada 10.000 personas)
• Reacciones alérgicas leves de la piel, como erupción.
Puede producirse un embarazo fuera del útero, torsión ovárica (un trastorno que afecta a los ovarios) y otras complicaciones a causa de las técnicas de reproducción asistida que pueda utilizar su médico.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Anexo V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Ovitrelle
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la etiqueta y en la caja después de CAD. La fecha de caducidad es el último día del mes que se indica.
Conservar en nevera (entre 2 °C y 8 °C). Conservar en el embalaje original. Ovitrelle 250 microgramos solución inyectable puede conservarse a temperatura ambiente (no superior a 25 °C) durante un máximo de 30 días, sin refrigerarlo de nuevo durante este periodo, y debe desecharse si no se utiliza durante estos 30 días.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de Ovitrelle
• El principio activo es coriogonadotropina alfa, producida por tecnología de ADN recombinante.
• Cada jeringa precargada contiene 250 microgramos/0,5 ml (equivalente a 6.500 UI).
• Los demás componentes son manitol, metionina, poloxámero 188, ácido fosfórico, hidróxido sódico, agua para inyección.
Aspecto del producto y contenido del envase
Ovitrelle se presenta como solución inyectable.
Está disponible en una jeringa precargada (envase de 1).
Titular de la autorización de comercialización
Merck Serano Europe Limited, 56 Marsh Wall, London E14 9TP,
Reino Unido
Responsable de la fabricación
Merck Serono S.p.A., Via delle Magnolie 15, 70026 Modugno (Bari), Italia.
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
|
Belgie/Belgique/Belgien MERCK NV/SA Tél/Tel: +32-2-686 07 11 |
Lietuva Merck Serono UAB Tel: +370 37320603 |
|
Etarapna „MepK Etarapu^ EAfl Tea.: +359 24461 111 |
Luxembourg/Luxemburg MERCK NV/SA, Belgique/Belgien Tél/Tel: +32-2-686 07 11 |
|
Ceská republika Merck spol.s.r.o Tel. +420 272084211 |
Magyarország Merck Kft. Tel: +36-1-463-8100 |
|
Danmark Merck A/S Tlf: +45 35253550 |
Malta Cherubino Ltd Tel: +356-21-343270/1/2/3/4 |
|
Deutschland Merck Serono GmbH Tel: +49-6151-6285-0 |
Nederland Merck BV Tel: +31-20-6582800 |
|
Eesti Merck Serono OÜ Tel: +372 682 5882 |
Norge Merck Serono Norge Tlf: +47 67 90 35 90 |
|
EXXáSa Merck A.E. Tr[X: +30-210-61 65 100 |
Osterreich Merck GesmbH. Tel: +43 1 57600-0 |
|
España Merck S.L. Línea de Información: 900 200 400 Tel: +34-91-745 44 00 |
Polska Merck Sp. z o.o. Tel.: +48 22 53 59 700 |
|
France Merck Serono s.a.s. Tél.: +33-4-72 78 25 25 Numéro vert : 0 800 888 024 |
Portugal Merck, s.a. Tel: +351-21-361 35 00 |
|
Hrvatska Merck d.o.o, Tel: +385 1 4864 111 |
Romania MERCK d.o.o., Slovenia Tel: +386 1 560 3 800 |
|
Íreland Merck Serono Ltd, United Kingdom Tel: +44-20 8818 7200 |
Slovenija MERCK d.o.o. Tel: +386 1 560 3 800 |
|
Ísland Icepharma hf Tel: + 354 540 8000 |
Slovenská republika Merck spol. s r.o. Tel: + 421 2 49 267 111 |
|
Italia Merck Serono S.p.A. Tel: +39-06-70 38 41 |
Suomi/Finland Merck Oy Puh/Tel: +358-9-8678 700 |
|
Kúnpoq Xp. r. nanaAorZou AtS TqA.: +357 22490305 |
Sverige Merck AB Tel: +46-8-562 445 00 |
|
Latvija Merck Serono SIA Tel: +371 67152500 |
United Kingdom Merck Serono Ltd Tel: +44-20 8818 7200 |
Fecha de la última revisión de este prospecto:
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
Prospecto: información para el usuario
Ovitrelle 250 microgramos solución inyectable en pluma precargada.
Coriogonadotropina alfa.
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas, aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto:
1. Qué es Ovitrelle y para qué se utiliza
2. Qué necesita saber antes de empezar a usar Ovitrelle
3. Cómo usar Ovitrelle
4. Posibles efectos adversos
5. Conservación de Ovitrelle
6. Contenido del envase e información adicional
1. Qué es Ovitrelle y para qué se utiliza Qué es Ovitrelle
Ovitrelle contiene un medicamento denominado “coriogonadotropina alfa”, fabricado en laboratorio mediante una técnica especial de ADN recombinante. La coriogonadotropina alfa es similar a una hormona que se encuentra en su organismo de forma natural denominada “gonadotropina coriónica”, que interviene en la reproducción y la fertilidad.
Para qué se utiliza Ovitrelle
Ovitrelle se utiliza junto con otros medicamentos:
• Para ayudar a que se desarrollen y maduren varios folículos (cada uno contiene un óvulo) en mujeres sometidas a Técnicas de Reproducción Asistida (procedimiento que puede ayudarle a quedarse embarazada), tales como la “fertilización in vitro”. Se darán primero otros medicamentos para desencadenar el crecimiento de varios folículos.
• Para ayudar a que se libere un óvulo del ovario (inducción de la ovulación) en mujeres que no pueden producir óvulos (“anovulación”) o producen muy pocos (“oligovulación”). Se darán primero otros medicamentos para desarrollar y madurar los folículos.
2. Qué necesita saber antes de empezar a usar Ovitrelle No use Ovitrelle
• si es alérgica a la coriogonadotropina alfa, o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6)
• si tiene un tumor en una parte de su cerebro llamada “hipotálamo” o “hipófisis”,
• si tiene ovarios grandes o bolsas grandes de líquido dentro de los ovarios (quistes ováricos) de
origen desconocido,
• si tiene hemorragias vaginales de causa desconocida,
• si tiene un cáncer de ovario, útero o mama,
• si ha tenido un embarazo fuera del útero (embarazo extrauterino) en los últimos tres meses,
• si padece de inflamación grave de las venas o coágulos de sangre en las venas (problemas
tromboembólicos activos),
• si presenta Vd. alguna circunstancia que por lo general impide un embarazo normal, como menopausia o menopausia precoz (insuficiencia ovárica), o malformaciones de los órganos sexuales.
No use Ovitrelle si se cumple cualquiera de las anteriores condiciones. Si no está segura, consulte a su médico antes de tomar este medicamento.
Advertencias y precauciones
Antes de iniciar el tratamiento, su fertilidad y la de su pareja deben ser evaluadas por un médico experto en el tratamiento de problemas de fertilidad.
Síndrome de hiperestimulación ovárica (SHO)
Este medicamento puede aumentar el riesgo de que presente un SHO. Esto ocurre cuando los folículos se desarrollan demasiado y se convierten en grandes quistes.
Si nota dolor en la parte inferior del abdomen, aumenta de peso rápidamente, tiene náuseas o vomita, o tiene dificultad para respirar, no se administre la inyección de Ovitrelle y consulte a su médico inmediatamente (ver la sección 4). Si desarrolla un SHO, se le puede indicar que no practique el sexo o que utilice un método anticonceptivo de barrera durante al menos cuatro días.
El riesgo de SHO disminuye si se utiliza la dosis habitual de Ovitrelle y si Vd. es controlada cuidadosamente a lo largo del ciclo de tratamiento (por ejemplo, mediante análisis de sangre para medir los niveles de estradiol y ecografías).
Embarazo múltiple o anomalías congénitas
Durante el uso de Ovitrelle Vd. tiene un mayor riesgo de quedarse embarazada de más de un bebé al mismo tiempo (“embarazo múltiple”, normalmente de gemelos) que si concibe de forma natural. El embarazo múltiple puede dar lugar a complicaciones para Vd. y para sus bebés. Durante el tratamiento con técnicas de reproducción asistida, el riesgo de tener un embarazo múltiple está relacionado con el número de óvulos fertilizados o embriones que se le implanten en el cuerpo. Los embarazos múltiples y ciertas características específicas de las parejas con problemas de fertilidad (p. ej., la edad) pueden estar relacionados también con un aumento de las probabilidades de anomalías congénitas.
El riesgo de embarazos múltiples disminuye si se utiliza la dosis habitual de Ovitrelle y si Vd. es controlada cuidadosamente a lo largo del ciclo de tratamiento (por ejemplo, mediante análisis de sangre para medir los niveles de estradiol y ecografías).
Embarazo ectópico
Puede producirse un embarazo fuera del útero (embarazo ectópico) en mujeres con lesiones en las trompas de Falopio (los conductos que transportan el óvulo desde el ovario hasta el útero). Por tanto, su médico debe realizar un examen ecográfico temprano para descartar la posibilidad de embarazo fuera del útero.
Aborto
Durante el tratamiento con técnicas de reproducción asistida o de estimulación de sus ovarios para producir óvulos, tiene una mayor probabilidad de tener un aborto que la media de las mujeres.
Problemas de coagulación de la sangre (episodios tromboembólicos)
Si ha tenido en el pasado o recientemente coágulos de sangre en las piernas o pulmones, o un ataque al corazón o un ictus, o si los ha padecido algún familiar, entonces puede tener un riesgo mayor de que aparezcan estos problemas o empeoren con el tratamiento con Ovitrelle.
Pruebas de embarazo
Si se realiza una prueba de embarazo con suero u orina después de usar Ovitrelle, y hasta diez días después, puede ocurrir que obtenga un resultado de la prueba falso positivo. Si no está segura, consúltelo con su médico.
Niños y adolescentes
Ovitrelle no se debe utilizar en niños y adolescentes.
Uso de Ovitrelle con otros medicamentos
Informe a su médico si está utilizando, ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento.
Embarazo y lactancia
No use Ovitrelle si está embarazada o en periodo de lactancia.
Consulte a su médico o farmacéutico antes de utilizar cualquier medicamento.
Conducción y uso de máquinas
No se prevé que Ovitrelle afecte a su capacidad de conducir o usar máquinas.
Información importante sobre algunos de los componentes de Ovitrelle
Este medicamento contiene menos de 1 mmol de sodio (23 mg) por dosis; esto es, esencialmente “exento de sodio”.
3. Cómo usar Ovitrelle
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico.
En caso de duda, consulte de nuevo a su médico o farmacéutico.
Cuánto utilizar
• La dosis recomendada de Ovitrelle es 1 pluma precargada (250 microgramos/0,5 ml) en una inyección única.
• Su médico le explicará exactamente cuándo debe ponerse la inyección.
Uso de este medicamento
• Ovitrelle se administra mediante inyección bajo la piel (subcutáneamente).
• Cada pluma precargada es para un solo uso. Su médico o enfermero le enseñará cómo usar la pluma precargada de Ovitrelle para inyectar el medicamento.
• Si se va a administrar Ovitrelle usted misma, lea atentamente y siga las “Instrucciones de uso” proporcionadas en el envase.
• Inyéctese Ovitrelle del modo que le enseñó su médico o enfermero.
• Después de la inyección, deseche la aguja usada de forma segura y deseche la pluma.
Si usa más Ovitrelle del que debe
Si se utiliza demasiado Ovitrelle, es posible que se produzca un síndrome de hiperestimulación ovárica Acuda a su médico inmediatamente si nota dolor en la parte inferior del abdomen, aumenta de peso rápidamente, tiene náuseas o vomita, o tiene dificultad para respirar.
Si olvidó usar Ovitrelle
Si olvidó usar Ovitrelle, contacte con su médico tan pronto como se dé cuenta.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Si nota alguno de los siguientes efectos adversos graves, interrumpa el uso de Ovitrelle y consulte
inmediatamente a un médico, puede que necesite tratamiento médico urgente:
• Las reacciones alérgicas tales como pulso acelerado o irregular, hinchazón de la lengua o garganta, estornudos, sibilancias o dificultad respiratoria grave son muy raras (pueden afectar hasta a 1 de cada 10.000 personas).
• El dolor en la parte inferior del abdomen acompañado de náuseas (tener ganas de vomitar) o los vómitos pueden ser síntomas del síndrome de hiperestimulación ovárica (SHO). Esto puede indicar que los ovarios reaccionaron de manera exagerada al tratamiento y se desarrollaron grandes quistes ováricos (ver también en la sección 2 bajo “Síndrome de hiperestimulación ovárica”). Estos episodios son frecuentes (pueden afectar hasta a 1 de cada 10 personas).
• El SHO puede llegar a hacerse grave con ovarios claramente agrandados, un descenso en la producción de orina, aumento de peso, dificultad respiratoria y posible acumulación de líquidos en el estómago o pecho. Estos episodios son poco frecuentes (pueden afectar hasta a 1 de cada 100 personas).
• Las complicaciones graves de coagulación de la sangre (episodios tromboembólicos) independientes del SHO se observan muy raramente. Éstas podrían provocar dolor en el pecho, falta de aliento, ictus o ataque al corazón (ver también en la sección 2 bajo “Problemas de coagulación de la sangre”).
Otros efectos adversos
Frecuentes (pueden afectar hasta a 1 de cada 10 personas)
• Dolor de cabeza, sensación de cansancio.
• Reacciones locales en el lugar de inyección, tales como dolor, enrojecimiento o hinchazón.
Poco frecuentes (pueden afectar hasta a 1 de cada 100 personas)
• Diarrea.
• Depresión, irritabilidad o intranquilidad.
• Dolor en las mamas.
Muy raros (pueden afectar hasta a 1 de cada 10.000 personas)
• Reacciones alérgicas leves de la piel, como erupción.
Puede producirse un embarazo fuera del útero, torsión ovárica (un trastorno que afecta a los ovarios) y otras complicaciones a causa de las técnicas de reproducción asistida que pueda utilizar su médico.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Anexo V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Ovitrelle
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la etiqueta y en el envase después de CAD. La fecha de caducidad es el último día del mes que se indica.
Conservar en nevera (entre 2 °C y 8 °C). No congelar.
No utilice Ovitrelle si observa indicios visibles de deterioro, si el líquido contiene partículas o no es transparente.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de Ovitrelle
• El principio activo es coriogonadotropina alfa, producida por tecnología de ADN recombinante.
• Cada pluma precargada contiene 250 microgramos de coriogonadotropina alfa en 0,5 ml (equivalente a aproximadamente 6.500 Unidades Internacionales, UI).
• Los demás componentes son manitol, metionina, hidrogenofosfato de disodio dihidrato, dihidrogenofosfato de sodio monohidrato, poloxámero 188, ácido fosfórico (para el ajuste del pH), hidróxido sódico (para el ajuste del pH) y agua para inyección.
Aspecto del producto y contenido del envase
• Ovitrelle se presenta como un líquido transparente, incoloro o ligeramente amarillento para inyección en una pluma precargada.
• Cada pluma contiene 0,5 ml de solución.
• Se suministra en envases de 1 pluma precargada y 1 aguja para inyección.
Titular de la autorización de comercialización
Merck Serono Europe Limited, 56 Marsh Wall, London E14 9TP, Reino Unido
Responsable de la fabricación
Merck Serono S.p.A., Via delle Magnolie 15, 70026 Modugno (Bari), Italia.
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del
titular de la autorización de comercialización:
Lietuva
Merck Serono UAB Tel: +370 37320603
Belgie/Belgique/Belgien
MERCK NV/SA Tél/Tel: +32-2-686 07 11
Etarapun
„MepK Etarapn^ EAfl Tea.: +359 24461 111
Luxembourg/Luxemburg
MERCK NV/SA, Belgique/Belgien Tél/Tel: +32-2-686 07 11
Ceská republika
Merck spol.s.r.o
Tel. +420 272084211
Danmark
Merck A/S Tlf: +45 35253550
Malta
Cherubino Ltd
Tel: +356-21-343270/1/2/3/4
Norge
Merck Serono Norge
Tlf: +47 67 90 35 90
Eesti
Merck Serono OÜ Tel: +372 682 5882
EAAáSa Merck A.E.
Osterreich
Merck GesmbH. Tel: +43 1 57600-0
T^A: +30-210-61 65 100
|
España Merck S.L. Línea de Información: 900 200 400 Tel: +34-91-745 44 00 |
Polska Merck Sp. z o.o. Tel.: +48 22 53 59 700 |
|
France Merck Serono s.a.s. Tél.: +33-4-72 78 25 25 Numéro vert : 0 800 888 024 |
Portugal Merck, s.a. Tel: +351-21-361 35 00 |
|
Hrvatska Merck d.o.o, Tel: +385 1 4864 111 |
Romania MERCK d.o.o., Slovenia Tel: +386 1 560 3 800 |
|
Íreland Merck Serono Ltd, United Kingdom Tel: +44-20 8818 7200 |
Slovenija MERCK d.o.o. Tel: +386 1 560 3 800 |
|
Ísland Icepharma hf Tel: + 354 540 8000 |
Slovenská republika Merck spol. s r.o. Tel: + 421 2 49 267 111 |
|
Italia Merck Serono S.p.A. Tel: +39-06-70 38 41 |
Suomi/Finland Merck Oy Puh/Tel: +358-9-8678 700 |
|
Kúnpoq Xp. r. nanaAot^ou AtS T^A.: +357 22490305 |
Sverige Merck AB Tel: +46-8-562 445 00 |
|
Latvija Merck Serono SIA Tel: +371 67152500 |
United Kingdom Merck Serono Ltd Tel: +44-20 8818 7200 |
|
Fecha de la última revisión de este prospecto: |
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
Ovitrelle 250 microgramos solución inyectable en pluma precargada
Instrucciones de uso
CONTENIDO
1. Cómo usar la pluma precargada de Ovitrelle
2. Antes de comenzar a usar la pluma precargada
3. Preparación de la pluma precargada para la inyección
4. Fijación de la dosis: “Cómo fijar la dosis en 250”
5. Inyección de la dosis
6. Después de la inyección 1. Cómo usar la pluma precargada de Ovitrelle
Antes de empezar a usar la pluma precargada, lea primero estas instrucciones íntegramente. Esta pluma es sólo para su uso personal; no deje que nadie más la use.
Inyecte Ovitrelle como su médico o enfermero le han indicado.
Esta pluma es para un solo uso.
2. Antes de comenzar a usar la pluma precargada
2.1 Lávese las manos
• Es importante que las manos y los objetos que utilice para preparar la pluma estén lo más limpios posible.
2.2 Busque un lugar limpio
• Un lugar adecuado es una mesa o superficie limpia.
2.3 Reúna y disponga todo lo que vaya a necesitar:
• Torundas empapadas en alcohol.
• La pluma precargada.
• La aguja.
A continuación hay un diagrama que muestra el aspecto de la pluma precargada junto con la
identificación de sus componentes:
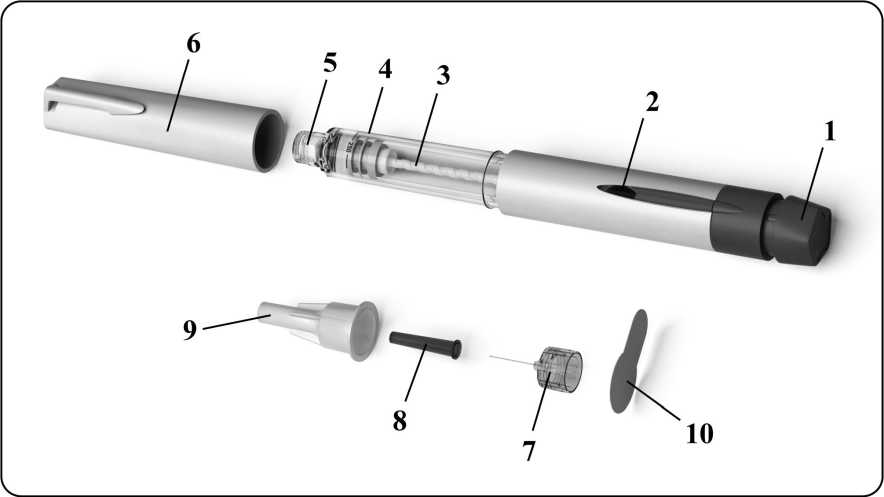
|
1. |
Botón de ajuste de la dosis |
6. |
Capuchón de la pluma |
|
2. |
Indicador de la dosis |
7. |
Aguja extraíble |
|
3. |
Pistón del émbolo |
8. |
Protector interno de la aguja |
|
4. |
Soporte del depósito |
9. |
Funda externa de la aguja |
|
5. |
Conector con rosca de la aguja |
10. |
Pestaña despegable |
3. Preparación de la pluma precargada para la inyección
3.1 Quite el capuchón de la pluma
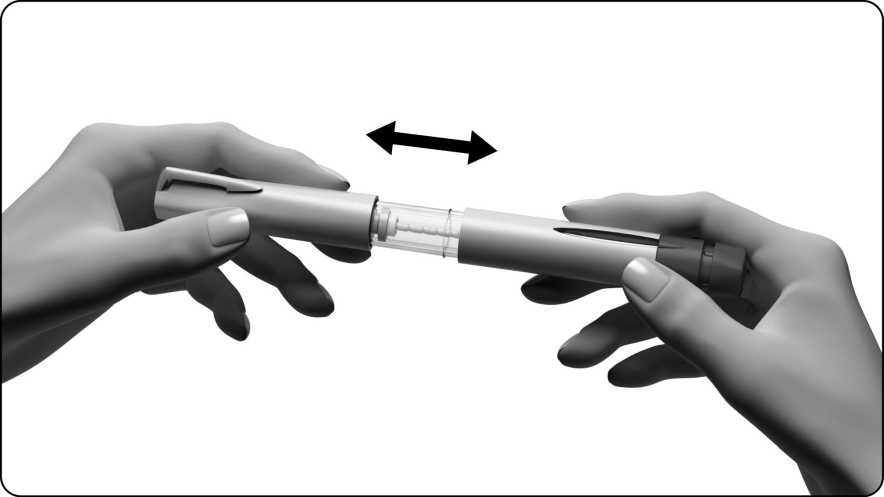
3.2 Colocación de una aguja
• Coja la aguja. Use sólo la aguja “de un solo uso” que se entrega con la pluma precargada de Ovitrelle.
• Compruebe que la pestaña despegable de la funda externa de la aguja no esté dañada o suelta. PRECAUCIÓN:
Si la pestaña despegable está dañada o suelta, no use la aguja y coja otra. Deseche la aguja sin usar con la funda externa todavía colocada. Pregunte a su farmacéutico cómo deshacerse de las agujas que no necesita.
• Arranque la pestaña.
• Sujete con firmeza la funda externa de la aguja.
• Apriete el extremo con rosca de la pluma contra la funda externa de la aguja y enrósquela hasta que esté bien sujeta.
• No tire la funda externa de la aguja; la necesitará para quitar la aguja de la pluma precargada después de la inyección.
3.3 Elimine primero cualquier burbuja de aire grande
• Examine cuidadosamente el soporte del depósito.
• Si no observa una burbuja de aire grande, la pluma precargada está preparada para su uso. Vaya directamente al paso “4. Fijación de la dosis en 250”.
Una burbuja de aire es grande si llena la punta del soporte del depósito cuando se sostiene la pluma precargada con la aguja hacia arriba (véase el dibujo). Si observa una burbuja de aire grande dentro del soporte del depósito, tiene que eliminarla. Pueden quedar en la pluma algunas burbujas de aire pequeñas adheridas a la pared interior del soporte del depósito. No se preocupe por las burbujas de aire pequeñas, no hace falta eliminarlas.

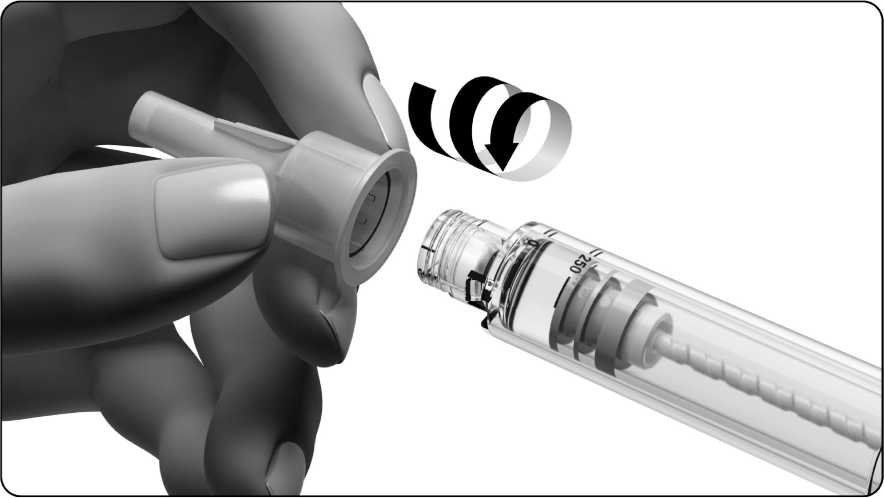
• Retire la funda externa de la aguja tirando de ella suavemente. Deje en su sitio el protector interno de la aguja.
2.
3.
4.
5.
Para eliminar una burbuja de aire grande:
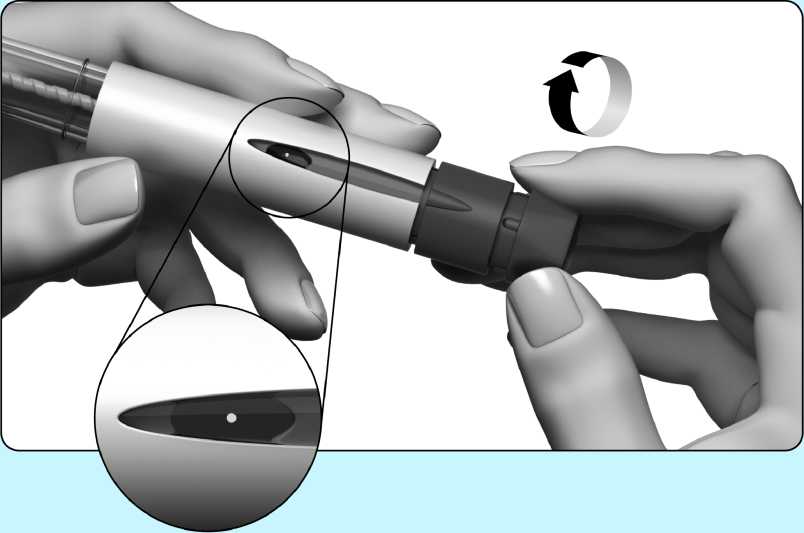
Gire con cuidado el botón de ajuste de la dosis en el sentido de las agujas del reloj hasta que vea un punto (•) en el indicador de la dosis. Si supera esta posición, basta girar el botón de ajuste de
la dosis hacia atrás hasta el punto (
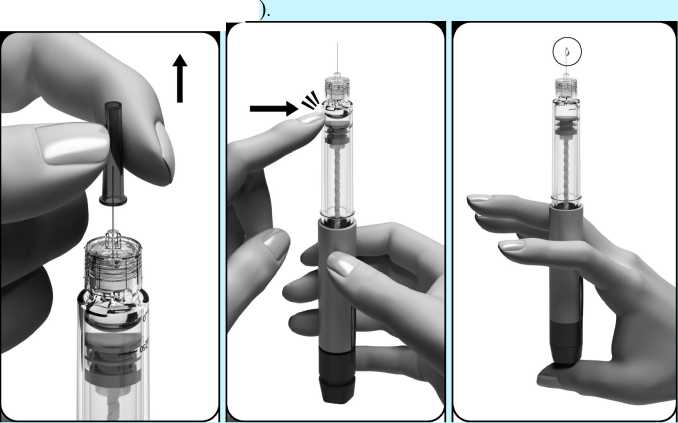
Después quite el protector interno de la aguja y sostenga la pluma con la aguja hacia arriba. Golpee suavemente con el dedo el soporte del depósito para que las burbujas se eleven hacia la aguja. Con la aguja todavía apuntando hacia arriba, pulse lentamente el botón de ajuste de la dosis por completo.
Debe aparecer una gota de líquido en la punta de la aguja; esto indica que la pluma precargada está lista para la inyección.
Si no observa ningún líquido, puede intentarlo de nuevo (puede hacer esto dos veces como máximo) a partir del paso 1 de la sección “Para eliminar una burbuja de aire grande” más arriba.
4. Fijación de la dosis en 250
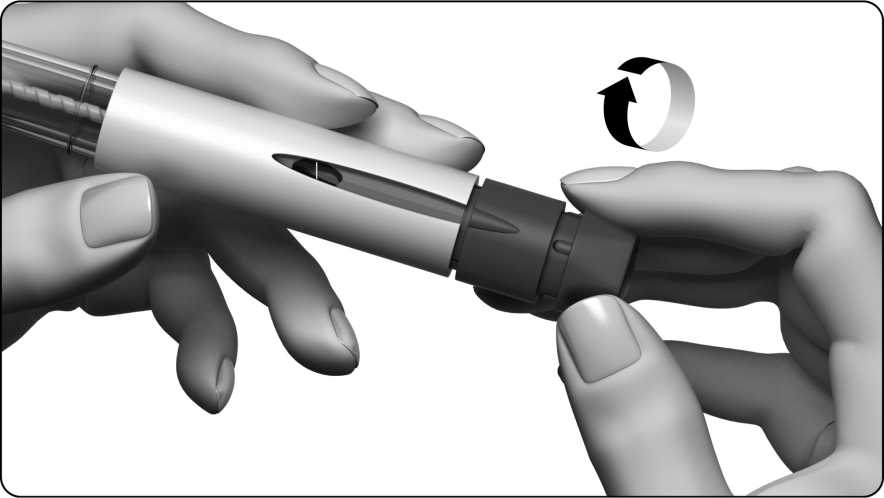
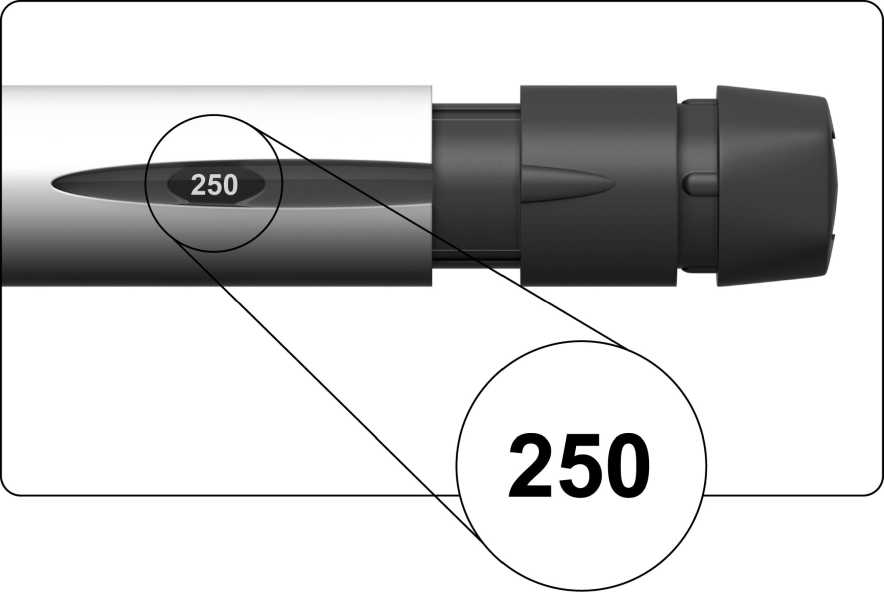
Gire suavemente el botón de ajuste de la dosis en el sentido de las agujas del reloj. El indicador de la dosis mostrará una línea recta y tiene que continuar girando hasta que pueda leer el número ‘250’.
No empuje ni tire del botón de ajuste de la dosis mientras lo gira.
El indicador de la dosis debería mostrar “250”, como se indica en la figura más abajo.
5. Inyección de la dosis
5.1 Elija el lugar para administrar la inyección, donde el médico o el enfermero le hayan indicado.
5.2 Limpie la piel en el lugar de la inyección, con una torunda empapada en alcohol.
5.3 Compruebe de nuevo que el número del indicador de la dosis muestra ‘250’. Si no es así, debe ajustarlo (véase el paso “4. Fijación de la dosis en 250”).
5.4 Retire cuidadosamente el protector interno de la aguja y deséchelo, si no lo ha hecho ya en el paso “3.3. Elimine primero cualquier burbuja de aire grande”, al eliminar el aire.
5.5 Inyéctese la dosis como el médico o enfermero le han enseñado
• Primero, inserte lentamente la aguja en la piel y después apriete el botón de ajuste de la dosis completamente, como se indica en el dibujo más abajo.
• El número de la dosis que aparece en el indicador de la dosis volverá a ‘0’. Esto indica que se ha administrado la dosis completa.
• Debe mantener la aguja bajo la piel con el botón de ajuste de la dosis apretado durante al menos 10 segundos.
• Después de 10 segundos, mantenga el botón de ajuste de la dosis apretado y saque la aguja de la piel.
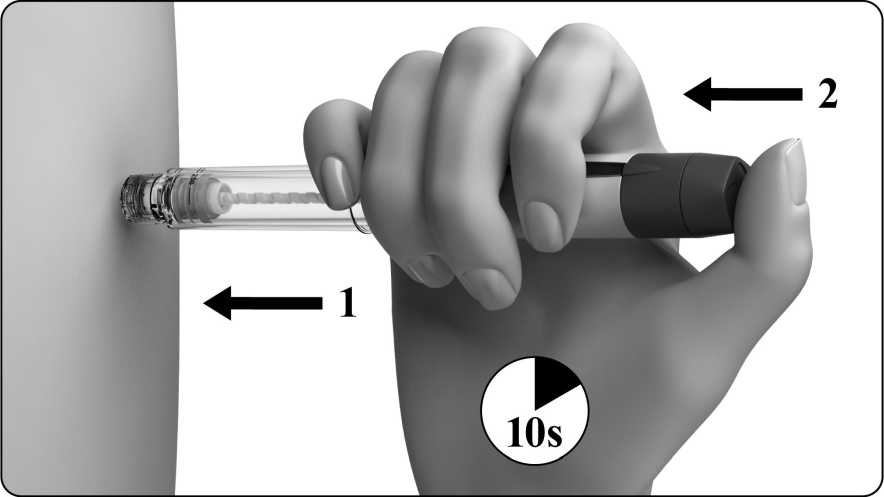
6. Después de la inyección
6.1 Comprobar que el indicador de la dosis indica ‘0’.
• Esto confirma que la dosificación se ha administrado en su totalidad. No intente inyectar una segunda vez.
• En el caso de que el indicador de la dosis no indique 0, póngase en contacto con su médico o farmacéutico.

6.2 Extracción de la aguja
• Sujete con firmeza la pluma precargada por el soporte del depósito.
• Coloque con cuidado la funda externa en la aguja.
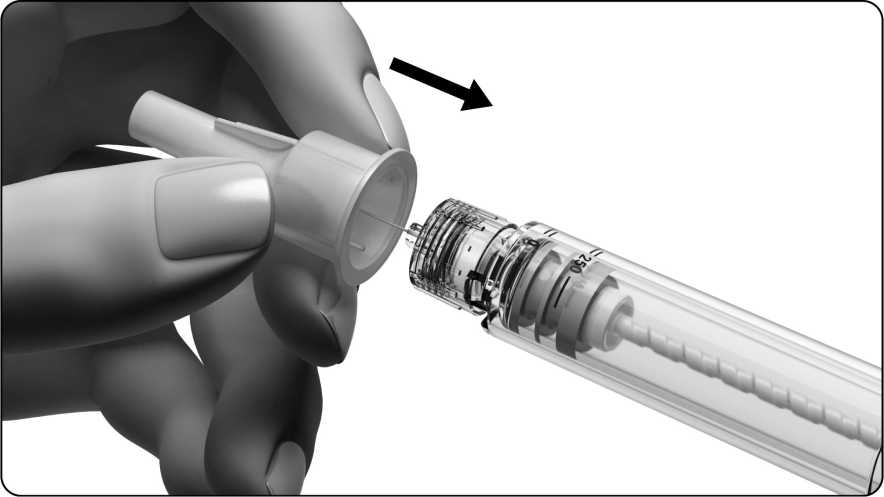
A continuación, sujete la funda externa de la aguja y desenrosque la aguja.
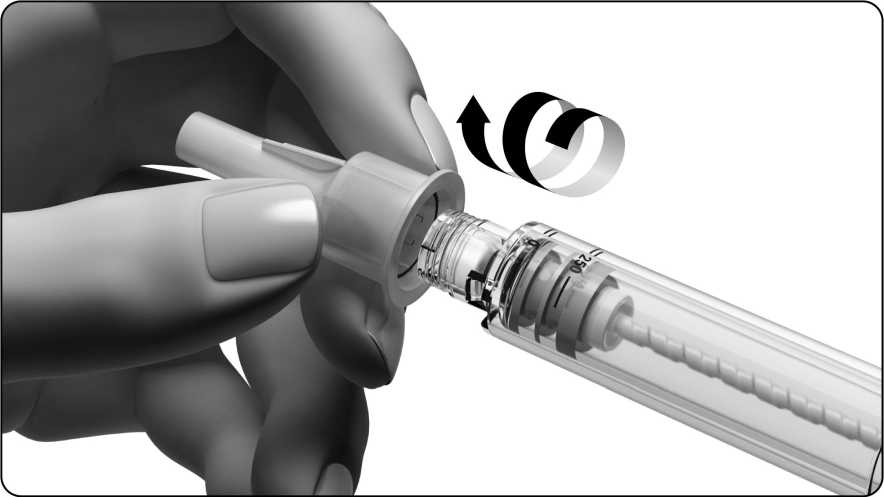
• Tenga cuidado de no pincharse con la aguja.
• Ahora, vuelva a colocar el capuchón en la pluma.
6.3 Eliminación
• Utilice cada aguja y pluma solamente una vez.
• Una vez que haya terminado su inyección, deseche la aguja usada con seguridad y deshágase de la pluma.
• Lo mejor es volver a colocarla en su envase original. Los medicamentos no se deben tirar por los desagües ni a la basura. Cuando la pluma esté vacía, pregunte a su farmacéutico cómo desecharla.
Fecha de la última revisión de estas instrucciones de uso:
47
Mujeres con anovulación u oligovulación:
Debe administrarse una jeringa precargada de Ovitrelle (250 microgramos) 24 a 48 horas después de lograr una estimulación óptima del desarrollo folicular. Se recomienda a la paciente que practique el coito el mismo día de la inyección de Ovitrelle, así como al día siguiente.
Mujeres con anovulación u oligovulación:
Debe administrarse una pluma precargada de Ovitrelle (250 microgramos) 24 a 48 horas después de lograr una estimulación óptima del desarrollo folicular. Se recomienda a la paciente que practique el coito el mismo día de la inyección de Ovitrelle, así como al día siguiente.