Optimark 500 Micromol/Ml Solucion Inyectable En Un Vial
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas. Ver la sección 4.8, en la que se incluye información sobre cómo notificarlas.
1. NOMBRE DEL MEDICAMENTO
Optimark 500 micromol/ml solución inyectable en jeringa precargada Optimark 500 micromol/ml solución inyectable en vial
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Jeringa precargada
1 ml contiene 330,9 mg de gadoversetamida, lo que equivale a 500 micromol.
Cada jeringa de 10 ml contiene 3309 mg de gadoversetamida, equivalente a 5 milimol. Cada jeringa de 15 ml contiene 4963,5 mg de gadoversetamida, equivalente a 7,5 milimol. Cada jeringa de 20 ml contiene 6618 mg de gadoversetamida, equivalente a 10 milimol. Cada jeringa de 30 ml contiene 9927 mg de gadoversetamida, equivalente a 15 milimol.
Excipiente(s) con efecto conocido:
20 ml de solución contienen 28,75 mg de sodio.
30 ml de solución contienen 43,13 mg de sodio.
Para consultar la lista completa de excipientes, ver sección 6.1.
Vial
1 ml contiene 330,9 mg de gadoversetamida, lo que equivale a 500 micromol.
Cada vial de 10 ml contiene 3309 mg de gadoversetamida, equivalente a 5 milimol.
Cada vial de 15 ml contiene 4963,5 mg de gadoversetamida, equivalente a 7,5 milimol. Cada vial de 20 ml contiene 6618 mg de gadoversetamida, equivalente a 10 milimol.
Excipiente(s) con efecto conocido:
20 ml de solución contienen 28,75 mg de sodio.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Jeringa precargada
Solución inyectable en jeringa precargada.
Vial
Solución inyectable en vial.
Solución transparente, de incolora a amarillo pálido pH: 6,0 - 7,5
Osmolaridad (37°C): 1000 - 1200 mOsm/kg
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Este medicamento es únicamente para uso diagnóstico.
Optimark está indicado para utilización en imagen por resonancia magnética (RM) del sistema nervioso central (SNC) e hígado. Intensifica el contraste y facilita la visualización, ayudando a la caracterización de lesiones focales y estructuras anormales en el SNC e hígado en pacientes adultos y en niños de dos o más años de edad con patología conocida o sospechada.
4.2 Posología y forma de administración
Optimark debe ser administrado solamente por médicos con experiencia en RM en la práctica clínica. Para permitir una acción inmediata en caso de emergencia, debe garantizarse la disponibilidad inmediata de los medicamentos necesarios (por ejemplo, epinefrina/adrenalina, teofilina, antihistamínicos, corticosteroides y atropinas), tubo endotraqueal y ventilador.
Posología
El medicamento debe administrarse en forma de inyección intravenosa periférica en bolo a una dosis de 0,2 ml/kg (100 micromol/kg) de peso corporal. Para garantizar la inyección completa del medio de contraste, debe administrarse una solución inyectable de 5 ml de cloruro sódico a 9 mg/ml (0,9 %) tras la inyección del medio de contraste. El procedimiento de imagen debe completarse en menos de una hora tras la administración del medio de contraste.
Dosis repetida
Para RM craneal en personas con función renal normal puede administrarse una segunda inyección en bolo de 0,2 ml/kg (100 micromoles/kg) dentro de los primeros 30 minutos tras la primera inyección si persiste una fuerte sospecha clínica de una lesión a pesar de una RM realzada con dosis única de contraste, o cuando una información más precisa sobre el número, tamaño o extensión de las lesiones pudiera influir en el manejo o tratamiento del paciente, , porque puede aumentar la sensibilidad diagnóstica de la prueba. No se ha establecido la seguridad de dosis repetidas en niños y adolescentes (de 2 o más años de edad), ni en pacientes con insuficiencia renal ni en ancianos. No se recomienda repetir la dosis en estas poblaciones.
Datos limitados con otros medios de contraste de gadolinio sugieren que para la exclusión de metástasis craneales adicionales en un paciente con una metástasis resecable solitaria única conocida, la RM con la inyección de la dosis de 300 micromol/kg de peso corporal de Optimark puede proporcionar mayor confianza diagnóstica.
Población pediátrica
No se considera necesario realizar un ajuste de la dosis en los niños mayores de 2 años de edad. Optimark está contraindicado en recién nacidos de hasta 4 semanas de edad (ver sección 4.3). Optimark no está recomendado para uso en niños menores de 2 años de edad porque la seguridad, eficacia e influencia de la inmadurez renal no se han estudiado en este grupo de edad.
Pacientes de edad avanzada (de al menos 65 años)
No se considera necesario realizar un ajuste de la dosis. Debe obrarse con precaución en los pacientes de edad avanzada (ver sección 4.4).
Insuficiencia renal y hepática
Optimark está contraindicado en pacientes con insuficiencia renal grave (TFG < 30 ml/min/1,73 m2) y/o lesión renal aguda y en pacientes que se hayan sometido a un trasplante hepático o que se encuentren en el período perioperatorio de un trasplante hepático (ver sección 4.3). Optimark sólo debe utilizarse tras realizar una meticulosa evaluación de los riesgos/beneficios en los pacientes con insuficiencia renal moderada (TFG de 30-59 ml/min/1,73 m2) en una dosis no superior a 100 micromoles/kg de peso corporal (ver sección 4.4). Durante una exploración no debe utilizarse más de una dosis. Debido a la ausencia de información sobre la administración repetida, no deben repetirse las inyecciones de Optimark a menos que el intervalo entre inyecciones sea de 7 días como mínimo.
Forma de administración
El medicamento debe administrarse en forma de inyección intravenosa periférica en bolo. Para garantizar la inyección completa del medio de contraste, debe administrarse una solución inyectable de 5 ml de cloruro sódico a 9 mg/ml (0,9 %) tras la inyección del medio de contraste. Se recomienda la inserción de un catéter flexible para acceso intravenoso, ver sección 4.4.
Optimark no se debe administrar con un autoinyector a niños de 2 a 11 años (ver sección 4.4).
Precauciones que deben tomarse antes de manipular o administrar el medicamento
El envase y la solución deben ser inspeccionados antes de su utilización, tal como se describe en la
sección 6.6.
4.3 Contraindicaciones
Hipersensibilidad a la gadoversetamida o a otros productos que contienen gadolinio o a alguno de los excipientes incluidos en la sección 6.1.
Optimark está contraindicado
• en pacientes con insuficiencia renal grave (tasa de filtración glomerular TFG <30 ml/min/1,73 m2) y/o lesión renal aguda,
• en pacientes que se hayan sometido a un trasplante hepático o
• que se encuentren en el período perioperatorio de un trasplante hepático y
• en recién nacidos de hasta 4 semanas de edad (ver sección 4.4).
4.4 Advertencias y precauciones especiales de empleo
Al igual que con otros medios de contraste paramagnéticos, el realce del contraste de la imagen de RM con gadoversetamida puede empeorar la visualización de lesiones existentes. Algunas de estas lesiones pueden detectarse mediante RM sin contraste. Por lo tanto, se debe actuar con precaución cuando la interpretación de la imagen realzada de contraste se realice en ausencia de una imagen de RM sin contraste
Antes de la prueba, los pacientes deben estar suficientemente hidratados.
Hipersensibilidad
También pueden ocurrir reacciones de tipo alérgico y otras relaciones idiosincrásicas con gadoversetamida, lo que podría manifestarse en forma de reacciones cardiovasculares, respiratorias y cutáneas (ver sección 4.8). La mayoría de estas reacciones ocurren en la primera media hora tras la administración del medio de contraste. Como ocurre con todos los demás medios de contraste de la misma clase, pueden producirse raramente reacciones tardías (después de horas o días) en casos raros; sin embargo, no se ha notificado ningún caso en los ensayos clínicos realizados.
Si se producen reacciones de hipersensibilidad, la administración del medio de contraste debe interrumpirse inmediatamente e iniciar un tratamiento intravenoso, si es necesario.
La prueba debe realizarse bajo la supervisión de un médico y se recomienda la inserción de un catéter flexible para acceso intravenoso. Para permitir una acción inmediata en caso de emergencia, debe garantizarse la disponibilidad inmediata de los medicamentos necesarios (por ejemplo, epinefrina/adrenalina, teofilina, antihistamínicos, corticosteroides y atropinas), tubo endotraqueal y ventilador.
El riesgo de reacciones de hipersensibilidad aumenta en los siguientes casos:
- pacientes con predisposición alérgica
- pacientes con asma bronquial; en estos pacientes es el riesgo de broncoespasmo lo que aumenta particularmente
- pacientes con un historial de reacciones a medios de contraste, incluyendo los medios yodados Antes de la inyección del medio de contraste, debe preguntarse a los pacientes si tienen alguna alergia (por ejemplo alergias al pescado o a medicamentos, fiebre del heno, urticaria) si son hipersensibles a los medios de contraste y si padecen asma bronquial. Puede considerarse una premedicación con antihistamínicos y/o glucocorticoides.
Pacientes en tratamiento con betabloqueantes
Se debe tener en cuenta que los pacientes que utilizan beta-bloqueantes no responden necesariamente a los beta-agonistas utilizados habitualmente para el tratamiento de las reacciones de hipersensibilidad.
Pacientes con trastornos cardiovasculares
En este grupo de pacientes las reacciones de hipersensibilidad pueden ser graves. Especialmente en pacientes con enfermedades cardíacas graves (por ejemplo, insuficiencia cardiaca grave, enfermedad arterial coronaria), las reacciones cardiovasculares pueden empeorar. Sin embargo, no hubo evidencias en los ensayos clínicos con Optimark.
Trastornos del sistema nervioso central
En pacientes con epilepsia o lesiones cerebrales puede aumentar la probabilidad de sufrir convulsiones durante la prueba. Son necesarias precauciones al realizar la exploración de estos pacientes (por ejemplo vigilancia del paciente), y debe estar disponible el equipo y los medicamentos necesarios para el tratamiento rápido de las posibles convulsiones.
Pacientes con insuficiencia renal
Antes de administrar Optimark, debe evaluarse a todos los pacientes para descartar disfunción renal mediante pruebas de laboratorio.
Se han notificado casos de fibrosis sistémica nefrogénica (FSN) asociada al uso de Optimark y de algunos medios de contraste que contienen gadolinio en pacientes con insuficiencia renal grave aguda o crónica (TFG < 30 ml/min/1,73 m2) y/o lesión renal aguda. Optimark está contraindicado en estos pacientes (ver sección 4.3). Los pacientes que se han sometido o se están sometiendo a trasplante hepático están especialmente en situación de riesgo, ya que hay una elevada incidencia de insuficiencia renal aguda en este grupo. Por lo tanto, Optimark no debe utilizarse en pacientes que se hayan sometido o se estén sometiendo a trasplante hepático ni en recién nacidos (ver sección 4.3).
Se desconoce el riesgo de desarrollo de FSN en pacientes con insuficiencia renal moderada (TFG 30-59 ml/min/1,73 m2); por lo tanto, Optimark sólo debe utilizarse tras realizar una meticulosa evaluación de los riesgos-beneficios en pacientes con insuficiencia renal moderada.
La gadoversetamida es dializable. La hemodiálisis poco tiempo después de la administración de Optimark puede ser útil para la eliminación de Optimark del organismo. No existen evidencias que apoyen iniciar hemodiálisis para la prevención o el tratamiento de la FSN en pacientes que no estén en hemodiálisis previamente.
En pacientes con insuficiencia renal basal se ha producido lesión renal aguda que precisó de diálisis con el uso de Optimark. El riesgo de lesión renal aguda puede aumentar con una dosis aumentada del medio de contraste. Debe administrarse la dosis más baja posible para la adquisición de imágenes adecuadas.
Niños y adolescentes
Optimark no se debe administrar con un autoinyector. La dosis necesaria debe ser administrada manualmente a los niños de 2 a 11 años para evitar una sobredosis por error.
Neonatos y lactantes
Optimark no está recomendado para uso en niños menores de dos años de edad debido a la ausencia de datos sobre seguridad y eficacia.
Pacientes de edad avanzada
Dado que el aclaramiento renal de gadoversetamida puede estar deteriorado en los pacientes de edad avanzada, es especialmente importante evaluar a los pacientes de al menos 65 años de edad para descartar la presencia de disfunción renal.
Sodio
Este medicamento contiene menos de 1 mmol de sodio (23 mg) por dosis de hasta 17 ml; esto es, esencialmente "exento de sodio".
Las jeringas de 10 ml y de 15 ml contienen menos de 1 mmol de sodio; esto es, esencialmente "exentas de sodio".
Dosis mayores contienen 1 mmol de sodio o más, lo que debe ser tenido en cuenta en pacientes con dietas pobres en sodio.
Jeringa precargada
20 ml de solución contienen 28,75 mg de sodio.
30 ml de solución contienen 43,13 mg de sodio.
Vial
20 ml de solución contienen 28,75 mg de sodio.
Niveles plasmáticos de hierro y zinc
En ensayos clínicos se han observado disminuciones transitorias de los niveles plasmáticos de hierro y zinc, por lo que se debe actuar con precaución. Se desconoce la relevancia clínica de estos hallazgos.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios formales de interacciones.
Se ha demostrado que Optimark causa interferencia en la determinación de los niveles séricos de calcio utilizando el método colorimétrico de la ortocresolftaleína complexona (OCP). Sin embargo, la administración de gadoversetamida no causa una disminución real de los niveles séricos de calcio. En presencia de gadoversetamida, la técnica OCP produce un valor erróneo inferior al nivel sérico real de calcio. La magnitud de este artefacto en la determinación es proporcional a la concentración de gadoversetamida en sangre, y en pacientes con excreción renal normal se pueden obtener valores precisos aproximadamente a los 90 minutos después de la inyección. En pacientes con insuficiencia renal, la eliminación de gadoversetamida será más lenta y la interferencia con la determinación de los niveles séricos de calcio mediante OCP más prolongada. La gadoversetamida no afecta a otros métodos de determinación de los niveles séricos de calcio, como el método colorimétrico arsenazo III, la espectrometría de absorción atómica y la espectrometría de masas con plasma acoplado inductivamente.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No hay datos relativos al uso de gadoversetamida en mujeres embarazadas. Los estudios en animales no sugieren efectos perjudiciales directos ni indirectos en términos de toxicidad para la reproducción (ver sección 5.3).
No debe utilizarse Optimark durante el embarazo a no ser que la situación clínica de la mujer requiera el uso de gadoversetamida.
Lactancia
Se desconoce si la gadoversetamida se excreta en la leche materna. No se dispone de información suficiente relativa a la excreción de gadoversetamida en la leche de animales. No se puede excluir el riesgo en niños lactantes. Debe interrumpirse la lactancia durante al menos 24 horas después de la administración de Optimark.
Fertilidad
Los datos de los estudios no clínicos no mostraron riesgos especiales para los seres humanos según los estudios convencionales de toxicidad reproductiva. No se han realizado estudios clínicos sobre fertilidad.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de Optimark sobre la capacidad para conducir y utilizar máquinas es nula o insignificante.
Los pacientes ambulatorios deben tener en cuenta que, de forma infrecuente (>1/1.000 a <1/100), pueden ocurrir mareos agudos al conducir vehículos o utilizar máquinas (ver sección 4.8).
4.8 Reacciones adversas
Resumen del perfil de seguridad
La mayoría de las reacciones adversas fueron de intensidad leve a moderada y de naturaleza pasajera. Las reacciones adversas más frecuentes fueron disgeusia, sensación de calor, cefalea y mareo.
Se ha hallado que la mayor parte de las reacciones adversas observadas tras la utilización de gadoversetamida afectaron al sistema nervioso, y, en orden decreciente de frecuencia reacciones adversas generales, trastornos gastrointestinales/ trastornos de la piel y del tejido subcutáneo.
Se han notificado reacciones adversas graves que incluyen reacciones anafilácticas, reacciones cardiovasculares, y trastornos respiratorios alérgicos. El tratamiento debe ser sintomático y debe estar disponible un acceso inmediato a los medicamentos y equipo de emergencia necesarios por si ocurriese una reacción grave.
Tabla de reacciones adversas
Se han notificado las siguientes reacciones adversas en ensayos clínicos y a partir de la utilización post-comercialización de la gadoversetamida. Las reacciones adversas se presentan en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
|
Sistema de clasificación de órganos (MedDRA) |
Frecuentes(>1/100 a <1/10) |
Poco frecuentes (>1/1.000 a <1/100) |
Raras (>1/10.000 a <1/1.000) |
Muy raras (<1/10.000) |
No conocida |
|
Trastornos del sistema inmunológico |
Reacción anafiláctica | ||||
|
Trastornos del metabolismo y de la nutrición |
Disminución del apetito | ||||
|
Trastornos psiquiátricos |
Ansiedad, trastornos del sueño, confusión y desorientación | ||||
|
Trastornos del sistema nervioso |
Cefalea, disgeusia |
Mareos, hipoestesia, parestesias, parosmia |
Convulsión, temblor, somnolencia, escozor |
Síncope | |
|
Trastornos oculares |
Eritema de párpados, dolor ocular, visión borrosa, conjuntivitis, hiperemia ocular | ||||
|
Trastornos del oído y del laberinto |
Tinnitus, vértigo | ||||
|
Trastornos cardiacos |
Palpitaciones, bloqueo A-V de primer grado, extrasístoles, taquicardia, arritmia | ||||
|
Trastornos vasculares |
Sofocos/rubor |
Hipotensión, hipertensión | |||
|
Trastornos respiratorios, torácicos y mediastínicos |
Congestión nasal, irritación de garganta |
Disnea, disfonía, rinorrea, opresión en la garganta, broncoespasmo, tos, edema laríngeo/faríngeo, faringitis, rinitis, estornudos |
|
Sistema de clasificación de órganos (MedDRA) |
Frecuentes(>1/100 a <1/10) |
Poco frecuentes (>1/1.000 a <1/100) |
Raras (>1/10.000 a <1/1.000) |
Muy raras (<1/10.000) |
No conocida |
|
Trastornos gastrointestinales |
Náuseas, diarrea |
Hipersecreción salival, dolor abdominal, estreñimiento, sequedad en la boca |
Vómitos | ||
|
Trastornos de la piel y del tejido subcutáneo |
Prurito, rash |
Urticaria, sudor frío, eritema, hiperhidrosis |
Edema periorbital |
Fibrosis sistémica nefrogénica (FSN) | |
|
Trastornos renales y urinarios |
Aumento de creatinina en sangre, hematuria | ||||
|
Trastornos generales y alteraciones en el lugar de administración |
Sensación de calor |
Malestar en el pecho, dolor en el pecho, sensación de frío (incluyendo sensación de frío periférica), reacciones en el lugar de administración |
Escalofríos, dolor, edema facial, enfermedades asténicas, incluyendo astenia, fatiga y malestar, fiebre, edema periférico, sensaciones extrañas | ||
|
Exploraciones complementarias |
Calcio en sangre anormal |
ALT aumentada, análisis de orina anormal, electrolitos de orina anormales, albúmina en orina, CPK aumentada, hemoglobina reducida |
Intervalo QT del electrocardiograma prolongado |
Se han producido reacciones locales en el lugar de inyección y pueden conducir a reacciones de tipo irritación local.
Se han notificado casos de fibrosis sistémica nefrogénica (FSN) con Optimark (ver sección 4.4). Se han notificado casos de placas cutáneas asociadas al gadolinio, con demostración de cuerpos escleróticos en el examen histológico, con algunos medios de contraste que contienen gadolinio en pacientes que, por lo demás, no presentan síntomas ni signos de fibrosis sistémica nefrogénica.
Población pediátrica
Optimark se ha estudiado en niños de 2 años y mayores, observándose un perfil de seguridad similar al de la población adulta.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Anexo V.
4.9 Sobredosis
La gadoversetamida se ha ensayado en humanos en dosis de hasta 700 micromoles/kg (siete veces la dosis estándar). No se han descrito las consecuencias clínicas de una sobredosis. Es improbable que se produzcan síntomas de toxicidad aguda en pacientes con una función renal normal. Optimark se puede eliminar mediante hemodiálisis. Sin embargo, no existen evidencias que indiquen que la hemodiálisis sea adecuada para la prevención de la fibrosis sistémica nefrogénica (FSN).
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Medios de contraste para RM, código ATC: V08CA06
La gadoversetamida es un quelato que contiene gadolinio -que tiene propiedades paramagnéticas y es responsable del realce del contraste en RM -y el ligando versetamida.
El objetivo de un medio de contraste RM es inducir cambios de intensidad de señal dentro de la lesión facilitando así su diferenciación de las estructuras normales circundantes. Por lo tanto, el uso de un medio de contraste por lo tanto reduce el umbral de detección y visualización de la lesión. Los medios de contraste RM que contienen gadolinio (quelatos de gadolinio) se han diseñado para actuar indirectamente sobre el campo magnético local, alterando los tiempos de relajación protónica T1 (espín-red) y T2 (espín-espín) y a la concentración habitual de 100 micromoles/kg, predomina el acortamiento en T1 y el acortamiento en T2 no es significativo utilizando secuencias ponderadas en T1.
Tras la administración intravenosa, la gadoversetamida, un quelato de gadolinio extracelular, tras la administración intravenosa, se equilibra rápidamente dentro del fluido/espacio extracelular y se elimina principalmente mediante filtración glomerular.
Como resultado de estas características, el momento de la adquisición de la imagen después de la administración del contraste es crítico en el caso de imágenes hepáticas. Para las metástasis hepáticas, la diferencia de señal entre el tumor y el tejido hepático circundante aumenta significativamente durante los primeros 90 segundos después de administrar un medio de contraste de gadolinio extracelular. Por lo tanto, debe iniciarse una secuencia rápida de imagen 20 segundos después de la inyección en bolo del medio de contraste, cuando el medio se localiza predominantemente en las arterias hepáticas y a continuación de nuevo a los 60 segundos después de la inyección durante la fase venosa portal dominante. Puesto que los sistemas arterial y venoso portal hepáticos suministran aproximadamente el 20 % y el 80 % del aporte sanguíneo a nivel hepático, respectivamente, las imágenes precoces (fase arterial hepática) proporcionan una óptima visualización de la lesión en el caso de lesiones hipervasculares y las imágenes adquiridas durante la fase venosa portal son útiles para lesiones hipovasculares (la mayoría de las lesiones metastásicas son relativamente hipovasculares y se visualizan mejor durante la fase venosa portal, manifestándose como áreas de menor intensidad de señal en comparación con el hígado, con gran intensidad de señal. La visibilidad de las lesiones hipo e hípervasculares puede quedar reducida si la adquisición de la imagen se demora más de tres minutos debido a la difusión del medio de contraste en los espacios intersticiales tanto del parénquima hepático como de la lesión (por ejemplo metástasis) haciendo que la lesión sea isointensa respecto al parénquima hepático normal. Las imágenes tardías tras la administración del contraste o imágenes en fase de equilibrio (obtenidas más de 5 minutos tras la administración del medio de contraste) ayudan a la caracterización de lesiones, por ejemplo el centro de una metástasis puede acumular medio de contraste en el espacio intersticial de la lesión y volverse hiperintenso respecto al hígado normal. Esta diferencia en el patrón de intensificación es útil para realizar un diagnóstico diferencial basado en la caracterización de la lesión y en la confianza diagnóstica.
El realce del contraste en los tumores cerebrales utilizando un medio de contraste que contenga gadolinio (o yodo) depende de la integridad de la barrera hematoencefálica (BHE). Por ello, estos medios de contraste se han denominado marcadores localizaciones con alteración de la BHE. Cuando se interrumpe la continuidad de la BHE, las moléculas de gadoversetamida difunden en el compartimiento intersticial produciendo así el efecto paramagnético característico de acortamiento de T1 y T2. En general, la adición de contraste a RM, a la dosis clínica estándar de 100 micromoles/kg, mejoró significativamente la detección de las lesiones, la sensibilidad y precisión diagnóstica.
5.2 Propiedades farmacocinéticas
Distribución
La farmacocinética de la gadoversetamida se ajusta a un modelo abierto bicompartimental. A la dosis de 100 micromol/kg, la semivida media de distribución en sujetos sanos calculada por el método de los residuales en 12 voluntarios sanos es 13,3 ± 6,8 min. El volumen de distribución medio a la dosis de 100 micromol/kg en pacientes sin insuficiencia renal (incluyendo tanto sujetos sanos como pacientes con patología de SNC o hepática) fue 158,7 ± 29,0 a 214,3 (intervalo 116,4 a 295,0) ml/kg. Este volumen de distribución (aproximadamente 10-15 l para un peso corporal de 70 kg) es coherente con medicamentos que se distribuyen en el fluido extracelular. La dosis no afectó de forma consistente al volumen de distribución en ninguno de los ensayos. La gadoversetamida no presenta unión a proteínas in vitro.
Eliminación
La semivida de eliminación a la dosis de 100 micromol/kg varía desde 1,49 ± 0,15 h en voluntarios sanos hasta 2,11 ± 0,62 h en pacientes sin insuficiencia renal (incluyendo sujetos sanos como pacientes con patología de SNC o hepática).
El aclaramiento plasmático medio de gadoversetamida en sujetos sanos (111,0 ± 14,1 ml/min/1,73 m2) no difiere significativamente del aclaramiento renal medio. Se obtienen resultados similares en sujetos normales y pacientes con diversas combinaciones de insuficiencia hepática, del SNC y renal, y el aclaramiento renal de gadoversetamida supone aproximadamente el 95 % del aclaramiento plasmático total. Estos resultados (relación aclaramiento renal/plasmático total cercana a 1) indican que la gadoversetamida se elimina principalmente a través de los riñones.
No hubo ninguna diferencia sistemática en ninguno de los parámetros cinéticos en relación con la dosis (100 a 700 micromol/kg). Por lo tanto, dentro de este rango de dosis, la cinética de la gadoversetamida es lineal.
Metabolismo
La mayor parte de la dosis se encuentra en forma de complejo intacto en la orina, lo que sugiere que no se metaboliza significativamente de la gadoversetamida en seres humanos.
Poblaciones especiales
Influencia del género:
Sujetos adultos de sexo masculino y femenino participaron en dos ensayos farmacocinéticos. No se identificaron diferencias significativas en la farmacocinética dependientes del género.
Efectos de la edad:
Al ajustar según el peso corporal, el aclaramiento total de gadoversetamida es mayor en el grupo de edad de 2 a 11 años (143 ± 27,9 ml/h/kg) que el observado en el grupo de edad de 12 a 18 años (117 ±
26,1 ml/h/kg) y las dos poblaciones adultas (82,1 ± 16,8 y 56,5 ± 9,7 ml/h/kg en los grupos de edad de 19 a 64 y > 65 años, respectivamente).
La semivida de eliminación en los grupos de edad de 2 a 11 y 12 a 18 años (1,4 ± 0,3 y 1,6 ± 0,3 h-1, respectivamente) es más corta que la observada en las dos poblaciones adultas (1,9 ± 0,5 y 2,5 ± 0,5 h-1 en los grupos de edad de 19 a 64 y > 65 años, respectivamente). El número de pacientes de edad avanzada en los que se caracterizó la farmacocinética fue limitado (más de 65 años, N=3).
Efecto de la insuficiencia renal
Los niveles plasmáticos de gadoversetamida aumentan linealmente cuando la función renal disminuye; en pacientes con insuficiencia renal grave (CrCl<30 ml/min) ), lo que produce incluso a una eliminación seis veces menor de gadoversetamida y a un consiguiente aumento de seis veces de la magnitud de la exposición, según AUC y t/2. La gadoversetamida se administra solamente como dosis única lo que limita la duración de esta exposición más intensa y prolongada. Con todo, casi la totalidad de la dosis se recupera en la orina después de 72 horas incluso en pacientes con insuficiencia renal grave y en voluntarios sanos se administraron dosis de hasta 500 micromol/kg sin problemas de seguridad. Sin embargo, dado que se han notificado casos de FSN que podrían estar asociados con la insuficiencia renal tras el uso de gadoversetamida y otros medios de contraste que contienen gadolinio, Optimark no debe utilizarse en estos pacientes.
5.3 Datos preclínicos sobre seguridad
Los datos de los estudios no clínicos no muestran riesgos especiales para los seres humanos según los estudios convencionales de farmacología de seguridad, toxicidad aguda, toxicidad reproductiva, tolerancia local, antigenicidad y genotoxicidad. No se han realizado estudios de carcinogenicidad.
Estudios de toxicidad a dosis repetidas en ratas y perros revelaron la formación de vacuolas en las células tubulares de los riñones, con una füerte evidencia que apunta a la reversibilidad de este efecto. No se observaron daños funcionales.
La eliminación de Optimark en perros menores de 3 meses de edad presentó un retraso significativo debido a la inmadurez de la función renal y provocó una elevada exposición sistémica a Optimark. La dosificación repetida semanalmente de dos a veinte veces la dosis clínica a partir de la semana de edad hasta la maduración generó una extensa mineralización tisular que produjo efectos localizados, como dermatitis ulcerosa, compromiso de la circulación y disfunción hepática.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Versetamida Hidróxido de calcio Cloruro de calcio dihidrato
Hidróxido de sodio y/o ácido clorhídrico para ajuste del pH. Agua para preparaciones inyectables.
6.2 Incompatibilidades
En ausencia de estudios de compatibilidad, Optimark no debe mezclarse con otros medicamentos.
6.3 Periodo de validez 3 años.
Se ha demostrado estabilidad en-uso química y física durante 24 horas a temperaturas de hasta 25°C. Por razones de seguridad microbiológica, el producto debe utilizarse inmediatamente. Si no se utiliza inmediatamente, la responsabilidad sobre el tiempo de almacenamiento en uso y las condiciones previas a la utilización recae sobre el usuario.
6.4 Precauciones especiales de conservación
Jeringa precargada
Conservar la jeringa en el embalaje exterior para protegerla de la luz.
Vial
Conservar el vial en el embalaje exterior para protegerlo de la luz.
No refrigerar o congelar.
Para las condiciones de conservación tras la primera apertura del medicamento, ver sección 6.3.
6.5 Naturaleza y contenido del envase Jeringa precargada
Optimark se presenta en jeringas precargadas hechas de polipropileno. La cápsula de la punta de la jeringa y el émbolo están hechos de goma de bromobutilo.
Tamaños de envases:
1 x 10 ml 10 x 10 ml
1 x 15 ml 10 x 15 ml
1 x 20 ml 10 x 20 ml
1 x 30 ml 10 x 30 ml
Puede que solamente estén comercializados algunos tamaños de envases.
Vial
Optimark se presenta en viales de vidrio de borosilicato incoloro de alta resistencia (EP Tipo I). Los viales llevan tapones de goma de bromobutilo, cápsulas de cierre de aluminio, y tapas de tipo "flip-off".
Tamaños de envases:
1 x 10 ml 10 x 10 ml
1 x 15 ml 10 x 15 ml
1 x 20 ml 10 x 20 ml
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Optimark está destinado a un solo uso; la solución no utilizada debe desecharse.
La solución no debe utilizarse en caso de que presente alteraciones del color o si aparecen partículas. Si se utiliza equipamiento no desechable, se debe prestar una escrupulosa atención para impedir cualquier contaminación residual con trazas de medios de limpieza.
Jeringa precargada
Jeringas precargadas Inspección y montaje
Inspeccione la jeringa para detectar posibles signos de escape. No la utilice si observa un escape.
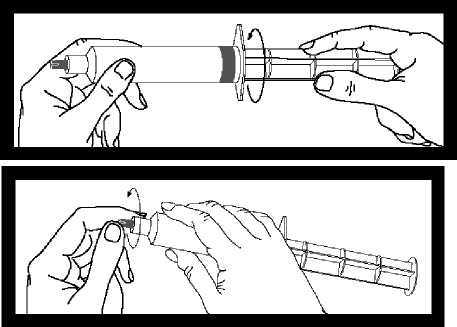
Tras enroscar la varilla en el émbolo de la jeringa, es importante girar la varilla media vuelta más, de modo que el émbolo gris rote libremente
Antes de usar la jeringa, desenrosque la cápsula gris de la punta y deséchela. La jeringa está ahora lista para acoplarla a la aguja o a la vía de perfusión.
Elimine la jeringa y la solución sobrante después del uso.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con las normativas locales.
La etiqueta de seguimiento despegable de las jeringas precargadas debe adherirse a la historia del paciente para permitir llevar un registro exacto del medio de contraste de gadolinio utilizado. También debe registrarse la dosis utilizada.
Si se utilizan historias del paciente electrónicas, el nombre del medicamento, el número de lote y la dosis se deben introducir en la historia del paciente.
Vial
Optimark sólo debe extraerse con la jeringa inmediatamente antes de ser usado.
El producto debe ser examinado antes de su utilización para confirmar que todos los sólidos estén disueltos y que el envase y el cierre no estén dañados. Si quedan sólidos, el vial debe eliminarse.
Elimine la jeringa y la solución sobrante después del uso.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con las normativas locales.
La etiqueta de seguimiento despegable de los viales debe adherirse a la historia del paciente para permitir llevar un registro exacto del medio de contraste de gadolinio utilizado. También debe registrarse la dosis utilizada. Si se utilizan historias del paciente electrónicas, el nombre del medicamento, el número de lote y la dosis se deben introducir en la historia del paciente.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Mallinckrodt Deutschland GmbH Josef-Dietzgen-Str. 1 53773 Hennef Alemania
Jeringa precargada 1 x 10 ml: EU/1/07/398/007 10 x 10 ml: EU/1/07/398/008 1 x 15 ml: EU/1/07/398/009 10 x 15 ml: EU/1/07/398/010 1 x 20 ml: EU/1/07/398/011 10 x 20 ml: EU/1/07/398/012 1 x 30 ml: EU/1/07/398/013 10 x 30 ml EU/1/07/398/014
Vial
1 x 10 ml: EU/1/07/398/001 10 x 10 ml: EU/1/07/398/002 1 x 15 ml: EU/1/07/398/003 10 x 15 ml: EU/1/07/398/004 1 x 20 ml: EU/1/07/398/005 10 x 20 ml: EU/1/07/398/006
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 23 de julio de 2007 Fecha de la última renovación: 15 de junio de 2012
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu/.
A. FABRICANTE(S) RESPONSABLE(S) DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
Nombre y dirección del fabricante responsable de la liberación de los lotes
Mallinckrodt Medical Imaging Ireland
Damastown
Mulhuddart
Dublín 15
Irlanda
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica restringida (ver Anexo I: Ficha Técnica o Resumen de las Características del Producto, sección 4.2).
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
Los requerimientos para la presentación de los informes periódicos de seguridad para este medicamento se establecen en la lista de fechas de referencia de la Unión (lista EURD) prevista en el artículo 107quater, apartado 7, de la Directiva 2001/83/CE y publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC se compromete a realizar los estudios y las actividades adicionales de farmacovigilancia detalladas en el Plan de Farmacovigilancia, de acuerdo con la versión del PGR incluido en el Módulo 1.8.2. de la Autorización de Comercialización y cualquier actualización posterior del PGR acordada por el Comité de Medicamentos de Uso Humano (CHMP).
De acuerdo con la Directriz del CHMP sobre Sistemas de Gestión de Riesgos para medicamentos de uso humano, el PGR actualizado se debe presentar junto con el siguiente Informe Periódico de Seguridad (IPS).
Además, se debe presentar un PGR actualizado:
• Cuando se reciba nueva información que pueda afectar a las especificaciones de seguridad vigentes, al Plan de Farmacovigilancia o las actividades de minimización de riesgos
• Dentro de los 60 días posteriores a la consecución de un hito importante (farmacovigilancia o minimización de riesgos)A petición de la Agencia Europea de Medicamentos.
• Medidas adicionales de minimización de riesgos
Antes del lanzamiento, el Titular de la Autorización de Comercialización (TAC) debe proporcionar a todos los potenciales prescriptores una copia de la ficha técnica o Resumen de las Características del Producto (RCP) junto con una nota aclaratoria destacando la información de seguridad incluida en las secciones 4.3 y 4.4. El texto se acordará con el CHMP y contendrá también el siguiente redactado:
• Optimark no está recomendado para uso en niños menores de 2 años de edad porque la seguridad, eficacia e influencia de la inmadurez renal no se han estudiado en este grupo de edad.
Optimark se ha estudiado en niños de 2 años y mayores, observándose un perfil de seguridad similar al de la población adulta.
• Obligación de llevar a cabo medidas posautorización
El TAC deberá llevar a cabo, dentro del plazo establecido, las siguientes medidas:
|
Descripción |
Fecha límite |
|
El TAC enviará revisiones acumuladas anuales sobre los casos de fibrosis sistémica nefrogénica (FSN). |
En julio de cada año hasta que se hayan presentado los resultados del estudio en el hueso. |
|
El TAC realizará un estudio para evaluar el potencial de acumulación a largo plazo del gadolinio en el hueso de acuerdo con un protocolo acordado con el CHMP. |
Informe final del estudio: Junio 2018 |
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR
Texto para el embalaje exterior de jeringas precargadas de 10 ml, 15 ml, 20 ml y 30 ml
Optimark 500 micromol/ml solución inyectable en jeringa precargada Gadoversetamida
1 ml contiene 330,9 mg de gadoversetamida, lo que equivale a 500 micromol.
Excipientes: versetamida, hidróxido de calcio, cloruro de calcio dihidrato, hidróxido de sodio y/o ácido clorhídrico, agua para preparaciones inyectables.
Para mayor información consultar el prospecto.
Solución inyectable en jeringa precargada 10 ml (1, 10 jeringas)
15 ml (1, 10 jeringas)
20 ml (1, 10 jeringas)
30 ml (1, 10 jeringas)
Leer el prospecto antes de utilizar este medicamento. Vía intravenosa.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
Medio de contraste para resonancia magnética
Para registrar: pegar la etiqueta de seguimiento despegable a la historia del paciente. En historias electrónicas: introducir nombre del medicamento, n° de lote y dosis.
Conservar la jeringa en el embalaje exterior para protegerla de la luz. No refrigerar o congelar.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO
UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
Para un solo uso. Desechar la solución sobrante después del uso.
Mallinckrodt Deutschland GmbH, Josef-Dietzgen-Str.1, 53773 Hennef, Alemania
EU/1/07/398/007 (1 x 10 ml) EU/1/07/398/008 (10 x 10 ml) EU/1/07/398/009 (1 x 15 ml) EU/1/07/398/010 (10 x 15 ml) EU/1/07/398/011 (1 x 20 ml) EU/1/07/398/012 (10 x 20 ml) EU/1/07/398/013 (1 x 30 ml) EU/1/07/398/014 (10 x 30 ml)
Lote
Medicamento sujeto a prescripción médica.
Se acepta la justificación para no incluir la información en Braille
Optimark 500 micromol/ml solución inyectable en jeringa precargada Gadoversetamida
1 ml contiene 330,9 mg de gadoversetamida, lo que equivale a 500 micromol.
Excipientes: versetamida, hidróxido de calcio, cloruro de calcio dihidrato, hidróxido de sodio y/o ácido clorhídrico, agua para preparaciones inyectables.
Solución inyectable en jeringa precargada 15 ml 20 ml 30 ml
Leer el prospecto antes de utilizar este medicamento. Vía intravenosa.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
Esta etiqueta adhesiva se debe pegar en las historias de los pacientes.
En historias electrónicas: introducir nombre del medicamento, n° de lote y dosis.
Conservar la jeringa en el embalaje exterior para protegerla de la luz. No refrigerar o congelar.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO
UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
Para un solo uso. Desechar la solución sobrante después del uso.
Mallinckrodt Deutschland GmbH, Josef-Dietzgen-Str.1, 53773 Hennef, Alemania
EU/1/07/398/007 (1 x 10 ml) EU/1/07/398/008 (10 x 10 ml) EU/1/07/398/009 (1 x 15 ml) EU/1/07/398/010 (10 x 15 ml) EU/1/07/398/011 (1 x 20 ml) EU/1/07/398/012 (10 x 20 ml) EU/1/07/398/013 (1 x 30 ml) EU/1/07/398/014 (10 x 30 ml)
Lote
Medicamento sujeto a prescripción médica.
Se acepta la justificación para no incluir la información en Braille
INFORMACIÓN MÍNIMA QUE DEBE INCLUIRSE EN PEQUEÑOS ACONDICIONAMIENTOS PRIMARIOS
Texto para el acondicionamiento primario de la jeringa precargada de 10 ml
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Optimark 500 micromol/ml solución inyectable en jeringa precargada
Gadoversetamida
Vía IV.
2. FORMA DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento.
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE
Lot
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
10 ml
6. OTROS
Conservar la jeringa en el embalaje exterior para protegerla de la luz. No refrigerar o congelar.
Optimark 500 micromol/ml solución inyectable en vial Gadoversetamida
1 ml contiene 330,9 mg de gadoversetamida, lo que equivale a 500 micromol.
Excipientes: versetamida, hidróxido de calcio, cloruro de calcio dihidrato, hidróxido de sodio y/o ácido clorhídrico, agua para preparaciones inyectables
Solución inyectable en vial 10 ml (1, 10 viales)
15 ml (1, 10 viales)
20 ml (1, 10 viales)
Leer el prospecto antes de utilizar este medicamento. Vía intravenosa.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
Medio de contraste para resonancia magnética.
Para registrar: pegar la etiqueta de seguimiento despegable a la historia del paciente. En historias electrónicas: introducir nombre del medicamento, n° de lote y dosis.
Conservar el vial en el embalaje exterior para protegerlo de la luz. No refrigerar o congelar.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO
UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
Para un solo uso. Desechar la solución sobrante después del uso.
Mallinckrodt Deutschland GmbH, Josef-Dietzgen-Str.1, 53773 Hennef, Alemania
EU/1/07/398/001 (1 x 10 ml) EU/1/07/398/002 (10 x 10 ml) EU/1/07/398/003 (1 x 15 ml) EU/1/07/398/004 (10 x 15 ml) EU/1/07/398/005 (1 x 20 ml) EU/1/07/398/006 (10 x 20 ml)
Lote
Medicamento sujeto a prescripción médica.
Se acepta la justificación para no incluir la información en Braille
Optimark 500 micromol/ml solución inyectable en vial Gadoversetamida
1 ml contiene 330,9 mg de gadoversetamida, lo que equivale a 500 micromol.
Excipientes: versetamida, hidróxido de calcio, cloruro de calcio dihidrato, hidróxido de sodio y/o ácido clorhídrico, agua para preparaciones inyectables
Solución inyectable en vial 15 ml 20 ml
Leer el prospecto antes de utilizar este medicamento. Vía intravenosa.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
Esta etiqueta adhesiva se debe pegar en la historia de los pacientes.
En historias electrónicas: introducir nombre del medicamento, n° de lote y dosis.
Conservar el vial en el embalaje exterior para protegerlo de la luz. No refrigerar o congelar.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO
UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
Para un solo uso. Desechar la solución sobrante después del uso.
Mallinckrodt Deutschland GmbH, Josef-Dietzgen-Str.1, 53773 Hennef, Alemania
EU/1/07/398/001 (1 x 10 ml) EU/1/07/398/002 (10 x 10 ml) EU/1/07/398/003 (1 x 15 ml) EU/1/07/398/004 (10 x 15 ml) EU/1/07/398/005 (1 x 20 ml) EU/1/07/398/006 (10 x 20 ml)
Lote
Medicamento sujeto a prescripción médica.
Se acepta la justificación para no incluir la información en Braille
INFORMACIÓN MÍNIMA QUE DEBE INCLUIRSE EN PEQUEÑOS ACONDICIONAMIENTOS PRIMARIOS
Texto para el acondicionamiento primario del vial de 10 ml
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Optimark 500 micromol/ml solución inyectable en vial
Gadoversetamida
Vía IV.
2. FORMA DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento.
3. FECHA DE CADUCIDAD
EXP
4. NÚMERO DE LOTE
Lot
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
10 ml
6. OTROS
Conservar el vial en el embalaje exterior para protegerlo de la luz. No refrigerar o congelar.
B. PROSPECTO
Prospecto: información para el usuario
Optimark 500 micromol/ml solución inyectable en jeringa precargada
Gadoversetamida
"VEste medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Puede contribuir comunicando los efectos adversos que pudiera usted tener. La parte final de la sección 4 incluye información sobre cómo comunicar estos efectos adversos.
Lea todo el prospecto detenidamente antes de que le empiecen a administrar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto:
1. Qué es Optimark y para qué se utiliza
2. Qué necesita saber antes de que se le empiece a administrar Optimark
3. Cómo se administra Optimark
4. Posibles efectos adversos
5. Conservación de Optimark
6. Contenido del envase e información adicional
1. Qué es Optimark y para qué se utiliza
Optimark contiene el principio activo gadoversetamida. La gadoversetamida se utiliza como "agente de contraste" en la obtención de imágenes mediante resonancia magnética.
Optimark es únicamente para uso diagnóstico. Se utiliza en pacientes adultos y niños de dos o más años de edad a los que se les va a realizar una resonancia magnética (RM), un tipo de exploración en la que se toman imágenes de los órganos internos. Optimark se utiliza para obtener imágenes más claras en los pacientes que tienen o se cree que tienen anormalidades del cerebro, la columna vertebral o el hígado.
2. Qué necesita saber antes de que se le empiece a administrar Optimark
No use Optimark
si es alérgico
• al principio activo gadoversetamida o
• a cualquiera de los demás componentes de Optimark (ver sección 6), o
• a otros medios de contraste de gadolinio
No se le debe administrar Optimark si
• padece insuficiencia renal grave y/o aguda, o
• si es un paciente que va a recibir o que ha recibido un transplante de hígado porque la utilización de Optimark en pacientes con estos problemas se ha asociado a una enfermedad llamada fibrosis sistémica nefrogénica (FSN). La FSN es una enfermedad que implica un engrasamiento de la piel y tejidos conectivos. La FSN puede causar inmovilidad debilitante de las articulaciones, debilidad muscular o puede afectar al funcionamiento normal de los órganos internos, lo que podría ser mortal.
• Optimark no debe utilizarse en niños recién nacidos hasta las 4 semanas de edad.
Antes de recibir Optimark, deberá someterse a un análisis de sangre para comprobar el funcionamiento de sus riñones.
Advertencias y precauciones
Consulte a su médico antes de que se empiece a administrar Optimark, si:
• tiene cualquier tipo de alergia (por ejemplo, a medicamentos o marisco, fiebre del heno, urticaria) o padece asma
• ha tenido cualquier tipo de reacción a inyecciones anteriores de medios de contraste, incluyendo los medios yodados
• sus riñones no funcionan adecuadamente
• se ha sometido recientemente o se someterá pronto a un trasplante hepático
• siente sed y/o solamente ha bebido pequeñas cantidades o nada en absoluto antes de la prueba
• está usando un beta-bloqueante (medicamento para la hipertensión)
• tiene una enfermedad del corazón
• tiene epilepsia o lesiones cerebrales
• usted sigue una dieta pobre en sodio
Si alguna de estas situaciones le afecta, su médico debe decidir si es apropiado realizar la prueba prevista.
Niños y adolescentes
Optimark no se recomienda en niños menores de dos años
Uso de Optimark con otros medicamentos
Informe a su médico o farmacéutico si está utilizando o ha utilizado recientemente otros medicamentos, incluso los adquiridos sin receta.
Embarazo y lactancia
Optimark no se debe utilizar durante el embarazo a menos que sea absolutamente necesario.
Debe interrumpirse la lactancia durante al menos 24 horas después de que reciba Optimark.
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico antes de utilizar este medicamento.
Conducción y uso de máquinas
Si usted es un paciente ambulatorio y tiene previsto conducir o utilizar herramientas o máquinas, tenga en cuenta que puede tener mareos fortuitos tras someterse a la prueba con Optimark. Hasta 1 de cada 100 personas pueden resultar afectadas.
Optimark contiene sodio
Este medicamento contiene menos de 1 mmol de sodio (23 mg) por dosis de hasta 17 ml; esto es, esencialmente "exento de sodio".
Las jeringas de 10 ml y de 15 ml contienen menos de 1 mmol de sodio; esto es, esencialmente "exentas de sodio".
Dosis mayores contienen 1 mmol de sodio o más, lo que debe ser tenido en cuenta en pacientes con dietas pobres en sodio.
20 ml de solución contienen 28,75 mg de sodio.
30 ml de solución contienen 43,13 mg de sodio.
3. Cómo se administra Optimark
Los procedimientos diagnósticos que implican el uso de medios de contraste deben realizarse bajo la supervisión de un médico con la formación y conocimientos necesarios sobre el procedimiento que se va a realizar.
Dosis normal
La dosis normal de 0,2 ml/kg de peso corporal es la misma en adultos y en niños de 2 o más años de edad. Corresponde a 14 ml para un individuo de 70 kg y este volumen debe inyectarse durante unos 7 -14 segundos en vena, normalmente una vena de un brazo. A continuación, el dispositivo de inyección se lava con una solución salina para garantizar que no quede nada en la jeringa o en el tubo utilizado para la inyección. En los adultos, se puede administrar una segunda dosis dentro de los siguientes 30 minutos a la primera inyección. Cuando se estén examinando un cierto tipo de anormalidades cerebrales, puede que se necesite utilizar Optimark en una cantidad tres veces superior a la dosis normal en adultos. El médico decidirá la dosis necesaria de Optimark para su prueba. Debe advertir inmediatamente al médico o enfermera/técnico si siente dolor alrededor del área donde se sitúa la aguja.
Dosis en grupos de pacientes especiales
En pacientes con problemas renales moderados, durante una exploración no debe utilizarse más de una dosis de Optimark. No deben repetirse las inyecciones de Optimark a menos que el intervalo entre inyecciones sea de 7 días como mínimo.
No es necesario ajustar la dosis si usted tiene 65 o más años de edad, pero le harán un análisis de sangre para comprobar el funcionamiento de sus riñones.
Si recibe más Optimark del que debe
Si le han inyectado demasiado Optimark, es improbable que eso le perjudique mucho, puesto que no se han observado problemas con dosis muy superiores a la normal administradas a algunas personas.
Si sus riñones funcionan normalmente es poco probable que tenga algún problema. Optimark se puede eliminar utilizando diálisis. Si piensa que se le ha inyectado demasiado Optimark, advierta inmediatamente al médico o enfermera/técnico.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, Optimark puede producir efectos adversos, aunque no todas las personas los sufran.
Debe comunicar inmediatamente al médico o enfermera/técnico que realizan la prueba sobre cualquiera de los siguientes síntomas, y recibir tratamiento inmediato puesto que pueden ser o llegar a ser muy graves:
efectos adversos que afectan al corazón (desmayos, latidos cardiacos adicionales a los regulares, dolor en el pecho) o al sistema respiratorio (dificultad de la respiración, opresión de las vías respiratorias, hinchazón u opresión de la garganta, picor de nariz o nariz cargada, estornudos).
La mayoría de los efectos adversos observados tras la utilización de Optimark tuvieron una intensidad leve a moderada y carácter transitorio. Los efectos adversos más frecuentes fueron gusto extraño en la boca, sensación de calor, dolor de cabeza y mareo.
Los posibles efectos adversos se describen de forma más detallada a continuación.
Las siguientes frecuencias y síntomas se basan en datos de ensayos clínicos y en la experiencia de uso de Optimark después de salir al mercado.
|
Frecuencia |
Posibles efectos adversos |
|
Frecuentes (pueden afectar a hasta 1 de cada 10 personas) |
Dolores de cabeza, gusto extraño en la boca, sensación de calor |
|
Frecuencia |
Posibles efectos adversos |
|
Poco frecuentes (pueden afectar a hasta 1 de cada 100 personas) |
Reacción alérgica/hipersensibilidad, mareos, sensación de hormigueo, entumecimiento, sentido del olfato reducido, enrojecimiento y calor en la piel, congestión nasal, faringitis, náuseas, diarrea, picor, sarpullido, malestar en el pecho, dolor en el pecho, sensación de frío incluyendo sensación de frío en las extremidades, reacciones en el lugar de la administración, cambios en los niveles de calcio en sangre |
|
Raros (pueden afectar a hasta 1 de cada 1000 personas) |
Disminución del apetito, sensación de ansiedad, trastornos del sueño, somnolencia, escozor, sensación de movimiento o giro, pitidos en los oídos, irritación de los párpados, dolor de ojos, visión borrosa, ojos irritados, conciencia del latido cardiaco, pulso irregular, latidos cardiacos adicionales a los regulares, tensión baja, dificultad para respirar, ronquera, nariz cargada, opresión en la garganta, insalivación excesiva, dolor abdominal, estreñimiento, sequedad en la boca, urticaria, sudor frío, enrojecimiento, mayores niveles en sangre de una sustancia (creatinina) que normalmente se elimina por los riñones, sangre en la orina, hinchazón de la cara, debilidad y síntomas similares como fatiga y sensación general de malestar, fiebre, inflamación de las extremidades, escalofríos, dolor, sensación de frío en las extremidades, aumento de las enzimas hepáticas, análisis de orina anormal, aumento de los valores de minerales en orina, proteínas en orina, aumento de enzimas de corazón y músculo, disminución de hemoglobina, sensación de confusión y desorientación, temblores, convulsión, ojos irritados, latido acelerado, tensión alta, opresión de las vías respiratorias, hinchazón de garganta o de las cuerdas vocales, faringitis, tos, picor de nariz, estornudos, sudoración |
|
Muy raros (pueden afectar a hasta 1 de cada 10.000 personas) |
Hinchazón alrededor de los ojos, trazado anormal en el ECG de la actividad cardiaca, desmayos, vómitos |
|
No conocida (la frecuencia no puede estimarse a partir de los datos disponibles) |
Endurecimiento de la piel que puede afectar también a los tejidos blandos y a los órganos internos (fibrosis sistémica nefrogénica), sensación de malestar |
Se han notificado casos de fibrosis sistémica nefrogénica (que causa endurecimiento de la piel y puede afectar también a los tejidos blandos y a los órganos internos).
En niños de 2 años de edad o más, se observaron efectos adversos del uso de Optimark similares a los adultos.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Anexo V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Optimark
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la caja y en la etiqueta de la jeringa después de CAD/EXP.
Conservar las jeringas en el embalaje exterior para protegerlas de la luz.
No refrigerar o congelar.
El medicamento debe usarse inmediatamente. De lo contrario, los tiempos de conservación durante el uso y las condiciones previas al mismo son responsabilidad del usuario.
No utilice la solución si presenta un color diferente o partículas.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de Optimark
• El principio activo es gadoversetamida.
1 ml contiene 330,9 mg de gadoversetamida, lo que equivale a 500 micromol.
Cada jeringa de 10 ml contiene 3309 mg de gadoversetamida.
Cada jeringa de 15 ml contiene 4963,5 mg de gadoversetamida.
Cada jeringa de 20 ml contiene 6618 mg de gadoversetamida.
Cada jeringa de 30 ml contiene 9927 mg de gadoversetamida.
• Los demás componentes son: versetamida, hidróxido de calcio, cloruro de calcio dihidrato, hidróxido de sodio y/o ácido clorhídrico, agua para preparaciones inyectables.
Aspecto del producto y contenido del envase
Optimark en jeringa precargada contiene una solución transparente (sin partículas), de incolora a amarillo pálido.
Optimark se suministra precargado en jeringas de polipropileno. El capuchón de la jeringa y el émbolo son de goma de bromobutilo.
Optimark jeringas precargadas se suministra en los siguientes tamaños de envases:
Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización y responsable de la fabricación
Titular de la autorización de comercialización:
Mallinckrodt Deutschland GmbH Josef-Dietzgen-Str. 1 53773 Hennef Alemania
Pueden solicitar más información respecto a este medicamento dirigiéndose al titular de la
autorización de comercialización.
Responsable de la fabricación
Mallinckrodt Medical Imaging Ireland
Damastown
Mulhuddart, Dublín 15
Irlanda
Fecha de la última revisión de este prospecto:
Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia
Europea de Medicamentos (EMA): http://www.ema.europa.eu.
Indicaciones terapéuticas
Optimark está indicado para utilización en imagen por resonancia magnética (RM) del sistema nervioso central (SNC) e hígado. Intensifica el contraste y facilita la visualización, ayudando a la caracterización de lesiones focales y estructuras anormales en el SNC e hígado en pacientes adultos y en niños de dos o más años con patología conocida o sospechada.
Contraindicaciones
• Hipersensibilidad a la gadoversetamida o a otros productos que contienen gadolinio o a alguno de los excipientes.
• Optimark está contraindicado en pacientes con insuficiencia renal grave (TFG < 30 ml/min/1,73 m2) y/o lesión renal aguda, en
• pacientes que se hayan sometido a un trasplante hepático o
• que se encuentren en el período perioperatorio de un trasplante hepático y
• en recién nacidos de hasta 4 semanas de edad.
Advertencias y precauciones especiales de empleo
Al igual que con otros medios de contraste paramagnéticos, el realce del contraste de la imagen de RM con gadoversetamida puede empeorar la visualización de lesiones existentes. Algunas de estas lesiones pueden detectarse mediante RM sin contraste. Por lo tanto, se debe actuar con precaución cuando la interpretación de la imagen realzada de contraste se realice en ausencia de una imagen de RM sin contraste.
Antes de la prueba, los pacientes deben estar suficientemente hidratados.
Hipersensibilidad
También pueden ocurrir reacciones de tipo alérgico y otras reacciones idiosincrásicas con gadoversetamida, lo que podría manifestarse en forma de reacciones cardiovasculares, respiratorias y cutáneas (ver sección 4.8). La mayoría de estas reacciones ocurren en la primera media hora tras la administración del medio de contraste. Como ocurre con todos los demás medios de contraste de la misma clase, pueden producirse raramente reacciones tardías (después de horas o días) en casos raros; sin embargo, no se ha notificado ningún caso en los ensayos clínicos realizados.
Si se producen reacciones de hipersensibilidad, la administración del medio de contraste debe interrumpirse inmediatamente e iniciar un tratamiento intravenoso, si es necesario.
La prueba debe realizarse bajo la supervisión de un médico y se recomienda la inserción de un catéter flexible para acceso intravenoso. Para permitir una acción inmediata en caso de emergencia, debe garantizarse la disponibilidad inmediata de los medicamentos necesarios (por ejemplo, epinefrina/adrenalina, teofilina, antihistamínicos, corticosteroides y atropinas), tubo endotraqueal y ventilador.
El riesgo de reacciones de hipersensibilidad aumenta en los siguientes casos:
- pacientes con predisposición alérgica
- pacientes con asma bronquial; en estos pacientes es el riesgo de broncoespasmo lo que aumenta particularmente
- pacientes con un historial de reacciones a medios de contraste, incluyendo los medios yodados Antes de la inyección del medio de contraste, debe preguntarse a los pacientes si tienen alguna alergia (por ejemplo alergias al pescado o a medicamentos, fiebre del heno, urticaria) si son hipersensibles a los medios de contraste y si padecen asma bronquial. Puede considerarse una premedicación con antihistamínicos y/o glucocorticoides.
Pacientes en tratamiento con betabloqueantes
Se debe tener en cuenta que los pacientes que utilizan beta-bloqueantes no responden necesariamente a los beta-agonistas utilizados habitualmente para el tratamiento de las reacciones de hipersensibilidad.
Pacientes con trastornos cardiovasculares
En este grupo de pacientes las reacciones de hipersensibilidad pueden ser graves. Especialmente en pacientes con enfermedades cardíacas graves (por ejemplo, insuficiencia cardiaca grave, enfermedad
arterial coronaria), las reacciones cardiovasculares pueden empeorar. Sin embargo, no hubo evidencias en los ensayos clínicos con Optimark.
Trastornos del sistema nervioso central
En pacientes con epilepsia o lesiones cerebrales puede aumentar la probabilidad de sufrir convulsiones durante la prueba. Son necesarias precauciones al realizar la exploración de estos pacientes (por ejemplo vigilancia del paciente), y debe estar disponible el equipo y los medicamentos necesarios para el tratamiento rápido de las posibles convulsiones.
Pacientes con insuficiencia renal
Antes de administrar Optimark, debe evaluarse a todos los pacientes para descartar disfunción renal mediante pruebas de laboratorio.
Se han notificado casos de fibrosis sistémica nefrogénica (FSN) asociada al uso de Optimark y de algunos medios de contraste de gadolinio en pacientes con insuficiencia renal grave aguda o crónica (TFG < 30 ml/min/1,73 m2) y/o lesión renal aguda. Optimark está contraindicado en estos pacientes (ver sección Contraindicaciones). Los pacientes que se han sometido o que se están sometiendo a trasplante hepático están especialmente en situación de riesgo, ya que hay una elevada incidencia de insuficiencia renal aguda en este grupo. Por lo tanto, Optimark no debe utilizarse en pacientes que se hayan sometido o que se vayan a someter a un trasplante hepático ni en recién nacidos. Se desconoce el riesgo de desarrollo de FSN en pacientes con insuficiencia renal moderada (TFG 3059 ml/min/1,73 m2), por lo que Optimark sólo debe utilizarse tras realizar una meticulosa evaluación de los riesgos-beneficios en pacientes con insuficiencia renal moderada.
La gadoversetamida es dializable. La hemodiálisis poco tiempo después de la administración de Optimark puede ser útil para la eliminación de Optimark del organismo. No existen evidencias que apoyen iniciar hemodiálisis para la prevención o el tratamiento de la FSN en pacientes que no estén en hemodiálisis previamente.
En pacientes con insuficiencia renal basal se ha producido lesión renal aguda que precisó de diálisis con el uso de Optimark. El riesgo de lesión renal aguda puede aumentar con una dosis aumentada del medio de contraste. Debe administrarse la dosis más baja posible para la adquisición de imágenes adecuadas.
Niños y adolescentes
Optimark no se debe administrar con un autoinyector. La dosis necesaria debe ser administrada manualmente a los niños de 2 a 11 años para evitar una sobredosis por error.
Neonatos y lactantes
Optimark no debe usarse en niños menores de 2 años de edad debido a la ausencia de datos sobre seguridad y eficacia.
Pacientes de edad avanzada
Dado que el aclaramiento renal de gadoversetamida puede estar deteriorado en los pacientes de edad avanzada, es especialmente importante evaluar a los pacientes de al menos 65 años para descartar la presencia de disfunción renal.
Sodio
Este medicamento contiene menos de 1 mmol de sodio (23 mg) por dosis de hasta 17 ml; esto es, esencialmente "exento de sodio".
Las jeringas de 10 ml y de 15 ml contienen menos de 1 mmol de sodio; esto es, esencialmente "exentas de sodio".
Dosis mayores contienen 1 mmol de sodio o más, lo que debe ser tenido en cuenta en pacientes con dietas pobres en sodio.
20 ml de solución contienen 28,75 mg de sodio.
30 ml de solución contienen 43,13 mg de sodio.
Niveles plasmáticos de hierro y zinc
En ensayos clínicos se han observado disminuciones transitorias de los niveles plasmáticos de hierro y zinc, por lo que se debe actuar con precaución. Se desconoce la relevancia clínica de estos hallazgos.
Fertilidad, embarazo y lactancia
Embarazo
No hay datos relativos al uso de gadoversetamida en mujeres embarazadas. Los estudios en animales no sugieren efectos perjudiciales directos ni indirectos en términos de toxicidad para la reproducción. No debe utilizarse Optimark durante el embarazo a no ser que la situación clínica de la mujer requiera el uso de gadoversetamida.
Lactancia
Se desconoce si la gadoversetamida se excreta en la leche materna. No se dispone de información suficiente relativa a la excreción de gadoversetamida en la leche de animales. No se puede excluir el riesgo en niños lactantes. Debe interrumpirse la lactancia durante al menos 24 horas después de la administración de Optimark.
Fertilidad
Los datos de los estudios no clínicos no mostraron riesgos especiales para los seres humanos según los estudios convencionales de toxicidad reproductiva. No se han realizado estudios clínicos sobre fertilidad.
Posología y forma de administración
Optimark debe ser administrado solamente por médicos con experiencia en RM en la práctica clínica. Para permitir una acción inmediata en caso de emergencia, debe garantizarse la disponibilidad inmediata de los medicamentos necesarios (por ejemplo, epinefrina/adrenalina, teofilina, antihistamínicos, corticosteroides y atropinas), tubo endotraqueal y ventilador.
Posología
El medicamento debe administrarse en forma de inyección intravenosa periférica en bolo a una dosis de 0,2 ml/kg (100 micromol/kg) de peso corporal. Para garantizar la inyección completa del medio de contraste, debe administrarse una solución inyectable de 5 ml de cloruro sódico a 9 mg/ml (0,9 %) tras la inyección del medio de contraste. El procedimiento de imagen debe completarse en menos de una hora tras la administración del medio de contraste.
Dosis repetida
Para RM craneal en personas con función renal normal puede administrarse una segunda inyección en bolo de 0,2 ml/kg (100 micromol/kg) dentro de los primeros 30 minutos tras la primera inyección si persiste una fuerte sospecha clínica de una lesión a pesar de una RM realzada con dosis única de contraste, o cuando una información más precisa sobre el número, tamaño o extensión de las lesiones pudiera influir en el manejo o tratamiento del paciente, porque puede aumentar la sensibilidad diagnóstica de la prueba.
No se ha establecido la seguridad de dosis repetidas en niños y adolescentes (de 2 o más años de edad), ni en pacientes con insuficiencia renal ni en ancianos. No se recomienda repetir la dosis en estas poblaciones.
Datos limitados con otros medios de contraste de gadolinio sugieren que para la exclusión de metástasis craneales adicionales en un paciente con una metástasis resecable solitaria única conocida, la RM con la inyección de la dosis de 300 micromol/kg de peso corporal de Optimark puede proporcionar mayor confianza diagnóstica.
Población pediátrica
No se considera necesario realizar un ajuste de la dosis en niños mayores de 2 años de edad.
Optimark está contraindicado en recién nacidos de hasta 4 semanas de edad. Optimark no está recomendado para uso en niños menores de 2años porque la seguridad, eficacia e influencia de la inmadurez renal no se han estudiado en este grupo de edad.
Ancianos (de al menos 65 años)
No se considera necesario realizar un ajuste de la dosis. Debe obrarse con precaución en los pacientes ancianos.
Insu ficiencia renal y hepática
Optimark está contraindicado en pacientes con insuficiencia renal grave (TFG < 30 ml/min/1,73 m2) y/o lesión renal aguda y en pacientes que se hayan sometido a un trasplante hepático o que se encuentren en el período perioperatorio de un trasplante hepático. Optimark sólo debe utilizarse tras realizar una meticulosa evaluación de los riesgos/beneficios en los pacientes con insuficiencia renal moderada (TFG de 30-59 ml/min/1,73 m2) en una dosis no superior a 100 micromol/kg de peso corporal. Durante una exploración no debe utilizarse más de una dosis. Debido a la ausencia de información sobre la administración repetida, no deben repetirse las inyecciones de Optimark a menos que el intervalo entre inyecciones sea de 7 días como mínimo.
Forma de administración
El medicamento debe administrarse en forma de inyección intravenosa periférica en bolo. Para garantizar la inyección completa del medio de contraste, debe administrarse una solución inyectable de 5 ml de cloruro sódico a 9 mg/ml (0,9 %) tras la inyección del medio de contraste. Se recomienda la inserción de un catéter flexible para acceso intravenoso.
Optimark no se debe administrar con un autoinyector a niños de 2 a 11 años.
Precauciones que deben tomarse antes de manipular o administrar el medicamento El envase y la solución deben ser inspeccionados antes de su utilización.
Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios formales de interacciones.
Se ha demostrado que Optimark causa interferencia en la determinación de los niveles séricos de calcio utilizando el método colorimétrico de la ortocresolftaleína complexona (OCP). Sin embargo, la administración de gadoversetamida no causa una disminución real de los niveles séricos de calcio. En presencia de gadoversetamida, la técnica OCP produce un valor erróneo inferior al nivel sérico real de calcio. La magnitud de este artefacto en la determinación es proporcional a la concentración de gadoversetamida en sangre, y en pacientes con excreción renal normal se pueden obtener valores precisos aproximadamente a los 90 minutos después de la inyección. En pacientes con insuficiencia renal, la eliminación de gadoversetamida será más lenta y la interferencia con la determinación de los niveles séricos de calcio mediante OCP más prolongada. La gadoversetamida no afecta a otros métodos de determinación de los niveles séricos de calcio, como el método colorimétrico arsenazo III, la espectrometría de absorción atómica y la espectrometría de masas con plasma acoplado inductivamente.
Precauciones especiales de eliminación y otras manipulaciones
Optimark está destinado a un solo uso; la solución no utilizada debe desecharse.
La solución no debe utilizarse en caso de que presente alteraciones del color o si aparecen partículas.
Si se utiliza equipamiento no desechable, se debe prestar una escrupulosa atención para impedir cualquier contaminación residual con trazas de medios de limpieza.
Jeringas precargadas:
Inspección y montaje
Inspeccione la jeringa para detectar posibles signos de escape. No la utilice si observa un escape.
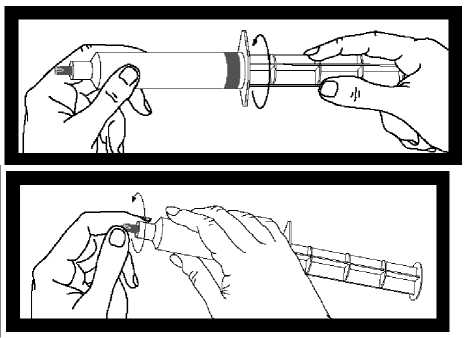
Tras enroscar la varilla en el émbolo de la jeringa, es importante girar la varilla media vuelta más, de
modo que el émbolo gris rote libremente
Antes de usar la jeringa, desenrosque la cápsula gris de la punta y deséchela. La jeringa está ahora lista para acoplarla a la aguja o a la vía de perfusión.
Elimine la jeringa y la solución sobrante después del uso.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con las normativas locales.
La etiqueta de seguimiento despegable de las jeringas precargadas deben adherirse a la historia del paciente para permitir llevar un registro exacto del medio de contraste de gadolinio utilizado. También debe registrarse la dosis utilizada.
Si se utilizan historias del paciente electrónicas, el nombre del medicamento, el número de lote y la dosis se deben introducir en la historia del paciente.
Optimark 500 micromol/ml solución inyectable en vial
Gadoversetamida
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Puede contribuir comunicando los efectos adversos que pudiera usted tener. La parte final de la sección 4 incluye información sobre cómo comunicar estos efectos adversos.
Lea todo el prospecto detenidamente antes de que le empiecen a administrar este medicamento porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto:
1. Qué es Optimark y para qué se utiliza
2. Qué necesita saber antes de que se le empiece a administrar Optimark
3. Cómo se administra Optimark
4. Posibles efectos adversos
5. Conservación de Optimark
6. Contenido del envase e información adicional
1. Qué es Optimark y para qué se utiliza
Optimark contiene el principio activo gadoversetamida. La gadoversetamida se utiliza como "agente de contraste" en la obtención de imágenes mediante resonancia magnética.
Optimark es únicamente para uso diagnóstico. Se utiliza en pacientes adultos y niños de dos o más años de edad a los que se les va a realizar una resonancia magnética (RM), un tipo de exploración en la que se toman imágenes de los órganos internos. Optimark se utiliza para obtener imágenes más claras en los pacientes que tienen o se cree que tienen anormalidades del cerebro, la columna vertebral o el hígado.
2. Qué necesita saber antes de que se le empiece a administrar Optimark
No use Optimark
si es alérgico
• al principio activo gadoversetamida o
• a cualquiera de los demás componentes de Optimark (ver sección 6), o
• a otros medios de contraste de gadolinio
No se le debe administrar Optimark si
• padece insuficiencia renal grave y/o aguda o
• si es un paciente que se va a someter o que se ha sometido a un transplante de hígado, porque la utilización de Optimark en pacientes con estos problemas se ha asociado a una enfermedad llamada fibrosis sistémica nefrogénica (FSN). La FSN es una enfermedad que implica un engrasamiento de la piel y tejidos conectivos. La FSN puede causar inmovilidad debilitante de las articulaciones, debilidad muscular o puede afectar al funcionamiento normal de los órganos internos, lo que podría ser mortal.
• Optimark no debe utilizarse en niños recién nacidos hasta las 4 semanas de edad.
Antes de recibir Optimark, deberá someterse a un análisis de sangre para comprobar el funcionamiento
de sus riñones.
Advertencias y precauciones
Consulte a su médico antes de que se empiece a administrar Optimark, si:
• tiene cualquier tipo de alergia (por ejemplo, a medicamentos o marisco, fiebre del heno, urticaria) o padece asma
• ha tenido cualquier tipo de reacción a inyecciones anteriores de medios de contraste, incluyendo los medios yodados
• sus riñones no funcionan adecuadamente
• se ha sometido recientemente, o se va a someter pronto a un trasplante hepático
• siente sed y/o solamente ha bebido pequeñas cantidades o nada en absoluto antes de la prueba
• está usando un beta-bloqueante (medicamento para la hipertensión)
• tiene una enfermedad del corazón
• tiene epilepsia o lesiones cerebrales
• usted sigue una dieta pobre en sodio
Si alguna de estas situaciones le afecta, su médico debe decidir si es apropiado realizar la prueba prevista.
Niños y adolescentes
Optimark no se recomienda en niños menores de dos años
Uso de Optimark con otros medicamentos
Informe a su médico o farmacéutico si está utilizando o ha utilizado recientemente otros medicamentos, incluso los adquiridos sin receta.
Embarazo y lactancia
Optimark no se debe utilizar durante el embarazo a menos que sea absolutamente necesario.
Debe interrumpirse la lactancia durante al menos 24 horas después de que reciba Optimark.
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico antes de utilizar este medicamento.
Conducción y uso de máquinas
Si usted es un paciente ambulatorio y tiene previsto conducir o utilizar herramientas o máquinas, tenga en cuenta que puede tener mareos fortuitos tras someterse a la prueba con Optimark. Hasta 1 de cada 100 personas pueden resultar afectadas.
Optimark contiene sodio
Este medicamento contiene menos de 1 mmol de sodio (23 mg) por dosis de hasta 17 ml; esto es, esencialmente "exento de sodio".
Los viales de 10 ml y de 15 ml contienen menos de 1 mmol de sodio; esto es, esencialmente "exentos de sodio".
Dosis mayores contienen 1 mmol de sodio o más, lo que debe ser tenido en cuenta en pacientes con dietas pobres en sodio.
20 ml de solución contienen 28,75 mg de sodio.
3. Cómo se administra Optimark
Los procedimientos diagnósticos que implican el uso de medios de contraste deben realizarse bajo la supervisión de un médico con la formación y conocimientos necesarios sobre el procedimiento que se va a realizar.
Dosis normal
La dosis normal de 0,2 ml/kg de peso corporal es la misma en adultos y en niños de 2 o más años de edad. Corresponde a 14 ml para un individuo de 70 kg y este volumen debe inyectarse durante unos 7 -14 segundos en vena, normalmente una vena de un brazo. A continuación, el dispositivo de inyección se lava con una solución salina para garantizar que no quede nada en la jeringa o en el tubo utilizado para la inyección.
En los adultos, se puede administrar una segunda dosis dentro de los siguientes 30 minutos a la primera inyección. Cuando se estén examinando un cierto tipo de anormalidades cerebrales, puede que se necesite utilizar Optimark en una cantidad tres veces superior a la dosis normal en adultos. El médico decidirá la dosis necesaria de Optimark para su prueba. Debe advertir inmediatamente al médico o enfermera/técnico si siente dolor alrededor del área donde se sitúa la aguja.
Dosis en grupos de pacientes especiales
En pacientes con problemas renales moderados, durante una exploración no debe utilizarse más de una dosis de Optimark. No deben repetirse las inyecciones de Optimark a menos que el intervalo entre inyecciones sea de 7 días como mínimo.
No es necesario ajustar la dosis si usted tiene 65 o más años de edad, pero le harán un análisis de sangre para comprobar el funcionamiento de sus riñones.
Si recibe más Optimark del que debe
Si le han inyectado demasiado Optimark, es improbable que eso le perjudique mucho, puesto que no se han observado problemas con dosis muy superiores a la normal administradas a algunas personas.
Si sus riñones funcionan normalmente es poco probable que tenga algún problema. Optimark se puede eliminar utilizando diálisis. Si piensa que se le ha inyectado demasiado Optimark, advierta inmediatamente al médico o enfermera/técnico.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, Optimark puede producir efectos adversos, aunque no todas las personas los sufran.
Debe comunicar inmediatamente al médico o enfermera/técnico que realizan la prueba sobre cualquiera de los siguientes síntomas, y recibir tratamiento inmediato puesto que pueden ser o llegar a ser muy graves:
efectos adversos que afectan al corazón (desmayos, latidos cardiacos adicionales a los regulares, dolor en el pecho) o al sistema respiratorio (dificultad de la respiración, opresión de las vías respiratorias, hinchazón u opresión de la garganta, picor de nariz o nariz cargada, estornudos).
La mayoría de los efectos adversos observados tras la utilización de Optimark tuvieron una intensidad leve a moderada y carácter transitorio. Los efectos adversos más frecuentes fueron gusto extraño en la boca, sensación de calor, dolor de cabeza y mareo.
Los posibles efectos adversos se describen de forma más detallada a continuación.
Las siguientes frecuencias y síntomas se basan en datos de ensayos clínicos y en la experiencia de uso de Optimark después de salir al mercado.
|
Frecuencia |
Posibles efectos adversos |
|
Frecuentes (pueden afectar a hasta 1 de cada 10 personas) |
Dolores de cabeza, gusto extraño en la boca, sensación de calor |
|
Poco frecuentes (pueden afectar a hasta 1 de cada 100 personas) |
Reacción alérgica/hipersensibilidad, mareos, sensación de hormigueo, entumecimiento, sentido del olfato reducido, enrojecimiento y calor en la piel, congestión nasal, faringitis, náuseas, diarrea, picor, sarpullido, malestar en el pecho, sensación de frío incluyendo sensación de frío en las extremidades, reacciones en el lugar de la administración, cambios en los niveles de calcio en sangre |
|
Frecuencia |
Posibles efectos adversos |
|
Raros (pueden afectar a hasta 1 de cada 1000 personas) |
Disminución del apetito, sensación de ansiedad, trastornos del sueño, somnolencia, escozor, sensación de movimiento o giro, pitidos en los oídos, irritación de los párpados, dolor de ojos, visión borrosa, irritación de los ojos, conciencia del latido cardiaco, pulso irregular, latidos cardiacos adicionales a los regulares, tensión baja, dificultad para respirar, ronquera, nariz cargada, opresión en la garganta, insalivación excesiva, dolor abdominal, estreñimiento, sequedad en la boca, urticaria, sudor frío, enrojecimiento, mayores niveles en sangre de una sustancia (creatinina) que normalmente se elimina por los riñones, sangre en la orina, hinchazón de la cara, debilidad y síntomas similares como fatiga y sensación general de malestar, fiebre, inflamación de las extremidades, escalofríos, dolor, sensación de frío en las extremidades, aumento de las enzimas hepáticas, análisis de orina anormal, aumento de los valores de minerales en orina, proteínas en la orina, aumento de enzimas de corazón y músculo, disminución de hemoglobina, sensación de confusión y desorientación, temblores, convulsión, ojos irritados, latido acelerado, tensión alta, opresión de las vías respiratorias, hinchazón de garganta o de las cuerdas vocales, faringitis, tos, picor de nariz, estornudos, sudoración |
|
Muy raros (pueden afectar a hasta 1 de cada 10.000 personas) |
Hinchazón alrededor de los ojos, trazado anormal en ECG de la actividad cardiaca, desmayos, vómitos |
|
No conocida (la frecuencia no puede estimarse a partir de los datos disponibles) |
Endurecimiento de la piel que puede afectar también a los tejidos blandos y a los órganos internos (fibrosis sistémica nefrogénica), sensación de malestar |
Se han notificado casos de fibrosis sistémica nefrogénica (que causa endurecimiento de la piel y puede afectar también a los tejidos blandos y a los órganos internos).
En niños de 2 años de edad o más, se observaron efectos adversos del uso de Optimark similares a los adultos.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Anexo V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Optimark
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la caja y en la etiqueta del vial después de CAD/EXP.
Conservar los viales en el embalaje exterior para protegerlos de la luz.
No refrigerar o congelar.
El medicamento debe usarse inmediatamente. De lo contrario, los tiempos de conservación durante el uso y las condiciones previas al mismo son responsabilidad del usuario.
No utilice la solución si presenta un color diferente o partículas.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de Optimark
• El principio activo es gadoversetamida.
1 ml contiene 330,9 mg de gadoversetamida, lo que equivale a 500 micromol.
Cada vial de 10 ml contiene 3309 mg de gadoversetamida.
Cada vial de 15 ml contiene 4963,5 mg de gadoversetamida.
Cada vial de 20 ml contiene 6618 mg de gadoversetamida.
• Los demás componentes son: versetamida, hidróxido de calcio, cloruro de calcio dihidrato, hidróxido de sodio y/o ácido clorhídrico, agua para preparaciones inyectables.
Aspecto del producto y contenido del envase
Optimark viales contiene una solución transparente (sin partículas), de incolora a amarillo pálido. Optimark se suministra en viales, con tapón de goma de bromobutilo y cápsulas de cierre de aluminio.
Optimark viales se suministra en los siguientes tamaños de envases:
1 x 10 ml 10 x 10 ml
1 x 15 ml 10 x 15 ml
1 x 20 ml 10 x 20 ml
Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización y responsable de la fabricación
Titular de la autorización de comercialización:
Mallinckrodt Deutschland GmbH Josef-Dietzgen-Str. 1 53773 Hennef Alemania
Pueden solicitar más información respecto a este medicamento dirigiéndose al titular de la
autorización de comercialización.
Responsable de la fabricación
Mallinckrodt Medical Imaging Ireland
Damastown
Mulhuddart, Dublín 15
Irlanda
Fecha de la última revisión de este prospecto:
Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia
Europea de Medicamentos (EMA): http://www.ema.europa.eu.
Esta información está destinada únicamente a profesionales del sector sanitario:
Indicaciones terapéuticas
Optimark está indicado para utilización en imagen por resonancia magnética (RM) del sistema nervioso central (SNC) e hígado. Intensifica el contraste y facilita la visualización, ayudando a la caracterización de lesiones focales y estructuras anormales en el SNC e hígado en pacientes adultos y en niños de dos o más años con patología conocida o sospechada.
Contraindicaciones
• Hipersensibilidad a la gadoversetamida o a otros productos que contienen gadolinio o a alguno de los excipientes.
• Optimark está contraindicado en pacientes con insuficiencia renal grave (TFG < 30 ml/min/1,73 m2) y/o lesión renal aguda, en
• pacientes que se hayan sometido a un trasplante hepático o
• que se encuentren en el período perioperatorio de un trasplante hepático y
• en recién nacidos de hasta 4 semanas de edad.
Advertencias y precauciones especiales de empleo
Al igual que con otros medios de contraste paramagnéticos, el realce del contraste de la imagen de RM con gadoversetamida puede empeorar la visualización de lesiones existentes. Algunas de estas lesiones pueden detectarse mediante RM sin contraste. Por lo tanto, se debe actuar con precaución cuando la interpretación de la imagen realzada de contraste se realice en ausencia de una imagen de RM sin contraste
Antes de la prueba, los pacientes deben estar suficientemente hidratados.
Hipersensibilidad
También pueden ocurrir reacciones de tipo alérgico y otras reacciones idiosincrásicas con gadoversetamida, lo que podría manifestarse en forma de reacciones cardiovasculares, respiratorias y cutáneas (ver sección 4.8). La mayoría de estas reacciones ocurren en la primera media hora tras la administración del medio de contraste. Como ocurre con todos los demás medios de contraste de la misma clase, pueden producirse raramente reacciones tardías (después de horas o días) en casos raros; sin embargo, no se ha notificado ningún caso en los ensayos clínicos realizados.
Si se producen reacciones de hipersensibilidad, la administración del medio de contraste debe interrumpirse inmediatamente e iniciar un tratamiento intravenoso, si es necesario.
La prueba debe realizarse bajo la supervisión de un médico y se recomienda la inserción de un catéter flexible para acceso intravenoso. Para permitir una acción inmediata en caso de emergencia, debe garantizarse la disponibilidad inmediata de los medicamentos necesarios (por ejemplo, epinefrina/adrenalina, teofilina, antihistamínicos, corticosteroides y atropinas), tubo endotraqueal y ventilador.
El riesgo de reacciones de hipersensibilidad aumenta en los siguientes casos:
- pacientes con predisposición alérgica
- pacientes con asma bronquial; en estos pacientes es el riesgo de broncoespasmo lo que aumenta particularmente
- pacientes con un historial de reacciones a medios de contraste, incluyendo los medios yodados Antes de la inyección del medio de contraste, debe preguntarse a los pacientes si tienen alguna alergia (por ejemplo alergias al pescado o a medicamentos, fiebre del heno, urticaria), si son hipersensibles a los medios de contraste y si padecen asma bronquial. Puede considerarse una premedicación con antihistamínicos y/o glucocorticoides.
Pacientes en tratamiento con beta-bloqueantes
Se debe tener en cuenta que los pacientes que utilizan beta-bloqueantes no responden necesariamente a los beta-agonistas utilizados habitualmente para el tratamiento de las reacciones de hipersensibilidad.
Pacientes con trastornos cardiovasculares
En este grupo de pacientes las reacciones de hipersensibilidad pueden ser graves. Especialmente en pacientes con enfermedades cardíacas graves (por ejemplo, insuficiencia cardiaca grave, enfermedad arterial coronaria), las reacciones cardiovasculares pueden empeorar. Sin embargo, no hubo evidencias en los ensayos clínicos con Optimark.
Trastornos del sistema nervioso central
En pacientes con epilepsia o lesiones cerebrales puede aumentar la probabilidad de sufrir convulsiones durante la prueba. Son necesarias precauciones al realizar la exploración de estos pacientes (por ejemplo vigilancia del paciente), y debe estar disponible el equipo y los medicamentos necesarios para el tratamiento rápido de las posibles convulsiones.
Pacientes con insuficiencia renal
Antes de administrar Optimark, debe evaluarse a todos los pacientes para descartar disfunción renal mediante pruebas de laboratorio.
Se han notificado casos de fibrosis sistémica nefrogénica (FSN) asociada al uso de Optimark y de algunos medios de contraste de gadolinio en pacientes con insuficiencia renal grave aguda o crónica (TFG < 30 ml/min/1,73 m2) y/o lesión renal aguda. Optimark está contraindicado en estos pacientes (ver sección Contraindicaciones). Los pacientes que se han sometido o que se están sometiendo a trasplante hepático están especialmente en situación de riesgo, ya que hay una elevada incidencia de insuficiencia renal aguda en este grupo. Por lo tanto, Optimark no debe utilizarse en pacientes que se hayan sometido o que se vayan a someter a un trasplante hepático ni en recién nacidos. Se desconoce el riesgo de desarrollo de FSN en pacientes con insuficiencia renal moderada (TFG 3059 ml/min/1,73 m2), por lo que Optimark sólo debe utilizarse tras realizar una meticulosa evaluación de los riesgos-beneficios en pacientes con insuficiencia renal moderada.
La gadoversetamida es dializable. La hemodiálisis poco tiempo después de la administración de Optimark puede ser útil para la eliminación de Optimark del organismo. No existen evidencias que apoyen iniciar hemodiálisis para la prevención o el tratamiento de la FSN en pacientes que no estén en hemodiálisis previamente.
En pacientes con insuficiencia renal basal se ha producido lesión renal aguda que precisó de diálisis con el uso de Optimark. El riesgo de lesión renal aguda puede aumentar con una dosis aumentada del medio de contraste. Debe administrarse la dosis más baja posible para la adquisición de imágenes adecuadas.
Niños y adolescentes
Optimark no se debe administrar con un autoinyector. La dosis necesaria debe ser administrada manualmente a los niños de 2 a 11 años para evitar una sobredosis por error.
Neonatos y lactantes
Optimark no debe usarse en niños menores de dos años de edad debido a la ausencia de datos sobre seguridad y eficacia.
Pacientes de edad avanzada
Dado que el aclaramiento renal de gadoversetamida puede estar deteriorado en los pacientes de edad avanzada, es especialmente importante evaluar a los pacientes de al menos 65 años de edad para descartar la presencia de disfunción renal.
Sodio
Este medicamento contiene menos de 1 mmol de sodio (23 mg) por dosis de hasta 17 ml; esto es, esencialmente "exento de sodio".
Los viales de 10 ml y de 15 ml contienen menos de 1 mmol de sodio; esto es, esencialmente "exentos de sodio".
Dosis mayores contienen 1 mmol de sodio o más, lo que debe ser tenido en cuenta en pacientes con dietas pobres en sodio.
20 ml de solución contienen 28,75 mg de sodio.
Niveles plasmáticos de hierro y zinc
En ensayos clínicos se han observado disminuciones transitorias de los niveles plasmáticos de hierro y zinc, por lo que se debe actuar con precaución. Se desconoce la relevancia clínica de estos hallazgos.
Fertilidad, embarazo y lactancia
Embarazo
No hay datos relativos al uso de gadoversetamida en mujeres embarazadas. Los estudios en animales no sugieren efectos perjudiciales directos ni indirectos en términos de toxicidad para la reproducción No debe utilizarse Optimark durante el embarazo a no ser que la situación clínica de la mujer requiera el uso de gadoversetamida.
Lactancia
Se desconoce si la gadoversetamida se excreta en la leche materna. No se dispone de información suficiente relativa a la excreción de gadoversetamida en la leche de animales. No se puede excluir el riesgo en niños lactantes. Debe interrumpirse la lactancia durante al menos 24 horas después de la administración de Optimark.
Fertilidad
Los datos de los estudios no clínicos no mostraron riesgos especiales para los seres humanos según los estudios convencionales de toxicidad reproductiva. No se han realizado estudios clínicos sobre fertilidad.
Posología y forma de administración
Optimark debe ser administrado solamente por médicos con experiencia en RM en la práctica clínica. Para permitir una acción inmediata en caso de emergencia, debe garantizarse la disponibilidad inmediata de los medicamentos necesarios (por ejemplo, epinefrina/adrenalina, teofilina, antihistamínicos, corticosteroides y atropinas), tubo endotraqueal y ventilador.
Posología
El medicamento debe administrarse en forma de inyección intravenosa periférica en bolo a una dosis de 0,2 ml/kg (100 micromol/kg) de peso corporal. Para garantizar la inyección completa del medio de contraste, debe administrarse una solución inyectable de 5 ml de cloruro sódico a 9 mg/ml (0,9 %) tras la inyección del medio de contraste. El procedimiento de imagen debe completarse en menos de una hora tras la administración del medio de contraste.
Dosis repetida
Para RM craneal en personas con función renal normal puede administrarse una segunda inyección en bolo de 0,2 ml/kg (100 micromol/kg) dentro de los primeros 30 minutos tras la primera inyección si persiste una fuerte sospecha clínica de una lesión a pesar de una RM realzada con dosis única de contraste, o cuando una información más precisa sobre el número, tamaño o extensión de las lesiones pudiera influir en el manejo o tratamiento del paciente, porque puede aumentar la sensibilidad diagnóstica de la prueba.
No se ha establecido la seguridad de dosis repetidas en niños y adolescentes (de 2 o más años de edad), ni en pacientes con insuficiencia renal ni en ancianos. No se recomienda repetir la dosis en estas poblaciones.
Datos limitados con otros medios de contraste de gadolinio sugieren que para la exclusión de metástasis craneales adicionales en un paciente con una metástasis resecable solitaria única conocida, la RM con la inyección de la dosis de 300 micromol/kg de peso corporal de Optimark puede proporcionar mayor confianza diagnóstica.
Población pediátrica
No se considera necesario realizar un ajuste de la dosis en niños mayores de 2 años de edad.
Optimark está contraindicado en recién nacidos de hasta 4 semanas de edad. Optimark no está recomendado para uso en niños menores de 2 años porque la seguridad, eficacia e influencia de la inmadurez renal no se han estudiado en este grupo de edad.
Ancianos (de al menos 65 años)
No se considera necesario realizar un ajuste de la dosis. Debe obrarse con precaución en los pacientes ancianos.
Insuficiencia renal y hepática
Optimark está contraindicado en pacientes con insuficiencia renal grave (TFG < 30 ml/min/1,73 m2) y/o lesión renal aguda y en pacientes que se hayan sometido a un trasplante hepático o que se encuentren en el período perioperatorio de un trasplante hepático. Optimark sólo debe utilizarse tras realizar una meticulosa evaluación de los riesgos/beneficios en los pacientes con insuficiencia renal moderada (TFG de 30-59 ml/min/1,73 m2) en una dosis no superior a 100 micromol/kg de peso corporal. Durante una exploración no debe utilizarse más de una dosis. Debido a la ausencia de información sobre la administración repetida, no deben repetirse las inyecciones de Optimark a menos que el intervalo entre inyecciones sea de 7 días como mínimo.
Forma de administración
El medicamento debe administrarse en forma de inyección intravenosa periférica en bolo. Para garantizar la inyección completa del medio de contraste, debe administrarse una solución inyectable de 5 ml de cloruro sódico a 9 mg/ml (0,9 %) tras la inyección del medio de contraste. Se recomienda la inserción de un catéter flexible para acceso intravenoso.
Optimark no se debe administrar con un autoinyector a niños de 2 a 11 años.
Precauciones que deben tomarse antes de manipular o administrar el medicamento El envase y la solución deben ser inspeccionados antes de su utilización.
Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios formales de interacciones.
Se ha demostrado que Optimark causa interferencia en la determinación de los niveles séricos de calcio utilizando el método colorimétrico de la ortocresolftaleína complexona (OCP). Sin embargo, la administración de gadoversetamida no causa una disminución real de los niveles séricos de calcio. En presencia de gadoversetamida, la técnica OCP produce un valor erróneo inferior al nivel sérico real de calcio. La magnitud de este artefacto en la determinación es proporcional a la concentración de gadoversetamida en sangre, y en pacientes con excreción renal normal se pueden obtener valores precisos aproximadamente a los 90 minutos después de la inyección. En pacientes con insuficiencia renal, la eliminación de gadoversetamida será más lenta y la interferencia con la determinación de los niveles séricos de calcio mediante OCP más prolongada. La gadoversetamida no afecta a otros métodos de determinación de los niveles séricos de calcio, como el método colorimétrico arsenazo III, la espectrometría de absorción atómica y la espectrometría de masas con plasma acoplado inductivamente.
Precauciones especiales de eliminación y otras manipulaciones
Optimark está destinado a un solo uso; la solución no utilizada debe desecharse.
La solución no debe utilizarse en caso de que presente alteraciones del color o si aparecen partículas.
Si se utiliza equipamiento no desechable, se debe prestar atención para impedir cualquier contaminación residual con trazas de medios de limpieza.
Optimark sólo debe extraerse con la jeringa inmediatamente antes de ser usado.
Las presentaciones de gadoversetamida en envases de vidrio que se hayan congelado pueden calentarse a temperatura ambiente y agitarse enérgicamente. El producto debe ser examinado antes de su utilización para confirmar que todos los sólidos estén disueltos y que el envase y el cierre no estén dañados. Si quedan sólidos, el vial debe eliminarse.
Elimine la jeringa y la solución sobrante después del uso.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con las normativas locales.
La etiqueta de seguimiento despegable de los viales debe adherirse a la historia del paciente para permitir llevar un registro exacto del medio de contraste de gadolinio utilizado. También debe registrarse la dosis utilizada. Si se utilizan historias del paciente electrónicas, el nombre del medicamento, el número de lote y la dosis se deben introducir en la historia del paciente.
50