Opatanol 1 Mg/Ml Colirio En Solucion
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
1. NOMBRE DEL MEDICAMENTO
OPATANOL 1 mg/ml colirio en solución
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada ml de solución contiene 1 mg de olopatadina (como hidrocloruro). Excipiente(s) con efecto conocido: cloruro de benzalconio 0,1 mg/ml Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Colirio en solución (colirio).
Solución incolora y transparente.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Tratamiento de los signos y síntomas oculares de la conjuntivitis alérgica estacional.
4.2 Posología y forma de administración Posología
La dosis es de una gota de OPATANOL dos veces al día (con un intervalo de 8 horas) en el saco conjuntival del ojo(s) afectado(s). El tratamiento puede mantenerse hasta un máximo de cuatro meses, si se considera necesario.
Uso en pacientes de edad avanzada
No es necesario un ajuste de la dosis en pacientes de edad avanzada.
Pacientes pediátricos
OPATANOL se puede utilizar en pacientes pediátricos de 3 años o mayores a la misma dosis que en adultos. No se ha establecido la seguridad y eficacia de OPATANOL en niños menores de 3 años. No se dispone de datos.
Uso en insuficiencia hepática y renal
No se ha estudiado la olopatadina en forma de colirio (OPATANOL) en pacientes con insuficiencia hepática o renal. No obstante, no se espera que sea necesario un ajuste de la dosis en insuficiencia hepática o renal (ver sección 5.2).
Forma de administración Sólo por vía oftálmica.
Después de quitar el tapón, se debe retirar el anillo de plástico del precinto antes de utilizar. Para evitar una posible contaminación de la punta del cuentagotas y de la solución, debe tenerse la precaución de no tocar los párpados, áreas circundantes ni otras superficies con la punta del frasco. Se debe mantener el frasco bien cerrado cuando no se utilice.
Si se emplea más de un medicamento por vía oftálmica, las aplicaciones de los medicamentos deben espaciarse al menos 5 minutos. Las pomadas oftálmicas deben administrarse en último lugar.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
OPATANOL es un agente antialérgico/antihistamínico que aunque se administre vía oftálmica se absorbe a nivel sistémico. Debe interrumpirse el tratamiento si aparecen signos de reacciones graves o de hipersensibilidad.
OPATANOL contiene cloruro de benzalconio que puede producir irritación ocular.
También se ha notificado que el cloruro de benzalconio produce queratopatía punctata y/o queratopatía ulcerativa tóxica. Se aconseja un especial seguimiento de aquellos pacientes que presenten ojo seco o trastornos de la córnea, y utilizan el producto con frecuencia o durante un periodo prolongado.
Lentes de contacto
Se sabe que el cloruro de benzalconio altera el color de las lentes de contacto blandas. Evitar el contacto con las lentes de contacto blandas. Debe indicarse a los pacientes que se retiren las lentes de contacto antes de la aplicación del colirio y esperen al menos 15 minutos después de la instilación antes de volverse a colocar las lentes de contacto.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios de interacción con otros medicamentos.
Los estudios in vitro han mostrado que la olopatadina no inhibe reacciones metabólicas que involucran al citocromo P-450 isoenzimas 1A2, 2C8, 2C9, 2C19, 2D6, 2E1 y 3A4. Estos resultados indican que no es probable que se produzcan interacciones metabólicas al administrar olopatadina conjuntamente con otras substancias activas.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No hay datos o éstos son limitados relativos al uso de olopatadina oftálmica en mujeres embarazadas.
Los estudios realizados en animales han mostrado toxicidad para la reproducción tras administración sistémica (ver sección 5.3).
No se recomienda utilizar olopatadina durante el embarazo, ni en mujeres en edad fértil que no estén utilizando métodos anticonceptivos.
Lactancia
Los datos disponibles en animales muestran que olopatadina se excreta en la leche tras administración oral (para mayor información ver sección 5.3).
No se puede excluir el riesgo en recién nacidos/niños.
No debe utilizarse OPATANOL durante la lactancia.
Fertilidad
No se han realizado estudios para evaluar el efecto de la administración oftálmica de olopatadina sobre la fertilidad en humanos.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de OPATANOL sobre la capacidad para conducir y utilizar máquinas es nula o insignificante.
Como con cualquier colirio, la presencia de visión borrosa transitoria y otras alteraciones visuales pueden afectar la capacidad de conducir o utilizar máquinas. Si aparece visión borrosa durante la instilación, el paciente debe esperar hasta que la visión sea nítida antes de conducir o utilizar maquinaria.
4.8 Reacciones adversas
Resumen del perfil de seguridad
En ensayos clínicos realizados en 1680 pacientes, OPATANOL se administró de una a cuatro veces al día, en ambos ojos hasta un máximo de cuatro meses como monoterapia o como terapia coadyuvante a loratadina 10 mg. Aunque puede esperarse que aproximadamente un 4,5% de los pacientes experimenten reacciones adversas relacionadas con el uso de OPATANOL, sólo un 1,6% de los pacientes abandonaron los ensayos clínicos debido a estas reacciones adversas. Durante los ensayos clínicos no se notificaron reacciones adversas graves oftálmicas ni sistémicas relacionadas con OPATANOL. La reacción adversa relacionada con el tratamiento notificada con más frecuencia consistió en dolor ocular, con una incidencia promedio del 0,7%.
Tabla de reacciones adversas
Se han notificado las siguientes reacciones adversas en ensayos clínicos y datos postcomercialización y se clasificaron de acuerdo con el siguiente criterio: muy frecuentes (>1/10), frecuentes (>1/100 a <1/10), poco frecuentes (>1/1.000 a <1/100), raras (>1/10.000 a <1/1.000), muy raras (<1/10.000) o frecuencia no conocida (no puede estimarse a partir de los datos disponibles). Las reacciones adversas se enumeran en orden decreciente de gravedad, dentro de cada intervalo de frecuencia.
|
Sistema de Clasificación de Órganos |
Frecuencia |
Reacciones adversas |
|
Infecciones e infestaciones |
Poco frecuentes |
rinitis |
|
Trastornos del sistema inmunológico |
No conocida |
hipersensibilidad, hinchazón de cara |
|
Trastornos del sistema nervioso |
Frecuentes |
cefalea, disgeusia |
|
Poco frecuentes |
mareo, hipoestesia | |
|
No conocida |
somnolencia | |
|
Trastornos oculares |
Frecuentes |
dolor ocular, irritación ocular, ojo seco, sensación anormal en el ojo |
|
Poco frecuentes |
erosión corneal, defecto del epitelio corneal, trastorno del epitelio corneal, queratitis puntiforme, queratitis, manchas corneales, secreción ocular, fotofobia, visión borrosa, agudeza visual disminuida, blefaroespasmo, molestia ocular, prurito ocular, folículos conjuntivales, trastorno conjuntival, sensación de cuerpo extraño en los ojos, lagrimeo aumentado, eritema del párpado, edema palpebral, trastorno del párpado, hiperemia ocular | |
|
No conocida |
edema corneal, edema ocular, hinchazón ocular, conjuntivitis, midriasis, deterioro visual, costra en margen de párpado | |
|
Trastornos respiratorios, torácicos y mediastínicos |
Frecuentes |
sequedad nasal |
|
No conocida |
disnea, sinusitis | |
|
Trastornos gastrointestinales |
No conocida |
náuseas, vómitos, |
|
Trastornos de la piel y tejido subcutáneo |
Poco frecuentes |
dermatitis de contacto, sensación de ardor en piel, piel seca |
|
No conocida |
dermatitis, eritema | |
|
Trastornos generales y alteraciones en el lugar de administración |
Frecuentes |
fatiga |
|
No conocida |
astenia, malestar general |
En algunos pacientes con córneas dañadas significativamente, muy raramente se han notificado casos de calcificación corneal relacionados con el uso de colirios que contienen fosfatos.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Anexo V.
4.9 Sobredosis
No existen datos disponibles en humanos en relación con la sobredosis por ingesta deliberada o accidental. La olopatadina tiene una toxicidad aguda baja en animales. La ingesta accidental del contenido completo de un frasco de OPATANOL daría lugar a una exposición sistémica máxima de 5 mg de olopatadina. De esta exposición resultaría una dosis final de 0,5 mg/kg en un niño de 10 kg, asumiendo una absorción del 100%.
En perros, la prolongación del intervalo QTc se observó solamente tras exposiciones bastante superiores a la exposición máxima en humanos, de lo que se deduce poca importancia clínica. No se observó prolongación significativa del intervalo QTc comparado con placebo, tras la administración de una dosis oral de 5 mg dos veces al día, durante 2,5 días, a 102 voluntarios sanos, jóvenes y pacientes de edad avanzada de ambos sexos. El intervalo de concentraciones plasmáticas pico de olopatadina en estado estacionario (35 a 127 ng/ml) observadas en este estudio representan al menos un margen de seguridad de 70 veces para la olopatadina oftálmica con respecto a los efectos sobre la repolarización cardíaca.
En el caso de sobredosis debe monitorizarse y tratarse adecuadamente al paciente.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: oftalmológicos; descongestivos y antialérgicos; otros antialérgicos. Código ATC: S01GX 09
La olopatadina es un agente antialérgico/antihistamínico potente y selectivo que ejerce su efecto a través de varios mecanismos de acción diferentes. Antagoniza la histamina (mediador primario de las respuestas alérgicas en humanos) y evita que la histamina induzca la formación de citocina inflamatoria por las células epiteliales de la conjuntiva. Los datos de estudios in vitro sugieren que puede actuar sobre los mastocitos de la conjuntiva humana, para inhibir la liberación de mediadores pro-inflamatorios. En pacientes con el conducto nasolagrimal no obstruido, se observó que la administración oftálmica de OPATANOL reduce los signos y síntomas nasales, que con frecuencia acompañan a la conjuntivitis alérgica estacional. No produce un cambio clínicamente significativo en el diámetro de la pupila.
5.2 Propiedades farmacocinéticas
Absorción
Como otros fármacos administrados vía oftálmica, la olopatadina se absorbe a nivel sistémico. No obstante, la absorción sistémica de la olopatadina administrada vía oftálmica es mínima alcanzando concentraciones plasmáticas que van desde por debajo del límite de cuantificación (< 0,5 ng/ml) hasta
1.3 ng/ml. Estas concentraciones son de 50 a 200 veces inferiores a las que se obtienen con dosis orales bien toleradas.
Eliminación
En los estudios farmacocinéticos realizados utilizando la vía oral, la semivida plasmática fue aproximadamente de 8 a 12 horas, y la eliminación fue predominantemente mediante excreción renal. Aproximadamente un 60-70% de la dosis se recuperó en la orina como fármaco sin metabolizar. En la orina se detectaron concentraciones bajas de dos metabolitos, el mono-desmetil y el N-óxido.
Como la olopatadina se excreta principalmente en la orina como fármaco sin metabolizar, los pacientes con insuficiencia renal grave (aclaramiento medio de creatinina 13,0 ml/min) presentan alteración de los parámetros farmacocinéticos de la olopatadina, con concentraciones pico 2,3 veces superiores a las de los adultos sanos. Tras la administración de 10 mg por vía oral en pacientes sometidos a hemodiálisis (sin flujo urinario), las concentraciones plasmáticas de olopatadina fueron significativamente menores el día de la hemodiálisis que el día sin hemodiálisis, lo que sugiere que la olopatadina puede ser eliminada por hemodiálisis.
En estudios comparativos de la farmacocinética de dosis orales de 10 mg olopatadina en jóvenes (media de 21 años) y pacientes de edad avanzada (media de 74 años) no se observaron diferencias significativas en las concentraciones plasmáticas (AUC), unión a proteínas o excreción urinaria del fármaco inalterado y de sus metabolitos.
Se ha realizado un estudio sobre insuficiencia renal tras la administración oral de olopatadina en pacientes con insuficiencia renal grave. Los resultados indican que en estos pacientes cabe esperar concentraciones plasmáticas algo más elevadas de OPATANOL. Como las concentraciones plasmáticas alcanzadas tras la administración oftálmica de olopatadina son de 50 a 200 veces inferiores que las obtenidas con dosis orales bien toleradas no cabe esperar que se necesite un ajuste de dosis en pacientes ancianos ni en pacientes con insuficiencia renal. Debido a que el metabolismo hepático es una vía de eliminación secundaria, no cabe esperar que sea necesario un ajuste de dosis en pacientes con insuficiencia hepática.
5.3 Datos preclínicos sobre seguridad
Los datos de los estudios no clínicos no muestran riesgos especiales para los seres humanos, según los estudios convencionales de seguridad, farmacología, toxicidad a dosis múltiple, genotoxicidad, potencial carcinogénico y toxicidad sobre la reproducción.
Estudios en animales han mostrado una reducción en el crecimiento de las crías lactantes de hembras que recibieron dosis sistémicas de olopatadina muy por encima del nivel máximo recomendado para el uso oftálmico en humanos. Se ha detectado olopatadina en la leche de ratas lactantes tras administración oral.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Cloruro de benzalconio cloruro de sodio
hidrogenofosfato de disodio dodecahidrato (E339) ácido clorhídrico (E507) (para ajustar pH) hidróxido de sodio (E524) (para ajustar pH)
agua purificada
6.2 Incompatibilidades
En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros.
6.3 Periodo de validez
3 años.
Periodo de validez después de la primera apertura Desechar 4 semanas después de la primera apertura del envase.
6.4 Precauciones especiales de conservación
Este medicamento no requiere condiciones especiales de conservación.
6.5 Naturaleza y contenido del envase
Frascos de 5 ml de polietileno de baja densidad y tapón de rosca de polipropileno (DROPTAINER).
Envases que contienen 1 o 3 frascos. Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación
Ninguna especial.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Alcon Laboratories (UK) Ltd
Frimley Business Park
Frimley
Camberley
Surrey GU16 7SR
Reino Unido
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/02/217/001-002
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 17 Mayo 2002 Fecha de la última renovación: 22 Mayo 2007
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
A. FABRICANTE(S) RESPONSABLE(S) DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
A. TITULARES DE LA AUTORIZACIÓN DE FABRICACIÓN RESPONSABLES DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección de los fabricantes responsables de la liberación de los lotes
S.A. Alcon Couvreur N.V.,
Rijksweg 14,
B-2870 Puurs,
Bélgica.
o
Alcon Cusí, S.A.,
Camil Fabra 58,
08320 El Masnou,
Barcelona,
España.
El prospecto impreso del medicamento debe especificar el nombre y dirección del fabricante responsable de la liberación del lote en cuestión.
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO IMPUESTAS AL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Medicamento sujeto a prescripción médica
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
El Titular de la Autorización de Comercialización (TAC) presentará los informes periódicos de seguridad para este medicamento de conformidad con las exigencias establecidas en la lista de fechas de referencia de la Unión (lista EURD) prevista en el artículo 107 ter, párrafo 7, de la Directiva 2001/83/CE y publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado en la versión del PGR incluido en el Módulo 1.8.2 de la Autorización de Comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos.
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
Si coincide la presentación de un IPS con la actualización del PGR, ambos documentos se pueden presentar conjuntamente.
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR CAJA DE 1 FRASCO + CAJA DE 3 FRASCOS
1. NOMBRE DEL MEDICAMENTO
OPATANOL 1 mg/ml colirio en solución Olopatadina
2. PRINCIPIO(S) ACTIVO(S)
Cada ml de solución contiene 1 mg de olopatadina (como hidrocloruro).
3. LISTA DE EXCIPIENTES
Cloruro de benzalconio, cloruro de sodio, hidrogenofosfato de disodio dodecahidrato, ácido clorhídrico/hidróxido de sodio (para ajustar el pH) y agua purificada.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Colirio en solución; 1 x 5 ml 3 x 5 ml
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Por vía oftálmica. Leer el prospecto antes de utilizar este medicamento.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRAS ADVERTENCIAS ESPECIALES, SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD xx/xxxx
Desechar cuatro semanas después de la primera apertura del envase. Fecha de apertura:
Fecha de apertura (1):
Fecha de apertura (2):
Fecha de apertura (3):
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Alcon Laboratories (UK) Ltd.
Frimley Business Park
Frimley
Camberley
Surrey GU16 7SR
Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/02/217/001 1 x 5 ml EU/1/02/217/002 3 x 5 ml
13. NÚMERO DE LOTE
Lote: xxxxx
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica.
15. INSTRUCCIONES DE USO
16. INFORMACION EN BRAILLE
Opatanol
INFORMACIÓN MÍNIMA QUE DEBE INCLUIRSE EN PEQUEÑOS ACONDICIONAMIENTOS PRIMARIOS
ETIQUETA DEL FRASCO_
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
OPATANOL 1 mg/ml colirio Olopatadina.
Por vía oftálmica.
2. FORMA DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento.
3. FECHA DE CADUCIDAD
CAD xx/xxxx
Desechar cuatro semanas después de la primera apertura del envase. Fecha de apertura:
4. NÚMERO DE LOTE
Lote: xxxxx
5. CONTENIDO EN PESO EN VOLUMEN O EN UNIDADES
5 ml
6. OTROS
OPATANOL 1 mg/ml colirio en solución.
Olopatadina.
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto.Ver sección 4.
Contenido del prospecto
1. Qué es OPATANOL y para qué se utiliza
2. Qué necesita saber antes de empezar a usar OPATANOL
3. Cómo usar OPATANOL
4. Posibles efectos adversos
5. Conservación de OPATANOL
6. Contenido del envase e información adicional
1. Qué es OPATANOL y para qué se utiliza
OPATANOL está indicado en el tratamiento de los signos y síntomas de la conjuntivitis alérgica estacional.
Conjuntivitis alérgica. Algunos elementos (llamados alérgenos) como el polen, el polvo doméstico o el pelo de los animales pueden causar reacciones alérgicas que dan lugar a picor y enrojecimiento así como inflamación de la superficie de sus ojos.
OPATANOL pertenece al grupo de medicamentos usados para el tratamiento de afecciones alérgicas de los ojos. Actúa reduciendo la intensidad de la reacción alérgica.
2. Qué necesita saber antes de empezar a usar OPATANOL
No use OPATANOL
• Si es alérgico (hipersensible) a la olopatadina o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
• No debe usar OPATANOL si está en periodo de lactancia.
Advertencias y precauciones
Consulte a su médico o farmacéutico antes de empezar a usar OPATANOL.
Debe retirar las lentes de contacto de sus ojos antes de usar OPATANOL.
Niños
• No utilice OPATANOL en niños menores de 3 años. No administre este medicamento a niños menores de 3 años porque no hay datos que indiquen que sea seguro y actúe en niños menores de 3 años.
Uso de OPATANOL con otros medicamentos
Informe a su médico o farmacéutico si está utilizando, ha utilizado recientemente o podría tener que
utilizar otros medicamentos .
Si está utilizando otro colirio o pomada oftálmica, espere al menos 5 minutos entre la aplicación de cada medicamento. Las pomadas oftálmicas deben administrarse en último lugar.
Embarazo, lactancia y fertilidad
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento.
No debe utilizar OPATANOL si está en periodo de lactancia, consulte a su médico antes de utilizar este medicamento..
Conducción y uso de máquinas
Inmediatamente después de la aplicación de OPATANOL puede notar que su visión es borrosa. No conduzca ni utilice máquinas hasta que este efecto haya desaparecido.
OPATANOL contiene cloruro de benzalconio
El cloruro de benzalconio puede producir irritación ocular y se sabe que altera el color de las lentes de contacto blandas, por lo que se debe evitar el contacto con las lentes de contacto blandas. Si lleva lentes de contacto, debe retirar las lentes de contacto antes de la aplicación y esperar al menos 15 minutos antes de volver a colocarlas.
3. Cómo usar OPATANOL
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico o farmacéutico. Si no está seguro, consulte a su médico o farmacéutico.
La dosis recomendada es una gota en un ojo o en los dos ojos, dos veces al día - por la mañana y por la tarde.
Utilice esta cantidad a no ser que su médico le dé otras indicaciones. Sólo debe aplicarse OPATANOL en los dos ojos si su médico así se lo ha indicado. Siga el tratamiento durante el periodo de tiempo indicado por su médico.
Sólo debe utilizarse OPATANOL como gotas para los ojos.
PARA MÁS INFORMACIÓN VER CARA POSTERIOR (Continúa)
3. Cómo usar OPATANOL (continuación)
Cantidad a utilizar
Ver cara anterior del prospecto
• Coja el frasco de OPATANOL y sitúese ante un espejo.
• Lávese las manos.
• Coja el frasco y desenrosque el tapón.
• Después de quitar el tapón, se debe retirar el anillo de plástico del precinto antes de utilizar.
• Sostenga el frasco, boca abajo, entre los dedos pulgar y corazón.
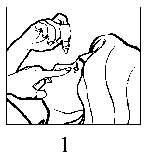
• Incline la cabeza hacia atrás. Separe suavemente el párpado del ojo con un dedo, hasta que se forme una bolsa, en la que deberá caer la gota (Figura 1).
• Acerque la punta del frasco al ojo. Puede serle útil el espejo.
• No toque el ojo, el párpado, zonas próximas ni otras superficies con el cuentagotas, porque las gotas que quedan en el frasco podrían infectarse.
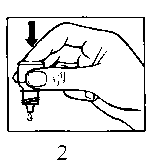
• Presione suavemente la base del frasco para que caiga una gota de OPATANOL cada vez.
• No apriete el frasco, está diseñado para que una suave presión sobre la base sea suficiente (Figura 2).
• Si se aplica las gotas en los dos ojos, repita los puntos anteriores para el otro ojo.
• Enrosque bien el tapón en el frasco inmediatamente después de utilizar el producto.
Si una gota cae fuera del ojo, inténtelo de nuevo.
Si usa más OPATANOL del que debe
Puede eliminarlo lavando los ojos con agua templada. No se aplique más gotas hasta la próxima aplicación.
Si olvidó usar OPATANOL
Aplíquese una gota en cuanto se dé cuenta y continúe con la siguiente dosis de su régimen habitual. Sin embargo, si ya es casi la hora de la siguiente dosis, no se aplique la dosis olvidada y continúe con la siguiente dosis de su régimen habitual. No se aplique una dosis doble para compensar la dosis olvidada.
Si interrumpe el tratamiento con OPATANOL
No interrumpa el uso de este medicamento sin consultar previamente con su médico.
Si tiene cualquier otra duda acerca del uso de este medicamento, consulte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Se han observado con OPATANOL los siguientes efectos adversos:
Frecuentes: pueden afectar hasta 1 de cada 10 personas
Efectos en el ojo: dolor ocular, irritación ocular, ojo seco, sensación anormal en el ojo, molestia ocular
Efectos generales: dolor de cabeza, fatiga, nariz seca, mal sabor de boca Poco frecuentes: pueden afectar hasta 1 de cada 100 personas
Efectos en el ojo: visión borrosa, disminuida o anormal, alteración corneal, inflamación de la superficie del ojo con o sin daño en la superficie, infección o inflamación de la conjuntiva, secreción ocular, sensibilidad a la luz, aumento de la producción de lágrimas, picor de ojo, enrojecimiento del ojo, anormalidad en el párpado, picazón, enrojecimiento, hinchazón o costra del párpado.
Efectos generales: percepción de estímulos disminuida o anormal, mareo, moqueo, piel seca, inflamación de la piel.
Frecuencia no conocida: (no puede estimarse a partir de los datos disponibles)
Efectos en el ojo: hinchazón en el ojo, hinchazón de la córnea, cambio del tamaño de la pupila
Efectos Generales: dificultad para respirar, síntomas alérgicos aumentados, tumefacción de la cara, adormecimiento, debilidad generalizada, náuseas, vómitos, infección de senos paranasales, enrojecimiento y picor en la piel.
En casos muy raros, a algunos pacientes con lesión grave en la capa transparente de la parte delantera del ojo (la córnea) les han aparecido manchas ensombrecidas en la córnea debido a una acumulación de calcio durante el tratamiento.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Anexo V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de OPATANOL
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en el frasco y en la caja después de “CAD”. La fecha de caducidad es el último día del mes que se indica.
Este medicamento no requiere ninguna condición especial de conservación.
Para evitar infecciones, debe desechar el frasco cuatro semanas después de haberlo abierto por primera vez y utilizar un nuevo frasco. Anote la fecha de apertura en el espacio provisto en la etiqueta de cada frasco y caja.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de OPATANOL
- El principio activo es olopatadina. Cada ml de solución contiene 1 mg de olopatadina (como hidrocloruro).
Los demás componentes son cloruro de benzalconio, cloruro de sodio, hidrogenofosfato de disodio dodecahidrato (E339), ácido clorhídrico (E507) y/o hidróxido de sodio (E524) y agua purificada. Aspecto del producto y contenido del envase
OPATANOL es un líquido transparente e incoloro (una solución) que se presenta en un envase que contiene un frasco de 5 ml o tres frascos de plástico de 5 ml con un tapón de rosca. Puede que solamente estén comercializados algunos tamaños de envases.
|
Titular de la autorización de comercialización |
Fabricante |
Fabricante |
|
Alcon Laboratories (UK) Ltd. |
S.A. Alcon - Couvreur N.V. |
Alcon Cusí, S.A. |
|
Frimley Business Park |
Rijksweg 14 |
Camil Fabra 58 |
|
Frimley |
B-2870 Puurs |
08320 El Masnou |
|
Camberley Surrey GU16 7SR Reino Unido |
Bélgica |
España |
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización.
Belgie/Belgique/Belgien
Luxembourg/Luxemburg
Alcon NV
® + 32 (0)2 754 32 10 (Belgie/Belgique/Belgien)
Bt^rapnn
Ahkoh Etarapna EOOfl ® + 359 2 950 15 65
Ceská republika
Alcon Pharmaceuticals (Czech Republic) s.r.o. ® + 420 225 775 111
Danmark
Alcon Nordic A/S ® + 45 3636 4300
Deutschland
Alcon Pharma GmbH ® + 49 (0)761 1304-0
EXláda
Kúnpoq
A^kov Aapnopáxoprg EAAág AEBE ® + 30 210 68 78 300 (EMáSa)
Eesti
Alcon Pharmaceuticals Ltd. Eesti filiaal ® + 372 6 313 214
España
Alcon Cusí, S.A.
® + 34 93 497 7000
France
Laboratoires Alcon ® + 33 (0)1 47 10 47 10
Hrvatska
Alcon Farmaceutika d.o.o.
® + 385 1 4611 988
Ireland
Malta
United Kingdom
Alcon Laboratories (UK) Ltd ® + 44 (0) 871 376 1402 (United Kingdom)
Ísland
Alcon Nordic A/S ® + 45 3636 4300
Lietuva
Alcon Pharmaceuticals Ltd. atstovybé ® + 370 5 2 314 756
Magyarország
Alcon Hungária Gyógyszerkereskedelmi Kft. ® + 36-1-463-9080
Nederland
Alcon Nederland BV ® + 31 (0) 183 654321
Norge
Alcon Nordic A/S ® + 45 3636 4300
Osterreich
Alcon Ophthalmika GmbH ® + 43 (0)1 596 69 70
Polska
Alcon Polska Sp. z o.o.
® + 48 22 820 3450
Portugal
Alcon Portugal - Produtos e Equipamentos Oftalmológicos, Lda.
® + 351 214 400 300
Romania
S.C. Alcon Romania S.R.L.
® + 40 21 203 93 24
Slovenija
Alcon d.o.o.
® + 386 1 422 5280
Slovenská republika
Alcon Pharmaceuticals Ltd., o.z.
® + 421 2 5441 0378
Italia
Sverige
Alcon Nordic A/S ® + 45 3636 4300
Alcon Italia S.p.A. ® + 39 02 81803.1
Este prospecto fue aprobado en XXXXX.
La información detallada de este medicamento está disponible en la página web de la Agencia Europea del Medicamento: http://www.ema.europa.eu
21