Olfex Bucal Infantil 50 Microgramos/Inhalacion, Suspension Para Inhalacion En Envase A Presion
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
OLFEX BUCAL 200 microgramos/inhalación suspensión para inhalación en envase a presión.
OLFEX BUCAL INFANTIL 50 microgramos/inhalación suspensión para inhalación en envase a presión.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
OLFEX BUCAL 200 microgramos/inhalación suspensión para inhalación en envase a presión: cada inhalación contiene 200 microgramos de budesonida (cantidad dosificada).
OLFEX BUCAL INFANTIL 50 microgramos/inhalación suspensión para inhalación en envase a presión: cada inhalación contiene 50 microgramos de budesonida (cantidad dosificada).
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA Suspensión para inhalación en envase a presión.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
OLFEX inhalación en envase a presión está indicado en pacientes con asma bronquial que requieran tratamiento de mantenimiento con glucocorticoides para el control de la inflamación subyacente de las vías respiratorias.
4.2 Posología y forma de administración
La dosis de OLFEX inhalación en envase a presión ha de ser individualizada según la gravedad de la enfermedad y la respuesta clínica del paciente. OLFEX inhalación en envase a presión es una nueva formulación, sin propelentes clorofluorocarbonos, por lo que puede ser necesario ajustar la dosis habitual de los pacientes a dosis más bajas.
Dosis inicial:
Cuando se inicie el tratamiento con glucocorticoides, durante periodos de asma grave, o mientras se reduce o se interrumpe el tratamiento con glucocorticoides orales, la dosis deberá ser:
Adultos: 200-1600 microgramos diarios, divididos en 2-4 administraciones (en los casos menos graves 200-800 microgramos diarios, en los casos más graves 800-1600 microgramos diarios).
Ancianos: la misma dosis que los adultos.
Niños a partir de 7 años: 200-800 microgramos diarios, divididos en 2-4 administraciones.
Niños de 2 a 7 años: 200-400 microgramos diarios, divididos en 2-4 administraciones.
Habitualmente, dos administraciones diarias (mañana y noche) son suficientes. En casos de asma grave y durante las exacerbaciones, para algunos pacientes puede resultar preferible dividir la dosis diaria en 3-4 administraciones.
1 de 9
En todos los pacientes, una vez controlado el asma, es aconsejable ajustar la dosis de mantenimiento a la mínima eficaz necesaria para el control de los síntomas.
Rango de dosis de mantenimiento
Adultos y ancianos: 200-1600 microgramos al día Niños a partir de 7 años: 200-800 microgramos al día Niños de 2 a 7 años: 200-400 microgramos al día
Inicio del efecto:
La mejoría en el control del asma tras la administración inhalada de OLFEX puede producirse en el plazo de 24 horas tras el inicio del tratamiento, aunque puede que no se alcance el beneficio máximo hasta que no transcurran de 1 a 2 semanas ó más desde el inicio del tratamiento.
Pacientes no tratados con glucocorticoides
Los pacientes que requieran una terapia de mantenimiento para el asma pueden conseguir el efecto deseado utilizando las dosis recomendadas anteriormente de OLFEX. En aquellos pacientes que no respondan adecuadamente a la dosis inicial, pueden requerirse dosis superiores para controlar el asma.
Pacientes bajo tratamiento con glucocorticoides inhalados
Los pacientes que pasen de un tratamiento con otros glucocorticoides inhalados al tratamiento con OLFEX, deben ser tratados con una dosis similar a la anterior.
Pacientes bajo tratamiento con glucocorticoides orales
OLFEX permite una sustitución o reducción significativa en la dosis de glucocorticoides orales manteniendo o mejorando el control del asma.
Inicialmente, OLFEX se empleará conjuntamente con la dosis de mantenimiento habitual del glucocorticoide oral que utilice el paciente. Después de aproximadamente una semana, la dosis oral se reducirá gradualmente hasta la cantidad mínima necesaria. Es muy recomendable efectuar la reducción muy lentamente. En muchos casos, puede retirarse por completo el corticoide oral y dejar al paciente únicamente bajo tratamiento con OLFEX.
Durante el paso de un tratamiento a otro, algunos pacientes pueden experimentar síntomas debidos a la retirada del glucocorticoide sistémico, por ej. dolor muscular y/o articular, laxitud y depresión, aunque se mantenga o incluso mejore la función pulmonar. Estos pacientes deben ser alentados a continuar el tratamiento con OLFEX pero deberán monitorizarse por si se observan signos objetivos de insuficiencia suprarrenal. En el caso de que se observara insuficiencia suprarrenal, deberán incrementarse temporalmente las dosis de corticoides sistémicos iniciando de nuevo la reducción de los mismos de forma más lenta. Durante las fases de estrés o ataques graves de asma, estos pacientes pueden requerir un tratamiento adicional con corticoides sistémicos.
Instrucciones de uso y manipulación
Al utilizar el envase a presión de OLFEX, se obtiene una suspensión del fármaco a gran velocidad.
Cuando el paciente inhala a través de la boquilla al mismo tiempo que libera una dosis, el fármaco es transportado con el aire inspirado por las vías respiratorias.
Es importante instruir al paciente para que lea cuidadosamente las instrucciones del prospecto que acompaña a cada inhalador, que incluye las siguientes recomendaciones de utilización:
1. Retire la tapa protectora de la boquilla del inhalador (fig. 1).

Agite vigorosamente el inhalador para mezclar adecuadamente su contenido (fig. 2). En el caso de que sea un inhalador nuevo o si lleva más de 7 días sin usarse, el inhalador necesita además cargarse mediante 1 pulsación al aire. Si se utiliza regularmente, se debe agitar igualmente pero no es necesario realizar la pulsación al aire.
3.
4.
Espire tanto aire como pueda. Adapte el inhalador a la boca sosteniendo el inhalador con los dedos pulgar e índice, tal y como se muestra en el dibujo (fig. 3).
Inspire profundamente, de forma cómoda y lenta por la boca, a la vez que se presiona firmemente el inhalador para liberar una dosis del medicamento. El paciente debe oprimir el inhalador, según las flechas del dibujo (fig. 4), mientras está haciendo esta inspiración.

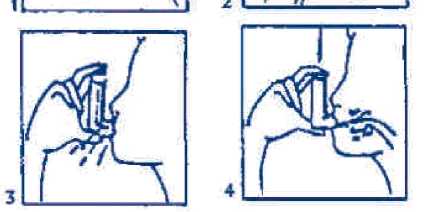
5. Retire el inhalador de la boca y, antes de expulsar el aire, contenga la respiración unos 10 segundos, y luego expulse el aire y comience a respirar normalmente.
6. Si se le ha prescrito otra inhalación, el paciente debe agitar suavemente el inhalador y después repetir los pasos 3 a 5.
7. Vuelva a colocar la tapa sobre la boquilla para proteger el medicamento del polvo y de la suciedad.
8. El paciente debe enjuagarse la boca con agua para retirar cualquier exceso de medicamento (sin tragarse el agua) para disminuir el riesgo de aparición de candidiasis orofaríngea (ver apartado 4.4. Advertencias y precauciones especiales de empleo).
El médico debe comprobar que el paciente sabe usar el inhalador y sincronizar la inspiración con la pulsación.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes.
4.4 Advertencias y precauciones especiales de empleo
OLFEX inhalación en envase a presión es una nueva formulación, sin propelentes clorofluorocarbonos, por lo que puede ser necesario ajustar la dosis habitual de los pacientes a dosis más bajas.
OLFEX no está indicado para el alivio rápido de los episodios agudos de asma en los que se requiere la administración de un broncodilatador de acción corta.
El incremento del uso de broncodilatadores como medicación de rescate indica un empeoramiento de la enfermedad de base y obliga a reevaluar el tratamiento del asma. Debe advertirse a los pacientes que el empeoramiento repentino y progresivo del control del asma supone una amenaza potencial para la vida y que deben buscar atención médica urgente. En estos casos puede ser necesario aumentar la dosis de corticoides o añadir tratamiento antiinflamatorio sistémico, por ejemplo, corticoides orales, o bien tratamiento antibiótico si hay signos de infección.
Deberá tenerse especial precaución cuando los pacientes pasen de una terapia de glucocorticoides orales a glucocorticoides inhalados, ya que durante un periodo de tiempo considerable pueden permanecer en riesgo de presentar una disminución de la función suprarrenal. También pueden estar en esta situación de riesgo los pacientes que hayan requerido un tratamiento de emergencia con corticoides por vía parenteral a dosis elevadas, o los que hayan estado en tratamiento a largo plazo con corticoides inhalados a la dosis más alta recomendada. Estos pacientes pueden mostrar signos y síntomas de insuficiencia suprarrenal en situaciones de estrés grave. Durante estas situaciones de estrés grave o intervenciones quirúrgicas programadas, deberá considerarse el tratamiento adicional con corticoides sistémicos.
Algunos pacientes pueden sentirse mal de forma no específica durante la fase de retirada de los corticoides sistémicos, apareciendo por ej. mialgias y artralgias. Raramente puede sospecharse un efecto glucocorticoide general insuficiente si aparecen síntomas tales como cansancio, cefaleas, náuseas y vómitos. En estos casos, es necesario en ocasiones un incremento temporal de la dosis de corticoides orales.
El paso de un tratamiento con esteroides sistémicos a un tratamiento con terapia inhalada puede desenmascarar alergias, por ej. rinitis y eczema, que previamente habían sido controladas con el fármaco sistémico. Estas alergias deberán controlarse sintomáticamente con antihistamínicos y/o preparaciones tópicas.
Se debe instruir al paciente para que se enjuague la boca con agua después de cada inhalación con el fin de minimizar el riesgo de infección orofaríngea por Candida.
Los corticosteroides inhalados pueden provocar efectos sistémicos, en especial a dosis altas prescritas durante períodos prolongados. No obstante, es mucho menos probable que se produzcan estos efectos que cuando se utilizan los corticosteroides orales y pueden variar dependiendo de cada paciente y entre diferentes preparaciones de corticosteroides. Los posibles efectos sistémicos pueden incluir síndrome de Cushing, aspecto Cushingoide, supresión suprarrenal, retraso del crecimiento en niños y adolescentes, disminución de la densidad mineral ósea, cataratas, glaucoma y, más raramente, una variedad de efectos psicológicos o de comportamiento tales como hiperactividad psicomotora, trastornos del sueño, ansiedad, depresión o agresividad (especialmente en niños). Por tanto, es importante que la dosis del corticosteroide inhalado se ajuste a la dosis más baja capaz de mantener un control eficaz del proceso asmático.
Una función hepática reducida puede afectar a la eliminación de corticoides. Sin embargo, la farmacocinética intravenosa de la budesonida es similar en pacientes con cirrosis y en sujetos sanos. La farmacocinética después de la administración oral se vio afectada por una función hepática comprometida, evidenciándose por una disponibilidad sistémica incrementada. Para OLFEX inhalación en envase a presión, este problema resulta de poca importancia clínica, ya que tras la inhalación, la contribución oral a la disponibilidad sistémica es relativamente pequeña.
Debe evitarse el tratamiento concomitante con itraconazol y ritonavir u otros inhibidores potentes de CYP3A4 (ver sección 4.5 "Interacción con otros medicamentos y otras formas de interacción"). Si esto no pudiera evitarse, debe pasar el mayor tiempo posible entre la administración de medicamentos que interaccionan entre sí.
En pacientes con tuberculosis pulmonar latente o activa, o infecciones fúngicas o víricas de las vías respiratorias debe evaluarse de nuevo la necesidad y la dosis de los corticoides inhalados.
No se conocen completamente los efectos locales y sistémicos a largo plazo de OLFEX en humanos. La dosis deberá ajustarse a la menor dosis de mantenimiento eficaz una vez que se ha alcanzado el control del asma. Se deberá llevar a cabo una estrecha monitorización de forma regular de la estatura de los niños que reciben tratamiento prolongado con corticoides por cualquier vía de administración. En caso de una ralentización del crecimiento, se debe volver a evaluar el tratamiento con el objetivo de reducir la dosis de corticoide inhalado. Deben sopesarse los beneficios del tratamiento con corticoides y el control del asma frente a los posibles riesgos de la disminución del crecimiento. Además, debe considerarse diferir al paciente a un neumólogo/alergólogo pediatra.
Deberá informarse a los deportistas que este medicamento contiene un componente que puede producir un resultado positivo en los controles de dopaje.
4.5 Interacción con otros medicamentos y otras formas de interacción
No se ha observado interacción entre la budesonida y otros fármacos empleados para el tratamiento del asma.
El metabolismo de la budesonida se ve afectado por las sustancias que son metabolizadas por el CYP P450 3A4 (por ej. itraconazol y ritonavir). La administración concomitante de estos inhibidores potentes del CYP P450 3A4 puede incrementar los niveles plasmáticos de la budesonida, por lo que deberá evitarse el empleo simultáneo de estos fármacos a no ser que el beneficio sea superior al incremento en el riesgo de efectos adversos sistémicos.
A las dosis recomendadas, la cimetidina posee un efecto leve y clínicamente irrelevante sobre la farmacocinética de la budesonida oral.
4.6 Fertilidad, embarazo y lactancia
4.6.1 Embarazo
La budesonida inhalada no produce efectos adversos sobre la salud del feto o neonato durante el embarazo.
Al igual que con otros fármacos, la administración de budesonida durante el embarazo requiere que los beneficios para la madre sean sopesados frente a los riesgos para el feto. Debido a los menores efectos sistémicos en comparación con dosis equipotentes de otros tratamientos antiasmáticos, los glucocorticoides inhalados deberían tomarse en consideración para el tratamiento del asma.
4.6.2 Lactancia
La budesonida se excreta en la lecha materna; sin embargo, a las dosis terapéuticas de OLFEX no se esperan efectos en el lactante. OLFEX suspensión para inhalación en envase a presión puede utilizarse durante la lactancia.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de OLFEX sobre la capacidad para conducir y utilizar máquinas es nula o insignificante.
4.8 Reacciones adversas
Los ensayos clínicos, publicaciones y la experiencia post-comercialización de la budesonida inhalada por vía oral sugieren que se pueden producir las reacciones adversas mostradas en la siguiente tabla. Se incluyen las reacciones adversas clasificadas por órganos y sistemas y por frecuencia, empezando por las más frecuentes, utilizando la siguiente convención: frecuentes (>1/100, <1/10); poco frecuentes (>1/1.000,
<1/100), raras (>1/10.000, < 1/1.000) o muy raras (< 1/10.000). Dentro de cada grupo de frecuencia, se clasifican de mayor a menor gravedad.
|
Clasificación de órganos del sistema MedDRA |
Reacción adversa |
|
Trastornos respiratorios, torácicos y mediastínicos Frecuentes |
Candidiasis orofaríngea, ronquera, tos, irritación de la garganta (leve) |
|
Raras |
Broncoespasmo |
|
Trastornos psiquiátricos Frecuencia desconocida |
Hiperactividad psicomotora, trastornos del sueño, ansiedad, depresión, agresividad y cambios de humor (principalmente en niños) |
|
Trastornos de la piel y del tejido subcutáneo Raras |
Reacciones de hipersensibilidad inmediata y retardada, rash, dermatitis de contacto, urticaria, angioedema, hematomas cutáneos |
Raramente, a través de mecanismos de acción desconocidos, los fármacos por vía inhalatoria pueden producir broncoespasmo.
Aunque se desconoce la frecuencia, con glucocorticoides inhalados se pueden producir signos o síntomas del efecto sistémico de los glucocorticoides, incluyendo hipofunción de la glándula suprarrenal y reducción de la velocidad de crecimiento, dependiendo probablemente de la dosis, tiempo de exposición, exposición concomitante y previa a glucocorticoides, y sensibilidad individual.
4.9 Sobredosis
No es de esperar que la sobredosis aguda con OLFEX inhalación en envase a presión, incluso con dosis muy elevadas, ocasione problemas de carácter clínico. Cuando se utilizan de forma crónica dosis muy elevadas pueden aparecer efectos propios de la administración de glucocorticoides sistémicos tales como hipercorticismo y supresión adrenal.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
La budesonida es un glucocorticoide con un elevado efecto antiinflamatorio local.
Grupo farmacoterapéutico: antiasmáticos: glucocorticoides; Código ATC: R03BA02.
Efecto anti-inflamatorio tópico
No se conoce completamente el mecanismo de acción exacto de los glucocorticoides en el tratamiento del asma. Probablemente sean importantes las acciones antiinflamatorias, tales como la inhibición de la liberación del mediador inflamatorio y la inhibición de las respuestas inmunes mediadas por la citoquina. La potencia intrínseca de la budesonida, medida como la afinidad por el receptor glucocorticoide, es aproximadamente 15 veces superior a la presentada por la prednisolona.
Un estudio clínico en pacientes asmáticos en el que se comparó la administración de la budesonida por vía oral y por vía inhalatoria, evidenció de forma estadísticamente significativa la eficacia de la budesonida
inhalada frente a placebo, mientras que comparando con budesonida administrada por vía oral no se hallaron diferencias significativas. Por tanto, el efecto terapéutico de las dosis convencionales de la budesonida inhalada puede explicarse en gran medida por su acción directa sobre el tracto respiratorio.
La budesonida ha mostrado efectos antianafilácticos y antiinflamatorios en estudios de provocación realizados tanto en animales como en pacientes, que se manifiestan como una disminución de la obstrucción bronquial producida por las reacciones alérgicas, tanto inmediatas como retardadas.
Exacerbaciones del asma
La budesonida inhalada, administrada una o dos veces al día, ha demostrado que previene eficazmente las exacerbaciones del asma en niños y en adultos.
Asma inducido _por ejercicio _físico
El tratamiento con budesonida inhalada ha sido eficaz en la prevención de la broncoconstricción inducida por ejercicio.
Reactividad de las vías aéreas
La budesonida también ha demostrado que disminuye la reactividad de las vías aéreas en pacientes hiperreactivos, tras provocación tanto directa como indirecta.
Función del eje hipotalámico-hipofisario-suprarrenal
Los estudios realizados en voluntarios sanos con budesonida inhalada han evidenciado un efecto relacionado con la dosis sobre el cortisol plasmático y urinario. La budesonida inhalada causa, a las dosis recomendadas, un efecto significativamente menor sobre la función suprarrenal que 10 mg de prednisolona, tal y como se demuestra en las pruebas de estimulación por ACTH.
Crecimiento
Los estudios a largo plazo muestran que niños y adolescentes tratados con budesonida inhalada alcanzan finalmente su altura correspondiente de adulto. Sin embargo, se ha observado una disminución inicial leve y transitoria en el crecimiento (de aproximadamente 1 cm), que generalmente se produce durante el primer año de tratamiento.
5.2 Propiedades farmacocinéticas
5.2.1 Absorción
Después de la inhalación a través del envase a presión, alrededor de un 10-15% de la dosis liberada se deposita en los pulmones. La concentración plasmática máxima después de la inhalación oral de una dosis única de 1 mg de budesonida es de aproximadamente 2 nmol/l, y se alcanza aproximadamente a los 10 minutos. Se ha estimado que la disponibilidad sistémica de la budesonida inhalada a través del envase a presión es aproximadamente un 26% de la cantidad dosificada, con una proporción de 2/5 procedente del fármaco deglutido.
5.2.2 Distribución
El volumen de distribución de la budesonida es aproximadamente de 3 l/kg, y la unión a proteínas plasmáticas oscila entre el 85-90%.
5.2.3 Metabolismo o Biotransformación
La budesonida sufre un alto grado de biotransformación (aprox. 90%) de primer paso en el hígado dando lugar a metabolitos de baja actividad glucocorticoide. La actividad glucocorticoide de los metabolitos principales, 6b-hidroxibudesónida y 16 a-hidroxiprednisolona, es inferior a un 1% de la presentada por la
budesónida. El metabolismo de la budesonida está mediado principalmente por una subfamilia del citocromo P450, la CYP3A.
5.2.4 Eliminación
Los metabolitos de la budesonida se excretan como tales o en forma conjugada principalmente a través de los riñones. No se ha detectado budesonida inalterada en la orina. La budesonida presenta un aclaramiento sistémico elevado (aproximadamente 1,2 l/min), y la vida media tras la administración intravenosa oscila entre las 2 y 3 horas.
5.2.5 Linealidad/ No linealidad
A dosis clínicamente relevantes, la cinética de la budesonida es proporcional a la dosis.
Niños
Tras la inhalación oral, la exposición sistémica medida por el área bajo la curva (AUC) de budesonida en niños es similar a la presentada por los adultos a la misma dosis.
5.3 Datos preclínicos sobre seguridad
Los resultados de los estudios de toxicidad aguda, subaguda y crónica mostraron que los efectos sistémicos de la budesonida, por ej. disminución del incremento de peso corporal y atrofia de los tejidos linfoides y de la corteza suprarrenal, son menos graves o similares a los observados tras la administración de otros glucocorticoides.
La budesonida, evaluada en 6 pruebas analíticas diferentes, no mostró ningún efecto mutagénico o clastogénico.
En un estudio de carcinogénesis en ratas macho se observó una incidencia incrementada de gliomas cerebrales que no se pudo verificar en un segundo estudio repetido, en el que la incidencia de gliomas no se diferenció en ninguno de los grupos de tratamiento activo (budesonida, prednisolona, acetónido de triamcinolona) y en los grupos control.
Las anomalías hepáticas (neoplasias hepatocelulares primarias), halladas en ratas macho en el estudio de carcinogénesis inicial, se observaron en el segundo estudio con la budesonida al igual que con los otros glucocorticoides de referencia. Estos efectos están probablemente más relacionados con un efecto sobre el receptor, representando así un efecto de clase.
La experiencia clínica disponible hasta la fecha no indica que la budesonida u otros glucocorticoides induzcan la aparición de gliomas cerebrales o neoplasias hepatocelulares primarias en el hombre.
En estudios de reproducción en animales se ha demostrado que los corticoides como la budesonida inducen malformaciones, como paladar hendido o malformaciones esqueléticas, aunque estos resultados experimentales no parecen ser aplicables al hombre a las dosis recomendadas.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Acido oleico, etanol y 1,1,1,2-Tetrafluoroetano (HFA 134a).
6.2 Incompatibilidades
No aplicable.
6.3 Periodo de validez
24 meses.
6.4 Precauciones especiales de conservación
Mantener con la válvula hacia abajo.
No conservar a temperatura superior a 30°C.
Proteger de la luz solar directa y no congelar.
6.5 Naturaleza y contenido del envase
El envase a presión consiste en un vial de aluminio de 10 ml unido a una válvula dosificadora, colocado en un dispositivo de plástico para inhalación.
OLFEX BUCAL 200 microgramos/inhalación suspensión para inhalación en envase a presión: cada inhalador proporciona 200 dosis de 200 microgramos de budesonida por dosis, después de haberse cargado por primera vez.
OLFEX BUCAL INFANTIL 50 microgramos/inhalación suspensión para inhalación en envase a presión: cada inhalador proporciona 200 dosis de 50 microgramos de budesonida por dosis, después de haberse cargado por primera vez.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Ver sección 4.2 y el prospecto de paciente. El vial de aluminio no deberá romperse, perforarse o quemarse, incluso cuando aparentemente esté vacío, ya que contiene un líquido a presión. No exponer a temperaturas superiores a 50°C.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Laboratorios BIAL, S.A.
Parque Científico y Tecnológico de Bizkaia, Edificio 401 48170 Zamudio (Vizcaya)
España
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
OLFEX BUCAL 200 microgramos/inhalación suspensión para inhalación en envase a presión: 59280 OLFEX BUCAL INFANTIL 50 microgramos/inhalación suspensión para inhalación en envase a presión: 59281
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
1 de abril de 1992
10. FECHA DE LA REVISIÓN DEL TEXTO
Mayo 2013
9 de 9