Octaplex, 500 Ui Polvo Y Disolvente Para Solucion Inyectable.
"I
an
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
OCTAPLEX, 500 UI, Polvo y disolvente para solución para perfusión,
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
OCTAPLEX se presenta como polvo y disolvente para solución inyectable conteniendo complejo de protrombina humana. Octaplex contiene nominalmente:
|
Nombre del principio activo |
OCTAPLEX Cantidad por vial (UI) |
OCTAPLEX Cantidad tras reconstitución con 20 ml de agua para inyectables (UI/ml) |
|
Principios activos | ||
|
Factor II de coagulación humano |
280 - 760 |
14 - 38 |
|
Factor VII de coagulación humano |
180 - 480 |
9 - 24 |
|
Factor IX de coagulación humano |
500 |
25 |
|
Factor X de coagulación humano |
360 - 600 |
18 - 30 |
|
Otros componentes activos | ||
|
Proteína C |
260 - 620 |
13 - 31 |
|
Proteína S |
240 - 640 |
12 - 32 |
El contenido total en proteína por vial es de 260-820 mg.
La actividad específica del medicamento es de > 0,6 UI/ mg de proteínas, expresado en actividad de factor IX..
Excipientes conocidos con acción o efectos reconocidos: Sodio (75 - 125 mg por vial), heparina (100-250 IU por vial, correspondientes a 0,2 - 0,5 UI / UI FIX)
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Polvo y disolvente para solución para perfusión.
El polvo tiene una coloración blanco-azulada.
El disolvente es un líquido claro e incoloro.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
- Tratamiento y profilaxis perioperatoria de las hemorragias en el déficit adquirido de los factores de coagulación del complejo de protrombina, tales como el déficit causado por el tratamiento con antagonistas de la vitamina K, o en caso de sobredosis de antagonistas de la vitamina K, cuando se requiere una rápida corrección del déficit.
- Tratamiento y profilaxis perioperatoria de hemorragias en el déficit congénito de cualquier factor de coagulación dependiente de la vitamina K cuando no se dispone de producto de factor de coagulación específico purificado.
4.2 Posología y forma de administración
Posología
A continuación se proporcionan sólo unas directrices generales acerca de la posología. El tratamiento se deberá iniciar bajo la supervisión de un especialista con experiencia en el tratamiento de los trastornos de la coagulación.
La dosis y la duración del tratamiento de sustitución dependen de la gravedad del trastorno, de la localización e intensidad de la hemorragia y de la condición clínica del paciente.
La cantidad y la frecuencia de administración se deberá calcular basándose en cada paciente individual. Los intervalos de dosificación se deben adaptar a las diferentes semividas circulantes de los distintos factores de coagulación en el complejo de protrombina (ver sección 5.2).
La dosis individual requerida solo puede calcularse basándose en la determinación regular de los niveles plasmáticos individuales de los factores de coagulación de interés o en el análisis global de los niveles del complejo de protrombina (tiempo de protrombina, INR), y en la monitorización continua de la condición clínica del paciente.
En el caso de intervenciones quirúrgicas mayores es esencial realizar una monitorización precisa del tratamiento de sustitución por medio de pruebas de coagulación (valoraciones del factor de coagulación específico y/o análisis globales de los niveles de complejo de protrombina).
Hemorragia y profilaxis perioperatoria de la hemorragia durante el tratamiento con antagonistas de la vitamina K:
La dosis dependerá del INR previo al tratamiento y el INR diana. En la siguiente tabla se proporcionan las dosis aproximadas (ml/kg peso corporal del producto reconstituido) necesarias para conseguir normalizar el INR (< 1,2 en 1 hora) partiendo de distintos niveles iniciales de INR.
|
INR inicial |
2 - 2,5 |
2,5 - 3 |
3 - 3,5 |
> 3,5 |
|
Dosis aproximada (ml de Octaplex/Kg peso corporal) |
0,9 -1,3 |
1,3 - 1,6 |
1,6 - 1,9 |
> 1,9 |
|
* La dosis unitaria no debe excec |
er las 3.000 |
.I. (120 mL de Octaplex) | ||
.Uí1.
"I ■"
La corrección del antagonista de la vitamina K que induce un deterioro de la hemostasis persiste durante unas 6-8 horas. Sin embargo, los efectos de la vitamina K, si se administra al mismo tiempo, se consiguen habitualmente dentro de las 4-6 horas. Por lo tanto, no es necesario repetir el tratamiento con complejo de protrombina humana cuando se ha administrado vitamina K.
Dado que estas recomendaciones son empíricas y que la recuperación y la duración del efecto pueden variar, es obligatorio monitorizar el INR durante el tratamiento.
Hemorragia y profilaxis perioperatoria del déficit congénito de cualquiera de los factores de coagulación que dependen de la vitamina K cuando no se dispone del producto de factor de coagulación específico:
El cálculo de la dosis requerida para el tratamiento se basa en el dato empírico de que aproximadamente 1 UI de factor II o X por kg de peso corporal aumenta la actividad plasmática del factor II o X en 0,02 y 0,017 UI/ml, respectivamente.
La dosis de un factor específico administrado se expresa en Unidades Internacionales (UI), que están relacionadas con el estándar actual de la OMS para cada factor. La actividad plasmática de un factor de coagulación específico se expresa bien en porcentaje (relativo al plasma normal) o en Unidades Internacionales (relativas al estándar internacional para el factor de coagulación específico).
La actividad de una Unidad Internacional (UI) de un factor de coagulación equivale a la cantidad de ese factor en un ml de plasma humano normal.
Por ejemplo, el cálculo de la dosis necesaria de factor X se basa en el dato empírico de que 1 Unidad Internacional (UI) de factor X por kg de peso corporal aumenta la actividad plasmática del factor X en 0,017 UI/ml. La dosis necesaria se determina empleando la siguiente fórmula:
Unidades requeridas = peso corporal (kg) x aumento deseado del factor X (UI/ml) x 59 donde 59 (ml/kg) es el inverso de la recuperación estimada.
Dosis necesaria para factor II:
Unidades requeridas = peso corporal (kg) x aumento deseado del factor II (UI/ml) x 50
Si se conoce la recuperación individual se deberá emplear este valor en el cálculo.
Forma de administración
Para consultar las instrucciones de reconstitución del medicamento antes de la administración, ver sección 6.6.
Octaplex debe administrarse por vía intravenosa. La perfusión debe comenzar a una velocidad de 1 ml por minuto, seguida de 2-3 ml por minuto, utilizando una técnica aséptica
4.3 Contraindicaciones
• Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
• Alergia conocida a la heparina o historia de trombocitopenia inducida por heparina.
4.4 Advertencias y precauciones especiales de empleo
Este tratamiento se realiza bajo la supervisión de un especialista con experiencia en el tratamiento de los trastornos de la coagulación.
En pacientes con déficit adquirido de los factores de coagulación dependientes de la vitamina K (ej. como la inducida por tratamiento con antagonistas de vitamina K), solo debe utilizarse Octaplex si es necesario una corrección rápida de los niveles del complejo de protrombina, como en los casos de hemorragias mayores o cirugía de emergencia. En otros casos por lo general es suficiente con la reducción de la dosis del antagonista de la vitamina K y/o la administración de vitamina K.
Los pacientes tratados con un antagonista de la vitamina K pueden tener un estado hipercoagulable subyacente y la perfusión de concentrado del complejo de protrombina puede exacerbar esta situación.
En el déficit congénito de cualquier factor dependiente de la vitamina K se deberá utilizar un producto de factor de coagulación específico cuando se dispone de él.
Si se producen reacciones alérgicas o de tipo anafiláctico, debe interrumpirse inmediatamente la perfusión. En caso de shock deben seguirse las pautas médicas estándares para el tratamiento del shock.
Para prevenir la transmisión de enfermedades infecciosas cuando se administran medicamentos derivados de la sangre o plasma humanos se toman medidas estándar como la selección de los donantes, análisis de marcadores específicos de infecciones en las donaciones individuales y en las mezclas de plasma, así como la inclusión de etapas en el proceso de fabricación para eliminar/inactivar virus. A pesar de esto, cuando se administran medicamentos derivados de sangre o plasma humano, la posibilidad de transmisión de agentes infecciosos no puede excluirse totalmente. Esto también se refiere a virus emergentes o de naturaleza desconocida y otros patógenos.
Las medidas se consideran eficaces para los virus envueltos como el VIH y el VHB y el VHC. Las medidas pueden tener un valor limitado para virus no envueltos tales como VHA y el parvovirus B19.
La infección por parvovirus B19 puede ser grave para una mujer embarazada (infección fetal) y para sujetos con inmunodeficiencia o con una eritropoyesis aumentada (ej. con anemia hemolítica).
Se recomienda encarecidamente que cada vez que se administre Octaplex a un paciente se deje constancia del nombre del medicamento y n° de lote administrado para mantener un vínculo entre el paciente y el lote del medicamento
Se recomienda la vacunación apropiada (hepatitis A y B) para los pacientes que reciban concentrados de complejo de protrombina derivados de plasma humano.
4 de 1 1 MINISTKIODE
SANIDAD, POLITICA SOCIAL E IGUALDAD Agencia españolaré medicamentos y productos san-lanos
¿i
aillos
ÍTTI
Hay un riesgo de trombosis o de coagulación intravascular diseminada cuando los pacientes, con déficit congénito o adquirido son tratados con complejo de protrombina humana, sobre todo cuando se administran repetidamente.
Se debe observar la posible aparición de signos y síntomas de coagulación intravascular o trombosis en pacientes tratados con complejo de protrombina humana. Debido al riesgo de complicaciones tromboembólicas, hay que llevar a cabo una estrecha monitorización cuando se administre complejo de protrombina humana a pacientes con historia de enfermedad cardiaca coronaria, a los pacientes con enfermedad hepática, a pacientes peri o postoperatorios, a neonatos, o a pacientes con riesgo de evento tromboembólico o de coagulación intravascular diseminada. En cada una de esas situaciones, debe sopesarse el beneficio potencial del tratamiento frente al riesgo de esas complicaciones.
No se dispone de ningún dato acerca del uso de Octaplex en caso de hemorragia perinatal debida a una deficiencia de vitamina K en el neonato.
Advertencias sobre excipientes:
Octaplex contiene 75-125 mg de sodio por vial. Esto debe ser considerado por pacientes con una dieta controlada en sodio.
4.5 Interacción con otros medicamentos y otras formas de interacción
Los productos de complejo de protrombina humana neutralizan el efecto del tratamiento con antagonistas de la vitamina K, pero no se conocen interacciones con otros medicamentos.
Interferencia con pruebas biológicas
Cuando se realicen los test de coagulación que son sensibles a la heparina en pacientes que reciben dosis elevadas de complejo de protrombina humana, hay que tener en cuenta la heparina como un componente del producto administrado.
4.6 Fertilidad, embarazo y lactancia
No se ha establecido la seguridad del empleo del complejo de protrombina humana ni en mujeres embarazadas ni durante el periodo de lactancia.
Los estudios en animales no son adecuados para evaluar la seguridad con respecto al embarazo, al desarrollo embrio/fetal, al parto o al desarrollo postnatal. Por lo tanto, el complejo de protrombina humana sólo debe usarse durante el embarazo y la lactancia si está claramente indicado.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No se han realizado estudios acerca de los efectos sobre la capacidad de conducir y utilizar máquinas.
4.8 Reacciones adversas
Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia.
Patologías del sistema inmune:
La terapia de sustitución en raras ocasiones (> 1/10.000 y <1/1.000) puede llevar a la formación de anticuerpos circulantes que inhiben uno o más de los factores de complejo de protrombina humana. Si se producen tales inhibiciones, la condición se manifestará en sí misma como una respuesta clínica insuficiente.
En estudios clínicos con Octaplex no se han observado reacciones alérgicas o de tipo anafiláctico ni un incremento en la temperatura corporal aunque pueden ocurrir en raras ocasiones (>1/10.000 y <1/1.000).
Trastornos generales y alteraciones en el lugar de administración:
No se ha observado aumento de la temperatura corporal, aunque puede ocurrir en raras ocasiones (>1/10.000 y <1/1.000).
Trastornos vasculares:
Existe riesgo de episodios tromboembólicos después de la administración de complejo de protrombina humana (ver sección 4.4).
Trastornos del sistema nervioso:
Raras veces aparecen cefaleas (>1/10.000 y <1/1.000).
Alteraciones analíticas:
En raras ocasiones (>1/10.000 y <1/1.000) se ha observado un aumento transitorio de las transaminasas hepáticas.
Otros:
Octaplex contiene heparina. Por lo tanto, raramente, puede ser observado una repentina alergia inducida por la reducción del recuento de plaquetas por debajo de 100.000/gl o el 50% del recuento inicial (trombocitopenia tipo II). En pacientes sin hipersensibilidad previa a la heparina, esta disminución de plaquetas puede ocurrir de 6 a 14 días tras el comienzo del tratamiento. En pacientes con hipersensibilidad previa a la heparina, esta reducción puede darse en unas pocas horas.
El tratamiento con Octaplex debe pararse inmediatamente en pacientes que muestren esta reacción alérgica. Estos pacientes no deben recibir medicamentos que contengan heparina en el futuro.
Para información sobre la seguridad viral, ver 4.4.
Notificación de sospechas de reacciones adversas
Es importante notificar las sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del
.«ste.
I*
a lili» a
ÍTTI
medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del www.notificaRAM.es.
4.9 Sobredosis
El empleo de dosis elevadas de productos de complejo de protrombina humana se ha asociado con casos de infarto de miocardio, coagulación intravascular diseminada, trombosis venosa y embolismo pulmonar. Por tanto, en caso de sobredosis, aumenta el riesgo de desarrollar complicaciones tromboembólicas o de coagulación intravascular diseminada.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: antihemorrágicos, factores de la coagulación sanguínea IX, II, VII y X en combinación,código ATC: B02BD01.
Los factores de coagulación II, VII, IX y X, que se sintetizan en el hígado con ayuda de la vitamina K, se denominan de comúnmente Complejo de Protrombina.
El Factor VII es el zimógeno del factor VIIa proteasa de serina activa mediante la cual se inicia la ruta extrínseca de coagulación sanguínea. El complejo factor tisular-factor VIIa activa los factores de coagulación X y IX, por medio de los cuales se forman el factor IXa y Xa. Con la posterior activación de la cascada de coagulación se activa la protrombina (factor II) y se transforma en trombina. Por acción de la trombina, el fibrinógeno se convierte en fibrina, que da lugar a la formación de coágulos. La normal generación de trombina es también de vital importancia para la función plaquetaria como parte de la hemostasis primaria.
El déficit grave aislado del factor VII conduce a una reducción de la formación de trombina y a una tendencia al sangrado debido al deterioro en la formación de fibrina y en la hemostasis primaria. El déficit aislado del factor IX es una de las hemofilias clásicas (hemofilia B). El déficit aislado del factor II o del factor X es muy poco frecuente pero en la forma grave puede causar una tendencia al sangrado similar a la observada en la hemofilia clásica.
El déficit adquirido de los factores de coagulación dependientes de la vitamina K se produce durante el tratamiento con antagonistas de la vitamina K. Si el déficit llega a ser grave, se produce una tendencia al sangrado grave, caracterizada por hemorragias cerebrales o retroperitoneales más que por hemorragia muscular y articular. La insuficiencia hepática grave también da lugar a niveles muy reducidos de los factores de coagulación dependientes de la vitamina K y a una tendencia clínica al sangrado que, suele ser compleja debido a una coagulación intravascular de bajo grado, cursando simultáneamente, a los bajos niveles plaquetarios, al déficit de inhibidores de la coagulación y a la fibrinolisis alterada.
La administración del complejo de protrombina humana proporciona un aumento en los niveles plasmáticos de los factores de coagulación dependientes de la vitamina K y puede
ílMt
ÍTTI
corregir temporalmente el defecto de la coagulación de los pacientes con deficiencia de uno o varios de esos factores.
5.2 Propiedades farmacocinéticas
Los intervalos de semivida plasmática son:
|
Factor de coagulación |
Semivida |
|
Factor II |
48 - 60 horas |
|
Factor VII |
1,5- 6 horas |
|
Factor IX |
20 - 24 horas |
|
Factor X |
24 - 48 horas |
Octaplex se administra por vía intravenosa y por tanto está disponible de forma inmediata en el organismo.
5.3 Datos preclínicos sobre seguridad
No hay datos preclínicos que se consideren relevantes para la seguridad clínica aparte de los datos incluidos en los otros apartados de la Ficha Técnica.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Polvo:
- Heparina: 0,2 - 0,5 UI/UI FIX
- Citrato trisódico dihidrato
Disolvente: Agua para inyección
6.2 Incompatibilidades
Este medicamento no debe mezclarse con otros medicamentos.
6.3 Periodo de validez
2 años.
Se ha demostrado una estabilidad física y química en uso durante un máximo de 8 horas a entre +2°C y +25°C.
Desde el punto de vista microbiológico, este producto debe ser usado inmediatamente. Si no es usado de inmediato, las condiciones y el tiempo de almacenamiento previo a su uso son
.’Stp.
*•£>
ilRia
an
responsabilidad del usuario y normalmente no debería ser superior a 24 horas a 2-8°C a menos que la dilución se haya realizado en condiciones asépticas validadas y controladas.
6.4 Precauciones especiales de conservación
Conservar el frasco en el embalaje exterior para protegerlo de la luz y por debajo de +25°C. No congelar.
Para las condiciones de conservación tras la reconstitución del medicamento, ver la sección 6.3.
6.5 Naturaleza y contenido del envase
Un envase de Octaplex contiene:
halobutilo) y una cápsula flip off (de I o tipo II) con un tapón (goma de
- Polvo en un vial (vidrio tipo I) con un tapón (goma de aluminio).
- 20 ml de agua para inyección en un vial (vidrio tipo halobutilo) y una cápsula flip off (de aluminio).
1 equipo de transferencia Mix2Vial™
6.6 Precauciones especiales de eliminación y otras manipulaciones
Instrucciones de uso/manipulación
Lea todas las instrucciones y sígalas con cuidado.
Durante el procedimiento descrito a continuación, debe seguirse una técnica aséptica.
El producto se reconstituye rápidamente a temperatura ambiente.
La solución debe ser clara o ligeramente opalescente. No utilice soluciones turbias o que presenten partículas. Los productos reconstituidos deben inspeccionarse visualmente antes de su administración para verificar la ausencia de partículas extrañas o coloración.
Una vez reconstituida la solución debe utilizarse inmediatamente.
La eliminación de los productos no utilizados o material de desecho se realizará de acuerdo con las exigencias locales.
Instrucciones para la reconstitución:
1. Si es necesario, llevar el disolvente (agua para inyección) y el concentrado en los viales cerrados hasta alcanzar temperatura ambiente. Esta temperatura debe mantenerse durante la reconstitución.
Si para calentar se utiliza un baño de agua, debe evitarse que el agua entre en contacto con los tapones de goma o las cápsulas de los viales. La temperatura del baño de agua no debe superar los 37°C.
2. Retire las cápsulas del vial de concentrado y del vial de agua y limpie los tapones con un algodón empapado en alcohol.
3. El Mix2vial™ está representado en la Fig. 1. Colocar el vial de disolvente sobre una superficie plana y sujetarlo con firmeza. Coger el Mix2vial™ y darle la vuelta. Colocar la parte azul del Mix2vial™ sobre la parte superior del vial del disolvente y presionar con firmeza hasta que se oiga un chasquido (Fig. 2 + 3).
9 de 1 1 MINISTWODE
SANIDAD, POLITICA SOCIAL E IGUALDAD Agencia españoiade medie amentos y proouctos sabíanos
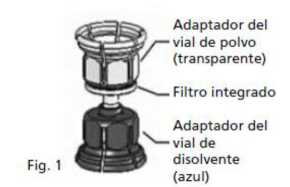

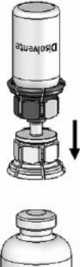
4. Colocar el vial del polvo sobre una superficie plana y sujetarlo con firmeza. Coger el vial de disolvente con el Mix2Vial™ acoplado y darle la vuelta. Colocar la parte transparente sobre la parte superior del vial del polvo y presionar con firmeza hasta que se oiga un chasquido (Fig. 4). El disolvente fluye automáticamente al interior del vial del polvo.
5. Con ambos viales todavía acoplados, agitar suavemente el vial del polvo hasta que el producto se haya disuelto.
Octaplex se disuelve rápidamente a temperatura ambiente para dar una solución incolora o ligeramente azulada. Desenroscar las dos partes del Mix2Vial™ (Fig. 5).
Polvo
Desechar el vial de disolvente vacío con la parte azul del Mix2Vial™.
*o tyi
i el concentrado no se disuelve completamente o se forma un conglomerado, no utilice la
Instrucciones para la perfusión :
Como medida de precaución, debe tomarse el pulso de los pacientes antes y durante laperfusión . Si se produce un aumento importante en el pulso debe de reducirse la velocidad de la perfusión o interrumpirse la administración.
1. Acoplar una jeringa de 20 ml a la parte transparente del Mix2Vial™. Darle la vuelta al vial y extraer la solución al interior de la jeringa.
Una vez que la solución ha sido transferida, sujetar con firmeza el émbolo de la jeringa (manteniéndolo hacia abajo) y extraer la jeringa del Mix2Vial™. Desechar el Mix2Vial™ y el vial vacío.
2. Desinfecte con un algodón empapado en alcohol la zona donde se va a aplicar la inyección.
3. Inyecte la solución intravenosamente a velocidad lenta: Inicialmente 1 ml por minuto, a una velocidad no superior a 2 - 3 ml por minuto.
No debe haber flujo de sangre a la jeringa debido al riesgo de formación de coágulos de fibrina.
El Mix2Vial™ es de un solo uso.
10 de 11 MINISTERIO DE
SANIDAD, POLIDC A SOCIAL E IGUALDAD Agencia es paño» de medicamentos y proouctos san-tanos
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Octapharma S.A.
Avda. Castilla, 2. (P.E. San Fernando)
Ed. Berlín, bajo
28830 San Fernando de Henares Madrid
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
66447
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 26.11.2005
Fecha de la renovación de la autorización: 27.07.2008
10. FECHA DE LA REVISIÓN DEL TEXTO
06/2013