Novothirteen 2500 Ui Polvo Y Disolvente Para Solucion Inyectable
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas. Ver la sección 4.8, en la que se incluye información sobre cómo notificarlas.
1. NOMBRE DEL MEDICAMENTO
NovoThirteen 2.500 UI polvo y disolvente para solución inyectable
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Un vial contiene 2.500 UI por 3 ml de catridecacog* (factor XIII de coagulación recombinante) (ADNr), que después de la reconstitución corresponden a una concentración de 833 UI/ml. La actividad específica de NovoThirteen es aproximadamente de 165 UI/mg de proteína.
*Producido en células de levadura (Saccharomyces cerevisiae) mediante tecnología del ADN recombinante.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Polvo y disolvente para solución inyectable.
El polvo es blanco y el disolvente es transparente e incoloro.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Tratamiento profiláctico a largo plazo de hemorragias en pacientes adultos y pediátricos con deficiencia congénita de la subunidad A del factor XIII.
4.2 Posología y forma de administración
El tratamiento debe iniciarse bajo la supervisión de un médico con experiencia en el tratamiento de trastornos hemorrágicos raros. La deficiencia congénita de la subunidad A del factor XIII se debe confirmar mediante procedimientos diagnósticos apropiados como la actividad y el inmunoensayo del factor XIII y, si procede, la determinación del genotipo.
Posología
La potencia de este medicamento se expresa en unidades internacionales (UI).
Aunque se expresa en el mismo sistema de unidades (UI), la posología de NovoThirteen es diferente al esquema posológico de otros productos que contienen FXIII (ver sección 4.4).
La dosis recomendada es 35 UI/kg de peso corporal (pc) una vez al mes (cada 28 días +/- 2 días), administrada como inyección en bolo intravenoso.
En base a la concentración real de NovoThirteen, el volumen de la dosis (en mililitros) que se ha de administrar a los pacientes que pesan al menos 24 kg puede calcularse a partir de la siguiente fórmula:
Volumen de la dosis en ml = 0,042 x pc del sujeto (kg)
El médico puede considerar necesario el ajuste de la dosis en ciertas situaciones donde la prevención de hemorragias no se consiga de forma apropiada con la dosis recomendada de 35 Ul/kg/mes.
Este ajuste de dosis debe estar basado en los niveles de actividad del FXIII.
Se recomienda monitorizar los niveles de actividad de NovoThirteen con una prueba de FXIII estándar.
Población pediátrica
No se requiere un ajuste de dosis cuando se utiliza NovoThirteen en pacientes pediátricos. Se debe utilizar la dosis de 35 UI/kg de peso corporal (ver sección 5.2 “Población pediátrica”).
Sin embargo, si el paciente pediátrico pesa menos de 24 kg, NovoThirteen reconstituido se debe diluir con 6,0 ml de cloruro de sodio 0,9% solución inyectable para ajustar la dosis de los niños pequeños (ver sección 6.6 “Precauciones especiales de eliminación y otras manipulaciones - Uso en la población pediátrica”).
El volumen de la dosis para NovoThirteen reconstituido diluido con 6,0 ml de cloruro de sodio 0,9% solución inyectable, puede calcularse a partir de la siguiente fórmula:
Volumen de la dosis en ml = 0,117* x peso corporal en kilogramos.
* El cálculo del factor de corrección 0,117 está relacionado con la cantidad exacta del producto y no con el valor nominal del producto.
Los datos actualmente disponibles están descritos en la sección 4.8, 5.1 y 5.2.
Forma de administración
Una vez reconstituido, el producto debe administrarse por separado y no debe mezclarse con soluciones para perfusión ni administrarse en goteo.
El producto reconstituido se debe administrar como inyección lenta en bolo intravenoso a una velocidad no superior a 2 ml/minuto.
Para consultar las instrucciones de reconstitución del medicamento antes de la administración, ver sección 6.6.
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
En pacientes con deficiencia de FXIII, NovoThirteen no es efectivo si se utiliza como tratamiento mensual profiláctico de hemorragias en pacientes con deficiencia congénita de la subunidad B del FXIII. La deficiencia de la subunidad B del FXIII está asociada a una vida media muy reducida de la subunidad A farmacológicamente activa administrada. La deficiencia de subunidad de los pacientes debe conocerse antes de que se inicie el tratamiento, mediante procedimientos diagnósticos apropiados como la actividad y el inmunoensayo del factor XIII y, si procede, la determinación del genotipo.
No se ha estudiado en ensayos clínicos el tratamiento a demanda de hemorragias agudas o intraterapéuticas con NovoThirteen. Se debe considerar un tratamiento alternativo en estas situaciones.
Teniendo en cuenta que la posología y la concentración del FXIII en NovoThirteen son diferentes a las de otros medicamentos que contienen FXIII, se debe poner especial atención en el cálculo de la dosis apropiada para cada paciente en particular (ver fórmula para el cálculo del volumen de la dosis en la sección 4.2).
Como NovoThirteen contiene una proteína recombinante puede producir reacciones alérgicas, incluida la de tipo anafiláctico. Se debe informar a los pacientes de los síntomas iniciales de las reacciones de hipersensibilidad (como urticaria localizada o generalizada, opresión en el pecho, respiración sibilante, hipotensión) y anafilaxis. Se debe suspender la administración inmediatamente si se producen reacciones alérgicas o de tipo anafiláctico y no debe continuarse el tratamiento con NovoThirteen.
Formación de inhibidores:
En los ensayos clínicos no se ha detectado la formación de inhibidores en el tratamiento con NovoThirteen. Se puede sospechar de la presencia de inhibidores en el caso de haber una falta de respuesta terapéutica que se hace evidente en forma de hemorragias o se demuestra mediante resultados analíticos por ejemplo que la actividad del FXIII no alcance los niveles esperados. Si se sospecha de la formación de inhibidores se deberá realizar un análisis de anticuerpos.
No se debe tratar con NovoThirteen a los pacientes cuyos anticuerpos neutralicen el FXIII sin una estrecha monitorización.
Riesgo tromboembólico
El producto reconstituido debe manipularse de acuerdo con la sección 6.3.
Debe evitarse la conservación incorrecta del producto una vez reconstituido ya que puede dar lugar a una pérdida de esterilidad y a un aumento del nivel de NovoThirteen activado. Un mayor nivel de NovoThirteen activado puede incrementar el riesgo de trombosis.
Cuando exista una predisposición a padecer una trombosis, se debe tener cuidado dado el efecto estabilizador de la fibrina de NovoThirteen. Se puede producir una estabilización del trombo, dando lugar a un mayor riesgo de oclusión de vasos.
No se han estudiado pacientes con disfunción hepática. NovoThirteen puede no resultar eficaz en pacientes con disfunción hepática si la disfunción hepática es lo suficientemente grave como para disminuir los niveles de subunidad B del FXIII. Se debe controlar los niveles de actividad del FXIII en pacientes con insuficiencia hepática grave.
La experiencia clínica en la administración de NovoThirteen en pacientes de edad avanzada con deficiencia congénita de FXIII es limitada.
No se han estudiado en ensayos clínicos pacientes con insuficiencia renal que necesitan diálisis.
Este medicamento contiene menos de 1 mmol (23 mg) de sodio por inyección, por lo que se considera esencialmente “exento de sodio”.
4.5 Interacción con otros medicamentos y otras formas de interacción
No hay datos clínicos disponibles sobre la interacción entre NovoThirteen y otros medicamentos.
En base a los datos del estudio no clínico (ver sección 5.3) no se recomienda combinar NovoThirteen y rFVIIa.
4.6 Fertilidad, embarazo y lactancia
Embarazo
No hay datos clínicos sobre el uso de NovoThirteen en mujeres embarazadas. Los estudios realizados en animales son insuficientes en términos de toxicidad para la reproducción (ver sección 5.3) ya que no se ha estudiado NovoThirteen en animales gestantes. Se desconoce el riesgo para el ser humano. Sin embargo, según la necesidad terapéutica, se puede considerar el uso de NovoThirteen como terapia sustitutiva durante el embarazo.
Lactancia
Se desconoce si el principio activo rFXIII se excreta en la leche materna humana. La excreción del principio activo rFXIII en la leche no se ha estudiado en animales. Se debe decidir si es necesario continuar/interrumpir la lactancia o continuar/interrumpir el tratamiento con NovoThirteen teniendo en cuenta el beneficio de la lactancia para el niño y el beneficio del tratamiento con NovoThirteen para la madre.
Fertilidad
No se han observado efectos sobre los órganos reproductivos en los estudios no clínicos. No hay datos sobre un posible efecto sobre la fertilidad en seres humanos.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de NovoThirteen sobre la capacidad para conducir y utilizar máquinas es nula.
4.8 Reacciones adversas Resumen del perfil de seguridad
En los ensayos clínicos, NovoThirteen se ha administrado a 56 pacientes con deficiencia congénita de la subunidad A del factor XIII (1.043 dosis de NovoThirteen). 15 pacientes tenían entre 6 y menos de 18 años de edad y 6 pacientes tenían menos de 6 años (un total de 393 exposiciones a NovoThirteen en sujetos pediátricos (menores de 18 años)).
El efecto adverso más frecuente es “cefalea”, notificado en un 34% de pacientes.
Tabla de reacciones adversas
Las descripciones de las frecuencias de todas las reacciones adversas identificadas en 51 pacientes con deficiencia congénita de FXIII expuestos en los ensayos clínicos se presentan en la tabla a continuación según la clasificación por órgano y sistema.
Las categorías de frecuencias vienen definidas por la siguiente convención: muy frecuente (>1/10); frecuente (>1/100 a <1/10); poco frecuente (>1/1.000 a <1/100); rara (>1/10.000 a <1/1.000); muy rara (<1/10.000); frecuencia no conocida (no puede estimarse a partir de los datos disponibles). En cada grupo de frecuencia, los efectos adversos se presentan en orden decreciente de gravedad.
|
Trastornos de la sangre y del sistema linfático | |
|
Frecuentes (> 1/100 a < 1/10) |
Leucopenia y empeoramiento de la neutropenia |
|
Trastornos del sistema nervioso | |
|
Frecuentes (> 1/100 a < 1/10) |
Cefalea |
|
Trastornos musculoesqueléticos y del tejido conjuntivo | |
|
Frecuentes (> 1/100 a < 1/10) |
Dolor en las extremidades |
|
Trastornos generales y alteraciones en el lugar de administración Frecuentes (> 1/100 a < 1/10) |
Dolor en la zona de inyección |
|
Exploraciones complementarias Frecuentes (> 1/100 a < 1/10) Frecuentes (> 1/100 a < 1/10) |
Anticuerpos no neutralizantes Aumento del dímero-D de la fibrina |
Descripción de determinadas reacciones adversas
Un paciente con neutropenia preexistente experimentó un empeoramiento leve de la neutropenia y leucopenia durante el tratamiento con NovoThirteen. Después de interrumpir la administración de NovoThirteen el recuento de neutrófilos del paciente volvió a niveles similares a los anteriores al tratamiento con NovoThirteen.
Se han observado anticuerpos no neutralizantes en 4 de los 56 pacientes expuestos con deficiencia congénita de FXIII. Los cuatro casos de anticuerpos no neutralizantes ocurrieron en pacientes menores de 18 años (8, 8, 14 y 16 años). Estos anticuerpos se observaron al comienzo del tratamiento con NovoThirteen. Los 4 pacientes recibieron al menos 2 dosis de NovoThirteen. 3 de los pacientes interrumpieron el ensayo y volvieron a su tratamiento anterior. Uno de ellos continuó recibiendo rFXIII y los anticuerpos descendieron por debajo del límite de detección. Los anticuerpos no tuvieron acción inhibitoria y los pacientes no experimentaron reacciones adversas ni hemorragias asociadas a estos anticuerpos. Los anticuerpos fueron transitorios en todos los pacientes.
Un sujeto sano desarrolló títulos bajos de anticuerpos no neutralizantes transitorios tras recibir la primera dosis de NovoThirteen. Los anticuerpos no presentaron actividad inhibitoria y el sujeto no experimentó reacciones adversas ni hemorragias asociadas a estos anticuerpos. Los anticuerpos desaparecieron en el seguimiento realizado a los 6 meses.
En un estudio de seguridad posautorización se observaron anticuerpos no neutralizantes transitorios en un niño con deficiencia congénita de FXIII después de varios años de tratamiento con NovoThirteen. No se asociaron signos clínicos con estos anticuerpos.
Población pediátrica
En los ensayos clínicos, se notificaron efectos adversos con más frecuencia en pacientes de entre 6 y menos de 18 años de edad que en adultos. 4 pacientes (25%) de entre 6 y 18 años experimentaron efectos adversos graves en comparación con 3 pacientes mayores de 18 años (8,5%) que experimentaron efectos adversos graves. Se notificaron cuatro casos de desarrollo de anticuerpos no neutralizantes al comienzo del tratamiento en pacientes de 6 a 18 años. 3 de estos pacientes interrumpieron el ensayo debido al acontecimiento adverso.
En pacientes menores de 6 años, no se notificaron ni anticuerpos anti-rFXIII, ni reacciones adversas tromboembólicas u otros problemas de seguridad.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Apéndice V.
4.9 Sobredosis
No se han observado síntomas clínicos en los casos notificados de sobredosis de hasta 2,3 veces la dosis recomendada de NovoThirteen.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Antihemorrágicos, factor XIII de la coagulación sanguínea, código ATC: B02BD11.
Mecanismo de acción
En plasma, el FXIII circula como un heterotetrámero [A2B2] compuesto por 2 subunidades A de FXIII y 2 subunidades B de FXIII unidas por fuertes interacciones no covalentes. La subunidad B del FXIII actúa como molécula transportadora de la subunidad A del FXIII en circulación, y está presente en exceso en el plasma. Cuando se liga la subunidad A del FXIII a la subunidad B del FXIII [A2B2], se prolonga la vida media de la subunidad A del FXIII [A2]. FXIII es una proenzima (protransglutaminasa), que se activa por la trombina en presencia de Ca2+. La actividad enzimática reside en la subunidad A del FXIII. Tras la activación, la subunidad A del FXIII se disocia de la subunidad B del FXIII y de esa manera expone la zona activa de la subunidad A del FXIII. La transglutaminasa activa enlaza a la fibrina con otras proteínas y produce una mayor fuerza mecánica y resistencia a la fibrinólisis del coágulo de fibrina y contribuye a favorecer la adhesión de plaquetas y coágulos al tejido lesionado.
NovoThirteen es una subunidad A del factor XIII de coagulación recombinante producida en células de levadura (Saccharomyces cerevisiae) mediante tecnología del ADN recombinante. Es estructuralmente idéntica a la subunidad A del FXIII humana [A2]. NovoThirteen (subunidad A) se une a la subunidad B del FXIII humana libre y da lugar a un heterotetrámero [rA2B2] con una vida media similar al [A2B2] endógeno.
Efectos farmacodinámicos
En la actualidad no hay marcadores para evaluar cuantitativamente la farmacodinámica in vivo del FXIII. Los resultados de las pruebas de coagulación estándar son normales, al igual que la calidad del coágulo afectado. Una prueba de solubilidad del coágulo se usa de forma generalizada como indicador de deficiencia de FXIII, pero la prueba es cualitativa y, cuando se realiza correctamente, la prueba sólo es positiva cuando la actividad de FXIII en la muestra es casi inexistente.
Se ha demostrado que NovoThirteen tiene las mismas propiedades farmacodinámicas en plasma que el FXIII endógeno.
Eficacia clínica y seguridad
Se llevó a cabo un ensayo prospectivo pivotal, abierto, de brazo único, de fase 3 (F13CD-1725) en el que participaron 41 pacientes con deficiencia de la subunidad A del FXIII para investigar la eficacia hemostática del rFXIII en pacientes con deficiencia congénita del FXIII reflejada por la tasa de episodios hemorrágicos que necesitan tratamiento con un medicamento con FXIII. El esquema posológico utilizado fue 35 UI/kg/mes (cada 28 días +/- 2 días).
En este ensayo, durante el tratamiento con rFXIII, se observaron cinco episodios hemorrágicos que requirieron tratamiento con un medicamento con FXIII en cuatro pacientes.
La tasa media de hemorragias que requirieron tratamiento se estableció en 0,151 por sujeto y año. En el análisis del criterio principal de valoración que abarcaba este período, la tasa ajustada por edad (número por sujeto y año) de hemorragias que requirieron tratamiento durante el periodo de tratamiento con rFXIII fue de 0,053/año (95%, IC: 0,010 - 0,272; estimación basada en el modelo estadístico correspondiente a la edad promedio de 26,4 años para los 41 pacientes).
Población pediátrica
Los análisis de los datos de los pacientes pediátricos incluidos en los ensayos clínicos no han revelado diferencias en la respuesta al tratamiento en función de la edad.
Quince niños de entre 6 y menos de 18 años y seis niños menores de 6 años han sido tratados con NovoThirteen hasta un total de 393 exposiciones.
Los niños mayores de 6 años fueron investigados mediante el ensayo pivotal de fase 3 (F13CD-1725) y el estudio de extensión en curso (F13CD-3720) que evalúa la seguridad de la terapia de reemplazo mensual con NovoThirteen.
Los seis niños menores de 6 años fueron investigados mediante un ensayo farmacocinético de fase 3b de dosis única (F13CD-3760) y después fueron incluidos en el ensayo de seguimiento a largo plazo en curso (F13CD-3835) que evalúa la seguridad y la eficacia de la terapia de reemplazo mensual con NovoThirteen. No se han detectado episodios hemorrágicos que requirieran tratamiento en pacientes menores de 6 años durante los 8,7 años de seguimiento acumulativo, lo que representa un total de 116 dosis. La dosis sugerida de 35 UI/kg ha demostrado ser apropiada para proporcionar cobertura hemostática en esta población joven.
5.2 Propiedades farmacocinéticas
Según la actividad del FXIII medida por la prueba Berichrom para 471 dosis mensuales de rFXIII, se estimó una vida media del rFXIII de 11,8 días en pacientes con deficiencia congénita de FXIII. Esto coincide con la farmacocinética de eliminación estimada a partir del ensayo farmacológico clínico realizado en sujetos sanos, que estableció la vida media en 11,8 días. En este ensayo el volumen de distribución medio en equilibrio fue 47 ml/kg, el tiempo medio de permanencia fue 15,5 días y el aclaramiento medio fue 0,13 ml/kg.
Población pediátrica
En un ensayo farmacocinético 6 niños (de 1 año a menos de 6 años) con deficiencia congénita de la subunidad A del FXIII fueron expuestos a una única dosis i.v. de NovoThirteen 35 UI/kg. El valor medio de la t1/2 del FXIII fue de aproximadamente 15 días (intervalo: 10 a 25 días). En este ensayo, el aclaramiento medio en niños fue 0,15 ml/h/kg.
5.3 Datos preclínicos sobre seguridad
Los datos de los estudios no clínicos no muestran riesgos especiales para los seres humanos según los estudios de farmacología de seguridad y toxicidad a dosis repetidas. Todos los hallazgos del programa de seguridad no clínica se han relacionado con la farmacología exacerbada prevista (trombosis general, necrosis isquémica y, en última instancia, mortalidad) del rFXIII y del FXIII recombinante y activado de forma no proteolítica a unos niveles de dosis por encima (>48 veces) de la dosis clínica máxima recomendada de 35 UI/kg.
Un efecto sinérgico potencial del tratamiento combinado de rFXIII y rFVIIa en un modelo cardiovascular avanzado en un mono cynomolgus dio lugar a una farmacología exacerbada (trombosis y muerte) a un nivel de dosis inferior que al administrar los compuestos de forma individual.
No se han realizado estudios de toxicidad para la reproducción o el desarrollo en animales. No se han observado efectos sobre los órganos reproductivos en los estudios de toxicidad a dosis repetidas.
No se ha estudiado el potencial genotóxico ni la carcinogenicidad pues rFXIII es una proteína endógena.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Polvo:
Cloruro sódico Sacarosa Polisorbato 20 L-histidina
Ácido clorhídrico (para ajuste de pH)
Hidróxido sódico (para ajuste de pH)
Disolvente:
Agua para preparaciones inyectables
6.2 Incompatibilidades
En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros.
6.3 Periodo de validez 2 años.
Después de la reconstitución, el medicamento debe utilizarse inmediatamente debido al riesgo de contaminación micriobiológica.
6.4 Precauciones especiales de conservación
Conservar en nevera (entre 2°C y 8°C).
Conservar en el embalaje original para protegerlo de la luz.
No congelar.
Para consultar las condiciones de conservación del medicamento reconstituido, ver sección 6.3.
6.5 Naturaleza y contenido del envase
Polvo (2.500 UI) en un vial (vidrio tipo I) con tapón de goma (clorobutilo) y 3,2 ml de disolvente en un vial (vidrio tipo I) con tapón de goma (bromobutilo) y un adaptador de vial para la reconstitución. Tamaño de envase de 1.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Instrucciones de uso de NovoThirteen
Para reconstituir y administrar este medicamento se necesitan las siguientes herramientas: una jeringa de 10 ml o del tamaño conveniente según el volumen de la inyección, toallitas impregnadas en alcohol, el adaptador del vial incluido y un equipo de perfusión (tubos, aguja mariposa).
Preparación de la solución
Utilice siempre una técnica aséptica. Antes de empezar debe lavarse las manos. Lleve los viales de polvo y disolvente a una temperatura no superior a 25°C, manteniendo los viales en las manos. Limpie los tapones de goma de los viales con una toallita impregnada en alcohol y déjelos secar antes de su uso.
El medicamento se reconstituye usando el adaptador del vial incluido.
Coloque el adaptador del vial en el vial de disolvente (agua para preparaciones inyectables). Tenga cuidado de no tocar la espiga del adaptador del vial.
Tire del émbolo de la jeringa para cargar un volumen de aire equivalente a la cantidad total de disolvente contenida en el vial de disolvente.
Enrosque la jeringa firmemente en el adaptador del vial unido al vial de disolvente. Inyecte aire en el vial presionando el émbolo hasta que sienta una clara resistencia.
Sujete la jeringa con el vial de disolvente boca abajo. Tire del émbolo para extraer el disolvente y pasarlo a la jeringa.
Retire el vial de disolvente vacío inclinando la jeringa con el adaptador del vial.
Ajuste el adaptador del vial, todavía unido a la jeringa, en el vial de polvo, hasta que note un clic. Presione el émbolo lentamente para inyectar el disolvente en el vial de polvo. Asegúrese de no dirigir el chorro de disolvente directamente sobre el polvo, ya que esto produciría espuma.
Haga suaves movimientos circulares con el vial hasta que se disuelva todo el polvo. No agite el vial, ya que esto produciría espuma. NovoThirteen se debe inspeccionar visualmente en busca de partículas extrañas (externas) y cambios de color antes de su administración. Si se diera alguno de los dos casos, deseche el medicamento.
NovoThirteen reconstituido es una solución transparente e incolora.
Si se necesita una dosis mayor, repita el procedimiento en otra jeringa aparte hasta alcanzar la dosis requerida.
Si el paciente pesa menos de 24 kg, NovoThirteen reconstituido se debe diluir con 6,0 ml de cloruro de sodio 0,9% solución inyectable (consulte la sección Uso en la población pediátrica para ver instrucciones más detalladas del paso de dilución).
Información importante
Una vez preparado, NovoThirteen inyectable debe utilizarse inmediatamente.
Inyección de la solución
Asegúrese de que el émbolo esté presionado hasta el fondo antes de dar la vuelta a la jeringa (puede haber sido expulsado por la presión en el vial). Sujete la jeringa con el vial boca abajo y tire del émbolo para cargar la cantidad calculada para la inyección.
Desenrosque el adaptador del vial con el vial.
Ahora el medicamento está listo para ser inyectado.
Deseche de forma segura la jeringa, el adaptador del vial, el equipo de perfusión y los viales. La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
Uso en la _población _pediátrica
Dilución del producto reconstituido con cloruro de sodio 0,9% solución inyectable
Si el paciente pediátrico pesa menos de 24 kg, NovoThirteen reconstituido se debe diluir con 6,0 ml de cloruro de sodio 0,9% solución inyectable para poder ajustar la dosis de los niños pequeños (ver sección 4.2 “Posología y forma de administración - Población pediátrica”).
Para diluir NovoThirteen reconstituido, se necesitan los siguientes materiales: un vial que contenga cloruro de sodio 0,9% solución inyectable, una jeringa de 10 ml y toallitas impregnadas en alcohol.
Instrucciones generales para la dilución
La dilución debe llevarse a cabo siguiendo técnicas asépticas.
Cuidadosamente cargue exactamente 6,0 ml de cloruro de sodio 0,9% solución inyectable dentro de la jeringa de 10 ml.
Lentamente inyecte los 6,0 ml de cloruro de sodio 0,9% solución inyectable dentro del vial de NovoThirteen reconstituido.
Haga suaves movimientos circulares con el vial para mezclar la solución.
La solución diluida es una solución transparente e incolora. Revise la solución inyectable en busca de partículas y de decoloración. Si observa alguna de ellas, por favor, deséchala.
Después de la disolución diríjase al paso “Inyección de la solución”.
Cualquier material residual del producto diluido debe ser desechado inmediatamente.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Novo Nordisk A/S Novo Allé DK-2880 Bagsv^rd Dinamarca
8. NÚMERO DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/12/775/001
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 03 septiembre 2012
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu/.
A. FABRICANTE(S) DEL (DE LOS) PRINCIPIO(S) ACTIVO(S) BIOLÓGICO(S) Y FABRICANTE(S) RESPONSABLE(S) DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
A. FABRICANTES DEL PRINCIPIO ACTIVO BIOLÓGICO Y FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección de los fabricantes del principio activo biológico
Novo Nordisk A/S Novo Allé DK-2880 Bagsv^rd Dinamarca
Novo Nordisk A/S Hagedornsvej 1 DK-2820 Gentofte Dinamarca
Nombre y dirección del fabricante responsable de la liberación de los lotes
Novo Nordisk A/S Novo Allé DK-2880 Bagsv^rd Dinamarca
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica restringida (ver Anexo I: Ficha Técnica o Resumen de las Características del Producto, sección 4.2).
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
El Titular de la Autorización de Comercialización (TAC) presentará los informes periódicos de seguridad para este medicamento de conformidad con las exigencias establecidas en la lista de fechas de referencia de la Unión (lista EURD) prevista en el artículo 107quater, apartado 7, de la Directiva 2001/83/CE y publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo
acordado en la versión del PGR incluido en el Módulo 1.8.2 de la Autorización de
Comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos.
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o dentro de un plazo de 60 días como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
• Medidas adicionales de minimización de riesgos
El Titular de la Autorización de Comercialización (TAC) deberá asegurar que, en el lanzamiento, se envíe una carta a todos los médicos prescriptores o potenciales prescriptores de NovoThirteen con un Material Informativo que contenga lo siguiente:
1. Folleto para el médico
2. Folleto para el paciente
Ambos documentos se deben utilizar como parte del plan informativo previsto para minimizar el riesgo de errores de medicación, el riesgo de aparición de episodios tromboembólicos debidos a niveles elevados de rFXIII activado de forma no proteolítica por un almacenamiento incorrecto, y el riesgo de uso del medicamento fuera de ficha técnica para tratar hemorragias intraterapéuticas. El TAC deber asegurar la armonización entre la terminología usada en los folletos y en la información de producto.
El folleto para el médico debe contener los siguientes elementos y puntos clave:
• Indicación del producto
• Los riesgos de su uso fuera de ficha técnica dentro de la deficiencia congénita del FXIII
• Procedimientos diagnósticos apropiados para confirmar la deficiencia de la subunidad A del FXIII
• Advertencia sobre la diferencia tanto en la posología como en la concentración entre NovoThirteen y otros productos que contienen FXIII (La dosis recomendada de NovoThirteen es 35 UI/kg de peso corporal (pc) una vez al mes, administrada como inyección en bolo intravenoso. El volumen de la dosis en mililitros debe calcularse para cada paciente según su peso corporal utilizando la siguiente fórmula: Volumen de la dosis en ml = 0,042 x pc del sujeto (kg) si el pc > 24 kg, o el volumen de la dosis en ml = 0,117 x pc (kg) si pc < 24 kg)).
• Manejo correcto y riesgos asociados al manejo inadecuado
• Episodios embólicos y trombóticos incluyendo el riesgo aumentado de oclusión venosa en pacientes con riesgo de padecer trombosis
• Qué hacer en caso de conservación incorrecta, trombosis o embolismo
• Contraindicación de hipersensiblidad
• Advertencias y precauciones en relación a la anafilaxia
• La importancia de recoger datos de seguridad y de cómo inscribir a pacientes en el EPA y otros registros.
• Distribución y uso del folleto para el paciente y la necesidad de asegurarse de que el paciente ha leído y entendido el folleto.
• Ficha Técnica.
El folleto para el paciente, para ser distribuido a los pacientes por los médicos, debe contener los siguientes elementos y puntos clave:
• Indicación del producto
• Los riesgos del uso fuera de ficha técnica dentro de la deficiencia congénita del FXIII
• Cómo conservar, manejar, reconstituir y administrar el producto con seguridad
• Los riesgos asociados a la conservación y manejo incorrectos
• Cómo reconocer los efectos adversos potenciales (trombosis y embolismo)
• Qué hacer en caso de conservación incorrecta, trombosis o embolismo
• Prospecto.
El Titular de la Autorización de Comercialización debe implementar este plan informativo a nivel nacional, antes de la comercialización. El contenido final, formato y modalidades de distribución de ambos documentos debe acordarse con la autoridad nacional competente en cada estado Estado Miembro.
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR Cartonaje_
1. NOMBRE DEL MEDICAMENTO
NovoThirteen 2.500 UI polvo y disolvente para solución inyectable catridecacog (factor XIII ADNr)
2. PRINCIPIO ACTIVO
Un vial contiene 2.500 UI por 3 ml de catridecacog (factor XIII de coagulación recombinante) (ADNr), después de la reconstitución corresponde a una concentración de 833 UI/ml.
3. LISTA DE EXCIPIENTES
Polvo: cloruro sódico, sacarosa, polisorbato 20, L-histidina, ácido clorhídrico (para ajuste de pH), hidróxido sódico (para ajuste de pH)
Disolvente: agua para preparaciones inyectables
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Polvo y disolvente para solución inyectable 2.500 UI de polvo en un vial,
3,2 ml de disolvente en un vial,
1 adaptador del vial
5. FORMA Y VÍA DE ADMINISTRACIÓN
Vía intravenosa
Leer el prospecto antes de utilizar este medicamento
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños
7. OTRAS ADVERTENCIAS ESPECIALES, SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
Después de su reconstitución, el medicamento se debe utilizar inmediatamente debido al riesgo de contaminación microbiológica.
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Conservar en nevera (entre 2°C y 8°C).
Conservar en el embalaje original para protegerlo de la luz. No congelar.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Novo Nordisk A/S Novo Allé DK-2880 Bagsv^rd Dinamarca
12. NÚMERO DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/12/775/001
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
Medicamento sujeto a prescripción médica
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
NovoThirteen
Etiqueta para el vial de polvo_
1. NOMBRE DEL MEDICAMENTO Y VÍA DE ADMINISTRACIÓN
NovoThirteen 2.500 UI polvo para inyectable catridecacog
Vía intravenosa tras reconstitución
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
2.500 UI
6. OTROS
Etiqueta para el vial de disolvente_
1. NOMBRE DEL MEDICAMENTO Y VÍA DE ADMINISTRACIÓN
Disolvente para NovoThirteen
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
3,2 ml agua para preparaciones inyectables
6. OTROS
Para reconstitución
B. PROSPECTO
Prospecto: información para el usuario NovoThirteen 2.500 UI polvo y disolvente para solución inyectable
catridecacog (factor XIII de coagulación recombinante)
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Puede contribuir comunicando los efectos adversos que pudiera usted tener. La parte final de la sección 4 incluye información sobre cómo comunicar estos efectos adversos.
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es NovoThirteen y para qué se utiliza
2. Qué necesita saber antes de empezar a usar NovoThirteen
3. Cómo usar NovoThirteen
4. Posibles efectos adversos
5. Conservación de NovoThirteen
6. Contenido del envase e información adicional
1. Qué es NovoThirteen y para qué se utiliza Qué es NovoThirteen
NovoThirteen contiene el principio activo catridecacog, que es idéntico al factor XIII de coagulación humano, una enzima necesaria para la coagulación de la sangre.
Para qué se utiliza NovoThirteen
NovoThirteen se utiliza para evitar las hemorragias en pacientes que no tienen suficiente factor XIII. NovoThirteen sustituye al factor XIII que falta y favorece la estabilización del coágulo sanguíneo inicial al crear una malla a su alrededor.
2. Qué necesita saber antes de empezar a usar NovoThirteen No use NovoThirteen
• Si es alérgico al catridecacog o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6).
Si no está seguro, consulte a su médico antes de empezar a usar este medicamento.
Advertencias y precauciones
Consulte a su médico antes de empezar a usar NovoThirteen:
• Si tiene o ha tenido un mayor riesgo de formación de coágulos sanguíneos (trombosis), ya que NovoThirteen puede incrementar la gravedad de un coágulo de sangre preexistente.
• Si tiene o ha tenido alguna lesión hepática.
Contacte con su médico inmediatamente:
• Si experimenta hemorragias durante el tratamiento con NovoThirteen y éstas ocurren de forma espontánea y/o requieren tratamiento. En este último caso el médico le recetará un tratamiento alternativo para tratar la hemorragia.
• Si experimenta una reacción alérgica al factor XIII de coagulación recombinante. Los síntomas pueden incluir: urticaria, picor, hinchazón, dificultad para respirar, hipotensión (los síntomas incluyen palidez y piel fría, pulso acelerado), mareos y sudoración.
Uso de NovoThirteen con otros medicamentos
Informe a su médico si está utilizando, ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento.
No se recomienda usar NovoThirteen conjuntamente con factor VIIa de coagulación recombinante (otro factor de la coagulación sanguínea).
Embarazo y lactancia
La utilización de NovoThirteen puede ser necesaria durante el embarazo y el periodo de lactancia.
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico antes de utilizar este medicamento.
NovoThirteen contiene sodio
Este medicamento contiene menos de 1mmol de sodio (23 mg) por inyección, por lo que se considera esencialmente “exento de sodio”.
3. Cómo usar NovoThirteen
Su tratamiento con NovoThirteen debe iniciarlo un médico con experiencia en el tratamiento de trastornos hemorrágicos raros.
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico. En caso de duda, consulte de nuevo a su médico.
NovoThirteen debe inyectarse en una vena. La dosis dependerá de su peso corporal. La dosis habitual es de 35 UI por kilo de peso corporal. Las inyecciones se administran una vez al mes (cada 28 +/- 2 días).
En base a la concentración de la solución de NovoThirteen, el volumen de dosis para la inyección (en mililitros) se puede calcular con la siguiente fórmula:
Volumen de dosis en mililitros = 0,042 x su peso corporal en kg.
Debe utilizar únicamente la dosis recetada y calculada por su médico a partir de esta fórmula teniendo en cuenta que la dosis habitual y la concentración de NovoThirteen son diferentes a las de otros medicamentos que contienen factor XIII.
Su médico puede adaptar la dosis si lo considera necesario.
Uso en niños pequeños
Dilución del producto reconstituido con 6 ml de cloruro de sodio 0,9% solución inyectable
Si se inyecta NovoThirteen a un niño que pesa menos de 24 kg, NovoThirteen reconstituido se debe diluir con 6,0 ml de cloruro de sodio 0,9% solución inyectable para poder ajustar la dosis de los niños pequeños. Para más información ver la sección “Instrucciones de uso de NovoThirteen - Dilución del producto reconstituido con cloruro de sodio 0,9% solución inyectable”.
El volumen de la dosis para NovoThirteen reconstituido diluido con 6 ml de cloruro de sodio 0,9% solución inyectable, puede calcularse a partir de la siguiente fórmula:
Volumen de la dosis en ml = 0,117* x peso corporal en kilogramos.
* El cálculo del factor de corrección 0,117 está relacionado con la cantidad exacta del producto y no con el valor nominal del producto.
NovoThirteen reconstituido debe inyectarse a una velocidad no superior a 2 ml/minuto.
Para más información sobre cómo preparar la inyección, ver “Instrucciones de uso de NovoThirteen”. Uso en niños y adolescentes
NovoThirteen se puede utilizar en adolescentes y niños de la misma forma que en los adultos.
Si usa más NovoThirteen del que debe
La información acerca de sobredosis de NovoThirteen es limitada. Ninguno de los casos declarados ha demostrado síntomas de enfermedad. Contacte con su médico si se ha inyectado una cantidad de NovoThirteen superior a la indicada.
Si olvidó usar NovoThirteen
Consulte a su médico si olvidó ponerse una inyección de NovoThirteen. No use una dosis doble para compensar las dosis olvidadas.
Si interrumpe el tratamiento con NovoThirteen
Si interrumpe el tratamiento con NovoThirteen ya no estará protegido contra las hemorragias. No interrumpa el tratamiento con NovoThirteen sin consultar con su médico, quien le explicará las consecuencias de interrumpir el tratamiento y le ofrecerá otras opciones.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Los efectos adversos incluyen:
Frecuentes:
pueden afectar hasta 1 de cada 10 personas
• Dolor de cabeza (el efecto adverso más frecuente)
• Dolor en el lugar de la inyección
• Dolor en piernas y brazos
• Mayor cantidad de fragmentos de proteína pequeños debido a la disolución de los coágulos sanguíneos
• Reducción del número de algunos tipos de leucocitos. Eso significa que su cuerpo puede ser más propenso a las infecciones
• Desarrollo de anticuerpos no neutralizantes del factor XIII. Estos anticuerpos no influyen en el efecto del principio activo.
Efectos adversos en niños:
Los efectos adversos observados en niños son los mismos que se han observado en los adultos, pero los efectos adversos pueden ser más frecuentes en niños que en adultos.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información
sobre la seguridad de este medicamento.
5. Conservación de NovoThirteen
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la etiqueta y la caja exterior después de ‘CAD’. La fecha de caducidad es el último día del mes que se indica.
Conservar en nevera (entre 2°C y 8°C).
No congelar.
Conservar en el embalaje original para protegerlo de la luz.
Una vez preparado, NovoThirteen inyectable debe utilizarse inmediatamente.
La solución es transparente e incolora. No use este medicamento si observa partículas o cambia de color cuando se reconstituye.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional Composición de NovoThirteen
• El principio activo es catridecacog* (factor XIII de coagulación recombinante): 2.500 UI/3 ml, después de la reconstitución, corresponde a una concentración de 833 UI/ml.
• Los demás componentes son, para el polvo: cloruro sódico, sacarosa y polisorbato 20, L-histidina, ácido clorhídrico (para ajuste de pH), hidróxido sódico (para ajuste de pH) y para el disolvente: agua para preparaciones inyectables.
• producido en células de levadura (Saccharomyces cerevisiae) mediante tecnología del ADN recombinante.
Aspecto del producto y contenido del envase
NovoThirteen se suministra como polvo y disolvente para solución inyectable (2.500 UI de polvo en un vial y 3,2 ml de disolvente en un vial, con un adaptador del vial).
Tamaño de envase de 1.
El polvo es blanco y el disolvente es transparente e incoloro.
Titular de la autorización de comercialización y responsable de la fabricación
Novo Nordisk A/S Novo Allé DK-2880 Bagsv^rd Dinamarca
Fecha de la última revisión de este prospecto:
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
Instrucciones de uso de NovoThirteen
Para reconstituir y administrar este medicamento se necesitan los siguientes utensilios: una jeringa de 10 ml o del tamaño conveniente según el volumen de la inyección, toallitas impregnadas en alcohol, el adaptador del vial incluido y un equipo de perfusión (tubos, aguja mariposa).
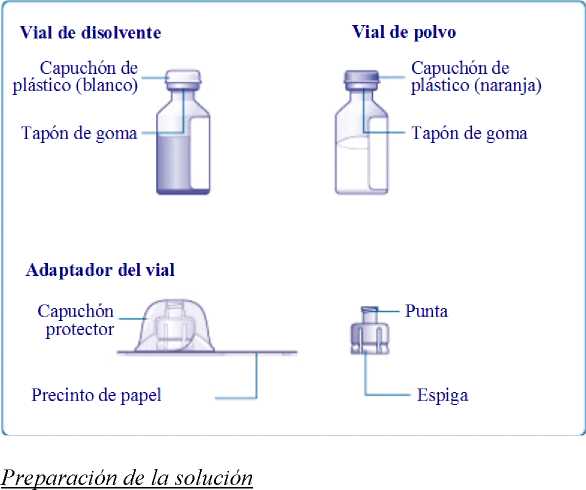
Utilice siempre una técnica aséptica. Antes de empezar debe lavarse las manos. Lleve los viales de polvo y disolvente a una temperatura no superior a 25°C, manteniendo los viales en las manos hasta que sienta que están a la misma temperatura que sus manos. Retire los capuchones de plástico de los 2 viales. No use los viales si los capuchones están sueltos o faltan. Limpie los tapones de goma de los viales con una toallita impregnada en alcohol y déjelos secar antes de su uso.
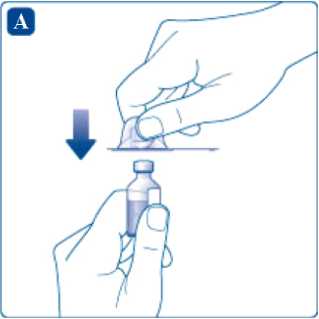
El medicamento se reconstituye usando el adaptador del vial incluido.
Retire el precinto de papel del adaptador del vial sin sacarlo del capuchón protector. Coloque el adaptador del vial en el vial de disolvente (agua para preparaciones inyectables). Tenga cuidado de no tocar la espiga del adaptador del vial.
Una vez unido, retire el capuchón protector del adaptador del vial.
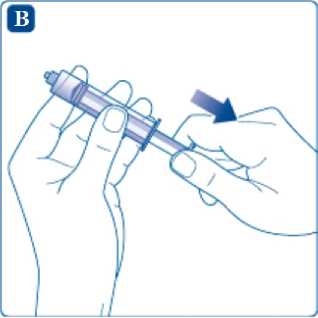
Tire del émbolo de la jeringa para cargar un volumen de aire equivalente a la cantidad total de disolvente contenida en el vial de disolvente.
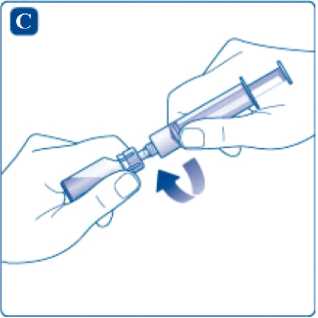
Enrosque la jeringa firmemente en el adaptador del vial unido al vial de disolvente. Inyecte aire en el vial presionando el émbolo hasta que sienta una clara resistencia.
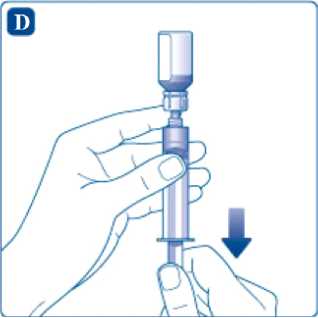
Sujete la jeringa con el vial de disolvente boca abajo. Tire del émbolo para extraer el disolvente y pasarlo a la jeringa.
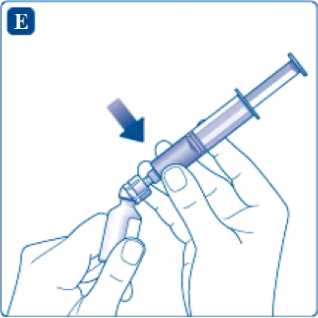
Retire el vial de disolvente vacío inclinando la jeringa unida al adaptador del vial.
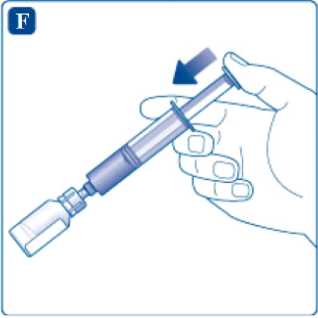
Ajuste el adaptador del vial, todavía unido a la jeringa, en el vial de polvo, hasta que note un clic. Sujete la jeringa ligeramente inclinada con el vial hacia abajo. Presione el émbolo lentamente para inyectar el disolvente en el vial de polvo. Asegúrese de no dirigir el chorro de disolvente directamente sobre el polvo ya que esto produciría espuma.
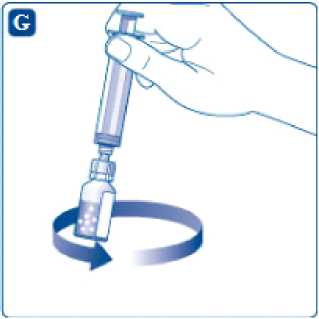
Haga suaves movimientos circulares con el vial hasta que se disuelva todo el polvo. No agite el vial, ya que esto produciría espuma.
NovoThirteen se debe inspeccionar visualmente en busca de partículas extrañas (externas) y de decoloración antes de su administración. Si se diera alguno de los dos casos, deseche el medicamento. NovoThirteen reconstituido es una solución transparente e incolora.
Si se necesita una dosis mayor, repita el procedimiento en otra jeringa aparte hasta alcanzar la dosis requerida.
Una vez preparado, NovoThirteen inyectable debe utilizarse inmediatamente.
Si se necesita una dilución de NovoThirteen reconstituido, diríjase a la sección “Dilución del producto reconstituido con cloruro de sodio 0,9% solución inyectable”.
Inyección de la solución
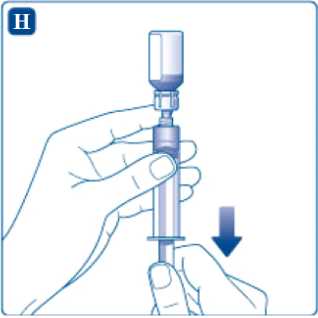
Asegúrese de que el émbolo esté presionado hasta el fondo antes de dar la vuelta a la jeringa (puede haber sido expulsado por la presión en el vial). Sujete la jeringa con el vial boca abajo y tire del émbolo para cargar la cantidad calculada para la inyección.
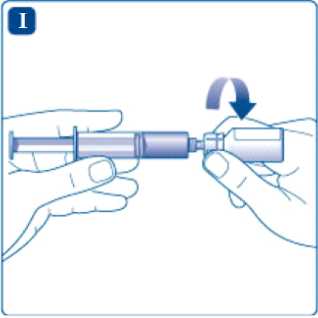
Desenrosque el adaptador del vial con el vial.
Ahora el medicamento está listo para ser inyectado en una vena. Siga el procedimiento de inyección que le haya indicado su médico.
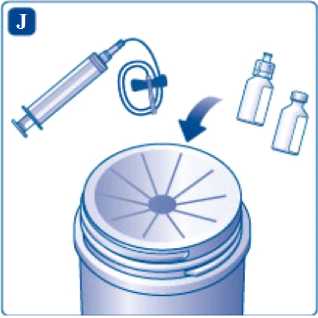
Deseche de forma segura la jeringa, el adaptador del vial, el equipo de perfusión y los viales. La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
Dilución del producto reconstituido con cloruro de sodio 0,9% solución inyectable
Si se necesita una dilución de NovoThirteen reconstituido para poder ajustar la dosis de los niños por debajo de 24 kg, NovoThirteen reconstituido se debe diluir con 6,0 ml de cloruro de sodio 0,9% solución inyectable (ver sección 3 “Cómo usar NovoThirteen - Uso en niños pequeños”).
Instrucciones sobre cómo diluir NovoThirteen reconstituido
Para diluir NovoThirteen reconstituido, se necesitan los siguientes utensilios: un vial que contenga cloruro de sodio 0,9% solución inyectable, una jeringa de 10 ml y toallitas impregnadas en alcohol.
Instrucciones generales para la dilución
La dilución debe llevarse a cabo siguiendo técnicas asépticas.
Cuidadosamente cargue exactamente 6,0 ml de cloruro de sodio 0,9% solución inyectable dentro de la jeringa de 10 ml.
Lentamente inyecte los 6,0 ml de cloruro de sodio 0,9% solución inyectable dentro del vial de NovoThirteen reconstituido.
Haga suaves movimientos circulares con el vial para mezclar la solución.
La solución diluida es una solución transparente e incolora. Revise la solución inyectable en busca de partículas y de decoloración. Si observa alguna de ellas, por favor, deséchela.
Después de la disolución diríjase al paso “Inyección de la solución”.
Cualquier material residual del producto diluido debe ser desechado inmediatamente.
Si tiene cualquier duda, pregunte a su médico o enfermero.
30