Nitroplast 15 Parches Transdermicos
.Uí1.
"I
an
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
Nitroplast 5 mg parches transdérmicos Nitroplast 10 mg parches transdérmicos Nitroplast 15 mg parches transdérmicos
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Nitroplast 5 mg parches transdérmicos
El parche de 9 cm2 contiene:
Nitroglicerina, 18,7 mg, con una liberación de 0,2 mg/h (5 mg/24h).
Nitroplast 10 mg parches transdérmicos El parche de 18 cm2 contiene:
Nitroglicerina, 37,4 mg, con una liberación de 0,4 mg/h (10 mg/24h).
Nitroplast 15 mg parches transdérmicos El parche de 27 cm2 contiene:
Nitroglicerina, 56,2 mg, con una liberación de 0,6 mg/h (15 mg/24h).
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Parches transdérmicos.
Los parches de Nitroplast son flexibles, de color blanco translúcido, cuadrados y con los bordes redondeados.
La matriz está cubierta por una capa protectora con una línea de separación en forma de S.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Tratamiento preventivo de la angina de pecho, ya sea en monoterapia o en combinación con otros tratamientos antianginosos.
4.2 Posología y forma de administración
Adultos:
El tratamiento deberá ajustarse a las necesidades de cada paciente de acuerdo con la gravedad del
proceso a tratar y con la respuesta individual al tratamiento.
Normalmente el tratamiento se inicia con 1 parche de Nitroplast al día. Si es necesario la dosis puede aumentarse con los parches de 5 mg y 10 mg (2 parches simultáneamente).
Niños:
La seguridad y eficacia de los parches de nitroglicerina no han sido establecidas en los niños. Ancianos:
No existe ninguna evidencia sobre la necesidad de ajustar la dosis en ancianos.
Modo de administración:
El parche de Nitroplast se aplicará en una zona de piel intacta, limpia y sin pelo. No deben utilizarse productos para el cuidado de la piel antes de la aplicación. No se utilizará el mismo lugar de aplicación hasta transcurridos unos días.
Para evitar el desarrollo de tolerancia, el parche sólo deberá permanecer sobre la piel por espacio de 12 a 16 horas, asegurando así un periodo libre de nitratos de 8 a 12 horas. En pacientes con angina grave, puede requerirse un tratamiento antianginoso adicional con fármacos que no contengan nitroderivados durante los intervalos libres del parche.
Los parches no se deben cortar.
4.3 Contraindicaciones
El empleo de Nitroplast parches transdérmicos está contraindicado en:
- Hipersensibilidad a la nitroglicerina, a otros nitratos orgánicos o a cualquiera de los demás componentes de Nitroplast.
- Insuficiencia circulatoria aguda asociada con una marcada hipotensión (shock).
- Shock cardiogénico (excepto que se mantenga una presión final diastólica suficiente con las medidas apropiadas).
- Hipotensión grave (PAS < 90 mmHg).
- Hipovolemia grave.
- Cardiomiopatía hipertrófica obstructiva.
- Situaciones asociadas con una presión intracraneal elevada.
- Insuficiencia miocárdica por obstrucción, tanto por estenosis aórtica o mitral o pericarditis constrictiva.
- Taponamiento cardiaco.
- Uso concomitante de inhibidores de la fosfodiesterasa tipo 5 (PDE5), como el sildenafilo, tadalafilo o vardenafilo, ya que pueden potenciar el efecto vasodilatador de Nitroplast, provocando una hipotensión grave.
4.4 Advertencias y precauciones especiales de empleo
Nitroplast debe utilizarse con especial precaución y bajo estricto control médico en caso de: - Disminución de la presión de llenado, como por ejemplo en infarto agudo de miocardio e
-lillas
ÍTTI
insuficiencia ventricular izquierda. Deben evitarse descensos de la PAS por debajo de 90 mmHg.
- Hipotensión ortostática.
- Se ha descrito el desarrollo de tolerancia y de tolerancia cruzada con otros nitratos.
Para evitar una posible reacción de retirada de nitratos, la supresión del tratamiento no se hará nunca bruscamente, sino que se disminuirá progresivamente la dosis y se alargarán los intervalos de administración.
Como cualquier otro medicamento con nitratos, cuando se cambia el tratamiento de larga duración del paciente a otro medicamento, se debe retirar gradualmente la nitroglicerina y se debe solapar con el nuevo tratamiento.
No se debe interrumpir el tratamiento con nitroglicerina por la toma de inhibidores de la fosfodiesterasa (p.ej. sildenafilo, tadalafilo, vardenafilo), porque al hacer esto se incrementa el riesgo de un episodio de angina de pecho (ver secciones 4.3. y 4.5.). Se debe informar a los pacientes que se encuentran bajo un tratamiento de mantenimiento con parches de nitroglicerina, de que no deben utilizar inhibidores de la fosfodiesterasa (sildenafilo, tadalafilo, vardenafilo), ni durante los periodos sin parche.
En caso de infarto de miocardio reciente o insuficiencia cardiaca aguda, Nitroplast deberá utilizarse bajo estricto control médico y monitorizando los parámetros hemodinámicos.
Nitroplast no es el tratamiento apropiado para el tratamiento del síndrome coronario agudo.
Si aparece hipotensión, sobre todo ortostática, mareos o sensación de debilidad, síntomas que pueden sugerir sobredosificación, hay que reducir la dosis. En los pacientes que desarrollan una hipotensión significativa, se debe considerar la retirada del parche.
Hipoxemia
Se debe tener precaución en pacientes con hipoxemia arterial debida a anemia grave (incluyendo formas debidas a la deficiencia de G6PD), porque en estos pacientes la biotransformación de la nitroglicerina está reducida.
De la misma forma, se debe tener precaución en pacientes con hipoxemia y alteración del equilibrio de ventilación/perfusión debida a enfermedad pulmonar o miocardiopatía isquémica. En pacientes con hipoventilación alveolar (como los pacientes con angina de pecho, infarto de miocardio o isquemia cerebral que padecen frecuentemente de anomalías de las vías respiratorias pequeñas, especialmente hipoxia alveolar), se produce una vasoconstricción dentro del pulmón para desplazar la perfusión desde áreas de hipoxia alveolar a regiones mejor ventiladas del pulmón (mecanismo de Euler-Liljestrand). La nitroglicerina, un potente vasodilatador, puede revertir esta vasoconstricción protectora y así producir un incremento de la perfusión en las áreas pobremente ventiladas, empeorando el equilibrio ventilación/perfusión, y una disminución adicional en la presión arterial parcial de oxígeno.
Miocardiopatía hipertrófica
El tratamiento con nitratos puede empeorar la angina de pecho debida a la miocardiopatía hipertrófica.
Aumento de la frecuencia de angina de pecho
ílMt
ÍTTI
Se tiene que tener en cuenta la posibilidad de un aumento de la frecuencia de angina de pecho durante el intervalo de tiempo sin parche. En estos casos, se debe considerar otro tratamiento antianginoso concomitante.
Tolerancia a la nitroglicerina sublingual
Como se desarrolla tolerancia a los parches de nitroglicerina, puede disminuir parcialmente el efecto de la nitroglicerina sublingual por la tolerancia desarrollada.
Nitroplast no contiene aluminio ni otros metales, y por lo tanto no es necesario retirar el parche antes de practicar una resonancia magnética de imagen (RMI) o maniobras de cardioversión, porque no existe riesgo de quemaduras en la piel debidas al parche adherido.
4.5 Interacción con otros medicamentos y otras formas de interacción
El tratamiento concomitante con otros vasodilatadores, por ejemplo, inhibidores de la fosfodiesterasa 5 (sildenafilo, tadalafilo, vardenafilo), antagonsitas del calcio, inhibidores de la ECA, betabloqueantes, diuréticos, antihipertensivos, antidepresivos tricíclicos y neurolépticos, así como el alcohol, pueden potenciar el efecto hipotensor de Nitroplast.
El uso de Nitroplast junto con inhibidores de la fosfodieterasa 5 (PDE5) puede causar complicaciones cardiovasculares que pongan en riesgo la vida del paciente. Interrumpir el tratamiento con nitroglicerina por la toma de medicamentos que contienen inhibidores de la PDE5 incrementa el riesgo de un episodio de angina de pecho. Los pacientes que están en tratamiento con parches de nitroglicerina no deben usar inhibidores de PDE5 (por ejemplo, sildenafilo, vardenafilo, tadalafilo) ni durante los periodos sin parche.
La administración simultánea de Nitroplast con dihidroergotamina, puede aumentar la biodisponibilidad de la dihidroergotamina y por tanto, aumentar sus niveles plasmáticos. Es necesaria una especial atención en pacientes con enfermedad arterial coronaria, porque la dihidroergotamina antagoniza el efecto de la nitroglicerina y puede conducir a una vasoconstricción coronaria.
Los medicamentos antiinflamatorios no esteroideos (AINEs), excepto el ácido acetilsalicílico, pueden disminuir la respuesta terapéutica de Nitroplast.
La administración simultánea de Nitroplast con amifostina y ácido acetilsalicílico pueden potenciar los efectos reductores de la presión sanguínea de Nitroplast.
En los pacientes ya tratados con nitratos orgánicos puede ser necesaria una dosis superior de nitroglicerina para alcanzar el efecto deseado.
No puede excluirse una interacción entre la nitroglicerina y la heparina (posible resistencia a la heparina inducida por la nitroglicerina).
4.6 Fertilidad, embarazo y lactancia
Embarazo
Estudios toxicológicos sobre la reproducción y el desarrollo, llevados a cabo en ratas y conejos por distintas vías de administración, no han puesto de manifiesto ningún efecto sobre los embriones, los
"I
an
fetos, o los animales jóvenes, incluso a dosis tóxicas para las madres.
Los estudios de reproducción realizados en ratas y conejos con nitroglicerina aplicada por vía tópica a dosis de hasta 80 mg/kg/día y 240 mg/kg/día respectivamente no han mostrado evidencia de daño para el feto debido a la nitroglicerina.
Sin embargo, no se dispone de estudios adecuados y bien controlados en mujeres embarazadas. Como cualquier otro medicamento, Nitroplast debe emplearse con precaución durante el embarazo, especialmente en los 3 primeros meses.
Lactancia
Hay información limitada sobre la secreción de la sustancia activa en la leche humana o animal. No se puede excluir el riesgo para los lactantes.
Se debe decidir si es necesario interrumpir la lactancia o interrumpir el tratamiento tras considerar el beneficio de la lactancia para el niño y el beneficio del tratamiento para la madre.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
Nitroplast, especialmente al inicio del tratamiento o al ajustar la dosis, puede afectar a la capacidad de reacción o raramente puede causar hipotensión ortostática y mareo (como también excepcionalmente síncope después de una sobredosis). Los pacientes que sufran alguno de estos efectos deben evitar conducir vehículos o utilizar máquinas.
4.8 Reacciones adversas
Las reacciones adversas se presentan en orden decreciente de gravedad dentro de cada intervalo de frecuencia. Las reacciones adversas se han clasificado en función de la frecuencia según la siguiente convención: muy frecuentes (> 1/10); frecuentes (> 1/100 a < 1/10); poco frecuentes (> 1/1.000 a < 1/100); raras (> 1/10.000 a < 1/1.000); muy raras (< 1/10.000); frecuencia no conocida: no puede estimarse por los datos disponibles.
Durante el tratamiento con Nitroplast se han observado las siguientes reacciones adversas clasificadas por órganos o sistemas:
- Trastornos del sistema nervioso Frecuentes: cefalea.
Muy raras: mareos.
- Trastornos cardíacos Raras: taquicardia.
Frecuencia no conocida: palpitación.
- Trastornos vasculares
Raras: hipotensión ortostática, rubor.
- Trastornos gastrointestinales Muy frecuentes: náuseas, vómitos.
- Trastornos de la piel y del tejido subcutáneo Poco frecuentes: dermatitis de contacto. Frecuencia no conocida: erupción generalizada.
- Trastornos generales y alteraciones en el lugar de administración
Poco frecuentes: eritema en el lugar de aplicación, prurito, quemazón, irritación.
- Exploraciones complementarias
Raras: aumento de la frecuencia cardiaca.
Como con otros medicamentos con nitratos, con frecuencia Nitroplast provoca dolores de cabeza dosis dependientes debido a la vasodilatación cerebral. Éstos desaparecen después de unos días a pesar del tratamiento de mantenimiento. Si el dolor de cabeza persiste durante el tratamiento intermitente, se debe tratar con analgésico suaves. Los dolores de cabeza sin respuesta son una indicación para reducir la dosis de nitroglicerina o interrumpir el tratamiento.
Una vez eliminado el parche, normalmente cualquier ligero enrojecimiento de la piel desaparecerá en unas pocas horas. Se debe cambiar regularmente el lugar de aplicación para prevenir irritaciones locales. Se puede evitar un ligero incremento reflejo en la frecuencia cardiaca recurriendo, si es necesario, a un tratamiento combinado con un beta-bloqueante.
Se han comunicado casos de hipotensión grave con el empleo de nitratos orgánicos, con náuseas, vómitos, inquietud, palidez y sudoración excesiva.
Durante el tratamiento con Nitroplast puede aparecer hipoxemia temporal como consecuencia de la relativa redistribución del flujo sanguíneo en las áreas alveolares hipoventiladas. Especialmente en los pacientes con enfermedad arterio-coronaria, este hecho puede conducir a una hipoxia miocárdica.
4.9 Sobredosis
• Experiencia, animal:
Los valores de DL50 observados en el ratón y la rata después de la administración de una dosis única por vía i.v., fueron de 10,6 mg/kg y 23,2 mg/kg, respectivamente.
Después de la administración de dosis únicas por vía subcutánea, se hallaron valores de DL50 de 94 mg/kg en la rata y de 110 mg/kg en el ratón.
• Experiencia humana - Síntomas
- Descenso de la presión arterial < 90 mmHg.
- Palidez.
- Sudoración.
- Pulso débil.
- Taquicardia.
í-*
aillos
ÍTTI
- Vértigo postural.
- Cefalea.
- Astenia.
- Mareo.
- Náuseas.
- Vómitos.
- Diarrea.
- Se ha registrado la aparición de metahemoglobinemia en pacientes que recibieron otros nitratos orgánicos. Durante la biotransformación de la nitroglicerina se liberan iones nitrito que pueden inducir metahemoglobinemia y cianosis con la aparición subsiguiente de taquipnea, ansiedad, pérdida de conciencia y parada cardiaca. No puede excluirse que una sobredosis de nitroglicerina pueda originar esta reacción adversa.
- Con dosis muy elevadas puede aumentar la presión intracraneal, con la consiguiente aparición de síntomas cerebrales.
Por vía transdérmica, no obstante, una sobredosis por nitroglicerina es improbable que aparezca.
- Tratamiento
Medidas generales:
- Retirar el parche.
- En caso de hipotensión relacionada con los nitratos:
- colocar al paciente en posición horizontal con las piernas elevadas o si es necesario un vendaje de compresión en las piernas del paciente.
- administración de oxígeno
- sustitutos del plasma
- si aparece shock (ingreso en una unidad de cuidados intensivos).
Medidas especiales:
- Incremento de la presión arterial cuando se haya producido un marcado descenso.
- Administración de vasoconstrictores (p.ej., norepinefrina).
- Tratamiento de la metahemoglobinemia:
- administración de vitamina C, azul de metileno o azul de toluidina
- oxígeno (si es necesario)
- ventilación asistida
- hemodiálisis (si es necesario).
- Medidas de reanimación
En caso de signos de parada cardiorespiratoria iniciar inmediatamente medidas de reanimación.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Vasodilatadores usados en enfermedades cardiacas. Nitratos orgánicos Código ATC: C01D A02
Desde el punto de vista hemodinámico, la principal actividad de la nitroglicerina y de los nitratos orgánicos en general es la relajación de la musculatura lisa vascular, que se traduce en una intensa vasodilatación venosa central y, en menor grado, arterial periférica. Esta vasodilatación tiene como consecuencia una disminución de la precarga y postcarga cardiacas, mejorando el trabajo del
ÍTTI
corazón y sus requerimientos de oxígeno. Se regulariza así el balance demanda/consumo que cuando está alterado origina la crisis de angina.
Asimismo, la vasodilatación, al incidir en las coronarias, actúa sobre los flujos epicárdicos y subendocárdicos aumentando el caudal circulatorio y facilitando un mayor aporte de oxígeno al miocardio.
5.2 Propiedades farmacocinéticas
Absorción
Nitroplast es un sistema transdérmico que libera el principio activo, la nitroglicerina, con un perfil característico de liberación. Durante el periodo en el que dicho sistema permanece en el lugar de aplicación, el promedio de la dosis de nitroglicerina liberada a la piel por los distintos parches es la siguiente: Nitroplast 5: 5 mg a lo largo de 24 horas, que corresponde a 0,2 mg/h. Nitroplast 10: 10 mg en 24 horas, que corresponde a 0,4 mg/h. Nitroplast 15: 15 mg en 24 horas, que corresponde a 0,6 mg/h.
Biodisponibilidad
Después de la administración oral, la nitroglicerina está sujeta a un importante efecto de primer paso, presentando una biodisponibilidad inferior al 1%. Sin embargo, en Nitroplast se absorbe a través de la piel, evitando el tracto gastrointestinal y el efecto de primer paso hepático. Como resultado, la biodisponibilidad es más elevada (alrededor del 55%).
Distribución
Se alcanzan concentraciones eficaces de nitroglicerina aproximadamente después de una hora de la aplicación de Nitroplast. Por término medio, las concentraciones plasmáticas máximas aparecen al cabo de 2-4 horas.
La concentración plasmática en estado estacionario depende de la dosis aplicada y del correspondiente ritmo de absorción. Con un ritmo de absorción de 0,4 mg/h, la concentración media en estado estacionario es de 0,2qg/l.
El lugar de la aplicación del parche (antebrazo, tórax, cadera) no influye en la concentración plasmática.
Si la liberación del fármaco se interrumpe (lo cual puede producirse en cualquier momento por retirada del parche), la concentración plasmática de nitroglicerina desciende rápidamente.
La unión a proteínas plasmáticas es de alrededor del 60%.
Metabolismo o Biotransformación
El metabolismo de la nitroglicerina, que tiene lugar en el hígado, pero también en muchas otras células (como p.ej. los glóbulos rojos), incluye el aclaramiento de uno o más grupos nitrato. El fármaco se metaboliza de forma muy rápida y casi por completo en el organismo.
Por vía ezimática, la nitroglicerina es desnitrada de forma gradual a dinitratos y mononitratos de glicerilo y finalmente a glicerol. El enzima necesario para llevar a cabo este proceso es el glutatión-S transferasa presente en muchos tejidos. El glicerol se integra en el metabolismo intermedio (síntesis de proteínas, glucógeno, lípidos y ácido ribonucleico) y es en parte oxidado hasta CO2 y espirado.
Los dinitratos y mononitratos de glicerol son también glucuronizados y excretados en la orina, y en menor proporción en la bilis. La mayor parte de la información metabólica de la nitroglicerina se ha obtenido de los estudios en animales. Ha sido posible la detección de mononitratos en la orina humana.
Eliminación
La vida media de eliminación de la nitroglicerina es de 2-4 min. El metabolismo del fármaco se acompaña de la excreción renal de los metabolitos.
5.3 Datos preclínicos sobre seguridad
La nitroglicerina es una sustancia conocida. Por lo tanto, únicamente se ha llevado a cabo un estudio preclínico en cobayas para valorar las propiedades sensibilizantes del parche (método según Bühler, E.V.). Los resultados del ensayo revelaron la ausencia de signos de sensibilización así como también de irritaciones dérmicas locales.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
El parche Nitroplast (sistema matricial) está compuesto de tres partes principales:
-Capa portadora dorsal de polipropileno que no está en contacto con la piel.
-Matriz adhesiva de acrilato (copolímero acrilato/acetato de vinilo) que contiene la nitroglicerina diluida.
-Capa protectora de polietileno de alta densidad y siliconada que se retira antes de su uso.
6.2 Incompatibilidades
No se han descrito.
6.3 Periodo de validez
Nitroplast 5 mg parches transdérmicos: 4 años.
Nitroplast 10 mg parches transdérmicos: 4 años.
Nitroplast 15 mg parches transdérmicos: 4 años.
6.4 Precauciones especiales de conservación
No almacenar a temperatura superior a 25°C.
.-ítp.
ÍTTI
6.5 Naturaleza y contenido del envase
Cajas con 7, 30 y 500 (envase clínico) parches transdérmicos, envasados individualmente en sobres termosellados formados por un complejo a base de papel, polietileno, aluminio e ionómero-Surlyn.
6.6 Precauciones especiales de eliminación e instrucciones especiales de uso/manipulación
Dosificación de acuerdo con la indicación autorizada:
El tratamiento deberá ajustarse lo máximo posible a las necesidades de cada paciente de acuerdo con la gravedad del proceso a tratar y con la respuesta individual al tratamiento.
Las recomendaciones generales a seguir son las siguientes:
Para el tratamiento a largo plazo de la enfermedad coronaria y prevención de la angina de pecho, se aplicará de inicio un parche de Nitroplast cada mañana. Si es necesario, puede aumentarse la dosis (dos parches simultáneamente).
Al igual que ocurre con los demás nitratos, el efecto de Nitroplast puede disminuir en algunos pacientes que reciben tratamiento durante periodos prolongados. En éstos se aconseja retirar el parche antes de que vayan a acostarse por la noche. No obstante, los pacientes que experimentan crisis de angina mayoritariamente por la noche, únicamente deben llevar un parche por la noche.
Con el fin de proteger a los pacientes de los ataque de angina, el tratamiento con Nitroplast no debe interrumpirse bruscamente.
¿En qué lugar del cuerpo debe aplicarse el parche?:
Siempre y cuando no se aplique en una zona de la piel demasiado gruesa o mal irrigada, Nitroplast es eficaz mientras permanece aplicado. Para evitar irritaciones de la piel, se recomienda aplicar el parche en diferentes áreas cada día, procurando no utilizar la misma zona hasta transcurridos por lo menos 2-3 días. La zona más recomendada para la aplicación del parche es la parte frontal y lateral del pecho. Sin embargo puede también aplicarse en el antebrazo, muslo, abdomen y hombro (figura 1).
Lugar de aplicación en la piel:
La zona de la piel en la que debe aplicarse Nitroplast debe estar sana, sin heridas, relativamente libre de arrugas y con poco vello.
- Nitroplast no debe aplicarse sobre la piel dañada o lesionada.
- Nitroplast se adhiere mejor si se aplica en una zona de piel que no esté sujeta a rozaduras cuando el paciente se mueve.
- Nitroplast no debe aplicarse en una zona con mucho vello. No es aconsejable afeitar la piel ni recortar el vello con unas tijeras, porque cuando vuelva a crecer el vello, puede hacer caer el parche de la piel.
El lugar de aplicación debe estar limpio y seco antes de la utilización de Nitroplast.
- Antes de utilizar Nitroplast debe lavarse la piel. Es suficiente agua y jabón. No es necesario utilizar otros agentes, como por ejemplo alcohol.
- Después de ducharse o bañarse, no se aplicará Nitroplast hasta que el cuerpo se haya enfriado a la temperatura normal y la piel esté totalmente seca. Si Nitroplast ya está colocado antes de
*
mi
m
bañarse, ducharse o nadar, generalmente se adhiere firmemente a la piel y continúa funcionando con normalidad. No obstante, para mayor seguridad, es aconsejable advertir al paciente que no esté en el agua durante mucho tiempo.
No se deben utilizar productos para el cuidado de la piel antes de la aplicación de Nitroplast.
- Los cosméticos (aceites, cremas, lociones, etc), no se utilizarán en la zona de la piel en la que vaya a aplicarse Nitroplast, ya que podría dificultar la correcta adhesión del parche.
Aplicación de Nitroplast:
Cada parche va envasado en una bolsa individual y no debe extraerse de la misma hasta que vaya a utilizarse. La bolsa precintada se rompe fácilmente a través de una hendidura en el borde (figura 2).
Se retira el parce de la bolsa y se sostiene con ambas manos con la lámina protectora hacia arriba.
A continuación se baja una mitad del parche, con lo que se abre el corte en forma de S. Una mitad de esta lámina ya puede ser entonces separada. La superficie adhesiva no debe tocarse (figura 3).
A continuación se aplica el parche en el área ya dispuesta y se elimina la otra mitad de la capa protectora (figura 4).
Seguidamente se presiona fuertemente el parche con la mano para asegurar que la totalidad de la superficie adhesiva se adhiera fuertemente a la piel (figura 5).
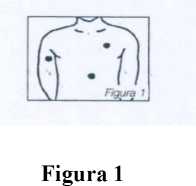
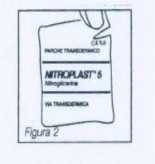
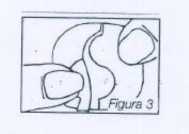
Figura 3
Figura 2
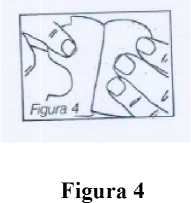
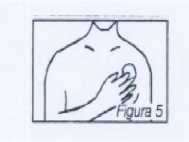
Figura 5
ílMt
ÍTTI
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
LACER, S.A.
Sardenya, 350
08025 Barcelona (España)
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
Nitroplast 5 mg parches transdérmicos, N° Reg 58.568 Nitroplast 10 mg parches transdérmicos, N° Reg 58.567 Nitroplast 15 mg parches transdérmicos, N° Reg 62.264
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Nitroplast 5 mg parches transdérmicos Nitroplast 10 mg parches transdérmicos 08 de Abril de 1991
Última revalidación: 26 de Enero de 2006 Nitroplast 15 mg parches transdérmicos 26 de Noviembre de 1998 Última revalidación: 27 de Mayo de 2008
10. FECHA DE LA REVISIÓN DEL TEXTO
Marzo 2013
12 de 12