Nimenrix Polvo Y Disolvente Para Solucion Inyectable En Jeringa Precargada
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas. Ver la sección 4.8, en la que se incluye información sobre cómo notificarlas.
1. NOMBRE DEL MEDICAMENTO
Nimenrix polvo y disolvente para solución inyectable en jeringa precargada Vacuna conjugada frente a meningococo de los grupos A, C, W-135 e Y
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Tras la reconstitución, 1 dosis (0,5 ml) contiene:
5 microgramos 5 microgramos 5 microgramos 5 microgramos
44 microgramos
Polisacárido de Neisseria meningitidis del grupo A1 Polisacárido de Neisseria meningitidis del grupo C1 Polisacárido de Neisseria meningitidis del grupo W-1351 Polisacárido de Neisseria meningitidis del grupo Y1
1conjugado con toxoide tetánico como proteína transportadora
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Polvo y disolvente para solución inyectable. El polvo es blanco.
El disolvente es transparente e incoloro.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Nimenrix está indicado para la inmunización activa de personas a partir de 12 meses de edad frente a enfermedad meningocócica invasiva causada por Neisseria meningitidis de los grupos A, C, W-135, e Y.
4.2 Posología y forma de administración
Posología
Nimenrix debe utilizarse de acuerdo con las recomendaciones oficiales.
Administrar una única dosis de 0,5 ml de la vacuna reconstituida para la inmunización.
Nimenrix puede administrarse como una dosis de recuerdo a personas que hayan recibido previamente una primovacunación con Nimenrix u otras vacunas meningocócicas polisacarídicas conjugadas o no conjugadas (ver secciones 4.4. y 5.1).
Una segunda dosis de Nimenrix puede considerarse apropiada para algunos sujetos (ver sección 4.4).
Población pediátrica
No se ha establecido todavía la seguridad y eficacia de Nimenrix en niños menores de 12 meses de edad.
No se dispone de datos.
Forma de administración
La inmunización debe realizarse únicamente mediante una inyección intramuscular, preferiblemente en el músculo deltoides.
En niños de 12 a 23 meses de edad la vacuna también puede administrarse en la zona anterolateral del muslo (ver secciones 4.4 y 4.5).
Para consultar las instrucciones de reconstitución del medicamento antes de la administración, ver sección 6.6.
4.3 Contraindicaciones
Hipersensibilidad a los principios activos o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
Nimenrix no debe administrarse por vía intravascular, intradérmica o subcutánea bajo ninguna circunstancia.
Antes de la vacunación, se considera una buena práctica clínica realizar una revisión de la historia clínica (en particular respecto a las vacunaciones anteriores y a la posible aparición de reacciones adversas) y una exploración física.
Se debe disponer en todo momento del tratamiento y supervisión médica adecuados, para el caso poco común de aparición de una reacción anafiláctica tras la administración de la vacuna.
Enfermedad concomitante
Se debe posponer la administración de Nimenrix en sujetos que padezcan enfermedades febriles agudas graves. Una infección leve, como un resfriado, no debería retrasar la vacunación.
Síncope
Después de cualquier vacunación, o incluso antes, se puede producir, especialmente en adolescentes, un síncope (desfallecimiento) como una reacción psicógena a la inyección de la aguja. Durante la recuperación, éste puede ir acompañado de varios signos neurológicos tales como déficit visual transitorio, parestesia y movimientos tónico clónicos en los miembros. Es importante que se disponga de procedimientos para evitar daños causados por las pérdidas de conocimiento.
Trombocitopenia y trastornos de la coagulación
Nimenrix se debe administrar con precaución en personas con trombocitopenia u otros trastornos de la coagulación, ya que puede producirse una hemorragia tras la administración intramuscular en estos sujetos.
Inmunodeficiencia
Cabe la posibilidad de que en pacientes que reciben tratamiento inmunosupresor o que padecen una inmunodeficiencia no se genere una respuesta inmune protectora.
No se han evaluado la seguridad e inmunogenicidad en pacientes con mayor susceptibilidad de padecer una infección meningocócica debido a enfermedades tales como deficiencias de componentes terminales del complemento y asplenia funcional o anatómica. Puede que en estos individuos no se genere una respuesta inmune protectora.
Protección frente a la enfermedad meningocócica
Nimenrix únicamente confiere protección frente a Neisseria meningitidis de los grupos A, C, W-135 e Y. La vacuna no protege frente a Neisseria meningitidis de otros grupos.
Puede que no se genere una respuesta inmune protectora en todos los vacunados.
Efecto de la vacunación previa con la vacuna meningocócica polisacarídica no conjugada Los sujetos vacunados con Nimenrix entre 30 y 42 meses después de haber recibido una vacuna meningocócica polisacarídica no conjugada, tuvieron una Media Geométrica de los Títulos (GMT en inglés), determinada mediante la prueba de actividad bactericida del suero con complemento de conejo (ABSc), inferior a la de los sujetos que no habían sido vacunados con ninguna vacuna meningocócica en los 10 años anteriores (ver sección 5.1). Se desconoce la relevancia clínica de este resultado.
Efecto de la vacunación previa con vacuna que contenga toxoide tetánico Se ha evaluado la seguridad e inmunogenicidad de Nimenrix cuando se administra de forma secuencial o simultánea con una vacuna DTPa-VHB-IPV/Hib durante el segundo año de vida. La administración de Nimenrix un mes después de la vacuna DTPa-VHB-IPV/Hib dio lugar a GMTs de ABSc inferiores, frente a los grupos A, C y W-135 en comparación con la administración conjunta (ver sección 4.5). Se desconoce la relevancia clínica de este resultado.
Respuesta inmune en niños de 12-14 meses
Los niños de 12-14 meses presentaron respuestas ABSc similares frente a los grupos A, C, W-135 e Y un mes después de una dosis de Nimenrix o un mes después de dos dosis de Nimenrix administradas con un intervalo de dos meses. En el ensayo de actividad bactericida del suero con complemento humano (ABSh), una única dosis se relacionó con títulos inferiores frente a los grupos W-135 e Y en comparación con dos dosis de Nimenrix administradas con un intervalo de dos meses. Se observaron respuestas similares frente a los grupos A y C después de una o dos dosis (ver sección 5.1). Se desconoce la relevancia clínica de estos resultados. Se puede considerar la administración de una segunda dosis de Nimenrix, tras un intervalo de dos meses a niños que tengan un riesgo aumentado de enfermedad meningocócica invasiva debido a la exposición a los grupos W-135 e Y. Respecto a la disminución de anticuerpos frente al grupo A o grupo C tras la primera dosis de Nimenrix en niños de 12-23 meses, ver el apartado “Persistencia de los títulos de anticuerpos bactericidas séricos”.
Persistencia de los títulos de anticuerpos bactericidas séricos
Tras la administración de Nimenrix se produce una disminución de los títulos de anticuerpos bactericidas séricos frente al grupo A cuando se utilizaba complemento humano en el ensayo (ABSh) (ver sección 5.1). Se desconoce la relevancia clínica de la disminución de los títulos de anticuerpos ABSh frente al grupo A. Sin embargo, se puede considerar la administración de una dosis de recuerdo a sujetos que tengan un riesgo aumentado de exposición al grupo A y que previamente hayan recibido una dosis de Nimenrix hace aproximadamente más de un año.
Se ha observado una disminución en los títulos de anticuerpos con el paso del tiempo para los grupos A, C, W-135 e Y. Se desconoce la relevancia clínica de la disminución de los títulos de anticuerpos.
Se puede considerar una dosis de recuerdo en sujetos vacunados entre los 12-23 meses que permanezcan en elevado riesgo de exposición a la enfermedad meningocócica producida por los grupos A, C, W-135 o Y (ver sección 5.1).
Efecto de Nimenrix sobre las concentraciones de anticuerpos antitetánicos
A pesar de que se observó un incremento de la concentración de anticuerpos anti-toxoide tetánico (TT) tras la vacunación con Nimenrix, Nimenrix no es un sustituto de la inmunización antitetánica.
La administración de Nimenrix al mismo tiempo o un mes antes que una vacuna que contiene TT durante el segundo año de vida no perjudica la respuesta a TT o afecta su seguridad de forma significativa. No se dispone de datos más allá de los 2 años de edad.
4.5 Interacción con otros medicamentos y otras formas de interacción
Nimenrix puede administrarse simultáneamente con cualquiera de las siguientes vacunas: vacunas de la hepatitis A (VHA) y de la hepatitis B (VHB), vacuna de sarampión, rubeola y parotiditis (SRP, triple vírica), vacuna sarampión, rubeola, parotiditis y varicela (SRPV), vacuna conjugada antineumocócica 10-valente o vacuna antigripal estacional no adyuvada.
Nimenrix también puede administrarse simultáneamente con las vacunas combinadas de difteria, tétanos y pertussis acelular en el segundo año de vida, incluyendo combinaciones de vacunas DTPa con hepatitis B, polio inactivada o Haemophilus influenzae tipo b, tales como la vacuna DTPa-VHB-IPV/Hib.
Siempre que sea posible, Nimenrix y una vacuna que contenga TT, como la vacuna DTPa-VHB-IPV/Hib, deben administrarse simultáneamente o Nimenrix debe administrarse al menos un mes antes de la vacuna que contenga TT. La administración secuencial de Nimenrix un mes después de la vacuna DTPa-VHB-IPV/Hib dio lugar a GMTs inferiores para anticuerpos frente a los grupos A, C y W-135. Se desconoce la relevancia clínica de este resultado, ya que al menos el 99,4% de los sujetos (N=178) alcanzó títulos ABSc > 8 para cada grupo (A, C, W-135, Y) (ver sección 4.4).
Un mes después de la administración simultánea con una vacuna conjugada antineumocócica 10-valente, se observaron Concentraciones Medias Geométricas de anticuerpos (GMCs) y GMTs del ensayo de anticuerpos opsonofagocíticos (OPA) menores para un serotipo neumocócico (18C conjugado con toxoide tetánico como proteína trasportadora). Se desconoce la relevancia clínica de este resultado. La administración simultánea no tuvo efecto sobre ninguno de los otros nueve serotipos neumocócicos.
Si Nimenrix se va a administrar al mismo tiempo que otra vacuna inyectable, las vacunas siempre deberán administrarse en distintos lugares de inyección.
Es posible que en pacientes que reciben terapia inmunosupresora, no se genere una respuesta adecuada.
4.6 Fertilidad, embarazo y lactancia
Embarazo
La experiencia respecto al uso de Nimenrix en mujeres embarazadas es limitada.
Los estudios en animales no sugieren efectos perjudiciales directos ni indirectos sobre el embarazo, el desarrollo embrionario o fetal, el parto o el desarrollo post-natal (ver sección 5.3).
Nimenrix sólo debe administrarse durante el embarazo cuando sea claramente necesario y los posibles beneficios superen los riesgos potenciales para el feto.
Lactancia
Se desconoce si Nimenrix se excreta en la leche materna.
Nimenrix sólo debe administrarse durante la lactancia cuando los posibles beneficios superen los riesgos potenciales.
Fertilidad
Los estudios en animales no sugieren efectos perjudiciales, directos o indirectos, sobre la fertilidad.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No se han realizado estudios acerca de los efectos de Nimenrix sobre la capacidad para conducir y utilizar máquinas. Sin embargo, algunos de los efectos mencionados en la sección 4.8 “Reacciones adversas” pueden afectar la capacidad para conducir o utilizar máquinas.
4.8 Reacciones adversas
Resumen del perfil de seguridad
El perfil de seguridad que se presenta a continuación está basado en un análisis combinado de 9.621 sujetos que fueron vacunados con una dosis de Nimenrix en los ensayos clínicos. Este análisis combinado incluye datos de 3.079 niños (de 12 meses a 23 meses), 909 niños entre 2 y 5 años, 990 niños entre 6 y 10 años, 2.317 adolescentes (entre 11 y 17 años) y 2.326 adultos (entre 18 y 55 años).
En todos los grupos de edad las reacciones adversas locales que se notificaron con más frecuencia tras la vacunación fueron dolor (entre 24,1% y 41,3%), enrojecimiento (entre 15,5% y 35,6%) e inflamación (entre 11,3% y 19,9%).
En los grupos de edad de 12-23 meses y de 2-5 años, las reacciones adversas generales que se notificaron con más frecuencia tras la vacunación fueron irritabilidad (44,0% y 9,2% respectivamente), somnolencia (34,1% y 10,8% respectivamente), pérdida de apetito (26,6% y 8,2% respectivamente) y fiebre (17,1% y 8,1% respectivamente).
En el grupo de edad de 12-14 meses que recibió 2 dosis de Nimenrix administradas con un intervalo de dos meses, la primera y segunda dosis se relacionaron con una reactogenicidad local y sistémica similar.
En los grupos de edad de 6-10, de 11-17 y >18 años, las reacciones adversas generales que se notificaron con más frecuencia tras la vacunación fueron cefalea (15,7%, 22,0% y 21,5% respectivamente), fatiga (15,6%, 21,9% y 20,7% respectivamente), síntomas gastrointestinales (9,3%, 9,4% y 8,3% respectivamente) y fiebre (8,0%, 5,3% y 4,9% respectivamente).
El perfil de reacciones adversas locales y generales de una dosis de recuerdo de Nimenrix después de la primovacunación con Nimenrix u otras vacunas meningocócicas polisacarídicas conjugadas o no conjugadas, fue similar al perfil de reacciones adversas locales y generales observado después de la primovacunación con Nimenrix, excepto en los síntomas gastrointestinales (incluida la diarrea, los vómitos y las náuseas), que fueron muy frecuentes.
En un estudio aparte se administró una única dosis de Nimenrix a 274 individuos a partir de 56 años de edad. Todas las reacciones adversas notificadas en este estudio ya fueron observadas en los grupos de edad más jóvenes.
Tabla de reacciones adversas
Las reacciones adversas notificadas se listan de acuerdo con la siguiente categoría de frecuencias:
Muy frecuentes: Frecuentes:
(>1/10)
(>1/100 a <1/10)
(>1/1.000 a <1/100) (>1/10.000 a <1/1.000) (<1/10.000)
|
Sistema de clasificación de Órganos |
Frecuencia |
Reacciones adversas |
|
Ensayos clínicos | ||
|
Trastornos del metabolismo y de la nutrición |
Muy frecuentes |
Pérdida de apetito |
|
Trastornos psiquiátricos |
Muy frecuentes |
Irritabilidad |
|
Poco frecuentes |
Imsomnio, llanto incontenible | |
|
Trastornos del sistema nervioso |
Muy frecuentes |
Adormecimiento, cefalea |
|
Poco frecuentes |
Hipoestesia, mareo | |
|
Trastornos gastrointestinales |
Frecuentes |
Síntomas gastrointestinales (incluyendo diarrea, vómitos y náuseas) |
|
Trastornos de la piel y del tejido subcutáneo |
Poco frecuentes |
Prurito, erupción |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Poco frecuentes |
Mialgia, dolor en la extremidad |
|
Trastornos generales y alteraciones en el lugar de administración |
Muy frecuentes |
Fiebre, inflamación, dolor y enrojecimiento en el lugar de inyección, fatiga |
|
Frecuentes |
Hematoma en el lugar de inyección | |
|
Poco frecuentes |
Malestar general, reacción en el lugar de inyección, (incluyendo induración, prurito, calor, anestesia) | |
|
Experiencia post-comercialización | ||
|
Trastornos generales y alteraciones en el lugar de administración |
Raras |
Hinchazón extensa de la extremidad en el lugar de inyección, frecuentemente asociado con eritema, algunas veces afectando a la articulación adyacente o hinchazón en toda la extremidad donde se administra la vacuna |
Poco frecuentes: Raras:
Muy raras:
Notificación de sospechas de reacciones adversas
. Se invita a los sistema nacional
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento profesionales sanitarios a notificar las sospechas de reacciones adversas a través del de notificación incluido en el Apéndice V.
4.9 Sobredosis
No se ha notificado ningún caso de sobredosis.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: vacunas, vacunas meningocócicas, código ATC: J07AH08 Mecanismo de acción
Los anticuerpos meningocócicos anticapsulares protegen frente a las enfermedades meningocócicas a través de la actividad bactericida mediada por el complemento. Nimenrix induce la producción de
anticuerpos bactericidas frente a polisacáridos capsulares de los grupos A, C, W-135 e Y, que se determina mediante ensayos que utilizan complemento de conejo (ABSc) o complemento humano (ABSh).
Efectos farmacodinámicos
Inmunogenicidad
La inmunogenicidad de una dosis de Nimenrix ha sido evaluada en más de 8.000 sujetos > 12 meses.
La eficacia de la vacuna se asumió a partir de la demostración de la no inferioridad inmunológica (fundamentalmente basada en comparar proporciones con títulos de ABSc de al menos 8) frente a otras vacunas meningocócicas autorizadas. La inmunogenicidad se determinó utilizando ABSc o ABSh como marcadores biológicos de eficacia protectora frente a los grupos meningocócicos A, C, W-135 e Y.
Persistencia de la respuesta inmune
Se evaluó la persistencia de la respuesta inmune inducida por Nimenrix hasta 60 meses después de la vacunación en sujetos de los 12 meses a los 55 años de edad.
Los anticuerpos inducidos por Nimenrix fueron similares o superiores a los inducidos por las vacunas meningocócicas autorizadas (es decir, la vacuna MenC-CRM en sujetos de 12-23 meses y la vacuna ACWY-PS en sujetos mayores de 2 años).
Respuesta de recuerdo
En los ensayos clínicos se evaluó el uso de Nimenrix como una dosis de recuerdo después de la primovacunación con Nimenrix u otras vacunas meningocócicas (vacuna conjugada meningocócica tetravalente frente a los grupos A, C, W e Y-DT o vacunas conjugadas monovalentes grupo C).
Lactantes
Inmunogenicidad en niños de 12-23 meses
En los ensayos clínicos MenACWY-TT-039 y MenACWY-TT-040, una única dosis de Nimenrix indujo respuestas de ABSc frente a los cuatro grupos meningocócicos, con una respuesta frente al grupo C comparable a la inducida por la vacuna autorizada MenC-CRM, en términos de porcentajes con títulos de ABSc > 8 (Tabla 1).
Tabla 1: Respuestas de anticuerpos bactericidas (ABSc*) en niños de 12-23 meses
|
Grupo |
Respuesta a |
Estudio MenACWY-TT-039 (1) |
Estudio MenACWY-TT-040 (2) | ||||
|
N |
>8 (IC 95%) |
GMT (IC 95%) |
N |
>8 (IC 95%) |
GMT (IC 95%) | ||
|
A |
Nimenrix |
354 |
99,7% (98,4; 100) |
2.205 (2.008; 2.422) |
183 |
98,4% (95,3; 99,7) |
3.170 (2.577; 3.899) |
|
C |
Nimenrix |
354 |
99,7% (98,4; 100) |
478 (437; 522) |
183 |
97,3% (93,7; 99,1) |
829 (672; 1.021) |
|
Vacuna MenC-CRM |
121 |
97,5% (92,9; 99,5) |
212 (170;265) |
114 |
98,2% (93,8; 99,8) |
691 (521; 918) | |
|
W-135 |
Nimenrix |
354 |
100% (99,0; 100) |
2.682 (2.453; 2.932) |
186 |
98,4% (95,4; 99,7) |
4.022 (3.269; 4.949) |
|
Y |
Nimenrix |
354 |
100% (99,0; 100) |
2.729 (2.473; 3.013) |
185 |
97,3% (93,8; 99,1) |
3.168 (2.522; 3.979) |
El análisis de inmunogenicidad se realizó en las cohortes por protocolo (PP) para la inmunogenicidad.
(1) muestras de sangre tomadas entre 42 y 56 días después de la vacunación
(2) muestras de sangre tomadas entre 30 y 42 días después de la vacunación *determinado en los laboratorios GSK
En el estudio MenACWY-TT-039, la actividad bactericida en suero también se determinó utilizando suero humano como fuente de complemento (ABSh) como variable secundaria (Tabla 2).
Tabla 2: Respuestas de anticuerpos bactericidas (ABSh*) en niños de 12-23 meses
|
Grupo |
Respuesta a |
N |
Estudio MenACWY-TT-039 (1) | |
|
>8 (IC 95%) |
GMT (IC 95%) | |||
|
A |
Nimenrix |
338 |
77,2% (72,4; 81,6) |
19,0 (16,4; 22,1) |
|
C |
Nimenrix |
341 |
98,5% (96,6; 99,5) |
196 (175; 219) |
|
Vacuna MenC-CRM |
116 |
81,9% (73,7; 88,4) |
40,3 (29,5; 55,1) | |
|
W-135 |
Nimenrix |
336 |
87,5% (83,5 ; 90,8) |
48,9 (41,2; 58,0) |
|
Y |
Nimenrix |
329 |
79,3% (74,5; 83,6) |
30,9 (25,8; 37,1) |
El análisis de inmunogenicidad se realizó en la cohorte por protocolo (PP) para la inmunogenicidad. (1) muestras de sangre tomadas entre 42 y 56 días después de la vacunación *determinado en los laboratorios GSK
En el estudio MenACWY-TT-104, se evaluó la respuesta inmune un mes después de la última vacunación después de una o dos dosis de Nimenrix administradas con un intervalo de dos meses. Nimenrix generó respuestas bactericidas frente a los cuatro grupos después de una o dos dosis similares en términos de % con títulos de ABSc >8 y GMT (Tabla 3).
Tabla 3: Respuestas de anticuerpos bactericidas (ABSc)* en niños de 12-14 meses
|
Grupo |
Respuesta a |
Tiempo |
Estudio MenACWY-TT-104 (1) | ||
|
N |
>8 (IC 95%) |
GMT (IC 95%) | |||
|
A |
Nimenrix 1 dosis |
Tras dosis 1 |
181 |
97,8% (94,4; 99,4) |
1445,4 (1126,1; 1855,2) |
|
Nimenrix 2 dosis |
Tras dosis 1 |
158 |
96,8% (92,8; 99,0) |
1275,2 (970,5; 1675,4) | |
|
Tras dosis 2 |
150 |
98,0% (94,3; 99,6) |
1176,3 (921,8; 1501) | ||
|
C |
Nimenrix 1 dosis |
Tras dosis 1 |
180 |
95,0% (90,7; 97,7) |
454,4 (347,7; 593,8) |
|
Nimenrix 2 dosis |
Tras dosis 1 |
157 |
95,5% (91,0; 98,2) |
369,3 (280,9; 485,5) | |
|
Tras dosis 2 |
150 |
98,7% (95,3; 99,8) |
639,1 (521,8; 782,9) | ||
|
W-135 |
Nimenrix 1 dosis |
Tras dosis 1 |
181 |
95,0% (90,8; 97,7) |
2136,1 (1614,9; 2825,5) |
|
Nimenrix 2 dosis |
Tras dosis 1 |
158 |
94,9% (90,3; 97,8) |
2030,1 (1510,7; 2728,2) | |
|
Tras dosis 2 |
150 |
100% (97,6; 100) |
3533 (2914,5; 4282,7) | ||
|
Y |
Nimenrix 1 dosis |
Tras dosis 1 |
181 |
92,8% (88,0; 96,1) |
955,8 (709,1; 1288,3) |
|
Nimenrix 2 dosis |
Tras dosis 1 |
157 |
93,6% (88,6; 96,9) |
933,3 (692,3; 1258,3) | |
|
Tras dosis 2 |
150 |
99,3% (96,3; 100) |
1133,6 (944,5; 1360,5) |
El análisis de inmunogenicidad se realizó en la cohorte por protocolo (PP) para la inmunogenicidad (1) muestras de sangre tomadas entre 21 y 48 días después de la vacunación *determinado en los laboratorios del “Public Health England”, Reino Unido
En el estudio MenACWY-TT-104, la actividad bactericida en suero también se determinó utilizando ABSh como variable secundaria. Nimenrix generó respuestas bactericidas frente a los grupos W-135 e Y, que fueron superiores en términos de % con títulos de ABSh >8 cuando se administraron dos dosis en comparación con una. Se observaron respuestas similares frente a los grupos A y C en términos de % con títulos de ABSh >8 (Tabla 4).
Tabla 4: Respuestas de anticuerpos bactericidas (ABSh)* en niños de 12-14 meses
|
Grupo |
Respuesta a |
Tiempo |
Estudio MenACWY-TT-104 (1) | ||
|
N |
>8 (IC 95%) |
GMT (IC 95%) | |||
|
A |
Nimenrix 1 dosis |
Tras dosis 1 |
75 |
96,0% (88,8; 99,2) |
119,3 (88,0; 161,7) |
|
Nimenrix 2 dosis |
Tras dosis 1 |
66 |
97,0% (89,5; 99,6) |
132,9 (98,1; 180,1) | |
|
Tras dosis 2 |
66 |
97,0% (89,5; 99,6) |
170,5 (126,2; 230,2) | ||
|
C |
Nimenrix 1 dosis |
Tras dosis 1 |
79 |
98,7% (93,1; 100) |
151,2 (104,7; 218,3) |
|
Nimenrix 2 dosis |
Tras dosis 1 |
70 |
95,7% (88,0; 99,1) |
161 (110; 236) | |
|
Tras dosis 2 |
69 |
100% (94,8; 100) |
1753,3 (1277,7; 2404,2) | ||
|
W-135 |
Nimenrix 1 dosis |
Tras dosis 1 |
72 |
62,5% (50,3; 73,6) |
27,5 (16,1; 46,8) |
|
Nimenrix 2 dosis |
Tras dosis 1 |
61 |
68,9% (55,7; 80,1) |
26,2 (16,0; 43,0) | |
|
Tras dosis 2 |
70 |
97,1% (90,1; 99,7) |
756,8 (550,1; 1041,3) | ||
|
Y |
Nimenrix 1 dosis |
Tras dosis 1 |
71 |
67,6% (55,5; 78,20) |
41,2 (23,7; 71,5) |
|
Nimenrix 2 dosis |
Tras dosis 1 |
56 |
64,3% (50,4; 76,6) |
31,9 (17,6; 57,9) | |
|
Tras dosis 2 |
64 |
95,3% (86,9; 99,0) |
513,0 (339,4; 775,4) |
El análisis de inmunogenicidad se realizó en la cohorte por protocolo (PP) para la inmunogenicidad (1) muestras de sangre tomadas entre 21 y 48 días después de la vacunación *determinado en los laboratorios GSK
Persistencia de la respuesta inmune en niños de 12-23 meses
En los estudios MenACWY-TT-048 y MenACWY-TT-032, se evaluó la persistencia de la respuesta inmune mediante ABSc y ABSh en niños primovacunados entre los 12-23 meses (lactantes), hasta 4 años después de la primovacunación en el estudio MenACWY-TT-039 (Tabla 5), y hasta 5 años después de la primovacunación en el estudio MenACWY-TT-027 (Tabla 6) respectivamente.
Tabla 5: Datos de persistencia a 4 años en niños de 12-23 meses en el momento de la vacunación _(estudio MenACWY-TT-048)_
|
Grupo |
Respuesta a |
Punto tempo ral (Año) |
ABSc* |
ABSh** | ||||
|
N |
>8 (IC 95%) |
GMT (IC 95%) |
N |
>8 (IC 95%) |
GMT (IC 95%) | |||
|
A*** |
Nimenrix |
3 |
262 |
59,9% (53,7; 65,9) |
19,3 (15,7; 23,6) |
251 |
35,9% (29,9; 42,1) |
5,8 (4,8; 7,0) |
|
4 |
224 |
74,1% (67,9; 79,7) |
107 (77,6; 148) |
198 |
28,8% (22,6; 35,6) |
4,9 (4,0; 6,0) | ||
|
C |
Nimenrix |
3 |
262 |
35,9% (30,1; 42,0) |
9,8 (8,1; 11,7) |
253 |
78,3% (72,7; 83,2) |
37,8 (29,4; 48,6) |
|
4 |
225 |
40,4% (34,0; 47,2) |
12,3 (9,8; 15,3) |
209 |
73,2% (66,7; 79,1) |
32,0 (23,8; 43,0) | ||
|
Vacuna MenC- CRM |
3 |
46 |
13,0% (4,9; 26,3) |
5,7 (4,2; 7,7) |
31 |
41,9% (24,5; 60,9) |
6,2 (3,7; 10,3) | |
|
4 |
45 |
35,6% (21,9; 51,2) |
13,5 (7,4; 24,5) |
32 |
46,9% (29,1; 65,3) |
11,3 (4,9; 25,6) | ||
|
W-135 |
Nimenrix |
3 |
261 |
49,8% (43,6; 56,0) |
24,9 (19,2; 32,4) |
254 |
82,3% (77,0; 86,8) |
52,0 (41,4; 65,2) |
|
4 |
225 |
49,3% (42,6; 56,1) |
30,5 (22,4; 41,5) |
165 |
80,6% (73,7; 86,3) |
47,1 (35,7; 62,2) | ||
|
Y |
Nimenrix |
3 |
262 |
53,8% (47,6; 60,0) |
22,3 (17,6; 28,4) |
250 |
72,0% (66,0; 77,5) |
33,2 (25,9; 42,5) |
|
4 |
225 |
58,2% (51,5; 64,7) |
36,2 (27,1; 48,4) |
130 |
65,4% (56,5; 73,5) |
29,8 (20,2; 44,1) | ||
El análisis de inmunogenicidad se realizó en la cohorte por protocolo (PP) para la persistencia adaptada para cada punto temporal.
* determinación de ABSc realizada en los laboratorios del “Public Health England”, Reino Unido **determinado en los laboratorios GSK
***de forma similar al aumento en las GMTs de ABSc para MenA, se observó un aumento en la media geométrica de las concentraciones de IgG para MenA entre el tercer y el cuarto año.
Tabla 6: Datos de persistencia a 5 años en niños de 12-23 meses en el momento de la vacunación _(estudio MenACWY-TT-032)_
|
Grupo |
Respuesta a |
Punto tempo ral (Año) |
ABSc* |
ABSh** | ||||
|
N |
>8 (IC 95%) |
GMT (IC 95%) |
N |
>8 (IC 95%) |
GMT (IC 95%) | |||
|
A |
Nimenrix |
4 |
45 |
64,4% (48,8; 78,1) |
35,1 (19,4; 63,4) |
44 |
52,3% (36,7; 67,5) |
8,8 (5,4; 14,2) |
|
5 |
49 |
73,5% (58,9; 85,1) |
37,4 (22,1; 63,2) |
45 |
35,6% (21,9; 51,2) |
5,2 (3,4; 7,8) | ||
|
C |
Nimenrix |
4 |
45 |
97,8% (88,2; 99,9) |
110 (62,7; 192) |
45 |
97,8% (88,2; 99,9) |
370 (214; 640) |
|
5 |
49 |
77,6% (63,4; 88,2) |
48,9 (28,5; 84,0) |
48 |
91,7% (80,0; 97,7) |
216 (124; 379) | ||
|
Vacuna MenC- CRM |
4 |
10 |
80,0% (44,4; 97,5) |
137 (22,6; 832) |
10 |
70,0% (34,8; 93,3) |
91,9 (9,8; 859) | |
|
5 |
11 |
63,6% (30,8; 89,1) |
26,5 (6,5; 107) |
11 |
90,9% (58,7; 99,8) |
109 (21,2; 557) | ||
|
W-135 |
Nimenrix |
4 |
45 |
60,0% (44,3; 74,3) |
50,8 (24,0; 108) |
45 |
84,4% (70,5; 93,5) |
76,9 (44,0; 134) |
|
5 |
49 |
34,7% (21,7; 49,6) |
18,2 (9,3; 35,3) |
46 |
82,6% (68,6; 92,2) |
59,7 (35,1; 101) | ||
|
Y |
Nimenrix |
4 |
45 |
62,2% (46,5; 76,2) |
44,9 (22,6; 89,3) |
41 |
87,8% (73,8; 95,9) |
74,6 (44,5; 125) |
|
5 |
49 |
42,9% (28,8; 57,8) |
20,6 (10,9; 39,2) |
45 |
80,0% (65,4; 90,4) |
70,6 (38,7; 129) | ||
La persistencia de la inmunogenicidad se analizó usando la cohorte por protocolo (PP) del año 5. Es posible que un sesgo de selección, debido principalmente a la revacunación de sujetos con títulos de ABSc <8 para MenC y a su exclusión de el(los) siguiente(s) punto(s) temporal(es), haya llevado a una sobreestimación de los títulos.
* determinación de ABSc realizada en los laboratorios del “Public Health England”, Reino Unido **determinado en los laboratorios GSK
Memoria inmune
En el estudio MenACWY-TT-014 se evaluó la inducción de memoria inmune un mes después de la administración de un quinto de la dosis de la vacuna ACWY-PS (10 ^g de cada polisacárido) a niños en el tercer año de vida que habían sido previamente primovacunados entre los 12 y los 14 meses de edad en el estudio MenACWY-TT-013 con Nimenrix o con una vacuna MenC-CRM autorizada.
Un mes después de la dosis de exposición, las GMTs inducidas en los sujetos primovacunados con Nimenrix se incrementaron de 6,5 a 8 veces para los grupos A, C, W-135 e Y, indicando que Nimenrix induce memoria inmune frente a los grupos A, W-135 e Y. La GMT de ABSc para MenC postexposición fue similar en ambos grupos del estudio, indicando que Nimenrix induce una memoria inmune frente al grupo C análoga a la de la vacuna MenC-CRM autorizada (Tabla 7).
|
MenC-CRM | |||||
|
Grupo |
Respuesta a |
Pre-exposición |
Post-exposición | ||
|
N |
GMT (IC 95%) |
N |
GMT (IC 95%) | ||
|
A |
Nimenrix |
32 |
544 (325;911) |
25 |
3.322 (2.294; 4.810) |
|
C |
Nimenrix |
31 |
174 (105; 289) |
32 |
5.966 (4.128; 8.621) |
|
Vacuna MenC-CRM |
28 |
34,4 (15,8; 75,3) |
30 |
5.265 (3.437; 8.065) | |
|
W-135 |
Nimenrix |
32 |
644 (394; 1.052) |
32 |
11.058 (8.587; 14.240) |
|
Y |
Nimenrix |
32 |
440 (274; 706) |
32 |
5.737 (4.216; 7.806) |
|
El análisis de inmunogenicid |
ad se realizó en la cohorte por protocolo (PP) para la inmunogenicidad. | ||||
*determinado en los laboratorios GSK Niños
Inmunogenicidad en niños de 2-10 años
En dos estudios comparativos realizados en sujetos de 2-10 años, un grupo de sujetos recibió una dosis de Nimenrix y un segundo grupo recibió una dosis de una vacuna autorizada MenC-CRM (estudio MenACWY-TT-081) o de la vacuna autorizada meningocócica polisacarídica no conjugada de los grupos A, C, W-135 e Y (ACWY-PS) de GlaxoSmithKline Biologicals (estudio MenACWY-TT-038), como comparador.
En MenACWY-TT-038, Nimenrix demostró no inferioridad respecto a la vacuna ACWY-PS autorizada en términos de respuesta vacunal a los cuatro grupos (A, C, W-135 e Y) (ver Tabla 8).
La respuesta vacunal se definió como la proporción de sujetos con:
• títulos ABSc > 32 en sujetos inicialmente seronegativos (es decir, con un título ABSc prevacunación < 8)
• un incremento de al menos 4 veces de los títulos ABSc entre el momento pre y postvacunación, en sujetos inicialmente seropositivos (es decir, con un título ABSc prevacunación > 8)
En MenACWY-TT-081, Nimenrix demostró no inferioridad respecto a otra vacuna MenC-CRM autorizada en términos de respuesta vacunal al grupo C [94,8% (IC 95%: 91,4; 97,1) y 95,7% (IC 95%: 89,2; 98,8) respectivamente], las GMTs fueron inferiores en el grupo de Nimenrix [2.795 (IC 95%: 2.393; 3.263)] con respecto a las de la vacuna MenC-CRM [5.292 (IC 95%: 3.815; 7.340].
Tabla 8: Respuestas de anticuerpos bactericidas (ABSc*) a Nimenrix y a la vacuna ACWY-PS _en niños de 2-10 años 1 mes después de la vacunación (estudio MenACWY-TT-038)
|
Grupo |
Nimenrix |
Vacuna ACWY-PS | ||||
|
N |
RV (IC 95%) |
GMT (IC 95%) |
N |
RV (IC 95%) |
GMT (IC 95%) | |
|
A |
594 |
89,1% (86,3; 91,5) |
6.343 (5.998; 6.708) |
192 |
64,6% (57,4; 71,3) |
2.283 (2.023; 2.577) |
|
C |
691 |
96,1% (94,4; 97,4) |
4.813 (4.342; 5.335) |
234 |
89,7% (85,1; 93,3) |
1.317 (1.043; 1.663) |
|
W-135 |
691 |
97,4% (95,9; 98,4) |
11.543 (10.873; 12.255) |
236 |
82,6% (77,2; 87,2) |
2.158 (1.815; 2.565) |
|
Y |
723 |
92,7% (90,5; 94,5) |
10.825 (10.233; 11.452) |
240 |
68,8% (62,5; 74,6) |
2.613 (2.237; 3.052) |
El análisis de inmunogenicidad se realizó en la cohorte por protocolo (PP) para la inmunogenicidad.
RV: respuesta vacunal
*determinado en los laboratorios GSK
Persistencia de la respuesta inmune en niños de 2-10 años
Persistencia de la respuesta inmune en niños de 2-10 años
En el estudio MenACWY-TT-088, se evaluó la persistencia de la respuesta inmune mediante ABSc y ABSh hasta 44 meses después de la vacunación en niños de 2-10 años primovacunados en el estudio MenACWY-TT-081 (Tabla 9).
Tabla 9: Datos de persistencia a 44 meses en niños de 2-10 años en el momento de la vacunación
|
Grupo |
Respuesta a |
Punto temporal (meses) |
ABSc* |
ABSh1 | ||||
|
N |
>8 (IC 95%) |
GMT (IC 95%) |
N |
>8 (IC 95%) |
GMT (IC 95%) | |||
|
A |
Nimenrix |
32 |
193 |
86,5% (80,9; 91,0) |
196 (144; 267) |
90 |
25,6% (16,9; 35,8) |
4,6 (3,3; 6,3) |
|
44 |
189 |
85,7% (79,9; 90,4) |
307 (224;423) |
89 |
25,8% (17,1; 36,2) |
4,8 (3,4; 6,7) | ||
|
C |
Nimenrix |
32 |
192 |
64,6% (57,4; 71,3) |
34,8 (26,0; 46,4) |
90 |
95,6% (89,0; 98,8) |
75,9 (53,4; 108) |
|
44 |
189 |
37,0% (30,1; 44,3) |
14,5 (10,9; 19,2) |
82 |
76,8% (66,2; 85,4) |
36,4 (23,1; 57,2) | ||
|
Vacuna MenC- CRM |
32 |
69 |
76,8% (65,1; 86,1) |
86,5 (47,3; 158) |
33 |
90,9% (75,7; 98,1) |
82,2 (34,6; 196) | |
|
44 |
66 |
45,5% (33,1; 58,2) |
31,0 (16,6; 58,0) |
31 |
64,5% (45,4; 80,8) |
38,8 (13,3; 113) | ||
|
W-135 |
Nimenrix |
32 |
193 |
77,2% (70,6; 82,9) |
214 (149; 307) |
86 |
84,9% (75,5; 91,7) |
69,9 (48,2; 101) |
|
44 |
189 |
68,3% (61,1; 74,8) |
103 (72,5; 148) |
87 |
80,5% (70,6; 88,2) |
64,3 (42,7; 96,8) | ||
|
Y |
Nimenrix |
32 |
193 |
81,3% (75,1; 86,6) |
227 (165; 314) |
91 |
81,3% (71,8; 88,7) |
79,2 (52,5; 119) |
|
44 |
189 |
62,4% (55,1; 69,4) |
78,9 (54,6; 114) |
76 |
82,9% (72,5; 90,6) |
127 (78,0; 206) | ||
El análisis de inmunogenicidad se realizó en la cohorte por protocolo (PP) para la persistencia adaptada para cada punto temporal.
* determinación de ABSc realizada en los laboratorios del “Public Health England”, Reino Unido
En el estudio MenACWY-TT-028, se evaluó la persistencia de la respuesta inmune mediante ABSh 1 año después de la vacunación en niños de 6-10 años primovacunados en el estudio MenACWY-TT-027 (Tabla 10) (ver sección 4.4).
Tabla 10: Datos a 1 mes después de la vacunación y datos de persistencia a 1 año (ABSh*) en niños de 6-10 años
|
Grupo |
Respuesta a |
1 mes después de |
a vacunación |
Persistencia a 1 año | |||
|
N |
^8 (IC 95%) |
GMT (IC 95%) |
N |
^8 (IC 95%) |
GMT (IC 95%) | ||
|
A |
Nimenrix |
105 |
80,0 % (71,1; 87,2) |
53,4 (37,3; 76,2) |
104 |
16,3% (9,8; 24,9) |
3,5 (2,7; 4,4) |
|
ACWY-PS |
35 |
25,7% (12,5;43,3) |
4,1 (2,6;6,5) |
35 |
5,7% (0,7;19,2) |
2,5 (1,9;3,3) | |
|
C |
Nimenrix |
101 |
89,1% (81,3;94,4) |
156 (99,3;244) |
105 |
95,2% (89,2;98,4) |
129 (95,4;176) |
|
ACWY-PS |
38 |
39,5% (24,0;56,6) |
13,1 (5,4;32,0) |
31 |
32,3% (16,7;51,4) |
7,7 (3,5;17,3) | |
|
W-135 |
Nimenrix |
103 |
95,1% (89,0;98,4) |
133 (99,9;178) |
103 |
100% (96,5;100) |
257 (218;302) |
|
ACWY-PS |
35 |
34,3% (19,1;52,2) |
5,8 (3,3;9,9) |
31 |
12,9% (3,6;29,8) |
3,4 (2,0;5,8) | |
|
Y |
Nimenrix |
89 |
83,1% (73,7;90,2) |
95,1 (62,4;145) |
106 |
99,1% (94,9;100) |
265 (213;330) |
|
ACWY-PS |
32 |
43,8% (26,4;62,3) |
12,5 (5,6;27,7) |
36 |
33,3% (18,6;51,0) |
9,3 (4,3;19,9) | |
El análisis de inmunogenicidad se realizó en la cohorte por protocolo (PP) para la persistencia. *determinado en los laboratorios GSK
Adolescentes y adultos
Inmunogenicidad en adolescentes de 11-17 años y adultos >18 años
En dos ensayos clínicos, realizados en adolescentes de 11-17 años (estudio MenACWY-TT-036) y en adultos de 18-55 años (estudio MenACWY-TT-035), se administró una dosis de Nimenrix o una dosis de la vacuna ACWY-PS.
Como se ha mencionado antes, Nimenrix demostró que era inmunológicamente no inferior a la vacuna ACWY-PS en términos de respuesta vacunal, tanto en adolescentes como en adultos (Tabla 11). La respuesta a los cuatro grupos meningocócicos inducida por Nimenrix fue similar o superior a la inducida por la vacuna ACWY-PS.
en adolescentes de 11-17 años y adultos >18 años un mes después de la vacunación
|
Estudio (Rango de edad) |
Grupo |
Nimenrix |
Vacuna ACWY-PS | ||||
|
N |
RV (IC 95%) |
GMT (IC 95%) |
N |
RV (IC 95%) |
GMT (IC 95%) | ||
|
Estudio MenACWY-TT-036 (11-17 años) |
A |
553 |
85,4% (82,1; 88,2) |
5.928 (5.557; 6.324) |
191 |
77,5% (70,9; 83,2) |
2.947 (2.612; 3.326) |
|
C |
642 |
97,4% (95,8; 98,5) |
13.110 (11.939; 14.395) |
211 |
96,7% (93,3; 98,7) |
8.222 (6.807; 9.930) | |
|
W-135 |
639 |
96,4% (94,6; 97,7) |
8.247 (7.639; 8.903) |
216 |
87,5% (82,3; 91,6) |
2.633 (2.299; 3.014) | |
|
Y |
657 |
93,8% (91,6; 95,5) |
14.086 (13.168; 15.069) |
219 |
78,5% (72,5; 83,8) |
5.066 (4.463; 5.751) | |
|
Estudio MenACWY-TT-035 (18-55 años) |
A |
743 |
80,1% (77,0; 82,9) |
3.625 (3.372; 3.897) |
252 |
69,8% (63,8; 75,4) |
2.127 (1.909; 2.370) |
|
C |
849 |
91,5% (89,4; 93,3) |
8.866 (8.011; 9.812) |
288 |
92,0% (88,3; 94,9) |
7.371 (6.297; 8.628) | |
|
W-135 |
860 |
90,2% (88,1; 92,1) |
5.136 (4.699; 5.614) |
283 |
85,5% (80,9; 89,4) |
2.461 (2.081; 2.911) | |
|
Y |
862 |
87,0% (84,6; 89,2) |
7.711 (7.100; 8.374) |
288 |
78,8% (73,6; 83,4) |
4.314 (3.782; 4.921) | |
El análisis de inmunogenicidad se realizó en las cohortes por protocolo (PP) para la inmunogenicidad.
RV: respuesta vacunal
*determinado en los laboratorios GSK
En un estudio aparte (MenACWY-TT-085) se administró una única dosis de Nimenrix a 194 adultos libaneses a partir de 56 años de edad (incluyendo 133 con edades entre 56-65 años y 61 mayores de 65 años). El porcentaje de sujetos con títulos ABSc (medidos en los laboratorios de GSK) > 128 antes de la vacunación osciló entre el 45% (grupo C) y el 62% (grupo Y). En conjunto, un mes después de la vacunación el porcentaje de sujetos vacunados con títulos ABSc > 128 osciló entre el 93% (grupo C) y el 97% (grupo Y). En el subgrupo de edad de mayores de 65 años el porcentaje de sujetos vacunados con títulos ABSc > 128 un mes después de la vacunación osciló entre el 90% (grupo A) y el 97% (grupo Y).
Persistencia de la respuesta inmune en adolescentes de 11-17 años
En el estudio MenACWY-TT-043, se evaluó la persistencia de la respuesta inmune 5 años después de la vacunación en adolescentes primovacunados en el estudio MenACWY-TT-036 (Tabla 12). Ver tabla 11 para los resultados primarios de este estudio.
Tabla 12: Datos de persistencia a 5 años (ABSc*) en adolescentes de 11-17 años en el momento de la vacunación
|
Grupo |
Punto tempo ral (Año) |
Nimenrix |
Vacuna ACWY-PS | ||||
|
N |
>8 (IC 95%) |
GMT (IC 95%) |
N |
>8 (IC 95%) |
GMT (IC 95%) | ||
|
A |
3 |
449 |
92,9% (90,1; 95,1) |
448 (381; 527) |
150 |
82,7% (75,6; 88,4) |
206 (147; 288) |
|
5 |
236 |
97,5% (94,5; 99,1) |
644 (531; 781) |
86 |
93.0% (85,4; 97,4) |
296 (202;433) | |
|
C |
3 |
449 |
91,1% (88,1; 93,6) |
371 (309; 446) |
150 |
86,0% (79,4; 91;1) |
390 (262; 580) |
|
5 |
236 |
88,6% (83,8; 92,3) |
249 (194; 318) |
85 |
87,1% (78,0; 93,4) |
366 (224;599) | |
|
W-135 |
3 |
449 |
82,0% (78,1; 85,4) |
338 (268; 426) |
150 |
30,0% (22,8; 38,0) |
16,0 (10,9; 23,6) |
|
5 |
236 |
86,0% (80,9; 90,2) |
437 (324; 588) |
86 |
34,9% (24,9; 45,9) |
19,7 (11,8; 32,9) | |
|
Y |
3 |
449 |
93,1% (90,3; 95,3) |
740 (620; 884) |
150 |
58,0% (49,7; 66,0) |
69,6 (44,6; 109) |
|
5 |
236 |
96,6% (93,4; 98,5) |
1000 (824; 1214) |
86 |
66,3% (55,3; 76,1) |
125 (71,2; 219) | |
El análisis de inmunogenicidad se realizó en la cohorte por protocolo (PP) para la persistencia adaptada para cada punto temporal.
* determinación de ABSc realizada en los laboratorios del “Public Health England”, Reino Unido.
Persistencia de la respuesta inmune en adolescentes y adultos de 11-25 años
En el estudio MenACWY-TT-059, se evaluó la persistencia de la respuesta inmune mediante ABSh, 1 y 5 años después de la vacunación en adolescentes y adultos de 11-25 años primovacunados en el estudio MenACWY-TT-052 (Tabla 13) (ver sección 4.4).
Tabla 13: Datos a 1 mes después de la vacunación y datos de persistencia a 5 años (ABSh*) en
|
adolescentes y adultos de 1 |
1-25 años | ||||
|
Grupo |
Respuesta a |
Punto temporal |
N |
^8 (IC 95%) |
GMT (IC 95%) |
|
Mes 1 |
356 |
82,0% (77,6; 85,9) |
58,7 (48,6; 70,9) | ||
|
A |
Nimenrix |
Año 1 |
350 |
29,1% (24,4; 34,2) |
5,4 (4,5; 6,4) |
|
Año 5 |
141 |
48,9% (40,4; 57,5) |
8,9 (6,8; 11,8) | ||
|
Mes 1 |
359 |
96,1% (93,5; 97,9) |
532 (424;668) | ||
|
C |
Nimenrix |
Año 1 |
336 |
94,9% (92,0; 97,0) |
172 (142; 207) |
|
Año 5 |
140 |
92,9% (87,3; 96,5) |
94,6 (65,9; 136) | ||
|
Mes 1 |
334 |
91,0% (87,4; 93,9) |
117 (96,8; 141) | ||
|
W-135 |
Nimenrix |
Año 1 |
327 |
98,5% (96,5; 99,5) |
197 (173;225) |
|
Año 5 |
138 |
87,0% (80,2; 92,1) |
103 (76,3; 140) | ||
|
Mes 1 |
364 |
95,1% (92,3; 97,0) |
246 (208;291) | ||
|
Y |
Nimenrix |
Año 1 |
356 |
97,8% (95,6; 99,0) |
272 (237; 311) |
|
Año 5 |
142 |
94,4% (89,2; 97,5) |
225 (174; 290) | ||
|
El análisis de inmunogenicidad se realizó en la co |
horte por protocolo (PP) para la persistencia | ||||
adaptada para cada punto temporal. *determinado en los laboratorios GSK
Respuesta de recuerdo para sujetos vacunados previamente con una vacuna meningocócica conjugada frente a Neisseria meningitidis
Vacunación de recuerdo con Nimenrix después de la primovacunación en lactantes, niños, adolescentes y adultos: más del 99,0% de los sujetos de 1 o más años de edad primovacunados con Nimenrix y que recibieron una dosis de recuerdo con Nimenrix 4 o 5 años más tarde alcanzaron títulos ABS > 1:8 en ambos ensayos (estudios MenACWY-TT-062, 048, 059, 088). Las GMTs inducidas un mes después de la dosis de recuerdo fueron significativamente mayores que las inducidas en los grupos control no tratados, por grupos de edad, indicando que Nimenrix induce memoria inmune frente a los grupos A, C, W-135 e Y.
La respuesta del grupo C observada tras la vacunación de recuerdo con Nimenrix, fue similar a la observada en sujetos primovacunados y que recibieron una vacuna de recuerdo monovalente conjugada MenC-CRM. Un año después de la vacunación de recuerdo, los títulos ABS > 1:8 persistieron en al menos el 95,5% de los sujetos (estudio MenACWY-TT-048 con primovacunación a los 12-23 meses).
Cuando se administró Nimenrix como vacuna de recuerdo después de la primovacunación con una vacuna conjugada MenACWY-DT o una vacuna conjugada monovalente grupo C (estudio MenACWY-TT-059 con primovacunación a los 10-25 años y estudio MenACWY-TT-088 con primovacunación a los 2-10 años), los títulos aumentaron de 48 a 340 veces en todos los grupos y el 100% de los sujetos alcanzaron títulos ABS > 1:8.
Respuesta de recuerdo para sujetos vacunados previamente con una vacuna polisacarídica no conjugada frente a Neisseria meningitidis
En el estudio MenACWY-TT-021 realizado en sujetos de 4,5 a 34 años, se comparó la inmunogenicidad de Nimenrix administrada entre 30 y 42 meses después de la vacunación con una vacuna ACWY-PS y la inmunogenicidad de Nimenrix administrada a sujetos de la misma edad que no habían sido vacunados con ninguna vacuna meningocócica en los 10 años anteriores. Se observó una respuesta inmune (título ABSc > 8) frente a todos los grupos (A, C, W-135, Y) en todos los sujetos independientemente de la historia de vacunación meningocócica. Las GMTs de ABSc fueron significativamente menores en los sujetos que habían recibido una dosis de la vacuna ACWY-PS entre 30 y 42 meses antes de recibir Nimenrix (Tabla 14) (ver sección 4.4).
Tabla 14: Respuesta inmune (ABSc*) 1 mes después de la vacunación con Nimenrix en sujetos _ de acuerdo con su historia de vacunación meningocócica_
|
Grupo |
Sujetos vacunados entre 30 y 42 meses antes con ACWY-PS |
Sujetos que no habían recibido ninguna vacuna meningocócica en los 10 años anteriores | ||||
|
N |
>8 (IC 95%) |
GMT (IC 95%) |
N |
>8 (IC 95%) |
GMT (IC 95%) | |
|
A |
146 |
100% (97,5; 100) |
6.869 (6.045; 7.805) |
69 |
100% (94,8; 100) |
13.015 (10.722; 15.798) |
|
C |
169 |
100% (97,8; 100) |
1.946 (1.583; 2.391) |
75 |
100% (95,2; 100) |
5.495 (4.266; 7.076) |
|
W-135 |
169 |
100% (97,8; 100) |
4.636 (3.942; 5.451) |
75 |
100% (95,2; 100) |
9.078 (7.088; 11.627) |
|
Y |
169 |
100% (97,8; 100) |
7.800 (6.683; 9.104) |
75 |
100% (95,2; 100) |
13.895 (11.186; 17.261) |
El análisis de inmunogenicidad se realizó en las cohortes por protocolo (PP) para
a inmunogenicidad.
*determinado en los laboratorios GSK
La Agencia Europea de Medicamentos ha concedido al titular un aplazamiento para presentar los resultados de los estudios realizados con Nimenrix en uno o más grupos de la población pediátrica en la prevención de la enfermedad meningocócica causada por Neisseria meningitidis de los grupos A, C, W-135 e Y (ver sección 4.2 para consultar la información sobre el uso en población pediátrica).
5.2 Propiedades farmacocinéticas
No procede.
5.3 Datos preclínicos sobre seguridad
Los datos de los estudios no clínicos no muestran riesgos especiales para los seres humanos según los estudios de tolerancia local, toxicidad aguda, toxicidad a dosis repetidas, toxicidad para la reproducción y el desarrollo y estudios de fertilidad.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Polvo:
Sacarosa
Trometamol
Disolvente:
Cloruro de sodio
Agua para preparaciones inyectables
6.2 Incompatibilidades
En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros.
6.3 Periodo de validez
3 años
Tras la reconstitución:
Tras la reconstitución, la vacuna debe administrarse rápidamente. Aunque no se recomienda retrasar su administración, se ha demostrado que es estable durante 8 horas a 30°C tras la reconstitución. No administrar la vacuna si no se usa en el plazo de 8 horas.
6.4 Precauciones especiales de conservación
Conservar en nevera (entre 2°C y 8°C).
No congelar.
Conservar en el embalaje original para protegerla de la luz.
Para las condiciones de conservación tras la reconstitución del medicamento, ver sección 6.3.
6.5 Naturaleza y contenido del envase
Polvo en un vial (vidrio de tipo I) con un tapón (goma de butilo) y disolvente en una jeringa precargada con un tapón (goma de butilo).
Tamaños de envase de 1 y 10 con o sin agujas.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Instrucciones para la reconstitución de la vacuna con el disolvente en jeringa precargada
Nimenrix se debe reconstituir añadiendo todo el contenido de la jeringa precargada al vial que contiene el polvo.
Para saber cómo insertar la aguja en la jeringa, véase el dibujo explicativo. No obstante, la jeringa facilitada con Nimenrix puede ser ligeramente diferente (sin rosca de tornillo) a la jeringa descrita en el dibujo. En tal caso, la aguja deberá insertarse sin enroscar.
Émbolo de la jeringa
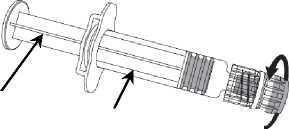
1. Desenroscar la tapa de la jeringa girándola
Cuerpo de la jeringa f
Tapa de la jeringa
en sentido contrario a las agujas del reloj sujetando el cuerpo de la jeringa con la otra mano (evitar sostener el émbolo de la jeringa).
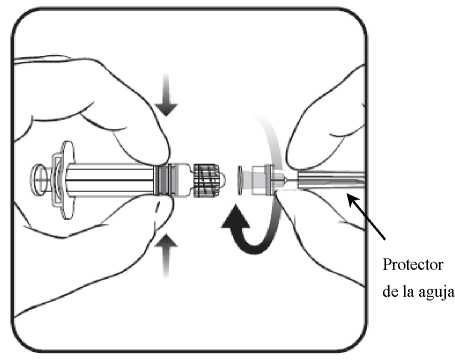
2. Insertarla aguja en la jeringa
y a continuación, girarla en el sentido de las agujas del reloj hasta que se bloquee (ver dibujo).
3. Retirar el protector de la aguja; en algunas ocasiones puede resultar un poco difícil.
4.
Añadir el disolvente al polvo. Después de añadir el disolvente al polvo, debe agitarse bien la mezcla hasta que el polvo esté completamente disuelto.
La vacuna reconstituida es una solución transparente incolora.
Se debe inspeccionar visualmente el contenido de la vacuna reconstituida para observar si existe alguna sustancia extraña y/o variación del aspecto físico antes de su administración. En caso de que se observe alguna de estas circunstancias, desechar la vacuna.
Tras la reconstitución, la vacuna debe administrarse rápidamente.
Se debe utilizar una aguja nueva para administrar la vacuna.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Pfizer Limited Ramsgate Road Sandwich Kent CT13 9NJ Reino Unido
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/12/767/001
EU/1/12/767/002
EU/1/12/767/003
EU/1/12/767/004
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 20/04/2012.
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas. Ver la sección 4.8, en la que se incluye información sobre cómo notificarlas.
1. NOMBRE DEL MEDICAMENTO
Nimenrix polvo y disolvente para solución inyectable en ampolla Vacuna conjugada frente a meningococo de los grupos A, C, W-135 e Y
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Tras la reconstitución, 1 dosis (0,5 ml) contiene:
5 microgramos 5 microgramos 5 microgramos 5 microgramos
44 microgramos
Polisacárido de Neisseria meningitidis del grupo A1 Polisacárido de Neisseria meningitidis del grupo C1 Polisacárido de Neisseria meningitidis del grupo W-1351 Polisacárido de Neisseria meningitidis del grupo Y1
1conjugado con toxoide tetánico como proteína transportadora
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Polvo y disolvente para solución inyectable. El polvo es blanco.
El disolvente es transparente e incoloro.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Nimenrix está indicado para la inmunización activa de personas a partir de 12 meses de edad frente a enfermedad meningocócica invasiva causada por Neisseria meningitidis de los grupos A, C, W-135, e Y.
4.2 Posología y forma de administración
Posología
Nimenrix debe utilizarse de acuerdo con las recomendaciones oficiales.
Administrar una única dosis de 0,5 ml de la vacuna reconstituida para la inmunización.
Nimenrix puede administrarse como una dosis de recuerdo a personas que hayan recibido previamente una primovacunación con Nimenrix u otras vacunas meningocócicas polisacarídicas conjugadas o no conjugadas (ver secciones 4.4. y 5.1).
Una segunda dosis de Nimenrix puede considerarse apropiada para algunos sujetos (ver sección 4.4).
Población pediátrica
No se ha establecido todavía la seguridad y eficacia de Nimenrix en niños menores de 12 meses de edad.
No se dispone de datos.
Forma de administración
La inmunización debe realizarse únicamente mediante una inyección intramuscular, preferiblemente en el músculo deltoides.
En niños de 12 a 23 meses de edad la vacuna también puede administrarse en la zona anterolateral del muslo (ver secciones 4.4 y 4.5).
Para consultar las instrucciones de reconstitución del medicamento antes de la administración, ver sección 6.6.
4.3 Contraindicaciones
Hipersensibilidad a los principios activos o a alguno de los excipientes incluidos en la sección 6.1.
4.4 Advertencias y precauciones especiales de empleo
Nimenrix no debe administrarse por vía intravascular, intradérmica o subcutánea bajo ninguna circunstancia.
Antes de la vacunación, se considera una buena práctica clínica realizar una revisión de la historia clínica (en particular respecto a las vacunaciones anteriores y a la posible aparición de reacciones adversas) y una exploración física.
Se debe disponer en todo momento del tratamiento y supervisión médica adecuados, para el caso poco común de aparición de una reacción anafiláctica tras la administración de la vacuna.
Enfermedad concomitante
Se debe posponer la administración de Nimenrix en sujetos que padezcan enfermedades febriles agudas graves. Una infección leve, como un resfriado, no debería retrasar la vacunación.
Síncope
Después de cualquier vacunación, o incluso antes, se puede producir, especialmente en adolescentes, un síncope (desfallecimiento) como una reacción psicógena a la inyección de la aguja. Durante la recuperación, éste puede ir acompañado de varios signos neurológicos tales como déficit visual transitorio, parestesia y movimientos tónico clónicos en los miembros. Es importante que se disponga de procedimientos para evitar daños causados por las pérdidas de conocimiento.
Trombocitopenia y trastornos de la coagulación
Nimenrix se debe administrar con precaución en personas con trombocitopenia u otros trastornos de la coagulación, ya que puede producirse una hemorragia tras la administración intramuscular en estos sujetos.
Inmunodeficiencia
Cabe la posibilidad de que en pacientes que reciben tratamiento inmunosupresor o que padecen una inmunodeficiencia no se genere una respuesta inmune protectora.
No se han evaluado la seguridad e inmunogenicidad en pacientes con mayor susceptibilidad de padecer una infección meningocócica debido a enfermedades tales como deficiencias de componentes terminales del complemento y asplenia funcional o anatómica. Puede que en estos individuos no se genere una respuesta inmune protectora.
Protección frente a la enfermedad meningocócica
Nimenrix únicamente confiere protección frente a Neisseria meningitidis de los grupos A, C, W-135 e Y. La vacuna no protege frente a Neisseria meningitidis de otros grupos.
Puede que no se genere una respuesta inmune protectora en todos los vacunados.
Efecto de la vacunación previa con la vacuna meningocócica polisacarídica no conjugada Los sujetos vacunados con Nimenrix entre 30 y 42 meses después de haber recibido una vacuna meningocócica polisacarídica no conjugada, tuvieron una Media Geométrica de los Títulos (GMT en inglés), determinada mediante la prueba de actividad bactericida del suero con complemento de conejo (ABSc), inferior a la de los sujetos que no habían sido vacunados con ninguna vacuna meningocócica en los 10 años anteriores (ver sección 5.1). Se desconoce la relevancia clínica de este resultado.
Efecto de la vacunación previa con vacuna que contenga toxoide tetánico Se ha evaluado la seguridad e inmunogenicidad de Nimenrix cuando se administra de forma secuencial o simultánea con una vacuna DTPa-VHB-IPV/Hib durante el segundo año de vida. La administración de Nimenrix un mes después de la vacuna DTPa-VHB-IPV/Hib dio lugar a GMTs de ABSc inferiores, frente a los grupos A, C y W-135 en comparación con la administración conjunta (ver sección 4.5). Se desconoce la relevancia clínica de este resultado.
Respuesta inmune en niños de 12-14 meses
Los niños de 12-14 meses presentaron respuestas ABSc similares frente a los grupos A, C, W-135 e Y un mes después de una dosis de Nimenrix o un mes después de dos dosis de Nimenrix administradas con un intervalo de dos meses. En el ensayo de actividad bactericida del suero con complemento humano (ABSh), una única dosis se relacionó con títulos inferiores frente a los grupos W-135 e Y en comparación con dos dosis de Nimenrix administradas con un intervalo de dos meses. Se observaron respuestas similares frente a los grupos A y C después de una o dos dosis (ver sección 5.1). Se desconoce la relevancia clínica de estos resultados. Se puede considerar la administración de una segunda dosis de Nimenrix, tras un intervalo de dos meses a niños que tengan un riesgo aumentado de enfermedad meningocócica invasiva debido a la exposición a los grupos W-135 e Y. Respecto a la disminución de anticuerpos frente al grupo A o grupo C tras la primera dosis de Nimenrix en niños de 12-23 meses, ver el apartado “Persistencia de los títulos de anticuerpos bactericidas séricos”.
Persistencia de los títulos de anticuerpos bactericidas séricos
Tras la administración de Nimenrix se produce una disminución de los títulos de anticuerpos bactericidas séricos frente al grupo A cuando se utilizaba complemento humano en el ensayo (ABSh) (ver sección 5.1). Se desconoce la relevancia clínica de la disminución de los títulos de anticuerpos ABSh frente al grupo A. Sin embargo, se puede considerar la administración de una dosis de recuerdo a sujetos que tengan un riesgo aumentado de exposición al grupo A y que previamente hayan recibido una dosis de Nimenrix hace aproximadamente más de un año.
Se ha observado una disminución en los títulos de anticuerpos con el paso del tiempo para los grupos A, C, W-135 e Y. Se desconoce la relevancia clínica de la disminución de los títulos de anticuerpos.
Se puede considerar una dosis de recuerdo en sujetos vacunados entre los 12-23 meses que permanezcan en elevado riesgo de exposición a la enfermedad meningocócica producida por los grupos A, C, W-135 o Y (ver sección 5.1).
Efecto de Nimenrix sobre las concentraciones de anticuerpos antitetánicos
A pesar de que se observó un incremento de la concentración de anticuerpos anti-toxoide tetánico (TT) tras la vacunación con Nimenrix, Nimenrix no es un sustituto de la inmunización antitetánica.
La administración de Nimenrix al mismo tiempo o un mes antes que una vacuna que contiene TT durante el segundo año de vida no perjudica la respuesta a TT o afecta su seguridad de forma significativa. No se dispone de datos más allá de los 2 años de edad.
4.5 Interacción con otros medicamentos y otras formas de interacción
Nimenrix puede administrarse simultáneamente con cualquiera de las siguientes vacunas: vacunas de la hepatitis A (VHA) y de la hepatitis B (VHB), vacuna de sarampión, rubeola y parotiditis (SRP, triple vírica), vacuna sarampión, rubeola, parotiditis y varicela (SRPV), vacuna conjugada antineumocócica 10-valente o vacuna antigripal estacional no adyuvada.
Nimenrix también puede administrarse simultáneamente con las vacunas combinadas de difteria, tétanos y pertussis acelular en el segundo año de vida, incluyendo combinaciones de vacunas DTPa con hepatitis B, polio inactivada o Haemophilus influenzae tipo b, tales como la vacuna DTPa-VHB-IPV/Hib.
Siempre que sea posible, Nimenrix y una vacuna que contenga TT, como la vacuna DTPa-VHB-IPV/Hib, deben administrarse simultáneamente o Nimenrix debe administrarse al menos un mes antes de la vacuna que contenga TT. La administración secuencial de Nimenrix un mes después de la vacuna DTPa-VHB-IPV/Hib dio lugar a GMTs inferiores para anticuerpos frente a los grupos A, C y W-135. Se desconoce la relevancia clínica de este resultado, ya que al menos el 99,4% de los sujetos (N=178) alcanzó títulos ABSc > 8 para cada grupo (A, C, W-135, Y) (ver sección 4.4).
Un mes después de la administración simultánea con una vacuna conjugada antineumocócica 10-valente, se observaron Concentraciones Medias Geométricas de anticuerpos (GMCs) y GMTs del ensayo de anticuerpos opsonofagocíticos (OPA) menores para un serotipo neumocócico (18C conjugado con toxoide tetánico como proteína trasportadora). Se desconoce la relevancia clínica de este resultado. La administración simultánea no tuvo efecto sobre ninguno de los otros nueve serotipos neumocócicos.
Si Nimenrix se va a administrar al mismo tiempo que otra vacuna inyectable, las vacunas siempre deberán administrarse en distintos lugares de inyección.
Es posible que en pacientes que reciben terapia inmunosupresora no se genere una respuesta adecuada.
4.6 Fertilidad, embarazo y lactancia Embarazo
La experiencia respecto al uso de Nimenrix en mujeres embarazadas es limitada.
Los estudios en animales no sugieren efectos perjudiciales directos ni indirectos sobre el embarazo, el desarrollo embrionario o fetal, el parto o el desarrollo post-natal (ver sección 5.3).
Nimenrix sólo debe administrarse durante el embarazo cuando sea claramente necesario y los posibles beneficios superen los riesgos potenciales para el feto.
Lactancia
Se desconoce si Nimenrix se excreta en la leche materna.
Nimenrix sólo debe administrarse durante la lactancia cuando los posibles beneficios superen los riesgos potenciales.
Fertilidad
Los estudios en animales no sugieren efectos perjudiciales, directos o indirectos, sobre la fertilidad.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No se han realizado estudios acerca de los efectos de Nimenrix sobre la capacidad para conducir y utilizar máquinas. Sin embargo, algunos de los efectos mencionados en la sección 4.8 “Reacciones adversas” pueden afectar la capacidad para conducir o utilizar máquinas.
4.8 Reacciones adversas
Resumen del perfil de seguridad
El perfil de seguridad que se presenta a continuación está basado en un análisis combinado de 9.621 sujetos que fueron vacunados con una dosis de Nimenrix en los ensayos clínicos. Este análisis combinado incluye datos de 3.079 niños (de 12 meses a 23 meses), 909 niños entre 2 y 5 años, 990 niños entre 6 y 10 años, 2.317 adolescentes (entre 11 y 17 años) y 2.326 adultos (entre 18 y 55 años).
En todos los grupos de edad las reacciones adversas locales que se notificaron con más frecuencia tras la vacunación fueron dolor (entre 24,1% y 41,3%), enrojecimiento (entre 15,5% y 35,6%) e inflamación (entre 11,3% y 19,9%).
En los grupos de edad de 12-23 meses y de 2-5 años, las reacciones adversas generales que se notificaron con más frecuencia tras la vacunación fueron irritabilidad (44,0% y 9,2% respectivamente), somnolencia (34,1% y 10,8% respectivamente), pérdida de apetito (26,6% y 8,2% respectivamente) y fiebre (17,1% y 8,1% respectivamente).
En el grupo de edad de 12-14 meses que recibió 2 dosis de Nimenrix administradas con un intervalo de dos meses, la primera y segunda dosis se relacionaron con una reactogenicidad local y sistémica similar.
En los grupos de edad de 6-10, de 11-17 y >18 años, las reacciones adversas generales que se notificaron con más frecuencia tras la vacunación fueron cefalea (15,7%, 22,0% y 21,5% respectivamente), fatiga (15,6%, 21,9% y 20,7% respectivamente), síntomas gastrointestinales (9,3%, 9,4% y 8,3% respectivamente) y fiebre (8,0%, 5,3% y 4,9% respectivamente).
El perfil de reacciones adversas locales y generales de una dosis de recuerdo de Nimenrix después de la primovacunación con Nimenrix u otras vacunas meningocócicas polisacarídicas conjugadas o no conjugadas, fue similar al perfil de reacciones adversas locales y generales observado después de la primovacunación con Nimenrix, excepto en los síntomas gastrointestinales (incluida la diarrea, los vómitos y las náuseas), que fueron muy frecuentes.
En un estudio aparte se administró una única dosis de Nimenrix a 274 individuos a partir de 56 años de edad. Todas las reacciones adversas notificadas en este estudio ya fueron observadas en los grupos de edad más jóvenes.
Tabla de reacciones adversas
Las reacciones adversas notificadas se listan de acuerdo con la siguiente categoría de frecuencias:
Muy frecuentes: Frecuentes:
Poco frecuentes:
(>1/10)
(>1/100 a <1/10) (>1/1.000 a <1/100)
(>1/10.000 a <1/1.000) (<1/10.000)
|
Sistema de clasificación de Órganos |
Frecuencia |
Reacciones adversas |
|
Ensayos clínicos | ||
|
Trastornos del metabolismo y de la nutrición |
Muy frecuentes |
Pérdida de apetito |
|
Trastornos psiquiátricos |
Muy frecuentes |
Irritabilidad |
|
Poco frecuentes |
Imsomnio, llanto incontenible | |
|
Trastornos del sistema nervioso |
Muy frecuentes |
Adormecimiento, cefalea |
|
Poco frecuentes |
Hipoestesia, mareo | |
|
Trastornos gastrointestinales |
Frecuentes |
Síntomas gastrointestinales (incluyendo diarrea, vómitos y náuseas) |
|
Trastornos de la piel y del tejido subcutáneo |
Poco frecuentes |
Prurito, erupción |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Poco frecuentes |
Mialgia, dolor en la extremidad |
|
Trastornos generales y alteraciones en el lugar de administración |
Muy frecuentes |
Fiebre, inflamación, dolor y enrojecimiento en el lugar de inyección, fatiga |
|
Frecuentes |
Hematoma en el lugar de inyección | |
|
Poco frecuentes |
Malestar general, reacción en el lugar de inyección, (incluyendo induración, prurito, calor, anestesia) | |
|
Experiencia post-comercialización | ||
|
Trastornos generales y alteraciones en el lugar de administración |
Raras |
Hinchazón extensa de la extremidad en el lugar de inyección, frecuentemente asociado con eritema, algunas veces afectando a la articulación adyacente o hinchazón en toda la extremidad donde se administra la vacuna |
Raras: Muy raras:
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Apéndice V.
4.9 Sobredosis
No se ha notificado ningún caso de sobredosis.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: vacunas, vacunas meningocócicas, código ATC: J07AH08 Mecanismo de acción
Los anticuerpos meningocócicos anticapsulares protegen frente a las enfermedades meningocócicas a través de la actividad bactericida mediada por el complemento. Nimenrix induce la producción de anticuerpos bactericidas frente a polisacáridos capsulares de los grupos A, C, W-135 e Y, que se determina mediante ensayos que utilizan complemento de conejo (ABSc) o complemento humano (ABSh).
Efectos farmacodinámicos
Inmunogenicidad
La inmunogenicidad de una dosis de Nimenrix ha sido evaluada en más de 8.000 sujetos > 12 meses.
La eficacia de la vacuna se asumió a partir de la demostración de la no inferioridad inmunológica (fundamentalmente basada en comparar proporciones con títulos de ABSc de al menos 8) frente a otras vacunas meningocócicas autorizadas. La inmunogenicidad se determinó utilizando ABSc o ABSh como marcadores biológicos de eficacia protectora frente a los grupos meningocócicos A, C, W-135 e Y.
Persistencia de la respuesta inmune
Se evaluó la persistencia de la respuesta inmune inducida por Nimenrix hasta 60 meses después de la vacunación en sujetos de los 12 meses a los 55 años de edad.
Los anticuerpos inducidos por Nimenrix fueron similares o superiores a los inducidos por las vacunas meningocócicas autorizadas (es decir, la vacuna MenC-CRM en sujetos de 12-23 meses y la vacuna ACWY-PS en sujetos mayores de 2 años).
Respuesta de recuerdo
En los ensayos clínicos se evaluó el uso de Nimenrix como una dosis de recuerdo después de la primovacunación con Nimenrix u otras vacunas meningocócicas (vacuna conjugada meningocócica tetravalente frente a los grupos A, C, W e Y-DT o vacunas conjugadas monovalentes grupo C).
Lactantes
Inmunogenicidad en niños de 12-23 meses
En los ensayos clínicos MenACWY-TT-039 y MenACWY-TT-040, una única dosis de Nimenrix indujo respuestas de ABSc frente a los cuatro grupos meningocócicos, con una respuesta frente al grupo C comparable a la inducida por la vacuna autorizada MenC-CRM, en términos de porcentajes con títulos de ABSc > 8 (Tabla 1).
Tabla 1: Respuestas de anticuerpos bactericidas (ABSc*) en niños de 12-23 meses
|
Grupo |
Respuesta a |
Estudio MenACWY-TT-039 (1) |
Estudio MenACWY-TT-040 (2) | ||||
|
N |
>8 (IC 95%) |
GMT (IC 95%) |
N |
>8 (IC 95%) |
GMT (IC 95%) | ||
|
A |
Nimenrix |
354 |
99,7% (98,4; 100) |
2.205 (2.008; 2.422) |
183 |
98,4% (95,3; 99,7) |
3.170 (2.577; 3.899) |
|
C |
Nimenrix |
354 |
99,7% (98,4; 100) |
478 (437; 522) |
183 |
97,3% (93,7; 99,1) |
829 (672; 1.021) |
|
Vacuna MenC-CRM |
121 |
97,5% (92,9; 99,5) |
212 (170;265) |
114 |
98,2% (93,8; 99,8) |
691 (521; 918) | |
|
W-135 |
Nimenrix |
354 |
100% (99,0; 100) |
2.682 (2.453; 2.932) |
186 |
98,4% (95,4; 99,7) |
4.022 (3.269; 4.949) |
|
Y |
Nimenrix |
354 |
100% (99,0; 100) |
2.729 (2.473; 3.013) |
185 |
97,3% (93,8; 99,1) |
3.168 (2.522; 3.979) |
El análisis de inmunogenicidad se realizó en las cohortes por protocolo (PP) para la inmunogenicidad.
(1) muestras de sangre tomadas entre 42 y 56 días después de la vacunación
(2) muestras de sangre tomadas entre 30 y 42 días después de la vacunación *determinado en los laboratorios GSK
En el estudio MenACWY-TT-039, la actividad bactericida en suero también se determinó utilizando suero humano como fuente de complemento (ABSh) como variable secundaria (Tabla 2).
Tabla 2: Respuestas de anticuerpos bactericidas (ABSh*) en niños de 12-23 meses
|
Grupo |
Respuesta a |
N |
Estudio MenACWY-TT-039 (1) | |
|
>8 (IC 95%) |
GMT (IC 95%) | |||
|
A |
Nimenrix |
338 |
77,2% (72,4; 81,6) |
19,0 (16,4; 22,1) |
|
C |
Nimenrix |
341 |
98,5% (96,6; 99,5) |
196 (175; 219) |
|
Vacuna MenC-CRM |
116 |
81,9% (73,7; 88,4) |
40,3 (29,5; 55,1) | |
|
W-135 |
Nimenrix |
336 |
87,5% (83,5 ; 90,8) |
48,9 (41,2; 58,0) |
|
Y |
Nimenrix |
329 |
79,3% (74,5; 83,6) |
30,9 (25,8; 37,1) |
El análisis de inmunogenicidad se realizó en la cohorte por protocolo (PP) para la inmunogenicidad. (1) muestras de sangre tomadas entre 42 y 56 días después de la vacunación *determinado en los laboratorios GSK
En el estudio MenACWY-TT-104, se evaluó la respuesta inmune un mes después de la última vacunación después de una o dos dosis de Nimenrix administradas con un intervalo de dos meses. Nimenrix generó respuestas bactericidas frente a los cuatro grupos después de una o dos dosis similares en términos de % con títulos de ABSc >8 y GMT (Tabla 3).
Tabla 3: Respuestas de anticuerpos bactericidas (ABSc)* en niños de 12-14 meses
|
Grupo |
Respuesta a |
Tiempo |
Estudio MenACWY-TT-104 (1) | ||
|
N |
>8 (IC 95%) |
GMT (IC 95%) | |||
|
A |
Nimenrix 1 dosis |
Tras dosis 1 |
181 |
97,8% (94,4; 99,4) |
1445,4 (1126,1; 1855,2) |
|
Nimenrix 2 dosis |
Tras dosis 1 |
158 |
96,8% (92,8; 99,0) |
1275,2 (970,5; 1675,4) | |
|
Tras dosis 2 |
150 |
98,0% (94,3; 99,6) |
1176,3 (921,8; 1501) | ||
|
C |
Nimenrix 1 dosis |
Tras dosis 1 |
180 |
95,0% (90,7; 97,7) |
454,4 (347,7; 593,8) |
|
Nimenrix 2 dosis |
Tras dosis 1 |
157 |
95,5% (91,0; 98,2) |
369,3 (280,9; 485,5) | |
|
Tras dosis 2 |
150 |
98,7% (95,3; 99,8) |
639,1 (521,8; 782,9) | ||
|
W-135 |
Nimenrix 1 dosis |
Tras dosis 1 |
181 |
95,0% (90,8; 97,7) |
2136,1 (1614,9; 2825,5) |
|
Nimenrix 2 dosis |
Tras dosis 1 |
158 |
94,9% (90,3; 97,8) |
2030,1 (1510,7; 2728,2) | |
|
Tras dosis 2 |
150 |
100% (97,6; 100) |
3533 (2914,5; 4282,7) | ||
|
Y |
Nimenrix 1 dosis |
Tras dosis 1 |
181 |
92,8% (88,0; 96,1) |
955,8 (709,1; 1288,3) |
|
Nimenrix 2 dosis |
Tras dosis 1 |
157 |
93,6% (88,6; 96,9) |
933,3 (692,3; 1258,3) | |
|
Tras dosis 2 |
150 |
99,3% (96,3; 100) |
1133,6 (944,5; 1360,5) |
El análisis de inmunogenicidad se realizó en la cohorte por protocolo (PP) para la inmunogenicidad (1) muestras de sangre tomadas entre 21 y 48 días después de la vacunación *determinado en los laboratorios del “Public Health England”, Reino Unido
En el estudio MenACWY-TT-104, la actividad bactericida en suero también se determinó utilizando ABSh como variable secundaria. Nimenrix generó respuestas bactericidas frente a los grupos W-135 e Y, que fueron superiores en términos de % con títulos de ABSh >8 cuando se administraron dos dosis en comparación con una. Se observaron respuestas similares frente a los grupos A y C en términos de % con títulos de ABSh >8 (Tabla 4).
Tabla 4: Respuestas de anticuerpos bactericidas (ABSh)* en niños de 12-14 meses
|
Grupo |
Respuesta a |
Tiempo |
Estudio MenACWY-TT-104 (1) | ||
|
N |
>8 (IC 95%) |
GMT (IC 95%) | |||
|
A |
Nimenrix 1 dosis |
Tras dosis 1 |
75 |
96,0% (88,8; 99,2) |
119,3 (88,0; 161,7) |
|
Nimenrix 2 dosis |
Tras dosis 1 |
66 |
97,0% (89,5; 99,6) |
132,9 (98,1; 180,1) | |
|
Tras dosis 2 |
66 |
97,0% (89,5; 99,6) |
170,5 (126,2; 230,2) | ||
|
C |
Nimenrix 1 dosis |
Tras dosis 1 |
79 |
98,7% (93,1; 100) |
151,2 (104,7; 218,3) |
|
Nimenrix 2 dosis |
Tras dosis 1 |
70 |
95,7% (88,0; 99,1) |
161 (110; 236) | |
|
Tras dosis 2 |
69 |
100% (94,8; 100) |
1753,3 (1277,7; 2404,2) | ||
|
W-135 |
Nimenrix 1 dosis |
Tras dosis 1 |
72 |
62,5% (50,3; 73,6) |
27,5 (16,1; 46,8) |
|
Nimenrix 2 dosis |
Tras dosis 1 |
61 |
68,9% (55,7; 80,1) |
26,2 (16,0; 43,0) | |
|
Tras dosis 2 |
70 |
97,1% (90,1; 99,7) |
756,8 (550,1; 1041,3) | ||
|
Y |
Nimenrix 1 dosis |
Tras dosis 1 |
71 |
67,6% (55,5; 78,20) |
41,2 (23,7; 71,5) |
|
Nimenrix 2 dosis |
Tras dosis 1 |
56 |
64,3% (50,4; 76,6) |
31,9 (17,6; 57,9) | |
|
Tras dosis 2 |
64 |
95,3% (86,9; 99,0) |
513,0 (339,4; 775,4) |
El análisis de inmunogenicidad se realizó en la cohorte por protocolo (PP) para la inmunogenicidad (1) muestras de sangre tomadas entre 21 y 48 días después de la vacunación *determinado en los laboratorios GSK
Persistencia de la respuesta inmune en niños de 12-23 meses
En los estudios MenACWY-TT-048 y MenACWY-TT-032, se evaluó la persistencia de la respuesta inmune mediante ABSc y ABSh en niños primovacunados entre los 12-23 meses (lactantes), hasta 4 años después de la primovacunación en el estudio MenACWY-TT-039 (Tabla 5), y hasta 5 años después de la primovacunación en el estudio MenACWY-TT-027 (Tabla 6) respectivamente.
Tabla 5: Datos de persistencia a 4 años en niños de 12-23 meses en el momento de la vacunación (estudio MenACWY-TT-048)
|
Grupo |
Respuesta a |
Punto tempo ral (Año) |
ABSc* |
ABS |
h** | |||
|
N |
>8 (IC 95%) |
GMT (IC 95%) |
N |
>8 (IC 95%) |
GMT (IC 95%) | |||
|
A*** |
Nimenrix |
3 |
262 |
59,9% (53,7; 65,9) |
19,3 (15,7; 23,6) |
251 |
35,9% (29,9; 42,1) |
5,8 (4,8; 7,0) |
|
4 |
224 |
74,1% (67,9; 79,7) |
107 (77,6; 148) |
198 |
28,8% (22,6; 35,6) |
4,9 (4,0; 6,0) | ||
|
C |
Nimenrix |
3 |
262 |
35,9% (30,1; 42,0) |
9,8 (8,1; 11,7) |
253 |
78,3% (72,7; 83,2) |
37,8 (29,4; 48,6) |
|
4 |
225 |
40,4% (34,0; 47,2) |
12,3 (9,8; 15,3) |
209 |
73,2% (66,7; 79,1) |
32,0 (23,8; 43,0) | ||
|
Vacuna MenC- CRM |
3 |
46 |
13,0% (4,9; 26,3) |
5,7 (4,2; 7,7) |
31 |
41,9% (24,5; 60,9) |
6,2 (3,7; 10,3) | |
|
4 |
45 |
35,6% (21,9; 51,2) |
13,5 (7,4; 24,5) |
32 |
46,9% (29,1; 65,3) |
11,3 (4,9; 25,6) | ||
|
W-135 |
Nimenrix |
3 |
261 |
49,8% (43,6; 56,0) |
24,9 (19,2; 32,4) |
254 |
82,3% (77,0; 86,8) |
52,0 (41,4; 65,2) |
|
4 |
225 |
49,3% (42,6; 56,1) |
30,5 (22,4; 41,5) |
165 |
80,6% (73,7; 86,3) |
47,1 (35,7; 62,2) | ||
|
Y |
Nimenrix |
3 |
262 |
53,8% (47,6; 60,0) |
22,3 (17,6; 28,4) |
250 |
72,0% (66,0; 77,5) |
33,2 (25,9; 42,5) |
|
4 |
225 |
58,2% (51,5; 64,7) |
36,2 (27,1; 48,4) |
130 |
65,4% (56,5; 73,5) |
29,8 (20,2; 44,1) | ||
El análisis de inmunogenicidad se realizó en la cohorte por protocolo (PP) para la persistencia adaptada para cada punto temporal.
* determinación de ABSc realizada en los laboratorios del “Public Health England”, Reino Unido **determinado en los laboratorios GSK
***de forma similar al aumento en las GMTs de ABSc para MenA, se observó un aumento en la media geométrica de las concentraciones de IgG para MenA entre el tercer y el cuarto año.
Tabla 6: Datos de persistencia a 5 años en niños de 12-23 meses en el momento de la vacunación (estudio MenACWY-TT-032)
|
Grupo |
Respuesta a |
Punto tempo ral (Año) |
ABSc* |
ABSh** | ||||
|
N |
>8 (IC 95%) |
GMT (IC 95%) |
N |
>8 (IC 95%) |
GMT (IC 95%) | |||
|
A |
Nimenrix |
4 |
45 |
64,4% (48,8; 78,1) |
35,1 (19,4; 63,4) |
44 |
52,3% (36,7; 67,5) |
8,8 (5,4; 14,2) |
|
5 |
49 |
73,5% (58,9; 85,1) |
37,4 (22,1; 63,2) |
45 |
35,6% (21,9; 51,2) |
5,2 (3,4; 7,8) | ||
|
C |
Nimenrix |
4 |
45 |
97,8% (88,2; 99,9) |
110 (62,7; 192) |
45 |
97,8% (88,2; 99,9) |
370 (214; 640) |
|
5 |
49 |
77,6% (63,4; 88,2) |
48,9 (28,5; 84,0) |
48 |
91,7% (80,0; 97,7) |
216 (124; 379) | ||
|
Vacuna MenC- CRM |
4 |
10 |
80,0% (44,4; 97,5) |
137 (22,6; 832) |
10 |
70,0% (34,8; 93,3) |
91,9 (9,8; 859) | |
|
5 |
11 |
63,6% (30,8; 89,1) |
26,5 (6,5; 107) |
11 |
90,9% (58,7; 99,8) |
109 (21,2; 557) | ||
|
W-135 |
Nimenrix |
4 |
45 |
60,0% (44,3; 74,3) |
50,8 (24,0; 108) |
45 |
84,4% (70,5; 93,5) |
76,9 (44,0; 134) |
|
5 |
49 |
34,7% (21,7; 49,6) |
18,2 (9,3; 35,3) |
46 |
82,6% (68,6; 92,2) |
59,7 (35,1; 101) | ||
|
Y |
Nimenrix |
4 |
45 |
62,2% (46,5; 76,2) |
44,9 (22,6; 89,3) |
41 |
87,8% (73,8; 95,9) |
74,6 (44,5; 125) |
|
5 |
49 |
42,9% (28,8; 57,8) |
20,6 (10,9; 39,2) |
45 |
80,0% (65,4; 90,4) |
70,6 (38,7; 129) | ||
La persistencia de la inmunogenicidad se analizó usando la cohorte por protocolo (PP) del año 5. Es posible que un sesgo de selección, debido principalmente a la revacunación de sujetos con títulos de ABSc <8 para MenC y a su exclusión de el(los) siguiente(s) punto(s) temporal(es), haya llevado a una sobreestimación de los títulos.
* determinación de ABSc realizada en los laboratorios del “Public Health England”, Reino Unido **determinado en los laboratorios GSK
Memoria inmune
En el estudio MenACWY-TT-014 se evaluó la inducción de memoria inmune un mes después de la administración de un quinto de la dosis de la vacuna ACWY-PS (10 ^g de cada polisacárido) a niños en el tercer año de vida que habían sido previamente primovacunados entre los 12 y los 14 meses de edad en el estudio MenACWY-TT-013 con Nimenrix o con una vacuna MenC-CRM autorizada.
Un mes después de la dosis de exposición, las GMTs inducidas en los sujetos primovacunados con Nimenrix se incrementaron de 6,5 a 8 veces para los grupos A, C, W-135 e Y, indicando que Nimenrix induce memoria inmune frente a los grupos A, W-135 e Y. La GMT de ABSc para MenC postexposición fue similar en ambos grupos del estudio, indicando que Nimenrix induce una memoria inmune frente al grupo C análoga a la de la vacuna MenC-CRM autorizada (Tabla 7).
Tabla 7: Respuesta inmune (ABSc*) 1 mes después de una dosis de exposición en sujetos primovacunados entre los 12 y los 14 meses de edad con Nimenrix o con una vacuna MenC-
CRM
|
Grupo |
Respuesta a |
Pre-exposición |
Post-exposición | ||
|
N |
GMT (IC 95%) |
N |
GMT (IC 95%) | ||
|
A |
Nimenrix |
32 |
544 (325; 911) |
25 |
3.322 (2.294; 4.810) |
|
C |
Nimenrix |
31 |
174 (105; 289) |
32 |
5.966 (4.128; 8.621) |
|
Vacuna |
28 |
34,4 |
30 |
5.265 | |
|
MenC-CRM |
(15,8; 75,3) |
(3.437; 8.065) | |||
|
W-135 |
Nimenrix |
32 |
644 (394; 1.052) |
32 |
11.058 (8.587; 14.240) |
|
Y |
Nimenrix |
32 |
440 (274; 706) |
32 |
5.737 (4.216; 7.806) |
El análisis de inmunogenicidad se realizó en la cohorte por protocolo (PP) para la inmunogenicidad.
*determinado en los laboratorios GSK
Niños
Inmunogenicidad en niños de 2-10 años
En dos estudios comparativos realizados en sujetos de 2-10 años, un grupo de sujetos recibió una dosis de Nimenrix y un segundo grupo recibió una dosis de una vacuna autorizada MenC-CRM (estudio MenACWY-TT-081) o de la vacuna autorizada meningocócica polisacarídica no conjugada de los grupos A, C, W-135 e Y (ACWY-PS) de GlaxoSmithKline Biologicals (estudio MenACWY-TT-038), como comparador.
En MenACWY-TT-038, Nimenrix demostró no inferioridad respecto a la vacuna ACWY-PS autorizada en términos de respuesta vacunal a los cuatro grupos (A, C, W-135 e Y) (ver Tabla 8).
La respuesta vacunal se definió como la proporción de sujetos con:
• títulos ABSc > 32 en sujetos inicialmente seronegativos (es decir, con un título ABSc
prevacunación < 8)
• un incremento de al menos 4 veces de los títulos ABSc entre el momento pre y postvacunación,
en sujetos inicialmente seropositivos (es decir, con un título ABSc prevacunación > 8)
En MenACWY-TT-081, Nimenrix demostró no inferioridad respecto a otra vacuna MenC-CRM autorizada en términos de respuesta vacunal al grupo C [94,8% (IC 95%: 91,4; 97,1) y 95,7% (IC 95%: 89,2; 98,8) respectivamente], las GMTs fueron inferiores en el grupo de Nimenrix [2.795 (IC 95%: 2.393; 3.263)] con respecto a las de la vacuna MenC-CRM [5.292 (IC 95%: 3.815; 7.340].
Tabla 8: Respuestas de anticuerpos bactericidas (ABSc*) a Nimenrix y a la vacuna ACWY-PS
|
Grupo |
Nimenrix |
Vacuna ACWY-PS | ||||
|
N |
RV (IC 95%) |
GMT (IC 95%) |
N |
RV (IC 95%) |
GMT (IC 95%) | |
|
A |
594 |
89,1% (86,3; 91,5) |
6.343 (5.998; 6.708) |
192 |
64,6% (57,4; 71,3) |
2.283 (2.023; 2.577) |
|
C |
691 |
96,1% (94,4; 97,4) |
4.813 (4.342; 5.335) |
234 |
89,7% (85,1; 93,3) |
1.317 (1.043; 1.663) |
|
W-135 |
691 |
97,4% (95,9; 98,4) |
11.543 (10.873; 12.255) |
236 |
82,6% (77,2; 87,2) |
2.158 (1.815; 2.565) |
|
Y |
723 |
92,7% (90,5; 94,5) |
10.825 (10.233; 11.452) |
240 |
68,8% (62,5; 74,6) |
2.613 (2.237; 3.052) |
El análisis de inmunogenicidad se realizó en la cohorte por protocolo (PP) para la inmunogenicidad.
RV: respuesta vacunal
*determinado en los laboratorios GSK
Persistencia de la respuesta inmune en niños de 2-10 años
Persistencia de la respuesta inmune en niños de 2-10 años
En el estudio MenACWY-TT-088, se evaluó la persistencia de la respuesta inmune mediante ABSc y ABSh hasta 44 meses después de la vacunación en niños de 2-10 años primovacunados en el estudio MenACWY-TT-081 (Tabla 9).
Tabla 9: Datos de persistencia a 44 meses en niños de 2-10 años en el momento de la vacunación
|
Grupo |
Respuesta a |
Punto temporal (meses) |
ABSc* |
ABSh** | ||||
|
N |
>8 (IC 95%) |
GMT (IC 95%) |
N |
>8 (IC 95%) |
GMT (IC 95%) | |||
|
A |
Nimenrix |
32 |
193 |
86,5% (80,9; 91,0) |
196 (144; 267) |
90 |
25,6% (16,9; 35,8) |
4,6 (3,3; 6,3) |
|
44 |
189 |
85,7% (79,9; 90,4) |
307 (224;423) |
89 |
25,8% (17,1; 36,2) |
4,8 (3,4; 6,7) | ||
|
C |
Nimenrix |
32 |
192 |
64,6% (57,4; 71,3) |
34,8 (26,0; 46,4) |
90 |
95,6% (89,0; 98,8) |
75,9 (53,4; 108) |
|
44 |
189 |
37,0% (30,1; 44,3) |
14,5 (10,9; 19,2) |
82 |
76,8% (66,2; 85,4) |
36,4 (23,1; 57,2) | ||
|
Vacuna MenC- CRM |
32 |
69 |
76,8% (65,1; 86,1) |
86,5 (47,3; 158) |
33 |
90,9% (75,7; 98,1) |
82,2 (34,6; 196) | |
|
44 |
66 |
45,5% (33,1; 58,2) |
31,0 (16,6; 58,0) |
31 |
64,5% (45,4; 80,8) |
38,8 (13,3; 113) | ||
|
W-135 |
Nimenrix |
32 |
193 |
77,2% (70,6; 82,9) |
214 (149; 307) |
86 |
84,9% (75,5; 91,7) |
69,9 (48,2; 101) |
|
44 |
189 |
68,3% (61,1; 74,8) |
103 (72,5; 148) |
87 |
80,5% (70,6; 88,2) |
64,3 (42,7; 96,8) | ||
|
Y |
Nimenrix |
32 |
193 |
81,3% (75,1; 86,6) |
227 (165; 314) |
91 |
81,3% (71,8; 88,7) |
79,2 (52,5; 119) |
|
44 |
189 |
62,4% (55,1; 69,4) |
78,9 (54,6; 114) |
76 |
82,9% (72,5; 90,6) |
127 (78,0; 206) | ||
El análisis de inmunogenicidad se realizó en la cohorte por protocolo (PP) para la persistencia adaptada para cada punto temporal.
* determinación de ABSc realizada en los laboratorios del “Public Health England”, Reino Unido
**determinado en los laboratorios GSK
Persistencia de la respuesta inmune en niños de 6-10 años
En el estudio MenACWY-TT-028, se evaluó la persistencia de la respuesta inmune mediante ABSh 1 año después de la vacunación en niños de 6-10 años primovacunados en el estudio MenACWY-TT-027 (Tabla 10) (ver sección 4.4).
Tabla 10: Datos a 1 mes después de la vacunación y datos de persistencia a 1 año (ABSh*) en niños de 6-10 años
|
Grupo |
Respuesta a |
1 mes después de la vacunación |
Persistencia a 1 año | ||||
|
N |
>8 (IC 95%) |
GMT (IC 95%) |
N |
>8 (IC 95%) |
GMT (IC 95%) | ||
|
A |
Nimenrix |
105 |
80,0 % (71,1; 87,2) |
53,4 (37,3; 76,2) |
104 |
16,3% (9,8; 24,9) |
3,5 (2,7; 4,4) |
|
ACWY-PS |
35 |
25,7% (12,5;43,3) |
4,1 (2,6;6,5) |
35 |
5,7% (0,7;19,2) |
2,5 (1,9;3,3) | |
|
C |
Nimenrix |
101 |
89,1% (81,3;94,4) |
156 (99,3;244) |
105 |
95,2% (89,2;98,4) |
129 (95,4;176) |
|
ACWY-PS |
38 |
39,5% (24,0;56,6) |
13,1 (5,4;32,0) |
31 |
32,3% (16,7;51,4) |
7,7 (3,5;17,3) | |
|
W-135 |
Nimenrix |
103 |
95,1% (89,0;98,4) |
133 (99,9;178) |
103 |
100% (96,5;100) |
257 (218;302) |
|
ACWY-PS |
35 |
34,3% (19,1;52,2) |
5,8 (3,3;9,9) |
31 |
12,9% (3,6;29,8) |
3,4 (2,0;5,8) | |
|
Y |
Nimenrix |
89 |
83,1% (73,7;90,2) |
95,1 (62,4;145) |
106 |
99,1% (94,9;100) |
265 (213;330) |
|
ACWY-PS |
32 |
43,8% |
12,5 |
36 |
33,3% |
9,3 | |
|
(26,4;62,3) |
(5,6;27,7) |
(18,6;51,0) |
(4,3;19,9) |
El análisis de inmunogenicidad se realizó en la cohorte por protocolo (PP) para la persistencia. *determinado en los laboratorios GSK
Adolescentes y adultos
Inmunogenicidad en adolescentes de 11-17 años y adultos >18 años
En dos ensayos clínicos, realizados en adolescentes de 11-17 años (estudio MenACWY-TT-036) y en adultos de 18-55 años (estudio MenACWY-TT-035), se administró una dosis de Nimenrix o una dosis de la vacuna ACWY-PS.
Como se ha mencionado antes, Nimenrix demostró que era inmunológicamente no inferior a la vacuna ACWY-PS en términos de respuesta vacunal, tanto en adolescentes como en adultos (Tabla 11). La respuesta a los cuatro grupos meningocócicos inducida por Nimenrix fue similar o superior a la inducida por la vacuna ACWY-PS.
Tabla 11: Respuestas de anticuerpos bactericidas (ABSc*) a Nimenrix y a la vacuna ACWY-PS en adolescentes de 11-17 años y adultos >18 años un mes después de la vacunación_
|
Estudio (Rango de edad) |
Grupo |
Nimenrix |
Vacuna ACWY-PS | ||||
|
N |
RV (IC 95%) |
GMT (IC 95%) |
N |
RV (IC 95%) |
GMT (IC 95%) | ||
|
Estudio MenACWY-TT-036 (11-17 años) |
A |
553 |
85,4% (82,1; 88,2) |
5.928 (5.557; 6.324) |
191 |
77,5% (70,9; 83,2) |
2.947 (2.612; 3.326) |
|
C |
642 |
97,4% (95,8; 98,5) |
13.110 (11.939; 14.395) |
211 |
96,7% (93,3; 98,7) |
8.222 (6.807; 9.930) | |
|
W-135 |
639 |
96,4% (94,6; 97,7) |
8.247 (7.639; 8.903) |
216 |
87,5% (82,3; 91,6) |
2.633 (2.299; 3.014) | |
|
Y |
657 |
93,8% (91,6; 95,5) |
14.086 (13.168; 15.069) |
219 |
78,5% (72,5; 83,8) |
5.066 (4.463; 5.751) | |
|
Estudio MenACWY-TT-035 (18-55 años) |
A |
743 |
80,1% (77,0; 82,9) |
3.625 (3.372; 3.897) |
252 |
69,8% (63,8; 75,4) |
2.127 (1.909; 2.370) |
|
C |
849 |
91,5% (89,4; 93,3) |
8.866 (8.011; 9.812) |
288 |
92,0% (88,3; 94,9) |
7.371 (6.297; 8.628) | |
|
W-135 |
860 |
90,2% (88,1; 92,1) |
5.136 (4.699; 5.614) |
283 |
85,5% (80,9; 89,4) |
2.461 (2.081; 2.911) | |
|
Y |
862 |
87,0% (84,6; 89,2) |
7.711 (7.100; 8.374) |
288 |
78,8% (73,6; 83,4) |
4.314 (3.782; 4.921) | |
El análisis de inmunogenicidad se realizó en las cohortes por protocolo (PP) para la inmunogenicidad.
RV: respuesta vacunal
*determinado en los laboratorios GSK
En un estudio aparte (MenACWY-TT-085) se administró una única dosis de Nimenrix a 194 adultos libaneses a partir de 56 años de edad (incluyendo 133 con edades entre 56-65 años y 61 mayores de 65 años). El porcentaje de sujetos con títulos ABSc (medidos en los laboratorios de GSK) > 128 antes de la vacunación osciló entre el 45% (grupo C) y el 62% (grupo Y). En conjunto, un mes después de la vacunación el porcentaje de sujetos vacunados con títulos ABSc > 128 osciló entre el 93% (grupo C) y el 97% (grupo Y). En el subgrupo de edad de mayores de 65 años el porcentaje de sujetos vacunados con títulos ABSc > 128 un mes después de la vacunación osciló entre el 90% (grupo A) y el 97% (grupo Y).
Persistencia de la respuesta inmune en adolescentes de 11-17 años
En el estudio MenACWY-TT-043, se evaluó la persistencia de la respuesta inmune 5 años después de la vacunación en adolescentes primovacunados en el estudio MenACWY-TT-036 (Tabla 12). Ver tabla 11 para los resultados primarios de este estudio.
Tabla 12: Datos de persistencia a 5 años (ABSc*) en adolescentes de 11-17 años en el momento de la vacunación
|
Grupo |
Punto tempo ral (Año) |
Nimenrix |
Vacuna ACWY-PS | ||||
|
N |
>8 (IC 95%) |
GMT (IC 95%) |
N |
>8 (IC 95%) |
GMT (IC 95%) | ||
|
A |
3 |
449 |
92,9% (90,1; 95,1) |
448 (381; 527) |
150 |
82,7% (75,6; 88,4) |
206 (147; 288) |
|
5 |
236 |
97,5% (94,5; 99,1) |
644 (531; 781) |
86 |
93.0% (85,4; 97,4) |
296 (202; 433) | |
|
C |
3 |
449 |
91,1% (88,1; 93,6) |
371 (309; 446) |
150 |
86,0% (79,4; 91;1) |
390 (262; 580) |
|
5 |
236 |
88,6% (83,8; 92,3) |
249 (194; 318) |
85 |
87,1% (78,0; 93,4) |
366 (224; 599) | |
|
W-135 |
3 |
449 |
82,0% (78,1; 85,4) |
338 (268; 426) |
150 |
30,0% (22,8; 38,0) |
16,0 (10,9; 23,6) |
|
5 |
236 |
86,0% (80,9; 90,2) |
437 (324; 588) |
86 |
34,9% (24,9; 45,9) |
19,7 (11,8; 32,9) | |
|
Y |
3 |
449 |
93,1% (90,3; 95,3) |
740 (620; 884) |
150 |
58,0% (49,7; 66,0) |
69,6 (44,6; 109) |
|
5 |
236 |
96,6% (93,4; 98,5) |
1000 (824; 1214) |
86 |
66,3% (55,3; 76,1) |
125 (71,2; 219) | |
El análisis de inmunogenicidad se realizó en la cohorte por protocolo (PP) para la persistencia adaptada para cada punto temporal.
* determinación de ABSc realizada en los laboratorios del “Public Health England”, Reino Unido.
Persistencia de la respuesta inmune en adolescentes y adultos de 11-25 años
En el estudio MenACWY-TT-059, se evaluó la persistencia de la respuesta inmune mediante ABSh, 1 y 5 años después de la vacunación en adolescentes y adultos de 11-25 años primovacunados en el estudio MenACWY-TT-052 (Tabla 13) (ver sección 4.4).
Tabla 13: Datos a 1 mes después de la vacunación y datos de persistencia a 5 años (ABSh*) en
adolescentes y adultos de 11-25 años
|
Grupo |
Respuesta a |
Punto temporal |
N |
>8 (IC 95%) |
GMT (IC 95%) |
|
Mes 1 |
356 |
82,0% (77,6; 85,9) |
58,7 (48,6; 70,9) | ||
|
A |
Nimenrix |
Año 1 |
350 |
29,1% (24,4; 34,2) |
5,4 (4,5; 6,4) |
|
Año 5 |
141 |
48,9% (40,4; 57,5) |
8,9 (6,8; 11,8) | ||
|
Mes 1 |
359 |
96,1% (93,5; 97,9) |
532 (424;668) | ||
|
C |
Nimenrix |
Año 1 |
336 |
94,9% (92,0; 97,0) |
172 (142; 207) |
|
Año 5 |
140 |
92,9% (87,3; 96,5) |
94,6 (65,9; 136) | ||
|
Mes 1 |
334 |
91,0% (87,4; 93,9) |
117 (96,8; 141) | ||
|
W-135 |
Nimenrix |
Año 1 |
327 |
98,5% (96,5; 99,5) |
197 (173;225) |
|
Año 5 |
138 |
87,0% (80,2; 92,1) |
103 (76,3; 140) |
|
Mes 1 |
364 |
95,1% (92,3; 97,0) |
246 (208;291) | ||
|
Y |
Nimenrix |
Año 1 |
356 |
97,8% (95,6; 99,0) |
272 (237; 311) |
|
Año 5 |
142 |
94,4% (89,2; 97,5) |
225 (174; 290) |
El análisis de inmunogenicidad se realizó en la coi adaptada para cada punto temporal.
íorte por protocolo (PP) para la persistencia
*determinado en los laboratorios GSK
Respuesta de recuerdo para sujetos vacunados previamente con una vacuna meningocócica conjugada frente a Neisseria meningitidis
Vacunación de recuerdo con Nimenrix después de la primovacunación en lactantes, niños, adolescentes y adultos: más del 99,0% de los sujetos de 1 o más años de edad primovacunados con Nimenrix y que recibieron una dosis de recuerdo con Nimenrix 4 o 5 años más tarde alcanzaron títulos ABS > 1:8 en ambos ensayos (estudios MenACWY-TT-062, 048, 059, 088). Las GMTs inducidas un mes después de la dosis de recuerdo fueron significativamente mayores que las inducidas en los grupos control no tratados, por grupos de edad, indicando que Nimenrix induce memoria inmune frente a los grupos A, C, W-135 e Y.
La respuesta del grupo C observada tras la vacunación de recuerdo con Nimenrix fue similar a la observada en sujetos primovacunados y que recibieron una vacuna de recuerdo monovalente conjugada MenC-CRM. Un año después de la vacunación de recuerdo, los títulos ABS > 1:8 persistieron en al menos el 95,5% de los sujetos (estudio MenACWY-TT-048 con primovacunación a los 12-23 meses).
Cuando se administró Nimenrix como vacuna de recuerdo después de la primovacunación con una vacuna conjugada MenACWY-DT o una vacuna conjugada monovalente grupo C (estudio MenACWY-TT-059 con primovacunación a los 10-25 años y estudio MenACWY-TT-088 con primovacunación a los 2-10 años), los títulos aumentaron de 48 a 340 veces en todos los grupos y el 100% de los sujetos alcanzaron títulos ABS > 1:8.
Respuesta de recuerdo para sujetos vacunados previamente con una vacuna polisacarídica no conjugada frente a Neisseria meningitidis
En el estudio MenACWY-TT-021 realizado en sujetos de 4,5 a 34 años, se comparó la inmunogenicidad de Nimenrix administrada entre 30 y 42 meses después de la vacunación con una vacuna ACWY-PS y la inmunogenicidad de Nimenrix administrada a sujetos de la misma edad que no habían sido vacunados con ninguna vacuna meningocócica en los 10 años anteriores. Se observó una respuesta inmune (título ABSc > 8) frente a todos los grupos (A, C, W-135, Y) en todos los sujetos independientemente de la historia de vacunación meningocócica. Las GMTs de ABSc fueron significativamente menores en los sujetos que habían recibido una dosis de la vacuna ACWY-PS entre 30 y 42 meses antes de recibir Nimenrix (Tabla 14) (ver sección 4.4).
Tabla 14: Respuesta inmune (ABSc*) 1 mes después de la vacunación con Nimenrix en sujetos de acuerdo con su historia de vacunación meningocócica_
|
Grupo |
Sujetos vacunados entre 30 y 42 meses antes con ACWY-PS |
Sujetos que no habían recibido ninguna vacuna meningocócica en los 10 años anteriores | ||||
|
N |
>8 (IC 95%) |
GMT (IC 95%) |
N |
>8 (IC 95%) |
GMT (IC 95%) | |
|
A |
146 |
100% (97,5; 100) |
6.869 (6.045; 7.805) |
69 |
100% (94,8; 100) |
13.015 (10.722; 15.798) |
|
C |
169 |
100% (97,8; 100) |
1.946 (1.583; 2.391) |
75 |
100% (95,2; 100) |
5.495 (4.266; 7.076) |
|
W-135 |
169 |
100% (97,8; 100) |
4.636 (3.942; 5.451) |
75 |
100% (95,2; 100) |
9.078 (7.088; 11.627) |
|
Y |
169 |
100% (97,8; 100) |
7.800 (6.683; 9.104) |
75 |
100% (95,2; 100) |
13.895 (11.186; 17.261) |
|
El análisis de inmunogenicidad se realizó en las cohortes por protocolo (PP) para |
la inmunogenicidad. | |||||
*determinado en los laboratorios GSK
La Agencia Europea de Medicamentos ha concedido al titular un aplazamiento para presentar los resultados de los estudios realizados con Nimenrix en uno o más grupos de la población pediátrica en la prevención de la enfermedad meningocócica causada por Neisseria meningitidis de los grupos A, C, W-135 e Y (ver sección 4.2 para consultar la información sobre el uso en población pediátrica).
5.2 Propiedades farmacocinéticas
No procede.
5.3 Datos preclínicos sobre seguridad
Los datos de los estudios no clínicos no muestran riesgos especiales para los seres humanos según los estudios de tolerancia local, toxicidad aguda, toxicidad a dosis repetidas, toxicidad para la reproducción y el desarrollo y estudios de fertilidad.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Polvo:
Sacarosa
Trometamol
Disolvente:
Cloruro de sodio
Agua para preparaciones inyectables
6.2 Incompatibilidades
En ausencia de estudios de compatibilidad, este medicamento no debe mezclarse con otros.
6.3 Periodo de validez
3 años
Tras la reconstitución:
Tras la reconstitución, la vacuna debe administrarse rápidamente. Aunque no se recomienda retrasar su administración, se ha demostrado que es estable durante 8 horas a 30°C tras la reconstitución. No administrar la vacuna si no se usa en el plazo de 8 horas.
6.4 Precauciones especiales de conservación
Conservar en nevera (entre 2°C y 8°C).
No congelar.
Conservar en el embalaje original para protegerla de la luz.
Para las condiciones de conservación tras la reconstitución del medicamento, ver sección 6.3.
6.5 Naturaleza y contenido del envase
Polvo en un vial (vidrio de tipo I) con un tapón (goma de butilo) y disolvente en una ampolla (vidrio de tipo I).
Tamaños de envase de 1, 10 y 100.
Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Instrucciones para la reconstitución de la vacuna con el disolvente en ampollas
Nimenrix se debe reconstituir añadiendo todo el contenido de la ampolla al vial que contiene el polvo.
1. Romper la parte superior de la ampolla, extraer el disolvente con una jeringa y añadir el disolvente al polvo.
2. Agitar bien la mezcla hasta que el polvo esté completamente disuelto en el disolvente.
La vacuna reconstituida es una solución transparente incolora.
Se debe inspeccionar visualmente el contenido de la vacuna reconstituida para observar si existe alguna sustancia extraña y/o variación del aspecto físico antes de su administración. En caso de que se observe alguna de estas circunstancias, desechar la vacuna.
Tras la reconstitución, la vacuna debe administrarse rápidamente.
Se debe utilizar una aguja nueva para administrar la vacuna.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Pfizer Limited Ramsgate Road Sandwich Kent CT13 9NJ Reino Unido
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/12/767/005
EU/1/12/767/006
EU/1/12/767/007
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 20/04/2012.
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
A. FABRICANTES DE LOS PRINCIPIOS ACTIVOS BIOLÓGICOS Y FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
A. FABRICANTES DE LOS PRINCIPIOS ACTIVOS BIOLÓGICOS Y FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección de los fabricantes de los principios activos biológicos
GlaxoSmithKline Biologicals S.A.
89, rue de l’Institut B-1330 Rixensart Bélgica
GlaxoSmithKline Biologicals Kft.
Homoki Nagy István utca 1.
2100 Gódólló Hungría
GlaxoSmithKline Biologicals S.A.
Parc de la Noire Epine 20, rue Fleming B-1300 Wavre Bélgica
Nombre y dirección del fabricante responsable de la liberación de los lotes
Pfizer Manufacturing Belgium N.V.
Rijksweg 12 B-2870 Puurs Bélgica
El prospecto impreso del medicamento debe especificar el nombre y dirección del fabricante responsable de la liberación del lote en cuestión.
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica.
• Liberación oficial de los lotes
De conformidad con el Artículo 114 de la Directiva 2001/83/CE modificada, la liberación oficial de los lotes será realizada por un laboratorio estatal o uno designado a tal efecto.
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPS)
Los requerimientos para la presentación de los informes periódicos de seguridad para este medicamento se establecen en la lista de fechas de referencia de la Unión (lista EURD) prevista en el artículo 107ter, apartado 7, de la Directiva 2001/83/CE y cualquier actualización posterior publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado
en la versión del PGR incluido en el Módulo 1.8.2. de la Autorización de Comercialización y en
cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos.
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
• Obligación de llevar a cabo medidas post-autorización
El TAC deberá llevar a cabo, dentro del plazo establecido, las siguientes medidas:
|
Descripción |
Fecha límite |
|
Estudio para evaluar los títulos de anticuerpos de forma inmediata y a más largo plazo generados por una o dos dosis de Nimenrix administradas en niños de 1223 meses. Los datos de seguridad y de persistencia de anticuerpos hasta el año 5 y los datos sobre la administración conjunta de MenACWY-TT con Prevenar 13 se proporcionarán en los informes de estudios secuenciales a los 1, 3 y 5 años posteriores a la vacunación. |
Informe del estudio clínico a 1 año, primer trimestre de 2017 Informe del estudio clínico a los 3 años, primer trimestre de 2019 Informe del estudio clínico a los 5 años, primer trimestre de 2021 |
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR 1 VIAL Y 1 JERINGA PRECARGADA SIN AGUJA 1 VIAL Y 1 JERINGA PRECARGADA CON 2 AGUJAS 10 VIALES Y 10 JERINGAS PRECARGADAS SIN AGUJAS 10 VIALES Y 10 JERINGAS PRECARGADAS CON 20 AGUJAS
1. NOMBRE DEL MEDICAMENTO
Nimenrix polvo y disolvente para solución inyectable en jeringa precargada Vacuna conjugada frente a meningococo de los grupos A, C, W-135 e Y
2. PRINCIPIO(S) ACTIVO(S)
Tras la reconstitución, 1 dosis (0,5 ml) contiene 5 microgramos de polisacáridos de Neisseria meningitidis de los grupos A, C, W-135 e Y
3. LISTA DE EXCIPIENTES
Excipientes:
Sacarosa Trometamol Cloruro de sodio
Agua para preparaciones inyectables
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Polvo y disolvente para solución inyectable en jeringa precargada 1 vial: polvo
1 jeringa precargada: disolvente 1 dosis (0,5 ml)
10 viales: polvo
10 jeringas precargadas: disolvente 10 x 1 dosis (0,5 ml)
1 vial: polvo
1 jeringa precargada: disolvente
2 agujas
1 dosis (0,5 ml)
10 viales: polvo
10 jeringas precargadas: disolvente 20 agujas
10 x 1 dosis (0,5 ml)
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento.
Vía intramuscular.
Agitar bien antes de usar.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Conservar en nevera No congelar
Conservar en el embalaje original para protegerla de la luz Tras la reconstitución, administrar rápidamente.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
Eliminar de acuerdo con la normativa local.
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Pfizer Limited Ramsgate Road Sandwich Kent CT13 9NJ Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/12/767/001 - envase de 1 sin aguja EU/1/12/767/002 - envase de 10 sin agujas EU/1/12/767/003 - envase de 1 con 2 agujas EU/1/12/767/004 - envase de 10 con 20 agujas
13. NÚMERO DE LOTE
15. INSTRUCCIONES DE USO
16. INFORMACIÓN EN BRAILLE
Se acepta la justificación para no incluir la información en Braille.
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR 1 VIAL Y 1 AMPOLLA 10 VIALES Y 10 AMPOLLAS 100 VIALES Y 100 AMPOLLAS
1. NOMBRE DEL MEDICAMENTO
Nimenrix polvo y disolvente para solución inyectable en ampolla Vacuna conjugada frente a meningococo de los grupos A, C, W-135 e Y
2. PRINCIPIO(S) ACTIVO(S)
Tras la reconstitución, 1 dosis (0,5 ml) contiene 5 microgramos de polisacáridos de Neisseria meningitidis de los grupos A, C, W-135 e Y
3. LISTA DE EXCIPIENTES
Excipientes:
Sacarosa Trometamol Cloruro de sodio
Agua para preparaciones inyectables
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Polvo y disolvente para solución inyectable en ampolla
1 vial: polvo 1 ampolla: disolvente 1 dosis (0,5 ml)
10 viales: polvo 10 ampollas: disolvente 10 x 1 dosis (0,5 ml)
100 viales: polvo 100 ampollas: disolvente 100 x 1 dosis (0,5 ml)
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento. Vía intramuscular.
Agitar bien antes de usar.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
CAD
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Conservar en nevera No congelar
Conservar en el embalaje original para protegerla de la luz Tras la reconstitución, administrar rápidamente.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)
Eliminar de acuerdo con la normativa local.
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Pfizer Limited Ramsgate Road Sandwich Kent CT13 9NJ Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/12/767/005 - envase de 1 EU/1/12/767/006 - envase de 10 EU/1/12/767/007 - envase de 100
13. NÚMERO DE LOTE
Lote
14. CONDICIONES GENERALES DE DISPENSACIÓN
16. INFORMACIÓN EN BRAILLE
Se acepta la justificación para no incluir la información en Braille.
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Disolvente para Nimenrix IM
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
1 dosis (0,5 ml)
6. OTROS
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Disolvente para Nimenrix IM
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
1 dosis (0,5 ml)
6. OTROS
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
Polvo para Nimenrix Conjugado de MenACWY IM
2. FORMA DE ADMINISTRACIÓN
3. FECHA DE CADUCIDAD
CAD
4. NÚMERO DE LOTE <, CÓDIGO DE DONACIÓN Y DEL PRODUCTO >
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
1 dosis
6. OTROS
B. PROSPECTO
Prospecto: información para el usuario
Nimenrix polvo y disolvente para solución inyectable en jeringa precargada
Vacuna conjugada frente a meningococo de los grupos A, C, W-135 e Y
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Puede contribuir comunicando los efectos adversos que pudiera usted tener. La parte final de la sección 4 incluye información sobre cómo comunicar estos efectos adversos.
Lea todo el prospecto detenidamente antes de que reciba esta vacuna, porque contiene información importante para usted.
• Conserve este prospecto, ya que puede tener que volver a leerlo.
• Si tiene alguna duda, consulte a su médico o farmacéutico.
• Este medicamento se le ha recetado solamente a usted o su hijo y no debe dárselo a otras personas.
• Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Este prospecto se ha escrito asumiendo que la persona que va a recibir la vacuna es la que lo va a leer. No obstante, la vacuna se puede administrar a adultos y niños, de modo que es posible que usted lo lea por su hijo.
Contenido del prospecto
1. Qué es Nimenrix y para qué se utiliza
2. Qué necesita saber antes de recibir Nimenrix
3. Cómo se administra Nimenrix
4. Posibles efectos adversos
5. Conservación de Nimenrix
6. Contenido del envase e información adicional
1. Qué es Nimenrix y para qué se utiliza Qué es Nimenrix y para que se utiliza
Nimenrix es una vacuna que ayuda a proteger frente a las infecciones causadas por la bacteria (germen) llamada “Neisseria meningitidis” de los tipos A, C, W-135 e Y.
“Neisseria meningitidis” de los tipos A, C, W-135 e Y puede producir enfermedades graves tales como:
• meningitis - una infección del tejido que recubre el cerebro y la médula espinal.
• septicemia - una infección de la sangre.
Estas infecciones se transmiten fácilmente de una persona a otra y, si no se tratan, pueden ocasionar la muerte.
Nimenrix puede administrarse a adultos, adolescentes y niños a partir de los 12 meses de edad.
Cómo funciona Nimenrix
Nimenrix ayuda a su organismo a producir su propia protección (anticuerpos) frente a las bacterias. Estos anticuerpos le ayudan a protegerse frente a las enfermedades.
Nimenrix únicamente le protegerá frente a las infecciones causadas por la bacteria “Neisseria meningitidis” de los tipos A, C, W-135 e Y.
2. Qué necesita saber antes de recibir Nimenrix No deben administrarle Nimenrix si:
• es alérgico a los principios activos o a cualquiera de los demás componentes de esta vacuna (incluidos en la sección 6).
Los signos de una reacción alérgica pueden incluir erupción cutánea con picor, dificultad para respirar e hinchazón de la cara o de la lengua. Acuda a su médico inmediatamente si experimenta cualquiera de estos signos.
Si no está seguro, hable con su médico o enfermero antes de que le administren Nimenrix. Advertencias y precauciones
Consulte a su médico o enfermero antes de que le administren esta vacuna si:
• tiene una infección con fiebre elevada (de más de 38°C). Si este es su caso, no deben administrarle la vacuna hasta que se encuentre mejor. Una infección de poca importancia, como un resfriado, no debería ser un problema. No obstante, consulte antes con su médico o enfermero.
• tiene un problema de coagulación o le aparecen cardenales con facilidad.
Si se encuentra en cualquiera de las circunstancias anteriores (o no está seguro), consulte con su médico o enfermero antes de que le administren Nimenrix.
Puede que Nimenrix no proteja por completo a todos los vacunados. Si usted tiene un sistema inmune débil (por ejemplo, debido a una infección por VIH o a medicamentos que afectan al sistema inmune) es posible que no se beneficie al máximo de la vacunación con Nimenrix.
Antes o después de cualquier inyección, podría producirse un desmayo (especialmente en los adolescentes), por lo que debe informar a su médico o enfermero si usted o su hijo se ha desmayado en anteriores ocasiones tras la administración de una inyección.
Uso de Nimenrix con otros medicamentos
Informe a su médico o enfermero si está utilizando o ha utilizado recientemente cualquier otro medicamento, incluyendo otras vacunas y medicamentos adquiridos sin receta.
Puede que Nimenrix no sea tan eficaz si está utilizando medicamentos que afecten a su sistema inmune.
Nimenrix se puede administrar al mismo tiempo que otras vacunas, como las vacunas de la hepatitis A y de la hepatitis B, la vacuna del sarampión-paperas-rubeola, la vacuna del sarampión-paperas-rubeola-varicela, la vacuna conjugada antineumocócica 10-valente o la vacuna antigripal estacional no adyuvada.
Durante el segundo año de vida Nimenrix también puede administrarse al mismo tiempo que las vacunas combinadas como difteria - tétanos - tos ferina, incluyendo las vacunas combinadas de difteria - tétanos - tos ferina con hepatitis B, polio inactivado o Haemophilus influenzae tipo b, como la vacuna DTPa-VHB-IPV/Hib.
Siempre que sea posible, la administración de Nimenrix y una vacuna que contenga tétanos, como la vacuna DTPa-VHB-IPV/Hib, se realizará al mismo tiempo o Nimenrix se administrará al menos un mes antes que la vacuna que contenga tétanos.
Cada vacuna se administrará en lugares de inyección diferentes.
Embarazo y lactancia
Si está embarazada, cree que podría estar embarazada, tiene intención de quedarse embarazada, o está en periodo de lactancia, consulte a su médico antes de recibir Nimenrix.
Conducción y uso de máquinas
No es probable que Nimenrix afecte a su capacidad para conducir o usar máquinas. No obstante, no conduzca o use máquinas si no se encuentra bien.
3. Cómo se administra Nimenrix
Cómo se administra la vacuna
Su médico o enfermero le administrará Nimenrix.
• Se inyectará en un músculo.
• Normalmente en la parte superior del brazo en niños, adolescentes y adultos, o en el muslo en niños de 12 a 23 meses de edad.
Cuánto se administra
La dosis recomendada es una única inyección (0,5 ml) de Nimenrix.
Informe a su médico si le han administrado anteriormente una inyección de otra vacuna
meningocócica distinta de Nimenrix.
Su médico le indicará si necesita una inyección adicional de Nimenrix y cuándo la necesita,
especialmente si usted o su hijo:
• recibió la primera dosis a los 12-23 meses de edad y podría tener riesgo de infección causada por Neisseria meningitidis de los tipos A, C, W-135 o Y;
• tenía más de 2 años cuando fue vacunado por primera vez y podría tener riesgo de infección causada por Neisseria meningitidis del tipo A.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran. Con este medicamento pueden ocurrir los siguientes efectos adversos:
Muy frecuentes (pueden ocurrir con más de 1 de cada 10 dosis de la vacuna):
• fiebre
• cansancio (fatiga)
• dolor de cabeza
• sensación de adormecimiento
• pérdida de apetito
• sensación de irritabilidad
• hinchazón, dolor y enrojecimiento en el lugar en el que se administró la inyección.
Frecuentes (pueden ocurrir hasta con 1 de cada 10 dosis de la vacuna):
• cardenales (hematomas) en el lugar en el que se administró la inyección
• problemas de estómago y de digestión, tales como diarrea, vómitos y náuseas.
Poco frecuentes (pueden ocurrir hasta con 1 de cada 100 dosis de la vacuna):
• erupción
• llanto no habitual
• picor
• sensación de mareo
• músculos doloridos
• dolor en los brazos o en las piernas
• malestar general
• dificultad para dormir
• sensibilidad disminuida, especialmente en la piel
• reacciones en el lugar en el que se administró la inyección, tales como picor, sensación de calor o entumecimiento o aparición de un bulto duro
Raras (pueden ocurrir hasta con 1 de cada 1.000 dosis de la vacuna):
• hinchazón en el lugar de la inyección y enrojecimiento; esto puede afectar a un área extensa de la extremidad donde se administra la vacuna
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Nimenrix
• Mantener este medicamento fuera de la vista y del alcance de los niños.
• No utilice este medicamento después de la fecha de caducidad que aparece en el envase. La fecha de caducidad es el último día del mes que se indica.
• Conservar en nevera (entre 2°C y 8°C).
• Conservar en el embalaje original para protegerla de la luz.
• No congelar.
• Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico
cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de Nimenrix
• Los principios activos son:
Tras la reconstitución, 1 dosis (0,5 ml) contiene:
Polisacárido de Neisseria meningitidis del grupo A1 5 microgramos
Polisacárido de Neisseria meningitidis del grupo C1 5 microgramos
Polisacárido de Neisseria meningitidis del grupo W-1351 5 microgramos
Polisacárido de Neisseria meningitidis del grupo Y1 5 microgramos
1conjugado con toxoide tetánico como proteína transportadora 44 microgramos
• Los demás componentes son:
- En el polvo: sacarosa y trometamol
- En el disolvente: cloruro de sodio y agua para preparaciones inyectables
Aspecto del producto y contenido del envase
Nimenrix es un polvo y disolvente para solución inyectable.
Nimenrix se suministra como un polvo blanco en un vial de vidrio de una sola dosis y un disolvente transparente e incoloro en una jeringa precargada.
Ambos deben mezclarse antes de su uso. La apariencia de la vacuna mezclada será una solución transparente e incolora.
Nimenrix está disponible en envases de 1 o 10 con o sin agujas.
Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización
Titular de la autorización de comercialización:
Pfizer Limited
Ramsgate Road
Sandwich
Kent CT13 9NJ
Reino Unido
y responsable de la fabricación
Fabricante responsable de la liberación de los lotes:
Pfizer Manufacturing Belgium N.V.
Rijksweg 12 B-2870 Puurs Bélgica
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
|
Belgie/Belgique/Belgien Luxembourg/Luxemburg Pfizer S.A./N.V. Tél/Tel: + 32 (0)2 554 62 11 |
Lietuva Pfizer Luxembourg SARL filialas Lietuvoje Tel. + 370 52 51 4000 |
|
Etarapna n^aroep HroKceMÓypr CAPH, KaoH Etarapua Tea: +359 2 970 4333 |
Magyarország Pfizer Kft Tel: +36 1 488 3700 |
|
Ceská Republika Pfizer PFE, spol. s.r.o. Tel: +420 283 004 111 |
Malta Vivian Corporation Ltd. Tel: + 35621 344610 |
|
Danmark Pfizer ApS Tlf: + 45 44 201 100 |
Nederland Pfizer BV Tel: +31 (0)10 406 43 01 |
|
Deutschland Pfizer Pharma GmbH Tel: + 49 (0)30 550055-51000 |
Norge Pfizer Norge AS Tlf: +47 67 52 61 00 |
|
Eesti Pfizer Luxembourg SARL Eesti filiaal Tel: +372 666 7500 |
Osterreich Pfizer Corporation Austria Ges.m.b.H. Tel: + 43 (0)1 521 15-0 |
|
EXXáSa Pfizer EAAág A.E. TpL: +30 210 6785 800 |
Polska Pfizer Polska Sp. z o.o. Tel.: +48 22 335 61 00 |
|
España Pfizer, S.L. Tel: +34 914909900 |
Portugal Pfizer Biofarmaceutica, Sociedade Unipessoal Lda Tel: +351 21 423 5500 |
|
France Pfizer Tél +33 1 58 07 3440 |
Romania Pfizer Romania S.R.L Tel: +40 (0) 21 207 28 00 |
|
Hrvatska Pfizer Croatia d.o.o. Tel: + 385 1 3908 777 |
Slovenija Pfizer Luxembourg SARL Pfizer, podruznica za svetovanje s podrocja farmacevtske dejavnosti, Ljubljana Tel.: + 386 (0) 1 52 11 400 |
|
Ireland Pfizer Healthcare Ireland Tel: 1800 633 363 (toll free) +44 (0)1304 616161 |
Slovenská republika Pfizer Luxembourg SARL, organizacná zlozka Tel: + 421 2 3355 5500 |
United Kingdom
Pfizer Limited
Tel: +44 (0) 1304 616161
Simi: + 354 540 8000
Kúrcpog
Pfizer EA^ág A.E. (Cyprus Branch) T^: +357 22 817690
Latvija
Pfizer Luxembourg SARL filiale Latvija Tel.: + 371 670 35 775
Fecha de la última revisión de este prospecto:
Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
Esta información está destinada únicamente a profesionales del sector sanitario:
La vacuna sólo debe administrarse por vía intramuscular. No administrar por vía intravascular, intradérmica o subcutánea.
Si Nimenrix se administra al mismo tiempo que otras vacunas, se deben utilizar lugares de inyección diferentes.
Nimenrix no se debe mezclar con otras vacunas.
Instrucciones para la reconstitución de la vacuna con el disolvente en jeringa precargada:
Nimenrix se debe reconstituir añadiendo todo el contenido de la jeringa precargada al vial que contiene el polvo.
Para saber cómo insertar la aguja en la jeringa, véase el dibujo explicativo. No obstante, la jeringa facilitada con Nimenrix puede ser ligeramente diferente (sin rosca de tornillo) a la jeringa descrita en el dibujo. En tal caso, la aguja deberá insertarse sin enroscar.
Desenrosque la tapa de la jeringa girándola en sentido contrario a las agujas del reloj sujetando el cuerpo de la jeringa con la otra mano (evite sostener el émbolo de la jeringa).

Tapa de la jeringa

2. Inserte la aguja en la jeringa
y a continuación, gírela en el sentido de las agujas del reloj hasta que se bloquee (ver dibujo).
3. Retire el protector de la aguja; en algunas ocasiones puede resultar un poco difícil.
4. Añada el disolvente al polvo. Después de añadir el disolvente al polvo, debe agitar bien la mezcla hasta que el polvo esté completamente disuelto en el disolvente.
La vacuna reconstituida es una solución transparente incolora.
Se debe inspeccionar visualmente el contenido de la vacuna reconstituida para observar si existe alguna sustancia extraña y/o variación del aspecto físico antes de su administración. En caso de que se observe alguna de estas circunstancias, desechar la vacuna.
Tras la reconstitución, la vacuna debe administrarse rápidamente.
Se debe utilizar una aguja nueva para administrar la vacuna.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
Prospecto: información para el usuario
Nimenrix polvo y disolvente para solución inyectable en ampolla
Vacuna conjugada frente a meningococo de los grupos A, C, W-135 e Y
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Puede contribuir comunicando los efectos adversos que pudiera usted tener. La parte final de la sección 4 incluye información sobre cómo comunicar estos efectos adversos.
Lea todo el prospecto detenidamente antes de que reciba esta vacuna, porque contiene información importante para usted.
• Conserve este prospecto, ya que puede tener que volver a leerlo.
• Si tiene alguna duda, consulte a su médico o farmacéutico.
• Este medicamento se le ha recetado solamente a usted o su hijo y no debe dárselo a otras
personas.
• Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Este prospecto se ha escrito asumiendo que la persona que va a recibir la vacuna es la que lo va a leer. No obstante, la vacuna se puede administrar a adultos y niños, de modo que es posible que usted lo lea por su hijo.
Contenido del prospecto
1. Qué es Nimenrix y para qué se utiliza
2. Qué necesita saber antes de recibir Nimenrix
3. Cómo se administra Nimenrix
4. Posibles efectos adversos
5. Conservación de Nimenrix
6. Contenido del envase e información adicional
1. Qué es Nimenrix y para qué se utiliza Qué es Nimenrix y para que se utiliza
Nimenrix es una vacuna que ayuda a proteger frente a las infecciones causadas por la bacteria (germen) llamada “Neisseria meningitidis” de los tipos A, C, W-135 e Y.
“Neisseria meningitidis” de los tipos A, C, W-135 e Y puede producir enfermedades graves tales como:
• meningitis - una infección del tejido que recubre el cerebro y la médula espinal
• septicemia - una infección de la sangre.
Estas infecciones se transmiten fácilmente de una persona a otra y, si no se tratan, pueden ocasionar la muerte.
Nimenrix puede administrarse a adultos, adolescentes y niños a partir de los 12 meses de edad.
Cómo funciona Nimenrix
Nimenrix ayuda a su organismo a producir su propia protección (anticuerpos) frente a las bacterias. Estos anticuerpos le ayudan a protegerse frente a las enfermedades.
Nimenrix únicamente le protegerá frente a las infecciones causadas por la bacteria “Neisseria meningitidis” de los tipos A, C, W-135 e Y.
2. Qué necesita saber antes de recibir Nimenrix No deben administrarle Nimenrix si:
• es alérgico a los principios activos o a cualquiera de los demás componentes de esta vacuna (incluidos en la sección 6).
Los signos de una reacción alérgica pueden incluir erupción cutánea con picor, dificultad para respirar e hinchazón de la cara o de la lengua. Acuda a su médico inmediatamente si experimenta cualquiera de estos signos.
Si no está seguro, hable con su médico o enfermero antes de que le administren Nimenrix. Advertencias y precauciones
Consulte a su médico o enfermero antes de que le administren esta vacuna si:
• tiene una infección con fiebre elevada (de más de 38°C). Si este es su caso, no deben administrarle la vacuna hasta que se encuentre mejor. Una infección de poca importancia, como un resfriado, no debería ser un problema. No obstante, consulte antes con su médico o enfermero.
• tiene un problema de coagulación o le aparecen cardenales con facilidad.
Si se encuentra en cualquiera de las circunstancias anteriores (o no está seguro), consulte con su médico o enfermero antes de que le administren Nimenrix.
Puede que Nimenrix no proteja por completo a todos los vacunados. Si usted tiene un sistema inmune débil (por ejemplo, debido a una infección por VIH o a medicamentos que afectan al sistema inmune) es posible que no se beneficie al máximo de la vacunación con Nimenrix.
Antes o después de cualquier inyección, podría producirse un desmayo (especialmente en los adolescentes), por lo que debe informar a su médico o enfermero si usted o su hijo se ha desmayado en anteriores ocasiones tras la administración de una inyección.
Uso de Nimenrix con otros medicamentos
Informe a su médico o enfermero si está utilizando o ha utilizado recientemente cualquier otro medicamento, incluyendo otras vacunas y medicamentos adquiridos sin receta.
Puede que Nimenrix no sea tan eficaz si está utilizando medicamentos que afecten a su sistema inmune.
Nimenrix se puede administrar al mismo tiempo que otras vacunas, como las vacunas de la hepatitis A y de la hepatitis B, la vacuna del sarampión-paperas-rubeola, la vacuna del sarampión-paperas-rubeola-varicela, la vacuna conjugada antineumocócica 10-valente o la vacuna antigripal estacional no adyuvada.
Durante el segundo año de vida Nimenrix también puede administrarse al mismo tiempo que las vacunas combinadas como difteria - tétanos - tos ferina, incluyendo las vacunas combinadas de difteria - tétanos - tos ferina con hepatitis B, polio inactivado o Haemophilus influenzae tipo b, como la vacuna DTPa-VHB-IPV/Hib.
Siempre que sea posible, la administración de Nimenrix y una vacuna que contenga tétanos, como la vacuna DTPa-VHB-IPV/Hib, se realizará al mismo tiempo o Nimenrix se administrará al menos un mes antes que la vacuna que contenga tétanos.
Cada vacuna se administrará en lugares de inyección diferentes.
Embarazo y lactancia
Si está embarazada, cree que podría estar embarazada, tiene intención de quedarse embarazada, o está en periodo de lactancia, consulte a su médico antes de recibir Nimenrix.
Conducción y uso de máquinas
No es probable que Nimenrix afecte a su capacidad para conducir o usar máquinas. No obstante, no conduzca o use máquinas si no se encuentra bien.
Cómo se administra Nimenrix
3.
Cómo se administra la vacuna
Su médico o enfermero le administrará Nimenrix.
• Se inyectará en un músculo.
• Normalmente en la parte superior del brazo en niños, adolescentes y adultos, o en el muslo en niños de 12 a 23 meses de edad.
Cuánto se administra
La dosis recomendada es una única inyección (0,5 ml) de Nimenrix.
Informe a su médico si le han administrado anteriormente una inyección de otra vacuna meningocócica distinta de Nimenrix.
Su médico le indicará si necesita una inyección adicional de Nimenrix y cuándo la necesita, especialmente si usted o su hijo:
• recibió la primera dosis a los 12-23 meses de edad y podría tener riesgo de infección causada por Neisseria meningitidis de los tipos A, C, W-135 o Y;
• tenía más de 2 años cuando fue vacunado por primera vez y podría tener riesgo de infección causada por Neisseria meningitidis del tipo A.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran. Con este medicamento pueden ocurrir los siguientes efectos adversos:
Muy frecuentes (pueden ocurrir con más de 1 de cada 10 dosis de la vacuna):
• fiebre
• cansancio (fatiga)
• dolor de cabeza
• sensación de adormecimiento
• pérdida de apetito
• sensación de irritabilidad
• hinchazón, dolor y enrojecimiento en el lugar en el que se administró la inyección.
Frecuentes (pueden ocurrir hasta con 1 de cada 10 dosis de la vacuna):
• cardenales (hematomas) en el lugar en el que se administró la inyección
• problemas de estómago y de digestión, tales como diarrea, vómitos y náuseas.
Poco frecuentes (pueden ocurrir hasta con 1 de cada 100 dosis de la vacuna):
• erupción
• llanto no habitual
• picor
• sensación de mareo
• músculos doloridos
• dolor en los brazos o en las piernas
• malestar general
• dificultad para dormir
• sensibilidad disminuida, especialmente en la piel
• reacciones en el lugar en el que se administró la inyección, tales como picor, sensación de calor o entumecimiento o aparición de un bulto duro
Raras (pueden ocurrir hasta con 1 de cada 1.000 dosis de la vacuna):
• hinchazón en el lugar de la inyección y enrojecimiento; esto puede afectar a un área extensa de la extremidad donde se administra la vacuna
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Nimenrix
• Mantener este medicamento fuera de la vista y del alcance de los niños.
• No utilice este medicamento después de la fecha de caducidad que aparece en el envase. La fecha de caducidad es el último día del mes que se indica.
• Conservar en nevera (entre 2°C y 8°C).
• Conservar en el embalaje original para protegerla de la luz.
• No congelar.
• Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de Nimenrix
• Los principios activos son:
Tras la reconstitución, 1 dosis (0,5 ml) contiene:
5 microgramos 5 microgramos 5 microgramos 5 microgramos 44 microgramos
Polisacárido de Neisseria meningitidis del grupo A1 Polisacárido de Neisseria meningitidis del grupo C1 Polisacárido de Neisseria meningitidis del grupo W-1351 Polisacárido de Neisseria meningitidis del grupo Y1 1conjugado con toxoide tetánico como proteína transportadora
• Los demás componentes son:
En el polvo: sacarosa y trometamol
En el disolvente: cloruro de sodio y agua para preparaciones inyectables
Aspecto del producto y contenido del envase
Nimenrix es un polvo y disolvente para solución inyectable.
Nimenrix se suministra como un polvo blanco en un vial de vidrio de una sola dosis y un disolvente
transparente e incoloro en una ampolla.
Ambos deben mezclarse antes de su uso. La apariencia de la vacuna mezclada será una solución
transparente e incolora.
Nimenrix está disponible en envases de 1, 10 ó 100.
Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización y responsable de la fabricación
Titular de la autorización de comercialización: Fabricante responsable de la liberación de los
|
Pfizer Limited Ramsgate Road Sandwich Kent CT13 9NJ Reino Unido |
lotes: Pfizer Manufacturing Belgium N.V. Rijksweg 12 B-2870 Puurs Bélgica |
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
|
Belgie/Belgique/Belgien Luxembourg/Luxemburg Pfizer S.A./N.V. Tél/Tel: + 32 (0)2 554 62 11 |
Lietuva Pfizer Luxembourg SARL filialas Lietuvoje Tel. + 370 52 51 4000 |
|
Etarapna n^aroep HroKceMÓypr CAPH, KaoH Etarapua Tea: +359 2 970 4333 |
Magyarország Pfizer Kft Tel: +36 1 488 3700 |
|
Ceská Republika Pfizer PFE, spol.s.r.o. Tel: +420 283 004 111 |
Malta Vivian Corporation Ltd. Tel: + 35621 344610 |
|
Danmark Pfizer ApS Tlf: +45 44 201 100 |
Nederland Pfizer BV Tel: +31 (0)10 406 43 01 |
|
Deutschland Pfizer Pharma GmbH Tel: + 49 (0)30 550055-51000 |
Norge Pfizer Norge AS Tlf: +47 67 52 61 00 |
|
Eesti Pfizer Luxembourg SARL Eesti filiaal Tel: +372 666 7500 |
Osterreich Pfizer Corporation Austria Ges.m.b.H. Tel: + 43 (0)1 521 15-0 |
|
EXXáSa Pfizer EA^ág A.E. TpL: +30 210 6785 800 |
Polska Pfizer Polska Sp. z o.o. Tel.: +48 22 335 61 00 |
|
España Pfizer, S.L. Tel: +34 914909900 |
Portugal Pfizer Biofarmaceutica, Sociedade Unipessoal Lda Tel: +351 21 423 5500 |
|
France Pfizer Tél +33 1 58 07 3440 |
Romania Pfizer Romania S.R.L Tel: +40 (0) 21 207 28 00 |
|
Hrvatska Pfizer Croatia d.o.o. Tel: + 385 1 3908 777 |
Slovenija Pfizer Luxembourg SARL Pfizer, podruznica za svetovanje s podrocja farmacevtske dejavnosti, Ljubljana Tel.: + 386 (0) 1 52 11 400 |
Ireland
Slovenská republika
Pfizer Luxembourg SARL, organizacná zlozka Tel: + 421 2 3355 5500
Suomi/Finland
Pfizer Oy
Puh/Tel: +358 (0)9 430 040 Sverige
Pfizer Innovations AB Tel: +46 (0)8 550 520 00
United Kingdom
Pfizer Limited
Tel: +44 (0) 1304 616161
Pfizer Healthcare Ireland Tel: 1800 633 363 (toll free)
+44 (0)1304 616161
Ísland
Icepharma hf Simi: + 354 540 8000
Italia
Pfizer S.r.l.
Tel: +39 06 33 18 21
Kúrcpog
Pfizer EA^ág A.E. (Cyprus Branch)
T^: +357 22 817690
Latvija
Pfizer Luxembourg SARL filiale Latvija Tel.: + 371 670 35 775
Fecha de la última revisión de este prospecto:
Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu.
Esta información está destinada únicamente a profesionales del sector sanitario:
La vacuna sólo debe administrarse por vía intramuscular. No administrar por vía intravascular, intradérmica o subcutánea.
Si Nimenrix se administra al mismo tiempo que otras vacunas, se deben utilizar lugares de inyección diferentes.
Nimenrix no se debe mezclar con otras vacunas.
Instrucciones para la reconstitución de la vacuna con el disolvente en ampollas:
Nimenrix se debe reconstituir añadiendo todo el contenido de la ampolla al vial que contiene el polvo.
1. Rompa la parte superior de la ampolla, extraiga el disolvente con una jeringa y añada el disolvente al polvo
2. Agite bien la mezcla hasta que el polvo esté completamente disuelto en el disolvente.
La vacuna reconstituida es una solución transparente incolora.
Se debe inspeccionar visualmente el contenido de la vacuna reconstituida para observar si existe alguna sustancia extraña y/o variación del aspecto físico antes de su administración. En caso de que se observe alguna de estas circunstancias, desechar la vacuna.
Tras la reconstitución, la vacuna debe administrarse rápidamente.
Se debe utilizar una aguja nueva para administrar la vacuna.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
68
determinado en los laboratorios GSK
Persistencia de la respuesta inmune en niños de 6-10 años