Nevanac 1Mg/Ml Colirio En Suspension
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
1. NOMBRE DEL MEDICAMENTO
NEVANAC 1 mg/ml colirio en suspensión
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
1 ml de suspensión contiene 1 mg de nepafenaco.
Excipiente(s) con efecto conocido:
Cada ml de suspensión contiene 0,05 mg de cloruro de benzalconio. Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Colirio en suspensión.
Suspensión uniforme de color entre amarillo pálido y naranja claro con un pH aproximado de 7,4.
4. DATOS CLÍNICOS
4.1. Indicaciones terapéuticas
NEVANAC 1 mg/ml está indicado en adultos para:
- Prevención y tratamiento del dolor y de la inflamación postoperatorios asociados a cirugía de catarata.
- Reducción del riesgo de edema macular postoperatorio asociado a la cirugía de catarata en pacientes diabéticos (ver sección 5.1).
4.2. Posología y forma de administración
Posología
Adultos, incluidos pacientes de edad avanzada
Para la prevención y el tratamiento del dolor y de la inflamación, la dosis es de 1 gota de NEVANAC administrada 3 veces al día en el saco conjuntival del ojo(s) afectado(s). Se debe empezar el día anterior a la cirugía de catarata, continuar durante el día de la cirugía y durante las 2 primeras semanas del periodo postoperatorio. El tratamiento se puede prolongar hasta las 3 primeras semanas del periodo postoperatorio según prescripción médica. Debe administrarse una gota adicional de 30 a 120 minutos antes de la cirugía.
Para la reducción del riesgo de edema macular postoperatorio asociado a la cirugía de catarata en pacientes diabéticos, la dosis es de 1 gota de NEVANAC administrada 3 veces al día en el saco conjuntival del ojo(s) afectado(s). Se debe empezar el día anterior a la cirugía de catarata, continuar durante el día de la cirugía y hasta los 60 días del período postoperatorio, según prescripción médica. Debe administrarse una gota adicional de 30 a 120 minutos antes de la cirugía.
Poblaciones especiales
Pacientes con insuficiencia hepática o renal
No se ha estudiado NEVANAC en pacientes con hepatopatías o insuficiencia renal. Después de su administración oftálmica, nepafenaco se elimina principalmente por biotransformación y la exposición sistémica es muy baja. No se requiere ajuste de dosis en estos pacientes.
Población pediátrica
No se ha establecido la seguridad y eficacia de NEVANAC en niños y adolescentes. No se dispone de datos. Su uso no está recomendado en estos pacientes hasta que se disponga de más datos.
Pacientes de edad avanzada
No se han observado diferencias relevantes en la seguridad y eficacia entre pacientes de edad avanzada y pacientes más jóvenes.
Forma de administración Vía oftálmica.
Se debe indicar a los pacientes que agiten bien el frasco antes de utilizarlo. Después de quitar el tapón, se debe retirar el anillo del precinto de seguridad antes de utilizar este medicamento.
Si se emplea más de un medicamento por vía oftálmica, las aplicaciones deben espaciarse al menos 5 minutos. Las pomadas oftálmicas deben administrarse en último lugar.
Para evitar una posible contaminación de la punta del cuentagotas y de la solución, debe tenerse la precaución de no tocar los párpados, áreas circundantes ni otras superficies con la punta del frasco. Se debe indicar a los pacientes que mantengan el frasco bien cerrado cuando no se utilice.
Si se olvida una dosis, se debe aplicar una gota lo antes posible antes de continuar con la posología habitual. No se debe aplicar una dosis doble para compensar la dosis olvidada.
4.3. Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
Hipersensibilidad a otros medicamentos antiinflamatorios no esteroideos (AINES).
Pacientes a los que el ácido salicílico u otros AINES provoquen ataques de asma, urticaria o rinitis aguda.
4.4. Advertencias y precauciones especiales de empleo
No se debe inyectar este medicamento. Se debe indicar a los pacientes que no ingieran NEVANAC.
Se debe indicar a los pacientes que eviten la exposición a la luz solar durante el tratamiento con NEVANAC.
Efectos oculares
El uso de AINES oftálmicos puede causar queratitis. En algunos pacientes sensibles, el uso continuado de AINES oftálmicos puede provocar ruptura epitelial, adelgazamiento de la córnea, erosión corneal, úlcera corneal o perforación corneal (ver sección 4.8). Estos efectos pueden comprometer la visión. Se debe interrumpir inmediatamente el tratamiento con NEVANAC en pacientes con evidencia de ruptura del epitelio corneal y se deberá realizar un seguimiento cuidadoso del estado de su córnea.
Los AINES oftálmicos pueden enlentecer o retrasar la cicatrización. También se sabe que los corticoides oftálmicos enlentecen o retrasan la cicatrización. El uso concomitante de AINES y esteroides oftálmicos puede aumentar el riesgo de problemas de cicatrización. Por lo que se recomienda precaución cuando se administre NEVANAC concomitantemente con corticosteroides, especialmente en pacientes con riesgo elevado de reacciones adversas corneales descritas a continuación.
La experiencia postcomercialización con AINES oftálmicos indica que existe un mayor riesgo de padecer reacciones adversas corneales que pueden comprometer la visión en pacientes sometidos a intervenciones oculares complicadas, en los que presentan denervación corneal, defectos en el epitelio corneal, diabetes mellitus, enfermedades de la superficie ocular (por ej. síndrome de ojo seco), artritis reumatoide o en los sometidos a repetidas intervenciones oculares en un corto periodo de tiempo. Por ello, los AINES oftálmicos deben usarse con precaución en estos pacientes. El uso prolongado de AINES oftálmicos puede aumentar el riesgo de aparición de reacciones adversas y su gravedad.
Se ha notificado que la administración oftálmica de AINES asociada a cirugía ocular puede provocar un aumento del sangrado de los tejidos oculares (incluyendo hipemas). NEVANAC se debe usar con precaución en pacientes en los que exista tendencia al sangrado o que estén recibiendo otros medicamentos que puedan prolongar el tiempo de sangrado.
El uso de medicamentos antiinflamatorios por vía oftálmica puede enmascarar una infección ocular aguda y por otra parte los AINES no poseen propiedades antimicrobianas. En caso de infección ocular, su utilización conjunta con antiinfecciosos se debe realizar con precaución.
Lentes de contacto
No se recomienda el uso de lentes de contacto durante el periodo postoperatorio de cirugía de catarata. Por lo tanto, debe recomendarse a los pacientes que no lleven lentes de contacto a menos que esté claramente indicado por su médico.
Cloruro de benzalconio
NEVANAC contiene cloruro de benzalconio que puede producir irritación ocular y que altera el color de las lentes de contacto blandas. En caso de que sea necesario utilizar lentes de contacto durante el tratamiento, debe aconsejarse a los pacientes que se retiren las lentes de contacto antes de la aplicación y esperen 15 minutos antes de volver a colocarlas.
Se han notificado casos de queratopatía puntiforme y/o queratopatía ulcerativa tóxica producidos por cloruro de benzalconio. Puesto que NEVANAC contiene cloruro de benzalconio, se aconseja un seguimiento cuidadoso de aquellos pacientes que utilicen este medicamento con frecuencia o durante un periodo prolongado.
Sensibilidad cruzada
Es posible que se produzca sensibilidad cruzada de nepafenaco con ácido acetilsalicílico, derivados del ácido fenilacético y otros AINES.
4.5. Interacción con otros medicamentos y otras formas de interacción
En estudios in vitro se ha observado un potencial muy bajo de interacciones con otros medicamentos e interacciones relacionadas con la unión a proteínas (ver sección 5.2).
Análogos de prostaglandina
Se dispone de datos muy limitados sobre el uso concomitante de análogos de prostaglandina y NEVANAC. Teniendo en cuenta el mecanismo de acción de ambos no se recomienda el uso concomitante de estos medicamentos.
El uso concomitante de esteroides y AINES oftálmicos puede aumentar el riesgo de problemas de cicatrización. El uso concomitante de NEVANAC y medicamentos que prolongan el tiempo de sangrado puede aumentar el riesgo de hemorragia (ver sección 4.4).
4.6. Fertilidad, embarazo y lactancia
Mujeres en edad fértil
No se debe utilizar NEVANAC en mujeres en edad fértil que no estén utilizando métodos anticonceptivos.
Embarazo
No hay datos adecuados relativos al uso de nepafenaco en mujeres embarazadas. En estudios en animales se ha observado toxicidad sobre la reproducción (ver sección 5.3). Se desconoce el riesgo potencial en humanos. Debido a que después del tratamiento con NEVANAC la exposición sistémica en mujeres no embarazadas es insignificante, el riesgo durante el embarazo puede considerarse bajo. Sin embargo, como la inhibición de la síntesis de prostaglandinas puede afectar negativamente al embarazo y/o al desarrollo embrional/fetal y/o al parto y/o al desarrollo postnatal. No se recomienda utilizar NEVANAC durante el embarazo.
Lactancia
Se desconoce si nepafenaco es excretado en la leche humana. Los estudios en animales muestran que nepafenaco se excreta en la leche de ratas. Sin embargo, dado que la exposición sistémica a nepafenaco en mujeres en periodo de lactancia es insignificante, no se espera que tenga efectos en los lactantes. NEVANAC puede administrarse durante la lactancia.
Fertilidad
No hay datos relativos al efecto de NEVANAC sobre la fertilidad humana.
4.7. Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de NEVANAC sobre la capacidad para conducir y utilizar máquinas es nula o insignificante.
La visión borrosa transitoria y otras alteraciones visuales pueden afectar la capacidad de conducir o utilizar máquinas. Si aparece visión borrosa durante la instilación, el paciente debe esperar hasta que la visión sea nítida antes de conducir o utilizar máquinas.
4.8. Reacciones adversas
Resumen del perfil de seguridad
En ensayos clínicos que incluyeron 2314 pacientes tratados con NEVANAC 1 mg/ml, las reacciones adversas más frecuentes fueron queratitis puntiforme, sensación de cuerpo extraño y costra en margen de párpado, que ocurrieron entre el 0,4% y 0,2% de los pacientes.
Lista tabulada de reacciones adversas
Las siguientes reacciones adversas se clasificaron de acuerdo con el siguiente criterio: muy frecuentes (>1/10), frecuentes (>1/100 a <1/10), poco frecuentes (>1/1.000 a <1/100), raras (>1/10.000 a <1/1.000), muy raras (<1/10.000) o de frecuencia no conocida (no puede estimarse a partir de los datos disponibles). Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia. Las reacciones adversas se obtuvieron de ensayos clínicos e informes posteriores a la comercialización.
|
Sistema de clasificación de órganos |
Reacciones adversas |
|
Trastornos del sistema inmunológico |
Raras: hipersensibilidad |
|
Trastornos del sistema nervioso |
Raras: mareo, cefalea |
|
Trastornos oculares |
Poco frecuentes: queratitis, queratitis puntiforme, defecto del epitelio corneal, sensación de cuerpo extraño en los ojos, costra en margen de párpado Raras: iritis, derrame coroideo, depósitos corneales, dolor ocular, molestia ocular, ojo seco, blefaritis, irritación ocular, prurito en el ojo, secreción ocular, conjuntivitis alérgica, lagrimeo aumentado, hiperemia de la conjuntiva Frecuencia no conocida: perforación corneal, alteración de la cicatrización (córnea), opacidad |
|
corneal, cicatriz corneal, reducción de la agudeza visual, hinchazón ocular, queratitis ulcerosa, adelgazamiento de la córnea, visión borrosa | |
|
Trastornos vasculares |
Frecuencia no conocida: presión arterial aumentada |
|
Trastornos gastrointestinales |
Raras: náuseas Frecuencia no conocida: vómitos |
|
Trastornos de la piel y del tejido subcutáneo |
Raras: cutis laxa (dermatocalasis), dermatitis alérgica |
Pacientes diabéticos
En los dos ensayos clínicos que incluyeron 209 pacientes, se expusieron pacientes diabéticos al tratamiento con NEVANAC durante un periodo igual o superior a 60 días para la prevención del edema macular posterior a la cirugía de cataratas. La reacción adversa notificada con más frecuencia fue queratitis puntiforme que ocurrió en un 3% de los pacientes y se clasifica como frecuente dentro del intervalo de frecuencias. Las otras reacciones adversas notificadas fueron defecto del epitelio corneal y dermatitis alérgica que ocurrieron en un 1% y 0,5% de los pacientes, respectivamente y ambas reacciones adversas se clasifican como poco frecuentes dentro del intervalo de frecuencias.
Descripción de reacciones adversas seleccionadas
La experiencia en los ensayos clínicos con el uso prolongado de NEVANAC para la prevención del edema macular posterior a la cirugía de cataratas en pacientes diabéticos es limitada. En los pacientes diabéticos pueden ocurrir reacciones adversas oculares con mayor frecuencia a las observadas en la población general (ver sección 4.4).
Se debe interrumpir inmediatamente el tratamiento con NEVANAC en pacientes con evidencia de ruptura del epitelio corneal incluyendo perforación corneal y se deberá realizar un seguimiento cuidadoso del estado de su córnea (ver sección 4.4).
De la experiencia postcomercialización con NEVANAC, se han identificado casos que notifican defectos o trastornos del epitelio corneal. La gravedad de estos casos varía desde efectos poco graves sobre la integridad epitelial del epitelio corneal a acontecimientos de mayor gravedad en los que se requieren intervenciones quirúrgicas y/o tratamiento médico para recuperar una visión clara.
La experiencia postcomercialización con AINES oftálmicos indica que existe un mayor riesgo de padecer reacciones adversas corneales que pueden comprometer la visión en pacientes sometidos a intervenciones oculares complicadas, en los que presentan denervación corneal, defectos en el epitelio corneal, diabetes mellitus, enfermedades de la superficie ocular (por ej. síndrome de ojo seco), artritis reumatoide o en los sometidos a repetidas intervenciones oculares en un corto periodo de tiempo. Cuando se receta nepafenaco a un paciente diabético después de cirugía de catarata para prevenir el edema macular, la existencia de algún factor de riesgo adicional debería llevar a una reevaluación de los riesgos y beneficios previstos y a una vigilancia del paciente más intensa.
Población pediátrica
No se ha establecido la seguridad y eficacia de NEVANAC en niños y adolescentes.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Apéndice V.
4.9 Sobredosis
No son de esperar efectos tóxicos con el uso oftálmico del mismo, ni en el caso de ingestión accidental del contenido de un frasco.
PROPIEDADES FARMACOLÓGICAS
5.
5.1. Propiedades farmacodinámicas
Grupo farmacoterapéutico: Oftalmológicos, Antiinflamatorios no esteroideos, código ATC: S01BC10 Mecanismo de acción
Nepafenaco es un profármaco antiinflamatorio no esteroideo y analgésico. Después de su administración oftálmica, nepafenaco penetra a través de la córnea y es convertido por hidrolasas del tejido ocular en amfenaco, un medicamento antiinflamatorio no esteroideo. Amfenaco inhibe la acción de la prostaglandina H sintetasa (ciclooxigenasa), una enzima necesaria para la producción de prostaglandinas.
Farmacología secundaria
Se ha demostrado en conejos que el nepafenaco inhibe la ruptura de la barrera hematorretiniana y al mismo tiempo suprime la síntesis de la PGE2. En un estudio ex vivo se observó que una única dosis oftálmica de nepafenaco inhibía la síntesis de prostaglandinas en el iris/cuerpo ciliar (85%-95%) y en la retina/coroides (55%) durante hasta 6 horas y 4 horas, respectivamente.
Efectos farmacodinámicos
La mayor parte de la hidrólisis tiene lugar en la retina/coroides seguido del iris/cuerpo ciliar y córnea, lo cual es consistente con el grado de tejido vascularizado.
Los resultados de los ensayos clínicos indican que NEVANAC colirio no tiene ningún efecto significativo sobre la presión intraocular.
Eficacia y seguridad clínica
Prevención y tratamiento del dolor y la inflamación postoperatorios asociados con la cirugía de catarata.
Se realizaron tres ensayos pivotales para evaluar la eficacia y seguridad de NEVANAC administrado 3 veces al día, en comparación con vehículo y/o ketorolaco trometamol, para prevención y tratamiento del dolor y la inflamación postoperatorios en pacientes intervenidos de cirugía de catarata. En estos ensayos, la medicación en estudio se comenzó a administrar el día anterior a la intervención, continuó el día de la cirugía y durante hasta 2-4 semanas del periodo postoperatorio. Además, prácticamente todos los pacientes recibieron tratamiento profiláctico con antibióticos, según la práctica clínica de los centros en los que se realizaban los ensayos clínicos.
En dos ensayos doble ciego, randomizados y controlados con vehículo, los pacientes tratados con NEVANAC presentaron un grado de inflamación significativamente menor (células acuosas y flare) en el inicio del periodo postoperatorio y hasta el final del tratamiento, con respecto a los tratados con su vehículo.
En un ensayo doble ciego, randomizado y controlado con tratamiento activo y vehículo, los pacientes tratados con NEVANAC presentaron un grado de inflamación significativamente menor que los tratados con vehículo. Adicionalmente, NEVANAC no fue inferior a ketorolaco 5 mg/ml en cuanto a la reducción de la inflamación y del dolor ocular y resultó un poco más agradable después de la instilación.
Un porcentaje significativamente mayor de pacientes en el grupo de NEVANAC notificó ausencia de dolor ocular después de la cirugía de catarata, en comparación con los del grupo al que se administró el vehículo.
Reducción del riesgo de edema macular postoperatorio asociado con la cirugía de catarata en pacientes diabéticos.
Se realizaron cuatro estudios (dos en pacientes diabéticos y dos en pacientes no diabéticos) para evaluar la eficacia y seguridad de NEVANAC para la prevención de edema macular postoperatorio asociado con la cirugía de catarata. En estos estudios, el medicamento del estudio se inició el día antes de la cirugía, se continuó durante el día de la cirugía y hasta los 90 días siguientes del período postoperatorio.
En 1 ensayo doble ciego, randomizado y controlado mediante vehículo, realizado en pacientes con retinopatía diabética, un porcentaje significativamente mayor de pacientes en el grupo que recibió vehículo desarrolló edema macular (16,7%) en comparación con los pacientes tratados con NEVANAC (3,2%). Un mayor porcentaje de pacientes tratados con vehículo experimentaron una reducción de la BCVA (agudeza visual mejor corregida) de más de 5 letras desde el día 7 al día 90 (o su retirada anticipada) (11,5%), en comparación con los pacientes tratados con Nepafenac (5,6%). Más pacientes tratados con NEVANAC obtuvieron una mejora de 15 letras en BCVA en comparación con los pacientes que recibieron vehículo, el 56,8%, en comparación con el 41,9%, respectivamente, p = 0,019.
La Agencia Europea de Medicamentos ha eximido al titular de la obligación de presentar los resultados de los ensayos realizados con NEVANAC en los diferentes grupos de la población pediátrica para prevención y tratamiento del dolor y de la inflamación postoperatorios asociados a cirugía de catarata y prevención del edema macular postoperatorio (ver sección 4.2 para consultar la información sobre el uso en población pediátrica).
5.2. Propiedades farmacocinéticas
Absorción
Tras la administración oftálmica de NEVANAC colirio en ambos ojos, tres veces al día, se observaron concentraciones plasmáticas bajas pero cuantificables de nepafenaco y amfenaco en la mayoría de sujetos a las 2 y 3 horas después de la administración, respectivamente. Después de la administración oftálmica la Cmax media plasmática en estado estacionario del nepafenaco y amfenaco fue de 0,310 ± 0,104 ng/ml y 0,422 ± 0,121 ng/ml, respectivamente.
Distribución
El amfenaco presenta una gran afinidad por la albúmina sérica. In vitro, el porcentaje de unión a albúmina de rata, albúmina humana y suero humano fue del 98,4%, 95,4% y 99,1%, respectivamente.
Estudios en ratas han mostrado que sustancias relacionadas con la sustancia activa y marcadas radioactivamente se distribuyen ampliamente en el organismo tras la administración de dosis orales únicas y múltiples de 14C-nepafenaco.
Estudios en conejos han demostrado que el nepafenaco administrado por vía oftálmica se distribuye localmente desde la parte frontal del ojo a los segmentos posteriores de los ojos (retina y coroides).
Bi otransformaci ón
El nepafenaco experimenta una bioactivación relativamente rápida a amfenaco por las hidrolasas intraoculares. Posteriormente, el amfenaco es ampliamente metabolizado para dar lugar a metabolitos más polares lo que incluye hidroxilación del anillo aromático para dar lugar al conjugado con ácido glucurónico. Los análisis radiocromatográficos antes y después de la hidrólisis por p -glucuronidasa indicaron que todos los metabolitos estaban en forma de conjugados glucurónidos, a excepción del amfenaco. El amfenaco fue el metabolito mayoritario en plasma que representaba aproximadamente el 13% de la radioactividad total en plasma. El segundo metabolito plasmático más abundante fue identificado como 5-hidroxi nepafenaco y representaba aproximadamente el 9% de la radioactividad total en la C max.
Interacciones con otros medicamentos: Se ha observado in vitro que ni el nepafenaco ni el amfenaco inhiben ninguna de las actividades metabólicas del principal citocromo humano P450 (CYP1A2, 2C9, 2C19, 2D6, 2E1 y 3A4) a concentraciones de hasta 300 ng/ml. Por lo tanto, es poco probable que se produzcan interacciones que afecten al metabolismo, mediado por el CYP, de medicamentos administrados concomitantemente. También es improbable que se produzcan interacciones a consecuencia de la unión a proteínas.
Eliminación
Tras la administración oral de 14C-nepafenaco a voluntarios sanos, se observó que la excreción urinaria era la principal vía de eliminación de excreciones radioactivas, con aproximadamente un 85%, mientras que mediante excreción fecal se eliminó aproximadamente un 6% de la dosis. Nepafenaco y amfenaco no se pudieron cuantificar en la orina.
Se determinaron las concentraciones en humor acuoso a los 15, 30, 45 y 60 minutos después de la administración de una dosis única de NEVANAC en 25 pacientes intervenidos de catarata. Las concentraciones máximas medias en humor acuoso se observaron al cabo de 1 hora (nepafenaco 177 ng/ml, amfenaco 44,8 ng/ml). Estos resultados indican una penetración corneal rápida.
5.3. Datos preclínicos sobre seguridad
Los datos de los estudios no clínicos muestran que no presenta riesgos especiales para los seres humanos, según los estudios convencionales de farmacología de seguridad, toxicidad a dosis repetida y genotoxicidad.
Nepafenaco no ha sido evaluado en estudios carcinogénicos a largo plazo.
En estudios de toxicidad para la reproducción realizados en ratas con nepafenaco, dosis tóxicas maternales > 10 mg/kg se relacionaron con distocia, incremento de las pérdidas postimplantación, disminución del peso y del crecimiento fetal y reducción de la supervivencia fetal. En conejos hembra preñadas, una dosis maternal de 30 mg/kg, que provocó leve toxicidad en las madres, mostró un incremento estadísticamente significativo en la incidencia de malformaciones en las crías.
6. DATOS FARMACÉUTICOS
6.1. Lista de excipientes
Manitol (E421)
Carbómero Cloruro de sodio Tiloxapol Edetato de disodio Cloruro de benzalconio
Hidróxido de sodio y/o ácido clorhídrico (para ajuste de pH)
Agua purificada
6.2. Incompatibilidades
No procede.
6.3. Periodo de validez
2 años.
Desechar 4 semanas después de la primera apertura del envase.
6.4. Precauciones especiales de conservación
No conservar a temperatura superior a 30°C.
Para las condiciones de conservación tras la primera apertura del medicamento, ver sección 6.3.
6.5. Naturaleza y contenido del envase
Frasco redondo de 5 ml, de polietileno de baja densidad, con gotero dispensador y tapón de rosca blanco de polipropileno, que contiene 5 ml de suspensión.
Envase que contiene 1 frasco.
6.6. Precauciones especiales de eliminación
Ninguna especial para su eliminación.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Alcon Laboratories (UK) Ltd.
Frimley Business Park Frimley Camberley Surrey, GU16 7SR Reino Unido
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/07/433/001
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN.
Fecha de la primera autorización: 11 Diciembre 2007 Fecha de la última renovación: 24 Septiembre 2012
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www. ema. europa. eu
1. NOMBRE DEL MEDICAMENTO
NEVANAC 3 mg/ml colirio en suspensión
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
1 ml de suspensión contiene 3 mg de nepafenaco.
Excipiente(s) con efecto conocido:
Cada ml de suspensión contiene 0,05 mg de cloruro de benzalconio. Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Colirio en suspensión.
Suspensión uniforme de color entre amarillo pálido y naranja oscuro, con un pH aproximado de 6,8.
4. DATOS CLÍNICOS
4.1. Indicaciones terapéuticas
NEVANAC 3 mg/ml colirio en suspensión está indicado en adultos para:
- Prevención y tratamiento del dolor y de la inflamación postoperatorios asociados a cirugía de catarata.
- Reducción del riesgo de edema macular postoperatorio asociado a la cirugía de catarata en pacientes diabéticos (ver sección 5.1).
4.2. Posología y forma de administración
Posología
Adultos, incluidos pacientes de edad avanzada
Para la prevención y el tratamiento del dolor y de la inflamación, la dosis es de 1 gota de NEVANAC administrada una vez al día en el saco conjuntival del ojo(s) afectado(s). Se debe empezar el día anterior a la cirugía de catarata, continuar durante el día de la cirugía y durante las 2 primeras semanas del periodo postoperatorio. El tratamiento se puede prolongar hasta las 3 primeras semanas del periodo postoperatorio según prescripción médica. Debe administrarse una gota adicional de 30 a 120 minutos antes de la cirugía.
En ensayos clínicos, se trataron pacientes hasta durante 21 días con NEVANAC 3 mg/ml colirio en suspensión (ver sección 5.1).
Para la reducción del riesgo de edema macular postoperatorio asociado a la cirugía de catarata en pacientes diabéticos, la dosis es de 1 gota de NEVANAC administrada 1 vez al día en el saco conjuntival del ojo(s) afectado(s). Se debe empezar el día anterior a la cirugía de catarata, continuar durante el día de la cirugía y hasta los 60 días del período postoperatorio, según prescripción médica. Debe administrarse una gota adicional de 30 a 120 minutos antes de la cirugía.
La dosis diaria de NEVANAC 3 mg/ml colirio en suspensión proporciona la misma dosis diaria total de nepafenaco que tres dosis diarias de NEVANAC 1 mg/ml colirio en suspensión.
Poblaciones especiales
Pacientes con insuficiencia hepática o renal
No se ha estudiado NEVANAC en pacientes con hepatopatías o insuficiencia renal. Después de su administración oftálmica, nepafenaco se elimina principalmente por biotransformación y la exposición sistémica es muy baja. No se requiere ajuste de dosis en estos pacientes.
Población pediátrica
No se ha establecido la seguridad y eficacia de NEVANAC en niños y adolescentes. No se dispone de datos. Su uso no está recomendado en estos pacientes hasta que se disponga de más datos.
Pacientes de edad avanzada
No se han observado diferencias relevantes en la seguridad y eficacia entre pacientes de edad avanzada y pacientes más jóvenes.
Forma de administración Vía oftálmica.
Se debe indicar a los pacientes que agiten bien el frasco antes de utilizarlo. Después de quitar el tapón, se debe retirar el anillo del precinto de seguridad si está presente y suelto antes de utilizar este medicamento.
Si se emplea más de un medicamento por vía oftálmica, las aplicaciones de los medicamentos deben espaciarse al menos 5 minutos. Las pomadas oftálmicas deben administrarse en último lugar.
Para evitar una posible contaminación de la punta del cuentagotas y de la solución, debe tenerse la precaución de no tocar los párpados, áreas circundantes ni otras superficies con la punta del frasco. Se debe indicar a los pacientes que mantengan el frasco bien cerrado cuando no se utilice.
Si se olvida una dosis, se debe aplicar una gota lo antes posible antes de continuar con la posología habitual. No se debe aplicar una dosis doble para compensar la dosis olvidada.
4.3. Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
Hipersensibilidad a otros medicamentos antiinflamatorios no esteroideos (AINES).
Pacientes a los que el ácido salicílico u otros AINES provoquen ataques de asma, urticaria o rinitis aguda.
4.4. Advertencias y precauciones especiales de empleo
No se debe inyectar este medicamento. Se debe indicar a los pacientes que no ingieran NEVANAC.
Se debe indicar a los pacientes que eviten la exposición a la luz solar durante el tratamiento con NEVANAC.
Efectos oculares
El uso de AINES oftálmicos puede causar queratitis. En algunos pacientes sensibles, el uso continuado de AINES oftálmicos puede provocar ruptura epitelial, adelgazamiento de la córnea, erosión corneal, úlcera corneal o perforación corneal (ver sección 4.8). Estos efectos pueden comprometer la visión. Se debe interrumpir inmediatamente el tratamiento con NEVANAC en pacientes con evidencia de ruptura del epitelio corneal y se deberá realizar un seguimiento cuidadoso del estado de su córnea.
Los AINES oftálmicos pueden enlentecer o retrasar la cicatrización. También se sabe que los corticoides oftálmicos enlentecen o retrasan la cicatrización. El uso concomitante de AINES y esteroides oftálmicos puede aumentar el riesgo de problemas de cicatrización. Por lo que se recomienda precaución cuando se administre NEVANAC concomitantemente con corticosteroides, especialmente en pacientes con riesgo elevado de reacciones adversas corneales descritas a continuación.
La experiencia postcomercialización con AINES oftálmicos indica que existe un mayor riesgo de padecer reacciones adversas corneales que pueden comprometer la visión en pacientes sometidos a intervenciones oculares complicadas, en los que presentan denervación corneal, defectos en el epitelio corneal, diabetes mellitus, enfermedades de la superficie ocular (por ej. síndrome de ojo seco), artritis reumatoide o en los sometidos a repetidas intervenciones oculares en un corto periodo de tiempo. Por ello, los AINES oftálmicos deben usarse con precaución en estos pacientes. El uso prolongado de AINES oftálmicos puede aumentar el riesgo de aparición de reacciones adversas y su gravedad.
Se ha notificado que la administración oftálmica de AINES asociada a cirugía ocular puede provocar un aumento del sangrado de los tejidos oculares (incluyendo hipemas). NEVANAC se debe usar con precaución en pacientes en los que exista tendencia al sangrado o que estén recibiendo otros medicamentos que puedan prolongar el tiempo de sangrado.
El uso de medicamentos antiinflamatorios por vía oftálmica puede enmascarar una infección ocular aguda y por otra parte los AINES no poseen propiedades antimicrobianas. En caso de infección ocular, su utilización conjunta con antiinfecciosos se debe realizar con precaución.
Lentes de contacto
No se recomienda el uso de lentes de contacto durante el periodo postoperatorio de cirugía de catarata. Por lo tanto, debe recomendarse a los pacientes que no lleven lentes de contacto a menos que esté claramente indicado por su médico.
Cloruro de benzalconio
NEVANAC contiene cloruro de benzalconio que puede producir irritación ocular y que altera el color de las lentes de contacto blandas. En caso de que sea necesario utilizar lentes de contacto durante el tratamiento, debe aconsejarse a los pacientes que se retiren las lentes de contacto antes de la aplicación y esperen 15 minutos antes de volver a colocarlas.
Se han notificado casos de queratopatía puntiforme y/o queratopatía ulcerativa tóxica producidos por cloruro de benzalconio. Puesto que NEVANAC contiene cloruro de benzalconio, se aconseja un seguimiento cuidadoso de aquellos pacientes que utilicen este medicamento con frecuencia o durante un periodo prolongado.
Sensibilidad cruzada
Es posible que se produzca sensibilidad cruzada de nepafenaco con ácido acetilsalicílico, derivados del ácido fenilacético y otros AINES.
4.5. Interacción con otros medicamentos y otras formas de interacción
En estudios in vitro se ha observado un potencial muy bajo de interacciones con otros medicamentos e interacciones relacionadas con la unión a proteínas (ver sección 5.2).
Análogos de prostaglandina
Se dispone de datos muy limitados sobre el uso concomitante de análogos de prostaglandina y NEVANAC. Teniendo en cuenta el mecanismo de acción de ambos no se recomienda el uso concomitante de estos medicamentos.
El uso concomitante de esteroides y AINES oftálmicos puede aumentar el riesgo de problemas de cicatrización. El uso concomitante de NEVANAC y medicamentos que prolongan el tiempo de sangrado puede aumentar el riesgo de hemorragia (ver sección 4.4).
Fertilidad, embarazo y lactancia
4.6.
Mujeres en edad fértil
No se debe utilizar NEVANAC en mujeres en edad fértil que no estén utilizando métodos anticonceptivos.
Embarazo
No hay datos adecuados relativos al uso de nepafenaco en mujeres embarazadas. En estudios en animales se ha observado toxicidad sobre la reproducción (ver sección 5.3). Se desconoce el riesgo potencial en humanos. Debido a que después del tratamiento con NEVANAC la exposición sistémica en mujeres no embarazadas es insignificante, el riesgo durante el embarazo puede considerarse bajo. Sin embargo, como la inhibición de la síntesis de prostaglandinas puede afectar negativamente al embarazo y/o al desarrollo embrional/fetal y/o al parto y/o al desarrollo postnatal, no se recomienda utilizar NEVANAC durante el embarazo.
Lactancia
Se desconoce si nepafenaco es excretado en la leche humana. Los estudios en animales muestran que nepafenaco se excreta en la leche de ratas. Sin embargo, dado que la exposición sistémica a nepafenaco en mujeres en periodo de lactancia es insignificante, no se espera que tenga efectos en los lactantes. NEVANAC puede administrarse durante la lactancia.
Fertilidad
No hay datos relativos al efecto de NEVANAC sobre la fertilidad humana.
4.7. Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de NEVANAC sobre la capacidad para conducir y utilizar máquinas es nula o insignificante.
La visión borrosa transitoria y otras alteraciones visuales pueden afectar la capacidad de conducir o utilizar máquinas. Si aparece visión borrosa durante la instilación, el paciente debe esperar hasta que la visión sea nítida antes de conducir o utilizar máquinas.
4.8. Reacciones adversas
Resumen del perfil de seguridad
En ensayos clínicos que incluyeron más de 1900 pacientes tratados con NEVANAC 3 mg/ml colirio en suspensión, las reacciones adversas notificadas con más frecuencia fueron queratitis puntiforme, queratitis, sensación de cuerpo extraño en los ojos y dolor ocular, que ocurrieron entre el 0,4% y 0,1% de los pacientes.
Pacientes diabéticos
En los dos ensayos clínicos que incluyeron 594 pacientes, se trataron pacientes diabéticos con NEVANAC colirio en suspensión durante 90 días para la prevención del edema macular posterior a la cirugía de cataratas. La reacción adversa notificada con más frecuencia fue queratitis puntiforme que ocurrió en un 1% de los pacientes y se clasificó como frecuente dentro del intervalo de frecuencias.
Las otras reacciones adversas notificadas con más frecuencia fueron queratitis y sensación de cuerpo extraño en los ojos, que ocurrieron en un 0,5% y 0,3% de los pacientes, respectivamente y ambas reacciones adversas se clasificaron como poco frecuentes dentro del intervalo de frecuencias.
Tabla de reacciones adversas
Las siguientes reacciones adversas se clasificaron de acuerdo con el siguiente criterio: muy frecuentes (>1/10), frecuentes (>1/100 a <1/10), poco frecuentes (>1/1.000 a <1/100), raras (>1/10.000 a <1/1.000), muy raras (<1/10.000) o de frecuencia no conocida (no puede estimarse a partir de los datos disponibles). Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia. Las reacciones adversas se obtuvieron de ensayos clínicos o informes posteriores a la comercialización con NEVANAC 3 mg/ml colirio en suspensión y NEVANAC 1 mg/ml colirio en suspensión.
|
Sistema de clasificación de órganos |
Reacciones adversas |
|
Trastornos del sistema inmunológico |
Raras: hipersensibilidad |
|
Trastornos del sistema nervioso |
Raras: mareo, cefalea |
|
Trastornos oculares |
Poco frecuentes: queratitis, queratitis puntiforme, defecto del epitelio corneal, sensación de cuerpo extraño en los ojos, costra en margen de párpado Raras: iritis, derrame coroideo, depósitos corneales, dolor ocular, molestia ocular, ojo seco, blefaritis, irritación ocular, prurito en el ojo, secreción ocular, conjuntivitis alérgica, lagrimeo aumentado, hiperemia de la conjuntiva Frecuencia no conocida: perforación corneal, alteración de la cicatrización (córnea), opacidad corneal, cicatriz corneal, reducción de la agudeza visual, hinchazón ocular, queratitis ulcerosa, adelgazamiento de la córnea, visión borrosa |
|
Trastornos vasculares |
Poco frecuentes: hipertensión |
|
Trastornos gastrointestinales |
Raras: náuseas Frecuencia no conocida: vómitos |
|
Trastornos de la piel y del tejido subcutáneo |
Raras: cutis laxa (dermatocalasis), dermatitis alérgica |
|
Exploraciones complementarias |
Frecuencia no conocida: presión arterial aumentada |
Descripción de reacciones adversas seleccionadas
Se debe interrumpir inmediatamente el tratamiento con NEVANAC en pacientes con evidencia de ruptura del epitelio corneal incluyendo perforación corneal y se deberá realizar un seguimiento cuidadoso del estado de su córnea (ver sección 4.4).
De la experiencia postcomercialización con NEVANAC 1 mg/ml colirio en suspensión, se han identificado casos que notifican defectos o trastornos del epitelio corneal. La gravedad de estos casos varía desde efectos poco graves sobre la integridad epitelial del epitelio corneal a acontecimientos de mayor gravedad en los que se requieren intervenciones quirúrgicas y/o tratamiento médico para recuperar una visión clara.
La experiencia postcomercialización con AINES oftálmicos indica que existe un mayor riesgo de padecer reacciones adversas corneales que pueden comprometer la visión en pacientes sometidos a intervenciones oculares complicadas, en los que presentan denervación corneal, defectos en el epitelio corneal, diabetes mellitus, enfermedades de la superficie ocular (por ej. síndrome de ojo seco), artritis reumatoide o en los sometidos a repetidas intervenciones oculares en un corto periodo de tiempo.
Población pediátrica
No se ha establecido la seguridad y eficacia de NEVANAC en niños y adolescentes.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Apéndice V.
4.9 Sobredosis
No son de esperar efectos tóxicos con el uso oftálmico del mismo, ni en el caso de ingestión accidental del contenido de un frasco.
5. PROPIEDADES FARMACOLÓGICAS
5.1. Propiedades farmacodinámicas
Grupo farmacoterapéutico: Oftalmológicos, Antiinflamatorios no esteroideos, código ATC: S01BC10 Mecanismo de acción
Nepafenaco es un profármaco antiinflamatorio no esteroideo y analgésico. Después de su administración oftálmica, nepafenaco penetra a través de la córnea y es convertido por hidrolasas del tejido ocular en amfenaco, un medicamento antiinflamatorio no esteroideo. Amfenaco inhibe la acción de la prostaglandina H sintetasa (ciclooxigenasa), una enzima necesaria para la producción de prostaglandinas.
Farmacología secundaria
Se ha demostrado en conejos que el nepafenaco inhibe la ruptura de la barrera hematorretiniana y al mismo tiempo suprime la síntesis de la PGE2. En un estudio ex vivo se observó que una única dosis oftálmica de nepafenaco inhibía la síntesis de prostaglandinas en el iris/cuerpo ciliar (85%-95%) y en la retina/coroides (55%) durante hasta 6 horas y 4 horas, respectivamente.
Efectos farmacodinámicos
La mayor parte de la hidrólisis tiene lugar en la retina/coroides seguido del iris/cuerpo ciliar y córnea, lo cual es consistente con el grado de tejido vascularizado.
Los resultados de los ensayos clínicos indican que NEVANAC 3 mg/ml colirio en suspensión no tiene ningún efecto significativo sobre la presión intraocular.
Eficacia y seguridad clínica
Prevención y tratamiento del dolor y la inflamación postoperatorios asociados con la cirugía de catarata.
La eficacia y seguridad de NEVANAC 3 mg/ml para la prevención y tratamiento del dolor y la inflamación postoperatorios asociados a cirugía de catarata se ha demostrado en dos ensayos clínicos enmascarados, doble ciego y controlados con placebo realizados en un total de 1339 pacientes. En estos ensayos, en que los pacientes recibieron tratamiento diario empezando el día anterior a la cirugía de catarata, continuaron el día de la cirugía y durante los primeros 14 días del periodo postoperatorio, NEVANAC 3 mg/ml colirio en suspensión demostró eficacia clínica superior en comparación con su vehículo en el tratamiento del dolor y la inflamación postoperatorios.
Los pacientes tratados con NEVANAC fueron menos propensos a tener dolor ocular y signos apreciables de inflamación (células acuosas y flare) en el inicio del periodo postoperatorio y hasta el final del tratamiento, con respecto a los tratados con su vehículo. En los dos ensayos, NEVANAC resolvió la inflamación en el día 14 después de la operación en el 65% y 68% de los pacientes en comparación con el 25% y 35% de los pacientes con vehículo. En el grupo de NEVANAC los porcentajes de pacientes sin dolor fueron del 89% y 91% en comparación con el 40% y 50% de los pacientes con vehículo.
Algunos pacientes recibieron NEVANAC 3 mg/ml colirio en suspensión hasta durante 21 días después de la operación. Sin embargo, no se determinó la eficacia tras el día 14 después de la operación.
Adicionalmente, en uno de los dos ensayos clínicos, NEVANAC 3 mg/ml colirio en suspensión administrado una vez al día fue no inferior a NEVANAC 1 mg/ml colirio en suspensión administrado tres veces al día para la prevención y tratamiento del dolor y la inflamación postoperatorios después de la cirugía de catarata.
Los porcentajes de resolución de la inflamación y de pacientes sin dolor fueron similares para ambos medicamentos en todas las evaluaciones postoperatorias.
Reducción del riesgo de edema macular postoperatorio asociado con la cirugía de catarata en pacientes diabéticos.
Se realizaron dos estudios en pacientes diabéticos para evaluar la eficacia y seguridad de NEVANAC 3 mg/ml colirio en suspensión, administrado una vez al día para la prevención del edema macular postoperatorio asociado con la cirugía de catarata. En estos estudios, el medicamento del estudio se inició el día antes de la cirugía, se continuó durante el día de la cirugía y hasta los 90 días siguientes del período postoperatorio.
En ambos ensayos doble ciego, randomizados y controlados mediante vehículo, realizados en pacientes con retinopatía diabética, en el grupo que recibió el vehículo, un porcentaje significativamente mayor de pacientes desarrolló edema macular (17,3% y 14,3%) en comparación con los pacientes tratados con NEVANAC 3 mg/ml (2,3% y 5,9%). Los porcentajes correspondientes al análisis integrado de los 2 estudios fueron 15,9% en el grupo del vehículo y 4,1% en los pacientes tratados con NEVANAC, p<0,001. En el primer ensayo, en el grupo que recibió NEVANAC 3 mg/ml, un porcentaje significativamente mayor de pacientes experimentó una mejora de 15 o más letras en el día 14 y se mantuvo hasta el día 90 (61,7%) en comparación con el grupo del vehículo (43%); en el segundo estudio el porcentaje de sujetos fue similar en los dos grupos de tratamiento al final del estudio (48,8% en el grupo de pacientes tratados con NEVANAC y el 50,5% en el grupo de pacientes que recibieron el vehículo). En el análisis integrado de los 2 estudios, el porcentaje de sujetos con mejora de 15 letras en el día 14 y mantenida hasta el día 90 fue mayor en el grupo tratado con NEVANAC 3 mg/ml (55,4%) en comparación con el grupo que recibió el vehículo (46,7%, p =
0,003).
La Agencia Europea de Medicamentos ha eximido al titular de la obligación de presentar los resultados de los ensayos realizados con NEVANAC en los diferentes grupos de la población pediátrica para prevención y tratamiento del dolor y de la inflamación postoperatorios asociados a cirugía de catarata (ver sección 4.2 para consultar la información sobre el uso en población pediátrica).
5.2. Propiedades farmacocinéticas
Absorción
Tras la administración de una gota de NEVANAC 3 mg/ml colirio en suspensión en ambos ojos, una vez al día durante cuatro días, se observaron concentraciones plasmáticas bajas pero cuantificables de nepafenaco y amfenaco en la mayoría de sujetos a las 2 y 3 horas después de la administración, respectivamente. Después de la administración oftálmica la Cmax media plasmática en estado estacionario del nepafenaco y amfenaco fue de 0,847 ± 0,269 ng/ml y 1,13 ± 0,491 ng/ml, respectivamente.
Distribución
El amfenaco presenta una gran afinidad por la albúmina sérica. In vitro, el porcentaje de unión a albúmina de rata, albúmina humana y suero humano fue del 98,4%, 95,4% y 99,1%, respectivamente.
Estudios en ratas han mostrado que sustancias relacionadas con la sustancia activa y marcadas radioactivamente se distribuyen ampliamente en el organismo tras la administración de dosis orales únicas y múltiples de 14C-nepafenaco.
Estudios en conejos han demostrado que el nepafenaco administrado por vía oftálmica se distribuye localmente desde la parte frontal del ojo a los segmentos posteriores de los ojos (retina y coroides).
Bi otransformaci ón
El nepafenaco experimenta una bioactivación relativamente rápida a amfenaco por las hidrolasas intraoculares. Posteriormente, el amfenaco es ampliamente metabolizado para dar lugar a metabolitos más polares lo que incluye hidroxilación del anillo aromático para dar lugar al conjugado con ácido glucurónico.
Los análisis radiocromatográficos antes y después de la hidrólisis por P-glucuronidasa indicaron que todos los metabolitos estaban en forma de conjugados glucurónidos, a excepción del amfenaco. El amfenaco fue el metabolito mayoritario en plasma que representaba aproximadamente el 13% de la radioactividad total en plasma. El segundo metabolito plasmático más abundante fue identificado como 5-hidroxi nepafenaco y representaba aproximadamente el 9% de la radioactividad total en la
Cmax.
Interacciones con otros medicamentos: Se ha observado in vitro que ni el nepafenaco ni el amfenaco inhiben ninguna de las actividades metabólicas del principal citocromo humano P450 (CYP1A2, 2C9, 2C19, 2D6, 2E1 y 3A4) a concentraciones de hasta 3000 ng/ml. Por lo tanto, es poco probable que se produzcan interacciones que afecten al metabolismo, mediado por el CYP, de medicamentos administrados concomitantemente. También es improbable que se produzcan interacciones a consecuencia de la unión a proteínas.
Eliminación
Tras la administración oral de 1 2 3 4 5 6 7 8 9C-nepafenaco a voluntarios sanos, se observó que la excreción urinaria era la principal vía de eliminación de excreciones radioactivas, con aproximadamente un 85%, mientras que mediante excreción fecal se eliminó aproximadamente un 6% de la dosis.
5.3. Datos preclínicos sobre seguridad
Los datos de los estudios no clínicos muestran que no presenta riesgos especiales para los seres humanos, según los estudios convencionales de farmacología de seguridad, toxicidad a dosis repetida y genotoxicidad.
Nepafenaco no ha sido evaluado en estudios carcinogénicos a largo plazo.
En estudios de toxicidad para la reproducción realizados en ratas con nepafenaco, dosis tóxicas maternales > 10 mg/kg se relacionaron con distocia, incremento de las pérdidas postimplantación, disminución del peso y del crecimiento fetal y reducción de la supervivencia fetal. En conejos hembra preñadas, una dosis maternal de 30 mg/kg, que provocó leve toxicidad en las madres, mostró un incremento estadísticamente significativo en la incidencia de malformaciones en las crías.
Desechar 4 semanas después de la primera apertura.
6.4. Precauciones especiales de conservación
No conservar a temperatura superior a 25°C. Conservar el frasco en el embalaje exterior para protegerlo de la luz.
Para las condiciones de conservación tras la primera apertura del medicamento, ver sección 6.3.
6.5. Naturaleza y contenido del envase
Frasco redondo u oval de polietileno de baja densidad, con gotero dispensador y tapón de rosca blanco de polipropileno, que contiene 3 ml de suspensión. Puede que el frasco se encuentre dentro de un envoltorio.
Envase que contiene 1 frasco.
6.6. Precauciones especiales de eliminación
Ninguna especial para su eliminación.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Alcon Laboratories (UK) Ltd.
Frimley Business Park,
Frimley,
Camberley,
Surrey, GU16 7SR Reino Unido
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/07/433/002
A. FABRICANTE(S) RESPONSABLE(S) DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
A.
Nombre y dirección del fabricante responsable de la liberación de los lotes
S.A. Alcon-Couvreur N.V.
Rijksweg 14 B-2870 Puurs Bélgica
B. CONDICIONES O RESTRICCIONES DE SUBMINISTRO Y USO
Medicamento sujeto a prescripción médica.
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad
Los requerimientos para la presentación de los informes periódicos de seguridad para este medicamento se establecen en la lista de fechas de referencia de la Unión (lista EURD), prevista en el artículo 107 quater, apartado 7, de la Directiva 2001/83/CE y cualquier actualización posterior publicada en el portal web europeo sobre medicamentos.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de Gestión de Riesgos (PGR)
El TAC realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado en la versión del PGR incluido en el Módulo 1.8.2. de la Autorización de Comercialización y cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos;
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (Farmacovigilancia o minimización de riesgos).
ETIQUETADO Y PROSPECTO
A. ETIQUETADO
NEVANAC 1 mg/ml colirio en suspensión Nepafenaco
1 ml de suspensión contiene 1 mg de nepafenaco.
Manitol E421, carbómero, cloruro de sodio, tiloxapol, edetato de disodio, cloruro de benzalconio, hidróxido de sodio y/o ácido clorhídrico (para ajuste de pH) y agua purificada.
Para mayor información consultar el prospecto.
Colirio en suspensión 1 x 5 ml
Agitar bien antes de usar.
Leer el prospecto antes de utilizar este medicamento. Vía oftálmica.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
CAD
Desechar 4 semanas después de la primera apertura del envase. Fecha de apertura:
No conservar a temperatura superior a 30°C.
10. PRECAUCIONES ESPECIALES DE ELIMINACION DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACION
Alcon Laboratories (UK) Ltd.
Frimley Business Park
Frimley
Camberley
Surrey, GU16 7SR
Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/07/433/001 1 x 5 ml
13. NÚMERO DE LOTE
Lote
|
14. CONDICIONES GENERALES DE DISPENSACIÓN | |
|
Medicamento sujeto a prescripción médica | |
|
15. INSTRUCCIONES DE USO | |
|
16. INFORMACIÓN EN BRAILLE | |
|
Nevanac 1 mg/ml | |
|
17. IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D | |
|
No procede. | |
|
18. IDENTIFICADOR ÚNICO - INFORMACIÓN EN CARACTERES VISUALES | |
No procede.
ETIQUETA DEL FRASCO
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
NEVANAC 1 mg/ml colirio en suspensión
Nepafenaco
Vía oftálmica
2. FORMA DE ADMINISTRACIÓN
Leer el prospecto antes de utilizar este medicamento.
3. FECHA DE CADUCIDAD
CAD
Fecha de apertura:
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
5 ml
6. OTROS
NEVANAC 3 mg/ml colirio en suspensión Nepafenaco
1 ml de suspensión contiene 3 mg de nepafenaco.
Ácido bórico, propilenglicol, carbómero, cloruro de sodio, polvo de guar, carmelosa sódica, edetato de disodio, cloruro de benzalconio, hidróxido de sodio y/o ácido clorhídrico (para ajuste de pH) y agua purificada.
Para mayor información consultar el prospecto.
Colirio en suspensión 1 x 3 ml
Agitar bien antes de usar.
Leer el prospecto antes de utilizar este medicamento. Vía oftálmica.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE
FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
Mantener fuera de la vista y del alcance de los niños.
Una vez al día
CAD
Desechar a las 4 semanas después de la primera apertura. Fecha de apertura:
No conservar a temperatura superior a 25°C. Conservar el frasco en el embalaje exterior para protegerlo de la luz.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO (CUANDO CORRESPONDA)_
11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Alcon Laboratories (UK) Ltd. Frimley Business Park, Frimley,
Camberley,
Surrey, GU16 7SR Reino Unido
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/07/433/002
EU/1/07/433/003
1 x 3 ml - Frasco redondo 1 x 3 ml - Frasco oval
13. NÚMERO DE LOTE
Lote
|
14. CONDICIONES GENERALES DE DISPENSACIÓN | |
|
Medicamento sujeto a prescripción médica | |
|
15. INSTRUCCIONES DE USO | |
|
16. INFORMACIÓN EN BRAILLE | |
|
Nevanac 3 mg/ml | |
|
17. IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D | |
|
No procede. | |
|
18. IDENTIFICADOR ÚNICO - INFORMACIÓN EN CARACTERES VISUALES | |
|
No procede. | |
ETIQUETA DEL FRASCO
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
NEVANAC 3 mg/ml colirio en suspensión
Nepafenaco
Vía oftálmica
|
2. |
FORMA DE ADMINISTRACIÓN | |
|
Leer el prospecto antes de utilizar este medicamento. | ||
|
3. |
FECHA DE CADUCIDAD | |
|
CAD | ||
|
4. |
NÚMERO DE LOTE | |
|
Lote | ||
|
5. |
CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES | |
3 ml
6. OTROS
BOLSA ENVOLTORIO
1. NOMBRE DEL MEDICAMENTO Y VÍA(S) DE ADMINISTRACIÓN
NEVANAC 3 mg/ml colirio en suspensión
Nepafenaco
Vía oftálmica
|
2. FORMA DE ADMINISTRACIÓN | |
|
Leer el prospecto antes de utilizar este medicamento. | |
|
3. FECHA DE CADUCIDAD | |
CAD
Desechar a las 4 semanas después de la primera apertura.
4. NÚMERO DE LOTE
Lote
5. CONTENIDO EN PESO, EN VOLUMEN O EN UNIDADES
3 ml
6. OTROS
B. PROSPECTO
Prospecto: información para el usuario
NEVANAC 1 mg/ml colirio en suspensión
Nepafenaco
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico, farmacéutico o enfermero.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico, farmacéutico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es NEVANAC y para qué se utiliza
2. Qué necesita saber antes de empezar a usar NEVANAC
3. Cómo usar NEVANAC
4. Posibles efectos adversos
5. Conservación de NEVANAC
6. Contenido del envase e información adicional
1. Qué es NEVANAC y para qué se utiliza
NEVANAC contiene la sustancia activa nepafenaco que pertenece a un grupo de medicamentos llamados medicamentos antiinflamatorios no esteroideos (AINES).
NEVANAC se utiliza en adultos:
- Para prevenir y aliviar el dolor ocular y la inflamación después de una operación de catarata en el ojo.
- Para reducir el riesgo de edema macular (hinchazón en la parte posterior del ojo) después de una operación de catarata en el ojo en pacientes diabéticos.
2. Qué necesita saber antes de empezar a usar NEVANAC No use NEVANAC
- si es alérgico a nepafenaco o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6),
- si es alérgico a otros medicamentos antiinflamatorios no esteroideos (AINES)
- si ha sufrido asma, alergia en la piel o inflamación intensa de la nariz al utilizar otros AINES. Ejemplos de AINES son: ácido acetilsalicílico, ibuprofeno, ketoprofeno, piroxicam y diclofenaco.
Advertencias y precauciones
Consulte a su médico, farmacéutico o enfermero antes de empezar a usar NEVANAC.
- si le salen moratones con facilidad o tiene problemas de sangrado o los ha tenido en el pasado.
- si sufre cualquier otro trastorno ocular (por ej. una infección en el ojo) o si está utilizando otros medicamentos para los ojos (especialmente esteroides oftálmicos).
- si padece diabetes.
- si padece artritis reumatoide.
- si le han operado de los ojos varias veces en poco tiempo.
Evite la exposición a la luz solar durante el tratamiento con NEVANAC.
No se recomienda el uso de lentes de contacto después de una operación de catarata. Su médico le indicará cuando puede volver a usar las lentes de contacto (ver también “ NEVANAC contiene cloruro de benzalconio).
Niños y adolescentes
No utilice este medicamento en niños y adolescentes menores de 18 años ya que no se ha establecido la seguridad y eficacia en esta población.
Uso de NEVANAC con otros medicamentos
Informe a su médico o farmacéutico si está utilizando, ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento.
NEVANAC puede afectar o puede ser afectado por otros medicamentos que esté utilizando, incluyendo otros colirios para el tratamiento del glaucoma.
Informe también a su médico si está utilizando medicamentos que disminuyen la coagulación de la sangre (warfarina) u otros AINES. Estos medicamentos pueden aumentar el riesgo de sangrado.
Embarazo y lactancia
Si está embarazada o puede quedarse embarazada, consulte con su médico antes de utilizar NEVANAC. Se recomienda a las mujeres que puedan quedarse embarazadas que utilicen métodos anticonceptivos efectivos durante el tratamiento con NEVANAC. No se recomienda el uso de NEVANAC durante el embarazo. No utilice NEVANAC a menos que esté claramente indicado por su médico.
Si se encuentra en periodo de lactancia, NEVANAC puede pasar a la leche materna. Sin embargo, no se esperan efectos sobre el niño lactante. Puede utilizarse NEVANAC durante la lactancia.
Si está embarazada o en periodo de lactancia, o cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento.
Conducción y uso de máquinas
No conduzca ni utilice máquinas hasta que su visión sea clara. Inmediatamente después de la aplicación de NEVANAC puede notar que su visión se vuelve borrosa.
NEVANAC contiene cloruro de benzalconio
NEVANAC contiene un conservante, cloruro de benzalconio, que puede alterar el color de las lentes de contacto blandas y causar irritación en el ojo y efectos adversos corneales (problemas en la superficie del ojo). Si el médico le indica que puede volver a usar lentes de contacto, debe retirárselas antes de la aplicación y esperar al menos 15 minutos antes de volver a colocárselas.
3. Cómo usar NEVANAC
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico o farmacéutico. En caso de duda, consulte de nuevo a su médico o farmacéutico.
Utilice NEVANAC solo en sus ojos. No tragar ni inyectar.
La dosis recomendada es de
Una gota en el ojo u ojos afectados, tres veces al día, mañana, mediodía y noche. Úselo a la misma hora cada día.
Cuando usar y durante cuánto tiempo
Empezar 1 día antes de la operación de catarata. Continuar durante el día de la operación. Luego utilizarlo durante el periodo de tiempo que su médico le indique, que puede ser de hasta 3 semanas
(para prevenir y aliviar el dolor y la inflamación oculares) o 60 días (para evitar la aparición de edema macular) después de su operación.
Como usar
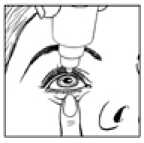
Lávese las manos antes de empezar.
1

• Agite bien antes de usar.
• Desenrosque el tapón del frasco.
• Después de quitar el tapón, se debe retirar el anillo del precinto de seguridad antes de utilizar este medicamento.
• Sostenga el frasco, boca abajo, entre los dedos.
• Incline la cabeza hacia atrás.
• Separe suavemente el párpado inferior del ojo con un dedo, hasta que se forme una bolsa en la que deberá caer la gota (figura 1).
• Acerque la punta del frasco al ojo. Puede ayudarse con un espejo.
• No toque el ojo, el párpado, zonas próximas ni otras superficies con el cuentagotas, porque las gotas podrían contaminarse.
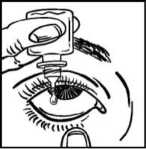
• Presione suavemente la base del frasco para que caiga una gota de NEVANAC cada vez.
• No apriete el frasco: está diseñado para que una suave presión en la base sea suficiente (figura 2).
Si se aplica gotas en ambos ojos, repita los puntos anteriores para el otro ojo. Enrosque bien el tapón en el frasco inmediatamente después de utilizar el producto.
Si una gota cae fuera del ojo, inténtelo de nuevo.
Si está utilizando otros colirios, espere por lo menos 5 minutos entre la aplicación de NEVANAC y de las otras gotas.
Si usa más NEVANAC del que debe
Puede eliminarlo lavando los ojos con agua templada. No se aplique más gotas hasta que sea la hora de la siguiente dosis.
Si olvidó usar NEVANAC
Aplíquese una única dosis en cuanto se dé cuenta. Si ya es casi la hora de la siguiente dosis, no se aplique la dosis olvidada y después continúe con la siguiente dosis de su régimen habitual. No se aplique una dosis doble para compensar la dosis olvidada. No se aplique más de una gota 3 veces al día en el ojo(s) afectado(s).
Si interrumpe el tratamiento con NEVANAC
No interrumpa el tratamiento con NEVANAC sin consultarlo a su médico. Por lo general, podrá seguir usando el colirio salvo que los efectos sean graves. Si estos efectos le preocupan, consulte a su médico o farmacéutico.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico, farmacéutico o enfermero.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Podría tener mayor riesgo de sufrir efectos adversos corneales (problemas en la superficie del ojo), si presenta:
- una operación complicada en el ojo
- varias operaciones en el oj o en poco tiempo
- determinadas alteraciones de la superficie del ojo, como inflamación u ojo seco
- determinadas enfermedades como diabetes o artritis reumatoide
Póngase inmediatamente en contacto con su médico si sus ojos se enrojecen o aumenta el dolor mientras está utilizando las gotas. Esto puede ser consecuencia de una inflamación de la superficie del ojo con o sin pérdida o daño de células o de una inflamación de la parte coloreada del ojo (iritis). Se han observado estos efectos adversos en hasta 1 de cada 100 personas.
También se han observado con NEVANAC 1 mg/ml colirio en suspensión o NEVANAC 3 mg/ml colirio en suspensión o con ambos los siguientes efectos adversos:
Efectos adversos poco frecuentes
(pueden afectar hasta 1 de cada 100personas)
• Efectos en el ojo: inflamación de la superficie del ojo con o sin daño o pérdida de células, sensación de cuerpo extraño en los ojos, costras o caída del párpado.
Efectos adversos raros
(pueden afectar hasta 1 de cada 1.000personas)
• Efectos en el ojo: inflamación del iris, dolor en el ojo, molestia en el ojo, ojo seco, hinchazón del párpado, irritación en el ojo, picor en el ojo, secreción del ojo, conjuntivitis alérgica (alergia ocular), lagrimeo aumentado, depósitos en la superficie del ojo, acumulación de fluido o hinchazón en la parte posterior del ojo, enrojecimiento del ojo.
• Efectos adversos generales: mareos, dolor de cabeza, síntomas de alergia (hinchazón alérgico de los párpados), náuseas, picor, enrojecimiento e inflamación de la piel.
Efectos adversos con frecuencia no conocida (no puede estimarse a partir de los datos disponibles)
• Efectos en el ojo: daño en la superficie del ojo como por ejemplo adelgazamiento o perforación, empeoramiento de la cicatrización del ojo, cicatriz en la superficie del ojo, sensación de niebla, visión reducida, hinchazón del ojo, visión borrosa.
• Efectos adversos generales: vómitos, aumento de la presión sanguínea Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de NEVANAC
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en el frasco y en la caja después de CAD. La fecha de caducidad es el último día del mes que se indica.
No conservar a temperatura superior a 30°C.
Para evitar infecciones debe desechar el frasco 4 semanas después de la primera apertura. Escriba la fecha de apertura en el espacio provisto en la etiqueta del frasco y en la caja.
No tire los medicamentos por los desagües ni a la basura. Pregunte a su farmacéutico como deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma ayudará a proteger el medioambiente.
6. Contenido del envase e información adicional Composición de NEVANAC
• El principio activo es nepafenaco. Un ml de suspensión contiene 1 mg de nepafenaco.
• Los demás componentes son cloruro de benzalconio (ver sección 2), carbómero, edetato de disodio, manitol, agua purificada, cloruro de sodio y tiloxapol.
Se añaden cantidades muy pequeñas de hidróxido de sodio y/o ácido clorhídrico para mantener los niveles normales de acidez (niveles de pH).
Aspecto del producto y contenido del envase
NEVANAC es un líquido (una suspensión de amarillo pálido a naranja claro) que se presenta en una caja que contiene un frasco de plástico de 5 ml con un tapón de rosca.
Titular de la autorización de comercialización
Alcon Laboratories (UK) Ltd.
Frimley Business Park Frimley Camberley Surrey, GU16 7SR Reino Unido
Responsable de la fabricación
S.A. Alcon-Couvreur N.V.
Rijksweg 14 B-2870 Puurs Bélgica
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
Belgie/Belgique/Belgien
Luxembourg/Luxemburg
Alcon NV
S + 32 (0)2 754 32 10 (Belgie/Belgique/Belgien) E’b.nrapHfl
A^koh Etarapua EOO^
S + 359 2 950 15 65
Ceská republika
Alcon Pharmaceuticals (Czech Republic) s.r.o.
S + 420 225 775 111
Danmark
Alcon Nordic A/S S + 45 3636 4300
Deutschland
Alcon Pharma GmbH S + 49 (0)761 1304-0
Magyarország
Alcon Hungária Gyógyszerkereskedelmi Kft. S + 36-1-463-9080
Nederland
Alcon Nederland BV S + 31 (0) 183 654321
Norge
Alcon Nordic A/S S + 45 3636 4300
Osterreich
Alcon Ophthalmika GmbH S + 43 (0)1 596 69 70
Polska
Alcon Polska Sp. z o.o. S + 48 22 820 3450
Portugal
Alcon Portugal -Produtos e Equipamentos Oftalmológicos, Lda.
S + 351 214 400 300
Románia
S.C. Alcon Romania S.R.L.
S + 40 21 203 93 24
EM,á8a
Kúnpo^
AXkov Aagnopáxopiq E XXáq AEBE S + 30 210 68 78 300 (EMáSa)
Eesti
Alcon Pharmaceuticals Ltd.
Eesti filiaal S + 372 6 313 214
España
Alcon Cusí, S.A.
S + 34 93 497 7000
France
Laboratoires Alcon S + 33 (0)1 47 10 47 10
Hrvatska
Alcon Farmaceutika d.o.o.
S + 385 1 4611 988
Ireland
Malta
United Kingdom
Alcon Laboratories (UK) Ltd S + 44 (0) 345 266 9363 (United Kingdom)
Ísland
Alcon Nordic A/S S + 45 3636 4300
Sverige
Italia
Alcon Italia S.p.A. 2 + 39 02 81 80 31
Alcon Nordic A/S 2 + 45 3636 4300
Latvija
Alcon Pharmaceuticals Ltd 2 + 371 67 321 121
Fecha de la última revisión de este prospecto:
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www. ema. europa. eu
Prospecto: información para el usuario
NEVANAC 3 mg/ml colirio en suspensión
Nepafenaco
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico, farmacéutico o enfermero.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico, farmacéutico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es NEVANAC y para qué se utiliza
2. Qué necesita saber antes de empezar a usar NEVANAC
3. Cómo usar NEVANAC
4. Posibles efectos adversos
5. Conservación de NEVANAC
6. Contenido del envase e información adicional
1. Qué es NEVANAC y para qué se utiliza
NEVANAC contiene la sustancia activa nepafenaco que pertenece a un grupo de medicamentos llamados medicamentos antiinflamatorios no esteroideos (AINES).
NEVANAC se utiliza en adultos:
- Para prevenir y aliviar el dolor ocular y la inflamación después de una operación de catarata en el ojo.
- Para reducir el riesgo de edema macular (inflamación en la parte posterior del ojo) después de una operación de catarata en el ojo en pacientes diabéticos.
2. Qué necesita saber antes de empezar a usar NEVANAC
No use NEVANAC
- si es alérgico a nepafenaco o a cualquiera de los demás componentes de este medicamento (incluidos en la sección 6)
- si es alérgico a otros medicamentos antiinflamatorios no esteroideos (AINES)
- si ha sufrido asma, alergia en la piel o inflamación intensa de la nariz al utilizar otros AINES.
Ejemplos de AINES son: ácido acetilsalicílico, ibuprofeno, ketoprofeno, piroxicam y diclofenaco.
Advertencias y precauciones
Consulte a su médico, farmacéutico o enfermero antes de empezar a usar NEVANAC:
- si le salen moratones con facilidad o tiene problemas de sangrado o los ha tenido en el pasado
- si sufre cualquier otro trastorno ocular (por ej. una infección en el ojo) o si está utilizando otros medicamentos para los ojos (especialmente esteroides oftálmicos)
- si padece diabetes
- si padece artritis reumatoide
- si le han operado de los oj os varias veces en poco tiempo.
Evite la exposición a la luz solar durante el tratamiento con NEVANAC.
No se recomienda el uso de lentes de contacto después de una operación de catarata. Su médico le indicará cuando puede volver a usar las lentes de contacto (ver también “NEVANAC contiene cloruro de benzalconio”).
Niños y adolescentes
No utilice este medicamento en niños y adolescentes menores de 18 años ya que no se ha establecido la seguridad y eficacia en esta población.
Uso de NEVANAC con otros medicamentos
Informe a su médico o farmacéutico si está utilizando, ha utilizado recientemente o podría tener que utilizar cualquier otro medicamento.
NEVANAC puede afectar o puede ser afectado por otros medicamentos que esté utilizando, incluyendo otros colirios para el tratamiento del glaucoma.
Informe también a su médico si está utilizando medicamentos que disminuyen la coagulación de la sangre (warfarina) u otros AINES. Estos medicamentos pueden aumentar el riesgo de sangrado.
Embarazo y lactancia
Si está embarazada o puede quedarse embarazada, consulte con su médico antes de utilizar NEVANAC. Se recomienda a las mujeres que puedan quedarse embarazadas que utilicen métodos anticonceptivos efectivos durante el tratamiento con NEVANAC. No se recomienda el uso de NEVANAC durante el embarazo. No utilice NEVANAC a menos que esté claramente indicado por su médico.
Si se encuentra en periodo de lactancia, NEVANAC puede pasar a la leche materna. Sin embargo, no se esperan efectos sobre el niño lactante. Puede utilizarse NEVANAC durante la lactancia.
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento.
Conducción y uso de máquinas
No conduzca ni utilice máquinas hasta que su visión sea clara. Inmediatamente después de la aplicación de NEVANAC puede notar que su visión se vuelve borrosa durante un momento.
NEVANAC contiene cloruro de benzalconio
NEVANAC contiene un conservante, cloruro de benzalconio, que puede alterar el color de las lentes de contacto blandas y causar irritación en el ojo y efectos adversos corneales (problemas en la superficie del ojo). Si el médico le indica que puede volver a usar lentes de contacto, debe retirárselas antes de la aplicación y esperar al menos 15 minutos antes de volver a colocárselas.
3. Cómo usar NEVANAC
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico o farmacéutico. En caso de duda, consulte de nuevo a su médico o farmacéutico.
Utilice NEVANAC solo en sus ojos. No tragar ni inyectar.
La dosis recomendada es de
Una gota en el ojo u ojos afectados, una vez al día. Úselo a la misma hora cada día.
Cuando usar y durante cuánto tiempo
Empezar 1 día antes de la operación de catarata. Continuar durante el día de la operación. Luego utilizarlo durante el periodo de tiempo que su médico le indique, que puede ser de hasta 3 semanas (para prevenir y aliviar el dolor ocular y la inflamación) o 60 días (para prevenir la formación de edema macular y mejorar la visión) después de su operación.
Como usar
Lávese las manos antes de empezar.
1
2
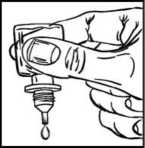
• Agite bien antes de usar.
• Ponga el frasco cerrado boca abajo y agítelo hacia abajo una vez antes de cada uso.
• Desenrosque el tapón del frasco.
• Después de quitar el tapón, se debe retirar el anillo del precinto de seguridad si está presente y suelto antes de utilizar este medicamento.
• Sostenga el frasco, boca abajo, entre los dedos.
• Incline la cabeza hacia atrás.
• Separe suavemente el párpado inferior del ojo con un dedo, hasta que se forme una bolsa en la que deberá caer la gota (figura 1).
• Acerque la punta del frasco al ojo. Puede ayudarse con un espejo.
• No toque el ojo, el párpado, zonas próximas ni otras superficies con el cuentagotas, porque las gotas podrían contaminarse.
• Apriete suavemente los lados del frasco hasta que caiga una gota dentro de su ojo (figura 2).
Si se aplica gotas en ambos ojos, repita los puntos anteriores para el otro ojo. No es necesario cerrar y agitar el frasco entre las administraciones de ambos ojos. Enrosque bien el tapón en el frasco inmediatamente después de utilizar el producto.
Si una gota cae fuera del ojo, inténtelo de nuevo.
Si está utilizando otros colirios, espere por lo menos 5 minutos entre la aplicación de NEVANAC y de las otras gotas.
Si usa más NEVANAC del que debe
Puede eliminarlo lavando los ojos con agua templada. No se aplique más gotas hasta que sea la hora de la siguiente dosis.
Si olvidó usar NEVANAC
Aplíquese una única dosis en cuanto se dé cuenta. Si ya es casi la hora de la siguiente dosis, no se aplique la dosis olvidada y después continúe con la siguiente dosis de su régimen habitual. No se aplique una dosis doble para compensar la dosis olvidada. No se aplique más de una gota en el ojo(s) afectado(s).
Si interrumpe el tratamiento con NEVANAC
No interrumpa el tratamiento con NEVANAC sin consultarlo a su médico. Por lo general, podrá seguir usando el colirio salvo que los efectos sean graves.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico, farmacéutico o enfermero.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Podría tener mayor riesgo de sufrir efectos adversos corneales (problemas en la superficie del ojo), si presenta:
- una operación complicada en el ojo
- varias operaciones en el oj o en poco tiempo
- determinadas alteraciones de la superficie del ojo, como inflamación u ojo seco
- determinadas enfermedades como diabetes o artritis reumatoide
Póngase inmediatamente en contacto con su médico si sus ojos se enrojecen o aumenta el dolor mientras está utilizando las gotas. Esto puede ser consecuencia de una inflamación de la superficie del ojo con o sin pérdida o daño de células o de una inflamación de la parte coloreada del ojo (iritis). Se han observado estos efectos adversos en hasta 1 de cada 100 personas.
Se han observado con NEVANAC 3 mg/ml colirio en suspensión o NEVANAC 1 mg/ml colirio en suspensión o con ambos los siguientes efectos adversos:
Efectos adversos poco frecuentes (pueden afectar hasta 1 de cada 100personas)
• Efectos en el ojo: inflamación de la superficie del ojo con o sin daño o pérdida de células, sensación de cuerpo extraño en los ojos, costras o caída del párpado.
Efectos adversos raros (pueden afectar hasta 1 de cada 1.000personas)
• Efectos en el ojo: inflamación del iris, dolor en el ojo, molestia en el ojo, ojo seco, hinchazón del párpado, irritación en el ojo, picor en el ojo, secreción del ojo, conjuntivitis alérgica (alergia ocular), lagrimeo aumentado, depósitos en la superficie del ojo, acumulación de fluido o hinchazón en la parte posterior del ojo, enrojecimiento del ojo.
• Efectos adversos generales: mareos, dolor de cabeza, síntomas de alergia (hinchazón alérgico de los párpados), náuseas, picor, enrojecimiento e inflamación de la piel.
Efectos adversos con frecuencia no conocida (no puede estimarse a partir de los datos disponibles)
• Efectos en el ojo: daño en la superficie del ojo como por ejemplo adelgazamiento o perforación, empeoramiento de la cicatrización del ojo, cicatriz en la superficie del ojo, sensación de niebla, visión reducida, hinchazón del ojo, visión borrosa.
• Efectos adversos generales: vómitos, aumento de la presión sanguínea.
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de NEVANAC
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en el frasco y en la caja después de CAD. La fecha de caducidad es el último día del mes que se indica.
No conservar a temperatura superior a 25°C. Conservar el frasco en el embalaje exterior para protegerlo de la luz.
Para evitar infecciones debe desechar el frasco 4 semanas después de la primera apertura. Escriba la fecha de apertura en el espacio provisto en la caja.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico como deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medioambiente.
6. Contenido del envase e información adicional Composición de NEVANAC
• El principio activo es nepafenaco. Un ml de suspensión contiene 3 mg de nepafenaco.
• Los demás componentes son ácido bórico, propilenglicol, carbómero, cloruro de sodio, polvo de guar, carmelosa sódica, edetato de disodio, cloruro de benzalconio (ver sección 2) y agua purificada. Se añaden cantidades muy pequeñas de hidróxido de sodio y/o ácido clorhídrico para mantener los niveles normales de acidez (niveles de pH).
Aspecto del producto y contenido del envase
NEVANAC colirio en suspensión (colirio) es un líquido (una suspensión de amarillo pálido a naranja oscuro) que se presenta en un frasco de plástico con un tapón de rosca. Puede que el frasco se encuentre dentro de una bolsa.
Cada envase contiene un frasco de 3 ml.
Titular de la autorización de comercialización
Alcon Laboratories (UK) Ltd.
Frimley Business Park,
Frimley,
Camberley,
Surrey, GU16 7SR Reino Unido
Responsable de la fabricación
S.A. Alcon-Couvreur N.V.
Rijksweg 14 B-2870 Puurs Bélgica
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
Belgie/Belgique/Belgien
Luxembourg/Luxemburg
Alcon NV
S + 32 (0)2 754 32 10 (Belgie/Belgique/Belgien) E’b.arapHfl
ÁnKOH Etnrapna EOO^
S + 359 2 950 15 65
Ceská republika
Alcon Pharmaceuticals (Czech Republic) s.r.o.
S + 420 225 775 111
Danmark
Alcon Nordic A/S S + 45 3636 4300
Deutschland
Alcon Pharma GmbH S + 49 (0)761 1304-0
EM,á8a
Kúnpo^
AXkov Aagnopáropu; EXlá^ AEBE S + 30 210 68 78 300 (EUáóa)
Eesti
Alcon Pharmaceuticals Ltd.
Eesti filiaal S + 372 6 313 214
España
Alcon Cusí, S.A.
S + 34 93 497 7000
France
Laboratoires Alcon S + 33 (0)1 47 10 47 10
Hrvatska
Alcon Farmaceutika d.o.o.
S + 385 1 4611 988
Ireland
Malta
United Kingdom
Alcon Laboratories (UK) Ltd.
S + 44 (0) 345 266 9363 (United Kingdom)
Ísland
Alcon Nordic A/S S + 45 3636 4300
Magyarország
Alcon Hungária Gyógyszerkereskedelmi Kft. S + 36-1-463-9080
Nederland
Alcon Nederland BV S + 31 (0) 183 654321
Norge
Alcon Nordic A/S S + 45 3636 4300
Osterreich
Alcon Ophthalmika GmbH S + 43 (0)1 596 69 70
Polska
Alcon Polska Sp. z o.o.
S + 48 22 820 3450
Portugal
Alcon Portugal -Produtos e Equipamentos Oftalmológicos, Lda.
S + 351 214 400 300
Románia
S.C. Alcon Romania S.R.L.
S + 40 21 203 93 24
Slovenija
Alcon d.o.o.
S + 386 1 422 5280
Slovenská republika
Novartis Slovakia s.r.o.
Alcon Division S + 421 2 5441 0378
Suomi/Finland
AlconNordic A/S S + 45 3636 4300
Italia
Alcon Italia S.p.A.
2 + 39 02 81 80 3.1
Latvija
Alcon Pharmaceuticals Ltd 2 + 371 67 321 121
Fecha de la última revisión de este prospecto:
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www. ema. europa. eu
45
DATOS FARMACÉUTICOS
6.1. Lista de excipientes
Ácido bórico
Propilenglicol Carbómero Cloruro de sodio Polvo de guar Carmelosa sódica Edetato de disodio Cloruro de benzalconio
Hidróxido de sodio y/o ácido clorhídrico (para ajuste de pH) Agua purificada
6.2. Incompatibilidades
No procede.
6.3. Periodo de validez
18 meses
FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 03 Mayo 2013
FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www. ema. europa. eu