Myoxam 600 Mg, Granulado Para Suspension Oral

MINISTERIO
DE SANIDAD, POLÍTICA SOCIAL E IGUALDAD
|
íit |
k agencia española de 1 medicamentos y | productos sanitarios |
Myoxam
Diacetil-midecamicina
1. NOMBRE DEL MEDICAMENTO
MYOXAM 600 mg Comprimidos recubiertos MYOXAM 250 mg/5ml Granulado para suspensión oral MYOXAM 900 mg Granulado para suspensión oral MYOXAM 600 mg Granulado para suspensión oral
2. COMPOSICION CUALITATIVA Y CUANTITATIVA
Para MYOXAM 600 mg Comprimidos recubiertos:
Cada comprimido contiene: Diacetil-midecamicina (DCI), 600 mg
Para MYOXAM 250 mg/5 ml Granulado para suspensión oral:
Cada frasco de 30 g de granulado para preparar 120 ml de suspensión extemporánea contiene: Diacetil-midecamicina (DCI), 6 g
(Cada 5 ml de suspensión extemporánea reconstituida contienen 250 mg de diacetil-midecamicina).
Para MYOXAM 900 mg Granulado para suspensión oral:
Cada sobre contiene: Diacetil-midecamicina (DCI), 900 mg
Para MYOXAM 600 mg Granulado para suspensión oral:
Cada sobre contiene: Diacetil-midecamicina (DCI), 600 mg
Para los excipientes, ver el apartado 6.1.
3. FORMA FARMACEUTICA Comprimidos recubiertos.
Granulado para suspensión oral para preparar de forma extemporánea en unidosis (sobres) o multidosis (frasco).
4. DATOS CLINICOS
4.1. Indicaciones terapéuticas
Tratamiento de las infecciones producidas por gérmenes sensibles a diacetil-midecamicina (ver apartado Propiedades Farmacológicas) en niños y adultos, en las siguientes condiciones:
- Infecciones del tracto respiratorio superior: amigdalitis, faringitis, rinofaringitis, sinusitis, otitis, escarlatina.
- Infecciones del tracto respiratorio inferior: bronquitis, neumonías.
Infecciones cutáneas : piodermitis, abscesos, forunculosis.
- Infecciones odontoestomatológicas.
- Infecciones urogenitales.
Correo electrónicoI
C/ CAMPEZO, 1 - EDIFICIO 8 28022 MADRID
Se atenderán exclusivamente incidencias informáticas sobre la aplicación CIMA (http://www.aemps.gob.es/cima)

4.2. Posología y forma de administración
La pauta posológica recomendada estará en función de la edad del paciente y la gravedad de la infección.
Se recomiendan las siguientes dosis:
Adultos y niños de más de 35 kg de peso: 1200 mg al día administrados en dos tomas, es decir, 1 comprimido de 600 mg ó 1 sobre de 600 mg cada 12 horas.
En infecciones más severas se recomiendan 1800 mg al día, administrados en dos o tres tomas, es decir, 1 sobre de 900 mg cada 12 horas ó 1 comprimido de 600 mg ó 1 sobre de 600 mg cada 8 horas.
Niños de menos de 35 kg de peso: de 35 a 50 mg/kg/día repartidos en dos o tres tomas. En ningún caso se superarán los 1800 mg/día. No existen datos suficientes para recomendar su administración en neonatos.
La duración normal del tratamiento varía entre 7 y 14 días, pero puede prolongarse dependiendo del germen y de la gravedad de la infección.
Pacientes con alteración de la función renal:
Estudios farmacocinéticos indican que no es necesario realizar ajuste de dosis en pacientes con alteración de la función renal.
Pacientes con insuficiencia hepatobiliar:
La dosis de diacetil-midecamicina se deberá ajustar de forma individualizada para cada paciente.
Para MYOXAM 600 mg Comprimidos recubiertos:
Los comprimidos deben ingerirse sin masticar ni machacar, con ayuda de un poco de agua o de algún otro líquido. No son adecuados para niños; para éstos, la forma más indicada es la suspensión oral.
Para MYOXAM 250 mg/5 ml Granulado para suspensión oral:
Para la preparación de la suspensión extemporánea:
1. Añadir agua potable en el frasco, hasta la señal de nivel de llenado.
2. Poner el tapón perforado en la boca del frasco.
3. Cerrar el frasco con el tapón de rosca.
4. Agitar enérgicamente hasta conseguir una suspensión uniforme. NO AÑADIR MAS AGUA, aún cuando después de agitar, el nivel de llenado quede por debajo de la señal de nivel de llenado.
5. Introducir la jeringa dosificadora, presionando en el orificio del tapón perforado.
6. Invertir el frasco y retirar con la jeringa dosificadora el volumen de líquido indicado por su médico.
7. Administrar directamente con la jeringa dosificadora o, si se prefiere, poner el líquido en una cucharilla.
8. Cerrar el frasco con el tapón de rosca sin retirar el tapón perforado y enjuagar la jeringa dosificadora solamente con agua. Conservar el frasco en nevera.
Para cada nueva administración, proceder tal como se describe a partir del punto 4.

|
•U A -IIKL- |
1. |
|
5, | |
|
/i | |
|
© L> | |
|
6, | |
3,
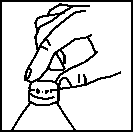
4,

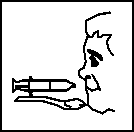
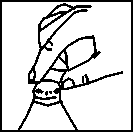
La jeringa dosificadora debe llenarse con el volumen de líquido adecuado, según el peso del paciente.
La jeringa dosificadora tiene dos escalas, una en volumen y otra en peso. Por ejemplo, para un paciente de 8 kg (dosis 4 ml), llenar el dosificador hasta la señal de 8 kg ó 4 ml. Para un paciente de 14 kg (dosis 7 ml), requiere llenar el dosificador dos veces, la primera hasta 10 kg (5 ml) y la segunda hasta los 4 kg (2 ml) y administrar la totalidad.
Para MYOXAM 900 mg Granulado para suspensión oral y MYOXAM 600 mg Granulado para suspensión oral:
Viértase el contenido del sobre en agua, zumo de fruta, leche, etc., y agítese hasta conseguir una suspensión uniforme. La suspensión debe ingerirse inmediatamente.
4.3. Contraindicaciones
Demostrada hipersensibilidad individual a antibióticos macrólidos o a alguno de los excipientes. Insuficiencia hepatobiliar grave.
4.4. Advertencias y precauciones especiales de empleo
El tratamiento con diacetil-midecamicina, como con otros antibióticos, puede dar lugar a sobreinfecciones de agentes bacterianos resistentes y de hongos, que requieren la interrupción del tratamiento y la institución de una terapia idónea.
En pacientes con insuficiencia hepatobiliar, se aconseja realizar controles de funcionalismo hepático.
4.5. Interacción con otros medicamentos y otras formas de interacción
No se debe administrar simultáneamente con antibióticos B-lactámicos, pues puede disminuir su eficacia por antagonismo en el mecanismo de acción.
Diacetil-midecamicina no modifica de forma clínicamente significativa el aclaramiento de teofilina.

Diacetil-midecamicina puede aumentar las concentraciones plasmáticas de carbamacepina y ciclosporina. Por tanto, se recomienda monitorizar los niveles plasmáticos de estos fármacos durante el tratamiento concomitante con diacetil-midecamicina.
4.6. Embarazo y lactancia
Embarazo:
No se dispone de datos sobre la administración de este fármaco en el embarazo. Por lo tanto, no se recomienda su administración a mujeres gestantes.
Lactancia:
Se ha detectado la presencia del fármaco en la leche materna, por lo tanto, no se recomienda administrar diacetil-midecamicina durante la lactancia.
4.7. Efectos sobre la capacidad para conducir vehículos y utilizar maquinaria
No existen datos de los efectos sobre la capacidad de conducir vehículos. Cuando se conduzca o se utilice maquinaria se debe tener en cuenta que la diacetil-midecamicina puede producir vómitos y dolor de cabeza.
4.8. Reacciones adversas
La mayoría de reacciones adversas observadas para la diacetil-midecamicina son de carácter leve y transitorias. El perfil de toxicidad es similar al de otros antibióticos del grupo de los macrólidos. Las reacciones adversas más frecuentemente observadas son de tipo gastrointestinal (dolor abdominal, náuseas, vómitos, diarrea, y anorexia). También puede producir erupciones cutáneas y urticaria. Raramente se han descrito cefaleas y en alguna ocasión incremento leve de los valores de transaminasas.
4.9. Sobredosis
No se han descrito casos de intoxicación. En caso de sobredosificación se recomienda un tratamiento sintomático y la rápida eliminación del fármaco no absorbido.
5. PROPIEDADES FARMACOLOGICAS
5.1. Propiedades farmacodinámicas
Grupo farmacoterapéutico: Macrólidos. Código ATC: J01F A11
Diacetil-midecamicina es un antibiótico semisintético de la familia de los macrólidos con un anillo lactónico de 16 átomos, activo por vía oral. Su mecanismo de acción se basa en la inhibición de la síntesis proteica bacteriana.
El fármaco se metaboliza totalmente en el organismo dando lugar rápidamente a tres metabolitos principales (Mb12, Mb6 y Mb9a), que también presentan actividad antibacteriana.
Actividad antibacteriana
Diacetil-midecamicina es activa frente a la mayoría de las cepas de los siguientes microorganismos tanto in vitro como en las infecciones clínicas citadas en el apartado de indicaciones.
Se consideran cepas sensibles aquellas que presentan unas concentraciones mínimas inhibitorias de la actividad antimicrobiana in vitro (CMI90) <2 mg/L y resistentes si > 8 mg/L.

Bacterias sensibles (CMIon <2 mg/L)
Microorganismos aerobios Gram-positivos:
- Listeria monocytogenes
- Staphylococcus aureus meticilín sensibles
- Streptococcus agalactiae
- Streptococcus pneumoniae
- Streptococcus pyogenes
- Streptococcus viridans Microorganismos aerobios Gram-negativos:
- Bordetella pertussis
- Helicobacter pylori
- Legionella pneumophila
- Moraxella catarrhalis
- Neisseria meningitidis Microorganismos anaerobios:
- -Corynebacterium diphteriae
- Propionibacterium acnes Otros microorganismos:
- Chlamydia trachomatis
- Gardnerella vaginalis
- Mycoplasma pneumoniae
- Ureaplasma urealyticum
La producción de beta-lactamasas no debe tener efecto en la actividad de diacetil-midecamicina.
Un porcentaje elevado de cepas que presentan resistencia de tipo inducible a la eritromicina son sensibles a la diacetil-midecamicina.
Bacterias moderadamente sensibles (CMI9n 2-8 mg/L)
Microorganismos aerobios Gram-negativos:
- Campylobacter jejuni
- Haemophilus influenzae
- Neisseria gonorrhoeae Microorganismos anaerobios:
- Bacteroides fragilis
- Clostridium perfringens
- Peptostreptococcus sp.
Otros microorganismos:
- Mycoplasma hominis
Bacterias resistentes (CMIon > 8 mg/L)
Los datos in vitro indican que los siguientes microorganismos no son sensibles a diacetil-midecamicina:
- Microorganismos Gram-negativos de las enterobacteriáceas: Salmonella, Sighella, Escherichia.
- Cepas de Gram-positivos con resistencia a eritromicina de tipo constitutivo, como Staphylococcus meticilín y oxicilín resistentes de tipo constitutivo pero no de tipo inducible.
Se han descrito para los macrólidos resistencias en distinto grado para gérmenes habitualmente implicados en las infecciones del tracto respiratorio incluyendo faringoamigdalitis, bronquitis y neumonía. Dado que la prevalencia de resistencias puede variar geográficamente y con el tiempo,

se recomienda que el médico tenga en cuenta la información local sobre resistencias, en especial al tratar infecciones graves. Esta información da solamente una guía aproximada sobre las probabilidades de que dichos microorganismos serán o no susceptibles a diacetil-midecamicina.
5.2. Propiedades farmacocinéticas
Diacetil-midecamicina se absorbe de forma rápida y extensamente a traves del tracto-gastrointestinal. Tras su administración oral, se detecta en plasma y en orina en forma de sus metabolitos, los cuales son los responsables de la actividad antimicrobiana, siendo los principales Mb12, Mb6 y Mb9a. La absorción de la diacetil-midecamicina no se reduce en presencia de alimentos.
Las concentraciones plasmáticas máximas se alcanzan a los 30 min - 1 hora de la administración de la dosis, siendo aproximadamente de 1,8 mcg/ml y de 2,6 mcg/ml con dosis únicas de 600 y 900 mg, respectivamente.
Administrando una dosis de 600 mg cada 8 horas, la concentración plasmática máxima en estado de equilibrio es aproximadamente 2,6 mcg/ml. Con una pauta posológica de 900 mg cada 12 horas, se alcanzan en el estado de equilibrio unas concentraciones plasmáticas máximas de aproximadamente 3,9 mcg/ml.
Diacetil-midecamicina se une a proteínas plasmáticas, en una proproción no superior al 47%, sus metabolitos se unen también aunque de forma más débil (del 3 al 29%). Debido a su liposolubilidad, atraviesa con facilidad las membranas celulares; ello explica su elevada penetración intracelular. Se observan concentraciones elevadas a nivel tisular (amígdalas, tejido pulmonar, mucosa nasal, mucosa laríngea, tejidos urogenitales) y de líquidos biológicos (secreciones bronquiales, esputo), alcanzándose en algunos casos concentraciones superiores a las plasmáticas. También se ha recuperado en la leche materna.
La metabolización de la diacetil-midecamicina se produce principalmente a nivel hepático.
Se elimina en forma de metabolitos activos, principalmente por vía biliar y en menor cantidad por riñón (menos del 5% de la dosis administrada). Tras su administración a dosis única, la semivida aparente de eliminación es de 0,78 a 1,99 horas para la actividad antimicrobiana total.
La semivida de eliminación se prolonga entre 45 y 90 minutos más cuando se administra a dosis repetidas.
El ritmo de eliminación de diacetil-midecamicina se encuentra algo disminuido en ancianos, si bien no se precisa ajuste de la dosis.
5.3. Datos preclínicos sobre seguridad
La toxicidad experimental de diacetil-midecamicina es muy baja. Las DL50 por vía oral e intraperitoneal en rata y en ratón son superiores a 5.000 mg/kg. La diacetil-midecamicina no ha mostrado efectos embriotóxicos o teratógenos en el conejo, y no presenta actividad mutagénica en el test de Ames.
Los datos preclínicos no muestran riesgos especiales para los seres humanos según los estudios convencionales sobre farmacología de seguridad, toxicidad de dosis repetidas, genotoxicidad, potencial carcinogénico, toxicidad para la reproducción.
6.

DATOS FARMACEUTICOS
6.1. Lista de excipientes
Para MYOXAM 600 mg Comprimidos recubiertos:
Etilcelulosa
Hidroxipropilmetilcelulosa Estearato magnésico Celulosa microcristalina Glicinato de aluminio Carboximetilalmidón sódico Oxido de titanio Polietilenglicol Talco
Colorante amarillo anaranjado S (E110)
Colorante rojo (E127)
Para MYOXAM Granulado para suspensión oral:
Etilcelulosa
Parahidroxibenzoato de metilo Parahidroxibenzoato de propilo Acido cítrico Fosfato sódico Esencia de plátano Sacarina sódica Hipromelosa Dimeticona
Monopalmitato de sorbitano Monoestearato de glicerol Palmitato de sacarosa Manitol
Colorante amarillo naranja S (E110)
6.2. Incompatibilidades
No se han descrito.
La diacetil-midecamicina se puede administrar a personas alérgicas a Penicilina.
6.3. Período de validez
MYOXAM 600 mg Comprimidos recubiertos, MYOXAM Granulado para suspensión oral (sobres y frasco): 3 años.
Frasco con suspensión extemporánea reconstituida de MYOXAM 250 mg/5 ml: 14 días en frigorífico.
6.4. Precauciones especiales de conservación
No se precisan condiciones especiales de conservación para los comprimidos, sobres y suspensión sin reconstituir.

La suspensión extemporánea reconstituida debe conservarse en frigorífico y debe utilizarse antes de transcurridos 14 días de su preparación.
6.5. Naturaleza y contenido del recipiente
MYOXAM 600 mg Comprimidos recubiertos se envasa en blister alveolar con soporte de PVC y lámina de aluminio termosellada. Cada estuche contiene 12 comprimidos.
MYOXAM 250 mg/5 ml Granulado para suspensión oral se envasa en frascos de polietileno de alta densidad con tapón de rosca y una línea de nivel de llenado. El envase incluye un tapón perforado para acoplar al frasco y una jeringa dosificadora de 5 ml de capacidad con dos escalas, una en volumen y otra en peso. Cada estuche contiene 1 frasco con 30 g de granulado para preparar 120 ml de suspensión extemporánea a la concentración de 250 mg/5 ml. MYOXAM 600 mg y MYOXAM 900 mg Granulado para suspensión oral se envasan en sobres a base de laminado comprendiendo una capa de estucado, lámina de aluminio y polietileno. Cada estuche contiene 12 sobres.
6.6. Instrucciones de uso y manipulación
Ninguna especial.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
LABORATORIOS MENARINI, S.A.
Alfonso XII, 587 08918-Badalona (Barcelona)
"bajo licencia de Meiji Seika Kaisha Ltd. Tokio-Japón"
8. NUMEROS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
MYOXAM 600 mg Comprimidos recubiertos: 57.810 MYOXAM 250 mg/5ml Granulado para suspensión oral: 57.811 MYOXAM 900 mg Granulado para suspensión oral: 61.271 MYOXAM 600 mg Granulado para suspensión oral: ---------
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Noviembre 1988
10. FECHA DE LA REVISIÓN DEL TEXTO: Julio 2001
Agencia española de
medicamentos y
productos sanitarios