Muse 500 Microgramos Bastoncillo Uretral
•4^
sm
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
MUSE 500 microgramos bastoncillo uretral.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Composición cualitativa y cuantitativa
Cada bastoncillo uretral contiene 500 microgramos de alprostadil.
Excipiente(s) con efecto conocido
Para consultar la lista completa de excipientes ver sección 6.1.
3. FORMA FARMACÉUTICA Bastoncillo uretral.
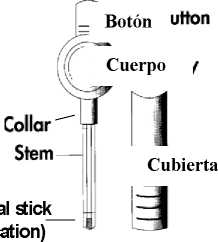
MUSE es un sistema transuretral unidosis estéril para la administración de alprostadil en la uretra masculina. El alprostadil está suspendido en macrogol y se presenta en forma de bastoncillo uretral (1,4 mm de diámetro por 3 mm de longitud), contenido en el extremo del aplicador de polipropileno.
Cuello
Cánula
Bastoncillo uretral (Medicamento)
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Tratamiento de la disfunción eréctil, de etiología principalmente orgánica.
Coadyuvante de otras pruebas para el diagnóstico y tratamiento de la disfunción eréctil.
4.2 Posología y forma de administración Uso en Adultos
Tratamiento de la disfunción eréctil
Inicio del tratamiento: el médico deberá instruir al paciente acerca del uso correcto de MUSE. La dosis inicial recomendada es de 500 microgramos.
La dosis podrá aumentarse de forma escalonada (a 1000 microgramos) o reducirse (a 250 ó 125 microgramos) bajo supervisión médica hasta que el paciente alcance una respuesta satisfactoria. Tras la evaluación de la habilidad y capacidad del paciente para usar el medicamento, la dosis seleccionada podrá prescribirse para su uso en el domicilio.
Es importante que el paciente orine antes de la administración ya que la humedad de la uretra facilitará la aplicación de MUSE y es esencial para la disolución del fármaco. Para administrar MUSE, retirar la cubierta protectora del aplicador, extender el pene hacia arriba hasta su máxima longitud e insertar la cánula del aplicador en la uretra. Presionar el botón del aplicador para liberar el medicamento y posteriormente retirar el aplicador de la uretra (moviéndolo suavemente antes de retirarlo asegura que la medicación se separa de la cánula del aplicador). Realizar movimientos rotatorios del pene entre las manos durante al menos 10 segundos para asegurar que la medicación se ha distribuido adecuadamente a lo largo de la pared de la uretra. Si el paciente nota una sensación de quemazón, deberá realizar movimientos rotatorios del pene entre las manos durante otros 30 ó 60 segundos o hasta que desaparezca dicha sensación. La erección debe producirse a los 5-10 minutos de la administración y durar aproximadamente 30-60 minutos. Después de la administración de MUSE, es importante sentarse o, preferiblemente, permanecer de pie o andar durante unos 10 minutos mientras se desarrolla la erección. Una información más detallada se proporciona en el prospecto. Durante su uso en el domicilio, se recomienda la realización de controles periódicos de eficacia y seguridad.
No se recomienda la administración de más de 2 dosis en un periodo de 24 horas, ni más de 7 dosis en un periodo de 7 días. No se debe exceder la posología prescrita.
Coadyuvante de otras pruebas para el diagnóstico y tratamiento de la dis función eréctil
MUSE puede emplearse como coadyuvante en la evaluación de la función vascular peneal mediante ultrasonografia Doppler dual. Se ha demostrado que una dosis de 500 microgramos de MUSE ejerce un efecto comparable a 10 microgramos de alprostadil administrado mediante inyección intracavernosa sobre la dilatación arterial peneal y en la velocidad de flujo sistólico máximo. En el momento en que el paciente abandone la consulta, la erección debe haber finalizado.
Uso en personas de edad avanzada No se requiere ajuste de dosis.
4.3 Contraindicaciones
MUSE está contraindicado en los siguientes pacientes:
• Pacientes que tienen hipersensibilidad conocida al principio activo o a alguno de los excipientes.
• Pacientes que sufren una deformación anatómica del pene tal como estenosis de la uretra distal, hipospadias graves, curvatura pronunciada, balanitis, uretritis aguda o crónica, angulación, fibrosis cavernosa o enfermedad de Peyronie.
• Pacientes que tienen trastornos que pudieran predisponerles a sufrir priapismo, tales como rasgo drepanocítico o anemia drepanocítica, trombocitopenia, policitemia, mieloma múltiple o leucemia; predisposición a padecer trombosis venosa o historia de priapismo recurrente.
• Pacientes en los que la actividad sexual esté desaconsejada o contraindicada, como por ejemplo en caso de padecer trastornos cardiovasculares o cerebrovasculares inestables.
No deberá utilizarse MUSE en caso de que la pareja esté o pueda estar embarazada, a menos que se emplee preservativo.
MUSE está contraindicado en mujeres y niños.
4.4 Advertencias y precauciones especiales de empleo
Antes de iniciar el tratamiento con MUSE, deberán diagnosticarse y tratarse las causas médicas tratables subyacentes de la disfunción eréctil.
Existen más probabilidades de que se produzcan erecciones dolorosas en los pacientes con deformaciones anatómicas del pene tales como angulación, fimosis, fibrosis cavernosa, enfermedad o placas de Peyronie.
La inserción incorrecta de MUSE puede causar abrasión uretral y sangrado uretral leve. En pacientes infectados con enfermedades de transmisión sanguínea, esto podría aumentar la transmisión de dichas enfermedades a la pareja.
Los pacientes que estén bajo tratamiento con anticoagulantes o que padezcan problemas de coagulación pueden tener un mayor riesgo de sangrado uretral.
Tras la administración de MUSE puede producirse priapismo (una erección de más de seis horas de duración). El tratamiento del priapismo no debe posponerse más de 6 horas (ver sección 4.9 Sobredosis). Advierta a sus pacientes de que deberán informar inmediatamente al médico responsable del tratamiento o, en caso de que éste no se encuentre disponible, solicitar atención médica urgente ante una erección que se prolongue durante más de 4 horas. El tratamiento del priapismo deberá llevarse a cabo de acuerdo con prácticas clínicas establecidas.
En los ensayos clínicos realizados con MUSE, se observó priapismo (erección rígida durante más de 6 horas) y erecciones prolongadas (erección rígida entre 4 horas y 6 horas) con una frecuencia muy baja (<0,1 % y 0,3% de pacientes, respectivamente). Para reducir el riesgo al mínimo, seleccione la dosis eficaz más baja. Puede ser necesario reducir la dosis o retirar el tratamiento en aquellos pacientes que desarrollen priapismo.
Tras la administración de MUSE se puede producir fibrosis peneana, que incluye angulación, fibrosis cavernosa, nódulos fibróticos y enfermedad de Peyronie. La aparición de fibrosis puede aumentar con una mayor duración de uso. Se recomienda encarecidamente realizar un seguimiento regular del paciente, con una exploración detenida del pene, para detectar signos de fibrosis peneana o enfermedad de Peyronie. Se deberá interrumpir el tratamiento con MUSE en pacientes que desarrollen angulación peneana, fibrosis cavernosa o enfermedad de Peyronie.
MUSE se deberá utilizar con precaución en pacientes que hayan sufrido ataques isquémicos transitorios o que muestren trastornos cardiovasculares inestables.
No está prevista la coadministración de MUSE con ningún otro producto para tratar la disfunción eréctil (ver también sección 4.5).
Se deberá considerar el potencial de abuso de MUSE en pacientes con antecedentes de trastornos psiquiátricos o adicción.
La estimulación y las relaciones sexuales pueden dar lugar a episodios cardiacos y pulmonares en pacientes con cardiopatía coronaria, insuficiencia cardiaca congestiva o enfermedad pulmonar. Mientras utilicen MUSE, estos pacientes deberán practicar sus actividades sexuales con precaución.
Deberá advertirse a los pacientes y a sus parejas que MUSE no ofrece protección frente a las enfermedades de transmisión sexual. Deben ser aconsejados acerca de las medidas de protección necesarias frente a los agentes patógenos transmitidos sexualmente, incluido el virus de la inmunodeficiencia humana (VIH). El uso de MUSE no afecta la integridad de los preservativos. Como MUSE puede aportar pequeñas cantidades de alprostadil a la PGEl que se encuentra ya de forma natural en el semen, se recomienda tomar medidas de contracepción adecuadas en caso de que la mujer se halle en edad fértil.
El uso de MUSE en pacientes con implante peneal se ha estudiado en un número limitado de casos que aparecen en la literatura. Sin embargo no se pueden sacar conclusiones sobre la seguridad y eficacia de esta combinación.
4.5 Interacción con otros medicamentos y otras formas de interacción
Las interacciones sistémicas son improbables a causa de los bajos niveles de alprostadil que alcanzan la circulación venosa periférica. No obstante, la administración de medicamentos que afecten la función eréctil puede influir sobre la respuesta de MUSE. Descongestionantes y supresores del apetito pueden disminuir el efecto de MUSE. Los pacientes tratados con anticoagulantes o con trastornos hemorrágicos pueden tener un mayor riesgo de sangrado uretral.
Los efectos de la combinación de alprostadil con otros tratamientos para la disfunción eréctil (ej., sildenafilo) u otros medicamentos que inducen la erección (ej., papaverina) no han sido formalmente estudiados. Por tanto, no se pueden sacar conclusiones sobre la seguridad y eficacia de esta combinación.
Los simpatomiméticos pueden reducir el efecto de alprostadil. Alprostadil puede potenciar los efectos de los antihipertensivos, anticoagulantes e inhibidores de la agregación plaquetaria.
No se dispone de datos suficientes acerca del uso concomitante de MUSE y medicación vasoactiva. Es posible que dicha asociación pueda aumentar el riesgo de síntomas de hipotensión; este efecto podría producirse más comúnmente en personas de edad avanzada.
4.6 Fertilidad, embarazo y lactancia
MUSE puede aportar pequeñas cantidades de alprostadil a la ya existente de PGE1 presente de forma natural en el semen. Por ello, deberá emplearse un preservativo durante el acto sexual si la pareja está embarazada para evitar la irritación vaginal y prevenir cualquier riesgo para el feto.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
Los pacientes tratados con MUSE deberán evitar ciertas actividades como conducir o realizar trabajos peligrosos, ya que en caso de producirse hipotensión o síncope tras la administración de MUSE podrían producirse accidentes. En aquellos pacientes en los que se produce hipotensión y/o síncope, dichos efectos se han manifestado habitualmente durante el inicio del tratamiento y durante la hora siguiente a su administración.
4.8 Reacciones adversas
El efecto adverso más frecuentemente comunicado tras el tratamiento con MUSE fue dolor en el pene. En la mayoría de los casos, el dolor se calificó como leve o moderado.
En el 3% de los pacientes incluidos en los ensayos clínicos se ha informado de fibrosis peneana que incluye angulación, nódulos fibróticos y enfermedad de Peyronie.
En la tabla siguiente se presentan las reacciones adversas al medicamento comunicadas durante el tratamiento con MUSE. Las frecuencias son: Muy frecuentes (> 1/10); Frecuentes (> 1/100 a < 1/10); Poco frecuentes (> 1/1.000 a < 1/100); Raras (> 1/10.000 a < 1/1.000); y Muy raras (< 1/10.000); Frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
|
Clasificación de órganos del sistema |
Frecuencia |
Reacción adversa |
|
Infecciones e infestaciones |
Poco frecuentes |
Resfriado común |
|
Trastornos del sistema nervioso |
Frecuentes |
Cefaleas, mareos |
|
Poco frecuentes |
Síncope, pre-síncope, hipoestesia, hiperestesia | |
|
Trastornos vasculares |
Frecuentes |
Hipotensión sintomática, hematoma |
|
Poco frecuentes |
Trastornos venosos, trastorno vascular periférico, vasodilatación | |
|
Trastornos gastrointestinales |
Poco frecuentes |
Náuseas |
|
Trastornos de la piel y del tejido subcutáneo |
Poco Frecuentes |
Hinchazón de las venas de las piernas, eritema, hiperhidrosis, exantema, prurito, eritema escrotal |
|
Muy raras |
Urticaria | |
|
Trastornos musculoesqueléticos y del tejido conjuntivo |
Frecuentes |
Espasmos musculares |
|
Poco frecuentes |
Dolor en las piernas | |
|
Trastornos renales y urinarios |
Muy frecuentes |
Quemazón uretral |
|
Frecuentes |
Sangrado uretral menor | |
|
Poco frecuentes |
Disuria, polaquiuria, urgencia de micción, hemorragia uretral | |
|
Raras |
Infección del tracto urinario | |
|
Trastornos del aparato reproductor |
Muy frecuentes |
Dolor del pene |
|
Frecuentes |
Erección incrementada, enfermedad de Peyronie, trastornos del pene, prurito/quemazón vaginal (en la pareja) | |
|
Poco frecuentes |
Dolor perineal, disfunción eréctil, trastornos de la eyaculación, balanitis, erección dolorosa, fimosis, priapismo, dolor testicular, trastornos escrotales, eritema escrotal, dolor de escroto, espermatocele, edema escrotal, trastornos testiculares, |
|
inflamación testicular, edema testicular, masa testicular, dolor pelviano | ||
|
Raras |
Fibrosis peneana, | |
|
Exploraciones complementarias |
Poco frecuentes |
Disminución de la presión sanguínea, aumento de la frecuencia cardiaca, aumento de creatinina en sangre |
Aproximadamente el 6% de las parejas de pacientes que recibieron tratamiento activo notificaron quemazón/escozor vaginal. Ello puede deberse a la reanudación de la actividad sexual o al uso de MUSE.
Notificación de sospechas de reacciones adversas:
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de medicamentos de Uso Humanos: https://www.notificaram.es.
4.9 Sobredosis
No se ha registrado ningún caso de sobredosis con MUSE.
La sobredosis de alprostadil puede producir hipotensión sintomática, dolor del pene persistente y, raramente, priapismo. Los pacientes deberán permanecer bajo control médico hasta que desaparezcan los síntomas sistémicos o locales.
En caso de que se produzca una erección prolongada durante un periodo de tiempo igual o superior a 4 horas, el paciente deberá solicitar atención médica. Se tomarán las siguientes medidas:
• El paciente deberá acostarse en posición supina o sobre un lado. Se aplicarán compresas de hielo, alternativamente, durante 2 minutos, sobre la zona interna superior de cada uno de los muslos (ello puede causar la apertura refleja de las válvulas venosas). En caso de no producirse respuesta al cabo de 10 minutos, interrumpir el tratamiento.
• Si dicho tratamiento es ineficaz y la erección rígida permanece por más de 6 horas, deberá realizarse una aspiración peneal. De forma aséptica, insertar una aguja de tipo "mariposa" de calibre 19-21 en el cuerpo cavernoso y aspirar 20-50 ml de sangre. Ello puede desentumecer el pene. En caso de ser necesario, repetir el procedimiento en el lado opuesto de éste.
• Si dicho tratamiento tampoco es efectivo, se recomienda la inyección intracavernosa de un fármaco a-adrenérgico. Aunque la contraindicación habitual de administración intrapeneal de un vasoconstrictor no ha lugar en el caso de priapismo, se recomienda precaución en caso de seleccionar esta opción terapéutica. Durante este procedimiento deberá controlarse de forma continua la presión arterial y el pulso. Debe tenerse extrema precaución en pacientes con enfermedades coronarias, hipertensión no controlada, isquemia cerebral y en sujetos bajo tratamiento con inhibidores de la monoamino oxidasa. En este último caso, deberá disponerse de medios para tratar una posible crisis de hipertensión.
• Debe prepararse una solución de fenilefrina de 200 microgramos/ml, e inyectar entre 0,5 y 1,0 ml de esta solución cada 5-10 minutos. De forma alternativa, puede utilizarse una solución de adrenalina de 20 microgramos/ml. En caso de ser necesario, puede extraerse sangre,
rj$k
an
posteriormente, con la misma aguja. La dosis máxima de fenilefrina o de adrenalina es de 1 mg, y 100 microgramos respectivamente (5 ml de solución).
• De forma alternativa puede emplearse metaraminol, pero debe tenerse presente que se han notificado casos de crisis hipertensivas fatales. Si de esta forma tampoco se resuelve el priapismo, el paciente deberá ser sometido inmediatamente a cirugía.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Código ATC: G04B E01 (Fármacos utilizados en disfunción eréctil).
Alprostadil es químicamente idéntico a la prostaglandina El y su actividad incluye la vasodilatación de vasos sanguíneos de los tejidos eréctiles del cuerpo cavernoso y el aumento del flujo arterial cavernoso, causando rigidez peneal.
5.2 Propiedades farmacocinéticas
Aproximadamente, el 80% del alprostadil liberado por MUSE es absorbido a través de la mucosa uretral en 10 minutos. La vida media es inferior a 10 minutos y las concentraciones plasmáticas venosas periféricas son bajas o indetectables. Alprostadil es metabolizado rápidamente, tanto localmente como en el lecho capilar pulmonar; los metabolitos son excretados en la orina (90% en 24 horas) y en las heces. No existen evidencias de retención tisular del alprostadil o sus metabolitos.
5.3 Datos preclínicos sobre seguridad
Dosis altas de prostaglandina El aumentaron la reabsorción fetal en ratas, debido presumiblemente a stress materno. Concentraciones elevadas de alprostadil (400 microgramos/ml) no tuvieron efecto sobre la motilidad o viabilidad del esperma humano in vitro. No se observaron efectos sobre la función reproductora o alteraciones fetales en conejos con dosis de 4 mg que es la máxima dosis intravaginal ensayada.
En la mayoría de ensayos de genotoxicidad in vitro e in vivo realizados para la evaluación de alprostadil se obtuvieron resultados negativos. Estos ensayos incluían el test de reversión bacteriana con Salmonella typhimurium, la síntesis de ADN en hepatocitos primarios de rata, el ensayo de mutación anterógrada en el locus hprt en cultivos de células de ovario de hámster chino, el ensayo de elución alcalina, el ensayo del intercambio de cromátidas hermanas (todos tests in vitro) y el test de micronúcleo de ratón y ratas (tests in vivo). En otros dos tests in vitro, el test de mutación anterógrada de linfoma de ratón y el ensayo de aberración cromosómica de ovario de hámster chino, alprostadil dio resultados positivos dudosos y evidencias positivas, respectivamente, de daño cromosómico. En vista de los diversos resultados negativos obtenidos in vitro y la falta de evidencias de genotoxicidad en los dos ensayos in vivo, se considera que los resultados positivos obtenidos en estos dos tests in vitro son de dudosa significación biológica. En conjunto, los datos actualmente disponibles no permiten excluir totalmente el riesgo de actividad genotóxica en humanos.
6 . DATOS FARMACÉUTICOS 6.1 Lista de excipientes
Macrogol 1450.
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
2 años.
Desde el punto de vista microbiológico, el producto debe ser usado inmediatamente después de la apertura del sobre de aluminio.
6.4 Precauciones especiales de conservación
Conservar en nevera entre 2° y 8°C. Conservar en el envase original.
El paciente puede mantener los sobres sin abrir a temperatura inferior a 30°C durante un periodo de hasta 14 días antes de su uso.
6.5 Naturaleza y contenido del envase
MUSE está disponible en cajas de 1, 2, 3, 6 ó 10 sobres individuales, conteniendo cada uno de ellos un bastoncillo.
Puede que solamente estén comercializados algunos tamaños de envases.
Los sobres se componen de láminas de aluminio/laminada. Los aplicadores son de polipropileno de calidad para uso médico y resistente a la radiación.
6.6 Precauciones especiales de eliminación y otras manipulaciones
Ninguna especial.
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él, se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Meda Pharma S.L.
Avda. Castilla, 2 ,Edif. Berlín 2a Planta 28830 San Fernando de Henares (Madrid)-España
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
62.697
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 13 de agosto de 1999.
Fecha de la última revalidación: 10 de octubre de 2007
Diciembre 2013
9 de 9