Multibic 2 Mmol/L De Potasio, Solucion Para Hemofiltracion
"I
an
FICHA TÉCNICA
1. NOMBRE DEL MEDICAMENTO
multiBic 2 mmol/l potasio, Solución para Hemofiltración
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
multiBic se presenta en una bolsa de dos compartimentos, en un compartimento hay 4,75 l de una solución alcalina de bicarbonato y en el otro compartimento hay 0,25 l de una solución de glucosa y electrolitos ácida.
ANTES DE LA MEZCLA:
Cada 1.000 ml de solución contienen:
Solución de glucosa y electrolitos ácida (compartimento pequeño)
|
Cloruro de potasio |
2,982 g |
|
Cloruro de calcio dihidrato |
4,410 g |
|
Cloruro de magnesio hexahidrato |
2,033 g |
|
Glucosa anhidra |
20,00 g |
|
como Glucosa monohidrato |
22,00 g |
|
K+ |
40 mmol |
|
Ca2+ |
30 mmol |
|
Mg2+ |
10 mmol |
|
Cl- |
122 mmol |
|
Glucosa |
111 mmol |
Solución alcalina de bicarbonato (compartimento grande)
|
Cloruro de sodio |
6,453 g |
|
Bicarbonato sódico |
3,104 g |
|
Na+ |
147,37 mmol |
|
Cl- |
110,42 mmol |
|
HCO3 - |
36,95 mmol |
DESPUÉS DE LA MEZCLA:
1.000 ml de la solución multiBic 2 mmol/l potasio lista para su uso contiene:
|
Cloruro de sodio |
6,136 g |
|
Cloruro de potasio |
0,1491 g |
|
Bicarbonato sódico |
2,904 g |
|
Cloruro de calcio dihidrato |
0,2205 g |
|
Cloruro de magnesio hexahidrato |
0,1017 g |
|
Glucosa anhidra |
1,000 g |
|
como Glucosa monohidrato |
1,100 g |
|
Na+ |
140 mmol |
|
K+ |
2,0 mmol |
|
Ca2+ |
1,5 mmol |
|
Mg2+ |
0,50 mmol |
|
Cl- |
111 mmol |
|
HCO3- |
35 mmol |
5,55 mmol
Glucosa
Para la lista completa de excipientes ver sección 6.1
3. FORMA FARMACÉUTICA
Solución para hemofiltración La solución es clara e incolora Osmolaridad teórica: 296 mosm/l pH s 7,40
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Para uso en pacientes con insuficiencia renal aguda que precisen hemofiltración continua.
4.2 Posología y forma de administración
La hemofiltración en pacientes con insuficiencia renal aguda incluyendo la prescripción de soluciones de sustitución, se debe realizar bajo la supervisión de un médico con experiencia en este tratamiento.
En el tratamiento de insuficiencia renal aguda, se realiza durante un periodo de tiempo limitado y se interrumpe cuando la función renal está completamente restablecida.
multiBic 2 mmol/l potasio está indicado exclusivamente para perfusión intravenosa.
Perfundir la solución lista para su uso en la circulación extracorporea mediante una bomba de medición.
En la hemofiltración se filtra el suero sanguíneo, por lo que el volumen filtrado menos el fluido de ultrafiltración necesario debe ser sustituido en forma de solución de hemofiltración.
La velocidad de filtración se prescribe por el facultativo en función del estado clínico y del peso corporal del paciente. Dependiendo de la situación metabólica del paciente, si no se prescribe de otra forma, una velocidad total de filtración de 800 a 1.400 ml/h es apropiada en adultos para eliminar los productos de desecho metabólico. Se recomienda una velocidad máxima de filtración de 75 l por día.
No existe experiencia clínica sobre el uso y dosificación de este producto en niños.
Para las instrucciones de uso del producto ver sección 6.0.
4.3 Contraindicaciones
♦ Hipokalemia
♦ Alcalosis metabólica
Contraindicaciones dependientes de la hemofiltración debido al procedimiento técnico mismo
♦ Fallo renal con hipercatabolismo incrementado en casos en los que los síntomas urémicos no pueden aliviarse por hemofiltración.
♦ Flujo sanguíneo inadecuado a partir del acceso vascular.
♦ Si hay un alto riesgo de hemorragia a causa de la anticoagulación sistémica.
4.4 Advertencias y precauciones especiales de empleo
La solución de hemofiltración debe calentarse antes de su perfusión con un equipo apropiado, hasta aproximadamente la temperatura corporal y no debe perfundirse en ningún caso a una temperatura menor de la temperatura ambiente.
El calentamiento de la solución hasta aproximadamente la temperatura corporal debe de ser controlado cuidadosamente verificando que la solución este clara y sin partículas.
Durante la administración de multiBic en Terapia de Reemplazamiento Renal Continua (CRRT), se ha observado en raras ocasiones, formación de precipitados blancos de carbonato de calcio en las líneas de tubos especialmente cerca de la bomba y del equipo de calentamiento de multiBic.
Los precipitados pueden particularmente producirse si la temperatura de la solución multiBic en la entrada de la bomba ya supera 25°C.
Por lo tanto, durante la Terapia de Reemplazamiento Renal Continua (CRRT) con multiBic, se deben inspeccionar cuidadosamente cada 30 minutos las líneas de tubos para verificar que la solución de los tubos es transparente y no contiene partículas.
También pueden aparecer precipitados si el inicio del tratamiento se retrasa de forma sustancial.
Si se observa precipitado, se deben reemplazar inmediatamente la solución de multiBic y las líneas de tubos de CRRT y debe monitorizarse cuidadosamente al paciente.
La concentración sérica de potasio debe controlarse de forma regular antes y durante la hemofiltración. Durante la hemofiltración se debe considerar el nivel de potasio del paciente y su trayectoria. Si se presenta hipokalemia o tiende a desarrollarse, puede ser necesaria una suplementación de potasio y/o un cambio a una solución de sustitución con una mayor concentración de potasio.
Si se tiende a desarrollar hiperkalemia, puede estar indicado un aumento en la velocidad de filtración y/o un cambio a una solución de sustitución con una concentración de potasio menor así como de las medidas habituales de la medicina de cuidados intensivos.
Además, se recomienda la monitorización de los siguientes parámetros antes y durante la hemofiltración: Sodio, calcio, magnesio, fosfato y glucosa séricos, equilibrio ácido-base, niveles de urea y creatinina, peso corporal y balance de fluidos (para el reconocimiento temprano de hiperhidratación y deshidratación).
Antes de su utilización, se debe examinar cuidadosamente la bolsa con la solución, tal como se describe detalladamente en el apartado 6.6 “Instrucciones de uso y manipulación”.
No usar antes de realizar la mezcla de las dos soluciones.
4.5 Interacción con otros medicamentos y otras formas de interacción
La correcta dosificación de las soluciones de sustitución y una estricta monitorización de los parámetros de laboratorio clínicos y de los signos vitales evitará interacciones con otros medicamentos. Se puede pensar en las siguientes interacciones:
❖ Las sustituciones de electrolitos, nutrición parenteral y otras perfusiones normalmente utilizadas en medicina de cuidados intensivos, interaccionan con la composición sérica y el balance de fluidos del paciente. Cuando se prescriba un tratamiento de hemofiltración, esto se tiene que tener en consideración.
❖ El tratamiento de hemofiltración puede reducir la concentración de los medicamentos en sangre, especialmente de medicamentos con una baja capacidad de unión a las proteínas, con un pequeño volumen de distribución, con un peso molecular por debajo del tamaño de poro del hemofiltro y de medicamentos adsorbidos en el hemofiltro. Puede ser necesaria una revisión apropiada de la dosis de dichos medicamentos.
❖ Los efectos tóxicos de digitalis pueden ser enmascarados por hiperkalemia, hipermagnesemia e hipocalcemia. La corrección de estos electrolitos mediante una hemofiltración puede dar lugar a signos y síntomas de la toxicidad de digitalis, p.e. arritmia cardiaca.
4.6 Fertilidad, embarazo y lactancia
No se dispone de experiencia clínica en la actualidad. La solución de sustitución tamponada con bicarbonato sólo debe usarse después de evaluar los riesgos y beneficios para la madre y el hijo.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
No aplicable
4.8 Reacciones adversas
Las reacciones adversas, como nauseas, vómitos, calambres musculares, hipotensión e hipertensión, pueden ser el resultado del propio tratamiento o pueden ser inducidas por la solución de sustitución.
En general, la tolerancia de la solución de hemofiltración tamponada con bicarbonato es buena. Sin embargo, pueden citarse los siguientes efectos secundarios potenciales, atribuibles al tratamiento:
Hiper- o hipohidratación, alteraciones electrolíticas (p.e. hipokalemia), hipofosfatemia, hiperglicemia y alcalosis metabólica.
4.9 Sobredosis
Después de usar las dosis recomendadas, no han habido informes de situaciones de emergencia. Por otra parte, la administración de la solución puede interrumpirse en cualquier momento. Si no se calcula con exactitud el balance de fluidos y se monitoriza, puede aparecer una hiperhidratación o una deshidratación, con las consecuentes reacciones asociadas a nivel circulatorio. Estas pueden ponerse de manifiesto a través de cambios en la presión sanguínea, presión venosa central, ritmo cardíaco y presión arterial pulmonar. En casos de hiperhidratación, se puede producir un fallo cardiaco congestivo y/o una congestión pulmonar.
En casos de hiperhidratación deberá aumentarse la ultrafiltración, y reducirse la velocidad y el volumen perfundido de solución de sustitución. En casos de una marcada deshidratación, la ultrafiltración deberá disminuir o interrumpirse y el volumen de solución de sustitución perfundido aumentarse de forma adecuada.
Durante el tratamiento se pueden producir alteraciones de las concentraciones de electrolitos y del equilibrio ácido-base, p.e. puede aparecer una sobredosis de bicarbonato si se perfunde o administra un volumen muy grande e inapropiado de solución de sustitución. Esto podría conducir a una alcalosis metabólica, disminución del calcio ionizado o tetania.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico
Grupo : Solución para hemofiltración
Código ATC: B05Z B - Hemofiltrados
Principios básicos de la hemofiltración
Durante una hemofiltración continua el agua y los solutos tales como las toxinas urémicas, electrolitos y bicarbonato se eliminan de la sangre por ultrafiltración. El ultrafiltrado se sustituye por una solución de sustitución (una solución para hemofiltración) con una composición equilibrada de electrolitos y tampón.
La solución de hemofiltración lista para su uso, es una solución de sustitución tamponada con bicarbonato, para administración intravenosa en el tratamiento de la insuficiencia renal aguda de cualquier origen, mediante una hemofiltración continua.
.-ítp.
ÍTTI
Los electrolitos Na+ , K+, Mg2+ Ca2+ Cl" y bicarbonato, son esenciales para el mantenimiento y corrección de la homeostasis de fluidos y electrolitos (volumen sanguíneo, equilibrio osmótico, equilibrio ácido-base).
5.2 Propiedades farmacocinéticas
La solución de hemofiltración lista para su uso sólo se debe administrar por vía intravenosa.
La distribución de los electrolitos y bicarbonato se regula en función de las necesidades y del estado metabólico y función renal residual. Los principios activos de la solución de sustitución no se metabolizan, con excepción de la glucosa. La eliminación del agua y los electrolitos depende de las necesidades celulares, del estado metabólico, función renal residual y de las otras vías de pérdida de fluidos (p.e. intestinos, pulmones y piel).
5.3 Datos preclínicos sobre seguridad
No hay datos preclínicos de relevancia para el médico.
6 . DATOS FARMACÉUTICOS
6.1 Lista de excipientes
En el compartimento pequeño A: Agua para preparaciones inyectables, ácido clorhídrico al 25%
En el compartimento grande B: Agua para preparaciones inyectables, dióxido de carbono
6.2 Incompatibilidades
En ausencia de estudios de compatibilidad, esta especialidad no se debe mezclar con otras especialidades farmacéuticas. Si se realiza una adición a la solución de sustitución, solo se debe realizar después de la evaluación de la compatibilidad con la solución de sustitución y solo después de que se hayan mezclado completamente los dos compartimentos de la solución de sustitución.
6.3 Periodo de validez
Caducidad del medicamento envasado: 12 MESES Caducidad después de la apertura del envase: -Caducidad después de realizar la mezcla: 48 horas
Se ha demostrado estabilidad química y física de la solución lista para su uso en un periodo de 48 horas a 25°C.
Diferentes tiempos y condiciones de conservación de la mezcla antes de su uso (superior a 48 horas incluyendo la duración del tratamiento, y más de 25°C antes de la entrada en la bomba) son responsabilidad del usuario.
Desde un punto de vista microbiológico, una vez conectado al circuito de hemofiltración, y puesto que contiene bicarbonato, el producto se debe utilizar inmediatamente. Diferentes condiciones y tiempos de conservación son responsabilidad del usuario.
6.4 Precauciones especiales de conservación No conservar por debajo de 4°C
6.5 Naturaleza y contenido del envase Bolsa de doble cámara:
4,75 l (solución alcalina de bicarbonato) + 0,25 l (solución de glucosa y electrolitos ácida) = 5,0 l (solución lista para su uso)
<jtj>
allKPS
ÍTTI
La lámina usada para la fabricación de la bolsa está compuesta de tereftalato de polietileno, recubierto por SiOx como barrera gaseosa, poliamida y una mezcla elastomérica de polipropileno sintético.
Sobrebolsa:
La bolsa con doble cámara se envuelve en un film de una mezcla elastomérica sintética de poliolefina.
2 bolsas de 5.000 ml (por caja)
6.6 Precauciones especiales de eliminación
La solución de hemofiltración se debe de administrar en las siguientes etapas:
1. Eliminación de la sobrebolsa e inspección detallada de la bolsa de hemofiltración:
Se tiene que eliminar la sobrebolsa solo inmediatamente antes de la administración.
Los envases de plástico se pueden dañar de forma ocasional durante el trasporte desde el lugar de fabricación a la clínica de diálisis o dentro de la misma clínica. En la solución de hemofiltración esto puede conducir a una contaminación y crecimiento microbiológico o de hongos. Por ello es necesario realizar una cuidadosa inspección visual del envase antes de la conexión y de la solución antes de su uso. Se tiene que tener una particular atención incluso a leves desperfectos del tapón, de las soldaduras y bordes del envase en vista de una posible contaminación.
Solo se debe utilizar la solución si es clara e incolora y si el envase y los conectores están sin desperfectos e intactos.
En caso de dudas, el médico que realiza el tratamiento deberá decidir sobre la utilización de la solución de hemofiltración.
2. Mezcla de los dos compartimentos
La bolsa de dos compartimentos, el de bicarbonato y el de glucosa y electrolitos, se mezclan inmediatamente antes de su utilización para obtener una solución lista para su uso. La solución mezclada es transparente e incolora.
Después de que ambos compartimentos se hayan mezclado, debe verificarse que la soldadura esté totalmente abierta, que la solución sea transparente e incolora y que el envase no pierda líquido.
Q
A)
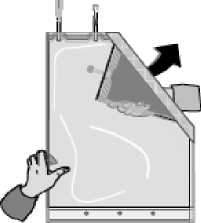
Desdoble el compart miento pequeño
B)
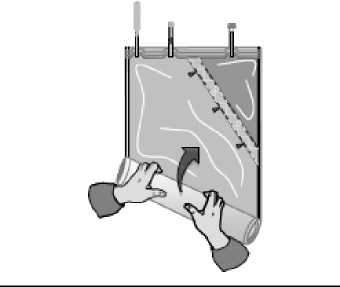
Enrolle la bolsa con la solución empezando desde la esquina opuesta al compartimento pequeño...
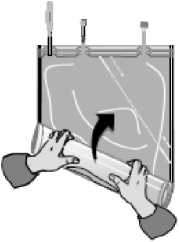
... hasta que la soldadura entre ambos compartimentos se abra en toda su longitud y la solución de ambos compartimentos se mezclen.
3. Solución lista para su uso
Cualquier adición a la solución de sustitución solo se debe realizar después de que la solución de sustitución se haya mezclado a fondo (ver apartado 6.2). Después de realizar una adición, la solución de sustitución se debe mezclar otra vez a fondo antes de iniciar la perfusión.
La solución lista para su uso se debe utilizar inmediatamente, dentro de las 48 horas siguientes a la mezcla.
Si no se prescribe lo contrario, la solución de sustitución lista para su uso, se debe calentar inmediatamente antes de la perfusión a 36,5° C - 38,0° C. La temperatura exacta se debe seleccionar dependiendo de los requerimientos clínicos y del equipo técnico utilizado.
La solución de hemofiltración es de un solo uso.
Se deben desechar los envases parcialmente utilizados y dañados.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Fresenius Medical Care Deutschland GmbH
61346 Bad Homburg v.d.H
Alemania
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
65.804
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
10. FECHA DE LA REVISIÓN DEL TEXTO
Agosto 2011
7 de 7